1.小的活检标本 小的活检标本包括支气管镜活检、经支气管肺活检、经皮肺穿刺活检,对获得的肺组织进行恰当正确的诊断性检查,从标本中获得最多的信息,从而成功做出肺病理诊断。但是小标本仍存在局限性,有时候只能进行非特异性描述性诊断,此时临床可排除某些诊断的可能性,进行另外的诊断性检查。
大多数小组织标本,包括内镜下钳夹活检或经支气管、经皮肺穿刺活检标本的处理过程是相似的。支气管镜活检标本最大径1~2mm,经皮肺穿刺标本长1~2cm,宽不到1mm。标准的程序包括固定,用湿的擦镜纸,包好放入包埋盒中,注意不能放入纱布或海绵里,以免形成锯齿状及不规则的腔隙。应进行HE染色的连续切片及空白切片以备特殊染色,蜡块中的组织需要时仍可利用。进行微生物学培养的组织或液体,或行特殊检查如免疫荧光显微镜或电镜检查的组织应取新鲜组织直接送到微生物实验室或病理科,或置于合适的固定液中。固定液种类很多,包括甲醛及非甲醛固定剂,常用10%中性缓冲甲醛溶液(福尔马林)作为常规固定液。采用合适的抗原修复方法,大多数免疫组织化学染色可以在甲醛固定的组织上进行,不需要新鲜组织或其他特殊固定剂。但是,对怀疑淋巴组织增生性病变,特别是大的组织标本,至少取一片组织固定在B-5固定液中。如必须行电镜检查,则取新鲜组织直接送检或切成几个立方毫米大小的小块置于戊二醛或其他的电镜固定液(如Karnovsky液)中。
最常用的特殊染色包括组织革兰染色(图1-3)、Brown-Brenn或Brown-Hopps、PAS(图1-4)、Gomori Methenamin Silver(GMS,图1-5)染真菌、Ziehl-Neelsen染色染抗酸杆菌(图1-6)等微生物染色法;弹性纤维染色(图1-7)、Van Gieson、Movat 五色及Masson三色(图1-8)等显示结缔组织的染色法;Perls及Prussian蓝显示含铁的物质;PAS及黏液卡红等显示黏蛋白。免疫组织化学染色可用于判断肿瘤的成分。偏振光过滤片常规用于在非肿瘤性肺疾病中寻找晶体及其他双折光性的物质。
(1)支气管活检及经支气管肺活检:传统上外科医生使用的坚硬的支气管镜,现主要用于取出气管支气管异物、控制大量咯血、替代气管支架及激光消融术。柔软有弹性的纤维光学支气管镜于2026年由Ikeda引入使用,现已取代了坚硬的支气管镜,成为观察支气管树、活检支气管及其周围肺实质的标准方法。对支气管内病变首选支气管活检,一般取3~4块组织可以获得近100%的诊断成功率。经支气管肺活检(TBLB)通过活检钳取得肺实质或周围性肿块组织,相对安全,病死率低(0.1%~0.2%),主要的并发症是气胸(3%~5%)及出血(常规病例中9%)。
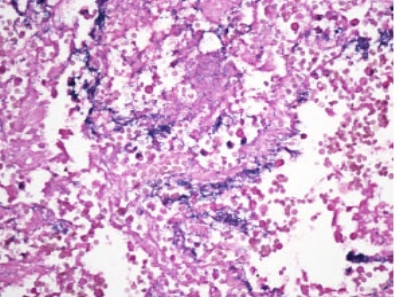
图1-3 革兰染色示蓝色革兰阳性菌
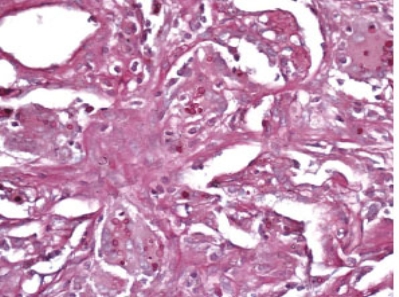
图1-4 PAS染色示组织细胞内见红染隐球菌孢子
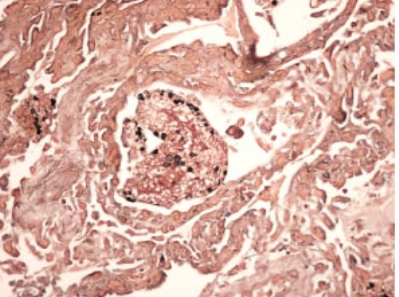
图1-5 GMS 染色示肺泡腔泡沫样物中见黑色肺孢子菌
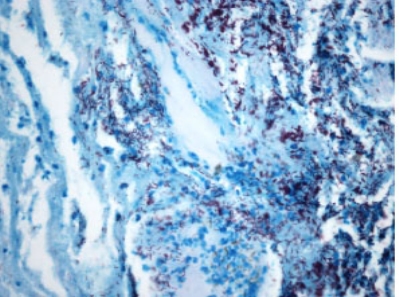
图1-6 抗酸染色示坏死组织内见紫红色抗酸杆菌
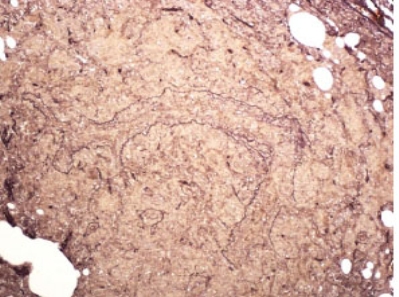
图1-7 弹性纤维染色显示血管壁弹性纤维(黑色)
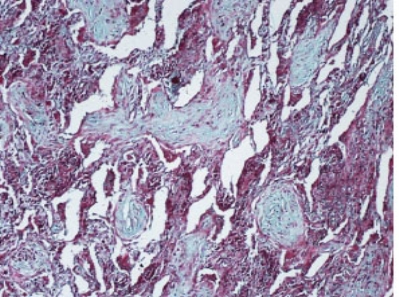
图1-8 Masson染色示蓝色的Masson小体
TBLB的诊断率受患者人群、基础病变非特异性炎症及纤维化是否为一个特异的组织学类型的影响。在外周肿块中的诊断率可达30%~80%(平均约50%),恶性结节的诊断率(63%)比良性结节的诊断率(38%)高,中央型肿瘤的诊断率超过外周型肿瘤的诊断率。诊断成功率随病变的大小及取材的数量增加而增加。一个研究中发现,75%的外周型肿瘤在取6块标本时获得诊断。TBLB与支气管灌洗、支气管肺泡灌洗及刷片联合可提高诊断准确率。TBLB对局限性或弥漫性浸润性病变的诊断率有限,不仅因为不规则分布的病变取材不一致性,而且因为很多肺病变都存在慢性炎症及纤维化的非特异性改变。常可对感染、结节病、恶性肿瘤(包括癌性淋巴管炎)和一些疾病(如肺Langerhans组织细胞增生症、Wegener肉芽肿、肺泡蛋白沉积症、淀粉样变及淋巴管肌瘤病)获得明确诊断。另外一些情况,如胶原血管病、嗜酸性粒细胞性肺炎、药物反应(如胺碘酮毒性)及过敏性肺炎,非特异性的组织学表现与临床紧密联系可获得临床病理诊断。辅助检查如直接免疫荧光显微镜、电镜或微生物培养等可以在某些具有非特异性组织学表现的病例提供特异的诊断。但是,对特发性间质性肺炎、淋巴组织增生性疾病及肺尘埃沉着症等病变,TBLB常不足以获得明确的诊断。
①TBLB标本合适性:一般来说,支气管镜医师在活检时,不能单纯根据主观评价如组织是否漂浮在甲醛中来预测标本的质量。病理医师应判断TBLB标本组织是否适于诊断且将这些发现与支气管镜医师交流。肺泡组织存在与否是评价一个TBLB标本是否“满意”的条件,有人认为至少有一个含有肺泡的肺实质片段存在即为合适的标本,但是有人认为一个合适的活检标本需要含有至少20个肺泡。如果TBLB标本中没有含有肺泡的肺实质且无诊断特异性疾病的特征时,此标本是不适于做诊断的。如一个活检标本中虽没有肺泡存在,但有肺泡壁组织且存在特异性病变如肉芽肿或肿瘤,显然不能将这个标本认定为合适标本。甚至在TBLB标本中无组织片,但是在分泌物、碎片或病毒包涵体中可见到病原体或在脱落的细胞簇中可见恶性细胞特征,这些组织也是适于诊断的。因此,“不适于诊断的组织”是指无肺泡且经仔细检查(包括病原体特殊染色)后,无特异性疾病诊断特征的组织。偶尔微生物实验室发现了病原体而外检标本中缺乏肺实质的标本为不合适标本,临床医师必须清楚,若活检标本没有可用于诊断的肺组织则会使病理医师无法提示感染,临床医师也可能错误地认为这一病原体仅为寄生性的。(https://www.daowen.com)
②人工假象:TBLB标本中可有多种人工假象,有时导致诊断困难,病理医师对此应有足够的认识。这些人工假象包括:肺实质的挤压,肺泡间隔受挤压,看起来富于细胞,类似于间质性肺炎;淋巴细胞及肿瘤细胞核的挤压(特别是小细胞癌时),可通过在组织固定时机械性搅动固定液降低挤压假象的程度;海绵状假象:包埋盒内的海绵可在组织中产生成角的裂隙,因此小标本应包在擦镜纸内,不要用海绵或纱布;气泡假象,挤压的肺实质内大小不等的气泡导致外源性脂性肺炎的错觉,但气泡假象中缺乏巨细胞反应及脂性肺炎中的空泡样组织细胞,可以鉴别;取材造成急性肺泡出血:TBLB标本中考虑出血必须见到含铁血黄素及红细胞;血管套入,类似于机化性血栓;无意中取到脏层胸膜:不仅会导致气胸,而且会将被覆间皮的组织条误诊为间质纤维化伴肺泡细胞增生。免疫组织化学染色calretinin可显示间皮细胞,而弹性纤维染色可显示正常胸膜的弹性纤维。
(2)经皮细针穿刺肺活检:影像科医师在影像学引导下对肺实质内结节、肿块或囊肿进行经皮经胸细针穿刺肺活检(percutaneous transbronchial needle biopsy,PTNB)。以前的经胸肺活检因采用切针或环钻取材导致并发症多,病死率约0.5%(主要由于大量出血及气体栓塞)。CT引导下经皮细针肺穿刺活检更安全,在某些选择性病例中诊断率高。自动切取细针的应用提供了组织条,可以进行组织学诊断及确定恶性肿瘤的细胞类型。组织条的技术组处理过程与常规实性脏器如前列腺、肝或乳腺的组织条活检标本相似。PTNB对恶性疾病的诊断率为89%~93%,特异性达100%。经皮经胸细针活检对确定多发性肺结节及已知单个原发灶的肺转移十分有用。细针吸取细胞学加上组织学可提高诊断率。良性病变的特异性诊断约达71%。经胸细针活检最主要的难题在于仅表现为非特异性炎症及纤维化的良性肿瘤,此时需完整切除肿块以排除恶性病变的可能。
2.外科手术肺活检标本 在创伤小的活检技术不能满足诊断需要时,开胸肺活检已成为获取肺组织的标准方法。电视辅助胸腔镜下外科肺活检(VATS)因创伤小、并发症少、住院时间短,且能够和开胸肺活检一样获得足够诊断的标本,被愈来愈广泛地应用。
2026年Klassen等提出采用微小开胸术来代替完全的开胸术,开启了弥漫性肺病变中诊断性开胸肺活检的常规应用之门。微小开胸术是指在第4或第5前肋间隙切开大约8cm。这一技术的改进包括通过第2或第3肋间隙的小切口(改良chamberlain术)、通过后听诊三角的较大切口、甚至锁骨上切口以取肺尖的病变。X线的肺病变的分布常提示可在哪个部位行开胸术。组织块为至少取来自肺不同肺叶的两个区域的标本。组织块应达(3~4)cm×2cm×1cm,两侧被覆胸膜,沿着切除线缝合。
大约在2026年,Jacobaeus首次提出用改良的膀胱镜作为胸腔镜来溶解胸膜粘连、活检胸膜肿瘤。纤维光学及影像学技术的进展导致了胸腔镜的广泛使用。开胸肺活检现在很大程度上被VATS肺活检取代,降低了患者的病死率,缩短了患者的住院时间,降低了整个费用。VATS切取孤立性肺肿块的活检标本已成为这些病变的诊断手段,能提供对良、恶性病变的快速明确诊断。VATS的应用已越来越广泛,包括更大、更复杂的外科操作,如肺缩减术、肺叶切除术及肺切除术。VATS活检在手术室进行,患者全麻,对侧肺的单侧通气,导致要操作的肺的塌陷。2~3个套针穿入胸膜腔以提供胸腔镜、电视照相机附件及胸腔镜下切除设备即抓取器、线性吻合器的通道。VATS的组织的大小及诊断的精确性与开胸肺活检(open lung biopsy, OLB)相似。组织学上,出血及中性粒细胞靠边在VATS活检中更常见,而膨胀过度在开胸肺活检标本中更明显。这些假象常轻微,不会影响活检诊断。
(1)取材部位:外科肺活检被认为是诊断弥漫性肺疾病的金标准,但是诊断率还是依赖于外科医生的恰当取材。取材部位取决于病变的分布和性质。对于肺弥漫性疾病,最好在影像学引导下,或根据当时的直视观察及了解影像学病变的分布情况下来采取中度异常病变部位,避免局部区域的终末期或蜂窝改变,建议在术前常规行CT检查,以便在开胸肺活检时指导外科医生取合适部位的标本。尽管开胸肺活检时舌叶易于取到,但是舌叶常有非特异性炎症及纤维化,因此舌叶不宜活检,也应避免肺尖及肺表面的瘢痕活检,尽可能取深部肺组织,对于弥漫性肺疾病,多叶肺组织活检是必要的。对于片块和灶状肺疾病,应该获取病变集中的实变区域。如果是肿块或结节应该全部切除。
(2)开胸和胸腔镜活检标本的处理:外科肺活检标本均应从手术室直接获取新鲜标本以方便进行性诊断检查(图1-9)。所有的标本应该做细菌、真菌和抗酸杆菌的培养(在手术室完成或直接从手术室送到微生物培养室),必要时进行病毒培养。病理科对标本的处理在某种程度上与临床情况有关。如果基础病是慢性间质性肺疾病,没有临床急症或临床对感染的怀疑小,那么就小心剪取吻合线,沿肺表面垂直方向切开标本,避免挤压和损伤组织,然后将组织直接置于固定液中。有人提倡先将固定液用细针经胸膜注入标本中作为减少挤压假象的方法,但可能造成气腔和淋巴管的扩张的人工假象。
对临床要求立即进行诊断的外科活检标本,如急性肺损伤、免疫缺陷或怀疑感染、可能淋巴瘤、血管炎、肺出血等,应首先用细胞学印片及冷冻切片来进行评价。免疫缺陷患者肺炎常进展迅速,病情凶险,冷冻切片HE染色及特殊染色可在短时间内发现是否存在可治疗的特殊感染,如卡氏肺囊虫、真菌等。冷冻切片可发现恶性肿瘤和药物引起的肺损伤病变、Goodpasture综合征、嗜酸性肺炎,Wegener肉芽肿病,Laegionnaire病及粟粒性肺结核,以争取及时治疗。冷冻切片还可帮助决定是否需要更复杂的诊断技术,如发现肺泡出血怀疑是否为Goodpasture或其他出血综合征时,应留取冷冻切片进行免疫荧光染色;若发现肺组织内大量淋巴细胞浸润应选择B-5固定液,并取新鲜标本进行流式细胞分析;及遗传学分析;若怀疑为感染的标本,应尽快进行组织化学染色查找微生物;若怀疑为职业病,需留取标本进行成分分析。冷冻切片还可评价是否已获得足够诊断的标本及是否已取到代表主要病变的组织,若弥漫性肺疾病的标本中只存在肺终末期或蜂窝改变,应建议外科医师采取更多组织,特别是取深部组织活检。
等待冷冻快速切片时,对新鲜切开组织的印片立即固定于无水乙醇中,然后快速进行HE染色以观察有无恶性细胞、炎细胞或病原体。
3.大标本包括肺叶切除、肺切除及尸检标本
大标本包括肺叶切除、肺切除及尸检标本。病理科偶可收到因非肿瘤性肺疾病而进行肺叶甚至是全肺切除的标本,此时需常规进行经支气管甲醛灌注固定1~2h,可采用重力引流方法,即固定液距标本2~3英尺(0.6~0.9m)高,通过塑料管、主支气管自然流入肺内,当肺膨胀到最大时即可,不必夹住支气管开口。更准确的方法是保持灌注压在25~30cmH2O,但一般没有必要。在灌注之前应进行微生物培养。对肺叶或肺切除标本进行取材时,用两根探针分别插入不同的支气管形成平面,用长刀沿探针切开肺组织,重复此操作则暴露病变和支气管树之间的关系。其他显示血管和支气管异常的方法需在未固定的标本上进行,常需要特殊设备和材料。对于病灶及周围正常组织和支气管断端均需取材包埋(图1-10)。
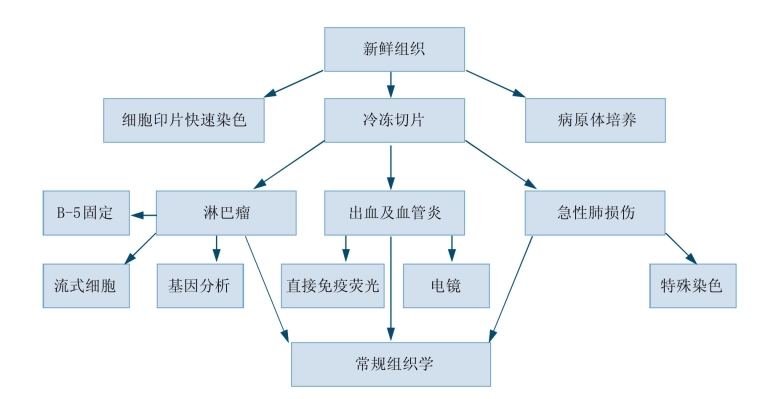
图1-9 新鲜标本的处理
(引自Tomashefski等.Dail and Hammar’s Pulmonary Pathology.Volume 1:Nonneoplastic Lung Disease)
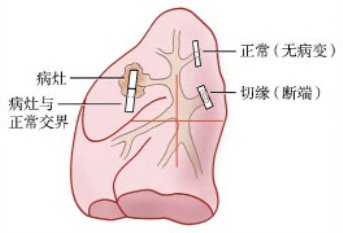
图1-10 肺叶标本的取材部位
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







