虽然,目前已有很多的药物分析方法,但是随着纳米技术不断地发展,用于修饰电极的纳米修饰材料也日新月异。碳纳米管具有很高的韧性、大的比表面积、小的纳米尺寸、极强的导电性、奇特的金属性和半导体性等,其可表现出独特的光、磁、电等效应,是一种特殊的一维纳米材料。碳纳米管是构建修饰电极和电化学传感器的较佳材料,当碳纳米管用作电极材料时,由于碳纳米管拥有石墨烯的结构及弯曲的表面,使得电荷在其中的传输速率比在石墨中更快,其表面的活性位点更多。基于碳纳米管的复合薄膜修饰电极具有独特的薄膜微结构和特殊化学性质,及优异的电化学传导性;另外,碳纳米管及以此为基础的纳米复合材料电化学传感器具有很好的协同作用,如除了可在电极界面处引入材料本身的物理化学特性外,由于纳米材料大的比表面积效应、较小的粒径,纳米粒子表面还可以带有对某些物质的电化学行为产生特有的电化学效应的功能基团,减小过电位、增加峰电流、改善分析性能、提高方法的选择性和灵敏度。利用碳纳米管及以此为基础的纳米复合材料之间的协同作用来发展和制备新的高选择性、高灵敏度的修饰电极及电化学传感器,以应用于药物分析及体内生物分子检测的应用研究正在取得快速的发展,这已经成为当今电分析化学研究领域的重要内容,是化学、材料和生命科学的交叉学科,也引起越来越多科研工作者的重视。相比于其他分析方法,电化学分析方法在药物分析中的应用具有方法简便,价格低廉,高选择性,稳定性良好及灵敏度高等优点。不断提高电极反应的选择性,加快电极反应速度、提高测量灵敏度,一直是科研分析者不断追求的重点。本章节在前人工作的基础上,经过大量的文献调研,利用碳纳米管的特殊性能,及以此为基础的纳米复合材料为修饰材料,以玻碳电极为工作电极,饱和甘汞电极为参比电极,针对一些药物及体内生物分子在分析中存在的低选择性,弱的抗干扰能力等难题,构建碳纳米管及以此为基础的纳米复合材料修饰电极并应用于药物分析及体内生物分子的测定方面进行一系列的探索,开展如下研究工作。
10.1 MWNTs/Nafion复合薄膜修饰电极对弱碱性和弱酸性药物的分析应用研究
10.1.1 对咖啡因的定量分析研究
咖啡因(3,7-二氢-1,3,7-三甲基氢嘌呤-2,6-二酮)是一种具有极好生物活性的生物碱,它广泛分布于植物体内,这些植物主要包括茶叶、咖啡豆、可可及可乐坚果。咖啡因经常和其他的N-甲基氧杂蒽衍生物同时存在,如茶碱和可可碱。此外,咖啡因即是咖啡、茶、可口可乐等日常饮料的主要成分,也是世界上使用最广泛的药物之一。咖啡因有许多重要的药理作用,例如刺激中枢神经系统,心血管系统,利尿等的积极影响,是一种常用的中枢神经兴奋剂。另外,咖啡因能够促进胃酸分泌,缓解偏头痛,它亦在身体的其他系统范围内起到很重要的作用。因此,研究和测定咖啡因,不仅有临床意义,同时也有利于人们的身体健康和起到延长寿命的作用。目前,已经发展了不同的方法用于咖啡因及其类似物定量分析测定,如分光光度法、反相薄层色谱法、液相色谱-ESI-质谱联合分析法、气相色谱法、高效液相色谱法、毛细管气相色谱法和毛细管电泳等。然而,这些方法也有一些不足之处,如色谱方法操作比较费时间,仪器昂贵,并且需要复杂的富集或多溶剂提取,以及需要经过专门培训的技术人员。相反,电化学方法的特点是简单,灵敏度高,稳定性好,仪器成本低及操作简单。为了提高测量的灵敏度和稳定性,按人为目的制备的修饰电极已经用于咖啡因含量测定,但除了少数文献报道外,有关咖啡因的电分析测定很少有人报告,因为咖啡因通常只在一个非常高的正电位才能发生电化学氧化。
近年来,碳纳米管已经越来越多地被用作电极修饰材料。自1991年碳纳米管被Iijima发现以来,它已经受到了社会各界的高度关注。由于其独特的结构和非凡的性能,现在碳纳米管已经在化学、物理和材料等领域得到广泛的应用。碳纳米管具有优良的电子特性,巨大的比表面积和高效率的催化活性,这表明它们可以促进电荷转移,使反应顺利进行。故它们常被作为电极材料使用,截至目前,碳纳米管被广泛用于电化学分析中。
Nafion膜是一种全氟磺化的阳离子交换剂,它具有很强的防污功能,又有化学惰性和高渗透性,现在已经被广泛用作电极修饰剂。由于Nafion膜侧链的疏水性和其极性头基的原因,碳纳米管可被均匀分散在Nafion溶液中。碳纳米管/Nafion复合薄膜修饰电极在电化学分析应用上极具吸引力,例如,它们已被用于电化学检测传感器来检测微量重金属和多巴胺,同时测定二硝基苯酚和4-硝基酚,以及对盐酸克伦特罗的测定。Nafion膜已被用作电极修饰剂涂于电极表面制备成电化学传感器,实现了对咖啡因的定量检测。但据文献调研,还未见有关功能化多壁碳纳米管(MWNTs) /Nafion复合薄膜修饰玻碳电极作为电化学传感器用于对咖啡因进行定量分析的报道。
本章节完成了功能化多壁碳纳米管/Nafion复合薄膜修饰玻碳电极(glassy carbon electrode,GCE)对咖啡因的伏安响应的研究,建立了定量测定咖啡因的检测体系。该方法可应用于对实际样品中咖啡因的定量分析,并且在测量前没有任何费时提取或分离步骤,故此方法省时省力,简便可行。
10.1.1.1 MWNTs/Nafion/GCE的表征
扫描电子显微镜(SEM)能有效地表征出修饰电极的特征。如图10.1所示,用扫描电子显微镜表征的MWNTs/Nafion/GCE的表面微结构。该图表明,MWNTs/Nafion复合物被均匀地涂在了电极表面,并形成一个多孔的网络状结构,特殊的多孔表面形貌明显比表观面积提供了更大的实际面积。

图10.1 MWNTs/Nafion复合薄膜修饰玻碳电极的SEM形貌表征
10.1.1.2 咖啡因在MWNTs/Nafion/GCE上的电化学响应
图10.2所示是扫速为80 mV/s时,在0.01 mol/L硫酸介质溶液(pH = 2.0)中,MWNTs/Nafion/GCE (图10.2a),MWNTs/GCE (图10.2b),Nafion/GCE (图10.2c)及裸GCE (图10.2d)分别对3.0×10-5mol/L咖啡因的循环伏安电化学响应。
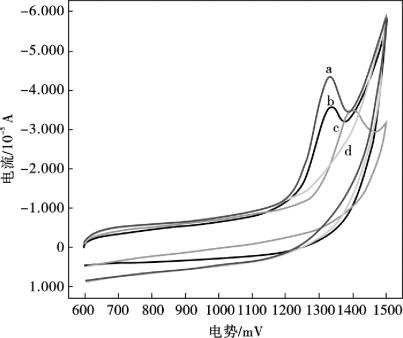
图10.2 0.01 mol/L硫酸溶液(pH = 2.0)中,3.0×10-5 mol/L咖啡因在不同电极上的循环伏安图
MWNTs/Nafion/GCE (a),MWNTs/GCE (b),Nafion/GCE (c)及裸GCE (d)
在相同的实验条件下,咖啡因在裸玻碳电极上没有阳极峰,但是咖啡因在修饰电极上有一明显的氧化峰;特别是在MWNTs/Nafion/GCE上,咖啡因的氧化峰电流明显比在MWNTs/GCE及Nafion/GCE上的氧化峰电流(ip)要高。图10.2也显示出咖啡因在修饰电极上电化学氧化过程都是不可逆的,这与之前的文献报道一致。咖啡因的氧化机制已经被Dryhurst等人所报道,即咖啡因的电化学氧化整个反应过程是4e-、4H+转移的过程,第一个反应是C-8到N-9键的2e-、2H+转移的氧化过程,生成取代基尿酸,此产物随后又立刻发生2e-、2H+转移的氧化反应,生成4,5-羟基尿酸类似物,此产物又快速碎裂。此外,相比较于Nafion/GCE,咖啡因在MWNTs/Nafion/GCE和MWNTs/GCE上的氧化电位由1 401 mV负移到1 330 mV。氧化峰电位(Ep)负移可以说明MWNTs对咖啡因的电化学氧化具有催化作用。在MWNTs/Nafion/GCE上,咖啡因具有高灵敏的电化学响应的原因可以归结为以下两点:①MWNTs/Nafion/GCE包含阳离子交换剂Nafion,Nafion利用静电相互作用可以选择性的交换阳离子;②MWNTs拥有优异的特性,如较大的表面积,极好的吸附能力和催化能力。毫无疑问,Nafion和MWNTs的协同作用促使咖啡因有较强的电化学响应。
10.1.1.3 支持电解质和pH值对咖啡因峰电流和峰电位的影响
由于不同的支持电解质溶液会影响咖啡因的电化学行为,因此,分别以硝酸、盐酸、硫酸和乙酸等多种0.01 mol/L的酸性溶液为支持电解质,研究了它们对咖啡因的电化学行为的影响,试验结果如图10.3所示。在以0.01 mol/L的硫酸电解质溶液中,咖啡因的氧化峰能很好地与背景电流相分离,减少背景干扰,并且咖啡因有较低的氧化电位(图10.3c),因此本实验选择0.01 mol/L的硫酸电解质溶液为支持底液。
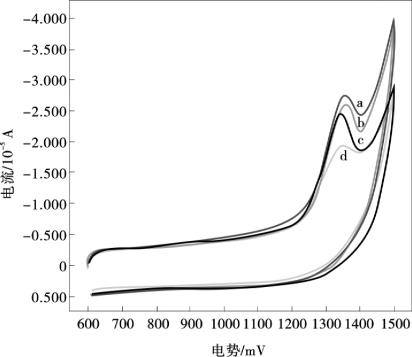
图10.3 MWNTs/Nafion复合薄膜修饰电极对3.0×10-5mol/L咖啡因在不同0.01 mol/L的电解质溶液中的循环伏安图
电解质(a→d) :硝酸、盐酸、硫酸、醋酸;扫描速率80 mV/s
咖啡因的峰电位和峰电流与硫酸电解质溶液的pH值密切相关。调节电解质溶液的pH值,随着pH值的增加,咖啡因的峰电位反而降低,但是在0.7~2.0的pH值范围内,咖啡因的峰电流几乎不变,当pH值由2.0逐渐增高时,其峰电流明显降低。因此,pH值为2.0作为本实验测定的最优pH值。
10.1.1.4 扫描速率对咖啡因峰电流和峰电位的影响
在0.01 mol/L的硫酸底液中(pH =2.0),用循环伏安法研究了MWNTs/Nafion复合薄膜修饰电极在不同扫速(30~400 mV/s)对3.0×10-5mol/L咖啡因的影响,实验结果表明,咖啡因的峰电位随着扫描速率的增加而向正电位方向移动,且发现阳极峰电流ip与扫描速率v的平方根成正比例,这表明在MWNTs/Nafion复合薄膜修饰电极表面,咖啡因发生了扩散控制的氧化过程,本研究结果与文献报道的咖啡因在化学修饰电极表面上的转移特征一致。
10.1.1.5 差示脉冲伏安法(Differential Pulse Voltammetry,DPV)参数的选择
DPV具有高灵敏度和与背景电流的极好分离性能,其常被用于电分析化学的定量测定中。由于阳极峰电流及峰型与差示脉冲伏安法的各种参数紧密相关(如脉冲电压、脉冲增量、脉冲宽度、脉冲周期),所以,实验最初在于选择最佳实验参数。对3.0×10-5mol/L咖啡因,实验结果表明,当脉冲幅度从10~60 mV逐渐变化时,峰电流随着脉冲幅度的增加而增大,同时峰型宽度也随着变宽。当脉冲幅度高于50 mV时,峰型变得太宽,而舍弃。因此,50 mV时峰电流最大而被选为最佳脉冲幅度。当脉冲增量从1 mV逐渐增加到14 mV,峰高随着电位增量的增加而增高,当脉冲增量大于6 mV时,峰形变得非常宽和不平滑,因此6 mV被选为最佳的脉冲增量。另外,无论脉冲宽度或脉冲周期增加都会使峰电流降低,即咖啡因的反应活性随着脉冲宽度和脉冲周期的增加而降低。当脉冲宽度和脉冲周期分别增加到20 ms和60 ms时,峰电流变得不稳定,而且很难与较大的背景电流相分离。同时发现,这些参数的变化对峰电位几乎没有影响。综上所述,选择的差示脉冲伏安法的最佳参数为:脉冲幅度50 mV;脉冲增量6 mV;脉冲宽度20 ms;脉冲周期60 ms。
10.1.1.6 标准曲线
为了验证所建立的方法对咖啡因定量分析的准确性,在最佳仪器条件下(脉冲幅度50 mV;脉冲增量6 mV;脉冲宽度20 ms;脉冲周期60 ms)下,用差示脉冲伏安法研究了咖啡因不同浓度时的峰电流变化(图10.4)。当咖啡因的浓度从4.0×10-4mol/L增加到6.0×10-7mol/L时,咖啡因的阳极峰电流(ipa)与咖啡因的浓度在4.0×10-4~1.0×10-5mol/L和1.0×10-5~6.0×10-7mol/L两个浓度范围内分别呈线性关系。对1.0×10-5~4.0×10-4mol/L浓度范围,其线性回归方程分别为: ipa= 1.572 5 + 0.426 4C (ipa: 10-5A; C: 10-5mol/L ; r = 0.997 1) ;对6.0×10-7~1.0×10-5mol/L浓度范围,其线性回归方程为: ipa= 0.458 1 +1.285 7C (ipa: 10-5A; C: 10-5mol/L; r = 0.997 9)。不同浓度的富集效率导致两条标准曲线的斜率不同,测得的最低检出限为2.3×10-7 mol/L。
再生性和重现性是修饰电极的两大特征,修饰电极应用于分析测定中应考察其再生性和重现性。用同一支MWNTs/Nafion复合薄膜修饰玻碳电极对3.0×10-5mol/L的咖啡因连续5次测量,在每一次测量后,电极都要在0.01 mol/L的硫酸溶液中连续扫描3周来清洗电极(扫描范围600~1 500 mV)。该电极显示出了较好的再生性和重现性,其峰电流的相对标准偏差(RSD)为2.3% (n = 5)。此外,在同样的制备条件下,5支MWNTs/Nafion复合薄膜修饰玻碳电极对3.0×10-5mol/L的咖啡因的峰电流测定的相对标准偏差是6.5%,显示良好的重现性。
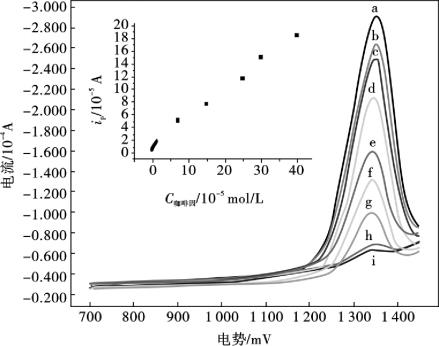
图10.4 不同浓度咖啡因的DPV图
(a→i) : 6.0×10-4,3.5×10-4,4.0×10-4,3.0×10-4,1.5×10-4,9.0×10-5,7.0×10-5,1.0×10-5,8.0×10-6mol/L;插入图:咖啡因的峰电流与其浓度的关系
10.1.1.7 干扰测定
为了进一步说明所建立的方法用于实际样品的可行性,本实验考察了一些可能共存的干扰物质的影响。固定咖啡因的浓度为3.0×10-5mol/L,在相同的实验条件下,测定加入其他干扰物质的影响。根据咖啡因测定的相对误差<±5%,得到如表10.1所示结果。由表10.1数据显示,本实验所建立的方法具有较高的选择性。
表10.1 对3.0×10-5mol/L咖啡因的干扰测定结果

10.1.1.8 实际样品分析
为了符合本方法所建立的线性范围,待测饮料样品用电解质底液准确稀释。检测结果如表10.2所示。从表10.2中测定数据可知,本实验所建立的方法的测定结果与文献报道的用紫外可见方法测定结果相一致,并且该测定结果也符合美国饮料协会所规定的饮料中咖啡因的含量范围(4.3×10-4~8.7×10-4mol/L)。本方法测定的能量饮料中咖啡因的含量与其标示量基本一致(标示量: 200 mg/L)。为了验证测定结果的准确性,采用标准加入法测定加标适量咖啡因的可乐饮料样品。实验结果列于表10.3。标准加入法测得咖啡因的回收率从95.8%至102.6%,这表明该方法具有良好的准确性。
表10.2 DPV及紫外可见光谱法对饮料中咖啡因的测定结果(n = 5)

表10.3 差示脉冲伏安法(DPV)对加标可乐饮料中咖啡因的测定结果(n = 5)

10.1.2 对茶碱的定量分析研究
茶碱(1,3-二甲基黄嘌呤)作为一种黄嘌呤衍生物已经被普遍用作辅助治疗药物,如逐步治疗儿童的剧烈哮喘及用于治疗成年人的哮喘和支气管痉挛等。茶碱也被临床用作利尿剂、强心剂和放松肌肉弛缓药等,然而,人体存在高浓度的茶碱会有严重的有害副作用,所以必须控制茶碱的适当剂量。目前,越来越多的科学家逐渐关注定量分析测定茶碱的技术。
现在,已经发展了很多的方法来定量测定茶碱,如液相色谱法、紫外可见光谱法、化学发光免疫法、气相色谱-质谱法、气相色谱-同位素标定质谱法。然而,以上这些方法中,如色谱法和质谱法需要较长的操作时间,复杂的样品前处理,测定对象的多溶剂萃取,专业的技术人员,以及此些方法所需仪器昂贵。相反,电化学分析方法具有操作简单,高灵敏性,好的稳定性,仪器便宜,并可实现现场检测。因此,电化学分析法已经用于茶碱的测定。为了提高测定的灵敏度的稳定性,按人们意图设计的修饰电极已经被用于茶碱的电分析测定中。但是,由于茶碱的电化学氧化发生在一个非常高的电位,并且茶碱易于在电极表面聚集,所以有关用电分析方法测定茶碱的文献报道较少。例如,Zen等研制了Nafion/铅-钌氧化物孔绿石化学修饰电极,伏安测定茶叶和药物制剂中的茶碱,最低检测限为1.0×10-7mol/L; Ferapontova等开发了微生物茶碱氧化酶修饰电极伏安测定茶碱,对茶碱的最低检测线为0.02 mmol/L,但是,由于酶活性的降解,这种生物传感器的稳定性较差;硼掺杂钻石电极和钴酞菁染料纳米颗粒修饰碳糊电极用于茶碱的伏安测定已经被报道,但是这两种修饰电极的制备过程较复杂,以及电极表面的再生能力较困难。近来,多壁碳纳米管直接修饰裸玻碳电极用于伏安测定茶碱已有报道,测得茶碱的线性范围是3.0×10-7~1.0×10-5mol/L,但是,很难直接将碳纳米管较均匀地分散在纯水中。
本章节探讨了茶碱在MWNTs/Nafion复合薄膜修饰玻碳电极上的伏安行为,茶碱在MWNTs/Nafion复合薄膜修饰玻碳电极上产生一个灵敏的氧化峰。与裸玻碳电极相比,MWNTs/Nafion复合薄膜修饰电极能明显增加茶碱氧化峰的峰电流和降低茶碱的氧化过电位。根据氧化峰电流与茶碱浓度的变化关系,可以实现定量分析测定实际样品中的茶碱,建立了定量分析测定茶碱的新方法。
10.1.2.1 茶碱在MWNTs/Nafion/GCE上的电化学响应
图10.5所示是在扫描速率100 mV/s时,0.01 mol/L H2SO4(pH =1.8)电解质溶液中,2.0×10-5mol/L的茶碱分别在MWNTs/Nafion/GCE (a)、Nafion/GCE (b)和裸GCE (c)的循环伏安图。在相同的测试条件下,茶碱在GCE上几乎没有出现茶碱的氧化还原峰,而在Nafion/GCE上,在1 280 mV电位处有一个峰型极好的氧化峰,这种现象是由于Nafion是一种阳离子交换剂,具有较强的与阳离子交换的能力,能有效地从茶碱的本体溶液中吸引茶碱分子到电极的表面。对比于Nafion/GCE,茶碱在MWNTs/Nafion/ GCE上的氧化峰电流明显增强,而且氧化峰电位从1 280 mV处负移到了1 180 mV,这个实验现象证明了MWNTs/Nafion/GCE对茶碱拥有更高的富集能力并能显著提高茶碱的电化学测定灵敏度。Nafion的阳离子交换能力和MWNTs的优异特性,如MWNTs的特殊电子结构,高的电导率,表面的拓扑缺陷,能使分析对象充分与电极表面接触的纳米尺寸,都能有效的电催化茶碱的氧化过程。
10.1.2.2 支持电解质和pH值对茶碱峰电流和峰电位的影响
由于不同的支持电解质溶液会影响茶碱的电化学行为,因此,分别以0.1 mol/L磷酸盐(pH =3.0~7.0),醋酸盐(pH =3.0~7.0),硼酸盐(pH =5.5~8.0),0.04 mol/L B-R溶液(pH =2.0~8.0),以及0.01 mol/L各种酸(如HCl、HNO3、H2SO4、H3PO4和CH3COOH)为支持电解质,研究了它们对茶碱的电化学行为的影响,实验结表明,茶碱只有在较低的pH值才显示了较高的氧化峰电流,对比茶碱在几种酸性溶液的循环伏安图,选择H2SO4 (0.01 mol/L)溶液为支持电解质底液。
茶碱的峰电位(Ep)和峰电流(ip)与硫酸电解质溶液的pH值密切相关。随着pH值的增加,茶碱的峰电位反而降低,但是pH值从0.7逐渐增加到4.2时,茶碱的氧化峰电位逐渐负移,说明氢离子参加了电极反应。茶碱的氧化峰电位与pH值(0.7~4.2)具有线性关系,线性方程为: Ep= 1.268 8-0.0306 pH (Ep: V,r = 0.998 7),方程的斜率30.6 mV/pH与文献报道28 mV/pH相近,这也说明了参加电化学反应的电子数是参加电化学反应的质子数的2倍。实验结果表明,在pH = 1.8硫酸底液中,茶碱具有较低的峰电位和最大的峰电流(ip),所以,pH = 1.8被选为测定茶碱的最佳pH值。由于茶碱的pKa= 8.77,这表明,在pH =1.8的硫酸底液中茶碱以质子化阳离子形式存在,由于Nafion的离子交换作用和MWNTs的静电作用,带正电荷的茶碱就会被更有效的吸附在电极表面。
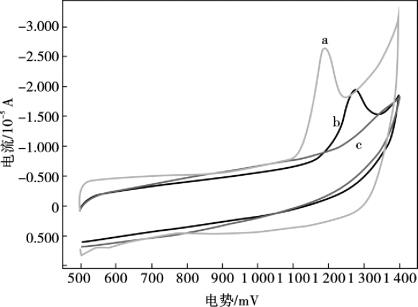
图10.5 0.01 mol/L H2SO4(pH = 1.8)电解质溶液中,2.0×10-5 mol/L茶碱在不同电极上的循环伏安图
MWNTs/Nafion/GCE (a),Nafion/GCE (b),裸GCE (c) ;扫描速率100 mV/s
10.1.2.3 扫描速率对茶碱峰电流和峰电位的影响
在0.01 mol/L的硫酸底液中(pH = 1.8),用循环伏安法研究了MWNTs/Nafion复合薄膜修饰电极在不同扫速(40~300 mV/s)下对2.0×10-5mol/L茶碱的影响,实验结果表明,茶碱的峰电位随着扫描速率的增加而向正电位方向移动,且发现阳极峰电流ip与扫描速率v成正比(r = 0.997 1),线性方程为: ip= 0.015 4v + 0.369 7 (ip: 10-5A,v: mV/ s),这表明在MWNTs/Nafion复合薄膜修饰电极表面,茶碱在电极表面发生了吸附控制的氧化过程。为了进一步阐明茶碱发生电化学氧化的实质,在0.01 mol/L H2SO4介质溶液中,对茶碱进行了连续的循环伏安扫描,实验结果表明,对比茶碱的氧化峰电流,第二周显著比第一周降低,第二周扫描之后,茶碱的氧化峰电流几乎不变。以上实验现象可以进一步说明在MWNTs/Nafion/GCE上,茶碱在电极表面发生的是吸附控制的电化学氧化过程。
茶碱的氧化峰电位随扫描速率的增加逐渐向正方向移动。茶碱的氧化峰电位(Ep)与扫描速率(v)在40~300 mV/s符合下列线性方程:
Ep= 1.093 1 + 0.022 9 lnv (Ep: V,v : mV/s,r = 0.996 0)
根据Laviron理论,对于一个不可逆的氧化反应,Ep-v关系符合下面关系式:
![]()
式中,E0为常规标准电位;α为电子转移系数; n为电子转移数; F为法拉第常数(96 500 C/mol),ks为反应速率常数。从Ep-lnv关系式的斜率,可以计算的αn = 1.12,假设n = 2,计算得α= 0.56.从Ep-v关系外推v = 0的得到的截距为E0= 1.17 V,再代入Ep-lnv线性方程,计算得ks= 6.70 s-1。
10.1.2.4 茶碱在MWNTs/Nafion/GCE上的最大覆盖量
茶碱的氧化峰电流与其在工作电极表面的最大吸附覆盖量紧密相关,依据电极表面富集反应的电化学氧化所消耗的电子转移数,基于如下方程:
![]()
可以计算得到最大覆盖量(Γmax) ;其中Γmax电极表面最大覆盖量(mol/cm2),Q消耗的电量,A电极表面的表观面积(cm2) ;假设茶碱在电极表面是单层吸附,计算得Γmax= 7.20×10-10mol/cm2,即每个茶碱分子所占面积是0.23 nm2。
10.1.2.5 标准曲线
由于差示脉冲伏安法(DPV)具有高灵敏度和与背景电流极好的分离性能,其常被用于电分析化学的定量测定中。为了验证所建立的方法对茶碱定量分析的准确性,在最佳仪器条件(脉冲幅度40 mV;脉冲增量8 mV;脉冲宽度45 ms;脉冲周期120 ms)下,用差示脉冲伏安法研究了茶碱在不同浓度时的峰电流变化。当茶碱的浓度从8.0×10-8mol/L增加到6.0×10-5mol/L时,茶碱的阳极峰电流与茶碱的浓度呈线性关系(图10.6),其线性回归方程分别为: ip= 0.282 5 + 0.070 3C (ip: 10-5A; C:μmol/L; r =0.998 9) ;最低检出限为2.0×10-8mol/L。
再生性和重现性是修饰电极的两大特征,修饰电极应用于分析测定应该考察其再生性和重现性。用同一支MWNTs/Nafion复合薄膜修饰玻碳电极对2.0×10-5mol/L的茶碱连续5次测量,在每一次测量后,电极都要在0.01 mol/L的硫酸溶液中连续扫描3周来清洗电极(扫描范围500~1 400 mV)。该电极显示出了较好的再生性和重现性,其峰电流的相对标准偏差(RSD)为2.4% (n = 5)。此外,在同样的制备条件下,5支MWNTs/Nafion复合薄膜修饰玻碳电极对2.0×10-5mol/L的茶碱的峰电流测定的相对标准偏差是6.3%,显示良好的重现性。
10.1.2.6 干扰测定
为了进一步说明所建立的方法用于实际样品的可行性,本实验考察了一些可能共存的干扰物质的影响。固定茶碱的浓度为2.0×10-5mol/L,在相同的实验条件下,测定加入其他干扰物质的影响。根据茶碱测定的相对误差<±10%,得到如表10.4所示结果。由表10.4数据显示,本实验所建立的方法具有较高的选择性。
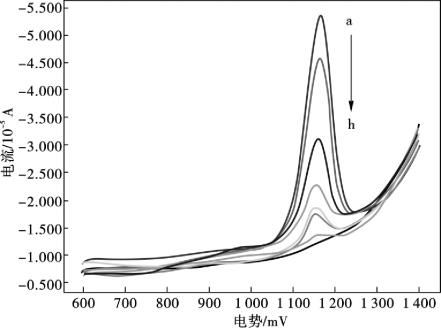
图10.6 不同浓度茶碱的DPV图
(a→h) : 6.0×10-5,4.0×10-5,2.0×10-5,8.0×10-6,6.0× 10-6,4.0×10-6,6.0×10-7,1.0×10-8mol/L
表10.4 对2.0×10-5mol/L茶碱的干扰测定结果

10.1.2.7 实际样品分析
为了说明本研究所建立的定量分析茶碱的方法可以实现在实际样品中的应用,选取茶碱缓释片和氨茶碱注射液作为测定的实际样品。为了符合本方法所建立的线性范围,待测样品先进行研磨,再用电解质底液准确稀释。检测结果如表10.5所示。从表10.5中测定数据可知,本方法测定茶碱在茶碱缓释片中的含量为0.092 1 g/片(标示量0.1 g/片) ;茶碱在氨茶碱注射液中的含量为0.197 6 g/瓶(标示量0.2 g/瓶),本方法测定的实际样品中茶碱的含量与其标示量基本一致。为了验证测定结果的准确性,采用标准加入法测定加标适量茶碱的实际样品。实验结果列于表10.6。标准加入法测得茶碱的回收率从96%~112.5%,这表明该方法具有良好的准确性。
![]()
表10.5 DPV对实际样品中茶碱的测定结果(n = 5)
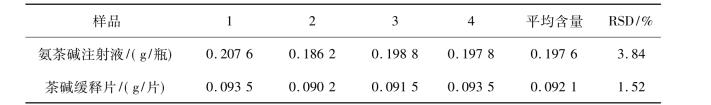
表10.6DPV对实际样品中茶碱的回收测定结果(n = 5)
10.1.3 对丹皮酚的定量分析研究
丹皮酚(2-羟基-4甲氧基乙酰苯酚Paeonol,PN)是丹皮中的一种主要酚类成分。众所周知,丹皮酚具有抗血小板凝聚,抗氧化和抗发炎的功效。一定剂量的丹皮酚有镇痛、解热、抗菌的性能,其已用于治疗关节炎并抑制腺苷或胶原诱导的人血小板聚集。许多的科研工作者逐渐关注丹皮酚的药理活性。因此,建立定量分析测定丹皮酚的技术对评价和普及传统中草药以及包含丹皮酚的药物产品至关紧要。
目前,科研工作者已经研发了许多方法来分析测定丹皮酚,例如,气相色谱/质谱法,液相色谱/质谱法,高效液相色谱和胶束电动毛细管色谱法等,这些测定方法都与样品前处理技术相结合,已经用于丹皮及其他产品中丹皮酚含量的测定。然而,这些方法也有一些不足之处,如色谱方法操作比较费时间,仪器昂贵,并且需要复杂的富集或多溶剂提取,以及需要经过专门培训的技术人员。相反,电化学方法的特点是简单、灵敏度高、稳定性好、仪器成本低、操作简单,并且还可以实现现场监测。因此,电化学分析法已经发展用于分析测定酚类物质。例如,Yi等人构建了Nafion膜修饰玻碳电极,并用于对苯酚的测定。Liu等人把酪氨酸酶固定于核-壳型磁性纳米粒子修饰碳糊电极中,制备了测定苯酚的酪氨酸酶生物传感器,检测限达6.0×10-7mol/L。Fernandez等人报道了苯酚可以有效地吸附在水滑石类黏土/阴离子表面活性剂/玻碳修饰电极上,并且苯酚的氧化峰电位向负方向移动。Liu等人研发了一种可再生的基于酪氨酸酶-胶体金修饰的碳糊电极,苯酚的检测限达6.1×10-9mol/L。然而,除了Wang科研组有关丹皮酚的电化学研究的文献报道外,还未见其他有关电化学测定丹皮酚的报道,这是因为丹皮酚很容易在电极表面产生紧密绝缘的芳基聚合物,并阻隔电极表面电化学反应的进行。据文献调研,还未见有关功能化多壁碳纳米管/Nafion复合薄膜修饰玻碳电极作为电化学传感器用于对丹皮酚进行定量分析的报道。
本章节详细研究了丹皮酚在MWNTs/Nafion/GCE上的电化学行为。MWNTs/Nafion/ GCE不仅显著提高了丹皮酚的氧化峰电流,还明显降低了丹皮酚的氧化峰电位,并且还有效地降低了电极污染。基于上述优点,构建了简单、可再生和灵敏的MWNTs/Nafion/ GCE电化学传感器,并用于实际药物样品和生物样品中丹皮酚的测定。10.1.3.1 丹皮酚在功能化多壁碳纳米管/Nafion/GCE上的电化学响应
图10.7显示,在0.1 mol/L磷酸盐缓冲液(pH =7.0)中,8×10-5mol/L丹皮酚在不同电极上的电化学响应: MWNTs/Nafion/GCE (a),Nafion/GCE (c)和裸GCE (b)。根据Wang等科研小组的报告,丹皮酚很易于在裸玻碳电极表面形成紧密的电绝缘性芳基醚类聚合物膜,并且这种电绝缘性芳基醚类聚合物膜会阻止该电极表面上丹皮酚电化学反应的继续进行。Nafion是一种全氟化高分子磺酸盐聚合物,具有良好的阳离子交换能力及较强的吸附性能,另外还具有优良的成膜性能;它可以有效地阻止丹皮酚在电极表面形成大量的电绝缘性芳基醚类聚合物膜,从而避免该聚合物在电极表面形成致密的低渗透性的表面膜而造成电极的污染。因此,当存在Nafion膜时,阳极峰电流(ipa)可以有效地与背景电流(图10.7曲线c)分开。当Nafion膜和MWNTs复合修饰玻碳电极时,丹皮酚的阳极峰电位开始负移至836 mV,同时伴有阳极峰电流的明显增强(图10.7曲线a)。这种使丹皮酚峰电流增强,峰电位负移的现象可能与丹皮酚在MWNTs上的电子转移速率增大,MWNTs能有效的增加电极有效表面积,促使丹皮酚在电极表面的有效富集有关。MWNTs/Nafion复合材料修饰剂修饰的电极对丹皮酚的电化学响应具有更高的敏感度,MWNTs/Nafion的协同作用可以提高丹皮酚的伏安响应。此外,从图10.7所示可知,在MWNTs/Nafio/GCE上,丹皮酚在440 mV(vs.SCE)产生了一个微小的阴极峰,这表明在同条件下,丹皮酚在MWNTs/Nafion/GCE电极上的伏安响应比在Nafion/GCE更加灵敏。
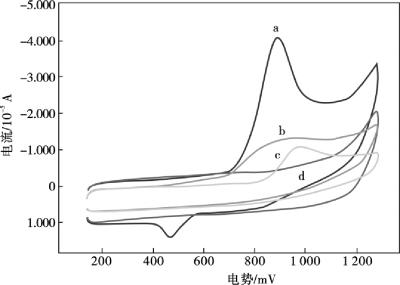
图10.7 在0.1 mol/L磷酸盐(pH =7.0)缓冲溶液中,8.0×10-5 mol/L丹皮酚在不同电极上的循环伏安图
MWNTs/Nafion/GCE (a),裸GCE (b),Nafion/GCE (c),MWNTs/Nafion/ GCE在空白底液中(d) ;扫速100 mV/s
10.1.3.2 不同pH值对丹皮酚伏安响应的影响
缓冲溶液的pH值对丹皮酚的电化学响应有重要的影响,因此本研究考察了丹皮酚在不同pH值的0.1 mol/L的磷酸盐缓冲液中的伏安行为。试验结果表明,从pH = 3.0逐渐增大到pH =5.0时,丹皮酚的氧化峰电流随pH值的增大而降低,从pH =5.0逐渐增至pH =7.0时,丹皮酚的氧化峰电流随pH值的增大而增加;最后,从pH =8.0逐渐增至pH =11.0时,丹皮酚的氧化峰电流随pH值的增大而降低。与此同时,丹皮酚的阳极峰和阴极峰的电位随pH值增加向负电位方向移动。这种试验现象表明,质子参加了丹皮酚的电化学反应,并且随着缓冲液pH值的增加,丹皮酚在电极表面的电化学反应更容易进行。考虑到人体的生理环境,本研究选用pH =7.0的0.1 mol/L的磷酸盐缓冲溶液为支持电解质溶液。参与电化学反应的质子数可以通过如下方程计算:
Epa= E0'-0.059 p/n pH
式中,p是参与电极反应的质子数; n是参与电极反应的电子数。根据试验测定,丹皮酚的阳极峰电位Epa与pH值呈线性,斜率为0.050 3;根据上述方程,参与电极反应的电子转移数与参加电极反应的质子数相等。
10.1.3.3 MWNTs/Nafion复合修饰剂的不同修饰量对丹皮酚电化学响应的影响
不同量的MWNTs/Nafion悬浮液涂在电极表面可以改变电极表面的性质和功能。本研究考察了MWNTs/Nafion复合修饰剂的不同修饰量对丹皮酚电化学响应的影响。试验结果发现,当MWNTs/Nafion悬浮液修饰量从4.0 μL逐渐增加到10.0 μL时,丹皮酚的氧化峰电流随MWNTs/Nafion修饰量的增加而增加;然而,当MWNTs/Nafion修饰量超过10.0 μL时,丹皮酚的氧化峰电流反而逐渐减小。分析此试验现象的原因可能为:开始,随着MWNTs/Nafion修饰量的逐渐增加,电极表面的电子交换位点逐渐增加,丹皮酚在MWNTs/Nafion修饰电极上的吸附量也逐渐增加,因此,丹皮酚的氧化峰电流逐渐增加。但是,当MWNTs/Nafion复合修饰剂的量超过某一个值时(10.0 μL),修饰薄膜逐渐变厚,逐渐加大阻碍电子及丹皮酚与电极表面间的传输,所以导致了丹皮酚的氧化峰电流下降。根据试验结果,本实验选取MWNTs/Nafion的最佳修饰量为10.0 μL。
10.1.3.4 扫描速率对丹皮酚的氧化峰电流及峰电位的影响
扫描速率是影响电活性物质的电化学响应的重要因素,本研究考察了扫描速率(v)对丹皮酚在MWNTs/Nafion/GCE上的电化学响应的影响,试验结果显示,扫描速率在20 mV/s变化到400 mV/s时,丹皮酚的氧化峰电流与扫描速率呈良好的线性关系,线性回归方程为:
ipa= 0.024 5 v + 3.553 9 (ipa: in 10-5A,v : in mV/s,r = 0.997 9)
这表明丹皮酚在MWNTs/Nafion/GCE上的电化学氧化反应是受吸附控制的氧化过程。
为了进一步阐明丹皮酚在MWNTs/Nafion/GCE上的电化学反应本质,本研究对丹皮酚进行了连续的多次循环伏安扫描,试验结果显示,相比于丹皮酚第一次循环的氧化峰电流,第二周的氧化峰电流剧烈下降;然而,第二周之后的几周扫描,丹皮酚的氧化峰电流几乎不变,这种试验现象进一步说明了丹皮酚在MWNTs/Nafion/GCE上的电化学反应是一个受吸附控制的反应过程。Wang等人报道,在Pt电极上,丹皮酚在连续两周循环伏安扫描后,由于丹皮酚在电极表面的快速钝化就观测不到丹皮酚的氧化峰信号,但是在MWNTs/Nafion/GCE上,在连续扫描的第九周还能观测到丹皮酚较高的峰电流,由此可以说明,MWNTs/Nafion/GCE对丹皮酚的电化学氧化所产生的电极钝化有极好的抵抗能力,并且第一周扫描后,在640 mV处,又出现一个较小的氧化峰。
丹皮酚的氧化峰电位随扫描速率的增加向正方向移动。扫描速率在20 mV/s到400 mV/s变化时,丹皮酚的氧化峰电位(Epa)与扫描速率(v)符合如下线性关系:
Epa= 0.676 0 + 0.053 0 lnv (Epa: V,v : mV/s,r = 0.997 2)
根据Laviron理论,对于一个不可逆的阳极反应,其Ep-v的线性关系遵循下列公式:
![]()
式中,EO是常规标准电位;α是电子转移系数; n是转移电子数; F是法拉第常数(96 500 C/mol) ; Ks是非均相标准反应速率常数。R和T是他们通常的意义。从Epa-lnv线性关系的斜率计算得到αn = 0.46,当a是0.5时,参与电极反应的电子数量为1。假设na= n,α值为0.46,根据Ep-v的线性关系外推v = 0,由其截距可以得到E0的值是0.870 V;又从Epa-lnv直线的截距计算Ks= 733 s-1。由于扫描速率为100 mV/s时,丹皮酚具有较高的氧化峰电流,较低的峰电位和较小的背景电流,因此被选为测定丹皮酚最佳扫描速率。
丹皮酚整个氧化反应过程的多电子-质子转移步骤和复杂的聚合过程。丹皮酚阴离子在第一步氧化的过程中产生含苯氧自由基;一方面,含苯氧自由基又快速的被氧化生成新的产物,这种新产物可以相互连接生成聚合物;另一方面,含苯氧自由基可以与其他自由基或者未反应的丹皮酚阴离子通过C—C或C—O键发生不可逆的反应形成不同的聚合物。根据本试验结果,一个可能的丹皮酚氧化机制可以表示如下:
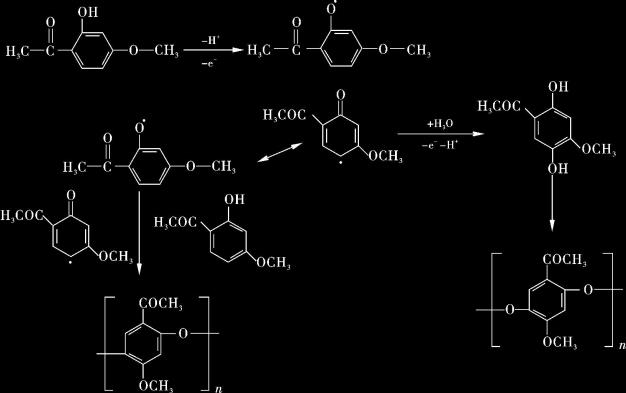
丹皮酚发生电化学反应产生的较小的还原峰可能是丹皮酚在发生氧化反应的过程中,由于副反应的发生产生的苯醌类化合物发生的电化学还原;而在640 mV处,丹皮酚产生的较小氧化峰可能是发生过电化学还原的苯醌类化合物所发生的又一次氧化。在同样的试验条件下,本研究对比了苯酚与丹皮酚的电化学反应过程,试验发现,苯酚的循环伏安图与丹皮酚的循环伏安图非常相近,由此也说明丹皮酚电化学反应机制推理的合理性。
10.1.3.5 差示脉冲阳极溶出伏安法的各种参数对丹皮酚电化学反应的影响
差示脉冲阳极溶出伏安法(differential pulse anodic stripping voltammetry,DPASV)具有较高的灵敏度及与背景电流极好的分离能力,所以用DPASV来定量分析丹皮酚。由于丹皮酚的氧化峰电流及其峰型受DPASV的各种参数的影响(如富集时间、富集电位、脉冲幅度、脉冲增量、脉冲宽度及脉冲周期),所以最初的试验是选择最佳的各种参数。试验结果表明,富集时间从0 s增加到20 s或富集电位从500 mV增加到700 mV,阳极峰电流随富集时间的增加而增大;当富集时间超过20 s时,氧化峰电流几乎不变;当富集电位超过700 mV时,氧化峰电流开始降低。因此,20 s作为最佳富集时间,700 mV作为最佳富集电位。对脉冲增量进行考察的范围是1~8 mV,试验结果显示:开始逐渐增大脉冲增量会促使丹皮酚的氧化峰电流逐渐增加,当脉冲增量增至6 mV时,其氧化峰电流几乎不变;因此,把6 mV选为最佳脉冲增量。脉冲幅度,脉冲宽度或脉冲周期逐渐增加,丹皮酚氧化峰电流逐渐增大,而当脉冲幅度,脉冲宽度或者脉冲周期分别为50 mV,40 ms和150 ms时,丹皮酚的氧化峰电流达到最大,因此,选用脉冲幅度,脉冲宽度及脉冲周期的最佳值分别为50 mV,40 ms和150 ms。试验还发现,DPASV的参数变化对丹皮酚的氧化峰电位几乎没有影响。
10.1.3.6 校准曲线的建立
为了进一步检验所建立方法用于丹皮酚的定量分析的可行性,用DPASV方法研究了丹皮酚浓度与丹皮酚氧化峰电流之间的关系。在最佳参数条件(富集时间20 s、富集电位700 mV、脉冲幅度50 mV、脉冲增量6 mV、脉冲宽度40 ms及脉冲周期100 ms)下,当丹皮酚的浓度从6.0×10-7mol/L逐渐增加到8.0×10-4mol/L时,丹皮酚的氧化峰电流与其浓度在6.0×10-7~6.0×10-5mol/L内呈良好的线性关系,线性回归方程为: ipa= 0.225 98 + 0.035 6 CPN(ipa: 10-5A,CPN:μmol/L,r = 0.997 7),对丹皮酚的最低检出限为4.0×10-7mol/L。
再生性和重现性是修饰电极的两个重要特征。同一个MWNTs/Nafion/GCE对8.0 ×10-5mol/L的丹皮酚连续测量7次(每次测量后,在0.1 mol/L磷酸盐缓冲液中,100 mV和1300 mV范围连续循环伏安扫描3周),计算丹皮酚氧化峰电流值的相对标准偏差(RSD)为2.3%,表明该修饰电极具有良好的重现性和再生性。
10.1.3.7 干扰研究
为了评价MWNTs/Nafion/GCE电极的选择性,在0.1 mol/L磷酸盐缓冲液中(pH =7.0),本研究考察一些可能共存的干扰物质对浓度为6.0×10-5mol/L丹皮酚氧化峰电流的影响。试验结果表明,依照对丹皮酚峰电流影响的相对误差<±10%,K+、Cl-、SO24-和醋酸盐的浓度为丹皮酚浓度500倍,抗坏血酸和尿素为50倍,氨基酸为20倍时,对丹皮酚的测定几乎没有干扰。
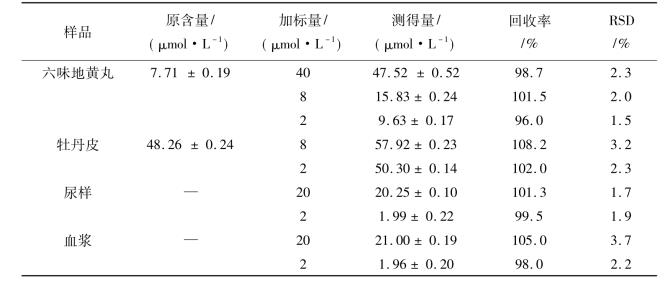
10.1.3.8 实际样品分析
为了符合本研究所建立方法的线性范围,实际样品六味地黄丸和牡丹皮用支持电解液准确的稀释。六味地黄丸按照1/100 (V/V)稀释,牡丹皮按照1/10 (V/V)稀释。血浆和尿样的按照1/100 (V/V)稀释,稀释的过程可以减少实际样品基质的干扰。用MWNT/Nafion/GCE测定六味地黄丸和牡丹皮中的丹皮酚,测定结果列于表10.7中,六味地黄丸中丹皮酚的含量为(3.20±0.75) mg/g,这与文献报道的值3.22 mg/g相近;丹皮酚在牡丹皮中的含量是(20.05±0.50) mg/g,这与报道的(20.61±0.986) mg/g基本相一致。利用加标回收试验来进一步验证本研究所建立方法的准确性和可重复性。对牡丹皮,尿样和血浆样本溶液分别进行加标回收测定,结果如表10.7示。从表10.7可知,本研究所建立的方法对药物药品和生物样品中丹皮酚的测试都具有较高的灵敏度和选择性。
表10.7 药物样品及生物样品中丹皮酚的测定结果(n = 5)
10.1.4 对抗坏血酸和尿酸的同时定量分析研究
抗坏血酸(Ascorbic Acid,AA)广泛存在于生物液体、药物、水果以及饮料中。AA是最重要的可溶性维生素之一,在调节生物体机能方面起到重要作用,如作为日常维生素吸收不足的补充,愈合伤口,预防以及治疗感冒、精神病、脱毛发等。尿酸(Uric Acid,UA)是嘌呤在人体内新陈代谢的最终产物之一,人体内,不正常水平的尿酸往往是某些疾病出现的征兆,如反常水平的尿酸含量与痛风、高尿酸血症、肾结石和雷纳综合征等疾病有关,因此,检测生物体液中尿酸的含量具有重要的临床意义。
由于尿酸在调节生理机能和临床意义方面的至关重要的作用,已经发展了几种传统的分析测定尿酸的方法,例如,比色法、酶技术及电化学方法。然而,比色法并不能提供尿酸准确的浓度,酶技术也存在其自身的缺陷,如花费昂贵,并且不能提供一个相对较高尿酸检测限。相反,电化学分析法的特色是具有较高的选择性、花费经济、检测快速,并可实现在活的有机体内的实时测定。UA具有良好的电化学活性,因此可以用电化学方法测定UA。但是,一般情况下,UA与AA总是共存于生物液体中(如血液、尿液),并且AA的电化学氧化峰电位与UA的氧化峰电位非常接近,因此,在传统的电极上,用电化学方法对真实样品中AA或UA的定量分析测定就具有较差的选择性。所以,建立一种更灵敏,选择性更高及更简单的方法来实现对UA和AA的同时定量分析测定是有必要的。
据文献报道,已经有各种各样的修饰电极用于分离AA与UA重叠的氧化峰,例如,纳米金修饰电极、碳糊电极、LaFeO3修饰电极、聚合物修饰电极、共价单层薄膜修饰电极、Nafion薄膜修饰电极、壳聚糖结合十六烷基溴化物修饰玻碳电极等。尽管有文献报道了采用各种修饰电极实现了AA的伏安分析测定,但是努力构建更高选择性、价格更便宜及分析速度更快的伏安分析技术来实现AA与UA的同时定量测定仍具有重要意义。据文献调研,还未见有关功能化多壁碳纳米管/Nafion复合薄膜修饰玻碳电极作为电化学传感器同时对AA和UA进行定量分析的报道。
本章节利用功能化多壁碳纳米管/Nafion复合薄膜修饰玻碳电极(MWNTs/Nafion/ GCE),在0.1 moL NaCl (pH =6.5)支持电解质溶液中,实现了同时伏安测定AA和UA。比较与裸玻碳电极,Nafion/GCE,MWNTs/Nafion/GCE能较大的增加AA和UA的氧化峰电流,并使AA和UA的氧化峰电位分离达320 mV,能够进行AA与UA的同时伏安定量分析测定。该修饰电极还实现了未前处理实际样品中AA和UA的定量分析。
10.1.4.1 UA和AA的电化学响应
图10.8A分别为AA与UA混合溶液(a),单独存在AA(b)和没有AA与UA的
0.1 mol/L NaCl (pH =6.5)底液(c)在MWNTs/Nafion/sGCE上的循环伏安图,图10.8A -a显示了两个氧化峰,分别属于UA(534 mV),AA(214 mV)的电化学氧化峰,UA与AA的氧化峰分离度高达320 mV。图10.8B为8.0×10-5mol/L UA和1.0×10-3mol/L AA的混合物在不同电极上的循环伏安图,由图可知,在同样条件下,在Nafion/GCE上,AA和UA都没有氧化还原峰;而在裸GCE上,在电位310 mV处,AA和UA有一个相互叠加较宽的氧化峰,峰宽范围为98~580 mV;然而,在MWNTs/Nafion/sGCE和MWNTs/ GCE上,AA和UA都有一个明显的氧化峰,且它们的氧化峰分离度为320 mV。
这个较宽的分离度可以实现AA和UA的同时电化学分离测定;另外,在MWNTs/Nafion/sGCE上,AA和UA的氧化峰电流明显高于其在MWNTs/GCE上的氧化峰电流。
10.1.4.2 扫描速率对UA和AA的电化学响应的影响
在0.1 mol/L NaCl (pH = 6.5)支持电解质溶液中,本文分别研究了AA和UA在MWNT/Nafion/ GCE上不同扫描速率时对其峰电流、峰电位的影响。当扫描速率v从20 mV/s逐渐增加到200 mV/s时,AA和UA的氧化峰电位都随着扫描速率的增加而正移,并且AA和UA的氧化峰电流与扫描速率的平方根(v1/2)成正比,这也说明在MWNTs/ Nafion/GCE上,AA和UA在该电极表面的电化学氧化受扩散控制。
10.1.4.3 支持电解质溶液pH值对UA和AA的电化学响应的影响
在MWNTs/Nafion/GCE上,研究了AA和UA在支持电解质溶液不同pH值时的电化学行为。当pH值从3.0逐渐增加到10.0时,AA和UA的氧化峰电位逐渐负移,而当pH值为6.5时,AA和UA的峰电流分别达到最大,所以本研究选择最佳的pH值为6.5。
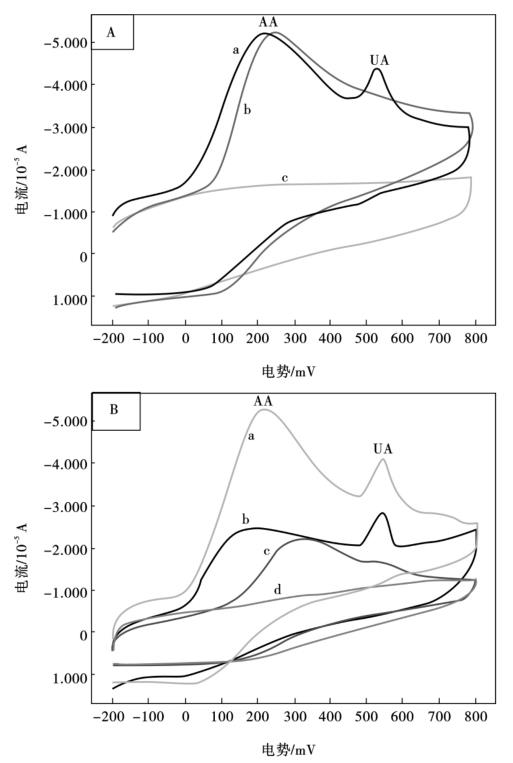
图10.8 A: MWNTs/Nafion/GCE上的循环伏安图:8.0×10-5mol/L UA + 1.0×10-3mol/L AA (a),1.0×10-3mol/L AA (b)和纯底液中(c) ; B:0.1 mol/L NaCl (pH =6.5)支持电解质底液中,8.0×10-5mol/L UA和1.0×10-3mol/L AA在不同电极上的循环伏安图: MWNTs/Nafion/GCE (a),MWNTs/GCE (b),bare GCE (c)和Nafion/GCE (d),扫描速率100 mV/s
10.1.4.4 差示脉冲伏安法同时对UA和AA的伏安测定
差示脉冲伏安法(DPV)具有较高的灵敏度和较好的与背景电流分离的能力,所以采用DPV法来实现AA和UA的同时伏安测定。在MWNTs/Nafion/GCE上,在AA和UA的混合物中,采用固定其中一种物质(如AA)而改变另一种物质的浓度(如UA)来建立标准曲线。当固定UA的浓度为8.0×10-5mol/L不变,而改变AA的浓度,AA的浓度与其峰电流在8.0×10-5~6.0×10-3mol/L浓度范围成线性关系,线性方程为:
iAA/10-5A = 0.086 9 CAA(10-4mol/L)+ 0.944 2 (r = 0.998 8)
其最低检出限为4.0×10-5mol/L。固定AA浓度2.0×10-3mol/L不变,改变UA的浓度,则UA的浓度在6.0×10-7~8.0×10-5mol/L范围内与其峰电流呈线性关系,其线性方程为:
iUA/10-6A = 4.447 7 CUA(10-5mol/L)+ 2.250 6 (r = 0.997)
最低检出限为2.0×10-7mol/L。
电极的重现性是修饰电极的重要特征,在分析测定中必须加以考察。对同一支MWNTs/Nafion/GCE,对1.0×10-3mol/L AA和8.0×10-5mol/LUA混合物连续测定5次,RSD为2.5%,证明了该修饰电极具有较好的重现性。
10.1.4.5 干扰研究
为了评价MWNTs/Nafion/GCE电极的选择性,在0.1 mol/L NaCl支持电解质溶液中(pH =6.5),当溶液中存在8.0×10-5mol/L UA时,本研究考察一些可能共存的干扰物质对浓度为1.0×10-3mol/L AA氧化峰电流的影响。试验结果表明,依照对AA峰电流影响的相对误差<±10%,KCl、MgCl2、葡萄糖和CaCl2的浓度为AA浓度100倍,ZnCl2 为5倍,氨基酸为20倍时对AA的测定几乎没有干扰。
10.1.4.6 实际样品分析
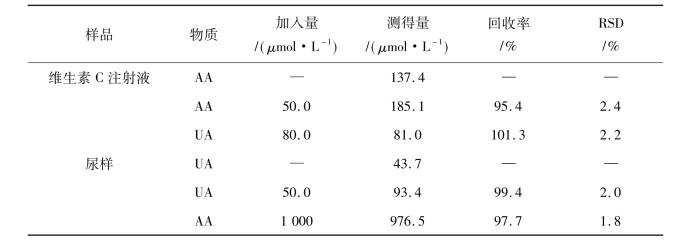
为了符合本研究所建立方法的线性范围,实际样品尿样、血浆和维生素C注射液用支持电解液准确的稀释,稀释的过程可以减少实际样品基质的干扰,测定结果列于表10.8中。维生素C注射液中AA的含量为242 g/L,这与它的标示含量的250 g/L基本相一致。尿样中测定的UA的浓度为4.37×10-3mol/L,这也在健康人尿酸含量范围。利用加标回收试验来进一步确证本研究所建立方法的准确性和可重复性。对尿样和维生素C样本溶液分别进行加标回收测定,结果如表10.8所示。从表10.8可知,本研究所建立的方法对药物药品和生物样品中AA和UA的测试都具有较高的灵敏度和选择性。
表10.8 药物样品及生物样品中的AA和UA的测定结果(n = 5)
10.1.5 小结
(1)本章节探讨了MWNTs/Nafion/GCE对弱碱性药物分子咖啡因、茶碱电化学行为;该修饰电极用于电分析测定咖啡因和茶碱能改善一系列在传统电极上出现的问题,如高的过电位,慢的电极反应,低的灵敏度等;建立了一种高灵敏度伏安测定咖啡因和茶碱定量检测体系。
(2)研究表明MWNTs/Nafion/GCE对丹皮酚的电化学氧化显示出明显的电催化活性,对电极污染显示出极好的抵抗能力;建立了定量分析丹皮酚的检测体系;得到了丹皮酚的动力学参数并提出了可能的丹皮酚的多步氧化机制。在该修饰电极上,体内弱酸性药物抗坏血酸和尿酸的氧化峰电流显著增加,抗坏血酸和尿酸的氧化峰分离度高达320 mV,避免了两个氧化峰之间的叠加;建立了同时定量分析抗坏血酸和尿酸的检测体系。
(3)研究表明,MWNTs/Nafion/GCE在对弱碱性药物分子咖啡因、茶碱及弱酸性药物分子丹皮酚、抗坏血酸和尿酸的定量分析测定中,不仅可以提高它们的氧化峰电流,而且还降低了它们的氧化过电位;该复合薄膜修饰电极不仅适用于弱碱性药物分子的定量分析测定,还适用于弱酸性药物分子的定量分析测定,并且实现了体内弱酸性生物小分子抗坏血酸和尿酸的同时灵敏分析测定。
10.2 亚甲基蓝/MWNTs/Nafion复合薄膜修饰电极及其对多巴胺和尿酸的同时定量分析
碳纳米管具有优良的电子特性,例如,有大的比表面积,高效的催化活性,这表明当它们作为电极材料时,它们可以促进电荷转移,从而使反应顺利进行,以达到预期的目的。亚甲基蓝(Methylene Blue,MB)作为一种电活性共轭阳离子染料,在pH = 2~8的溶液中,其常规电位介于0.08~0.25 V(相对于饱和甘汞电极)之间,故它经常被用作氧化还原反应的指示剂。此外,由于MB的相对分子质量较小,使其与裸电极表面的结合相对较微弱,从而使吸附在裸电极表面的MB分子容易脱落,严重损失。为了克服这个问题,科学家们通过应用多种纳米材料,如纳米氧化亚铜、纳米二氧化硅和纳米二氧化钛等来负载MB作为复合纳米材料修饰剂来修饰电极,都取得了很好的效果。Yogeswaran等人报道了电化学氧化MB聚合于碳纳米管上,构建修饰电极,用该修饰电极实现了儿茶酚胺和AA的同时电分析测定。据文献调研,还没有有关通过MB吸附于多壁碳纳米管上制备得MB/MWNTs复合纳米材料,并以此复合纳米材料作为电极修饰剂制备MB/MWNTs修饰电极,在高浓度AA存在的条件下,同时伏安测定DA和UA的报道。
碳纳米管拥有大的π-π共轭键和高度疏水的表面,这种特殊的结构可以促使一些带有共轭π电子的有机化合物与碳纳米管通过π-π共轭键和疏水相互作用形成新的复合材料。Zhang等利用聚合物的吸附作用层层组装于碳纳米管上,制备了聚合物/碳纳米管复合薄膜修饰电极,实现了在AA存在下,对多巴胺的电分析测定。利用非共价吸附,电沉积等手段,一些类似三明治层状结构的复合薄膜也被用于纳米器件的设计。
本章节,通过MWNTs与MB间的π-π共轭键和疏水作用,制备了MB/MWNTs复合电活性纳米材料,利用该纳米复合材料作为电极修饰材料,制备了在AA存在下,同时伏安测定DA和UA的电化学传感器。MB/MWNTs复合薄膜修饰电极既有碳纳米管的高表面积,又显示出MB的较好的亲和力,有利于DA和UA与电极表面的充分接触。在MB/ MWNTs/Nafion复合薄膜修饰电极上,DA、UA和AA能很好的相互分离,在高浓度AA存在的情况下,能消除AA电化学氧化的干扰,表现出对DA和UA灵敏度较高,选择性较好的电分析定量测定。
10.2.2 MB/MWNTs/Nafion复合薄膜修饰电极及其对多巴胺和尿酸的同时定量分析
10.2.2.1 MB吸附于多壁碳纳米管上的证明
为了进一步确证MB/MWNTs纳米复合材料的形成,分别对MB、MWNTs、MB/MWNTs分散液做了紫外-可见光谱测定,测定结果如图10.9所示。MWNTs的分散水溶液(曲线b)紫外-可见光谱曲线在263 nm处有一个较强的吸收峰,自由的MB水溶液(曲线a)在294 nm和665 nm两处有较强的吸收峰,这是MB单体在水溶液中的两个特征吸收峰。曲线c是MB/MWNTs复合纳米材料水分散液的紫外-可见吸收曲线,该吸收曲线与MWNTs单独存在时的吸收曲线相似,然而,进一步细微观察可以发现,吸附了MB的MWNTs水溶液在690 nm处有一个较小的吸收峰,这个吸收峰即为MB分子通过吸附作用集聚到多壁碳纳米管上的特征吸收峰。
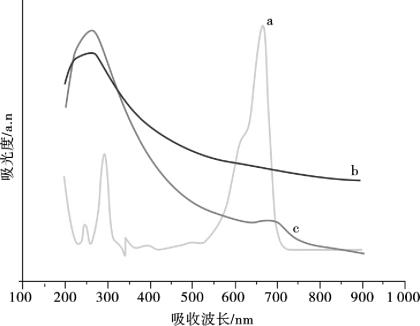
图10.9 MB(a),MWNTs (b),MB/MWNTs纳米复合物(c)水分散液的紫外-可见吸收光谱
图10.10是MWNTs (A,B)、MB/MWNTs (C,D)粉末样品在云母片上做的原子力显微镜表征图,从图10.10可以看出,MWNTs无序排列,相互缠绕呈网络状结构。MWNTs吸附了MB后,MWNTs的相互缠绕被打开了,呈单个分散的状态,另外,MWNTs明显被切断,剪裁为较短的MWNTs。单独MWNTs存在时,MWNTs的平均直径为38.05 nm; MWNTs吸附了MB之后,测得MWNTs的平均直径为62.03 nm,几乎为MWNTs单独存在时,其直径的2倍,这也可以进一步证明,MWNTs已经被MB通过π-π共轭键和疏水作用包裹起来,形成胶囊形状的管状复合物。此外,试验还发现,单独的MWNTs很难均匀地分散在水溶液中,但MB/MWNTs复合物很容易均匀分散于水溶液中,形成黑色的悬浮液,这又进一步表明,MB包裹于MWNTs上。

图10.10 MWNTs (A,B),MB/MWNTs (C,D)粉末在云母片上的原子力显微镜表征图
图10.11是在纯0.1 mol/L磷酸盐缓冲液中(pH = 3.0),MWNTs/Nafion/GCE(曲线a)和MB/MWNTs/Nafion/GCE (曲线b)循环伏安图。在-400~600 mV之间,MWNTs/ Nafion/GCE没有显示任何的氧化还原峰;而当MB/MWNTs/Nafion/GCE插入缓冲底液中,进行伏安扫描时,在95 mV和27 mV处有一对明显的氧化还原峰,这也说明,电活性的MB吸附在了MWNTs上,形成了电化学功能化纳米结构。
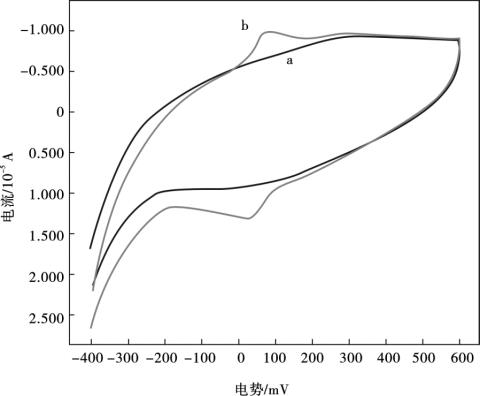
图10.11 MWNTs/Nafion/GCE (a),MB/MWNTs/Nafion/GCE (b)在纯0.1 mol/L磷酸盐缓冲液中(pH = 3.0)的循环伏安图
图10.12是在0.1 mol/L KCl和1.0 mmol/L Fe(CN)63-/4-溶液中,裸GCE(A),MB/ MWNTs/Nafion/GCE (B-a),MWNTs/Nafion/GCE (B-b)的电化学交流阻抗图谱。裸GCE的Nyquist点在较低的频率有一个微弱的较小的半圆,在较高的频率为一直线,这与电化学反应过程的扩散控制步骤特征相似。然而,MWNTs/Nafion/GCE Nyquist点在高频区表现出明显较大的半圆形,这与电子转移受限制过程一致;在低频区的线性特征归咎于电子转移受扩散控制。与MWNTs/Nafion/GCE比较,MB吸附于MWNTs之后制备的MB/ MWNTs/Nafion/GCE在高频区的半圆现象明显减弱,几乎成一直线,这也说明,MB/ MWNTs/Nafion/GCE更能促进电子的转移。因为MB/MWNTs薄膜中的MB分子带正电荷,所以带负电荷的Fe(CN)63-/4-能够更迅速地到达电极表面进行电子传输。不同电极的交流阻抗图谱的变化也解释了MB已经吸附于MWNTs表面。
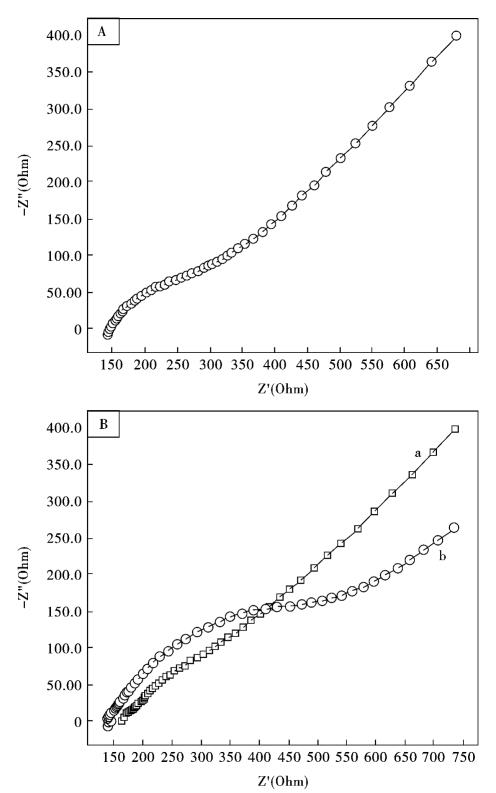
图10.12 A:裸GCE的电化学交流阻抗图; B: MB/MWNTs/Nafion/GCE (a)和MWNTs/Nafion/GCE (b)的电化学交流阻抗图;测定条件:频率范围: 100 kHz~1 Hz;信号幅度: 5 mV;测定液: 1.0 mmol/L Fe(CN)63-/4-和0.1 mol/L KCl.
10.2.2.2 MB/MWNTs/Nafion/GCE的表征
扫描电镜可以有效地证明该修饰电极的表面形貌,如图10.13显示用扫描电镜获得的MB/MWNTs/Nafion的形貌表征。该图显然表明了MB/MWNTs/Nafion复合膜能够均匀地涂在电极表面,形成一个网络状结构,特殊的表面形貌明显比表观面积提供了更大的实际面积。

图10.13 MB/MWNTs/Nafion复合膜在玻碳电极上扫描电镜图
10.2.2.3 多巴胺和尿酸在MB/MWNTs/Nafion/GCE上的电化学响应
图10.14A为在MWNTs/Nafion/ MB/GCE上,3.0×10-4mol/L DA和6.0× 10-4mol/L UA (a),3.0×10-4mol/L DA (b),6.0×10-4mol/L UA (c)和纯0.1 mol/L磷酸盐缓冲底液中(pH =3.0) (d)循环伏安图。从图10.14A-a可以看出,在电位429 mV和603 mV有两个分别属于DA和UA的氧化峰,两个氧化峰的分离度达到174 mV,这种足够宽的电位分离度能够为DA和UA的同时电化学分离测定提供了根据。图10.14B为在0.1 mol/L磷酸盐缓冲底液中(pH =3.0),3.0×10-4mol/L DA和6.0 ×10-4mol/L UA混合物分别在MB/MWNTs/Nafion/GCE (a),MWNTs/Nafion/GCE (b),裸GCE (c)和MB/GCE (d)上的循环伏安图。在相同的测定条件下,裸GCE上,DA和UA显示出两个微弱的氧化峰;在MB/GCE上,DA和UA的氧化峰相互叠加,峰宽范围为450~630 mV,两个混合氧化峰的峰电位在530 mV;在MWNTs/Nafion/GCE上,DA和UA的氧化峰较明显,且它们的氧化峰分离度达144 mV;与MWNTs/Nafion/GCE对比,在MB/MWNTs/Nafion/GCE上,DA的氧化还原峰电流显著增大,且其氧化峰电位负移30 mV,这种现象表明,MB在MB/MWNTs/Nafion/GCE上可以作为电催化氧化DA的有效电子媒介体;另外,MWNTs能有效地提高电子转移速率,促使更多的DA富集参与电化学反应;在MB/MWNTs/Nafion/GCE上,DA的氧化峰电位(Epa)和还原峰电位(Epc)分别在429 mV和336 mV,峰电位差ΔE = 93 mV,且它们的峰电流比(ipa/ipc)约为1,说明DA的电化学氧化还原反应为可逆的。(www.daowen.com)
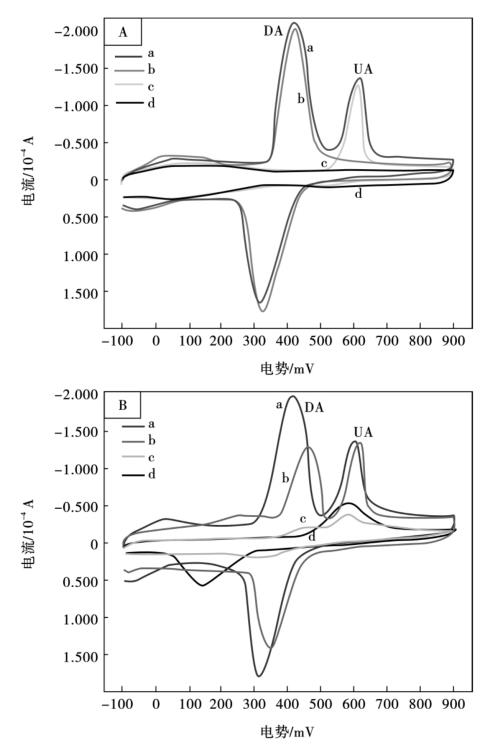
图10.14A:在MB/MWNTs/Nafion/ GCE上,3.0×10-4mol/L DA和6.0×10-4mol/L UA (a),3×10-4mol/L DA (b),6×10-4 mol/L UA (c)和纯0.1 mol/L磷酸盐缓冲液中(pH = 3.0) (d)的循环伏安图; B: 3.0×10-4mol/L DA和6.0×10-4mol/L UA混合物在0.1 mol/L磷酸盐缓冲液中(pH 3.0),分别在MB/ MWNTs/Nafion/GCE (a),MWNTs/Nafion/GCE (b),bare GCE (c),和MB/Nafion/GCE (d)循环伏安图;扫描速率80 mV/s
10.2.2.4 扫描速率对DA和UA的电化学响应的影响
在0.1 mol/L磷酸盐(pH =3.0)支持电解质溶液中,研究了3.0×10-4mol/L DA和6.0×10-4mol/L UA在不同扫描速率时对其峰电流,峰电位的影响。当扫描速率v从40 mV/s逐渐增加到300 mV/s时,DA和UA的氧化峰电位都随着扫描速率的增加而正移,并且DA氧化峰电流与扫描速率(v)成正比,表明DA在该修饰电极表面的电化学氧化受吸附控制。UA的氧化峰电流与扫描速率的平方根(v1/2)成正比,这也说明在MB/ MWNTs/Nafion/GCE上,UA在该电极表面的电化学氧化受扩散控制。
10.2.2.5 不同pH值对DA和UA的电化学响应的影响
缓冲溶液的pH值对丹皮酚的电化学响应有重要的影响,因此本研究考察了丹皮酚在不同pH值的0.1 mol/L的磷酸盐缓冲液中的伏安行为。试验结果表明,0.1 mol/L的磷酸盐缓冲液的pH值在从pH =3.0逐渐增大到pH =8.0时,多巴胺和尿酸的阳极峰电位逐渐地向负电位方向移动。当pH = 3.0时,多巴胺和尿酸的峰电流达到最大值,此时它们的阳极峰也达到最大程度的分离,所以选择pH = 3.0作为多巴胺和尿酸同时测定缓冲液的最佳值。
10.2.2.6 差示脉冲阳极溶出伏安法参数的选择
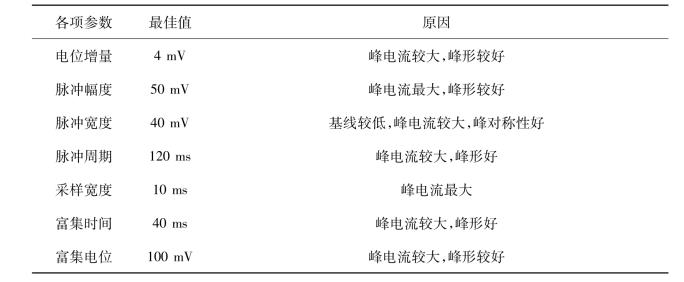
由于差示脉冲阳极溶出伏安法(DPASV)比较灵敏,使用其同时测定多巴胺和尿酸时,分别考察了它的各项参数,确定最佳测定条件,数据如表10.9所示。
表10.9 差示脉冲阳极溶出伏安法的最佳优化条件
10.2.2.7 干扰研究
为了评价MB/MWNTs/Nafion/GCE电极的选择性,在0.1 mol/L磷酸盐缓冲液中(pH =3.0),当溶液中存在6.0×10-4mol/LUA时,本研究考察一些可能共存的干扰物质对浓度为3.0×10-4mol/L多巴胺氧化峰电流的影响。试验结果表明,依照对DA峰电流影响的相对误差<±10%,测定以下物质:氯化钾、氯化镁、葡萄糖、甘氨酸和氯化钙(100倍),氯化铜(5倍)时对测定体系几乎没有干扰。
抗坏血酸、多巴胺和尿酸在生物体中同时存在,因此如何消除抗坏血酸干扰,对同时测定多巴胺和尿酸很重要。抗坏血酸的氧化峰电位与多巴胺和尿酸的氧化峰电位非常接近,因此,在实际样品中,常规的电极对多巴胺或尿酸的选择性测定就受到了很大程度的限制,因此,研制更灵敏,选择性更好,更简便的方法,用于抗坏血酸、多巴胺和尿酸的同时分离和测定是有必要的。如图10.15所示,DPASV测得以下溶液3.0×10-4mol/L多巴胺和6.0×10-4mol/L尿酸混合溶液(a),1.0×10-3mol/L抗坏血酸,3.0×10-4 mol/L多巴胺和6.0×10-4mol/L尿酸三者的混合溶液(b),3.0×10-3mol/L抗坏血酸(c),1.0×10-3mol/L抗坏血酸(d)和0.1 mol/L pH = 3.0的多磷酸缓冲液(e)的伏安曲线。图10.15c显示,抗坏血酸的阳极峰在200 mV附近出现,而多巴胺的阳极峰在419 mV附近,故抗坏血酸与多巴胺的分离电位大约是219 mV,这表明有足够宽的分离电位以消除抗坏血酸的干扰,即在抗坏血酸、多巴胺和尿酸三者的混合溶液中,能排除抗坏血酸的干扰,以实现对多巴胺和尿酸的同时电化学测定。
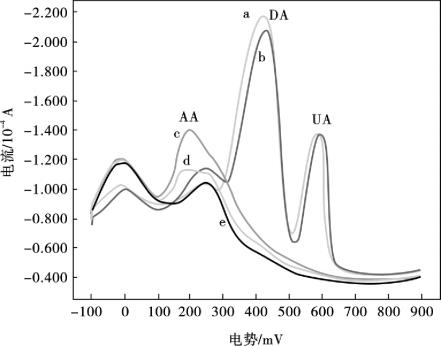
图10.15 在MB/MWNTs/Nafion/GCE上,3.0×10-4mol/L多巴胺和6.0×10-4mol/L尿酸混合溶液(a),1.0×10-3mol/ L抗坏血酸,3.0×10-4mol/L多巴胺和6.0×10-4mol/ L尿酸混合溶液(b),3.0×10-3mol/L抗坏血酸(c),1.0×10-3mol/L抗坏血酸(d)和0.1 mol/L pH =3.0的多磷酸缓冲液(e)的DPASV图
10.2.2.8 标准曲线的建立
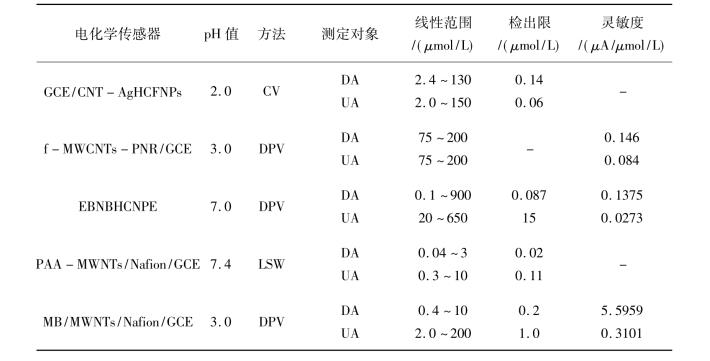
本实验采用DPASV同时测定多巴胺和尿酸。在1.0×10-3mol/L抗坏血酸存在条件下,用MB/MWNTs/Nafion/GCE同时测定多巴胺和尿酸的混合液,首先固定一种物质的浓度,去测定另一种物质的浓度。当混合溶液中含有10.0 μmol/L尿酸和1.0× 10-3mol/L抗坏血酸时,测定不同浓度的多巴胺在MB/MWNTs/Nafion/GCE上的曲线。试验结果表明,在0.4~10.0 μmol/L浓度范围内,多巴胺的阳极峰电流与多巴胺的浓度呈线性关系,其线性方程为: iDA/μA = 5.595 9CDA/μmol/L + 1.653 1(r = 0.997 2),最低检出限为2.0×10-7mol/L。当固定多巴胺的浓度为2.0 μmol/L和抗坏血酸的浓度是1.0×10-3mol/L时,测定不同浓度时尿酸的伏安曲线,在2.0~20.0 μmol/L和20.0 ~200.0 μmol/L范围内,尿酸的阳极峰电流与尿酸的浓度呈线性关系,2.0~20.0 μmol/L浓度范围的线性回归方程为iUA/μA = 0.582 7CUA/μmol/L + 1.719 1 (r = 0.996 2),对于20.0~200.0 μmol/L浓度范围的线性回归方程为iUA/μA = 0.310 1 CUA/μmol/L + 9.466 2 (r = 0.997 2),最低检出线为1.0 μmol/L。对比文献报道的基于MWNTs的电化学传感器,与本论文构建的MB/MWNTs/Nafion/GCE在同时电分析测定DA和UA的测定参数列于表10.10。从表10.10可以看出,本论文采用的电化学传感器制备简单,所建立的同时电分析测定DA和UA的方法具有较高的灵敏度、宽的线性范围和较低的检出限。
表10.10 基于MWNTs的电化学传感器用于同时电分析测定DA和UA的测定参数对比
可重复性是该修饰电极的重要性质,这尤其是分析测定方面应该研究的问题。实验过程中,用同一支MB/MWNTs/Nafion/GCE对同一浓度的溶液连续测定5次,结果为:对3.0×10-4mol/L多巴胺,其峰电流的相对标准偏差是3.5%,对6.0×10-4mol/L尿酸,其峰电流的相对标准偏差是3.0%,此结果表明此修饰电极具有良好的重现性。
10.2.2.9 实际样品分析
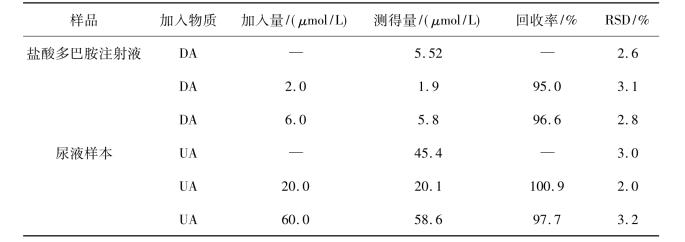
为了符合本研究所建立方法的线性范围,尿液样本和盐酸多巴胺注射液用支持电解溶液准确的稀释,稀释的过程可以减少实际样品基质的干扰,测定结果列于表10.11中。盐酸多巴胺注射液中多巴胺的总含量是10.48 mg/mL,这是有测定值乘以稀释因子而得到的结果,这个结果与样品的标示量10.0 mg/mL基本一致。尿样中测定的UA的浓度为3.54×10-3mol/L,这也在健康人尿酸含量范围。利用加标回收试验来进一步确证本研究所建立方法的准确性和可重复性。对尿样和盐酸多巴胺注射液样本溶液分别进行加标回收测定,结果如表10.11所示。从表10.11可知,本研究所建立的方法对药物药品和生物样品中DA和UA的测试都具有较高的灵敏度和选择性。
表10.11 在1.0×10-3mol/L抗坏血酸存在时实际样品中的多巴胺和尿酸测定结果(n = 5)
10.2.3 小结
本章节用MB/MWNTs/Nafion/GCE修饰电极研究了多巴胺和尿酸电化学行为。MB/MWNTs/Nafion/GCE能促使DA和UA发生电化学氧化;此外,该修饰电极在对多巴胺和尿酸的混合液进行电分析测定时表现出了较高的选择性,它们两者的氧化峰相差174 mV,这表明用MB/MWNTs/Nafion/GCE能够实现对多巴胺和尿酸同时电分析测定;而且,共存物质抗坏血酸对多巴胺和尿酸的同时测定几乎没有干扰,该方法被应用到实际样品中多巴胺和尿酸电分析定量测定。
10.3 铁氰化钇纳米颗粒/MWNTs/Nafion复合薄膜修饰电极的制备及其对L-半胱氨酸的定量分析研究
10.3.1 概述
L-半胱氨酸(L-Cysteine,L-CySH)是一个重要含硫元素的氨基酸分子。它普遍存在于各种药品、食品以及生物组织中,例如半胱氨酸蛋白酶、后叶加压素和抗利尿激素。L-半胱氨酸在生物系统中发挥着重要的作用,如在蛋白折叠与未折叠的空间变形中的重要作用。日常饮食摄入L-半胱氨酸不足可能导致大量的临床病况,例如,肝脏损伤、皮肤损害、发育缓慢。因此,灵敏地检测L-半胱氨酸具有重要的临床意义。由于L-半胱氨酸在生物体系中的重要功能和临床意义,一些传统的分析方法已经建立起来用来定量分析L-半胱氨酸,如光谱检测方法和高效液相色谱法。然而,其中的一些分析方法,如色谱分析方法耗时长、价格高,而且需要复杂的混合溶剂提取以及训练有素的技术人员;相反,电化学方法具有操作简单、灵敏度高、稳定性好、仪器成本低、规模小和便于现场监测等优点。虽然L-半胱氨酸是一种电活性化合物,利用电分析方法测定仍然有一些缺陷,如过电位高、灵敏度低及在常规的电极上电子传递缓慢,这些缺陷会导致在电极表面形成氧化物而污染电极表面。为了克服这些障碍,无数的技术手段已经发展起来,包括通过利用纳米材料修饰电极、基于生物酶的传感器和化学修饰电极进行电分析的方法。虽然这些改进电极已经大大提高了对L-半胱氨酸的电分析测定,但仍有一些挑战性的问题,如较低的灵敏度、较高的电极制备的复杂性和较低的抗干扰能力等,这些不利因素对于电分析测定L-半胱氨酸有很大的影响。因此,很有必要发展灵感度更高、选择性更好、更简单的方法去实现对L-半胱氨酸的定量分析测定。
金属铁氰化物是一种多核混合价态化合物。自Neff和Itaya等在普鲁士蓝修饰电极方面的开创性研究以来,金属铁氰化物已经引起了人们的高度重视。由于其广泛的应用,特别是过渡金属铁氰化物,由于其吸引人的特性得到了科研工作者越来越多的重视。例如,普鲁士蓝、锡,镍、铜、镧、铽、铈和银等的铁氰化物作为传感器修饰材料已被报道。据我们所知,目前还没有有关制备和应用铁氰化钇纳米颗粒作为电极修饰剂来实现对L-半胱氨酸电分析定量测定的报道。
本章节中,我们成功地制备了铁氰化钇纳米颗粒(yttrium hexacyanoferrate nanoparticle,YHCFNP),用0.1%(w/w) Nafion甲醇溶液作为分散剂,制备了铁氰化钇/功能化多壁碳纳米管/Nafion纳米混合物均匀悬浮液,以此悬浮液为修饰剂,制备了铁氰化钇/功能化多壁碳纳米管/Nafion纳米复合薄膜修饰玻碳电极(YHCFNP/MWNTs/Nafion/GCE),利用该修饰电极,采用循环伏安法和计时电流法实现了对L-半胱氨酸的电分析定量测定。试验结果显示,YHCFNP/MWNTs/Nafion/GCE能显著地提高L-半胱氨酸的阳极峰电流,能促使其发生电化学氧化反应。于0.1 mol/L磷酸盐缓冲溶液中(pH = 6.82),在YHCFNP/MWNTs/Nafion/GCE上,对L-半胱氨酸的电化学行为进行了详细的研究。此外,与文献所报道的电化学传感器相比,YHCFNP/MWNTs/Nafion/GCE表现出良好的性能,如制备简单、反应快速、灵敏度高、线性范围宽等优点。
10.3.2 YHCFNP/MWNTs/Nafion/GCE对L-半胱氨酸的定量分析研究
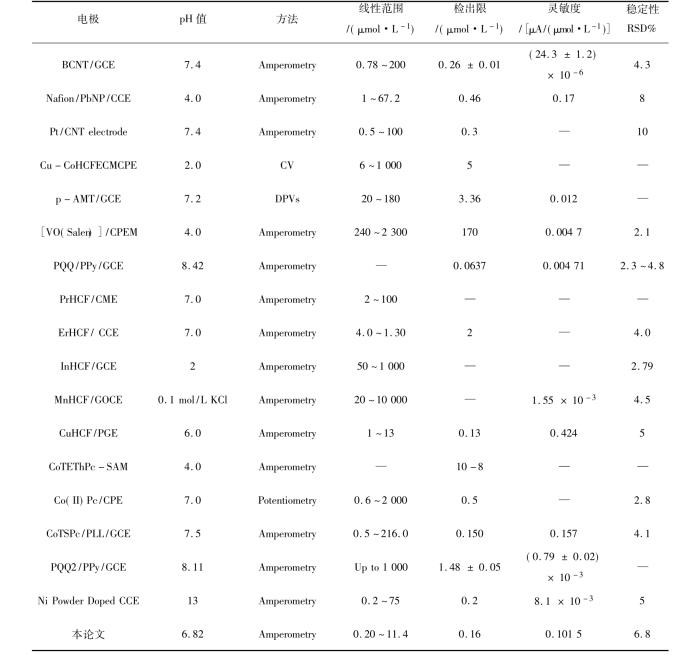
10.3.2.1 YHCFNP的表征
为了确证YHCFNP的形成及组成,分别用傅里叶变换红外光谱、扫描电子显微镜(SEM)和能量色散谱(energy dispersive spectrometry,EDS)对生成的YHCF进行了表征。
图10.16显示了YHCFNPs样品的特征FTIR光谱。根据文献报道分析在3 322 cm-1附近的宽吸收峰和在3 585 cm-1附近的尖锐吸收峰表明了在YHCF结构中存在两种类型的水分子:一种是YHCF结构空隙间的水分子,另一种是与Y结合的水分子。在2 078 cm-1处较强的和尖锐的吸收峰为金属铁氰化物的典型特征吸收峰,是YHCF结构中C≡N基团的伸缩振动吸收峰;位于1 647和1 595 cm-1吸收峰为YHCF结构中H—O—H弯曲模型中键振动的吸收峰;位于471 cm-1和602 cm-1的金属-碳键吸收峰分别属于δFe-C≡N和δFe-C振动的吸收峰。
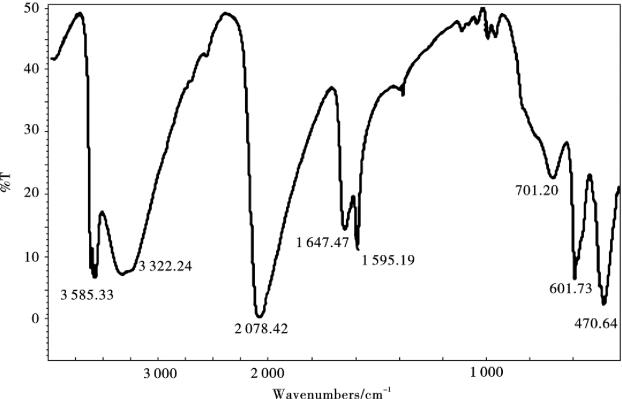
图10.16 YHCF的傅里叶变换红外光谱
YHCFNPs样品的EDS元素分析分析结果显示,K,Fe,Y的原子比为: 1∶1.51∶1.78
扫描电子显微镜(SEM)能有效地表征颗粒的形貌特征。图10.17分别为YHCFNPs (A)和YHCFNPs/MWNTs (B)的SEM表征图谱。由于光散射的作用,YHCFNPs显示为乳白色的纳米颗粒。YHCFNPs的直径不太均匀,最大颗粒的直径约为300 nm,最小颗粒的直径约为100 nm;取20个YHCFNPs计算其平均直径约为140 nm。从图10.17B可以看出,YHCFNPs和MWNTs可以均匀分散相互混合,并且MWNTs对YHCFNPs起到缠绕和巩固作用,使YHCFNPs不容易从电极表面脱落。

图10.17 YHCFNPs (A)和YHCFNPs/MWNTs (B)的SEM表征
10.3.2.2 YHCFNP/MWNTs/Nafion/GCE的电化学特征
YHCFNP/MWNTs/Nafion/GCE在0.1 mol/L PBS缓冲溶液中(pH = 6.82)不同扫描速率下,表现出良好的电化学响应,其显示出一对峰型较好的氧化还原峰,在扫描速率为20 mV/s时,YHCFNP的表观峰电位为+ 201 mV,这个表观电位值与其他所报道的稀土金属铁氰化物的非常相近。扫描速率在10~100 mV/s范围内,YHCFNP的氧化还原峰峰电位差(ΔEp)变化稍微于扫描速率有关。随着扫描速率的增加,YHCFNP的氧化还原峰分离度增加,表明电子转移动力学参数逐渐变慢。根据Sheng等人的报道,稀土金属铁氰化物对应的氧化还原峰为FeⅡ/FeⅢ的电化学氧化还原峰。据我们所知,一个电子的转移总是同时伴随着相对阳离子的运动,如Na+、K+、Li+等的运动,以维持金属铁氰化物在发生电化学反应的过程中的电荷平衡。Rutkowska研究小组和Kulesza研究小组采用石英晶体微天平技术通过分别研究铁氰化钴和铁氰化铀酰,证实了铁氰化物在发生电化学还原的时候,对阳离子可以插入铁氰化物的薄膜;而当铁氰化物发生电化学氧化反应的时候,铁氰化物薄膜又可以将对阳离子排除铁氰化物薄膜。所得的循环伏安图的不同形状与水合Na+的尺寸无关,虽然在水溶液中阳离子Na+一直都以水合离子形式存在;然而,对阳离子(Na+)必须经过部分脱水,因为对阳离子必须拥有适当的尺寸才能进入晶格去包围中心Fe离子与其电荷配对达到电荷平衡;所以铁氰化钇的电化学特征不仅仅依赖于Na+的浓度,也与包围中心Fe离子与其电荷配对的Na+数目有关。在电化学氧化还原的过程中,在YHCFNP晶格通道发生电荷转移的Na+数目可能控制整个电化学反应过程。
YHCFNP的氧化还原峰电流与扫描速率的平方根(v1/2)成正比,表明其电荷转移主要受扩散控制。
10.3.2.3 L-半胱氨酸在YHCFNP/MWNTs/Nafion/GCE上的电化学响应
图10.18所示为在扫描速率为20 mV/s时,不同的电极于0.1 mol/L磷酸盐缓冲溶液中(pH =6.82),分别在存在与不存在0.5 mmol/L L-半胱氨酸的情况下的循环伏安图。图10.18A显示,在0.1 mol/L纯磷酸盐缓冲溶液中(pH = 6.82),分别在250 mV和152 mV处,YHCFNP/MWNT/Nafion/GCE拥有一对峰型较好的氧化还原峰,为FeII/FeIII的电化学氧化还原峰;而在同一条件下,MWNT/Nafion/GCE和裸GCE没有任何的氧化还原峰。
图10.18B试验图谱为在0.1 mol/L磷酸盐缓冲溶液中(pH =6.82),0.5 mmol/L L-半胱氨酸在不同电极上的循环伏安图。裸GCE上,L-半胱氨酸显示出来一个较弱的氧化峰,这可能是由于L-半胱氨酸电化学氧化产物在电极表面的沉积而造成的电极表面的污染,导致L-半胱氨酸在电极表面产生较慢的电化学反应。在MWNTs/GCE上,L-半胱氨酸产生一个峰型较好的氧化峰,并且其峰电流明显大于其在GCE上氧化峰的峰电流,这可能是因为L-半胱氨酸分子可以更好地与MWNTs接触相互作用,也说明MWNTs 对L-半胱氨酸的电化学氧化具有很好的催化作用;在许多情况下,碳纳米管的末端或沿着管轴的槽刨位点或缺陷会对分析物质产生催化效应,但也有报道揭示出,在制备碳纳米管的过程中,残留在碳纳米管中的金属杂质也能对某些分析物产生催化效应。由于Nafion对MWNTs具有极好的均匀分散能力,L-半胱氨酸在MWNTs/Nafion/GCE上产生一个较强的氧化峰;而在YHCFNP/GCE上,L-半胱氨酸也发生电化学氧化,有一个峰型较好的氧化峰,峰电流都明显高于在GCE上的峰电流,表明YHCFNP可以促使L-半胱氨酸发生电化学氧化;另外,在YHCFNP/MWNTs/Nafion/GCE上,L-半胱氨酸的氧化峰电流比在MWNTs/GCE和YHCFNP/GCE上的峰电流都要高,其峰电位在570 mV,对比于在MWNTs/Nafion/GCE上的峰电位(642 mV),负移了72 mV,这种试验结果表明,由于高分散的YHCFNP/MWNTs纳米复合颗粒高的表面积和好的电子转移特征,YHCFNP/ MWNTs/Nafion/GCE可以显著地促使L-半胱氨酸发生电化学氧化。
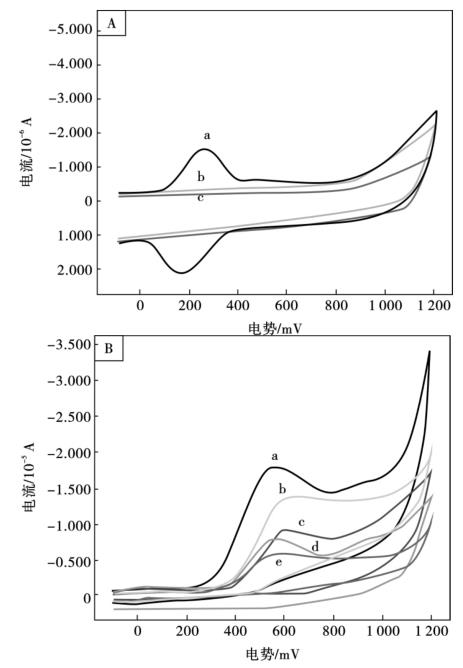
图10.18 A:在0.1 mol/L纯磷酸盐缓冲溶液中(pH 6.82),不同电极的循环伏安图: YHCFNP/MWNTs/Nafion/GCE (a),MWNTs/Nafion/GCE (b)和GCE (c) ; B:在0.1 mol/L磷酸盐缓冲溶液中(pH 6.82),0.5 mmol/L L-半胱氨酸在不同电极上的循环伏安图: YHCFNP/MWNTs/Nafion/ GCE (a),MWNTs/Nafion/GCE (b),MWNTs/GCE (c),YHCFNP/GCE (d),和GCE (e) ;扫描速率20 mV/s
10.3.2.4 扫描速率对L-半胱氨酸电化学响应的影响
在0.1 mol/L磷酸盐缓冲液中,1.0 mmol/L L-半胱氨酸在YHCFNP/MWNTs/Nafion/GCE上,不同扫描速率时的试验结果显示,在20~400 mV/s扫描速率范围内,L-半胱氨酸的氧化峰电流与扫描速率的平方根(v1/2)具有良好的线性关系,表明L-半胱氨酸的电化学氧化过程受扩散控制。L-半胱氨酸的氧化峰电位随着扫描速率的增加,逐渐向正电位方向移动,且与log v具有良好的线性关系,其线性方程为: Ep/V = 0.401 6 + 0.128 8 log v。对于一个不可逆的电化学氧化过程,氧化峰电位(Ep)与扫描速率具有如下关系:
![]()
式中,A为常数,α为电子转移系数,n电子转移数,R,T,F代表它们通常的意义;根据Ep -log v线性方程的斜率0.128 8,计算得α= 0.76,此α值比文献报道的Pt/石墨修饰电极上的α(0.8)较低,但是与Pt/CNT上的α(0.74)接近,此试验结果显示,L-半胱氨酸在YHCFNP/MWNTs/Nafion/GCE上比在Pt/石墨修饰电极上更易于发生电化学氧化,但与在Pt/CNT修饰电极上发生电化学反应的难易程度相近。
10.3.2.5 不同pH值对L-半胱氨酸电化学响应的影响
Ralph已经提出了L-半胱氨酸(L-CySH)在固体电极上的电化学氧化反应机制,过程如下:
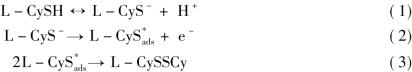
L-半胱氨酸的电化学氧化过程伴随着质子和电子的转移,溶液的pH值很可能影响着L-半胱氨酸的电化学氧化行为。因此,需要研究pH值对L-半胱氨酸的氧化峰电流和峰电位的影响。试验结果表明,在pH值小于4.0时L-半胱氨酸有一个弱的氧化峰,并且在pH值范围为2.0~4.0,它的氧化峰电流和峰电位无明显变化;随着pH值在6.0 ~10.0范围增大,L-半胱氨酸的氧化峰电位向负方向移动,在pH =7.0时,其峰电流达到最大值。考虑到YHCFNPs在酸性环境的稳定性及人体生理环境,选择pH =6.82作为研究L-半胱氨酸电化学氧化的最佳pH值。
10.3.2.6 干扰研究
如下15个氨基酸,如氨基乙酸、亮氨酸、丝氨酸、苏氨酸、酪氨酸、色氨酸、天冬氨酸、谷氨酸、赖氨酸、精氨酸、苯基丙氨酸、组氨酸、胱氨酸、N-乙酰-L-半胱氨酸和脯氨酸等与L-半胱氨酸共存于生物体系中,本章主要考察了这15种氨基酸对L-半胱氨酸的电分析测定的影响。试验结果显示,除了组氨酸、胱氨酸、酪氨酸和色氨酸,其他的一些氨基酸在-200~1 300 mV没有氧化还原峰,也没有观测到它们对L-半胱氨酸电分析测定的干扰现象。在YHCFNP/MWNTs/Nafion/GCE上,组氨酸和胱氨酸分别在1 200 mV和1 250 mV处显示出一个微弱的氧化峰,而L-半胱氨酸的氧化峰在570 mV,这足够宽的峰电位分离使组氨酸和胱氨酸的电化学氧化并不对电分析L-半胱氨酸产生干扰。色氨酸和酪氨酸在YHCFNP/MWNTs/Na-fion/GCE上分别在690 mV及666 mV处发生电化学氧化,此两个氨基酸的氧化峰电位非常接近于L-半胱氨酸的氧化峰电位(570 mV)。为了进一步确证色氨酸和酪氨酸对L-半胱氨酸电分析测定的干扰影响,利用计时电流法,考察了固定不同电解电位时色氨酸和酪氨酸对L-半胱氨酸电流测定的影响,试验结果如图10.19所示。从图10.19A曲线可以看出,固定电解电位670 mV,分别加入1.0 mmol/L色氨酸(曲线b)和酪氨酸(曲线c),对0.1 mmol/L L-半胱氨酸的峰电流有较大的干扰影响。然而,当固定电解电位为400 mV (图10.19C)或550 mV (图10.19B),分别加入1.0 mmol/L色氨酸和酪氨酸,对0.1 mmol/L L-半胱氨酸的电流测定几乎没有影响(曲线a),表明固定L-半胱氨酸的电解电位,可以消除色氨酸及酪氨酸的干扰。为了增强L-半胱氨酸的氧化峰电流和降低干扰,550 mV选作定量分析测定L-半胱氨酸的固定电解电位。另外,对生物体系中可能存在的其他干扰物质如葡萄糖、尿酸和抗坏血酸进行了考察,试验结果表明,只有尿酸对L-半胱氨酸的电流测定有较严重的影响,其他物质几乎没有干扰。
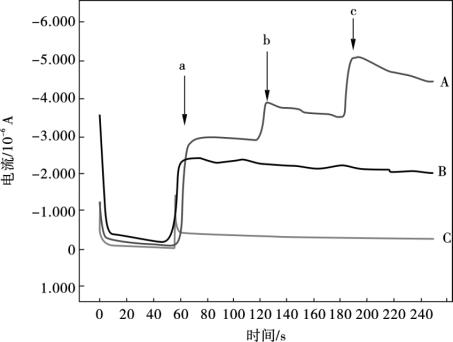
图10.19 在0.1mol/L磷酸盐缓冲液中(pH = 6.82),YHCFNP/MWNTs/Nafion/
GCE上分别固定不同的电解电位670 mV (A),550 mV (B)和400 mV (C)时,分别加入(箭头表示) 0.1 mmol/L L-半胱氨酸(a),1.0 mmol/L色氨酸(b)和1.0 mmol/L酪氨酸(c)的电流-时间曲线
10.3.2.7 标准曲线的建立
采用循环伏安法对不同浓度的L-半胱氨酸进行了灵敏测定,试验结果显示,L-半胱氨酸在1.00×10-5~2.00×10-3mol/L浓度范围内,与其氧化峰电流呈良好的线性关系,其线性方程为: ip/μA = 1.638 2 C/10-4mol/L + 0.907 3 (r = 0.998 2),最低检出限为8.00×10-6mol/L。因此,根据此线性关系下,很容易检测L-半胱氨酸的含量。
因为在搅拌的情况下,计时电流法比循环伏安法有更高的灵敏度,所以在YHCFNP/ MWNTs/Nafion/GCE上,采用计时电流法用于测量L-半胱氨酸的较低检出限。在YHCFNP/MWNTs/Nafion/GCE上,固定电解电位为550 mV,在缓和的匀速搅拌下,于10 mL 0.1mol/L磷酸盐缓冲液中连续加入一定量的L-半胱氨酸。电极对L-半胱氨酸基质的响应速度非常快,响应时间为4 s。L-半胱氨酸的浓度(0.20~11.4 μmol/L)与其电流的线性方程为ip/10-7A = 0.101 5C/10-7mol/L + 1.378 8 (r = 0.998 0),最低检出限为0.16 μmol/L。本论文所构建的YHCFNP/MWNTs/Nafion/GCE传感器与文献所报道的电分析测定L-半胱氨酸传感器的各种测定参数的对比列于表10.12,由表10.12可知,本论文所构建的传感器对L-半胱氨酸的定量分析测定具有较低的检出限和较高的灵敏度。
稳定性和重现性是修饰电极的两个重要特征。同一支YHCFNP/MWNTs/Nafion/ GCE对0.5 μmol/L L-半胱氨酸连续测量6次,每次测量后,该电极在0.1 mol/L磷酸盐缓冲液(pH =6.82)中,在100~900 mV之间循环扫描6周使其再生。6次测量的L-半胱氨酸阳极峰电流的相对标准偏差为6.8%,表明了修饰电极具有良好的稳定性和重现性。
表10.12 不同的传感器测定L-半胱氨酸的各种测定参数的对比
10.3.3 小结
本章节构建了一种新的YHCFNP/MWNTs/Nafion修饰电极,并且在0.1 mol/L磷酸盐缓冲液中(pH =6.82),该修饰电极对L-半胱氨酸电化学氧化具有较好的催化作用。在最佳测定条件下,L-半胱氨酸的阳极峰电流与其浓度在0.20~11.4 μmol/L范围内具有良好的线性关系,最低检出限为0.16 μmol/L。一些共存的可发生电化学氧化的物质如抗坏血酸、酪氨酸、色氨酸等均可以成功地避免对L-半胱氨酸测量的干扰。
10.4 金纳米颗粒/MWNTs/Nafion复合薄膜修饰电极的制备及其对多巴胺的定量分析研究
10.4.1 概述
多巴胺(DA)是一种重要的神经传递素,在中枢神经系统、肾脏及荷尔蒙生理系统等方面都具有重要的功能。因为多巴胺具有良好的电化学活性,在电分析领域,多巴胺的电化学分析测定引起了越来越多的关注。然而,在生物液体中,抗坏血酸(AA)及尿酸(UA)总是与多巴胺共存,并且AA与UA也是电活性物质,它们的氧化峰电位几乎与DA氧化峰电位重叠,因此,如何消除共存物质AA与UA的干扰,实现对DA的较高的选择性定量分析测定是一个科研难题。为了解决这个科研难题,已经发展了各种各样的电极修饰材料修饰在电极表面以提高电分析测定DA的选择性,这些材料包括金属纳米粒子,具有氧化还原活性的有机物,聚合物薄膜,以碳为基础的材料,离子液体,生物材料等。在电化学领域,虽然致力于高选择性、经济性、省时性的各种各样的修饰电极用于测定DA已经被报道,但是,采用绿色、简单的方法制备更新颖的电极修饰材料以用来更灵敏地测定DA仍具有较大的吸引力。
近年来,由于纳米尺寸材料的特殊物理和化学性质,其在电分析方面应用获得了广泛的关注,而金纳米粒子(Au nanopaticle,AuNP)是较常用的一种贵金属纳米材料。本章节通过分子水平的设计,采用一种新颖、绿色、简单的制备方法,制备了纳米金功能化多壁碳纳米管纳米复合材料。采用扫描电子显微镜和能量发射光谱对该新材料进行了表征。用纳米金功能化碳纳米管作电极修饰剂对DA的电化学行为进行了研究,试验发现,该修饰电极不仅能明显增大DA的氧化峰电流并能降低DA的氧化峰电位。DA的氧化峰电流与其浓度在0.06~8 μmol/L范围呈线性关系,最低检出限为0.04 μmol/L。
10.4.2 AuNP/MWNTs/Nafion/GCE对多巴胺的定量分析研究
10.4.2.1 AuNP/MWNTs纳米复合物的表征
图10.20A是AuNP/MWNTs纳米复合物SEM表征图,通过该图可知,球形的纳米金颗粒均匀地固定在MWNTs外表面,纳米金没有明显的团聚现象,Au颗粒的直径约是10 nm。在SEM图像的背景上没有观察到自由分散的纳米Au。EDS元素分析测定进一步证实了AuNP/MWNTs纳米复合物中Au的存在(图10.20B)。
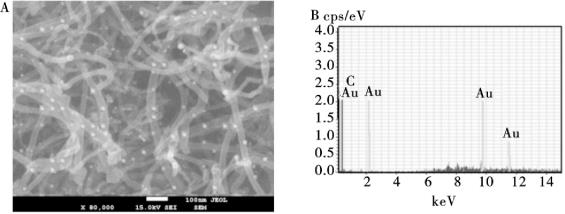
图10.20 A: AuNP/MWNTs的SEM表征; B: AuNP/MWNTs的EDS测定
10.4.2.2 多巴胺在AuNP/MWNTs/Nafion/GCE上的电化学响应
在0.1 mol/L PBS (pH =5.0)支持电解质溶液中,采用循环伏安法对60 μmol/L的多巴胺的电化学行为进行了研究。如图10.21所示,多巴胺在裸GCE上有一对微弱的氧化还原峰,显示了多巴胺较少的电子转移过程;多巴胺在Nafion/GCE上也有一对较小的氧化还原峰,且峰电位差较大,ΔE高达410 mV,显示了多巴胺在该电极表面较慢的电子转移过程;在MWNTs/Nafion/GCE上,多巴胺出现了一对较好的氧化还原峰,氧化峰在279 mV,还原峰在170 mV,峰电位差ΔE为109 mV;然而,在AuNP/MWNTs/Nafion/GCE上,多巴胺的氧化还原峰电流明显增强,而且氧化峰电位负移至256 mV,还原峰电位正移至190 mV,峰电位差ΔE降低为66 mV,该试验结果表明,纳米Au固定在MWNTs表面可以提高多巴胺在电极表面发生电化学反应的可逆性,并且纳米Au的存在能有效地加速多巴胺在电极表面的电子传递,明显增强多巴胺的氧化峰电流响应。
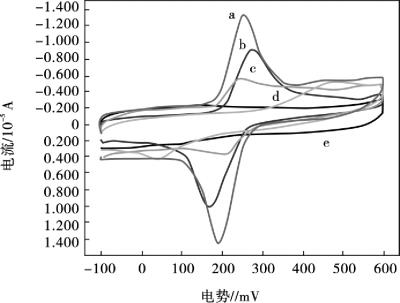
图10.21 AuNP/MWNTs/Nafion/GCE (a),MWNTs/Nafion/GCE (b),GCE (c),Nafion/GC E (d)和AuNP/MWNTs/Nafion/GCE在空白底液中(e),扫描速率: 80 mV/s
10.4.2.3 扫描速率对多巴胺电化学响应的影响
扫描速率(v)是影响电活性物质电化学响应的重要因素,本研究考察了扫描速率对多巴胺在AuNP/MWNTs/Nafion/GCE上的电化学响应的影响,试验结果表明,扫描速率在20 mV/s变化到200 mV/s时,多巴胺的氧化峰电流及还原峰电流分别与扫描速率呈良好的线性关系,线性回归方程分别为: ipa/μA = 3.769 + 0.079 v/mV/s(r = 0.995 3) ; ipc/μA = 3.478 2 + 0.108 6 v/mV/s (r = 0.996 8) ;这表明多巴胺在AuNP/MWNTs/ Nafion/GCE上的电化学氧化反应是受吸附控制的氧化还原过程。这最可能的原因为:在0.1 mol/L PBS pH =5.0的支持电解质底液中,MWNTs表面带电负性的含氧基团与电负性纳米Au能更容易地吸附电正性的多巴胺分子。
10.4.2.4 不同pH值对多巴胺电化学响应的影响
缓冲溶液的pH值对多巴胺的电化学响应有重要的影响,因此本研究考察了多巴胺在不同pH值的0.1 mol/L的磷酸盐缓冲液中的伏安行为。试验结果表明,0.1 mol/L的磷酸盐缓冲液的pH值在从pH =3.0逐渐增大到pH =4.0时,多巴胺的氧化峰电流随pH值的增大而降低,而在pH值从pH = 4.0逐渐增至pH = 5.0时,多巴胺的氧化峰电流随pH值的增大而增加;最后,在从pH =5.0逐渐增至pH =9.0时,多巴胺的氧化峰电流随pH值的增大而降低。与此同时,多巴胺的阳极峰和阴极峰的电位随pH值增加向负电位方向移动。这种试验现象表明,质子参加了多巴胺的电化学反应,本研究选用使多巴胺氧化峰电流最大时pH =5.0的0.1 mol/L的磷酸盐缓冲溶液为支持电解质溶液。
参与电化学反应的质子数可以通过如下方程计算:
Ep= Eo'-0.059 p/n pH
式中,p是参与电极反应的质子数,n是参与电极反应的电子数。根据试验测定,多巴胺的阳极峰电位Epa与pH呈线性: Epa= Eo'-0.064 3 pH (r = 0.998 6)。根据上述方程,参与电极反应的电子转移数与参加电极反应的质子数相等。根据方程ipa= n2F2vAΓ0/4RT = nFQv/4RT,计算得参与反应的电子数n = 1.98≈2,也表明有两电子、两质子参与了多巴胺的电化学氧化还原反应。
10.4.2.5 不同修饰量对多巴胺电化学响应的影响
不同量的AuNP/MWNTs/Nafion悬浮液涂在电极表面可以改变电极表面的性质和功能。本研究考察了AuNP/MWNTs/Nafion复合修饰剂的不同修饰量对多巴胺电化学响应的影响。试验结果发现,当悬浮液修饰量从5.0 μL逐渐增加到10.0 μL时,多巴胺的氧化峰电流随AuNP/MWNTs/Nafion修饰量的增加而增加;然而,当AuNP/MWNTs/Nafion修饰量超过10.0 μL时,多巴胺的氧化峰电流峰电流反而逐渐减小。分析此试验现象的原因可能为:开始,随着AuNP/MWNTs/Nafion修饰量的逐渐增加,电极表面的电子交换位点逐渐增加,多巴胺在AuNP/MWNTs/Nafion修饰电极上的吸附量也逐渐增加,因此,多巴胺的氧化峰电流逐渐增加。但是,当AuNP/MWNTs/Nafion复合修饰剂的量超过某一个值时(10.0 μL),修饰薄膜逐渐变厚,逐渐加大阻碍电子及多巴胺与电极表面间的传输,所以导致了多巴胺的氧化峰电流下降。根据试验结果,本实验选取AuNP/MWNTs/ Nafion的最佳修饰量为10.0 μL。
10.4.2.6 差示脉冲阳极溶出伏安法的各种参数的选择
差示脉冲阳极溶出伏安法(DPASV)具有较高的灵敏度及与背景电流极好的分离能力,所以用DPASV来定量分析测定多巴胺。由于多巴胺的氧化峰电流及其峰型受DPASV的各种参数的影响(如富集时间、富集电位、脉冲幅度、脉冲增量、脉冲宽度及脉冲周期),所以最初的试验是选择最佳的各种参数。试验结果表明,富集时间从0 s增加到20 s或富集电位从-100 mV增加到150 mV,阳极峰电流随富集时间的增加而增大;当富集时间超过20 s时,氧化峰电流几乎不变;当富集电位超过150 mV时,氧化峰电流开始降低。因此,20 s作为最佳富集时间,150 mV作为最佳富集电位。对电位增量进行考察的范围是1~5 mV,试验结果显示:逐渐增大电位增量会促使多巴胺的氧化峰电流逐渐降低,因此,把1 mV选为最佳电位增量。脉冲幅度,脉冲宽度或脉冲周期逐渐增加,多巴胺氧化峰电流逐渐增大,而当脉冲幅度、脉冲宽度或者脉冲周期分别为50 mV、40 ms和80 ms时,多巴胺的氧化峰电流达到最大,因此,选用脉冲幅度、脉冲宽度及脉冲周期的最佳值分别为50 mV、40 ms和80 ms。试验还发现,DPASV的参数变化对多巴胺的氧化峰电位几乎没有影响。
10.4.2.7 干扰研究
为了评价AuNP/MWNTs/Nafion/GCE电极的选择性,在0.1 mol/L磷酸盐缓冲液中(pH =5.0),本研究考察一些可能共存的干扰物质对浓度为8.0×10-7mol/L多巴胺氧化峰电流的影响。众所周知,在生物体系中,UA、AA为电活性分子,在传统的固相电极上,它们的氧化峰电位与DA的氧化峰电位相互叠加,产生干扰。因此,为了能更精确地指导定量测定多巴胺,研究UA和AA对多巴胺电化学响应的干扰具有重要性。在生物液体中,AA、UA的一般浓度含量约为10-4mol/L,因此,在0.1 mol/L pH =5.0的磷酸盐底液中,研究了4.0×10-4mol/L AA和4.0×10-4mol/L UA对8.0×10-7mol/L多巴胺氧化峰电流的影响。如图10.22所示,单独存在8.0×10-7mol/L多巴胺时,多巴胺有一个灵敏的氧化峰(图10.22a),而单独存在4.0×10-4mol/L AA,没有观察到明显的伏安响应(图10.22c)。由于AA的pKa= 4.10,所以,在pH =5.0的磷酸盐底液中,AA以阴离子形式存在;但是多巴胺的pKa= 8.87,在pH =5.0的磷酸盐底液中,多巴胺以阳离子形式存在;于是,Nafion,最为一种阳离子交换剂,在电极表面可以选择性的吸引阳离子形式的多巴胺,让多巴胺顺利通过到达电极表面;同时,Nafion阻止了以阴离子形式存在的AA到达电极表面,所以AA不能与电极交换电子,发生电极反应。当4.0× 10-4mol/L AA和4.0×10-4mol/LUA同时与8.0×10-7mol/L多巴胺共存时,多巴胺的氧化峰电流并没有发生明显的变化(图10.22b),另外,实验发现,UA的氧化峰电位在350 mV,可以与多巴胺的氧化峰电位200 mV完全分开。此外,还研究了其他一些可能存在的物质对8.0×10-7mol/L多巴胺氧化峰的影响,试验结果表明,依照对多巴胺峰电流影响的相对误差小于±10%,K+、Cl-和SO42-的浓度为多巴胺浓度500倍,Ca2+、葡萄糖和氨基乙酸为100倍时,对多巴胺的测定几乎没有干扰。
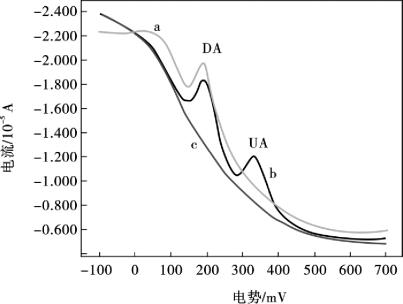
图10.22 4.0 ×10-4mol/L AA和4.0×10-4mol/LUA对8.0×10-7mol/L多巴胺氧化峰电流的影响DPASV:8.0×10-7mol/L多巴胺(a),8.0×10-7mol/L多巴胺 + 4.0×10-4mol/L AA + 4.0×10-4 mol/LUA (b)和4.0×10-4mol/L AA (c)
10.4.2.8 校准曲线的建立
为了进一步检验所建立方法用于多巴胺定量分析的可行性,用DPASV方法研究了多巴胺浓度与其氧化峰电流之间的关系。在最佳参数条件下(富集时间20 s,富集电位150 mV,脉冲幅度50 mV,电位增量1 mV,脉冲宽度40 ms及脉冲周期80 ms),当多巴胺的浓度从5.0×10-8mol/L逐渐增加到8.0×10-6mol/L时,多巴胺的氧化峰电流与其浓度呈良好的线性关系,线性回归方程为:
ipa= 1.41 + 4.96CDA(ipa/10-6A,CDA/μmol/L,r = 0.998 4),
对多巴胺的最低检出限为4.0×10-8mol/L。
再生性和重现性是修饰电极的两个重要特征。同一个AuNP/MWNTs/Nafion/GCE对2.0×10-6mol/L的多巴胺连续测量6次(每次测量后,在0.1 mol/L磷酸盐缓冲液中,AuNP/MWNTs/Nafion/ GCE在-100~700 mV范围连续循环伏安扫描3周),计算多巴胺氧化峰电流值的相对标准偏差(RSD)为2.9%,对6支相同过程制备的AuNP/MWNTs/ Nafion/GCE的RSD为5.3%,表明该修饰电极具有良好的重现性和再生性。
10.4.2.9 实际样品分析
为了符合本研究所建立方法的线性范围,实际样品多巴胺注射液用支持电解液按照稀释因子1/20 000 (v/v)准确的稀释,稀释的过程可以减少实际样品基质的干扰。用Au/MWNT/Nafion/GCE测定多巴胺注射液的多巴胺,测定结果列于表10.13中,多巴胺注射液中多巴胺的含量为9.85 mg/mL,这与它的标示量10 mg/mL相近。利用加标回收试验来进一步确证本研究所建立方法的定量性和可重复性,结果如表10.13所示。从表
10.13可知,本研究所建立的方法对药品中多巴胺的测试具有较高的灵敏度和选择性。
表10.13 实际样品中多巴胺回收测定结果(n = 5)

10.4.3 小结
本章节制备了高分散纳米Au颗粒锚定的多壁碳纳米管纳米复合薄膜修饰电极。采用SEM方法测定碳纳米管表面纳米Au颗粒的直径约为10 nm。在0.1 mol/L磷酸盐缓冲液中(pH =5.0),该新材料对多巴胺的电化学反应具有较高的电催化活性,该新材料不但能显著增大多巴胺的氧化峰电流,还降低了其氧化峰电位。运用DPASV建立了多巴胺的氧化峰电流与其浓度在5.0×10-8~8.0×10-6mol/L范围内呈线性关系,最低检出限为4.0×10-8mol/L。该方法成功用于药物样品中多巴胺的定量分析。
10.5 AuNP/乙二胺/MWNTs/Nafion复合多层薄膜修饰电
极的制备及其对芦丁的定量分析研究
10.5.1 概述
芦丁(3',4',5,7-四羟基黄酮-3β-d-芸香糖甙),是一种具有丰富生物活性的类黄酮,被称为维生素P,广泛存在于多种维生素制剂及70多种中草药中。作为一种天然黄酮衍生物,芦丁具有许多生理活性,例如,消炎、止血、抗菌、抗肿瘤和抗氧化等;它还经常作为临床应用的治疗药物,例如,它可以用于某些疾病的治疗,如由于血液稀释、毛细血管的渗透性降低、血压降低导致的毛细血管出血。因此,有必要发展简便、灵敏、经济、高效的测定芦丁的技术。目前,许多方法已经建立,并用于芦丁的分析,如毛细管电泳、吸附溶出伏安法、化学发光法、高效液相色谱法、流动注射分析、光度法等。然而,其中一些方法,如色谱法,不但费时,昂贵,而且需要复杂的预富集,多溶剂提取以及训练有素的技术人员。与其他方法相比,电化学方法的特点是操作简便、灵敏度高、稳定性好、成本低廉、使用的仪器体积小及能现场观测等。因为芦丁为电活性化合物,文献已经报道了多种不同方法构建的电极用于电分析定量测定芦丁。
本章节中,我们制备了纳米金/乙二胺(en) /功能化多壁碳纳米管/Nafion复合薄膜修饰玻碳电极(AuNP/en/MWNTs/Nafion/GCE),并用于实际样品中芦丁的电分析定量测定。
10.5.2 AuNP/en/MWNTs/Nafion复合多层薄膜修饰电极的制备及其对芦丁的定量分析研究
10.5.2.1 AuNP/en/MWNTs/Nafion修饰电极的表征
MWNTs可以均匀地滴涂于GCE表面,通过电化学嫁接,吊链状的乙二胺可以附着在MWNTs上。电化学嫁接乙二胺于MWNTs修饰电极表面,当以10 mV/s扫描速率,在电位范围0~1 400 mV(相对于饱和甘汞电极)连续扫描6周,第一周扫描时,在1 050 mV处有一个较大的氧化峰,第一周之后的(再次)扫描,此氧化峰基本消失,这种现象与文献报道的相似。最后一步是柠檬酸根包裹的纳米金粒子自组装电嫁接于MWNTs的乙二胺吊链上。
扫描电子显微镜(SEM)能有效地表征出修饰电极的特征。如图10.23a所示的是用扫描电子显微镜表征的MWNTs/Nafion薄膜的表面微结构。该图表明,MWNTs/Nafion复合物被均匀地涂在了电极表面,并形成一个多孔的网络状结构,特殊的多孔表面形貌明显提供了比表观面积更大的实际面积;与AuNP/en/MWNTs/Nafion复合薄膜对比,在AuNP/en/MWNTs/Nafion复合薄膜上显示出很多可以观测到的亮点(图10.23b),这些亮点就是自组装到电极表面的纳米金颗粒;从图10.23b还可以看出,虽然纳米金有几处聚集,但还是比较均匀的分散于电极表面。

图10.23 MWNTs/Nafion (a)和AuNP/en/MWNTs/Nafion (b)复合薄膜的SEM表征
10.5.2.2 芦丁在AuNP/en/MWNTs/Nafion上的电化学响应
图10.24显示芦丁在不同的修饰电极上的循环伏安曲线。在0.1 mol/L磷酸盐缓冲液(pH =3.5)中,芦丁在裸玻碳电极上没有任何氧化还原峰(a),这表明芦丁在玻碳电极上的较弱的吸附和较慢的电化学反应。然而,芦丁在en/MWNTs/Nafion/GCE (b),MWNTs/Nafion/GCE玻碳电极(c)和AuNP/en/MWNTs/Nafion/GCE (d)上具有明显峰型较好的氧化还原峰;其中,芦丁在AuNP/en/MWNTs/Nafion/GCE上的氧化还原峰电流要明显高于在en/MWNTs/Nafion/GCE及MWNTs/Nafion/GCE上的氧化还原峰电流。芦丁在AuNP/en/MWNTs/Nafion/GCE上的氧化峰电位(Epa),还原峰电位(Epc)分别在487 mV和432 mV处,峰电位差ΔE = 55 mV,且它们的峰电流比(ipa/ipc)约为1,说明芦丁的电化学氧化还原反应为可逆的。纳米金和多壁碳纳米管具有富集和催化能力,可以使更多的芦丁富集于电极表面,并能提高电子传输速率,促进芦丁进行电化学反应。
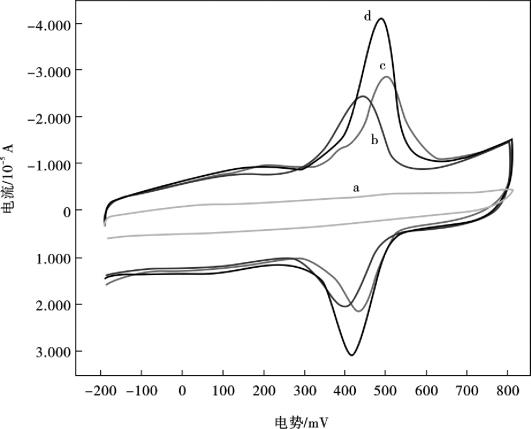
图10.24 4.0 ×10-5mol/L的芦丁在不同电极上的循环伏安曲线:裸GCE(a),en/ MWNTs/Nafion/GCE (b ),MWNTs/Nafion/GCE (c )及 AuNP/en/ MWNTs/Nafion/GCE (d)扫描速率为100 mV/s
10.5.2.3 扫描速度对芦丁电化学响应的影响
0.1 mol/L磷酸盐缓冲液(pH =3.5)中,本文研究了4.0×10-5mol/L芦丁在AuNP/ en/MWNTs/Nafion上不同扫描速率时对其峰电流、峰电位的影响。当扫描速率v从20 mV逐渐增加到500 mV时,芦丁的氧化峰电位都随着扫描速率的增加而正移,并且芦丁的氧化峰电流与扫描速率(v)成正比,具有良好的线性关系,其线性方程为:
ipa= 0.017 5v + 0.715 8 (ipa: 10-5A,v: mV/s,r = 0.998 8),
这也说明在AuNP/en/MWNTs/Nafion上,芦丁的电化学反应是受吸附控制的过程。当扫描速率逐渐增大,氧化还原峰电位分离度也逐渐加大,这表明该电极反应逐渐变得不可逆。根据方程
ipa= n2F2vAΓ0*/4RT = n F Q v/4RT
芦丁在电极表面发生电极反应的电子转移数n为1.95≈2,表明有两个电子参与了电化学氧化过程。芦丁的氧化峰电位(Epa),还原峰电位(Epc)分别与ln v也具有线性关系,其线性方程为
Epa= 0.017lnv + 0.409 7 (r = 0.996 7)
Epc= 0.514-0.0178lnv (r = 0.997 3) (Ep: V,v: mV/s)
根据如下方程:
Epa= Eo'+ m[0.78 + ln(D1/2ks-1)-0.5 ln m] + (m/2) lnv (m = RT/[(1-α) nα
F])
Epc= Eo'-m[0.78 + ln(D1/2ks-1)-0.5 lnm] -(m/2) lnv[m = RT/(αnα
F)]
计算得芦丁的电子转移系数α为0.62。
10.5.2.4 不同pH值对芦丁电化学响应的影响
在AuNP/en/MWNTs/Nafion/GCE上,研究了8.0×10-5mol/L芦丁在0.1 mol/L磷酸盐缓冲液中不同pH值时的电化学行为。试验结果表明,当pH值从2.0逐渐增加到9.0时,芦丁的氧化峰电位逐渐负移,且芦丁的氧化峰电位与pH值之间具有良好的线性关系,其线方程为Epa/V = 0.683 8-0.056 pH (r = 0.998 4),根据该方程的斜率56 mV pH-1可以推断出参与电化学反应的电子数与质子数相等,即两个质子参与了芦丁的电化学反应。随着pH值的增加,芦丁氧化峰电流先增大后减小,当pH =3.5时达到最大值。当pH值超过8.0时,阳极峰电流变得非常小,这种试验现象与质子参与电极反应有关,这是因为当pH值超过6.0时,带负电荷的纳米金与带负电荷的芦丁之间存在静电斥力。因此,pH =3.5的酸性溶液被用于芦丁的测定。
10.5.2.5 en/MWNTs/Nafion/GCE在纳米金溶胶中浸泡不同时间的影响
en/MWNTs/Nafion/GCE在纳米金溶胶中浸泡不同时间与测试相同浓度芦丁的峰电流的关系表明,当浸泡时间为2 h时,芦丁的氧化峰电流值最大且峰形对称性较好,综合来看,浸泡时间2 h为最佳浸泡时间。
10.5.2.6 差示脉冲阳极溶出伏安法各种参数的选择
由于差示脉冲阳极溶出伏安法(DPASV)方法比较灵敏,使用DPASV法定量测定芦丁,首先对2.0×10-5mol/L的芦丁考察了DPASV各项参数,确定了其最佳测定条件,数据如表10.14所示。
表10.14 差示脉冲阳极溶出伏安法的最佳优化条件

10.5.2.7 干扰研究
为了评价AuNP/en/MWNTs/Nafion/GCE的选择性,在0.1 mol/L磷酸盐缓冲液中(pH =3.5),当溶液中存在2.0×10-5mol/L芦丁时,本研究考察一些可能共存的干扰物质对芦丁氧化峰电流的影响。试验结果表明,依照对芦丁氧化峰电流影响的相对误差<±10%,测定以下物质: K+、Na+、Cl-、SO42-、PO4
3-和葡萄糖的浓度是芦丁浓度的500倍,甘氨酸和柠檬酸的200倍,Zn2+、Ca2+的100倍及Mg2+的60倍时对测定体系几乎没有干扰。
一般而言,抗坏血酸(AA)作为电活性物质,总是与芦丁在复方芦丁片中共存。抗坏血酸的氧化峰电位与芦丁的氧化峰电位非常接近,因此,在实际样品中,常规的电极对芦丁的选择性测定就受到了很大程度的限制,因此,研制更灵敏、选择性更好、更简便的方法,用于抗坏血酸和芦丁的选择性分离和测定是有必要的。在0.1 mol/L磷酸盐缓冲液(pH =3.5)中,图10.25显示了1.0×10-4mol/L抗坏血酸(a),芦丁和抗坏血酸的混合物(包含2.0×10-5mol/L芦丁和1.0×10-4mol/L抗坏血酸) (b),2.0×10-5mol/ L芦丁(c)和没有抗坏血酸的芦丁(d),在AuNP/en/MWNTs/Nafion/GCE上的循环伏安特性曲线。图10.25b显示,抗坏血酸氧化峰在大约186 mV,芦丁的氧化峰在约487 mV处,抗坏血酸与芦丁的氧化峰分离度高达约301 mV,足够宽的两个氧化峰分离度,使两峰完全分开,这表明该修饰电极能够实现在抗坏血酸存在下,对芦丁电化学分析选择性测定。
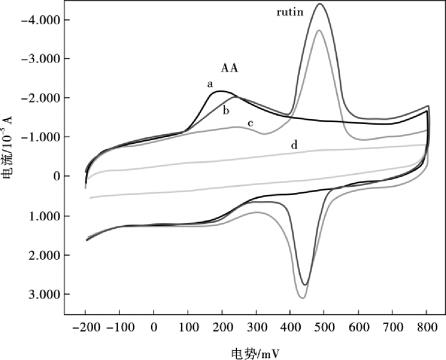
图10.25 1.0 ×10-4mol/L抗坏血酸(a),1.0×10-4mol/L抗坏血酸和2.0×10-5mol/L芦丁(b),2.0×10-5mol/L芦丁(c)和0.1 mol/L磷酸盐缓冲液(pH 3.5) (d)在AuNP/ en/MWNTs/Nafion/GCE上的循环伏安曲线;扫描速率100 mV/s
10.5.2.8 校准曲线的建立
DPASV具有较高的灵敏度和较好的与背景电流分离的能力,所以采用DPASV法来
实现芦丁伏安测定。在最佳条件(富集时间: 70 s,富集电位: 300 mV,脉冲幅度: 50 mV,电位增量: 1 mV,脉冲宽度: 40 ms,脉冲周期: 100 ms)下,研究芦丁浓度与其氧化峰电流之间的关系。当芦丁浓度在9.6×10-7~4.8×10-8mol/L范围内,阳极峰电流与芦丁浓度之间呈线性关系,其线性回归方程为: ipa= 2.372 8 Crutin-0.178 2 (ipa: 10-5A,Crutin:μmol/L,r = 0.997 3)。最低检出限为3.2×10-8mol/L。
稳定性和重现性是修饰电极的两个重要特征。同一支AuNP/en/MWNTs/Nafion/ GCE连续测量2.0×10-5mol/L芦丁6次,每次测量后,该电极在0.1 mol/L磷酸盐缓冲液(pH =3.5)中,在-200~800 mV之间循环扫描6周使其再生。6次测量的阳极峰电流的相对标准偏差为4.3%,表明了修饰电极具有良好的稳定性和重现性。
10.5.2.9 实际样品分析
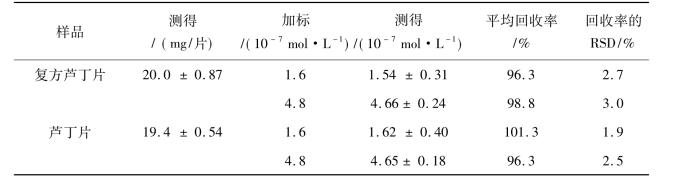
为了符合本研究所建立方法的线性范围,复方芦丁片和芦丁片都用支持电解溶液准确的稀释,稀释的过程可以减少实际样品基质的干扰,测定结果列于表10.15中。复方芦丁片中和芦丁片中芦丁含量的标示量为20 mg/片,本实验所建立方法测定的复方芦丁片和芦丁片中芦丁的含量分别为(20.0±0.87) mg/片和(19.4±0.54) mg/片,这是由测定值乘以稀释因子而得到的结果,这个结果与样品的标示量基本一致。利用加标回收试验来进一步确证本研究所建立方法的准确性和可重复性。对实际样本溶液分别进行加标回收测定,分析结果列于表10.15,回收率为96.3%~101.3%,从表10.15可知,本研究所建立的方法对药物药品芦丁的测试都具有较高的灵敏度和选择性。为了更进一步确证所建立方法测定结果的准确性,高效液相法被用于检测复方芦丁片和芦丁片中芦丁的含量,高效液相法测定的复方芦丁片和芦丁片中芦丁的含量分别为(18.9±0.47) mg/片和(18.1±0.57) mg/片,此测定结果与本实验所建立方法测定结果基本一致,进一步说明本研究所建立的方法对药物药品芦丁的测试具有较高的灵敏度和选择性。
表10.15 芦丁在复方芦丁片和芦丁片中的测定结果(n = 5)
10.5.3 小结
本章节构建了AuNP/en/MWNTs/Nafion/GCE,在0.1 mol/L (pH =3.5)的磷酸盐缓冲液中,利用该电极研究了芦丁的电化学行为,计算了其电化学反应参数。在最佳优化条件下,芦丁浓度在9.6×10-7~4.8×10-8mol/L范围内,其阳极峰电流与其浓度具有良好的线性关系,最低检出限为3.2×10-8mol/L。另外,共存物质抗坏血酸对芦丁的测定没有干扰;该方法可用于测定复方芦丁片和芦丁片样品中的芦丁的含量。
10.6 结论与展望
10.6.1 主要结论
本章主要针对基于碳纳米管复合纳米材料修饰电极的制备及其在药物分析中的应用,特别是针对药物分析及生物分析中存在的低选择性、弱的抗干扰能力等难题进行了初步的研究及探索。本章的主要研究工作总结如下:
(1)制备了功能化多壁碳纳米管,利用聚氟磺酸盐阳离子交换剂Nafion极好的分散能力制备了二组分复合薄膜功能化多壁碳纳米管/Nafion修饰玻碳电极。用扫描电子显微镜及电化学方法对该修饰电极进行了表征。用该修饰电极分别对弱碱性药物分子咖啡因、茶碱的电化学行为进行了研究;试验发现,该修饰电极在电分析测定咖啡因和茶碱中,能改善一系列在传统电极上出现的问题,如高的过电位、慢的电极反应、低的灵敏度等;建立了一种高灵敏度伏安测定咖啡因和茶碱定量检测体系。
(2)利用功能化多壁碳纳米管/Nafion复合薄膜修饰电极作为灵敏的伏安传感器分别对弱酸性药物丹皮酚、抗坏血酸和尿酸进行了定量分析研究。该修饰电极对药物制剂和生物样品中的弱酸性药物分子丹皮酚进行了定量分析测定;得到了丹皮酚的动力学参数并提出了可能的丹皮酚的多步氧化机制。该修饰电极还实现了对抗坏血酸和尿酸的同时电分析测定。相比于裸电极,抗坏血酸和尿酸的氧化峰电流显著增加,抗坏血酸和尿酸的氧化峰峰分离高达320 mV,避免了两个氧化峰之间峰的叠加。在最佳实验条件下,建立了定量分析抗坏血酸和尿酸的检测体系。该复合薄膜修饰电极不仅适用于弱碱性药物分子的定量分析测定,还适用于弱酸性药物分子的定量分析测定,并且实现了体内弱酸性生物小分子抗坏血酸和尿酸的同时灵敏分析测定。
(3)利用碳纳米管的吸附特性及碳纳米管与亚甲基蓝π-π共轭电子效应,制备了多壁碳纳米管吸附亚甲基蓝电化学功能化纳米复合材料;在构建功能化多壁碳纳米管/Nafion二组分复合薄膜修饰电极的基础上,又构建了新的亚甲基蓝/功能化多壁碳纳米管/ Nafion三组分复合薄膜电化学传感器。利用原子力显微镜,扫描电子显微镜及交流阻抗谱对该修饰电极进行了表征。实验发现,该修饰电极能明显的增强多巴胺和尿酸的峰电流,降低多巴胺的氧化峰电位,对多巴胺显示出极好的电催化活性;并且能避免多巴胺和尿酸的氧化峰的叠加,消除常见干扰物质抗坏血酸的干扰;建立了一种高灵敏度同时伏安测定多巴胺和尿酸的检测体系。
(4)制备了一种新的纳米材料:铁氰化钇纳米颗粒;利用红外光谱、能量发射光谱、扫描电镜和电化学方法对铁氰化钇纳米颗粒进行了表征。在构建功能化多壁碳纳米管/Na-fion二组分复合薄膜修饰电极的基础上,构建了一种新的三组分电化学传感器:铁氰化钇纳米颗粒/功能化多壁碳纳米管/Nafion复合薄膜修饰玻碳电极。考察了铁氰化钇纳米颗粒/功能化多壁碳纳米管/Nafion复合薄膜修饰玻碳电极对L-半胱氨酸的电化学响应。对比于裸玻碳电极及多壁碳纳米管修饰电极,其能显著的增强L-半胱氨酸的氧化峰电流。该修饰电极具有高的稳定性和较强的抗干扰能力(如可消除抗坏血酸和其他可氧化的氨基酸的干扰) ;建立了一种高灵敏度定量分析测定L-半胱氨酸的测定体系。
(5)本章提出了一种新颖的方法,制备了高分散纳米Au颗粒锚定的多壁碳纳米管纳米复合材料。采用SEM方法测定碳纳米管表面纳米Au颗粒的直径约为10 nm。在构建功能化多壁碳纳米管/Nafion二组分复合薄膜修饰电极的基础上,又构建了一种新的三组分修饰电极:纳米金/功能化多壁碳纳米管/Nafion三组分复合薄膜修饰玻碳电极。该新电极对多巴胺的电化学反应具有较高的电催化活性,该新材料不但能显著增大多巴胺的氧化峰电流,还降低了其氧化峰电位。该方法成功用于药物样品中多巴胺的定量分析测定。
(6)本章通过滴涂-电聚合-静电吸附等方法,在构建功能化多壁碳纳米管/Nafion单层二组分复合薄膜修饰电极的基础上,又制备了一种新的三层复合薄膜修饰电极:纳米金/乙二胺/功能化多壁碳纳米管/Nafion三层复合薄膜电化学传感器;研究了芦丁在纳米金/乙二胺/功能化多壁碳纳米管/Nafion复合薄膜修饰玻碳电极上的电化学行为,计算得芦丁的电化学参数。在最佳实验条件下,芦丁的阳极峰电流与其浓度在4.8×10-8~9.6×10-7mol/L范围内呈良好的线性关系,最低检出限为3.2×10-8mol/L。该修饰电极抗干扰能力强,消除了常见干扰物质抗坏血酸的干扰。建立了一种高灵敏度伏安测定芦丁的定量分析检测体系,并成功的用于实际样品中芦丁含量的测定。
10.6.2 后续工作及建议
10.6.2.1
MWNTs能均匀地分散在Nafion甲醇溶液中,但是在中性溶剂如DMF,甲醇和水中不易均匀分散,但是Nafion是聚阳离子交换剂,MWNTs/Nafion复合薄膜带负电性,不利于带负电荷的分子进行电子交换,因此,对MWNTs具有较好分散性的电中性及正电性的分散液的选择有待进一步的研究。
10.6.2.2
本章节制备了铁氰化钇纳米颗粒/功能化多壁碳纳米管/Nafion复合薄膜修饰玻碳电极,对于其他过渡金属铁氰化物纳米颗粒的制备、复合薄膜修饰电极的构建,以及其在电分析测定中的应用有待进一步的研究。
10.6.2.3
基于碳纳米管复合纳米材料修饰电极的制备及其在电分析化学中的应用,特别是针对药物分析及生物分析中存在的低选择性,弱的抗干扰能力等难题需要进行更多的研究与探索。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







