第4章 金磁纳米复合颗粒的制备及应用
4.1 金磁纳米复合微粒简介
4.1.1 金纳米微粒
金纳米微粒即指金的颗粒直径在1~100 nm,具有高电子密度、介电特性和催化作用,能与多种生物大分子结合,且不影响其生物活性。由氯金酸通过还原法可以方便地制备各种不同粒径的纳米金,其颜色依直径大小而呈红色至紫色。
作为现代四大标记技术之一的纳米金标记技术(nanogold labelling techique),实质上是蛋白质等高分子被吸附到纳米金颗粒表面的包被过程。吸附机制可能是纳米金颗粒表面负电荷,与蛋白质的正电荷基团因静电吸附而形成牢固结合,而且吸附后不会使生物分子变性,由于金颗粒具有高电子密度的特性,在金标蛋白结合处,在显微镜下可见黑褐色颗粒,当这些标记物在相应的配体处大量聚集时,肉眼可见红色或粉红色斑点,因而用于定性或半定量快速免疫检测方法中。以纳米金为标记物的免疫分析法及其他速测技术具有简单、快速、灵敏度高、特异性强、价廉、样品所需量少等优点,其灵敏度与常规的仪器分析一致,适合现场筛选,而且其中的金免疫层析技术正在向定量、半定量检测和多元检测的方向发展,更加体现出金标技术的优势。
4.1.2 磁性纳米微粒
4.1.2.1 磁性纳米微粒特点
磁性纳米微粒(magnetic nanoparticles,MNP),又称磁性微球或磁珠,主要是由顺磁性纳米粒子(如磁性金属Fe、Co、Ni及其氧化物)组成的胶体复合物。MNP既具有纳米材料所特有的性质如粒径小、比表面积大、偶联容量高,又具有磁响应性及超顺磁性,在恒定磁场下聚集和定位、在交变磁场下吸收电磁波产热。利用这些特性磁性纳米颗粒被应用于生物标记与分离、核磁共振成像(MRI)、组织修复、药物载体以及疾病诊断与治疗等方面。
磁性纳米微粒指尺寸是纳米数量级的磁性金属或者磁性金属氧化物微粒,也可以通过适当方法使磁性金属或金属氧化物微粒与包覆材料结合而形成具有一定磁性及特殊结构的复合磁性纳米微粒。除了具有纳米材料所不同于其他材料的特殊性,如表面效应、尺寸效应、量子尺寸、宏观量子隧道效应等,还具有以下特点:
(1)超顺磁性 即指当外加磁场变为0时,纳米微粒的矫顽力和剩磁也均趋近于0。纳米微粒尺寸小于一定临界值时呈现超顺磁性,不同种类纳米磁性微粒的临界尺寸不同。
(2)矫顽力 磁性纳米微粒尺寸大于超顺磁性临界尺寸时,会呈现出高的矫顽力。
(3)居里温度 物质磁性的重要参数,正比于交换积分,和原子结构和间距相关。由于小尺寸效应和表面效应使纳米微粒的磁性发生变化,因此磁性纳米微粒的居里温度一般较低。
磁性微粒,主要是由顺磁性纳米粒子(如磁性金属Fe、Co、Ni及其氧化物)组成的胶体复合物。该微粒既具有纳米粒子的光学和磁学特征,又可在其表面进行功能化修饰,结合生物大分子,在磁场作用下实现快速分离富集。
磁性微粒既作为反应固相,又作为分离的载体,它的应用使得免疫反应在近乎均相的条件下实现了快速的反应动力学,同时可以在磁场作用下快速分离游离蛋白和抗体-抗原复合物,从而简化了操作、缩短了反应时间。
磁性微粒按结构分为简单结构、核壳结构和夹心结构三种,目前研究较多的磁性微粒多为核壳结构。核壳结构又可分为三种:①粒径较小的磁颗粒作核层,外层包覆无机物或高分子物质;②无机物或高分子有机物作核层,磁性颗粒作壳层;③内外层均为高分子物质或金属无机物,夹层为磁性微粒。其中以第一种结构的研究应用最为广泛。
最新研究表明在磁颗粒表面包裹一层性能稳定的金属或金属氧化物纳米颗粒形成核壳状的复合磁性纳米材料,可以有效改善其物理化学性能,进一步扩大其应用范围。磁颗粒的制备主要集中在超顺磁性的氧化铁的微粒子上,如磁铁矿(magnetite,Fe3O4)、磁赤铁矿(maghemite,γ-Fe2O3)以及钴铁氧体(cobalt ferrite,CoFe2O4)等。
常用的磁性纳米微粒为Fe3O4纳米颗粒,这类Fe3O4纳米颗粒具有成本低、合成简便、磁响应性能明显等优点,但是稳定性差、容易团聚、表面功能基团少。
4.1.2.2 磁性纳米微粒的制备方法
磁性纳米颗粒主要包括:铁的氧化物如Fe3O4、γ-Fe2O3;纯金属如Fe、Co;其他一些磁性化合物如MgFe2O4、MnFe2O4、CoFe2O4;磁性合金如CoPt3、FePt等。其中Fe3O4和γ-Fe2O3这一类铁氧化合物应用最为广泛。
(1)沉淀法
1)化学共沉淀法 分别准确称取分析纯的FeCl3·6H2O、FeCl2·4H2O和抗坏血酸若干克,共溶于一定量的去离子水中;将完全溶解的FeCl3和FeCl2的混合溶液置于60℃的恒温水浴锅中,搅拌下快速加入过量氨水;当温度上升到80℃一段时间之后加入表面活性剂,再保温一段时间;将产物沉淀、洗涤干净,用真空干燥箱烘干,即可得到干燥纳米颗粒。该法合成γ-Fe2O3或Fe3O4颗粒,颗粒形貌为圆形,其粒径大小为10 nm以下,饱和磁化强度为73.85 A·m2/kg。反应原理如下:
![]()
2)氧化沉淀法 纳米Fe3O4传统的制备方法是以α-Fe4O3为原料在330℃的条件下用H2作还原剂还原而得,也可以Fe3+为原料用Na2SO3部分还原或以Fe2+为原料用KNO3部分氧化而得。
氧化沉淀法是在碱性条件下向Fe(OH)2的悬浮液中通入O2或者其他氧化剂(如H2O2等),将部分Fe2+氧化为Fe3+,其反应式为:
6Fe2++12OH-+ O →─2 2Fe3O4+6H2O
该法具有工艺成熟,操作方便,成本低,可应用于工业大量生产等优点,制备的磁粉纯度高、磁性强、粒径小,是一种制备粒径为20~30 nm Fe3O4的好方法。
3)均相沉淀法 该法是在铁盐溶液中缓慢加入某种沉淀剂,通过控制其滴加速度,使溶液中沉淀处于平衡状态,且沉淀能在整个溶液中均匀出现,从而控制粒子生长速度,获得粒度均匀、纯度高的超细氧化铁粒子。常用的试剂为尿素,它在约70℃水溶液中发生分解反应: CO(NH2)2+3H2 →─O 2NH4OH + CO2,得到分布均匀、浓度低的NH4OH沉淀剂,从而控制沉淀物均匀生成。
欧延等在FeCl3溶液中加入尿素沉淀剂,在不同条件下合成粒径在20~30 nm的α-Fe2O3; Liao X.H.等采用微波辅助加热的手段,以FeCl3和尿素为原料,并加入分散剂聚乙烯己二醇,制备出了粒径在3~5 nm的无定型纳米氧化铁。
4)直接沉淀法 国内专利以铁盐和碱溶液为原料,在表面活性剂条件下,调整分子表面活性剂的成分,可以得到10~30 nm、粒度细小均匀的纳米氧化铁粉体,该工艺设备简单、成本低廉; Khedr等以精制净化的FeCl3和NH4OH为原料,制备得到约78 nm氧化铁,应用于CO的催化氧化反应中。
5)还原沉淀法 娄敏毅等以FeCl3溶液作为原料,采用部分还原沉淀法,加入一定量的Na2SO3溶液,剧烈搅拌下滴加氨水,调节pH值使其值等于8,待沉淀结束后,将胶体于60~80℃的水浴中加热30 min,将产物分离、洗涤、真空干燥等,制得10~25 nm、分散性好的Fe3O4晶体,掺杂部分γ-Fe2O3晶粒。
6)配合物分解沉淀法 宋丽贤等报道了在N2保护下,以FeCl3·6H2O和FeCl2· 4H2O为原料,加入适量配合剂柠檬酸和分散剂聚乙二醇,在68℃水浴中恒温反应,同时缓慢滴加0.2 mol/L的NaOH溶液至pH≥9.2,反应结束后,经过分离、洗涤、真空干燥等工艺得纳米Fe3O4粉体。
Deepa Thapa等提出了一种更为简便的方法制备磁性纳米Fe3O4,即在80~90℃的条件下,将FeCl2·4H2O和NH4OH溶液充分混合后得到沉淀,将其过滤并在室温下于空气中放置干燥12 h,即可得粒径5~100 nm的Fe3O4微粒。
7)超声沉淀法 超声波所起作用的主要原因在于超声波所产生的“超声波气化泡”形成了局部高温高压环境和具有强烈冲击力的微射流。Vijayakumar等在5℃、0.15 MPa的氩气环境下,在高强度超声波环境里从乙酸铁盐水溶液中制得粒径10 nm、具有超顺磁性的Fe3O4纳米颗粒,室温下磁化强度约为1.25 emu/g。
(2)微乳液法 水/油(W/O)微乳剂系统中,水合相微滴截流在连续油相的表面活性剂分子里,稳定的表面活性剂分子的微孔(大约10 nm)限制了颗粒的形核、长大与团聚。该法合成γ-Fe2O3或Fe3O4颗粒,颗粒形貌为立方体或球形,其粒径大小为15 nm以下,饱和磁化强度大于30 A·m2/kg,具超顺磁性,且纳米微粒微乳液均匀稳定,呈多晶微晶形态,晶格参数比常规的要小;但是同时由于耗用大量乳化剂、产率较低,且价格昂贵。
宋丽贤等将Fe3+、Fe2+混合微乳液缓慢加入到剧烈搅拌的NaOH微乳液中,得到纳米Fe3O4,其粉体纯度较高,粒子平均粒径为24 nm,粒度分布均匀,分布带较窄;所制纳米Fe3O4具有超顺磁性,饱和磁化强度在66 A·m2/kg左右。
何秋星等以工业煤油作油相、AEO3+ TX10作表面活性剂、正丁醇作助溶剂,分别配成含Fe2+/Fe3+和NaOH的两种微乳液,用双乳液混合法制备纳米磁性Fe3O4微粉。实验表明在最优条件下所制备产物物相单一、平均粒径25~40 nm。
(3)溶胶-凝胶法 溶胶-凝胶法一般采用Fe3+盐溶液为原料,在一定温度下将其溶解在水或醇中,并加入适量的碱液(氨水)和一定量的表面活性剂,调节pH值后配成胶体,陈化至凝胶,经干燥、煅烧等即可以得到Fe3O4纳米粒子。
马振叶等采用相转移与溶胶-凝胶法相结合,以FeCl3和NaOH溶液为原料,并加入一定量的油酸和甲苯,制得平均粒径约12 nm的Fe2O3粉体; Tang等分别以氯化亚铁、柠檬酸、抗坏血酸和无水乙醇作为原料、螯合剂、抗氧化剂和溶剂,通过溶胶-凝胶法在300℃热处理条件下制备平均粒径只有12 nm的Fe3O4颗粒薄膜,该薄膜具有超顺磁性。
(4)水热法 水热法是指在高压釜里的高温、高压反应环境中,采用水作为反应介质,使得通常难溶或不溶的物质溶解、反应、重结晶而得到理想的产物。该方法对设备要求较高,具有原料易得、粒子纯度高、分散性好、晶型好等优点,但是粉体粒径均匀性差且颗粒较大。Wang H.W.在pH值小于9的情况下制备出平均粒度为20 nm的Fe3O4纳米粒子。
(5)水解法 水解法分为两种:一种是Massart法,另一种为滴定水解法。前者是将铁盐的混合溶液滴加在碱溶液里,后者则反之。该法对设备要求低,在较为温和条件下进行,原料廉价,流程简单,产物纯度高,粒子分散性好,但要求考虑影响粉末粒径和磁学性能的因素较多。Zhong B.H.等采用水解法制备Fe3O4纳米粒子粒径大约为10 nm,粒径分布窄。
(6)微波水热法 基本原理是用微波场作为热源,反应介质在特制的、能通过微波场的耐压反应釜中进行反应,在微波辐射作用下,极性分子接受微波辐射能量后,偶极子以数亿次每秒的高速旋转产生热效应。由于其加热速度快、反应灵敏、受热体系均匀等特点,其能快速制备粒径分布窄、形态均一的纳米粒子。因此微波水热法在制备超细粉体方面具有巨大的潜在研究价值。
Khollam Y.B.等采用微波水热法在90~200℃温度范围内,产物的粒度为0.15~0.12 μm的球形块体,其饱和磁化强度达到70 emu/g。Liu H.C.采用微波水热法制备磁性Fe3O4纳米粒子,利用NH4OH溶液对FeCl3·4H2O和FeCl3·6H2O进行沉淀,控制溶液浓度和反应温度,使形成的Fe3O4纳米粒子的粒径可为10 nm或15~20 nm。
(7)金属有机前驱体热分解法 是从金属有机前驱体出发,利用有机溶液的高沸点性,使分散在油相中的金属有机前驱体在高温下分解,并结晶成核生长,通过控制各种工艺参数可以控制粒子粒径、形状和晶型。这种高温分解法已被用于制备Fe、Co、Ni等多种磁性纳米粒子。其制得的纳米颗粒结晶度高、粒径可控且分布较窄,但所得纳米粒子为亲油性,颗粒的水溶性较差。
Sun等使用乙酰丙酮铁[Fe(acac)3]代替有剧毒的金属有机化合物Fe(CO)5,以1,2-十六烷基二醇、二苯醚、油酸等作溶剂,其中1,2-十六烷基二醇起着溶剂和还原剂双重作用,在惰性环境下,经过高温裂解、还原反应制备表面以十八胺、油酸作为有机配体的Fe3O4纳米粒子,产物具有非常好的单分散性,粒径均匀,可以小至4 nm,且呈疏水性,可以长期稳定分散于非极性有机溶剂中。随后,FePt、FePt/Fe3O4等多种磁性纳米粒子也用油相高温分解法制备出来。
(8)机器球磨法 其原理是将大的块状Fe3O4或粒径尺寸为微米级的Fe3O4粗粒于球磨机中进行研磨,需要研磨5~20 h。通过钢球之间或钢球与研磨罐内壁之间的撞击,使Fe3O4产生强烈的塑性变形破碎,然后用高速离心机除去粗大粒子。机器球磨法工艺操作简单,工艺成熟,成本低,但是该法易引入杂质,难得到均匀而细小的颗粒,分散性差,晶体缺陷多,颗粒稳定性低,且能耗很大。
倪颂等在水溶液中用行星式球磨机球磨金属铁粉成功制备了Fe3O4纳米粉末,获得了粒径为30~80 nm的颗粒。球料比50∶1、转速300 r/min的球磨罐,在球磨100 h时得到了较为均相的Fe3O4纳米粉末; Cerardo F.Goya在密闭氢气环境中将Fe3O4与甲醇的混合物进行球磨,控制甲醇含量与球磨时间等条件得到了平均粒径为7~10 nm的Fe3O4颗粒。
(9)多元醇法 多元醇法常被用来制备金属纳米Co、Ni,该方法主要利用多元醇作为还原剂,在搅拌状态下将金属盐溶于或悬浮于乙二醇(EG)或聚合乙二醇(PEG)等多元醇中,加热至醇的沸点时,将金属还原。通过控制反应温度或引入外界成核剂,可得到纳米级金属粒子。多元醇法制备的磁性纳米颗粒易分散在水或其他极性溶剂中;另外,颗粒结晶好而具有高的磁性能;最后,与传统制备方法相比,颗粒尺寸的单分散性更好。
刘飚等用氯化亚铁为前驱物,1,2-丙二醇为还原剂,获得了粒径为50~70 nm的Fe3 O4纳米粒子。研究表明,Fe2+发生了歧化反应,反应主要向Fe2+被氧化的方向进行,产物为纳米Fe3O4,在碱性的环境下,纯度为99.38%。
(10)电弧熔化法 电弧熔化法主要是通过电弧对块体材料激发得到纳米颗粒,合成颗粒主要是Ni、Gd-C,平均尺寸为10~50 nm,颗粒形貌为圆形。
4.1.2.3 应用
(1)生物分离 生物分离是指利用功能化磁性纳米颗粒的表面配体(或受体)与受体(或配体)之间的特异性相互作用(如抗原-抗体和亲和素-生物素等)来实现对靶向性生物目标的快速分离。该方法主要包括两个步骤:①将要研究的生物实体标记于磁性颗粒上;②利用磁性液体分离设备将被标记的生物实体分离出来。目前,磁分离方法已经拓展到对细胞、蛋白质和核酸(DNA,RNA)等多种生物的分离和纯化。磁分离技术具有快速、简便的特点,能够高效、可靠地捕获特定的蛋白质或其他生物大分子。
Xu等利用小分子的多巴胺与氨基三乙酸(NTA)结合,对磁性纳米颗粒表面改性。改性后磁性纳米颗粒对六聚组氨酸标记的蛋白质进行分离,每毫克纳米颗粒能够分离的最大蛋白载荷为2~3 mg,其最小分离浓度达到3.3×10-10mol/L。在生物分离研究中,Yu等发现经寡聚苹果酸改性的磁性纳米颗粒用作生物探针时,能特异性识别、捕获其互补核苷酸链段,并能在外加磁场作用下分离纯化,在肿瘤的诊断与治疗方面也显示出巨大的潜力。
(2)靶向热疗 靶向热疗利用物理能量在人体组织中产生热效应,并根据肿瘤细胞和正常细胞对热敏感性的不同而杀死肿瘤细胞。将磁性纳米材料注射到肿瘤组织,外加交变磁场产生热量并均匀释放给肿瘤组织。由于肿瘤组织中血液供给不足,肿瘤细胞中热量扩散较慢,导致局部温度升高,从而杀死肿瘤细胞。顺磁性材料通过奈尔弛豫机制产热,而普通铁磁性颗粒则通过磁滞效应和布朗运动产热。
Ito等制备了包有Fe3O4纳米颗粒的anti-HER2磁性脂质体,研究表明约60%的Fe3O4纳米颗粒融入SKBr3,然后用交流磁场加热至42.5℃,能很好地杀死癌细胞。Zhou等在PEG 6000的存在下用化学共沉淀法制备Fe3O4磁流体,把其注射于VX2兔肝肿瘤部位,热疗后,测得肿瘤部位温度可达41~46℃。
(3)靶向给药 靶向给药基本原理为:磁性载药微球作为药物载体,被注射到体内,于外部施加磁场,利用磁性载药微球的流动性和磁场的诱导性,将磁性载药微球移向病变区,然后药物以受控方式(如pH值、渗透压浓度和温度等)缓慢定位释放,集中在靶区发挥作用。该方法具有使用便捷、可增加病变部位药物浓度、减少毒副作用及提高药效等优点。
林本兰等运用化学共沉淀法制备出粒径均匀、生物相容性好的白蛋白包覆的纳米Fe3O4磁性微球,这种磁性白蛋白微粒不但被用作化疗药物载体,还被用于磁性微球栓塞及磁流体热疗等。Yang发展了一种新型的靶向给药系统治疗恶性肿瘤:在碳纳米管内表面上覆盖一层Fe3O4纳米颗粒形成磁性碳纳米管,5-氟尿嘧啶和顺铂等化学治疗剂就可以结合在碳纳米管的小孔中。磁性碳纳米管能够被迅速摄取进淋巴管中,并且可以保留数天,其间磁性碳纳米管可不断地向局部淋巴系统和淋巴结释放药物,因此可以选择性地破坏肿瘤细胞而不损害正常组织细胞。
(4)磁共振成像造影剂 磁共振成像(MRI)利用生物体不同组织在外加磁场影响下,产生不同的共振信号来成像,信号的强弱取决于组织内水的含量、水分子中质子的弛豫时间;造影剂是用来缩短成像生物体不同组织在外加磁场作用下产生不同的共振时间、增强对比信号差异、提高成像对比度和清晰度的一种试剂,它能改变局部水质子弛豫速率,延长质子弛豫时间,从而检测出正常组织与病变组织的成像差异。
Feng等成功地将具有生物相容性的APTES和PEG包覆在磁性纳米颗粒Fe3O4上,测试显示该磁性纳米颗粒平均粒径为20 nm左右。磁共振成像动物实验显示该种材料在磁共振成像方面很有潜力。Ge等制备出三种不同的磁性纳米颗粒(MNPs),2,3-二巯基丁二酸(DMSA)包覆的MNPs(DMSA@ MNPs)、壳聚糖(CS)包覆的MNPs(CS@ MNPs)和DMSA、CS共同包覆的MNPs(CS-DMSA@ MNPs),其中CS-DMSA@ MNPs的MRI效果最好。
(5)导电性材料 导电磁性材料因优异的性能而在电池、电显示、分子电器件、非线性光学材料、传感器、电磁屏蔽材料和微波吸收剂等众多领域具有广阔的应用前景,因而受到了材料科学界广泛的关注。Juan等制备了Fe3O4-聚苯胺复合颗粒,研究发现室温下其导电性随反应体系pH值升高而降低,再掺杂HCl得到了高磁性和中等导电性的纳米复合颗粒。
(6)催化剂 在多相催化体系中,超细粒子具有高比表面积和高催化活性,但因难以分离和回收,限制了其广泛应用。包淑娟等采用溶胶-凝胶法制备了TiO/SiO/Fe3O4复合光催化剂,以具有偶氮染料结构的甲基橙水溶液为目标反应物,评价其光催化活性。结果表明,其光催化活性高,并可回收利用,具有广阔的应用前景。
(7) Fe3O4磁流体 磁流体是一种新型液态磁性材料,在航空航天、电子、化工、机械、能源、冶金、仪表、环保、生物医疗等领域应用广泛。因Fe3O4纳米粒子矫顽力小、饱和磁化强度高,且廉价易得,是磁流体最常用的磁性粒子。
任欢鱼等利用醇-水共热法制备了Fe3O4磁流体,稳定性和磁性方面的性能都很优越;表面活性剂和磁性颗粒的含量是影响磁流体稳定性的主要因素,表面活性剂越多、磁性颗粒越少,磁流体稳定性越好,但实际生活中应综合考虑生产成本和磁流体的性能。
(8)废水处理 表面带有功能基团的磁性纳米颗粒有着广泛的应用,在废水处理领域的应用也迅速发展起来。这主要是因为磁性纳米颗粒吸附剂有如下优点:①使用外加磁场就可以方便地进行磁性分离,具有分离速度快、选择性好及分离效率高等特点;②纳米颗粒的大比表面积可以增加吸附容量;③功能基团往往都分布在磁性纳米颗粒的表面,大大减小了扩散阻力,加快了吸附速率。如2-巯基丁二酸修饰的Fe3O4纳米颗粒被用来去除废水中的Hg、Ag、Pb、Cd和Tl;腐殖酸修饰的Fe3O4纳米颗粒可以有效去除废水中的重金属离子;聚丙烯酸修饰的Fe3O4纳米颗粒可以有效去除废水中的亚甲基蓝染料。
(9)光子晶体 光子晶体(photonic crystals,PC)即光子带隙(PBG)材料,是一类由单分散的胶体结构单元自组装而成的介电常数周期性变化排列的微结构材料。自组装技术是构造三维光子晶体的方法之一,其具体操作是将单分散的胶体颗粒分散于乙醇、水等溶液中,通过自然沉积的方法合成光子晶体。模板法可以用来快速合成光子晶体,除此以外,通过引入外场来调控胶体颗粒自组装成有序结构,也是合成光子晶体的一种常用方法。
近年来,Xu等利用外加磁场的作用,将单分散的磁性高分子复合微球自组装成了磁性光子晶体,为快速、高效制备光子晶体提供了一条新途径。最近,Yin研究组也报道了通过高温水解法合成了Fe3O4胶体光子晶体,具有禁带宽度可调的优异性能。
4.1.2.4 展望
由于磁性纳米颗粒具有很大的比表面积,且本身又具有磁性,存在永久性的团聚作用,因此,制备颗粒尺寸均匀可控的磁性纳米颗粒、开发分散性好的多功能材料仍是今后研究的热点。预计今后几年的研究将主要集中于:①如何最优化磁性纳米颗粒的制备和性能,使其具有强磁响应性能,进而满足不同领域的应用要求;②提高磁性纳米颗粒的稳定性,因为磁性纳米颗粒在固相载体系统中的稳定性情况直接影响它的应用效果;③制备具有多功能的磁性纳米颗粒,提高表面的功能化和配体的键合效率。
以上综述了磁性纳米颗粒在生物医学、导电磁性材料、催化剂、磁流体、废水处理和光子晶体中的应用,这些应用涉及电子学、磁学、生物学、环境学等多种学科,是多学科的交叉。磁性纳米颗粒的研究趋势是多功能化、多学科交叉。
4.1.3 金磁纳米复合微粒
基于上述Fe3O4纳米微粒的特点,科学研究表明若在其表面包裹一层性能稳定的金属或金属氧化物纳米微粒形成核壳状的复合磁性纳米材料,可以改善其物理化学性能。常用的包覆材料有表面活性剂、合成高分子、生物高分子、无机材料等。纳米金能与含氨基、巯基等功能基团的抗体抗原、修饰有功能基团的生物分子牢固结合,具有良好的生物相容性,且结合后生物分子的生物学活性不发生改变。结合纳米金和Fe3O4纳米颗粒的优缺点,以纳米粒子或磁性纳米微粒的聚集体为核,在核表面包覆单质金、银等贵金属壳层,形成的磁性复合微粒称为金磁纳米微粒。
磁性颗粒粒径较小,比表面积较大,悬浮稳定性好,结合目标分子后利用磁分离器可快速实现待测物质与干扰物质的分离,清除干扰物的同时有效地富集目标物。常用的磁性颗粒为Fe3O4纳米颗粒,但其稳定性差,容易团聚,表面功能基团少;由于胶体金能与含氨基、巯基等功能基团的抗体抗原、修饰有功能基团的生物分子牢固结合,具有良好的生物相容性,且结合后生物分子的生物学活性不发生改变。
金磁纳米微粒具有外磁场中可分离性和胶体金的生物快速固定化等特点,金磁纳米微粒的合成和应用已成为各国研究者的关注热点。根据结构、组成的不同,金磁纳米微粒可分为核壳型和组装型:在磁性微粒表面直接将Au3+还原为Au,得到核壳型金磁纳米微粒;将磁性纳米微粒经过有机试剂的修饰,通过Au-S、Au-N等原子之间相互作用而将胶体金吸附在磁性颗球表面,得到组装型金磁纳米微粒。
2001年崔亚丽课题组最先研究核壳结构的金磁复合颗粒,成功合成了核壳结构的纳米级Fe3O4/Au金磁微粒和组装型微米级Fe3O4/Au金磁微粒,将其成功运用于免疫学检测和抗体固定化等方面。该课题组合成的平均粒径5 μm的组装结构Fe3O4/Au金磁微粒,分别合成纳米级Fe3O4粒子和Au纳米颗粒,之后将Fe3O4粒子进行表面硅烷化处理,使其表面引入—SH基团,再将纳米金与处理后的磁颗粒充分反应,最终得到组装型Fe3O4/Au金磁微粒。目前,将Au纳米颗粒包覆在Fe3O4磁性颗粒表面上形成金磁复合纳米颗粒作为固相载体应用于医学、生物学检测的例子已十分常见。
4.2 金磁纳米复合微粒的制备
4.2.1 金纳米材料的制备及表征
4.2.1.1 纳米金的制备
将玻璃器皿全部清洗干净,并用铬酸浸泡过夜,清洗干净后放入烘干机中烘干。取5 份0.01%氯金酸水溶液100 mL分别于250 mL锥形瓶中,标号分别为1、2、3、4、5,瓶中放置数粒防爆珠,于恒温磁力搅拌器中加热至沸腾,在手动晃动下逐滴加入1%柠檬酸三钠溶液1.0 mL,1.5 mL,2.0 mL,2.5 mL,3.0 mL,继续晃动加热10 min,取下锥形瓶继续晃动10 min,其间观察颜色变化。待室温冷却后,将所得5份胶体金溶液转移至棕色试剂瓶4℃下保存备用。
4.2.1.2 纳米金的表征
(1)目测法 用肉眼观察所制得的纳米金溶液,观察其颜色、均匀度和透明度。良好的胶体金应该是清亮透明的,若制备的纳米金混浊或液体表面有漂浮物,表明此次制备胶体金不成功。纳米金颗粒直径不同,其光散射作用也不同,所以制备出不同粒径的金溶胶时,由于其光散射作用的不同使其在外观上呈现的颜色也会有较大差异。微小颗粒胶体呈红色,但不同大小的胶体呈色有一定的差别。最小的胶体(2~5 nm)是橙黄色的,中等大小的纳米金溶胶(10~20 nm)是酒红色的,较大颗粒的纳米金溶胶(30~80 nm)则是紫红色的。用肉眼观察实验所制备的纳米金溶液,可见加入1%柠檬酸三钠体积分别为1.5 mL、2.0 mL、2.5 mL、3.0 mL的颜色相差不大,均为酒红色,清亮透明,无悬浮物;而加入1%柠檬酸三钠体积为1.0 mL的颜色为紫红色,亦清亮透明,无悬浮物。初步推测其粒径在10~20 nm,与参考文献相符,初步判断其符合实验要求,有进一步鉴定的价值。
(2)紫外法 用紫外可见分光光度计在可见光范围内(400~600 nm)对纳米金溶液进行波长扫描分析,获得纳米金可见光区吸收光谱,记录最大吸收波长。
扫描纳米金的吸收光谱,是一种简单易行的纳米金质量鉴定方法。金纳米微粒溶液呈现出颜色主要是因为等离子体共振吸收,而这个吸收与金纳米微粒的形态以及结构等有关。所以通过紫外可见光谱,可以得到颗粒粒度以及结构等信息。将冷却后的纳米金溶液,以双蒸水作对照,用紫外可见分光光度计在400~600 nm范围内进行扫描,测定吸收曲线和吸收峰,确定最大吸收峰。纳米金溶胶在可见光范围内有一单一光吸收峰,这个光吸收峰的最大吸收波长(λmax)在510~550 nm,随纳米金溶胶颗粒大小而变化,大颗粒纳米金溶胶的λmax偏向于长波长,反之,小颗粒纳米金溶胶的λmax则偏向于短波长,吸收峰宽度越小,标准偏差越小,说明颗粒越均匀;吸收峰宽度越大,标准偏差越大,说明颗粒越不均匀,可能会出现椭圆形或多三角形颗粒。实验所制备的5组胶体金溶液在400~600 nm扫描图谱如图4.1所示。
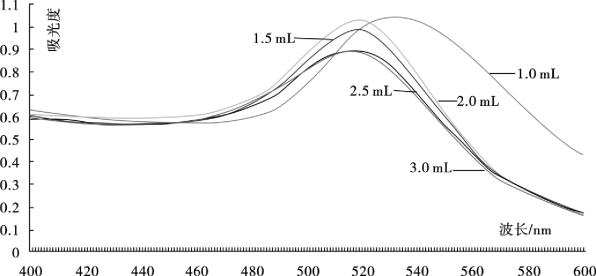
图4.1 胶体金溶液400~600 nm扫描图谱
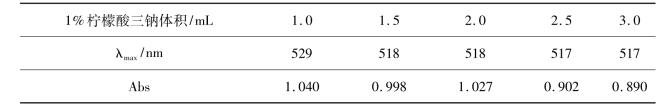
各组纳米金溶液吸收峰最大波长及吸光度值如表4.1所示。
表4.1 各组纳米金溶液峰最大吸收波长及吸光度值
(3) pH值的测定 由于金颗粒容易吸附于电极上使之堵塞,故不能用pH计测定胶体金溶液的pH值,一般使用精密pH试纸。柠檬酸三钠还原法制备纳米金,在柠檬酸三钠还原剂的作用下,氯金酸水溶液中的金离子还原成金原子,并聚集成一个微小的晶体金核,同时晶核周围吸附一定的氯金酸离子、氢离子和柠檬酸离子形成吸附层,依靠静电作用形成稳定的胶体溶液。因此制备的纳米金应该呈酸性,用精密pH试纸测定纳米金溶液的pH值为5.8。
4.2.2 磁性微粒Fe3O4的合成与表征
磁性微粒Fe3O4是合成金磁复合微粒的必要物质,只有合成高性能的磁颗粒,才能在其表面有效包金,实现目标产物-金磁复合微粒的合成。
4.4.2.1 磁性微粒的合成
本实验利用化学共沉淀法合成Fe3O4简便易行。氯化铁和氯化亚铁在碱性条件下加热发生下面反应:
Fe2++ 2Fe3++ 8OH═══- Fe3O4↓+ 4H2O
控制总铁量与碱量的配比、反应物浓度、反应pH值、反应温度以及加料、搅拌方式等反应条件使其生成单一相的Fe3O4磁性颗粒,用磁分离器进行分离,然后用无水乙醇和高纯水洗涤至中性备用。具体合成步骤如下:
(1)将0.8 mol/L FeCl3溶液和0.8 mol/L FeCl2溶液按一定配比加入到三颈瓶中,同时加入表面活性剂2 mL,用超纯水稀释至总体积100 mL,电动搅拌下混合均匀后通N2 15 min,除去水中溶解氧;
(2)室温搅拌下,采用氮气保护,向体系中缓慢滴加28 mL 1 mol/L NaOH溶液,使体系pH>11;
(3)氮气保护下,搅拌溶液30 min后,将溶液转移至烧杯中,置于70℃水浴锅中陈化30 min;
(4)陈化结束后超声分散30 min;(www.daowen.com)
(5)将烧杯置于磁分离器上磁分离3 min,用超纯水和无水乙醇洗至中性,定容到100 mL容量瓶中;
(6)采用真空或冷冻干燥得到固体粉末,对其进行表征,以备后用。
4.4.2.2 磁性微粒的表征
实验过程中对磁性微粒合成影响较大的因素(铁量与碱量的配比及表面活性剂的选择)进行了优化,优化条件如表4.2所示。
表4.2 磁性微粒不同反应条件优化

对4个条件下合成的磁性微粒进行了系统表征,表征结果如下:
(1)红外光谱(IR)表征 Fe3O4晶体里Fe—O键的红外特征吸收为557 cm-1,从图4.2中可以看到:在557 cm-1处有一个明显的吸收峰,可以初步判断该晶体为Fe3O4磁性微粒。
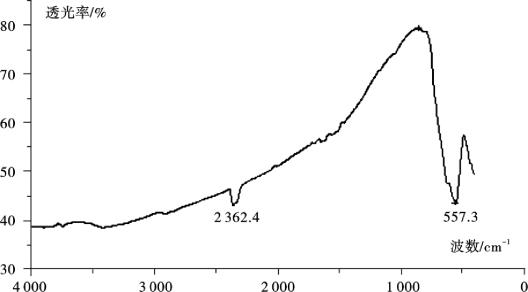
图4.2 磁性微粒IR谱图
(2)扫描电子显微镜(SEM)表征 扫描电镜(SEM)是利用电子和物质的相互作用,获取被测样品本身物理、化学性质信息,如形貌、组成、晶体结构、电子结构和内部电场或磁场等。从图4.3可以看出: 4种实验条件下合成的磁性微粒粒径不同,1号磁性微粒颗粒较小,相对分散性较好,可应用于后续实验。

图4.3 磁性微粒SEM观察
(注: 1、2、3、4分别为表4.2实验编号下的4种磁性微粒)
(3)粒度分布测定 利用激光粒度仪进行粒度分析,4种磁颗粒显示出不同的粒径大小,如图4.4所示: 1号平均为1 μm,2、3、4号均在1 μm以上,粒径大于1号。1号磁性微粒粒径最小,所以选择1号磁性微粒用于金磁微粒的合成单体。
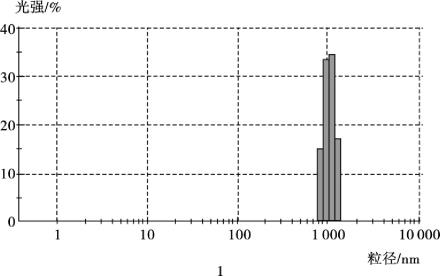
图4.4
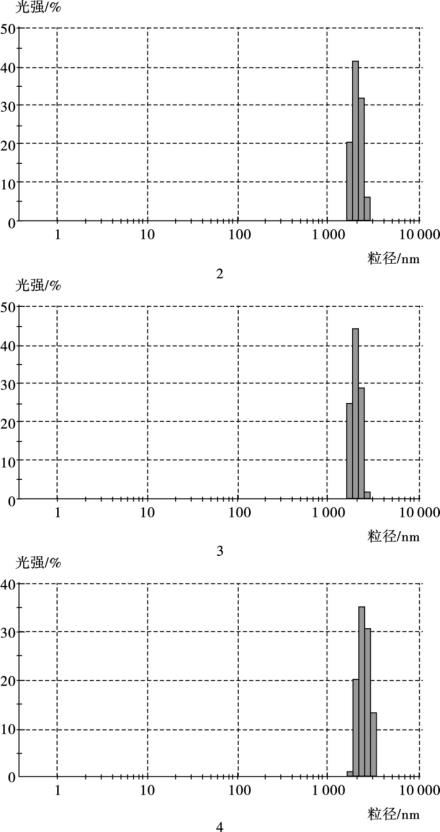
图4.4 磁性微粒粒度测定
(注: 1、2、3、4分别为表4.2实验编号下合成的磁性微粒)
(4)磁性分析 对不同条件下合成的磁颗粒比较磁性情况,如图4.5所示,4种磁颗粒均呈黑色,磁颗粒均匀悬浮于溶液中,且无外加磁场作用,未发生沉降,分散性较好;在溶液底部施加磁场后,磁颗粒迅速沉降至溶液底部,上清液澄清透亮,分离效果良好,说明合成的磁性微粒磁性较强,顺磁性较好。

图4.5 磁性微粒磁性效果
A:磁分前B:磁分后
4.2.3 金磁复合微粒Fe3O4@ Au的合成与表征
4.2.3.1 金磁复合微粒的合成
合成步骤如下:
(1)取500 μL 4 mg/mL的Fe3O4种子悬液,加入2.5 mL 0.1% HAuCl4水溶液,置恒温摇床室温振荡1 h;
(2)加入1 mL 80 mmol/L盐酸羟胺溶液,混合均匀,置摇床上振荡1 h;
(3)反应结束后磁性分离弃上清,加入2 mL 1 mol/L盐酸溶液,置摇床上振摇2 h; (4)磁性分离,去上清液,用超纯水洗涤至中性,PBS适当稀释后4℃保存。
4.2.3.2 金磁复合微粒的表征
(1)外观比较及磁性分析 从磁颗粒和金磁微粒的外观来看,磁颗粒呈黑色,金磁颗粒呈现棕红色,这是Au还原后包覆在Fe3O4表面呈现的颜色,同时说明达到了有效包金的目的;金磁微粒分散性良好,不会自然沉降,在磁场作用下,金磁复合微粒能够快速沉降,迅速实现液固分离,表现出良好顺磁性,如图4.6所示。

图4.6 磁性微粒与金磁复合微粒外观比较
(2) IR表征 Fe3O4晶体里Fe—O键的红外特征吸收为557 cm-1,从图4.7中可以看到:在557 cm-1处有一个明显的吸收峰,可以初步判断该晶体为Fe3O4磁性微粒。
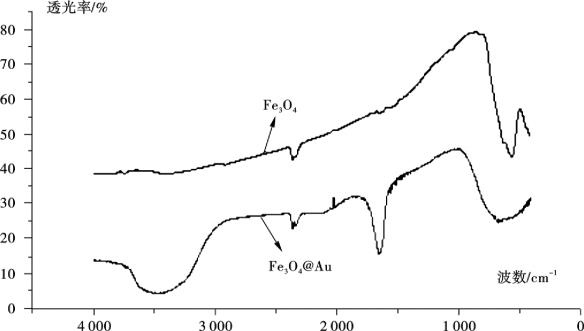
图4.7 磁性微粒、金磁复合微粒IR谱图
(3)粒度测定 金磁复合微粒平均粒径为1 990 nm,比磁性微粒(图4.41号,平均粒径1 106 nm)略有增加,原因是Au包覆到Fe3O4表面,造成粒径有所增大,形成新的核壳结构复合物。如图4.8所示。
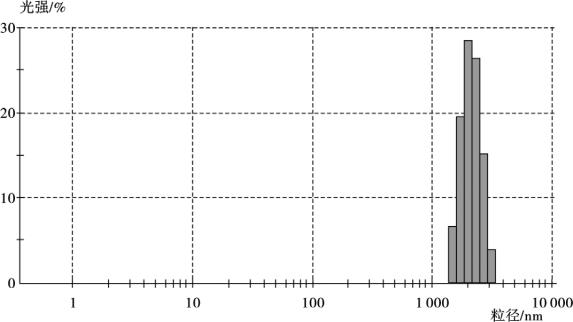
图4.8 金磁复合微粒粒径图
(4) Zeta电位分析 Zeta电位结果分析:金磁纳米粒子是HAuCl4在盐酸羟胺为还原剂的作用下,在Fe3O4表面原位包覆生成的,金纳米粒子的表面吸附一层[AuCl2]-,因此,金磁复合微粒表面带有负电荷。Fe3O4磁性微粒是通过与NaOH溶液反应得到的,其表面含有羟基,因此也带有负电荷。
在pH =7时,测量磁性微粒和金磁复合微粒的Zeta电位(图4.9,图4.10),Zeta电位分别为-10.5 mV,-30.1 mV。金磁颗粒的Zeta电位与磁颗粒相比,其绝对值显著增加,说明制备的Fe3O4@ Au复合颗粒经过表面修饰,其在水溶液中的分散稳定性明显提高。
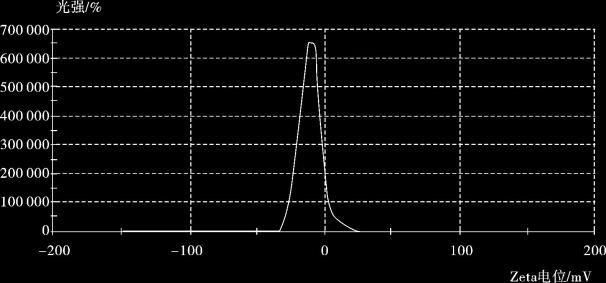
图4.9 磁性微粒Zeta电位图
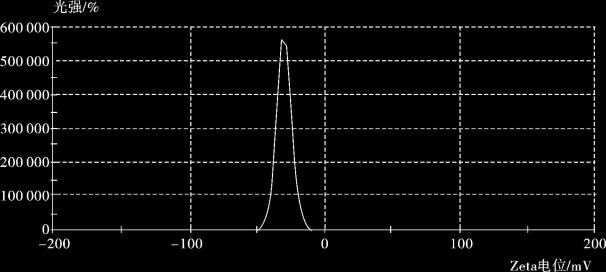
图4.10 金磁复合微粒Zeta电位图
4.3 纳米金免疫层析试纸条的应用
4.3.1 试纸条组装步骤
(1)样品垫的处理:剪裁好需要的玻璃纤维样品垫(长2 cm,宽1.5 cm)浸泡于0.01 mol/L pH值为7.4的PBS缓冲液中,15 min后将玻璃纤维取出真空干燥12 h,放于干燥器中保存备用。
(2)金标垫处理:剪裁好需要的玻璃纤维(长2 cm,宽1.2 cm)浸泡于金标垫处理液中,15 min后将玻璃纤维取出真空干燥12 h,用微量加样器以每1.2 cm×1.0 cm滴加120 μL的量将金标抗体点喷于金标垫上,37℃真空干燥2~3 h,密封保存备用。
(3)将黄曲霉毒素B1抗体标记于胶体金的作为免疫胶体金包被于金标结合垫,将AFB1-OVA最优浓度按1 μL/cm包被于硝酸纤维素膜(NC膜)作为检测线,将羊抗鼠抗体最优浓度按1 μL/cm包被于检测线后侧作为质控线。
(4)撕去塑料底板(PVC背衬)中间的牛皮纸,小心将包被有黄曲霉毒素B1(检测线)和羊抗鼠IgG(质控线)的NC膜平贴于洁净的白色PVC支持板上。
(5)撕去PVC背衬中间靠近检测线一端的牛皮纸,粘贴金标结合垫(包被有胶体金黄曲霉毒素B1抗体复合物),并与NC膜叠加4 mm左右。
(6)撕去PVC背衬上靠近金标结合垫一端的牛皮纸,粘贴样品垫,并与金标结合垫重叠4 mm左右。
(7)撕去PVC背衬上靠近质控线一端的牛皮纸,粘贴吸水纸,并与硝酸纤维素膜重叠4 mm左右。
(8)用切条机切成4 mm宽的试纸条,干燥、密封、4℃保存。
最终组成示意如图4.11所示。
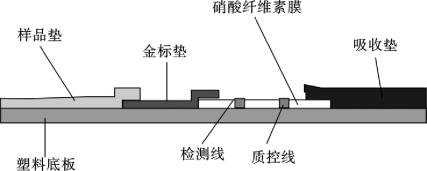
图4.11 胶体金试纸条组装示意
4.3.2 测试原理
竞争性免疫层析适用于检测带有单一抗原表位的小分子抗原,常用于农兽药残留、违禁药物的检测等。将胶体金与针对待测抗原的特异性抗体(Ab1)偶联,沉积在结合区。而检测区固相化与待测抗原或其类似物相同的已知抗原。若样品中含有待测抗原,则和带有标记物的Ab1形成金-Ab1-Ag复合物。随后在通过固相化有待测抗原或其类似物的检测区时,由于竞争抑制,不再发生反应,检测线不显色;样品继续前移,金-Ab1-Ag复合物被固相化在质控线处的抗Ab1抗体(二抗Ab2)所结合,形成金Ab1-Ag-Ab2复合物,质控线显色。
将黄曲霉毒素B1抗体标记于胶体金的作为免疫胶体金,将AFB1-OVA包被于NC膜作为检测线,将羊抗鼠抗体包被于检测线后侧作为质控线。加样检测,若样品中含有黄曲霉毒素B1时,首先与免疫胶体金结合形成复合物,此复合物向前涌动到检测线位置,免疫胶体金表面位点由于被黄曲霉毒素B1占据而使其不能与检测线的AFB1-OVA结合,此时检测线位置由于不能拦截胶体金而不显色或显色弱,将此检测结果视为阳性;而当样品中不含黄曲霉毒素B1时,免疫胶体金涌动到检测线位置时将被AFB1-OVA捕获,胶体金聚集于检测线上将呈现肉眼可见的红色条带,此检测结果视为阴性;当检测线与质控线均无红色条带出现时,说明试纸条失效。如图4.12所示。
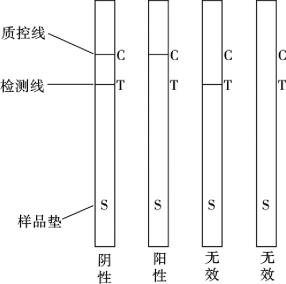
图4.12 竞争法免疫层析试纸条结果判定示意图
4.3.3 试纸条的灵敏度测试
将AFB1标准品配制为1.0 mg/mL的储备液,用甲醇∶PBS(V∶V = 1∶4)配制成0 ng/mL、20 ng/mL、25 ng/mL的标准系列溶液。用金标试纸条测试上述标准系列溶液,10~15 min内观察,质控线显红色而检测线不显色者为阳性(+ ),两条红色线者为阴性(-)。
4.4 基于金磁复合颗粒的ELISA法对实际样品中生物毒素DON的测定
4.4.1 实验方法
(1)包被 用0.05 mol/L CB(pH值9.6)梯度稀释DON免疫金磁复合颗粒或OVA(对照),分别加入微孔板的孔中,每孔100 μL。将微孔板放置于37℃恒温箱中,孵育2 h,用PBST洗板1次。
(2)封闭 用0.5% OVA的PBS作为封闭液,300 μL/孔加到96孔中。将微孔板放置于37℃恒温箱中,孵育1 h,用PBST洗板2次。
(3)加样 用含10%甲醇的PBS配制的DON溶液或样品提取液与等体积的抗体混合并振荡,室温静置15 min后,加入相应板孔中,每孔100 μL。将微孔板放置于37℃恒温箱中,孵育1 h,用PBST洗板3次。
(4)加酶 将HRP-lgG羊抗鼠免疫球蛋白用含0.5% OVA的PBS稀释,加入到相应的板孔中,每孔加100 μL。将微孔板放置于37℃恒温箱中,孵育1 h,用PBST洗板4次。
(5)显色 每孔先后加入100 μL显色剂A和B,避光37℃温育反应30 min。
(6)终止反应 温育反应后,每孔加入100 μL终止液(2 mol/L的H2SO4)。
(7)检测 终止反应结束后,立即在酶标仪上检测各孔的吸光度A,检测波长为450 nm。
4.4.2 实际样品前处理
首先将待测的玉米、小麦样品用高速万能粉碎机粉碎,过300目筛,分别称取15 g置于50 mL具塞玻璃瓶中,加20%乙醇溶液30 mL,盖塞后旋涡混合1 min,150 r/min震荡30 min,再旋涡1 min。转入离心管,4 000 r/min离心15 min,取上清液4℃保存备用,使用时与分析缓冲液等体积混合。
4.4.3 实际样品的检测
在玉米、小麦滤液中,分别加入DON标准品,配制浓度为0.01 ng/mL、1 ng/mL、5 ng/mL、15 ng/mL、20 ng/mL五个待测品溶液,用建立的方法检测,每个浓度测定6次,建立玉米、小麦样品的标准曲线,并考察实际样品的准确度、精密度和灵敏度。
4.4.4 实际样品的工作曲线
建立该方法检测玉米、小麦中的DON的工作曲线。将玉米、小麦中DON的工作曲线和DON标准曲线进行比较,如表4.3所示,实际样品中的相关系数降低,推测在实际样品的检测中会受到其他的影响,对DON含量的测定有一定干扰。
表4.3 实际样品与标准品回归方程和相关系数的比较

4.4.5 准确度考察
在空白小麦、玉米样品基质中,加入低、中、高(0.1 ng/mL、5 ng/mL、20 ng/mL)三水平浓度的DON标准品,测定加标孔的发光值,每个浓度平行测定6次,根据标准曲线求测得含量,再得出加标回收率,实际样品中准确度的考察主要就是通过回收率来体现的。结果见表4.4,该方法检测DON在小麦样品低、中、高三个水平浓度的回收率范围为85.2%~126.2%,在玉米样品低、中、高三个水平浓度的回收率范围为98.2%~120%。
表4.4 DON在实际样品中的准确度(n =6)

4.4.6 精密度考察
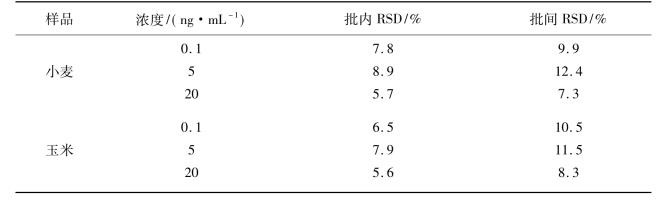
在空白小麦、玉米样品基质中,加入低、中、高(0.1 ng/mL、5 ng/mL、20 ng/mL)三水平浓度的DON标准品,测定加标孔的发光值,每个浓度平行测定6次。结果如表4.5所示。该方法检测DON在小麦样品低、中、高三个水平浓度的批内RSD范围为5.7%~8.9%,批间RSD范围为7.3%~12.4%;该方法检测DON在玉米样品低、中、高三个水平浓度的批内RSD范围为5.6%~7.9%,批间RSD范围为8.3%~11.5%.
表4.5 DON在实际样品中的精密度(n =6)
4.4.7 灵敏度考察
采用所建立的方法分别检测小麦、玉米实际样品的10个零标准品的发光值,根据X-2SD,代入各自的回归方程,求出各自的检测限,结果如表4.6所示,小麦中DON的检测限为0.054 ng/mL,玉米中DON的检测限为0.045 ng/mL。
表4.6 实际样品中DON的检测限

免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。





