痴呆(dementia)是一种以慢性、获得性、进行性智能损害为特点的神经变性疾病。患者丧失智力、注意力、判断力、记忆力和语言,并伴随人格的改变和其他一些神经特征。痴呆按照发病的原因可分为:①原发性神经变性痴呆,如早老性痴呆(Alzheimer's disease,AD)、额叶性痴呆(Pick病)、亨廷顿病(huntington's disease,HD)、帕金森病伴痴呆(Pakinson's disease with dementia,PDD)、进行性核上性麻痹(progressive supranuclear palsy,PSP)、进行性皮质下胶质增生等;②血管性痴呆,如多发性脑梗死性痴呆(multi-infarct dementia,MID)等;③继发性痴呆可由脑积水、颅内感染和中毒性疾病引起,如克—雅病性痴呆(Creuzfeldt-Jakob disease,CJD)和艾滋病痴呆综合征(AIDS dementia complex,ADC)等。
痴呆的诊断分为两个步骤:首先确定是否为痴呆(即真性痴呆和假性痴呆的鉴别),然后进一步确定引起痴呆的病因和疾病。诊断方法为综合利用多种手段,包括临床病史和症状、神经心理量表、神经影像学(CT、MRI、SPECT、PET等)、神经电生理及实验室检查等。本节主要介绍SPECT及PET在痴呆中的应用及研究。
一、脑血流灌注/血流显像
SPECT脑血流灌注显像(perfusion imaging)是核医学影像技术在神经系统疾病基础研究和临床诊断中最常用的方法,已经广泛应用于各种脑部疾病和精神活动障碍疾病的诊断以及脑生理功能和病理生理的研究,成为神经和精神病学有用的影像学技术之一。随着SPECT脑血流灌注显像在临床广泛应用,PET脑血流显像因受设备条件限制,加之检查方法复杂,应用明显减少,本节仅作简要介绍。
(一)SPECT脑血流灌注显像
1.原理脑血流灌注显像是利用脑血流灌注显像剂和SPECT显示脑的血流灌注与功能的成像方法。由于具有脂溶性、电中性和低分子量的脑显像剂可以自由通过完整的血脑屏障(blood brain barrier,BBB),其入脑量依赖于脑灌注血流量和功能,所以,在体外用SPECT仪所获得的影像既反映脑血流灌注,又反映脑功能。运用SPECT的计算机技术可以分析和定量某区域脑组织的脑血流灌注和功能,因此脑血流灌注显像也称局部脑血流(regional cerebral blood flow,rCBF)显像。
2.显像剂
(1)99m Tc标记的脑血流灌注显像剂99m Tc的物理特性最适用于显像,它的物理半衰期为6.02 h,发射单一的γ射线,其能量为140 KeV。99m Tc由发生器生产,使用方便、安全,故99m Tc标记的脑血流灌注显像剂得到广泛应用。常用的有锝(99m Tc)-双半胱乙酯(99m Tc-ethyl cysteinate dimer,99m Tc-ECD)和锝(99m Tc)-六甲基丙烯胺肟(99m Tc-hexamethyl propyleneamine oxime,99m Tc-HMPAO)。二者均依靠单向被动扩散通过BBB进入脑组织,然后失去脂溶性并转变成带有电荷的亲水性化合物,不能再反向通过BBB,可以较长时间地滞留在脑组织内。
1)99m Tc-ECD:以TcO+3作为中心离子,通过化学键和配位键与配体分子相连形成螯合物。99m Tc-ECD的脑摄取率为4.6%~7.6%,使用量740~1 110 MBq(20~30 mCi),静脉注射。99m Tc-ECD的主要优点是脑摄取率高,放化稳定性极好,制备后放置24 h放化纯度仍超过90%,体内从肾脏排泄快,允许在同一天或若干小时内进行重复显像,使用方便,适于特殊检查和介入研究。主要缺点是脑内分布有轻微变化,脑内总放射性1 h减少约10%。
2)99m Tc-HMPAO:99m Tc-HMPAO螯合物的形成类似99m Tc-ECD。99m Tc-HMPAO脑摄取率为3.5%~7.0%,使用量740~1 110 MBq(20~30 mCi),静脉注射。99m Tc-HMPAO的主要优点是脑摄取率高,脑内分布相对稳定;主要缺点是放化纯度不很稳定,制备后快速降解,必须在短时间内(<30 min)注入人体。
(2)123 I标记的胺类化合物123 I由加速器生产,衰变类型为电子俘获,不发射β射线,其主要γ射线的能量为159 KeV(83%),物理半衰期为13.2 h。其物理学特性适合于SPECT显像,国外早在20世纪80年代初就应用于脑灌注显像,但由于我国尚未生产,故使用受到限制。常用的显像剂为碘(123 I)-异丙基安菲他明(123 I-isopropyliodoamphetamine,123 I-IMP),进入脑组织的机理同99m Tc-ECD。
123 I-IMP是从一系列123 I标记的碘代苯烷基胺中筛选出来的,脑摄取量为注入量的8%。123 I-IMP在脑内的放射性浓集量是一个逐渐积累的过程,在注射后20~30 min达到平衡,1 h内脑内分布相对稳定。此后,因123 I-IMP在脑内不断被洗出、在肺内摄取并不断地释放,加之脑组织的再摄取,脑内123 I-IMP的分布就不再按固定比例反映脑血流的灌注情况。如缺血性脑血管疾病,静脉注射3 h后行延迟显像,原有的缺血区会逐步消失,甚至变成高灌注区。延迟影像的这种“再分布”现象反映局部脑组织的生存能力,它和脑神经细胞的代谢有关。123 I-IMP使用量111~222 MBq(3~6 mCi),静脉注射给药。
(3)惰性气体显像剂氙(133 Xe)是一种中性脂溶性惰性气体,主要γ射线能量81 keV,半衰期为5.3 d。是依靠浓度差被动扩散通过BBB,被脑细胞摄取后,在脑内滞留的时间短暂,其入脑和出脑是正逆双向过程。
吸入的133 Xe在肺泡内交换进入动脉血中,很快弥散入脑并被血流清除经肺呼出。脑组织摄取和洗脱133 Xe的量和脑血流成正比,脑的初期摄取量较高。使用133 Xe不但可以定量测定局部脑血流量,而且可分别计算灰质和白质的血流量,还可重复多次检查。主要缺点在于133 Xe以弥散方式通过血流屏障的能力是双向性的,在脑内滞留的时间较短,维持高放射性的时间仅5 min左右,难以获得高质量的影像,且需要高速和高灵敏的SPECT仪。133 Xe使用量185~370 MBq(5~10mCi)/1~2ml。
3.检查方法
(1)患者准备
1)使用99m Tc标记的放射性药品前,用过氯酸钾封闭器官,阻止甲状腺摄取显像剂,减少辐射剂量;抑制脉络丛分泌,降低对脑显像的干扰。一般在检查前0.5~1 h口服过氯酸钾,因过氯酸钾是一种氧化剂,有一定的腐蚀作用,服用后应饮水200 ml。使用123 I标记的放射性药品时,需用复方碘溶液封闭甲状腺,一般在检查前2~3 d开始服用,检查后仍需服用2~3 d,即连续服用5~6 d。
2)向接受检查的患者说明检查项目的意义和临床价值,取得患者合作;令受检者闭目或带黑色眼罩,用耳塞塞住外耳道口,5 min后由静脉注射显像剂;对不能配合检查的患者,在显像剂注射5 min之后注射镇静剂,避免脑血流灌注、脑功能和脑代谢受到影响。
(2)图像采集
1)仪器条件:SPECT探头配置低能高分辨型、通用型或会聚型准直器;探头旋转半径以12~14 cm为宜;采集矩阵128×128,旋转360°,3.2°~6.4°/帧;99m Tc标记物15~20 s/帧,123 I标记物40~60 s/帧,共采集64~128帧投影像; 99m Tc标记物能峰140 keV,窗宽15%;123 I标记物能峰159 keV,窗宽15%;脑组织的净计数率40~80 k/帧或者3~5 k/s。
2)采集方法:注射99m Tc-ECD或99m Tc-HMPAO后30 min显像,注射123 I-IMP后10 min即可开始图像采集。令患者平卧于检查床上,头部枕于头托中,用胶带固定体位,保持体位不变直至检查完毕;若采用体外OM线显像时,调节头托使眼外眦和外耳道的连线与地面垂直;调节探头的旋转半径和检查床的高度,即在不影响探头的旋转并避免碰撞患者肩部的情况下,探头平面尽可能贴近头颅使其适于脑显像的要求;显像期间把检查房内的灯光调暗,并保持室内安静。
(3)图像处理
1)影像重建:图像采集完成后,使用计算机软件进行脑的影像重建。首先进行OM线校正。然后作数据前滤波,前滤波的最佳参数各家仪器不尽相同,可通过实验确定最佳值。推荐使用Butterworth滤波:123 I标记物推荐使用截止频率(fc)= 0.5,陡度因子(n)= 12;99m Tc标记物推荐使用fc= 0.35~4.0,n=12~20,继而用反投影或迭代法重建横断面影像。若使用Ramp滤波,推荐层厚2~6 mm;衰减校正系数(μ)也因各家仪器不同而要通过试验确定。推荐采用Sorenson法和Chang法进行衰减校正,使用123 I标记物时,推荐μ=0.11 cm-1;使用99m Tc标记物时,推荐μ= 0.12 cm-1。最后在重建横断面影像的基础上,重建冠状面、矢状面的断层影像。必要时重建三维立体影像,阈值30%~40%。
2)半定量分析技术:目测读片往往带有主观因素,并受到阅片者的经验等影响。半定量分析的目的就是在于尽可能地消除人为因素。进行半定量分析首先要选择提供分析的脑断层层面,然后在所选的各个层面上划出感兴趣区(ROI)。多数情况下选择能清晰显示额叶、颞叶、基底节、丘脑和小脑的数个横断面作半定量分析。必要时也可选择冠状面或矢状面,感兴趣区的大小以4~6个像素为佳。
半定量分析可用与对侧镜像相应部位的放射性比值作为参照,也可以选用小脑计数、全脑计数、单侧大脑计数、基底核计数作为对照。
两侧相应部位对比是最早使用的半定量方法,其病理生理基础是人体大脑半球左右对称。正常情况下左右大脑半球对应部位放射性差异小于10%,大于10%被视为异常。但该方法不能用于左右大脑半球对称部位局部血流量均下降的病例。
由于小脑的局部血流量相对较为恒定,因此被许多学者选来作为参照标准。但在具体操作时有不同方法,有人用双侧小脑的平均计数作为参照,也有人取单侧小脑计数。进一步的研究认为,在某些病理条件下,小脑的血流也会有一定的改变。因而产生了以全脑、一侧脑或基底节作参照的方法。老年性痴呆者往往基底核局部血流量没有大的改变,这时以基底节作为参照物就更具有诊断意义。
4.图像分析
(1)正常图像大脑额、顶、颞、枕叶皮质(影像上所见宽度5~8 mm)的放射性分布高于白质和脑室部位,即周边放射性浓影。丘脑、基底节、脑干等灰质核团的放射性分布与脑皮质相近且高于白质,呈“岛状”团块浓影。小脑皮质放射性分布亦高于髓质。由于入脑的显像剂和脑的血流灌注量及脑细胞摄取功能成比例,所以,影像上所见的放射性分布高低,反映不同局部脑血流灌注、脑神经细胞功能活跃程度(见彩图9-2-1~4)。
1)额叶:双侧额叶皮质横断层像可见几个类圆形浓团,为额叶的沟回;内侧面则为半球内面和扣带回共同构成。双侧额叶皮质内侧放射性分布减淡区为额叶白质和双侧脑室的前角。
2)顶叶:横断层像可见双侧多个类圆形浓团,由前向后为中央后回、缘上回、顶上回和角回。内侧放射性分布减淡区为顶叶白质和脑室。
3)枕叶:外侧面枕极部位由于皮质向内折皱少,无大的脑沟,故放射性分布薄而少,有时出现双侧对称性等大的放射性分布变窄或中断。双侧内面可见明显的“X”形浓影,主要是顶枕裂内侧皮层、距状裂和辅助视皮质构成。若视觉封闭好,该区放射性分布和其他各叶皮质脑沟的浓度接近,一般不超过丘脑或小脑的放射性分布。若睁眼或视觉封闭不佳时,该区的放射性浓度则明显增高,有时甚至影响其他各叶皮层的分析,故视觉封闭很重要。内侧放射性分布淡区为枕叶白质和脑室后角。
4)颞叶:由于外侧裂向脑内弯转,额、颞分界明显,双侧颞部由前向后为颞上回,颞中回和颞下回,相当于颞上沟和颞下沟处放射性分布浓密。接近OM线时颞叶皮质呈半环形,在OM线附近颞叶形成环形,中间部淡区为白质。
5)岛叶:OM+5~6 cm处可见皮质沿外侧裂向内折皱,SPECT分辨率高时,可见双层皮质影像,但多数仅在该处皮质增宽和颞叶、豆状核融合在一起,形成小片状浓影。
6)丘脑:丘脑的放射性分布较高,若SPECT分辨率高,衰减校正适宜,双侧对称等大的两个卵圆形放射性浓影清晰可辨。少数人仅可见融合在一起的丘脑浓影,个别人第三脑室较大,两侧丘脑分离明显。
7)基底节:典型的双侧基底节影像是“八”字形,前方是尾状核的头部,后方是豆状核。由于外侧裂、岛叶和豆状核接近,SPECT不能分辨,故豆状核和外侧裂以及岛叶常融合在一起。尾状核头部较大,多数人显影清晰可辨认,部分人可见尾状核尾部。
8)小脑:双侧小脑影像呈双半环形,皮质放射性分布很高,中心部放射性淡区为髓质。小脑蚓部及中央核团(齿状核、栓状核、球核和顶核)构成半球间的浓影。双侧小脑半球放射性分布对称等大。
(2)异常图像
1)局限性放射性分布减低或缺损:脑皮质和脑内灰质核团不同部位有单处或多处局限性放射性分布减低或缺损区,三维立体影像显示呈类圆形、椭圆形和不规则形等。在横断层影像上,大脑皮质有一处或多处放射性减低或缺损区,范围>1.5 cm×1.5 cm,累及层面厚度>1.2 cm;并在冠状断层、矢状断层或者三维立体影像可见且位置相同者。多见于脑血管病、癫痫发作间期、偏头痛等。
2)局限性放射性浓集或增高:脑皮质和脑内灰质核团不同部位有单处或几处局限性放射性浓集或增高,多数呈点灶状、团块状,有的呈环行或新月形等。有一处或多处异常放射性增高区,范围>2 cm×2 cm,超出正常结构之外,累及层面厚度>1.2 cm。多见于癫痫发作期、偏头痛发作期、梗死灶周围血流过度灌注区等。
3)大小脑失联络现象:一侧大脑皮质有局限性放射性分布减低或缺损,同时对侧小脑放射性分布亦见明显减低,这种现象称为大小脑交叉失联络(crossed cerebellar diaschisis)现象。多见于慢性脑血管病,其原因尚不清楚。
4)白质区扩大:脑梗死、脑出血和脑肿瘤等疾病,除可见局部明显的放射性分布减低或缺损外,有时可见白质区扩大,中线结构偏移,多不规则。这是由于局部病变造成周围组织缺血、水肿和受压所致。
5)假性结构紊乱:脑内放射性分布紊乱,无法识别原有的结构。有时可见脑皮质周围有环形放射性分布,呈花边状。多见于脑挫伤。
6)异位放射性浓集:除正常脑内结构的放射性分布外,异位出现放射性浓集现象。多见于脑挫伤伴脑脊液漏、硬膜下血肿术后引流管和术后渗出等。
7)全脑缩小:脑内容量减少,皮质变薄,弥漫性放射性分布稀疏,白质和脑室相对扩大,脑裂增宽,脑内灰质核团变小,距离加宽。多见于脑萎缩、抑郁症晚期、阿尔茨海默病等。
5.注意事项
(1)体位移动。进行数据采集时患者头部位置变动,会严重影响影像质量,重建的断层影像见脑内各结构紊乱。在采集时为防止头部移位,要用胶带强制固定。对神经或精神症状明显、小儿和不能合作的患者,预先应给予镇静剂。
(2)脑血流灌注显像剂放射化学纯度不够。使用99m Tc标记化合物时,若放射化学纯度<80%,游离99m Tc和其他杂质量相对多,头皮、颅骨、静脉窦、鼻腔及软组织内放射性浓集增高,易造成脑内放射性分布紊乱,甚至产生伪影。故使用的99m Tc标记化合物放化纯度应>90%。使用99m Tc-HMPAO时,应在标记后30 min内使用。
(3)封闭不够。使用99m Tc标记化合物时即便放化纯度>90%,但若未使用过氯酸钾封闭脉络丛、鼻黏膜或封闭不够时,有时可见静脉窦轻度显影,特别是鼻黏膜内放射性浓集明显,影响影像的清晰度,在进行三维立体显示时可见鼻腔显影,严重干扰影像。
(4)摄片时要选择最佳的对比度、亮度和曝光时间,冲片药液配方,冲片流程和药液更换的时间也应固定。
(二)SPECT脑血流灌注显像介入试验
脑血流灌注显像介入试验是指利用介入因素,包括药物干预、器材干预、物理干预、生理负荷(冷、热、声、光)和各种治疗等,使脑的血流灌注和功能发生改变的诊断和研究方法。介入试验前,静脉注射脑灌注显像剂反映基础状态脑的血流分布和功能状态,当进行介入试验时使脑细胞处于激发状态,再次注射脑灌注显像剂,就可获得介入状态下的脑血流灌注和脑的功能活动状态。由于介入试验前脑灌注显像尚残留部分脑灌注显像剂,介入状态下所获得的影像是介入试验前和介入试验状态下的叠加影像,可通过影像的归一化和数字减影技术处理叠加影像,使其具有可比性。也可在其基础上进行定量测定。其中药品介入试验——乙酰唑胺介入试验是临床常用方法,下面将重点介绍。
1.原理 乙酰唑胺为磺胺的衍生物。它对体内碳酸酐酶有抑制作用。碳酸酐酶存在于中枢神经系统、肾皮质和眼等组织中。它能促进CO2与水形成碳酸,也能促进碳酸分解成CO2与水。当碳酸酐酶被乙酰唑胺抑制时,任何需要大量及连续供应H+和HCO-3的功能活动都将受到抑制。乙酰唑胺阻断脑内碳酸酐酶的作用,使碳酸脱氢氧化过程受到抑制,脑内pH急速下降。由于脑组织pH下降,正常情况下会反射性地使脑血管扩张,rCBF增加。但是,病变部位血管反应不明显。即便是一些潜在的缺血区,在SPECT影像上并无放射性减低区,但是乙酰唑胺介入后正常部位rCBF增高20%~30%,潜在的缺血区因反应不明显,而出现相对放射性减低区。这种介入试验可提高SPECT脑灌注显像对缺血性脑血管病的检出率。
2.显像剂 推荐使用99m Tc-ECD。
3.检查方法
(1)患者准备 同静息显像。
(2)图像采集
1)仪器条件:同静息显像。
2)采集方法:通常分为隔日法与同日法,分别介绍如下。
①隔日法:静息显像与乙酰唑胺介入显像间隔48 h左右,可先作静息显像,也可先作乙酰唑胺介入显像。静脉注射显像剂前15~20 min注射乙酰唑胺,(注射量15~20 mg/kg,成人总剂量不超过1 000 mg)。显像前和显像中的准备和体位与静息显像相同。
②同日法:首先,按静息显像的条件,注射约1/3剂量的脑显像剂等待一定时间后,将被检查者移至检查床上,在进行第一次即静息态SPECT采集之前,静脉注射乙酰唑胺,然后进行静态SPECT采集,采集完成后,保持患者体位不动,静脉注射约2/3剂量脑显像剂,然后进行第二次SPECT采集,即为介入状态下显像。两次采集过程中体位保持恒定不变。待采集过程完成后,两次显像所得的资料以同样条件处理,再对比对应层面的相对应的感兴趣区时更具有可比性。
(3)图像处理
1)影像重建:条件同静息显像。将介入试验和介入试验中或后断层影像归一化后在同一屏幕上组合显示,使其位置、大小和色调一致,并摄片。
2)数字减影技术
①一般减影:以介入试验中或介入试验的投影数据或断层影像为被减像,以介入试验前投影数据或断层影像为减像,得到实际介入试验投影数据或断层影像。投影数据按静息显像方法重建断层影像。然后,再行影像组合显示和摄片。
②匹配减影:非同体位双次显像时,两次显像的体位很难一致,匹配两次横断层影像的X轴、Y轴和Z轴后再进行减影。
③差值减影:用上述方法获得介入试验前、中或后的断层影像,可继续以介入试验中或试验后的断层影像作为被减像,以介入试验前影像作为减像,得到差值像,更直观地显示脑局部血流灌注和功能的变化。
3)定量分析:除可采用静息显像的方法外,还可以在介入试验前、中或后的断层影像某区域和镜像部位提取计数,计算变化率,评价介入试验对脑局部血流灌注和功能的影响程度。
4.图像分析正常与异常图像分析方法同静息显像,对两次图像结果进行对比分析。
5.注意事项
(1)介入试验特别是药物介入试验不同程度地存在风险,在进行介入试验前必须熟知所实施介入试验的原理、方法、注意事项和可能出现的危险,要针对介入试验可能出现的问题,准备必要对抗药品和抢救措施,防止发生意外。
(2)数字减影技术难度较大,其关键点在于头部固定、层与层的一致和像素的匹配。如果在位置、层与层不一致或像素不匹配的情况下做减影处理,势必造成假性脑内结构错乱,影像模糊,分辨率下降。
(3)其他注意事项同静息显像。
(三)PET脑血流显像
1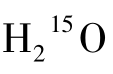 显像
显像
(1)原理 水是构成人体组织的基本成分,血浆中含有大量水分并随血液循环。由回旋加速器生产的15 O2与H2反应后形成的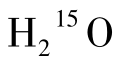 与天然水的生物学性质相似,而物理学性质不同。作为弥漫性示踪剂,
与天然水的生物学性质相似,而物理学性质不同。作为弥漫性示踪剂,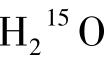 静脉注射后可以自由通过血脑屏障入脑,在脑内的分布与局部脑血流量呈高度正相关。在PET显像中,通过采集和测定外周动脉血放射性计数以及利用PET扫描仪测定局部脑组织计数,可以分别获得动脉血及脑组织的时间—放射性活度曲线。结合以下计算公式可以求出脑血流量。
静脉注射后可以自由通过血脑屏障入脑,在脑内的分布与局部脑血流量呈高度正相关。在PET显像中,通过采集和测定外周动脉血放射性计数以及利用PET扫描仪测定局部脑组织计数,可以分别获得动脉血及脑组织的时间—放射性活度曲线。结合以下计算公式可以求出脑血流量。
![]()
式中F为局部组织血流量;Ca为动脉血示踪剂浓度;Cv为静脉血示踪剂浓度;Ct为组织中示踪剂浓度;p为分配系数。
(2)检查方法 受检者取仰卧位,头部置于PET扫描仪探测野内,以定位线确定好位置。在一侧肘静脉建立静脉通路用于注射显像剂,同时在桡动脉插入导管用于动脉采血。
首先以自动注射器“弹丸”注射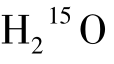 700~1 100 MBq,待显像剂到达脑部后以单次静态方式行发射显像采集数据60 s;同时,以专用采血装置行连续动脉采血和测量;最后做透射扫描用于衰减校正。
700~1 100 MBq,待显像剂到达脑部后以单次静态方式行发射显像采集数据60 s;同时,以专用采血装置行连续动脉采血和测量;最后做透射扫描用于衰减校正。
当进行激发试验或药物负荷试验时,先行基础显像,然后给予语言任务或注射血管扩张剂,接着以同样条件进行第二次显像。
图像处理可采用专用软件。经过预处理后,利用ROI技术获得局部脑组织放射性计数,结合动脉血样数据,获得参数影像、相减影像及脑血流定量参数。
2.C15O显像2
(1)原理 由加速器生产的15O2输入气体合成模块,制备出C15O2,经管道送入面罩供受检者吸入。当C15O2吸入至肺部,于肺泡毛细血管内,在碳酸酐酶作用下,C15 O2溶于水转变成为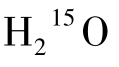 并随血液循环至脑部。当连续吸入C15 O2时,
并随血液循环至脑部。当连续吸入C15 O2时,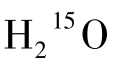 即可由肺部连续生成入脑。15 O半衰期为123 s,经过大约3个半衰期,脑内放射性即仅来源于
即可由肺部连续生成入脑。15 O半衰期为123 s,经过大约3个半衰期,脑内放射性即仅来源于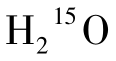 ,且到达脑部15O量与其在脑组织通过静脉的清除量和自身衰变率之间达到动态平衡,即脑内15O的放射性分布和放射性强度进入所谓的稳定状态。在这种情况下,可以通过计算动脉血与脑组织放射性浓度的比值,结合以下计算公式求得通过一定体积脑组织的局部脑血流量。
,且到达脑部15O量与其在脑组织通过静脉的清除量和自身衰变率之间达到动态平衡,即脑内15O的放射性分布和放射性强度进入所谓的稳定状态。在这种情况下,可以通过计算动脉血与脑组织放射性浓度的比值,结合以下计算公式求得通过一定体积脑组织的局部脑血流量。
![]()
式中λ为15O的物理衰变常数;Ca为动脉血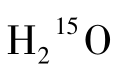 浓度;Ct为组织中
浓度;Ct为组织中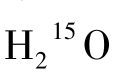 浓度;p为血脑分配系数;F为局部血流量。
浓度;p为血脑分配系数;F为局部血流量。
(2)检查方法 受检者取仰卧位,头部置于PET扫描仪探测野内,保持舒适和位置固定。面部佩戴面罩,并有两条气体管道与面罩相连。一条来自加速器的气体模块,提供放射性C15 O。
2另一条管道用于回收放射性废气,将其送入临时性储气罐,保存至安全水平后排放。检查时先行5~10 min透射扫描,然后持续吸入一定浓度和一定流量的C15 O2与空气相混合的气体,经过8~10 min达到平衡,随即以计数控制条件行发射扫描,并继续吸入C15 O2直至显像完成。在发射显像期间,经过预置的桡动脉插管抽取动脉血样数次,分别获得全血和血浆放射性计数、血细胞比容、血红蛋白、pH以及PaCO2、PaO2。检查期间,需要检测受检者的血压、呼吸和脉搏。检查完毕,利用ROI技术获得脑组织断层影像的放射性计数,并将其他参数输入计算机,经过专用软件处理后获得局部脑血流量的定量测定值。
二、脑代谢显像
脑的代谢非常旺盛,其能量绝大部分(90%以上)来自糖的氧代谢。由于脑组织本身并不能储存能量,所以需要连续不断地供应氧气和葡萄糖。脑的重量占体重的3%,而其消耗的葡萄糖占全身的20%。葡萄糖通过有氧代谢提供能量,只有当氧分压下降至6.67 kPa(50mmHg)时才通过无氧酵解供应能量。
脑部氧的消耗量占整个机体总氧耗量的20%,远比其他组织多,几乎达到静息时肌肉氧耗量的20倍以上。脑每分钟氧耗量为42~53 ml,若以每100 g脑组织计算,为2.5~3.5 ml/min。脑组织的氧耗量与大脑皮质活动有关,机体兴奋时,脑氧耗量增加,睡眠、安静时氧耗量降低。
脑代谢显像主要应用PET仪完成,尽管符合线路SPECT已经可以进行脑葡萄糖代谢显像,但受设备本身灵敏度、固有分辨率、显像剂制备等限制,应用极少;SPECT成像技术应用于脑氧代谢尚难以实现。
(一)脑葡萄糖代谢显像
1.原理 葡萄糖几乎是脑细胞能量代谢的唯一来源。葡萄糖由血液输送到脑后可穿透血脑屏障进入脑组织,进入脑组织的葡萄糖在己糖激酶作用下磷酸化葡萄糖变成6-磷酸葡萄糖(G-6-P),后者继续在磷酸果糖激酶等一系列酶的作用下氧化降解,最后生成二氧化碳和水,并释放能量提供脑功能活动。将葡萄糖链上第二位的羟基(OH)转变为H,即脱去一个氧原子,形成2-脱氧葡萄糖(DG)。2-脱氧葡萄糖与普通的葡萄糖一样,能穿越血脑屏障进入脑组织,也能在细胞内己糖激酶作用下变成6-磷酸脱氧葡萄糖(DG-6-P)。由于分子构型的改变,6-磷酸脱氧葡萄糖不能像6-磷酸葡萄糖那样与磷酸果糖激酶作用,因此停止其分解过程,不会被氧化成二氧化碳和水。同时磷酸化后的脱氧葡萄糖又不能很快逸出细胞外,更不能快速通过血脑屏障返回血液中,故能在脑中滞留较长时间。因此使用放射性核素标记的脱氧葡萄糖,能进行脑的葡萄糖代谢成像,可以反映大脑生理和病理情况下葡萄糖代谢情况,了解脑局部葡萄糖的代谢状态。应用动态采集及其软件,还可获得有关糖代谢的各种速率常数、脑组织葡萄糖代谢率等定量参数。另外正电子脑代谢显像可以借助各种生理性刺激或药物介入完成神经活动状态的观察,以协助临床诊断和治疗。
2.显像剂 18氟-2-脱氧葡萄糖(18 F-deoxyglucose,18 F-FDG)。18 F主要由小型医用回旋加速器生产,其物理半衰期为109min,适合脑代谢显像,是目前最广泛的代谢显像剂。
3.检查方法
(1)显像前准备 熟悉患者病情、采集相关病史,并了解是否存在影响FDG摄取的因素,其中包括:近期化疗、放疗、手术及其他用药情况(如激素等);CT及MRI等影像学资料;病理资料;是否有糖尿病病史;癫痫患者的发作情况、抗癫痫药物治疗情况、脑电图资料等。注射FDG前患者禁食4~6 h。
(2)图像采集 ①建立静脉通道,2D模式采集时,注射18 F-FDG 3.7~6.66 MBq(0.10~0.18 mCi)/kg;3D模式采集时,18 F-FDG注射剂量要减少,剂量范围在1.85~3.7 MBq(0.05~0.10 mCi)/kg。常规显像宜在注射后30 min进行,然后用生理盐水冲洗通道。②确认PET仪器质量控制测试结果合格。检查者保持安静,戴黑眼罩和耳塞,避免声光刺激。患者定位于检查床上,先行发射(emission,简称E)或先行透射(tranmission,简称T)依具体情况而定,采集时间一般为透射扫描10 min,发射扫描>8千万计数。
(3)图像处理 视PET机型不同,选择其适当的重建参数(重建方式、滤波函数、矩阵大小、放大因子、截止频率、陡度因子等)进行图像的重建。
4.定量分析
1)两侧放射性浓度的对称性以两侧相同面积内的平均计数值之差占两侧均数的百分数来判断,相差10%以内的为正常,相差15%以上为异常,相差10%~15%提示可疑异常。
2)因大脑各叶皮质的葡萄糖代谢率不尽相同,难以相互比较,而小脑皮质的葡萄糖代谢率一般较为稳定,疾病也较少,故常以其为参照。计算大脑各叶皮质计数,分别与同等面积小脑皮质计数计算比值,作为判断和比较大脑各叶葡萄糖代谢率高低的根据。当然必须事先除外该患者没有器质性和功能性小脑病变,并且注意年龄的影响。
3)SUV的计算适用于对病变的葡萄糖代谢情况进行定量评价,并有利于组间比较和患者自身多次显像比较。(https://www.daowen.com)
4)脑局部葡萄糖代谢率(LCMRGlu)测定,除研究工作外,很少进行。
5)统计参数图(statistical parametricmapping,SPM)主要用于脑功能研究。
5.图像分析 首先阅读横断影像,主要是因为医生已比较熟悉CT和MRI横断图像,较容易做对照分析。必须先判断影像的体位是否正确(即头位应当端正,OM线与体轴垂直),必要时要重新重建或旋转头位至正确位置。一般从头顶向下逐层仔细阅读,观察各结构是否完整、各皮质影像的厚度、浓度和沟回、基底节影像的形态、大小和浓度、白质区的大小和浓度等是否对称,有无异常。在结构完整的情况下,皮质沟回和基底节的位置和大小可有轻度不对称。然后逐层阅读冠状和矢状影像,印证在横断影像上看到的正常和异常表现并加以确定。冠状影像特别有助于观察两侧的对称性,有利于观察颞叶内、外侧皮质(特别是海马回)和定位各叶的上中下各回。矢状影像则较有利于展示颞叶和顶叶全貌。
(1)正常图像 脑皮质摄取18 F-FDG总注入量的2.5%左右,呈现为极为明显的浓影。PET正常影像与SPECT脑血流灌注显像所得影像相似,但皮质的主要沟回、基底节结构、中脑和海马显示更清晰,结构更完整。沟由两层皮质折叠靠拢而成,故呈最为突出的浓影;无明显折叠之处为回,呈较淡的影像。根据解剖知识可定位大脑各叶及其主要沟回。两侧皮质的厚度和放射性浓度为其特点。放射性浓度以枕叶、颞叶上回皮质、尾状核头部和壳核最高。小脑较低,是唯一与SPECT脑血流灌注影像不同之处。正常图像见彩图9-2-5~12。
(2)异常图像类型和诊断标准
1)异常图像类型:①脑萎缩征。大脑皮质普遍淡而薄。大沟裂增宽,表现为沟内两侧皮质影像分开。小沟裂正常时不显影,脑萎缩者也稍显影,表现为皮质表面多数“毛刺”。两侧尾状核影像间距增宽,白质和侧脑室区明显扩大。②局部放射性增高。见于发作期、亚临床发作期和发作后期癫痫、转移瘤、分化不良的脑瘤、炎症、局部功能增高、皮质异位等。分单发和多发。③局部放射性减低。见于发作间期癫痫、各种痴呆、脑血管疾病、变性病、精神疾病、分化良好的肿瘤和其他各种占位病变、脑损伤和各种手术、毁损治疗后。减低区的部位、数目、形态和是否对称有助于疾病的鉴别诊断。④区域失联络征。最早注意到的是大小脑失联络,表现为大脑原发葡萄糖代谢减低病灶的对侧小脑同时发生葡萄糖代谢减低。近年又发现对侧或同侧的大脑各部位皮质之间、与基底节和丘脑之间也有类似现象发生。并且还可发生在代谢增高的病灶,应称为联络增强。⑤失去正常外形和中线移位。见于外伤、术后、出血和占位病变时。也可为正常变异。
2)异常图像的判断标准:以熟悉正常解剖结构和正常影像为基础,不难识别明显异常。有的是不对称性病变,计算两侧计数差值有助于确认异常,差值大于15%为异常,在10%~15%内可疑异常,小于10%为正常。有的病变为对称性异常,如阿尔茨海默病、Pick病,则要根据异常部位来鉴别。以下是几点注意事项:①横断影像上所见异常,至少要在连续的两个层面上出现,并且必须得到其他两个方向影像的印证才能确定。否则仅为可疑。②最上部的额叶和顶叶皮质在横断影像上常常失真,更需要几个方向的影像来确定是否异常。此区域也很难进行半定量分析。在这些部位判断异常的标准宜从严。③少数正常解剖结构可以不完全对称,如尾状核头部的位置可以一侧稍上移,在从上往下的横断影像上,该侧尾状核头部影像会先出现,可误认为对侧尾状核头部放射性减低。但若往下的几层出现逆转表现,即对侧尾状核头部影像晚消失,则表明上述差别是双侧解剖结构的高低差别。④颞骨岩部不对称,较大侧会挤压额下回和小脑造成影像与对侧很不对称,需结合CT分析。⑤显像时头部或影像层面的方位不规范,可严重影响脑影像的对称性、形状,甚至造成放射性浓度不对称,有疑问时需纠正头位和方位之后再进行重建和分析。
6.注意事项
(1)有糖尿病病史或糖耐量异常者,应测定血葡萄糖浓度。理想的血糖水平在60~120 mg/dl(3.33~6.67 mmol/L),若血糖高于200 mg/dl(11.11 mmol/L)应采取措施降低血糖。
(2)怀孕和哺乳期妇女一般不进行PET检查。怀孕妇女确需进行PET检查,应认定检查的益处远大于对胎儿的不良影响,由申请医师告知患者或患者委托的直系家属,并取得知情同意,且必须调整注射剂量。
(3)对不合作患者可应用适量镇静剂。
(4)PET或SPECT/PET图像要结合CT或MRI的影像结果进行综合判断,最好能进行图像融合,从而使精确的解剖结构与灵敏的代谢改变融为一体。
(5)患者应向医师提供尽可能详细的病史及其他影像学、电生理检查资料。
(二)脑氧代谢显像
1.原理 15 O2由加速器生产,半衰期123 s。受试者持续吸入15 O2可在脑部记录到放射性,它由三部分组成:①脑组织从动脉血中提取分子15O2用于细胞有氧代谢,最后形成H215 O,此部分H215O的放射性代表了脑细胞对氧的利用;②动脉血中与血红蛋白结合的15 O2,形成了标记的氧合血红蛋白;③存留于血液中,由身体组织代谢清除的再循环性H215O。后两部分放射性会被记录到动脉血中15 O2的放射性内,但不代表脑氧代谢。于是,需要进一步确定有多少氧被脑组织提取利用,此时,需结合脑血流。在吸入C15 O2行脑血流检测时,可获得局部脑组织中H215 O的放射性,则吸入15O2时与吸入C15 O2时H215 O的放射性比值就代表了脑组织对氧的提取率。
2.检查方法 受检者首先吸入C15 O2行脑血流显像。适当调整加速器条件后,接着吸入一定浓度和一定流量的15 O2至平衡状态,然后按照预置计数完成显像,同时抽取动脉血测定放射性及其他参数。
脑氧代谢显像对于脑功能的研究以及脑血管病、痴呆等的诊断有重要意义,但由于显像技术和设备较为复杂,临床应用很少。
(三)氨基酸代谢及其他代谢显像
近几年来,以碳(11 C)-甲基-L-蛋氨酸(11 Cmethyl-L-methionin,11 C-MET)和18 F-氟代乙基酪氨酸(18 F-fluoroethyl tyrosine,18 F-FET)为代表的氨基酸代谢显像、11 C-乙酸盐(11 C-acetate)氧化代谢显像以及11 C或18 F标记的胆碱(11 C或18 F-choline)和11 C-胸腺嘧啶(11 C-thymine)、18 F-氟代胸腺嘧啶(18 F-thymine)代谢显像越来越多地被应用于临床。这些显像剂与18 F-FDG相比,具有更高的靶/非靶(target/non target,T/NT)比值,能反映细胞的增殖,对于脑肿瘤的诊断、分期以及治疗后的疗效评价等都具有重要的意义。
三、神经受体显像
受体是一种存在于活体组织内能与神经递质或相应配体(ligand)特异性结合的蛋白质,是神经细胞间信息传递的主要载体。由于受体在中枢神经系统的作用,使其在生理研究和疾病诊断方面都优于代谢,当然也优于血流。脑受体显像已进入临床应用阶段并日益受到重视。目前研究和应用比较多的神经递质和受体主要有多巴胺受体、乙酰胆碱受体、5-羟色胺受体、γ-氨基丁酸受体、阿片受体等。
(一)原理
中枢神经递质和受体显像是根据受体—配体特异性结合性能,用放射性核素标记特定的配体,通过PET或SPECT对活体人脑特定解剖部位受体结合位点进行精确定位和获取受体功能代谢影像,并借助生理数学模型,获得定量或半定量脑内受体与配体特异性结合浓度及其相关代谢参数如受体的分布、数目(密度)和功能(亲和力)等,从而对与受体有关的疾病作出诊断;指导合理用药、评价疗效和判断预后;同时为神经生物学研究提供一种新方法。
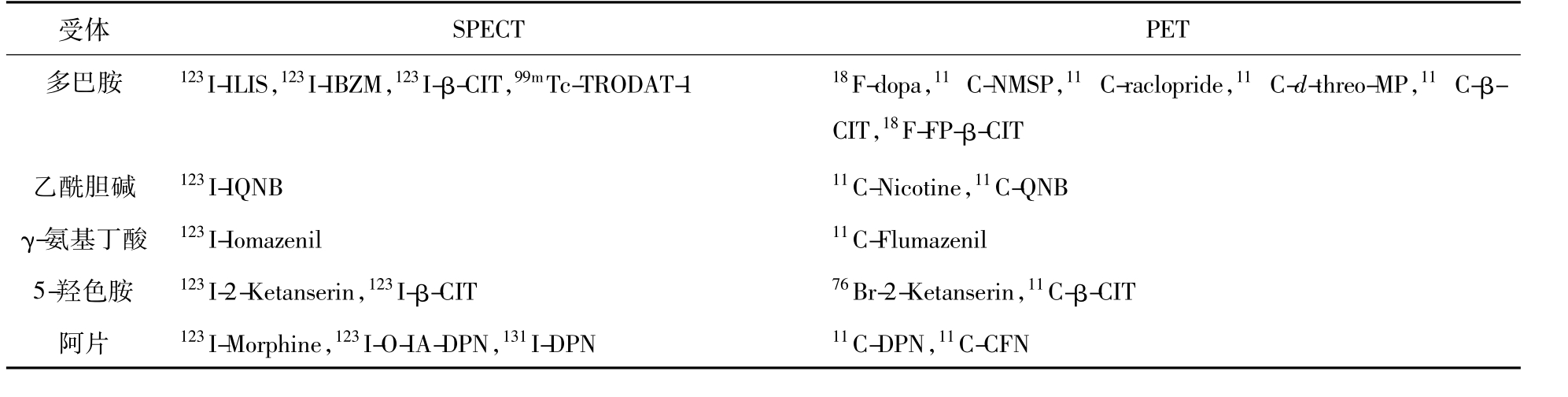
(二)放射性配体
见表9-2-1。
表9-2-1 目前较有前途的放射性配体
(三)检查方法
1.SPECT显像
(1)患者准备 受检者空腹,保持安静,给药前后进行视听封闭,检查室灯光暗淡。对个别不能配合者需在检查前给予适当镇静剂。
(2)方法 ①根据标记配体的放射性核素,选用适合的准直器,目前采用会聚型准直器或低能高分辨准直器(99m Tc)进行SPECT神经受体显像较为理想;②受检者一般取仰卧位平躺在检查床上,头部固定并处于SPECT探测器视野内,采集条件与脑SPECT相同。
2.PET显像
(1)患者准备 受检者空腹,保持安静,给药前后进行视听封闭。对个别不能配合者需在检查前给予适当镇静剂,保持检查室灯光暗淡。
(2)方法 ①受检者一般取仰卧位平躺在检查床上,头部固定并处于PET探测器视野内,充分暴露双侧肘静脉并放置插管备用。②显像前,用探头上装置的68Ge放射源做透射(transmission)扫描,以后再行发射(emission)扫描,主要用于组织的衰减校正。使用PET/CT者,则用CT行扫描和衰减校正。③由一侧肘静脉快速注入显像剂后即刻连续动态显像,然后进行特定时相的静态断层显像。另一侧肘静脉分别在注药后不同时间点采集动脉或静脉血,血样经处理、测量、数据归一化,通过计算获取动脉输入功能参数,为定量分析提供依据。进行竞争抑制试验时,可预先(注射显像剂前30 min)将拮抗剂引入活体后注入受体显像剂或显像剂和拮抗剂混合后注射,是计算放射性配体的抑制常数和受体亲和常数等功能参数的常用方法。
(四)影像处理和分析
断层影像采用计算机提供的软件处理,一般常用滤波反投影法及迭代法,并需要进行衰减校正。影像经计算机重建获得放射性配基与脑内富有受体的特异结合分布区域的横断层、冠状断层和矢状断层三个断面和三维立体影像(见彩图9-2-13,14)。利用计算机ROI技术和采用一定的生理数学模型可得到定量分析的功能参数即放射性配体与受体特异结合的最大结合容量(Bmax)和结合解离常数(Kd),定量反映受体数量(密度)和功能(亲和力)。半定量分析常在富有受体分布区域与参考区分别设置ROI,计算靶/本底(T/B)摄取比值,例如多巴胺受体显像半定量分析常用纹状体/小脑或纹状体/枕叶比值。
(五)受体显像的主要类型
见表9-2-2。
表9-2-2 受体显像的主要类型

四、临床应用
神经核医学在神经精神疾病诊治中的作用已得到肯定,但使用不同的显像设备(SPECT或PET)、应用不同的显像方法和显像剂,其临床应用价值也不一样。因此,应根据不同的疾病和不同的显像目的,在现有医疗机构所具备的设备条件下,选择合适的显像方法与显像药物。
(一)早老性痴呆(Alzheimer's disease,AD)
AD是大脑皮层的一种变性疾病,通常在50岁以后发病。具有缓慢发展、逐渐进展的特点,以痴呆、渐进性的记忆减退、言语困难和认知障碍为主要表现。病理变化为神经细胞变性、神经元纤维缠结和老年斑形成。
SPECT脑血流灌注显像表现为:弥漫性大脑皮层萎缩,脑室扩大和脑沟增宽;脑内多发性放射性减低区,主要位于颞区及颞顶,多为对称性(见彩图9-2-15)。病情较轻者在右半球的颞顶区放射性分布减少,中等者波及两侧额及枕叶,较重者在两侧额及颞、枕区放射性分布更稀疏,呈“分水岭”征,中额区亦见下降。表明rCBF和脑细胞功能低下程度与病情有关。AD表现为中枢神经系统的退行性病变,而脑部血管的数量和结构仍在基本正常范围,应用乙酰唑胺介入试验,病灶局部脑血流量可有增加,显示正常或接近正常的脑血流储备功能。
前瞻性研究发现,PET脑代谢显像比临床诊断方法(包括血液学检查、反复性的神经心理测试、EEG和结构影像)能提前约2.5年检测AD,其准确性在90%以上。PET对痴呆治疗的评价也是重要的。葡萄糖代谢显像还可以根据受累脑叶的范围和代谢减低的程度来评价痴呆的严重程度,评估其病程,AD早期双侧顶叶出现对称性减低,晚期双侧颞叶出现减低,常累及额叶,最后导致全脑的代谢减低(见彩图9-2-16)。
乙酰胆碱受体显像在研究探讨AD的病因、病理变化及与其他类型痴呆的鉴别诊断方面具有重要意义。AD最重要的病理改变是胆碱能神经元丧失或破坏,乙酰胆碱合成障碍。本病的早期诊断有一定困难,CT和MR检查灵敏度低。有资料显示乙酰胆碱受体显像可见大脑皮质和海马M2受体分布密度明显减低,脑皮质摄取11 C-N亦明显降低,并得到尸解结果印证。AD患者γ-氨基丁酸受体显像可见显像剂与受体结合减低。
(二)多发性脑梗死性痴呆(Multi-infarct dementia MID)
MID是脑血管性痴呆的一种,临床上常有高血压、动脉硬化、反复发作的脑血管病,以及每次发作后留下的神经与精神症状。随每次缺血发作,损伤不断叠加,直至智能全面减退,发展为痴呆。梗死灶的数量、大小及部位各不相同,有分别以皮质、广泛白质、丘脑和基底节为中心的各种病灶。
SPECT脑血流灌注显像典型表现为多个大小不一血流灌注和脑细胞功能低下区,且呈不规则分布,散布于大脑各叶皮质(见彩图9-2-17)。可与AD鉴别,后者见颞、顶和枕叶等处皮质局限性血流灌注和脑细胞功能低下,多表现对称性。MID在乙酰唑胺介入试验时往往显示原放射性稀疏缺损区血流量不能增加。
18 F-FDG-PET脑代谢显像典型图像表现为脑内散在的、多发和不规则的代谢减低区,往往和脑血流灌注显像所示的放射性减低、缺损区相吻合。
(三)额叶性痴呆(Pick's disease Pick病)
Pick病是一种罕见的原发性退行性痴呆,多见于45~60岁,女性较多。早期发生各式各样的人格情感改变,并在早期出现语言不正常,后来是记忆力、视空间技能的改变,终期出现进行性椎体外系统综合征,智能减退影响到各个领域。神经病理的主要发现是皮层萎缩神经元丢失、神经胶质增生和Pick小体。
SPECT脑血流灌注显像显示选择性前半球血流受损,放射性分布减少,伴皮质边缘异常(见彩图9-2-18)。CT和MRI可见脑室扩大和额颞部叶性萎缩。
18 F-FDG-PET脑代谢显像的典型表现为两侧额叶、颞叶前部对称性代谢降低。这种代谢模式有助于与AD患者相鉴别。这种鉴别有重要意义,因为AD患者有可能经过特殊治疗有所好转,而Pick病患者则不然。
(四)帕金森病伴痴呆(Pakinson's disease with dementia,PDD)
PD是发生于中老年的黑质纹状体通路的变性性疾病。其临床特征为震颤、肌强直、运动迟缓及姿势反射障碍。约30%的患者最终发展为痴呆。PDD也出现智能、记忆、语言障碍,视空间技能下降等症状,但是抑郁较为常见。有时PDD与AD需进行随访鉴别。
SPECT脑血流灌注显像见基底节包括尾状核头部和邻近区放射性分布减少,反映了脑神经细胞功能低下的状态。整个大脑皮层亦见中度弥漫性放射性分布减少(见彩图9-2-19)。
PD患者疾病早期纹状体葡萄糖代谢率降低。病情进展时,可表现为全脑葡萄糖代谢率的逐渐降低,呈弥漫性分布(见彩图9-2-20A)。后期伴有痴呆症状的PD患者可出现与AD类似的影像学表现。也有报道,早期未治疗的PD基底节区呈现高代谢(见彩图9-2-20B),偏侧震颤麻痹与对侧基底节的高代谢有关。PD与正常对照组比较,有轻度弥漫性皮质低代谢,这种低代谢与运动减少的严重程度相关,而与疾病的病程无关。但一般说来FDG PET显示对PD早期缺乏特异性。
目前对PD研究较多的是多巴胺能神经递质系统显像,18 F-多巴PET显像,纹状体对显像剂的摄取反映了黑质纹状体多巴胺能神经元末梢的密度,PD患者呈放射性减低区,并且随着治疗后临床症状的改善,纹状体对18 F-多巴的摄取有不同程度的增加(见彩图9-2-21);18 F-多巴PET显像可用于PD的早期诊断和鉴别诊断、评估疾病的严重程度和监测治疗效果。未经治疗的单侧PD患者的显像发现,受累对侧纹状体对D2受体显像剂的结合增加,这种D2受体的上调预测其对多巴胺的治疗有效,D2受体显像的研究还表明,它可以用于临床治疗效果的监测,PD患者经有效治疗后可见富集多巴胺受体的纹状体放射性分布明显增加。
(五)亨廷顿病(Huntington's disease,HD)
HD是基底节和大脑皮层变性的一种遗传性疾病,其特征为慢性进行性舞蹈样动作和痴呆。本病主要侵犯基底节和大脑皮质,尾状核和壳核受累最严重。HD患者的认知障碍具有皮质下痴呆的特征,即记忆缺陷、认知缓慢、淡漠和抑郁,与AD不同的是无失语、失用和失认。神经病理的特点是纹状体神经元丢失、神经胶质增生。
SPECT脑血流灌注显像见两侧基底节区和多处大脑皮质放射性减低。这些功能性改变继而发展成形态学改变,导致基底节萎缩(见彩图9-2-22)。
HD早期CT示尾状核头部解剖结构完整,晚期则见尾状核头部明显萎缩,而FDG PET脑代谢显像早期可见尾状核葡萄糖代谢明显减低,随病情发展可波及壳核。这种代谢的改变可以早于临床症状的出现,相反,在出现临床症状以后,CT、MRI仍可表现为正常,有助于早期诊断。
HD由于黑质纹状体多巴胺通路代谢功能紊乱,导致纹状体多巴胺受体数目、密度和功能减低,用18 F-多巴进行PET多巴胺能神经递质显像可见放射性摄取速率减低、清除加快,即特异性结合减少。从而可对HD进行早期诊断,动态观察还能判断疗效和预后。HD主要表现为神经基底节,特别是尾状核多巴胺D2受体密度和活性明显减低,其程度与病情严重程度呈正相关,故本检查对HD的诊断及病情评估有较高临床应用价值。
(六)克—雅病性痴呆(Creuzfeldt-Jakob disease,CJD)
CJD又称传染性病毒性痴呆,是一种以进行性痴呆等为特征的致命性中枢神经系统疾病。发病年龄35~71岁,高峰为55岁。女性多见。本病为一种慢性病毒性感染,多散发。主要影响大脑和小脑皮质。病变为双侧性,常不对称;有研究报道脑血流灌注显像可表现为弥漫性额叶、颞叶、顶叶血流灌注减低。CT和MRI可见病程长短成比例的脑皮质萎缩和脑室扩大。
对CJD的PET研究相对不多,只认为大脑皮质广泛性18 F-FDG摄取减少,局灶性病灶少见,但具体为何种模式,尚不清楚。
(七)艾滋病痴呆综合征(AIDS dementia complex,ADC)
ADC一般症状包括免疫功能低下而伴发的机会感染、某些恶性肿瘤及神经系统损害。神经系统的发生率约为10%~20%,而最终将近60% AIDS患者及近10%~30%的艾滋相关综合征患者可发生ADC。
18 F-FDG PET脑代谢显像可用于颅内艾滋病的早期诊断和疗效观察。早期患者可以表现为脑皮质和皮质下灰质结构异常:轻症者,可见基底节和丘脑的葡萄糖代谢增加;伴发痴呆者,葡萄糖代谢局部或广泛性减低。这些改变,在治疗后可以明显改善,病灶可以明显缩小或消失。18 F-FDG PET脑代谢显像在探测AIDS神经系统损害方面较CT和MRI更为灵敏。
(吕学民 韩建奎)
参考文献
1.王瑞,郭庆乐,元小冬,赵静,郑宝霞,刘景旺,赵文忠,韩义,刘淑娟,李健,王振常.老年认知功能障碍与脑结构CT测量的相关性研究.实用放射学杂志.2007,3(23):289-192
2.吴杰,杨文,林哲,姜立刚.老年血管性痴呆的临床与MRI对照研究.中国老年学杂志.2005,6(25):642-643
3.张秋娟,杨军乐,郭佑民.皮层下缺血性血管性痴呆的神经影像学研究.实用放射学杂志.2008,11(24):1 551-1 554
4.钟永海.Alzheimer病和多发梗塞性痴呆的CT诊断价值.医学影像学杂志.2008,18(6):586-589
5.安维民,贾建军,汤洪川,蔡幼铨,王鲁宁.MRI测量颞叶钩回间距在老年痴呆诊断上的应用.军医进修学院学报.2000,21(1):51-54
6.王亮,李坤成,刘树良.内颞叶结构MR体积测量在Alzheimer病和皮层下血管性痴呆鉴别诊断中的价值.中华放射学杂志.2003,4(37):322-326
7.袁慧书,谢敬霞,刘溢,王华丽.阿尔茨海默病与血管性痴呆的胼胝体MR定量研究.中华放射学杂志.2003,37(3):243-246
8.何国军,陈俊抛,温志波,杨波.阿尔茨海默病与血管性痴呆胼胝体的体视学定量研究.中国临床康复.2004,8(10):1 832-1 833
9.陈俊抛,何国军.阿尔茨海默病和血管性痴呆的颅脑核磁共振定量研究.2006,11(5):1 132-1 135
10.宋晓灵,陈俊抛.阿尔茨海默病和血管性痴呆患者颅脑海马、白质疏松定量研究.卒中与神经疾病,2006,13(3):180-182
11.孙冬,章军建.1H-MRS在痴呆诊断与治疗中的应用研究进展.卒中与神经疾病,2008,15(3):192-194
12.嵇鸣,叶春涛,颂华.MR弥散张量成像在老年性痴呆中的应用.上海医学影像,2007,16(3):250-252
13.袁飞,祁吉,龙淼淼,吴胜勇,冯凯琳,顾欣,袁滨.皮层下缺血性血管性痴呆胼胝体的扩散张量成像研究.中国临床解剖学杂志,2006,24(5):524-527
14.王亮,李坤成.血管性痴呆的MRI研究.国外医学临床放射学分册.2001,24(2):70-72
15.张秋娟,齐乃新,白芝兰.血管性痴呆的影像学诊断研究进展.实用放射学杂志2002,18(1):58-60
16.黄钢,林祥通.PET脑显像.见:中华人民共和国卫生部医政司主编.核医学诊断与治疗规范,北京:科学出版社,1997,110-114
17.王荣福主编.核医学.北京:北京大学医学出版社,2003,27-39
18.王荣福.分子核医学.见:林景辉主编.核医学.北京:北京医科大学出版社,2002,P166-174
19.Phelps ME.PET:themerging of biology and imaging intomolecular imaging.JNucl Med,2000,41:661-681
20.Newberg A,Alavi A,Reivich M.Determination of regional cerebral function with FDG PET imaging in neuropsychiatric disorders.Semin Nucl Med,2002,32:13-34
21.Hu MT,Taylor-Robinson SD,Chaudhuri KR,et al.Cortical dysfunction in non-demented Parkinson's disease patients:a combined 31P-MRSand 18FDG-PET study.Brain,2000,123:340-352
22.王荣福.多巴胺能神经递质及受体显像的临床研究和应用进展.国外医学放射医学核医学分册,2000,24(2):59-61
23.王荣福.中枢神经递质和受体显像的研究现状.同位素,2000,13(4):227-234
24.王荣福.脑受体显像.当代医学,2001,7(9):49-53
25.王荣福.神经系统.见:主编:林景辉.核医学.北京:北京医科大学出版社,2002,80-92
26.孙达编著.放射性核素脑显像.杭州:杭州大学出版社,1997,222-234
27.田嘉禾主编.正电子发射体层显像(PET)图谱.北京:中国协和医科大学出版社,2002,139-145
28.田嘉禾主编.PET、PET/CT诊断学.北京:化学工业出版社,2007,448-458
29.潘中允主编.PET诊断学.北京:人民卫生出版社,2005,457-465
30.李少林主编.核医学.北京:人民卫生出版社,2002,66-104
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






