第一节 痴呆影像学(CT与MRI)特点
痴呆是困扰老年人生活的常见疾病,是指由于脑功能障碍而产生的获得性智能障碍综合征,患者表现为记忆障碍,认知功能损害,这些智能障碍可以影响到患者的日常生活和社交活动。虽然近年来对痴呆的分类和诊断标准一直存在着不同意见,但是痴呆的主要形式为老年性痴呆(Alzheimer's disease,AD)、血管性痴呆(Vascular dementia,VD)及混合性痴呆(Mixed dementia,MD)。
一、老年性痴呆的影像学表现
(一)影像学表现
痴呆的一般检查方法无特征性改变,在无创性的磁共振成像(magnetic vesonance imaging,MRI)和CT应用之前,不能对活体脑组织的形态学改变进行观察,因此痴呆的诊断主要依据临床表现及智能量表来判断。近年来随着CT和MRI的普及和发展,能够观察其形态学改变,对痴呆的诊断具有重要的意义。
1.CT CT是目前医学影像学常规的检查方法之一,特别是在中枢神经系统疾病的诊断方面得到了广泛应用。但是,由于CT对软组织对比分辨率不高,使其区分脑灰、白质的能力不佳,另外,CT难以直接显示脑冠状、矢状层面,以及颅底骨质结构伪影干扰太多等缺点,使其在痴呆的诊断方面有其局限性。
CT用于AD患者主要是对脑萎缩的评价。全脑弥漫性脑萎缩,表现为脑沟和脑室扩大,且与痴呆程度有相关性,但是缺乏诊断的特异性。病理学证实AD的主要表现之一是海马萎缩,CT表现为颞角扩大(正常双边径<3~5 mm,可扩大至1 cm以上)、颞叶内侧皮质萎缩、颞叶外侧皮质萎缩、全颞叶萎缩及海马透明区扩大(位于颞叶实质内侧与颞角内侧,乃脉络丛与海马裂部分容积所致),这一点对诊断AD具有重要的意义。但是CT通常难以准确显示海马结构,因此对海马萎缩的诊断有一定的局限性。近年发现,单独依赖于CT诊断AD误诊率高达28%,而且CT对脑白质的改变敏感性不高,故目前已经很少用CT评价AD及鉴别AD与VD[1]。
2.MRI 在所有影像学检查方法中,MRI软组织分辨率最高,其显示的脑解剖结构最为清晰。弥漫性脑萎缩MRI表现为全脑室与脑沟扩大,灰质明显丧失(图9-1-1)。海马结构作为MRI的首要研究对象,也是AD的MRI研究热点之一,其病理改变是老年斑和神经元纤维缠绕形成,由于海马内有过多的老年斑和神经元纤维缠绕,结果导致海马神经元减少和体积缩小。在MRI上主要表现为海马萎缩,即海马透明区的扩大、颞角扩大、内外侧萎缩(侧裂与环池扩大),以及全颞叶萎缩(图9-1-2)。杏仁核为内颞叶记忆系统的组成部分,对轻型AD患者和年龄匹配的对照组进行杏仁核体积测量后发现,前者杏仁核体积明显减小。也有学者认为早期AD患者内嗅皮层体积也缩小。随着病情的发展,病理变化更加广泛,导致愈来愈重的记忆认知功能障碍,晚期这些变化可见于皮层区域。
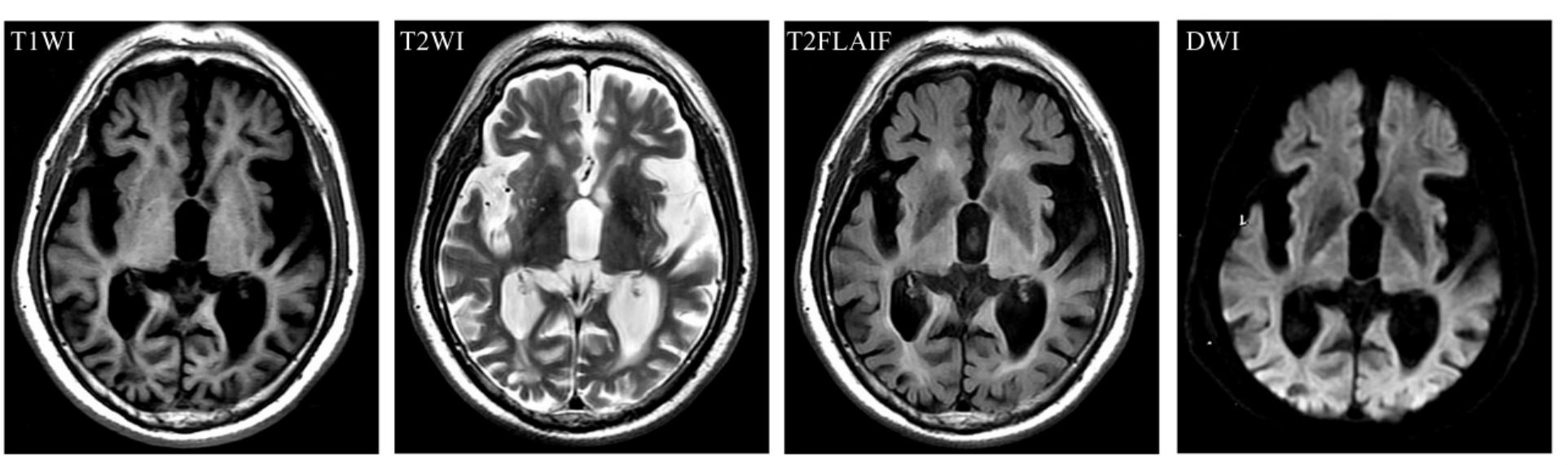
图9-1-1 弥漫性脑萎缩。MRI为全脑室与脑沟扩大
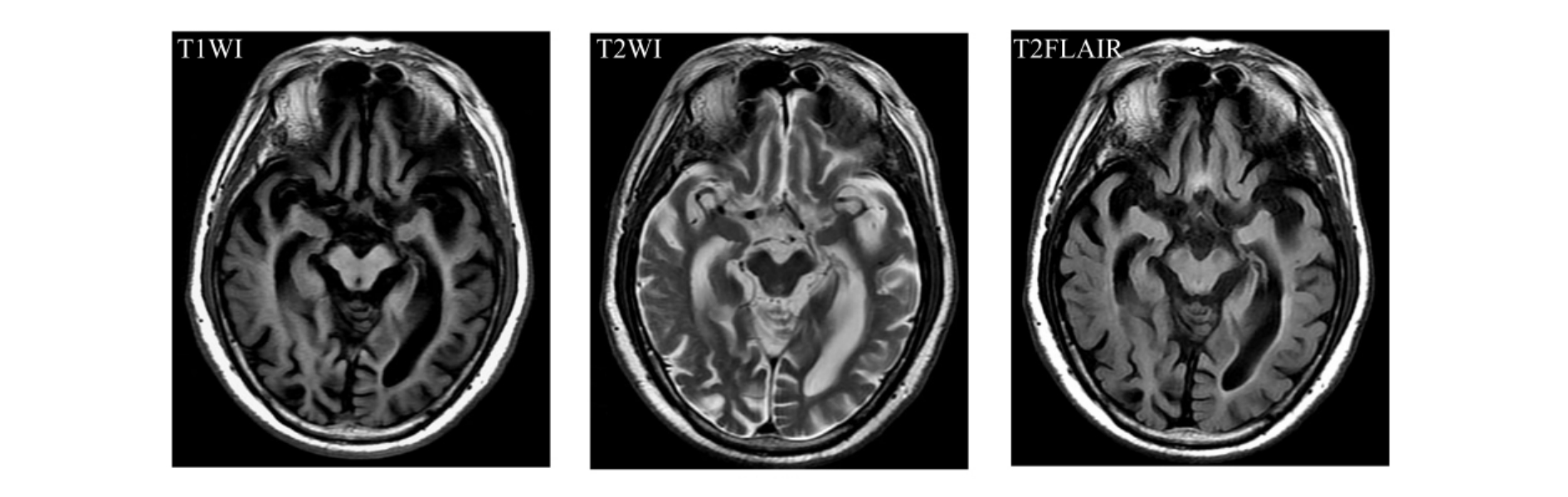
图9-1-2 海马萎缩。MRI表现为海马透明区的扩大,颞角扩大,内外侧萎缩(侧裂与环池扩大),以及全颞叶萎缩
(二)影像学诊断应注意的问题
1.正常衰老的脑形态与变化 临床上,脑的生理性衰老可分为寻常衰老(usual aging)和无疾衰老(successful aging)二类。前者是指无明显神经系统障碍者,但不排除具有心、脑血管疾病高危因素和存在轻微神经心理及锥体外系功能异常者;后者是指那些即使与青壮年比较其生理功能亦无明显改变的无疾衰老状态。寻常衰老是正常生理衰老的主要形式。
轻至中度的脑萎缩可出现在老年期甚至老年前期。一般认为生理性脑萎缩始于50岁左右,但亦可有高于70岁而脑室扩大不明显者,并且存在老年期脑形态学变化与神经心理学功能不平行,部分个体在脑萎缩十分明显时,其神经心理测验可完全正常。一般情况下,生理性脑萎缩涉及多个对称性的解剖部位,但是仍存在受累部位的选择性和双侧变化的非对称性。脑皮质萎缩表现为脑沟增宽,常首先见于额叶、顶叶和旁矢状区域。随着年龄的增加,中央前回、中央后回、额上回等部位的脑沟亦扩大,这可能与皮质下脑白质的缺失有关。正常老人由于丘脑中核退行性变可导致三脑室扩大,但是双侧侧脑室颞角的老年性扩大却不明显。
生理性脑萎缩CT和MRI检查表现为脑沟、脑裂增宽,脑室扩大,脑脊液体积增加等(图9-1-3)。有研究者对28例无神经系统症状的老年人的病理学改变进行了研究,发现17例无脑皮质萎缩现象,仅表现为脑室大小正常或仅有轻微扩大;11例中度脑室扩大者中6例具有基底核梗死灶,5例发现老年斑和神经纤维缠结和颗粒空泡样变性,但数目远远低于AD脑组织所见。另外,有研究者对500例健康志愿者进行了脑CT扫描,发现脑脊液/脑比值在10~50岁间保持恒定,50岁以后随年龄增长,脑脊液体积进行性增加,但其进展的速度远较病理性脑萎缩缓慢。
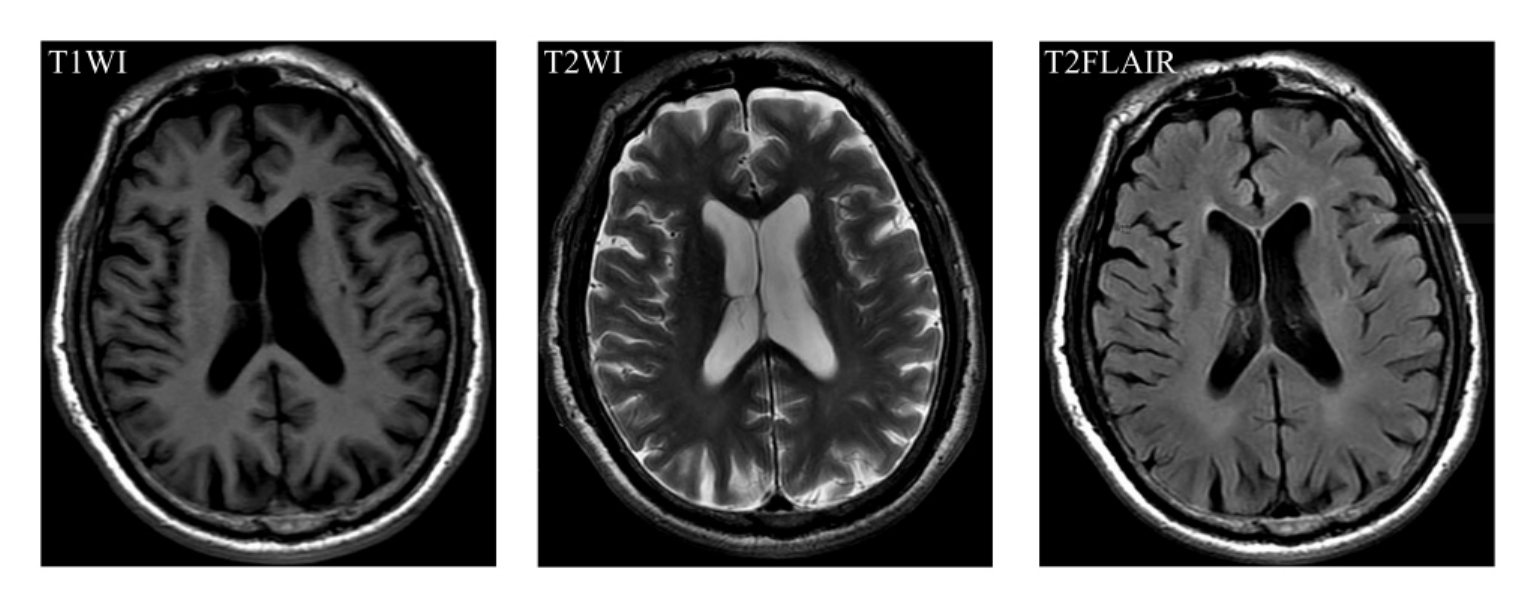
图9-1-3 生理性脑萎缩。MRI表现为脑沟增宽,脑室扩大,脑脊液体积增加
在无神经系统功能障碍老年人,通常可见皮质下斑点状改变,在T2W I上呈高信号影,称之为“脑白质斑点状病灶”(periventricalar whitemateer lesions,PWMLs)(图9-1-4)。有学者认为,它们是一种老年性脑退行性改变,属生理性变化范畴,但多数研究者认为,PWMLs随年龄增加而增多只是一种表面现象,与脑动脉硬化、高血压、糖尿病等其他老年疾病有密切关系,需引起高度重视,加强对相关疾病的控制。另外,随年龄增长,脑组织中铁蛋白含量增加,T2W I上可在纹状体、苍白球、黑质和小脑齿状核等铁蛋白富集区域呈低信号影(图9-1-5)。
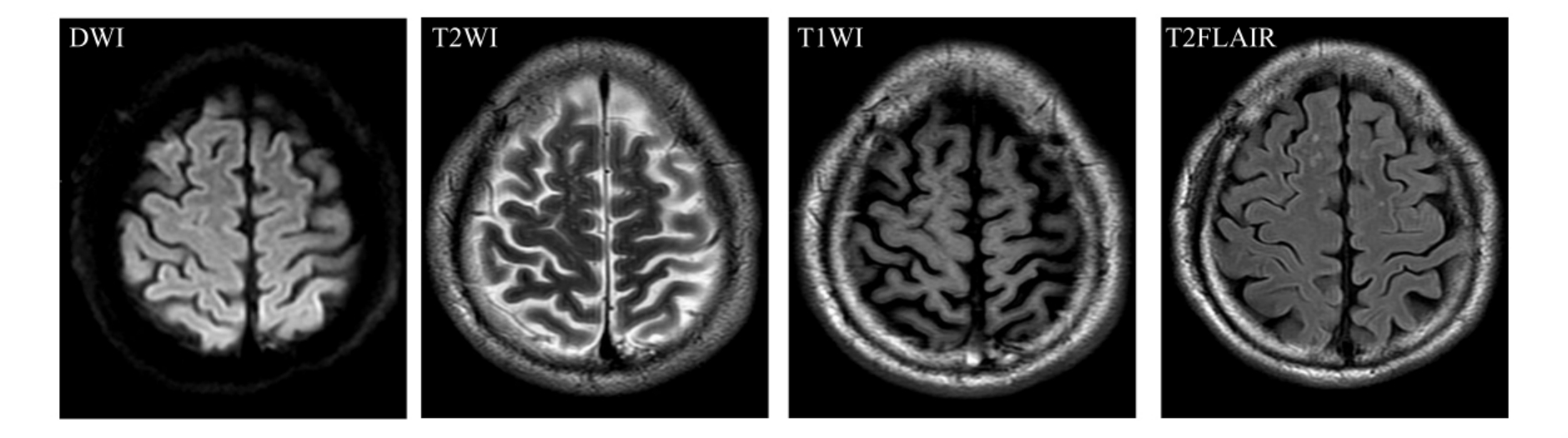
图9-1-4 脑白质斑点状病灶。MRI表现为在T2W I及T2FLAIR上可见皮质下斑点状呈高信号影,DWI及T1W I未见明显改变
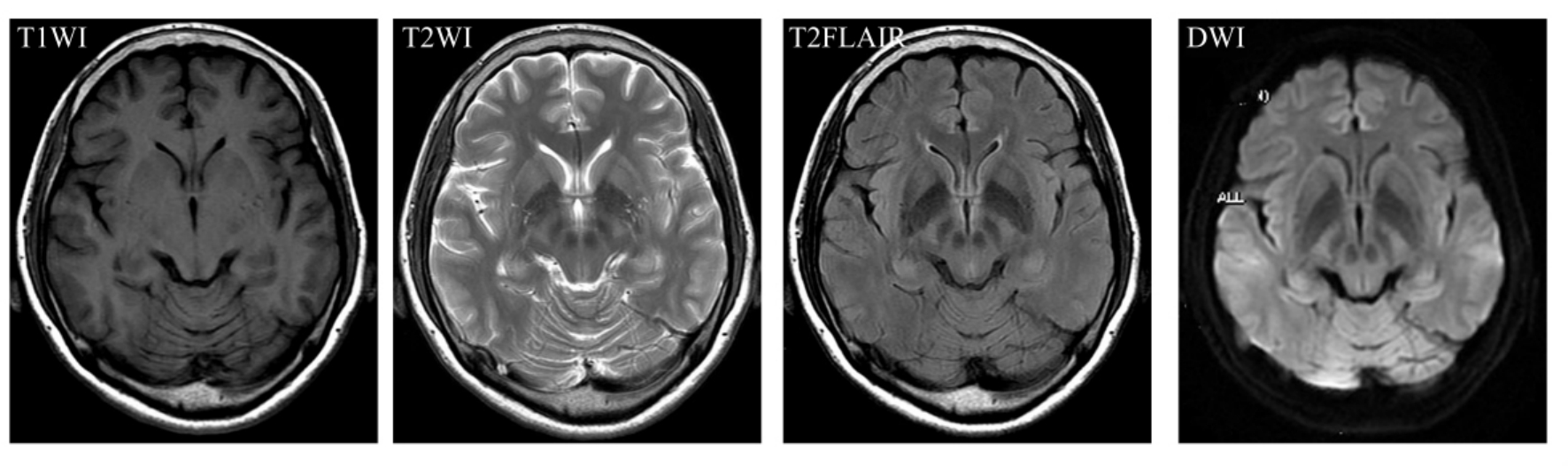
图9-1-5 脑组织铁蛋白含量增加。MRI表现为T2W I上在纹状体、苍白球、黑质等铁蛋白富集区域呈低信号影
有研究表明约60%的AD皮层下具有PWMLs,与正常老人比较,同年龄组中AD患者PWMLs发生率高、范围广。另外,在发生部位上,AD和脑血管性痴呆有所区别,99%~100%的VD和AD出现侧脑室周围白质区域内的PWMLs,100%的VD和50%的AD出现脑皮层下白质区和基底核区的PWMLs。但是,尽管如此,目前认为PWMLs的存在对AD的诊断价值不大。
2.AD患者脑萎缩影像学观察 不同的研究表明脑萎缩涉及的部位和范围存在差异。双侧脑室、第三脑室和颞角大小的评价一致性最佳,而脑白质病变、大脑外侧裂扩大、广泛性脑萎缩等脑区的一致性较差,因此有必要寻找更为客观准确的检查方式。目前,认为图像量化分析,包括二维面积和三维体积测定,是一种有效的测量方法。对AD患者和正常人群脑脊液(cere brospinal flaid,CSF)体积研究发现,正常成人(年龄平均35岁)CSF体积为97.4 ml,正常老年人(年龄平均71.1岁)CSF体积为164.5 ml,而AD患者的CSF体积为317.6 ml,它们之间均有显著差异。另外,有研究认为,在有关AD脑萎缩结构变化(脑灰质萎缩导致的脑沟和第三脑室扩大,白质变化引起的侧脑室扩大)中,侧脑室和侧裂体积是研究的主要内容之一,且AD与正常对照间差别最大,在AD早期即可存在。进一步研究认为第三脑室体积的定量分析在鉴别正常脑衰老与AD脑萎缩方面最有价值,且第三脑室的体积变化与AD神经心理功能的变化密切相关,以记忆障碍为主的AD患者脑颞叶萎缩突出而且发生较早。
内侧颞叶的定量分析可能成为AD、非痴呆老年人和其他病因导致痴呆之间鉴别诊断的重要方法。在CT上,颞叶萎缩主要表现为侧脑室颞角的扩大,大于3 mm仅见于AD患者,小于或等于3 mm可见于非痴呆老人和AD患者。此外,海马透明区扩大亦是CT反映颞叶萎缩的间接指标。MRI可多方位成像,无骨质伪影,更适合对颞叶结构的定量分析。在方法学上,垂直于大脑侧裂或与中脑导水管平行的倾斜冠状成像有利于对颞叶内侧各结构的显示。若以正常老人海马体积为标准,可疑痴呆患者的海马体积低于正常对照1.75标准差(stand deviation,SD),轻度为1.99 SD,中至重度为2.72 SD,并且发现双侧颞叶结构变化与AD记忆等神经心理学功能的损害有密切相关性。通过对AD患者进行了内侧颞叶结构与神经心理学功能关系的多元回归分析,发现右侧杏仁复合体萎缩与视觉记忆功能障碍密切相关,杏仁体和海马下脚与记忆有关。
3.AD早期诊断中的研究 AD早期诊断十分重要,主要表现为脑颞叶内侧的形态学改变,因此,也成为影像学研究AD的热点之一。在其他脑结构变化不明显时,CT或MRI即可检出脑颞叶内侧的形态学变化。利用CT以颞叶内侧宽度指数(MoM,实测值与年龄相关希望值的比率)为研究指标对AD进行了研究。当以MoM<0.79为界值时,敏感度为92%,特异性为95%;以0.70为界值时,敏感度为79%,特异性为99%,认为该颞叶萎缩参考值是AD诊断的一个敏感指标。具有轻微认知功能损害者(mild cognitive impairment,MCI)是AD的危险人群,研究发现,MCI人群海马体积较正常对照减少14%,AD减少22%,海马体积定量分析可用于正常老人与MCI的区别,其敏感性为74%。但由于颞叶萎缩亦见于颞叶癫痫和慢性精神分裂症患者,单纯应用脑形态影像学进行AD早期诊断尚为时过早。
4.与其他检查技术的结合 结合其他实验室手段诊断AD,可提高诊断的可信度与有效性,功能性脑影像学PET、SPET、载脂蛋白E(ApoE)是结合研究较多的领域。
AD早期,神经突触联系减少,神经元缺失尚不明显以前,在相应的脑解剖区域即存在物质和能量代谢的障碍。PET可检查局部葡萄糖代谢(regional cerebrcelmetabdlic rate for glucose,rCMRglu)的情况,反映早期AD的这些脑病变特征。PET图像显示,AD脑rCMRglu缺损以额、颞和顶叶最明显,其检出率为100%。PET和MRI体积定量分析技术结合,可提高功能缺损区域定位的准确性,较好地校正脑萎缩等因素对PET物质代谢率测定的影响,更准确地揭示AD的病理机理。
多数研究认为,SPECT在评价痴呆时可替代PET。SPECT图像表现为不对称性的顶颞叶血流缺损区。CT和SPECT相结合可提高AD诊断的准确性。有研究发现,CT提示颞叶中部萎缩对诊断的敏感性为94%,特异性为93%;SPECT显示的AD颞顶叶低灌注区,其敏感性和特异性分别为96%和89%。两者结合敏感性和特异性各为90%和97%,表明CT与SPECT结合有助于AD诊断。业已证实,ApoE4是AD的危险因素,E4基因型携带的AD患者中枢胆碱能神经元对损伤的易感性增加。结合MRI和ApoE进行分析表明,携带ApoE4表型的AD患者海马和杏仁体体积较其他表型携带者小,尤以右侧明显,并在延迟记忆测试方面得分最低。有研究者认为ApoE4基因型和内侧颞叶萎缩可作AD记忆障碍发展的预警指标。
5.AD与VD的不同 血管性痴呆的MRI表现为患者存在全脑萎缩,脑室脑脊液空间扩大,另外VD中可见海马或海马—杏仁核复合体萎缩,也可见小脑全面萎缩或胼胝体萎缩。需要注意的是VD患者内嗅皮层和海马体积虽较正常认知者体积缩小,但缩小范围小于AD。另外,在VD患者中海马萎缩和皮质萎缩是两个相对独立的过程,前者是病变严重程度最好的预测指标,后者为相对独立的脑萎缩过程,常伴有脑室扩张,皮质萎缩和白质高信号增多。通过对VD患者的脑白质改变与VD的关系及其对认知的影响的研究发现,VD患者T2W I异常白质高信号增加,VD患者除梗死灶外,还存在白质弥漫性腔隙化、动脉硬化改变、血管周围间隙增宽以及髓鞘脱失,但是AD患者的白质改变与梗死无关。也有人认为,VD患者皮质代谢功能障碍和脑灌注受损与皮质下白质病变高度相关,并在VD的发生中具有独特的作用,而且VD患者深部白质和脑室周围白质有广泛异常。
二、血管性痴呆的影像学表现
(一)多发性脑梗死性痴呆
VD是引起老年性痴呆的另一个重要原因,是由缺血、缺氧性脑损害导致的以认知损害为特征的进行性智能障碍综合征。
病理生理学研究表明,脑血流量下降是引起VD的重要因素之一,造成脑血流量下降的原因主要有两个方面:一是由于大脑多灶性微小梗死,或反复脑出血及大面积脑梗死后引起脑动脉狭窄或闭塞,导致脑缺血,进一步加剧脑组织灌流量降低,导致脑循环障碍等;二是由于脑功能的兴奋性降低,导致脑代谢率及血流量的相对下降。目前,研究资料表明,VD不仅与脑损害的体积有关,而且与脑损害的部位以及皮质下脑白质的变化有密切关系。
血管性痴呆可分六种类型:多发脑梗死性痴呆、大面积脑梗死性痴呆、关键部位脑梗死性痴呆、低灌流性痴呆、小血管病变引起的痴呆、出血性痴呆。其中以多发脑梗死性痴呆最常见。
1.多发性脑梗死性痴呆(multi-infarctdementia,MID) MID是VD最主要类型。是大脑多发性性脑梗死的结果,常有一次或多次脑卒中病史,表现为有局灶神经症状、体征(如偏瘫、失语、偏盲)、假性球麻痹,可能伴有语言障碍、小步态、强哭强笑、巴宾斯基征阳性、自制能力丧失等。
2.单发性脑梗死性痴呆 为脑动脉主干闭塞,大多数情况下一次发病即可导致痴呆,另外,脑的关键部位(如海马、丘脑、角回、尾状核、苍白球及左半球与人的学习、语言、认知等功能有关的区域)一次梗死后,即使脑梗死面积较小也可引起痴呆。
3.小血管疾病引起的痴呆 包括多发性腔隙梗死、Binswanger病、脑淀粉样血管病(cerebral amyloid angiopathy,CAA)、常染色体显性遗传病合并皮质下梗死和白质脑病(cerebral artosomal dominant arteriopath with subcortical infarcts and leukoencephalopathy,CADSIL)等引起的痴呆。现有学者研究认为小血管疾病在血管性认知功能障碍方面起着非常重要的作用。
4.低灌注性痴呆 常为急性脑血流动力学改变(如心脏骤停、脱水、低血压)导致分水岭脑梗死。
5.出血性痴呆 指脑出血、蛛网膜下腔出血后引起的痴呆,但是蛛网膜下腔出血后正常颅压脑积水导致的痴呆是否包括在内尚有争议(图9-1-6,7)。
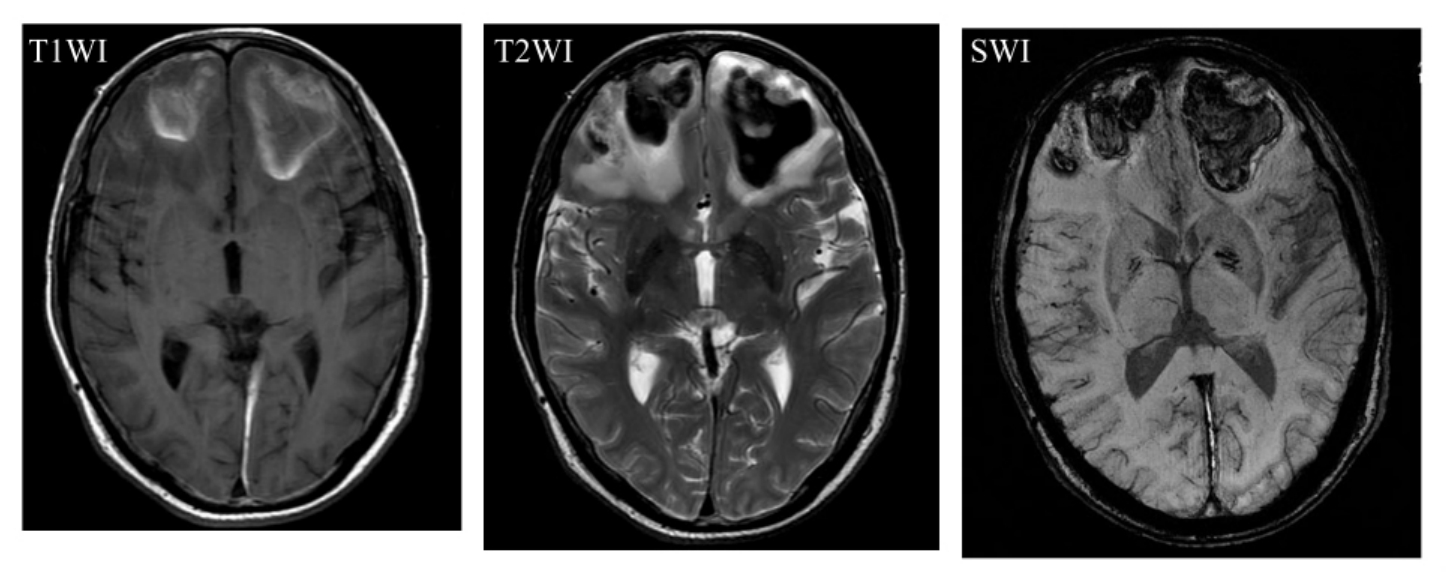
图9-1-6 双侧额叶出血
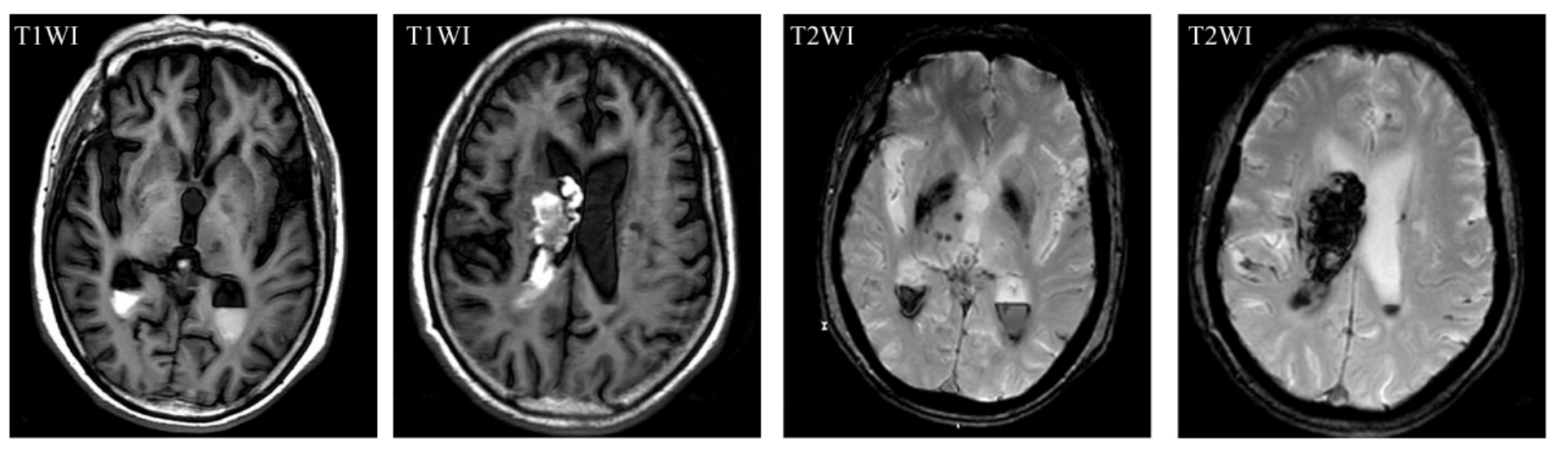
图9-1-7 脑实质微出血及脑室积血
6.其他机制引起的痴呆 包括原因不明和罕见的脑血管病引起的痴呆,如烟雾病和先天性血管异常等引起的痴呆。多年来沿用动脉硬化性痴呆、脑血管性痴呆或脑动脉硬化症等来说明老年人因脑缺血性改变所致的进行性智力减退。近年来研究表明,脑动脉硬化本身不会引起老年人智力减退,椎基底动脉缺血与痴呆亦无因果关系,在脑动脉疾患中只有多发梗死性痴呆与血管性进行性皮质下脑病(Binswanger脑病)才是导致老年人智能减退的确切病因。
MID属于脑血管性痴呆,占器质性痴呆的15%~20%,它是由多次反复发作的脑梗死而引起的智力衰退,占我国老年性痴呆发病率的首位。临床上急性或亚急性起病,有明显智能障碍及神经系统阳性体征,呈阶梯样进行性发展。近年来,随着脑血管病发病率的增加及人均寿命的延长,MID的患病率亦随之增加。
病理证实,多发梗死灶总面积>50 ml或单发大面积梗死>100 m l,即可引起痴呆。小梗死灶尽管神经障碍轻微,但数目多,使皮质下白质传导纤维多处损害与多处断裂,破坏了边缘系统Papez环路与Livingston环路的完整性与统一性,故而引起皮质下痴呆,若梗死位于海马、乳头体、杏仁体等边缘系统关键部位则直接导致器质性痴呆。另外,双侧大脑半球白质灶与痴呆关系密切,尤其是从扣带回至胼胝体的脑白质。
CT问世前主要靠尸检的组织病理学确诊,自从CT等影像检查技术应用于临床以来,明显提高了该病的诊断正确率。脑CT可显示脑梗死的部位、脑白质疏松、脑室扩大及脑萎缩,这些表现是除病史之外诊断MID的重要依据,因此早期CT发现MID的亚临床患者而进行预防,对提高老年人口的生活质量有积极意义。痴呆程度与梗死部位、数目、大小有一定关系,伴发痴呆的多发性梗死是预后不良的标志,往往影响患者的生活质量。
MID是有着明确的致病因素和病因的一类疾病,有效地消除危险因素,控制或改善脑血管障碍,可以减轻或消除MID的症状,部分MID给予早期诊断和治疗,有望控制痴呆发展。
1.影像学表现
(1)CT 头颅CT扫描能很好显示脑梗死的部位、大小、形态、数目、分布以及脑萎缩等情况,对MID有重要的早期诊断价值。MID的主要CT征象为:①腔隙性脑梗死,腔隙灶越多痴呆越严重,多位于基底节区、丘脑与桥脑区;②双侧或多处脑软化灶,范围比腔隙灶大,以基底节与内囊区最为常见,亦可散布于脑叶;③脑萎缩(常为局限性脑萎缩),CT显示脑室、脑池或脑沟局部扩大,病情严重者可显示广泛脑萎缩。多数病例侧脑室旁可见月晕状低密度区。
(2)MRI MRI不但可以提供详细解剖信息,而且具有很好的软组织对比度和较高的空间分辨率。采用MRI技术对痴呆患者脑形态学改变的研究日益增多。MRI显示多发性脑梗死灶比CT敏感,一是可显示脑干部位的腔隙灶,二是MRI显示的病灶比CT多。在显示脑萎缩与脑室扩大方面与CT相似(图9-1-8,9)。
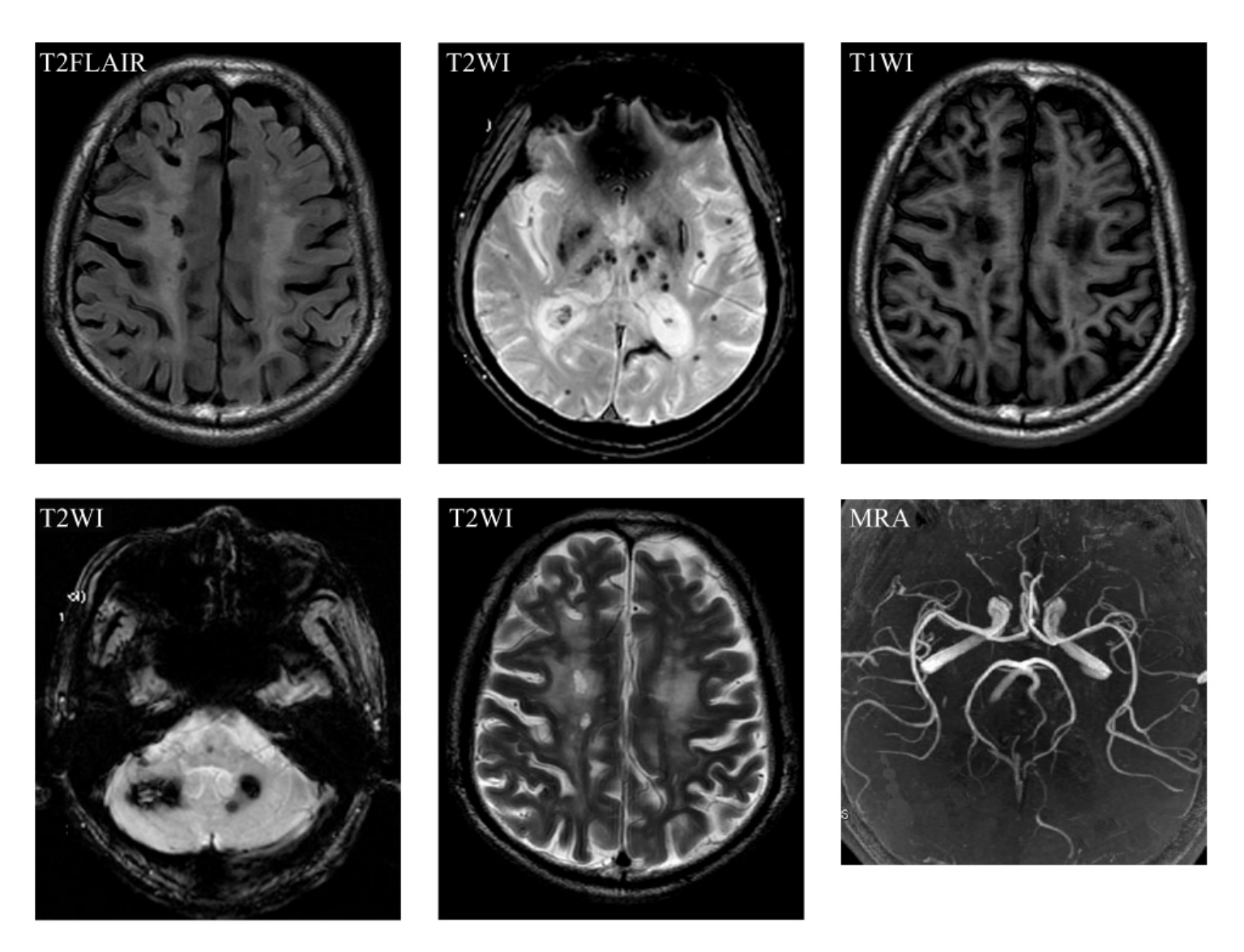
图9-1-8 多发性脑腔隙灶、脑萎缩及小脑出血
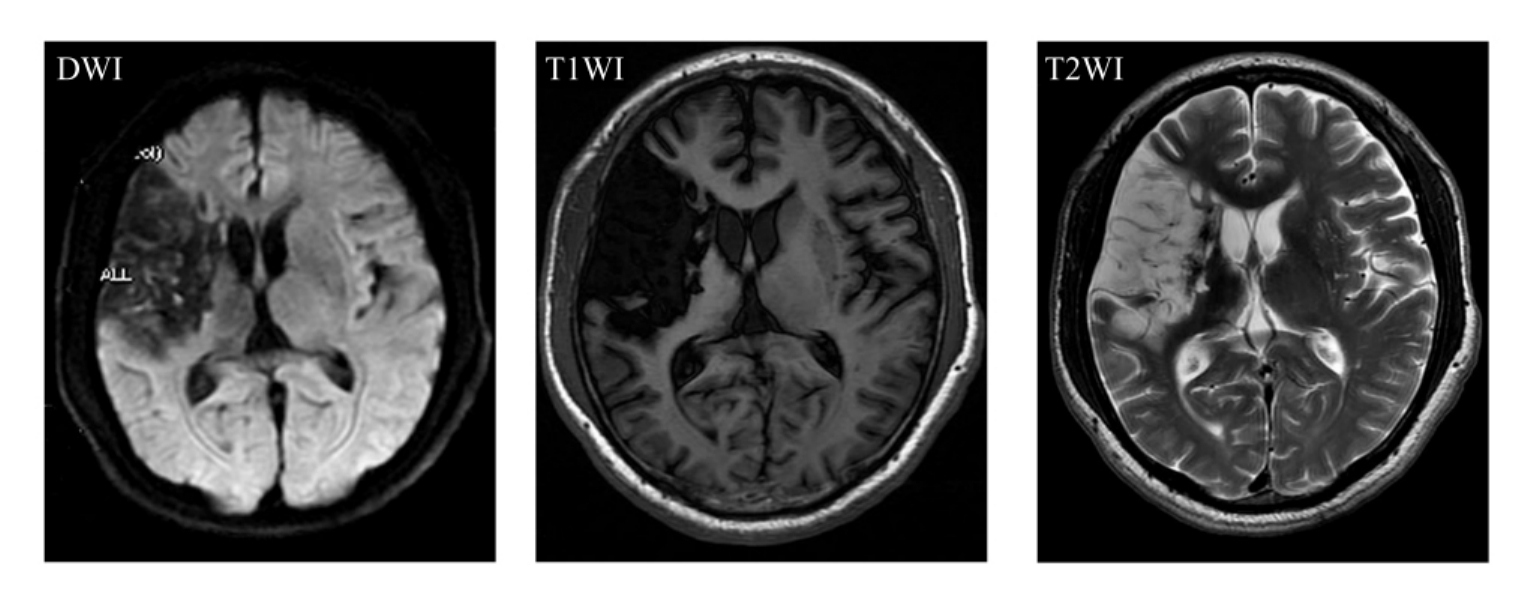
图9-1-9 大面积脑梗死
1)多发腔隙性梗死与较大面积的脑软化灶在MRI上表现为长T1长T2信号。
2)脑梗死灶越多则痴呆的程度越重。多发脑梗死灶的总容积超过50 ml时可引起脑血管性痴呆。
3)脑萎缩。脑室扩大程度与痴呆的严重程度呈线性关系。
总之,痴呆患者的常规MRI检查可以发现以下三类异常:①皮质性脑梗死或腔隙性脑梗死,提供脑血管病的有力证据,在血管性痴呆中较其他类型的痴呆更为常见。②痴呆患者与正常老年人相比,脑萎缩明显,有证据表明,萎缩的分布形式和进展速度随病程不同而相异。③T2W I上脑白质的异常高信号区常见于痴呆患者,有研究认为,血管性痴呆患者较其他类型痴呆患者更为常见,但是无证据表明,T2W I异常高信号区的发生率和分布形式有助于区分变性病所致的痴呆[2]。
MID的诊断必须以临床为主,以影像为辅,其诊断要点为:高血压或脑动脉硬化者有小中风或中风史;进行性痴呆呈台阶式加重;有神经系统症状或体征;CT或MRI显示多发性腔隙灶、软化灶、脑萎缩;排除其他器质性痴呆,尤其是阿尔茨海默病。
2.影像学诊断应注意的问题
(1)脑萎缩 血管性痴呆患者存在全脑萎缩,表现为灰质变薄、脑室脑脊液空间扩大,但是脑沟脑脊液间隙的容积与正常老年人可能相似。血管性痴呆中海马或海马—杏仁体复合体萎缩,可能是由于同时存在的AD的病理学或缺血性损害所致。血管性痴呆内嗅皮质和海马体积较正常认知者缩小,但是缩小范围小于AD。有研究者认为,皮质下缺血性血管性痴呆与AD相同,其痴呆与海马萎缩和皮质萎缩有关,与腔隙性梗死的数目、部位、体积无关。与AD病理学改变不同的是,血管性痴呆中海马萎缩和皮质萎缩这两个过程相对独立,前者是病变严重程度最好的预测指标,可能是由于缺血性和退行性混合性病理改变所致;后者为相对独立的萎缩过程,伴有脑室扩张、皮质灰质萎缩和白质高信号增多(图9-1-10)。
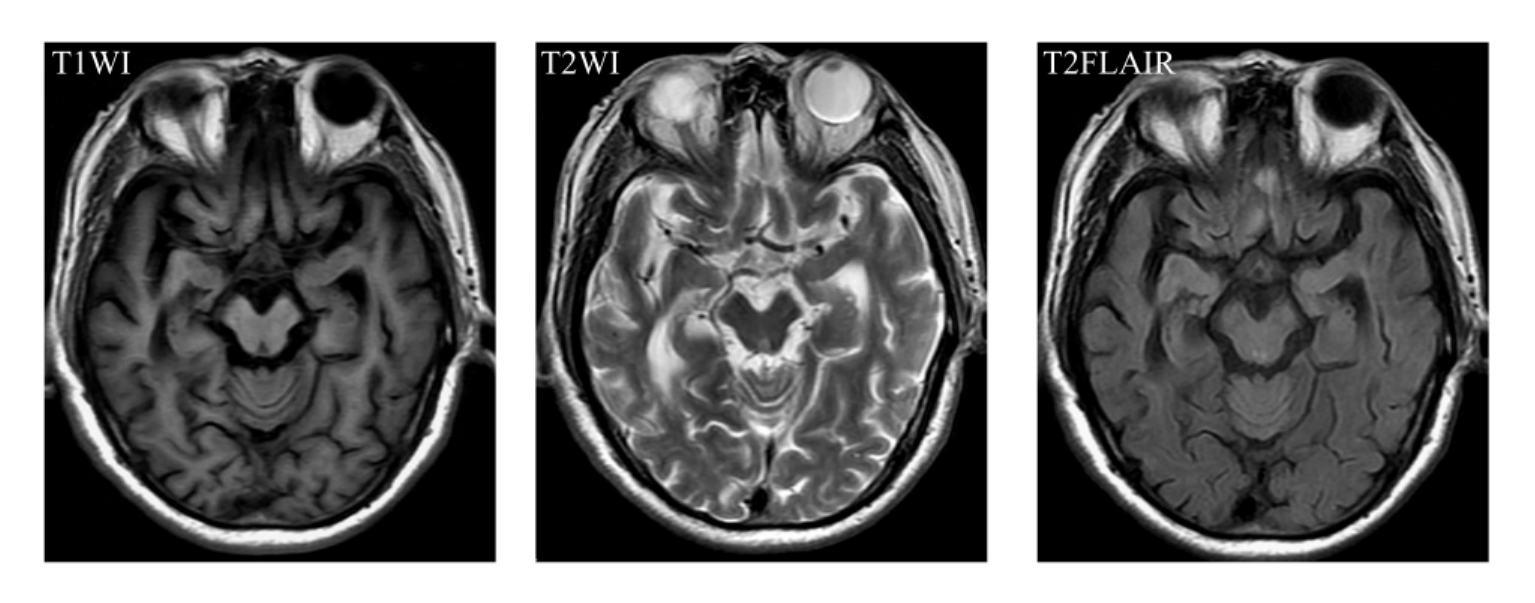
图9-1-10 海马萎缩及多发性腔隙灶
(2)腔隙性梗死与腔隙状态根据 组织病理学研究的结果,腔隙性梗死是指由于累及脑内大动脉穿通支的原发性小动脉病变引起的小的深部梗死,主要位于基底节、丘脑、脑桥和内囊的白质,直径<15 mm。反复出现的腔隙性脑梗死使深部白质梗死灶数量增多,形成腔隙状态,部分患者即可出现进行性认知障碍。有研究者认为,深部小梗死和腔隙状态而非大范围梗死与痴呆的发生密切相关。但是,另有研究认为,认知障碍的程度与海马和灰质萎缩有关,而与腔隙的体积、数量和部位无关;但不可否认的是单个关键部位的梗死同样可引起痴呆,尤其是丘脑内侧核腔隙性梗死引起的丘脑性痴呆。另外,角回和额叶等关键部位,甚至内囊膝部的梗死也可引起认知障碍。最近的研究表明,VD与中枢神经系统内分布广泛的小缺血灶(腔隙性梗死)伴有显著的皮质下损害(基底节、白质、丘脑和海马)有关。
(3)海马改变 海马结构是痴呆患者MRI的首要研究对象。海马CA1区神经元含有丰富的谷氨酸受体,对缺血性损伤非常敏感。利用大脑中动脉闭塞动物模型的研究发现,皮质梗死伴有海马神经元迟发性死亡,动物实验亦证实,无论是局灶性还是全脑缺血,海马均可产生不可逆性脑损伤。对小血管病变导致的痴呆患者尸检发现,海马CA1区可见大量锥体细胞脱失,病理学改变明显不同于AD的异常蛋白质沉积,由此认为小血管病变是VD的独立发病因素,可能与海马CA1区的锥体细胞脱失有关。
(4)梗死部位与VD的相关性 关于痴呆与梗死灶的关系,多数学者认为脑梗死的部位、大小及数目与痴呆的严重程度有密切关系,双侧、多发、大小不一的梗死灶比单侧发病者痴呆发病率高,其中以基底节区、皮质下白质、丘脑多发性梗死多见,基底节区梗死引起的痴呆者比皮层梗死灶小、数目多。脑萎缩大部分表现为脑室、脑池、脑沟的局部扩大,仅少数为广泛性的萎缩,但常不对称,提示多发性脑梗死可引起脑萎缩。
在VD患者,重要部位的脑梗死被认为是引起痴呆的主要原因。丘脑前辐射的多发梗死较其他部位的梗死更易导致痴呆,表现为额叶、颞叶、半卵圆中心前部、内囊前肢、侧脑室体旁前部白质、尾状核及丘脑的梗死。额叶皮层下多发梗死是导致痴呆的一个重要因素,前额区可能与语言、抽象思维和高级智力活动有关,这些功能有赖于额叶皮层与丘脑及其他部位间纤维联系的完整性,而多发梗死使这一完整性遭到破坏。丘脑梗死可能与丘脑前核和乳头体、丘脑背核和间脑之间密切的联系破坏有关,乳头体丘脑束对于记忆有重要的作用,丘脑背侧核和间脑的密切联系与中枢整体功能有关。尾状核在调控前额叶功能和概念化记忆整合方面具有重要意义。
(5)梗死灶数目与VD的相关性 有研究报道,同样体积的脑梗死,在呈多发时易引起痴呆。这可能与小的多发性皮层下梗死灶更易打断皮层—皮层连接、丘脑—皮层连接以及皮质—纹状体通路,致使脑前部皮质分离。皮质下损害在阻断传导通路和导致脑功能不全上具有倍增效应,而不是简单的加法效应。
(6)梗死体积与VD的关系 有学者曾指出,至少需要50 ml的脑梗死,才可能导致患者痴呆,若梗死脑组织达100 ml则患者一定出现痴呆。然而在经尸检确诊的VD中,其脑梗死平均为40 ml,但其中有的少于10 ml,因此这些结果不尽一致,争议很多。总之,目前有学者认为脑梗死体积与痴呆有关,但梗死所在的部位比体积更重要。
(二)皮层下缺血性血管性痴呆
皮层下缺血性血管性痴呆(subcortical ischemic vascular dementia,SIVD)是血管性痴呆常见的亚型,占VD的36%~67%。其病理表现为腔隙性脑梗死和脑白质病变,常伴发皮层和海马萎缩以及基底节腔隙梗死。然而,近年来有学者指出,此类型痴呆不一定是脑动脉硬化的独立类型,而认为脑白质病变是慢性循环障碍所致的缺氧性改变,是供应深部白质长支动脉硬化的结果,另一些学者则认为60%~80%与血压有关,因多数重症病例有小动脉硬化,属于高血压性脑血管病。
1.影像学表现
(1)CT 脑室周围、半卵圆中心呈对称性或大致对称性低密度区,是缺血性微梗死与白质脱髓鞘的联合表现,呈月晕样。另外,基底节、内囊、丘脑、半卵圆中心可见单发或多发性腔隙灶。上述两种低密度灶无强化,这一点可与脑白质营养不良病变相鉴别。
重度与少数中度患者可见脑室扩大,是脑室周围脑白质萎缩的结果,使室管膜面参差不齐,呈碎布片状,说明室管膜下有微梗死,与正常压力脑积水主要累及前角,室管膜面光滑显然不同。
依据CT表现可将本病分为三型:1型病变局限于额角与额叶周围,尤其是额叶后部;2型病变围绕侧脑室体、枕角及半卵圆中心后部脑白质;3型病变环绕侧脑室周围,弥漫于整个大脑半球。
(2)MRI 在显示痴呆方面比CT优越。侧脑室前角、后角及体部周围显示对称性月晕状异常信号,在T1W I上呈长T1低信号,在T2W I上呈长T2高信号,此乃脑白质缺血性脱髓鞘改变,是MRI诊断本病的重要依据,在T2W I上最明显(图9-1-11)。
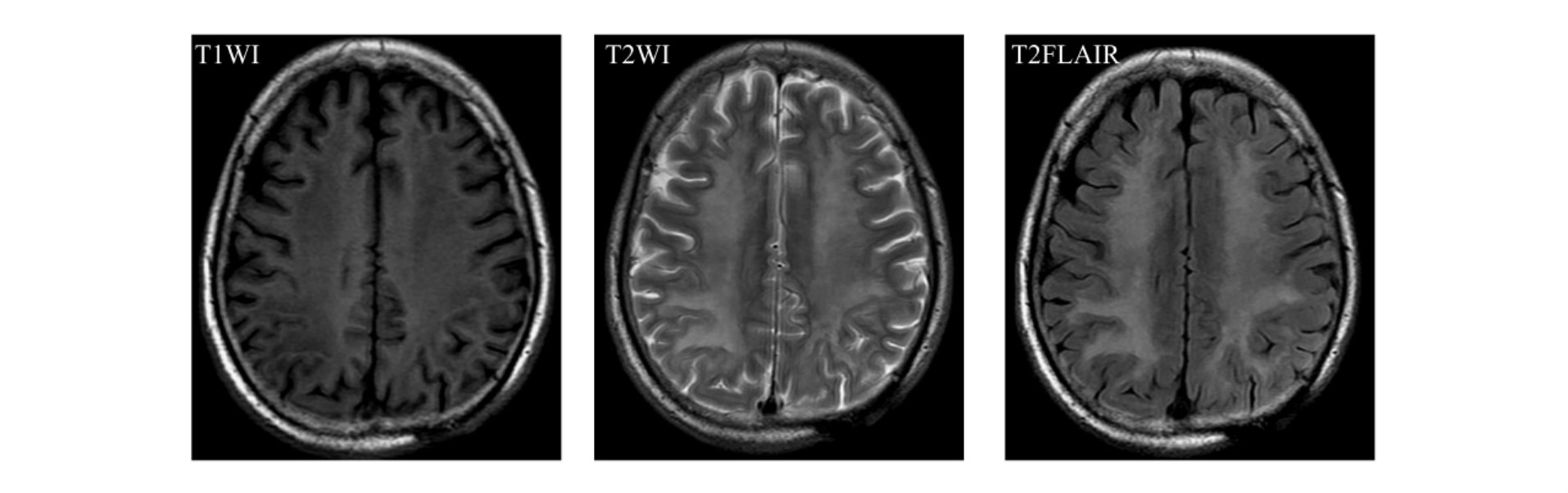
图9-1-11 脑白质缺血性脱髓鞘改变。MRI表现为半卵圆中心对称性月晕状异常信号,T1W I呈长T1低信号,T2W I呈长T2高信号
轻度患者上述脑白质异常信号仅局限于双侧侧脑室额角、额叶后部或枕角周围,患者表现轻度智能障碍或无明显症状。中度患者异常信号散布于侧脑室体部及前后角周围,范围扩大,但未见相互融合,临床上表现中度智能障碍。重度患者异常信号已环绕侧脑室体部和前后角,相互融合呈片,临床上表现重度智能障碍。
侧脑室周围、半卵圆中心及基底节区可伴有多发性腔隙性或大面积梗死。重度以及部分中度病例伴脑室扩大及脑沟裂加宽[3]。
2.影像学诊断应注意的问题
(1)脑白质病变(whitematter lesions,WMLs) WMLs在CT上表现为脑室周围或深部皮层下白质双侧对称分布的低密度区,MDI中T2W I或FLAIR上表现为高信号。由于CT和MRI对WMLs检出的灵敏度和特异度不同,故它们在确定WMLs的程度、位置和范围上并非完全一致。
正常成年人脑灰质血流量为半球深部脑白质血流量的3倍。深部脑白质区依赖穿支动脉供血,这些血管又细又长,而且比较稀疏,随着年龄的增长,脑血流量减少,但首先开始减少的区域是脑深部白质和基底节,如果同时伴有其他因素如脑外大血管阻塞、脑内小血管变性或粥样硬化、心输出量减少等情况,很容易超过对缺血的耐受阈值而引起脑损伤,因此在无症状的老年人脑深部白质中常常发现长T2高信号病灶,这实际上代表弥漫性缺血性改变,它们与痴呆有因果关系(图9-1-12)。其基本病理学改变为脑组织缺血,组织学上表现为局限性脱髓鞘、反应性星形细胞增生,部分区域出现轴突断裂和神经胶质细胞残骸,可伴有巨噬细胞浸润。这种以缺血改变为主的WMLs又称为缺血性白质疏松(ischemic leukoaraiosis,ILA),以别于其他原因,如正常压力性脑积水、部分脑部遗传性、感染性等疾病所致的WMLs。
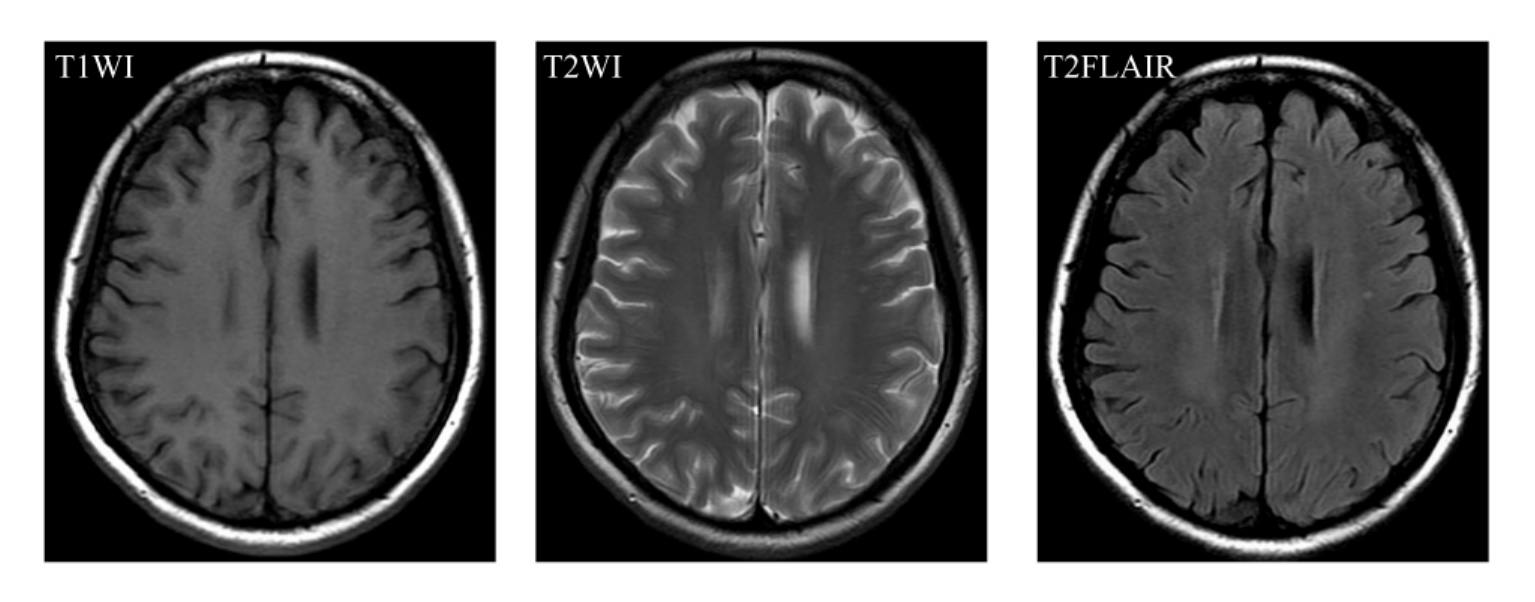
图9-1-12 脑白质缺血性改变。MRI表现为老年人脑深部组织呈长T2高信号病灶
在老年人,若在脑部MRI上发现慢性脑软化性斑片状缺血灶,诊断应予谨慎。65岁以上的老年人在大脑半球深部常显示缺血性改变,在有脑血管病危险因素的老年人中,脑MRI可见T2高信号灶,散布于半球深部白质区与基底节,如果临床上有高血压及痴呆,即应诊断为SIVD。
(2)腔隙性梗死 腔隙性脑梗死是SIVD的影像学特点之一。慢性期,CT上腔隙性脑梗死表现为低密度,FLAIR或T2W I上为高信号,质子加权像上信号强度高于脑脊液。其有别于扩大的血管周围间隙,后者位于前联合水平和壳核下方,质子加权像信号强度与脑脊液相同,直径多为1~2 mm。(https://www.daowen.com)
腔隙性脑梗死与认知障碍和痴呆的关系目前仍存在争议。根据腔隙性假说,认知障碍主要与腔隙性脑梗死的数目和体积有关,尤其是位于额叶皮层下环路的腔隙性脑梗死。另外,也有研究认为腔隙性脑梗死的体积、数目和发生部位与认知障碍无显著相关。
(3)普遍性脑萎缩 普遍性脑萎缩(皮质萎缩和白质萎缩)也是常见的增龄性脑形态学的改变,其表现为脑沟增宽和脑室扩大。在健康老年人中,皮质萎缩和白质萎缩与思维灵活性及抽象推理能力下降有关。对于脑中风患者,脑萎缩是中风后痴呆的重要预测因素。研究显示,VD中脑总体积与整体认知功能之间有很明显的相关性,而WMLs体积与特定的认知障碍如注意和执行功能障碍有关。而另有研究发现脑萎缩和脑室周围WMLs是认知障碍的独立预测因素。
(4)胼胝体萎缩 胼胝体是脑内最大的白质联络纤维。胼胝体萎缩可见于正常老龄、慢性酒精中毒、脑外伤、AD和VD等情况。在缺血性脑白质疏松症患者中,胼胝体萎缩与整体认知功能障碍有关。VD和AD中胼胝体萎缩的机制可能不同。研究证实AD患者出现胼胝体膝部及压部局限性萎缩,且是反映AD病程的重要指标。与正常老年人相比,AD和VD患者胼胝体均表现不同程度萎缩,但胼胝体总面积在AD和VD间无显著性差异。AD患者胼胝体的厚度与脑重量相关,而VD中胼胝体萎缩与深部WMLs的严重程度密切相关。免疫组化研究发现VD中胼胝体呈现明显的轴索损伤和胶质增生,神经纤维密度降低18%~26%,而AD则无此表现。因此得出AD中胼胝体萎缩与脑萎缩相关,而VD中胼胝体萎缩为脑深部白质病变继发性损害(图9-1-13)。
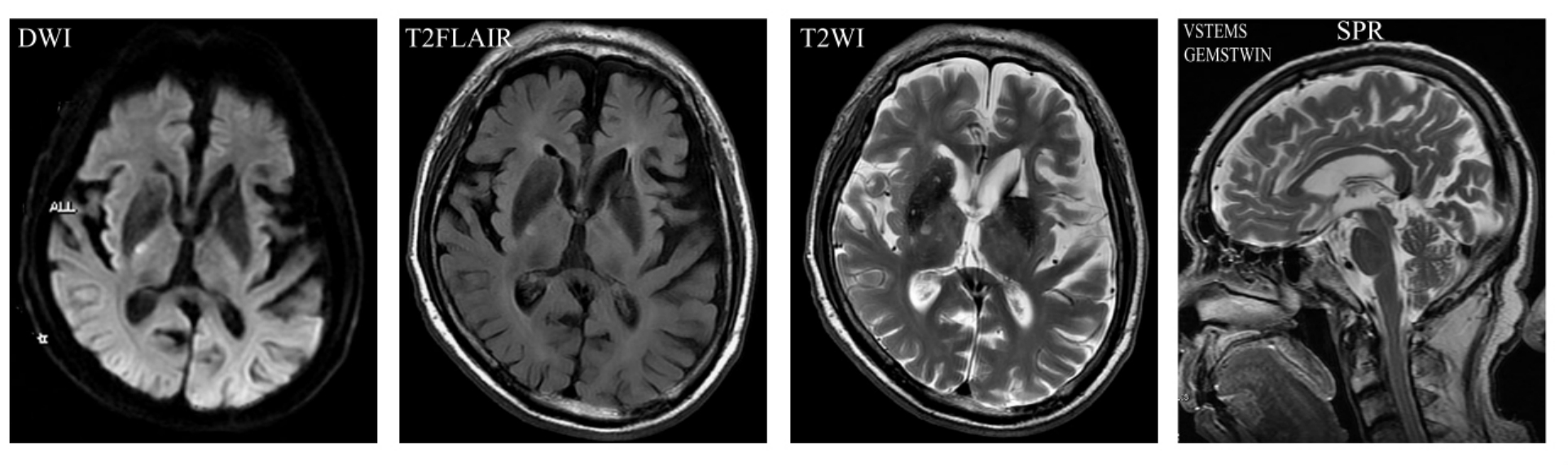
图9-1-13 胼胝体萎缩合并丘脑梗死及多发性脑腔隙灶
(5)海马萎缩 海马萎缩被认为是AD的典型改变,主要与海马内过多的老年斑和神经元纤维缠绕有关。既往的研究发现VD患者也存在海马萎缩。SIVD患者海马和皮质体积分别较正常对照减少了26.0%和10.9%,海马和皮质萎缩可预测SIVD患者的认知障碍;有研究显示SIVD和AD表现为类似的皮层和边缘系统的退变,尤其是海马出现广泛的微血管病变。对常染色体显性遗传性脑动脉疾病伴皮层下梗死和白质脑病,CADASIL患者的海马研究发现其体积是CADASIL认知障碍的独立预测因素。尽管如此,目前仍不清楚VD中海马萎缩是否反映了共存的AD病理或者是与脑血管病相关的独立现象。
总之,腔隙性梗死、白质异常高信号在VD发病机制中均具有一定的促进作用,海马萎缩虽然与AD密切相关,但随着神经科学和影像学的发展,人们注意到血管性病变引起的海马结构和功能的改变同样影响着患者的认知水平。通过MRI和MR波谱分析有可能从结构和代谢紊乱两方面对VD做出较早的评价。
三、痴呆的影像学研究进展
随着经济的发展,人口寿命的延长,老年期痴呆的发病率有增高趋势,给患者、家庭及社会带来了沉重的负担。目前我国,60岁以上人口老年痴呆的患病率高达2.9%,因此老年痴呆的诊断引起越来越多的重视。目前临床对痴呆的病因鉴别诊断较为困难,主要依靠临床病史、体征、检测量表、影像学表现等综合判断,其中影像学的表现在定性诊断中具有较为重要的作用。痴呆的影像学研究进展包括形态学和功能影像学方面的研究进展。
(一)形态学的进展
脑室系统和海马的形态学改变反映了痴呆的影像学特征表现。
海马属于古皮质,是边缘系统的重要组成部分,海马与丘脑前核群、板内核群、扣带回等组成的神经环路是调节行为、学习和记忆、情绪反应的重要的神经解剖学基础。认知功能的下降与颞叶海马萎缩有关,而且随着年龄的增长认知功能障碍者较认知功能正常者的海马萎缩程度更为严重。
MRI对软组织分辨力高,对脑灰白质的分界显示良好,又能做直接冠状位和矢状位扫描,因此在测量颞叶、海马和杏仁核方面有明显优势。MRI对这些部位不仅能够做到线性测量,还可以进行面积甚至体积测量。线性测量的优势是简便易行,其缺点是由于这些解剖结构不规则,易致测量数据不准确。这些指标主要包括纵裂宽度、侧脑室额角宽度、海马沟回间距、海马高度、中颞叶最小厚度、颞角宽度和脉络膜裂宽度。MRI对面积和体积测量主要是对杏仁核、海马和海马旁回进行体积测量,对颞叶、侧脑室颞角、侧脑室体部断面和外侧裂进行面积测量。有文献指出,AD患者脑萎缩,其灵敏度依次是颞角、海马旁回、海马和颞叶,而杏仁核萎缩并不明显。因此MRI体积和面积测量对AD的影像诊断可提供重要依据。
1.脑室扩大 脑室扩大认为是诊断痴呆的一个指标。有文献报道,如果总的侧脑室横径1年增大3 cm即有诊断意义。研究发现AD和MID者的脑室系统是有一定程度变化的,主要区别在侧脑室体部、第三脑室及外侧裂等宽度变化方面,前者比后者明显增宽,且异常发生率也较高,CT表现对于鉴别二者有一定的临床参考价值[4]。
AD和MID的脑室系统宽度变化既有不同之处,也有共同之点。不同的在于AD者的侧脑室体部、第三脑室及外侧裂明显增宽外,他们的痴呆病程较长,高血压中风史较少,认知功能障碍更严重。相同的在于他们都可出现不同程度的脑萎缩征象,只是MID脑萎缩的程度较AD轻,各部位异常增宽发生率较低,智能损害相对较轻,表明AD的脑室系统中不是所有部位都会发生脑萎缩。在脑室系统几个容易发生萎缩的部位,不是所有患者都显示这一特点,MID者更是如此。
2.测量颞叶沟回间距在诊断AD中的价值AD是一种神经系统退行性疾病,目前病因未明。该病的早期临床表现为记忆功能障碍,继而出现全面智能衰退与神经功能障碍。病理除大脑皮层的广泛萎缩外,主要是海马、杏仁核以及颞叶萎缩、变性,是造成MRI上颞叶沟回间距增宽、大脑容积缩小的病理学依据。
通过CT线性测量能够反映海马萎缩的海马沟回间距,如果以海马沟回间距20 mm作为提示认知功能障碍的标准值,其敏感度达98.14%,但特异度仅6.14%,将诊断标准值定在25 mm时,其敏感度有所下降(56.48%),但特异度(50.12%)有提高,如再结合皮质脑萎缩或混合脑萎缩其特异度有较大幅度的提高。随着CT的普及、软硬件的不断更新、空间分辨率和密度分辨率的不断提高及其扫描简便、快捷、经济,易被广大患者接受,并且亦能够对某些部位进行薄层或超薄层扫描,并可进行精确的线性测量,因此适用于对高危人群的普查。
2026年,有学者首次利用MRI颞叶沟回间距诊断AD,并认为AD患者的颞叶沟回间距均大于30 mm。
在AD患者中颞叶、海马、杏仁核的容积萎缩更为明显,因此颞叶沟回间距/大脑左右径比值明显增大。颞叶沟回间距小于30 mm的临床属于轻型痴呆,因此颞叶沟回间距的测量有助于AD的诊断;AD的颞叶沟回间距/大脑左右径超过0.22的高达100%,VD中颞叶沟回间距大于30 mm仅为3.77%,VD组中颞叶沟回间距/大脑左右径超过0.22的为3.77%。因此颞叶沟回间距和颞叶沟回间距/大脑左右径相结合提高了对AD诊断的敏感性和特异性[5]。
3.测量海马体积在痴呆诊断中的价值包括杏仁核、海马结构、内嗅皮层、海马旁回及侧脑室颞角萎缩是AD的特征性病理改变。
AD与VD约占全部痴呆病例的90%,而SIVD则是VD中的最常见类型。由于VD与AD的临床表现有重叠,鉴别诊断有一定难度,所以寻找影像学鉴别诊断指标十分必要。
杏仁核—海马复合结构萎缩并非AD的特异性改变,亦可见于VD患者。研究证实SIVD者存在海马结构萎缩及侧脑室颞角扩张。目前已知海马结构在正常脑老化过程中仅齿状回的门部(hilus)和下托(subiculum)出现神经元丢失,其萎缩并不明显。AD患者病理检查可见老年斑(senile plaque,SP)和神经元纤维缠结(neurofibrillary tangle,NFT)增多,特异性累及海马结构的CA1区,神经元大量丢失引起海马结构显著萎缩。研究表明SIVD海马结构亦可发生萎缩,可能与下列因素有关:SIVD患者新皮层中出现SP,但其数量未达到AD的诊断标准,称之为AD样病理改变。尽管AD的诊断标准排除了VD的存在,但最近有关AD流行病学和发病机制的研究表明血管因素参与了AD的发病。例如:高血压被认为是VD(尤其SIVD)和AD的共同危险因素,有研究发现无痴呆高血压患者SP与NFT的数量较非高血压者显著增多。此外,尸检发现许多临床诊断为VD的患者,大脑中有AD样病理改变。脑血管病(cerebrovascular disease,CVD)诱发AD样病理改变的机制至少涉及以下几方面:①高血压加重大脑毛细血管退变,引起脑组织低灌注使神经元代谢率下降,加速了AD的病理进程。②载脂蛋白E(ApoE)ε4基因型是晚发型AD和VD共同的易感因素,ε4携带者发生AD的几率是未携带者的3倍。动脉硬化性小血管病是SIVD的病理基础,而ε4患者血胆固醇增高,可加速动脉粥样硬化的发展。③脑缺血可诱发多种细胞生物学反应,包括:在低灌注脑区形成淀粉样蛋白前体(amyloid precursor protain,APP)和β淀粉样蛋白(β-amyloid protain,β-AP),而β-AP是SP的主要成分;氧自由基形成可诱导β-AP的细胞毒性作用;诱发早老素1基因(presenillin1,PS1)的突变。缺血、β-AP、氧自由基及PS1突变均可激活或诱导细胞凋亡(apoptosis)过程。
海马结构、尤其CA1区的神经元容易遭受缺血损伤,脑缺血可引起内颞叶硬化。心搏骤停引起全脑缺血缺氧造成痴呆的病例中,尸检发现其海马萎缩,CA1区、下托及杏仁核的神经元丢失及胶质增生。SIVD患者晚期全脑血流量下降也是引起内颞叶硬化的病理基础。SIVD者在严重白质病变和海马萎缩的双重作用下颞角显著扩张,所以与正常对照者判别分析,颞角扩大具有很强的判别意义。
内嗅皮层除具有较大的AD诊断价值外,还具有鉴别AD与SIVD的作用。由于AD和SIVD均可致颞角扩大,故颞角扩大无鉴别诊断价值。研究发现,在相同认知障碍水平AD合并CVD者的新皮层SP和NFT数量显著低于纯AD者。以MRI为基础的体积测量来区分正常对照者、AD及SIVD患者已进行了许多研究。进行线性测量与体积测量的相关性分析从而筛选出准确易行的线性测量指标应是研究痴呆性大脑结构改变的方向。但体积测量的复杂性使其在临床中难以推广应用。
总之,内颞叶结构MRI体积测量有助于AD与SIVD的鉴别,但同时必须充分考虑SIVD中可能存在的AD样病理改变,以及AD与CVD在引起认知功能下降时的叠加作用[6]。
4.测量胼胝体在痴呆诊断中的价值
胼胝体位于大脑中央,由连接左右大脑半球的白质纤维构成。在头颅的正中矢状面上看到的是胼胝体白质纤维的横断面,此断面胼胝面积的减少可以反映胼胝体白质纤维的萎缩,因此可以通过测量胼胝体正中矢状面的横截面积来评估胼胝体的萎缩程度。
在AD患者中,胼胝体正中矢状横截面积明显小于对照组,提示左右大脑半球联系的减弱可能参与了AD的病理生理过程。VD组患者胼胝体正中矢状横截面积与AD组相似,也明显小于对照组,但也有研究结果表明VD患者胼胝体的面积与对照组差异无显著性意义。有研究表明,AD患者组胼胝体各部位的厚度都明显较对照组减少,以胼胝体的前中部萎缩更显著。
胼胝体各部位的厚度在AD组与VD组间差异亦无显著性意义,表明AD与VD患者在胼胝体形态的改变上可能存在某些共同之处。AD与VD患者胼胝体的显著萎缩,提示AD与VD患者可能存在着大脑左右半球沟通障碍,但不能作为两者的鉴别依据[7,8]。
5.测量白质疏松的体积在痴呆诊断中的价值
海马体积测量能够区分AD、VD组与正常对照,提示AD患者显著的萎缩发生在该部位,其神经病理学改变可能优先发生在这些区域,然后再向其他皮层区及皮层下区发展;根据LA体积结果可初步认为小血管病变所致的白质损害是VD的主要发病机制之一。定量体积研究能够区分AD、VD组与对照组,但是可区分的程度文献报道不同。AD、VD组与对照组比较,前2组海马体积均显著小于对照组;LA体积均显著大于对照组; AD与VD比较,AD组的海马体积显著小于VD组,VD组的LA体积显著大于AD组。亦有研究发现定量体积研究不能完全区分2组。
总之,MRI对海马、LA体积的定量测量在区分AD、VD与健康对照中起着重要作用[9,10]。
(二)功能影像学的进展
MRI功能成像可同时提供解剖和生理信息,其中,临床常用的MRI功能成像有磁共振波谱和弥散加权成像。
1.磁共振波谱成像在老年性痴呆中的应用
近年来,质子磁共振波谱(proton magnetic resonance spectroscopy,1H-MRS)作为一种无创性活体组织代谢与生化指标测定技术已逐渐应用于临床。国内外学者利用1H-MRS对阿尔茨海默病和血管性痴呆进行了不少的临床研究。
(1)1H-MRS的基本原理及其稳定性1HMRS是一种利用磁共振现象核化学位移效应,进行一系列特定原子核及化合物分析的功能影像学检查方法。原子核的共振频率不仅取决于外加磁场强度和原子核自身的物理性质,同时还受原子核在化合物中的化学环境的影响。即使是同一种原子核(如氢原子核),其所在的化合物的化学环境不同,其进动频率就不同,产生核磁共振的频率也就不同,在波谱上产生共振峰就存在差别,这种现象叫化学位移。由于化学位移的不同,不同化合物可以根据其在1H-MRS上共振峰的不同加以区别。共振峰的面积与共振核的数目成正比,它能反映化合物的浓度,因此可以用来进行定量分析。
1H-MRS成像技术包括单体素MRS和多体素MRS,其中多体素MRS又包括二维和三维MRS成像技术。单体素MRS选择性采集某一立方体体积内组织的波谱,1次仅能提供1个兴趣区化学成分的信息,如需检查1个以上兴趣区多部位的化学信息需重复扫描。其优点是每次采集前MRI机器均进行了完整的脂肪抑制和水抑制,受邻近组织干扰小,获得的波谱信噪比高,结果可信度高。其缺点是感兴趣容积(volume of interest,VOI)为立方体,为获得较好的信噪比,VOI必须足够大(如2.2~15 ml),因其内可包含非目标性脑组织,造成了1H-MRS的部分容积效应,致使空间分辨力降低。多体素MRS也称为磁共振波谱成像(magnetic resonance spectroscopic imaging,MRSI)或者化学位移成像(chemical shift timaging,CSI)。1次采集可以同时获得多个部位的谱线或代谢图,依赖三维定位技术,每一个波谱采集前需要先做x、y、z轴三个方向的匀场和抑水,对设备要求高,检查时间长,约为单体索MRS检查时间的1~4倍,每一体素的波谱都受邻近体素影响,信噪比相对较差,可信度低于单体素MRS。
目前,临床根据不同目的选择不同的定位方法。痴呆是弥漫性脑组织病变,AD病变发展过程按照内嗅皮层/内嗅皮层移行区经海马、扣带回至颞叶外侧、额叶及顶叶、枕叶的顺序发展,病理特征为大脑皮质形成大量老年斑和神经元纤维缠结,皮质萎缩、神经元减少,皮层是病变原发部位。而VD发病机制不一,大多数研究选择临床过程和影像学表现相对均一的皮层下小血管病变患者作为研究对象,主要病理特征是小血管病变引起腔隙灶,或下半卵圆中心白质、皮层下深部白质和灰质的慢性缺血缺氧,被覆皮层出现继发性异常改变乃至萎缩,导致全脑萎缩。AD与SIVD临床表现与影像学表现存在一定的重叠,但疾病的病理生理具有不同的发展模式。
1H-MRS研究的主要对象是NAA、M I、Cr和Cho(图9-1-14)。
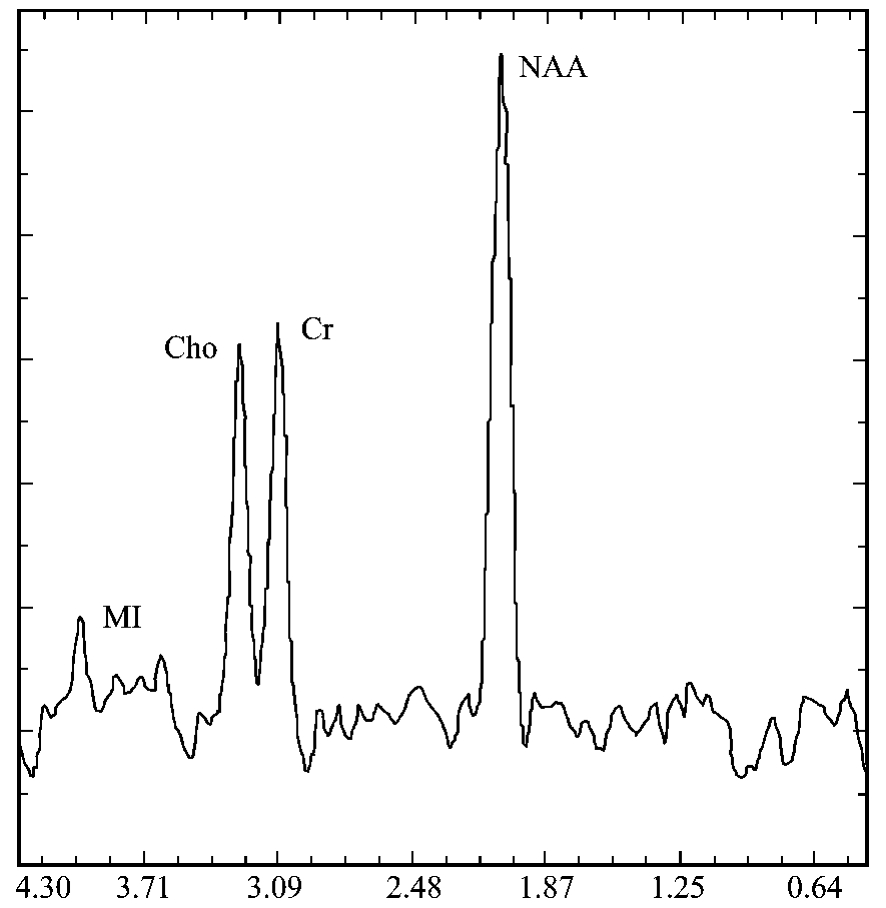
图9-1-14 正常IH-MRS。N-乙酰基天门冬氨酸(NAA)存在于神经元中,肌酸(Cr)浓度水平反映了脑内能量代谢水平,胆碱(Cho)包含着如甘油磷酸胆碱等物质,肌醇(M I)通常被认为是神经胶质的标记物
N-乙酰基天门冬氨酸(NAA)存在于神经元中,具有较高的浓度,免疫细胞生化和其他方法的研究均证实NAA是神经特有的物质,均匀分布于全脑,因此被认为是神经元的标记物。有研究认为NAA的浓度与年龄、性别之间无明显关系。有学者认为NAA浓度的降低主要是神经元的丢失所致。在额叶AD和VD的患者中NAA浓度较正常对照组均明显下降,而AD和VD之间无统计学差异,在海马区AD患者的NAA浓度较正常对照组和VD均明显降低。还有研究认为AD患者痴呆程度与额叶、颞叶NAA浓度呈负相关。另外,轻度痴呆的AD患者在海马区的NAA浓度与VD组相比即有明显差异,可望以此作为AD与VD的鉴别要点,并可能为AD的早期诊断提供帮助。
肌酸(Cr)浓度水平反映了脑内能量代谢水平。有研究认为其在脑内不同代谢条件下其总量是恒定的,因此,可将Cr作为参照的波峰进行比较。其比值虽不能反映代谢物的来源,但可以借此除外脑脊液等因素的影响。
胆碱(Cho)包含胆碱、磷酸胆碱和甘油磷酸胆碱等物质,其与年龄之间的关系以及在AD等神经变性病变中的作用还有待进一步研究。有研究认为在正常健康人中随着年龄的增长额叶灰质内的Cho浓度增高,基底节区和额叶白质内Cho的浓度则降低。但也有研究认为Cho浓度与年龄之间无明确关系。
肌醇(M I)通常被认为是神经胶质的标记物,其浓度的增高被认为是胶质增生的指征。有研究认为成人脑内M I浓度与年龄无关。多数研究认为AD患者颞叶M I浓度增高是痴呆的特征性表现。AD患者颞叶和海马区的M I浓度均较VD和对照组明显增高。有研究认为认为海马结构的嗅皮层和海马下角区域为信息进出海马的主要通路,对新信息的学习和保持有重要作用,该区域的损伤导致AD患者临床表现为顺行性和逆行性记忆障碍。病理表现为海马区老年斑、神经元的丢失、神经元纤维缠结和神经胶质增生。因此,NAA浓度降低和M I浓度的升高可能是AD患者特征性改变,可与VD进行鉴别。由于轻度痴呆的AD患者已在颞叶和海马区被发现MI浓度有明显升高,因此,它为早期AD的诊断提供帮助。
(2)1H-MRS在痴呆诊断中的应用[11]
1)在正常脑老化、轻度认知功能损害及痴呆临床研究中的应用:轻度认知功能损害(mild cognitive impairment,MCI)是一种介于正常老化与痴呆间的临床状态。流行病学研究表明每年大约有10%的MCI患者转化为痴呆;有超过50%的MCI患者在3年内转化为临床痴呆,而9.5年后转化为临床痴呆的MCI患者几乎达到了100%。以往认为其主要特点是记忆功能在主观和客观检查上均有不同程度的减退,而日常生活能力保留。但近年来多数学者认为MCI不仅只表现在记忆功能损害上,同时可以伴有其他认知功能损害,从而将MCI分为了四型:①单纯遗忘型MCI;②以遗忘型为主且包括其他认知功能损害的MCI;③单纯其他认知功能损害型MCI;④以其他认知功能损害为主同时包括一定遗忘表现的MCI。这里所指的其他认知功能包括语言功能、注意和执行功能等。既然MCI被看做是痴呆的临床前状态,而遗忘型MCI更主要是转化为AD,那么早期诊断MCI并及时干预,对延缓痴呆的进展具有重要意义。
近年来神经病理学尸检研究发现,MCI虽然达不到临床痴呆的诊断标准,但其大脑的病理变化,如内侧颞叶萎缩、神经纤维缠结的程度与数量等,与正常脑老化表现出显著不同。进一步的1H-MRS分析发现更易发展为临床痴呆的MCI患者大脑内的一些生化物质在早期就已经表现出了显著的差异。正常老化、轻度认知功能障碍及痴呆患者的脑内这些生化物质的差异,可能为临床早期诊断痴呆提供重要线索。易转化为痴呆的MCI患者在痴呆症状出现前就已经表现出海马和颞中叶区NAA及NAA/Cr值的显著降低及M I/Cr值的升高。1年后转化为痴呆的MCI患者左侧大脑半球的NAA/Cr值(1.48±0.08)明显低于未转化为痴呆的MCI患者(1.65±0.12)及正常对照组(1.63±0.16)。因此,提示通过1HMRS检测大脑代谢物质的含量可筛查出更易转化为痴呆的MCI患者。基于此,目前试图明确这些代谢指标的变化趋势及临界值,但不同的研究者得出的结论却有所不同,甚至有些是相反的结果。对老年MCI患者进行前瞻性研究发现在早期具有较高Cho/Cr值的MCI患者,在未来4年内转化为痴呆的几率更大(95% CI,1.05~2.28),认为Cho/Cr值高可以作为判断MCI转化为痴呆的一项指标;当应用1H-MRS分别测定正常老年人、MCI及痴呆患者双侧大脑白质、灰质及海马时,结果表明MCI与痴呆患者海马处的NAA/Cr值并无显著差异(MCI:1.00±0.12,痴呆:1.00±0.15),而外侧灰质的M I/NAA值存在明显差异,MCI与痴呆患者海马处NAA/Cr值较正常老年人显著降低(图9-1-15)。
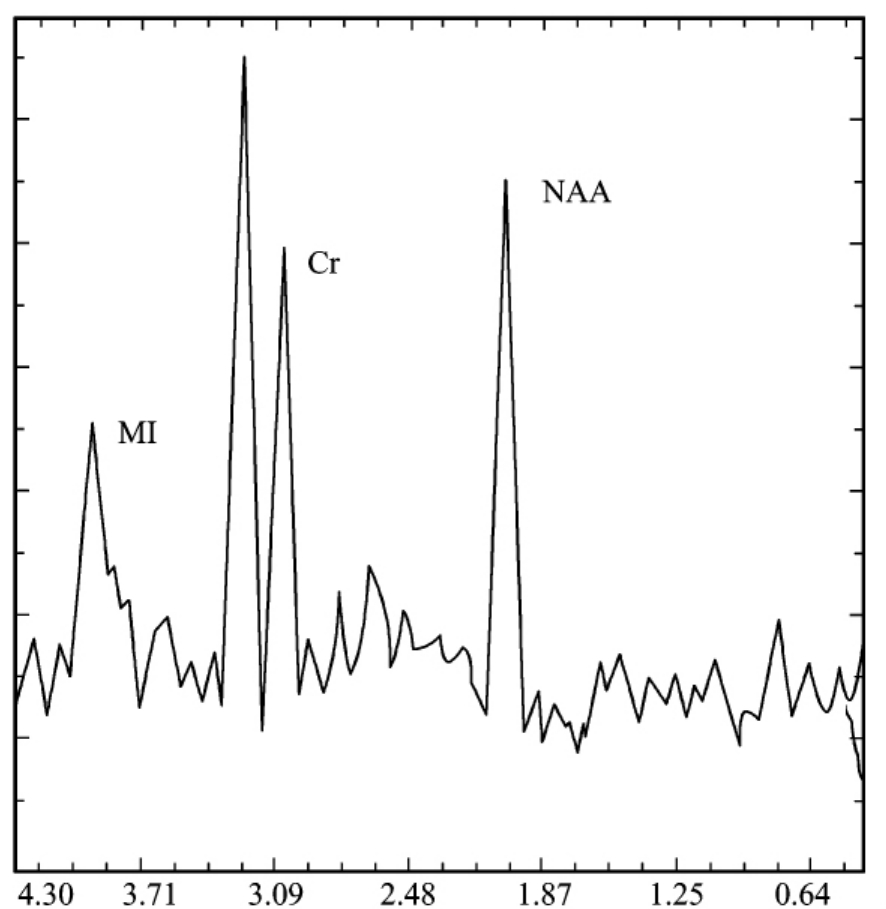
图9-1-15 痴呆患者的1H-MRS。表现为胆碱峰升高,N-乙酰基天门冬氨酸峰降低
在现有的这些研究报道中,有的研究者认为MCI与痴呆患者脑内很多区域的NAA/Cr值并无显著差异,而有的研究表明即使是在MCI患者之间都可以表现出NAA/Cr或Cho/Cr值的显著差异。最近研究认为产生上述矛盾的原因主要有两个方面:其一,有的研究者没有将MCI患者中易转化为痴呆的一部分MCI患者筛选出,从而导致了整个MCI患者与痴呆患者之间的测量误差;其二,不同的学者对所选MCI患者的限定条件不同。如前所述,MCI分为四型,而不同类型MCI的大脑主要受损区域是不同,譬如遗忘型MCI主要表现为内侧颞叶萎缩和海马硬化,以执行和注意损害为主的MCI主要表现为前额叶皮层的损伤,若仍然检测同一个部位的代谢水平则会出现误差。这些研究提示,在MCI的研究过程中应该将其进行细分为不同的类型,以减少选择对象的误差。
2)在AD与VD鉴别诊断的应用:AD和VD的危险因素、临床表现及脑组织病理改变常有复杂的联系。长期以来,不少学者对VD的临床诊断标准提出异议,因为VD的诊断标准很大程度上是源于AD的临床标准,但二者之间无论是病理改变还是治疗转归都有很大的不同。近年来许多研究证实AD患者的大脑中有血管病变的存在,并认为这些血管病变(尤其是小血管病变)在AD的进展中起到了一定作用。这些研究说明目前AD和VD的临床鉴别诊断有一定困难。
常规影像学检查(包括常规MRI在内)可以为临床诊断提供形态学上的支持依据,但难以准确鉴别痴呆的类型。1H-MRS对痴呆研究最有意义,和常规MRI检查同时进行,能提供更多的诊断信息。M I异常出现于AD早期阶段,NAA/M I比值是诊断AD很有价值的指标,其敏感性和特异性分别为98%和90%。因此1H-MRSI检测对AD早期诊断具有非常重要的意义。对大脑皮质进行研究发现,AD患者枕叶M I/Cr明显高于VD患者,且AD组M I/NAA与简易智能量表(MMSE)的结果具相关性,而VD不存在此相关性。同时发现,两组患者NAA/Cr和Cho/Cr的降低没有明显差别。然而,有研究显示,AD和VD均可出现NAA/Cr比值降低,M I/Cr比值增高,但存在区域的差异,AD以颞顶叶代谢改变为主,VD为全脑但以皮质下改变最为明显,这项研究与AD和VD的不同病理变化是吻合的,因为AD主要是皮层尤其是内侧颞叶及海马的神经元变性,而VD更多表现在皮层下小血管的病变。另有研究发现,AD和VD在海马及白质等处的NAA、NAA/Cr值及Cho/Cr值并无显著性差异,但AD的M I/Cr值明显高于VD,具有显著差异,认为M I/Cr值可能被看做是AD和VD鉴别诊断的指标之一。
总之,AD和VD存在着许多病理改变上的重叠,仅以一个或几个指标的异常难以鉴别二者,因此大量的深入研究和多个诊断手段的联合研究是非常必要的。
(3)在痴呆治疗效果评估中的应用
1)1H-MRS能够用于评价痴呆的疗效:由于痴呆的临床病程随着时间而进展,痴呆患者病变范围不断扩大,患者认知、记忆能力逐渐下降。1H-MRS可通过化合物浓度变化来反应痴呆的病理改变,1H-MRS对NAA/Cr,NAA/M I,M I/Cr及这三种化合物浓度绝对值的测量具有较高的可重复性和稳定性。
AD患者MMSE评分与右半球脑皮质NAA/ Cr呈明显正相关,可反映痴呆的严重程度,另有研究表明AD患者的NAA/M I与MMSE之间存在正相关,而M I/Cr和MMSE之间呈负相关。最近通过探讨轻度认知功能障碍、AD患者1H-MRS与认知指标(痴呆分级和听说测试成绩)间可能存在的联系,发现NAA/M I的回归分析效果最好。另一项研究发现AD患者MMSE评分和扣带回后部NAA/M I(主要是NAA/Cr的成分,M I/Cr的作用要小)存在密切联系,但是这一现象未见于血管性痴呆患者。
SIVD以皮质下白质损害为主,皮质下白质的NAA/Cr和NAA/Cho比值与AD患者相比明显减低,皮质下白质的1H-MRS研究有望发现与MMSE评分的关系,寻求临床检测VD病程进展的客观指标。并且不同部位NAA的变化与MMSE评分的关系可在一定程度上鉴别诊断VD与AD。
2)1H-MRS对痴呆疗效的观察:在痴呆治疗效果的观察中,临床表现的改善如症状好转、神经心理测试评分增高等往往出现的比较迟,CT或MRI短时间内又难以观察到脑组织明显的结构改善,而NAA作为反映神经元功能活性及完整性的生化指标,其含量的增减可以反映痴呆治疗的效果。
VD患者给予胆碱酯酶抑制剂治疗后,患者脑内NAA/Cr值明显高于对照组,Cho/Cr值则明显降低。服用胆碱酯酶抑制剂(12 mg/d)的轻度AD患者与未服用胆碱酯酶抑制剂的轻度AD患者,4个月后的临床认知量表评分并没有显著差异,但1H-MRS分析已经显示接受治疗后患者额叶的NAA/Cr显著高于未治疗组,M I/Cr值显著降低。这说明尽管临床症状尚未得到改善,但药物对神经代谢的改善作用已经表现出来了。
正常颅压脑积水(normal pressure hydrocephalus,NPH)是临床上少数的可治性痴呆之一,早期手术治疗对于其临床改善有重要意义。分别对NPH患者手术前和手术后第6个月进行认知功能评分、步态评分及额叶1H-MRS分析,发现手术后6月患者的MMSE评分尚无明显改善,但额叶的NAA/Cr值较手术前已经有了显著升高,NPH步态异常也得到了明显改善。可见1H-MRS分析比神经心理检测能够更早地观察到痴呆治疗的效果。
随着痴呆的临床研究的深入,对痴呆的认识也在不断加深,出现了一些新疗法。对于疗效的监测,常规影像学很难发现明显的改变,1H-MRS对检测生物化学方面改变的监测,具有很大的意义。
综上所述,磁共振波谱分析作为一种无创性、可直接观察人体内生化物质含量改变的影像学技术,在痴呆的早期诊断和疗效观察中起到了重要作用:①可通过检测以记忆功能损害为主的轻度认知功能障碍患者海马NAA/Cr值、Cho/Cr值,来预测其转化为痴呆的可能性大小。②1HMRS通过对健康老年人最易出现萎缩和生化物质含量改变的区域如海马、扣带回的检测,可作为认知功能障碍发生的评估和筛查工具,且磁共振波谱在痴呆疗效观察上更是具有其他方法所不能比拟的优势。③当患者的临床症状尚未明显改善时,我们就可以通过观察患者脑内NAA/ Cr等值的改变,来判断治疗手段是否起到了效果。④另外,磁共振波谱分析反映的是神经元变性坏死过程中生化改变的普遍现象,其对痴呆的诊断特异性尚待进一步的研究,尤其是MCI分型的提出为认知功能障碍的磁共振波谱研究提供了新思路。相信随着更多的对1H-MRS的研究和技术的不断完善,1H-MRS能够从细胞功能代谢的角度对痴呆进行深入的研究,明确病理变化过程,鉴别痴呆的类型,监控疾病的发展演变,但是目前的研究结论尚未获得病理及病理生理的证实,检查方法本身较为复杂,尚未应用到日常的临床实践中。随着研究的深入,1H-MRS能够成为痴呆重要的影像学检查手段,提高痴呆类型诊断的准确度,以及监测疾病的发展过程。
2.磁共振弥散张量成像在老年性痴呆中的应用
随着MRI的进展,磁共振弥散加权成像(diffusion weighted imaging,DWI)和弥散张量成像(diffusion tensor imaging,DTI)主要用来评价组织结构的完整性,是功能磁共振成像的一个重要组成部分,已经用于对老年性痴呆的研究。
(1)DTI的基本原理以往痴呆的诊断主要靠临床表现、神经心理学测试和一定的实验室检查,常用的有MMSE、日常生活能力量表(activities of daily living,ADL)、长谷川痴呆量表(Hastgawa dementia seale,HDS)及维生素B12、叶酸水平、同型半胱氨酸水平测定等。实验室检查的主要目的在于排除一些可预防性痴呆,如维生素缺乏症、病毒感染、内分泌疾病等,也可确认某些可预防性痴呆如VD或不可逆性痴呆如AD等。MRI、PET-CT用于临床后,为痴呆诊断提供了更多更准确的信息。MRI准确显示AD患者内颞叶结构如杏仁核、海马结构、内嗅皮层、海马旁回、侧脑室颞角萎缩。在VD患者亦可显示相似的脑萎缩及由血管闭塞导致的脑梗死。内颞叶结构MR体积测量还有助于区分AD与SIVD。PET-CT显示痴呆患者葡萄糖代谢功能减低。AD主要是皮质性痴呆,对白质的研究很少。常规的MRI技术不能提供白质纤维受损的情况。弥散张量成像是目前惟一能在活体人脑组织显示白质纤维束的走行、方向、排列、髓鞘化情况的无创性新技术,有望揭示痴呆白质改变的影像学信息。
1)磁共振弥散加权成像:DWI是一种测量自旋质子的微观随机位移运动的较新技术。目前在活体中主要是测量水分子的运动,其图像对比度主要用于观察水分子的位移运动,它通常是在标准MRI序列上再加上对弥散敏感的梯度脉冲来获得。水分子的运动特性可以用弥散敏感梯度方向上的表现弥散系数(apparent diffusion coefficient,ADC)表示,加上“表观”二字是由于影响水分子运动(随机和非随机)的所有因素都被叠加成一个观察值。
常规MRI系统中测得的水分子典型弥散值为1×10-3 mm2/s。在这一弥散速度下,自由水分子将在20 ms内弥散约6μm的距离。人体约含70%的水,不同的组织弥散系数不同,例如,水在脑脊液中和在灰质中的弥散系数就相差4倍。病理情况下,弥散系数将发生变化,这种变化构成了弥散成像的病理生理基础。
由于物理特性差异,人体某些组织中水的弥散还呈现各向异性的特点。如在脑白质中水的弥散有各向异性特点,即在不同方向上弥散系数不同,这是由于神经纤维的走向对水运动的壁垒效应有方向性。在MRI中,弥散系数同T1和T2参数一样能被用来产生组织的图像对比度。利用水分子的弥散系数和产生的对比度来成像称为弥散加权成像。弥散加权成像主要用于超急、急性期脑梗死,为临床诊断提供及时准确的信息,在治疗中起到非常积极的作用。弥散成像对设备的要求也较高,要在高的梯度场下进行。目前,随着梯度场性能的进一步提高,已经能在保持高信噪比的前提下,取得短弥散时间和大b值,使评估很慢的弥散现象,如细胞间水的弥散和代谢等项研究成为可能。
2)人体水分子弥散的各向异性(anisotropic water diffusion):在人体生理条件下,水分子向三维空间各个方向的弥散运动不仅受细胞本身特征的影响,而且受阻碍水自由运动的细胞结构的影响,因此一个方向比另一个方向的弥散可能受到更多的限制。例如,水分子在有髓鞘白质中垂直纤维方向的弥散受到的限制远大于沿着纤维方向的弥散。这种有很强的方向依赖性的弥散就是弥散的各向异性。
3)磁共振弥散张量成像:弥散张量是指“水分子弥散的各向异性、不均匀性组织弥散特征”,弥散张量成像与弥散加权成像不同点是突出强调水分子弥散的各向异性,反映水分子在白质内弥散的优势方向,以显示脑白质纤维束的走行,并观察白质纤维束的空间方向性和完整性,而ADC指一个方向分子的位移。
要评估弥散的各向异性,首先要确定整体弥散张量,这就要求至少在6个非共线方向上连续应用弥散梯度,来获得一组弥散加权图像。用来定量分析各向异性程度的参数很多,最常用的是各向异性分数(fractional anisotropy,FA)。
为了显示和说明临床图像,弥散张量的示踪(trace)或平均弥散图需要联合应用相应的示踪ADC和FA图进行评价。在ADC图中,信号强度与ADC值呈正相关,如脑脊液为高信号而脑实质为低信号。在FA图中,脑白质各向异性最高,表现为高信号;相反,各向异性最低的脑脊液则表现为低信号。组织的生化特性(黏滞性和温度)、组织结构(大分子、膜和细胞内的细胞器等)能够从根本上影响水的弥散能力,因此组织纤维结构的病理状态既影响水的弥散性,又影响水的各向异性弥散特征。
DTI有较多的参数指标反映水分子在神经纤维中弥散的不同特性,比如平均弥散系数(DCavg)反映水分子弥散程度。弥散敏感因子b值反映MRI各成像序列,如SE、FE、EPI对弥散运动表现的敏感程度,体现成像序列检测弥散的能力。b值的单位是s/mm2,b值弥散造成的信号差别不同,b值越大,弥散造成的信号差别越大,对病灶检出也越敏感。表观弥散系数(ADC)描述不同方向水分子弥散运动的速度和范围。各向异性体现局部环境的影响使水分子弥散运动在各个方向不一致的特性,如白质纤维中水分子在平行于白质纤维方向时易于弥散,垂直于纤维方向时弥散受限,包括相对各向异性(relative anisotropy,RA)、部分各向异性(fractional anisotropy,FA)、容积比(volume rate,VR)、各向异性指数(index anisotropy)和张量的本征值(eigen value of tensor)。其中FA最常用,反应弥散各向异性占整个弥散张量的比值。对低的各向异性更敏感,FA值的范围是0~1.0,0代表最大各向同性的弥散,1代表假想状况下最大各向异性的弥散。弥散张量轨迹与平均弥散率代表弥散张量的各项同性部分均为旋转不变量,是由弥散张量的3个本征值计算出来的,是一个特别理想的参数,已成为研究脑白质病的重要参数。DTI虽然在多种组织器官都有研究,但应用最广泛者在中枢神经系统,在神经科和精神科方面的研究正成为热点。
(2)DTI在痴呆中的研究[12]
1)AD是一多发生在老年,以近期记忆障碍为主要临床症状,以老年斑、神经元纤维缠结为主要病理改变的进行性神经变性性疾病,其原因和发病机制尚不清楚。尽管以前病理认为AD的主要影响在脑皮层,但MRI研究认为白质亦有受累。常规MRI可清楚显示痴呆中脑萎缩的程度和部位,但对白质纤维的一致性、完整性的微观变化不能提供信息,常规MRI与DTI联合应用可为痴呆的研究提供更多信息。DTI是一项新技术,在评价不同年龄健康人群中的白质情况方面已有差异,提示不同年龄的白质可通过量化来评价,为痴呆的评价提供了依据。有报道,老年白质与青年白质DTI检查在内囊膝部、视辐射、额叶白质的FA值差异有统计学意义。对年龄分布21~69岁共50名正常志愿者进行研究表明,男女组左右半球ADC值和FA值无显著性差异,而胼胝体膝部、压部、内囊的FA随年龄增长降低。AD患者的胼胝体、额、颞、顶叶平均弥散系数增高、FA降低,同时AD患者的白质纤维改变,很可能继发于相应皮层的神经元丢失导致的wallerian变性。为了研究AD患者弥漫性脑异常是否与疾病程度之间存在相关性,对AD患者用DTI进行的研究发现,扣带束平均弥散系数、FA值和3个本征向量值与MMSE积分测量相关,其中平均弥散系数和3个本征向量值与MMSE积分显著相关,因此,平均弥散系数和3个本征向量值能反映AD患者后扣带束改变的病理过程,也许对监测AD发展有帮助。
2)轻度认知损害被认为是正常老化和AD之间的过渡阶段。轻度认知损害人群中每年约15%发展为早期AD,随访7年有80%发展为AD。然而,轻度认知损害发生记忆障碍的白质部位和范围以及作为AD的前兆还不清楚。DTI显示大脑白质束超微结构的完整性。因此,它能诊断出MCI的白质组织的病理改变过程。
应用高分辨MR体积测量和DTI的联合应用对轻度认知损害患者及相同的年龄、性别对照组配对研究,发现患者在左侧海马的体积较对照组明显降低,右侧海马未发现显著性差异。在轻度认知损害组双侧海马平均弥散系数较对照组明显增高。海马体积和平均弥散系数无明显的相关性。因此,DTI显示的微结构异常敏感的提示早期海马功能不全。
DTI检查可以从定量数据的测量到形态的显示全方位了解白质纤维情况。AD患者和记忆障碍的轻度认知损害患者的白质纤维的FA值较对照组明显降低。而且用彩色编码DTI研究髓鞘神经纤维束后,显示后扣带束这一被认为神经元网络参与记忆过程的重要纤维束不仅靠常规的MR来定位,还可用彩色编码DTI显示定量的改变,即后扣带束成像显示FA值和平均弥散系数在轻度认知损害和对照组、AD组和对照组有显著性差异。彩色编码DTI成像在MCI患者的后扣带束结构的完整性定量诊断很有优势并可评价不同年龄、不同病因导致的髓鞘改变引发的认知障碍的改变。
常规MR和DTI检查对MCI患者、AD患者以及对照组进行研究,分析在颞叶、额叶、顶叶、枕叶、胼胝体膝部、压部以及海马区测量平均弥散系数、FA,发现MCI患者与对照组比较左侧半卵圆区、双颞叶、左海马平均弥散系数值增高。MCI患者的FA值与对照组比较在任何部位没有显著性差异。AD患者与对照组比较,平均弥散系数在左侧半卵圆区、双顶叶、双颞叶和左海马区增加。AD组和对照组比较FA值在左颞叶区、左海马区减低。FA和平均弥散系数在AD组和MCI组没有显著性差异。平均弥散系数评价提示在MCI患者中的改变是很有意义,特别在左侧海马区数据的改变。因此,利用常规MR和DTI检查能够对MCI能与对照组进行鉴别,其敏感性是71.4%,特异性是80%。
3)皮层下缺血性血管性痴呆胼胝体的扩散张量成像研究。胼胝体是联系两侧大脑半球的主要连合纤维,大约有3.5亿神经纤维构成,在两侧大脑半球间的感觉、运动及认知功能等信息的交换和传递起着至关重要的作用。胼胝体的广泛病灶可导致精神失常、情绪淡漠、记忆力下降、人格改变等。研究表明,Down综合征、阿尔茨海默病、精神分裂症、诵读障碍可能与胼胝体异常有关。
VD是仅次于阿尔茨海默病的第二位最常见的痴呆类型。VD因病因和病理机制的不同而有多种亚型,其中SIVD是一种同源性的亚型,其特点是腔隙性梗死和深部白质改变。大量对SIVD患者的MRI研究发现,T2W I上病灶的多少与认知损害程度的相关性较弱。原因之一脑白质区T2W I高信号反映的是从神经纤维框架相对完好到完全性轴索退变、丢失的一系列病理过程。
正常人胼胝体后部较膝部的相对各向异性(relative anisotropy,RA)值高,平均ADC无明显差别。胼胝体后部各向异性高的可能原因是:神经元纤维的密度(单位面积轴索)较高,但有些人及猴的组织学研究并不支持该理论,因为胼胝体前部纤维的密度或数量较后部高。另一种解释是后部由大量具相同方向的有髓神经纤维构成,神经纤维束的轴索密度高,每个体素内髓鞘基质比率高于膝部,导致胼胝体后部各向异性高。有研究发现压部髓鞘较厚,髓鞘化轴索的比率高;另外压部轴索的直径大,粗纤维(>3μm)含量多。胼胝体膝部各向异性低可能与每个体素内含较多的斜行纤维有关。
在SIVD患者,胼胝体前后部的各向异性下降,平均ADC升高,胼胝体前部ADC值与MMSE评分有明显的相关性。此结果与Binswanger病的病理研究结果部分相符。Binswanger病的脑白质区能见到小动脉和微动脉具有特征性的小动脉粥样硬化。如这些受损的血管栓塞,可导致白质广泛的蜂窝状病变,同时引起广泛脱髓鞘和轴索丢失,髓鞘丢失比神经轴索的丢失要多得多。Binswanger病变在脑室周围区明显,白质灰质比例下降,胼胝体体积缩小,厚度显著减小。有研究发现,小胶质细胞的活化与髓鞘和轴突成分的降解有关,通过免疫组化研究发现,SIVD患者的胼胝体呈明显的轴索损伤和胶质增生,神经纤维的密度降低18%~26%。尽管目前未见到关于SIVD的DTI参数异常的病理学基础的研究报道。但根据大量以往的病理研究结果,认为SIVD的胼胝体前后部的各向异性下降,说明神经纤维的完整性破坏,其髓鞘和轴索的损伤和丢失;平均ADC升高可能与神经纤维成分密度减低,细胞外间隙增大,扩散阻力减低有关。
胼胝体前部ADC值与MMSE评分有明显的相关性,提示胼胝体的平均扩散率的改变可作为评价SIVD认知功能及病情进展的指标。目前,对多发性硬化(multiple sclerosis,MS)的研究显示,平均扩散率的逐渐增加出现在新病灶出现之前,这种改变代表白质损伤早期病理变化,如果SIVD的DTI改变的基础与MS相似,则胼胝体平均ADC的变化将有助SIVD的早期预防及治疗,阻止或逆转认知下降[13]。
总之,老年性痴呆的研究无论是基础、临床还是影像都是较复杂的。DTI在该领域的研究在逐渐开始,已显示出极大的潜力。相信随着MR技术的不断进步,研究的不断深入,将为老年痴呆的研究提供更多、更可靠的信息[14,15]。
(曾庆师 李传福)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。





