第三节 淀粉样肽前体蛋白
淀粉样肽前体蛋白(β-Amyloid precursor protein,β-APP)为Aβ的前体,是含单一跨膜域的大蛋白分子,有大的N端胞外极性区和短的C端胞内区。Aβ肽段部分位于APP的胞外和质膜双层中。
APP基因定位于人第21号染色体长臂近侧区(21q21.1-21.3)。含18外显子,其转录mRNA产物可经不同方式剪接,已经发现10种βAPP基因的转录物。通过外显子7和8的可变剪接可生成六种不同的mRNA转录物,相应的编码产物为APP365、563、695、714、751、770(数字为所含氨基酸的个数),含Aβ的四种APP为APP695、714、751、770。其中APP695不含K型蛋白酶抑制剂(KPI),在神经细胞主要表达APP695;而APP751、770和563含KPI结构域,这类APP可在星状胶质细胞和内皮细胞中高表达。APP几种主要同工体的结构见图5-3-1。除整合膜蛋白形式的APP外,还有分泌形式的APP(s-APPα),可在神经元在膜去极化或电活动中释放,通过参与信号转导通路,影响神经元可塑性和生存能力。
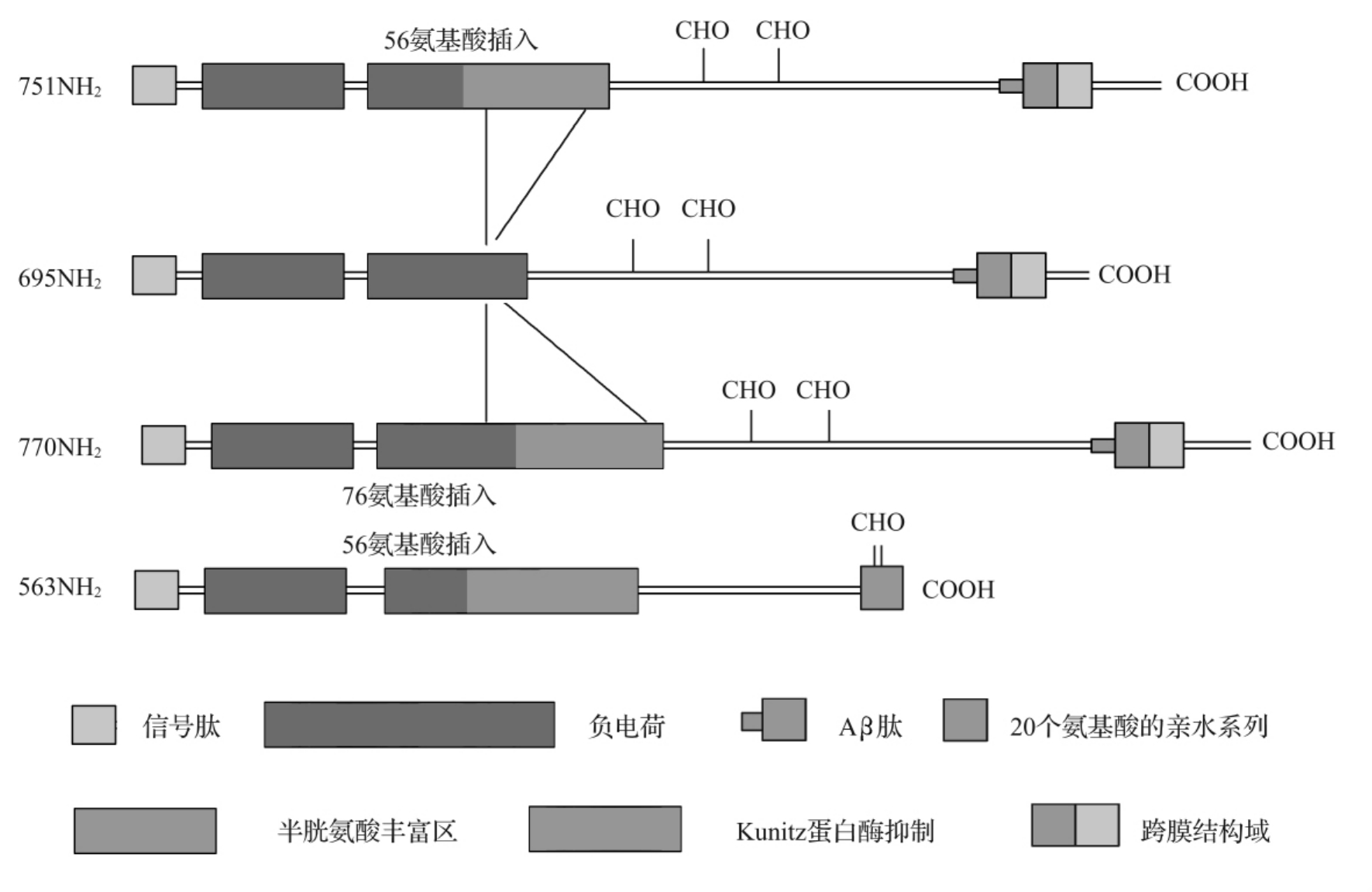
图5-3-1 APP主要同工体的结构
APP作为一种管家基因在机体各种组织广泛表达,但是,各种转录物的表达方式显示一定的细胞和组织特异性。在非神经组织细胞,APP751、770和563三种含KPI结构域的同工体表达水平高。而脑组织中高水平表达APP695,但APP751、770低表达。各脑区APP同工体表达也显示差别。另外,神经元广泛表达APP695,神经胶质细胞主要表达APP751、770。在脑发育、成熟过程中及部分AD患者,APPmRNAs的剪接形式也可发生变化。
一、APP的分子结构
翻译修饰后的APP,是具有单一跨膜结构的膜整合糖蛋白,以APP770为例,其基本结构见图5-3-2。从细胞外N端开始结构如下。
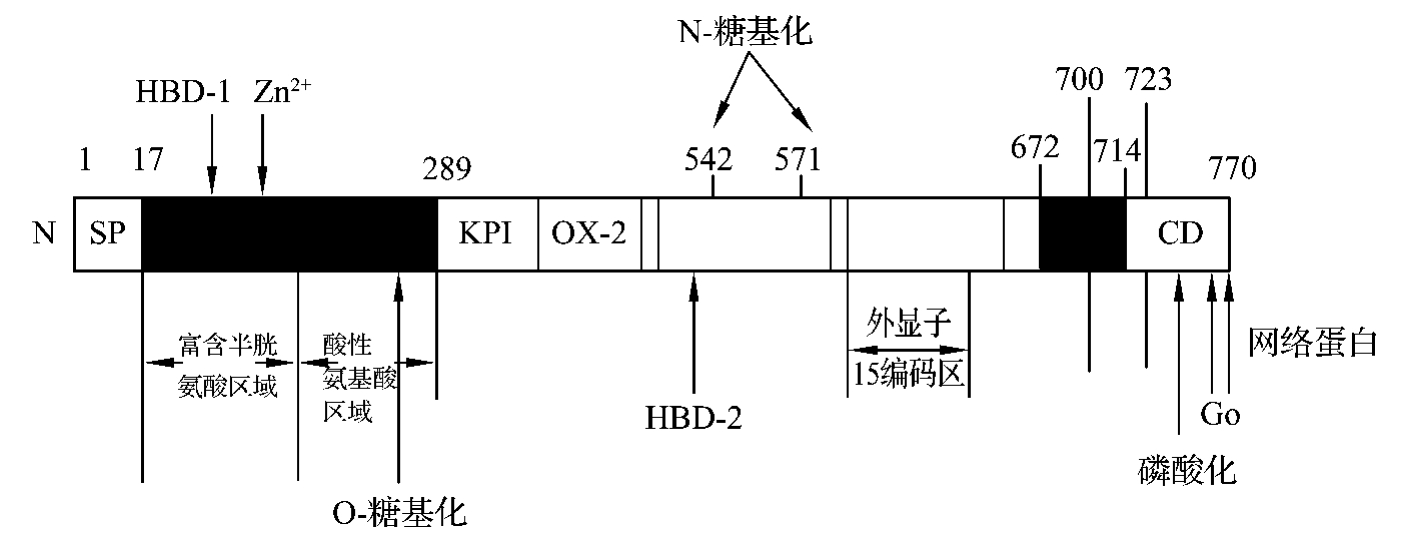
图5-3-2 APP770的基本结构
(一)信号肽
含由17个氨基酸残基,含Aβ序列的APP同工体都具有信号肽结构,可引导APP转运进入内质网。
(二)富含半胱氨酸(cys)域
170个氨基酸残基组成,含12个Cys。该区含肝素结合域-1(HBD-1)和锌离子结合域。
(三)酸性域
含100个氨基酸残基,富含酸性谷氨酸(G1u)和天冬氨酸(Asp)。另外,含多聚苏氨酸段及一个O-糖基化位点。
(四)KPI域及OX-2域
第289残基处可变剪接插入该域。KPI域由外显子7编码,含56个残基,与Kunitz型蛋白酶抑制剂(KPI)有同源性。OX-2域由外显子8编码,含19个残基,与胸腺细胞的OX-2抗原有同源性。
(五)肝素结合域-2及N-糖基化域
含肝素结合域-2(HBD-2),在第542及571残基处各存在一N-糖基化位点。在HBD-2内可能还存在一神经营养域及一金属蛋白酶抑制域。
(六)外显子15编码域
该域位于Aβ序列前。部分同工体如LAPP,不含此结构域。
(七)Aβ域
由外显子16和17的邻接部分编码,含42个残基(672~714)。从N端开始,1~28残基位于膜外,剩余的14个残基结合于细胞膜上。
(八)单跨膜域
含24个氨基酸残基,主要为疏水性氨基酸。
(九)胞质内域
APP同工体均含一较短的胞质内域(cytoplasmic dornain,CD)。此域内可存在磷酸化位点、Go结合及网格蛋白结合模体。
二、APP及其衍生物的生理功能
体内广泛表达的APP应该有重要生物功能。因为APP是定位于神经元终末的跨膜蛋白,可能是一类受体。但至今未发现其相应配体。细胞合成的APP,作为跨膜蛋白仅有10%,大部分APP在神经元内裂解加工生成N端可溶性APP(sAPP),以及其他各种活性多肽片段。其相应功能是APP生理功能的重要方面。如α分泌酶裂解生成的可溶性sAPPα对神经元损伤有保护作用。APP表达后经快速轴突转运到突触区,通过与胞外基质作用,调节神经突触可塑性。APP可能影响长时程增强(Long term potentiation,LTP)。
APP基因敲除小鼠可表现体重减轻、运动减少、自发性惊厥和行为障碍等异常,常在成熟前死亡,可能涉及突触触功能损害。这反面证实APP在调节中枢神经元活动和突触功能方面的重要作用。(https://www.daowen.com)
(一)促进生长或神经营养活性
APP显示神经营养作用,有利于神经细胞的生存。全长的APP及其分泌性N端衍生物(APPs)能促进神经突生长或保护神经元免受兴奋性毒性的损害。如神经元释放的s-APPα存在能延长培养神经元的存活时间。使海马神经元减少兴奋性神经毒性和氧化损伤。表达重组的sAPPα对培养神经元有神经营养活性,可作为培养中枢神经系神经元的强力营养剂[11]。APP及其代谢产物都可促使培养神经元长时间存活。Masliah发现,APP能提高谷氨酸转运体(Glutamate transporter,GT)的功能,从而对兴奋性毒性产生保护作用。
(二)促进神经元突起生长和突触发生
体外研究证实,膜结合或可溶性的β-APP均有促进培养神经元突起生长和突触发生的作用。APP表达可以刺激神经元突起的长出,增加神经元突起的延长和分支,促进树突的扩展。如移植、接近表达APP的单层细胞后,海马神经突触的长出增加。谷氨酸对培养海马神经元树突生长有抑制作用,sAPPα存在能抵消这一抑制作用,促进树突扩展[12]。内源性sAPPα还与NGF诱发的神经元突起生长相关联。加入APP抗体,则阻断NGF诱发神经元突起长出的效用。实验结果证明,APP和sAPPα显示调节神经突起长出的重要功能。动物水平实验证明,APP促进突触的形成和维持。刺激突触的发生,修饰突触的可塑性。动物脑室加入APP片段后,额顶皮质突触密度增加,且动物的记忆保持加强。神经元特异过表达APP的转基因小鼠中,突触密度和生长相关蛋白43都明显增加。
(三)促进神经细胞的黏附
实验表明,APPs能够和某些细胞外基质结台而促进神经元的附着。在培养的神经元,APPs能调节细胞和细胞或细胞和细胞外基质之问的黏附。全长的APP分子也能促进神经元的黏附。
APP对细胞间的黏附有重要作用,而在APP调节促进神经突起长出和突触发生的机制中,需要细胞黏附性的相互作用。β-APP和细胞基质的结合对海马神经元突起的生成有刺激作用。实验证明APP结合到核纤层蛋白特定部位和促进神经突起生成有关。APP能强力结合硫酸软骨素黏蛋白等细胞外基质分子。sAPPα影响细胞内Ca2+浓度作用与其促进神经突起生出和突触发生功能有密切联系。
sAPPα可能通过激活K+通道和降低静息Ca2+浓度方式,实现降低细胞内Ca2+浓度作用。由营养因子促进的神经突起生出也可能由于降低Ca2+浓度而实现。
(四)调节突触的可塑性促进学习、记忆
sAPPα可通过影响跨膜离子通道影响神经细胞膜的兴奋性。s-APPα695、751可以激活某种K+通道,实验提示该K+通道激活与降低钙内流相关,并影响膜的超极化和进行性谷氨酸修饰的突触活动。sAPPα还通过修饰兴奋性氨基酸受体活动,影响神经元的兴奋性。以培养海马细胞实验证明,s-APPα可以浓度依赖性地诱发NMDA受体电流降低,这一电流抑制发生迅速。sAPPα刺激能使大鼠海马神经元cGMP水平快速增加2~4倍,其机制可能涉及sAPPα激活一种受体型鸟苷酸环化酶。而cGMP通过cGMP依赖的蛋白激酶(PKG)激活下游蛋白磷酸酶,进而导致通道蛋白的去磷酸化,引发的钾通道激活和NMDA电流抑制。最终影响神经元的兴奋性。
如sAPPα加入脑中能改善成年大鼠学习记忆功能。成年大鼠细胞外sAPP水平增加,影响小脑的长时程增强(LTP)。由于LTP是学习记忆细胞联系的关键,表明sAPP可能通过修饰LTP影响学习记忆功能。sAPP预处理可以改变海马薄片CA1区频率依赖的LTP。在sAPPα修饰LTP过程中,cGMP可能起着重要作用。
(五)减少神经元毒性损伤
在兴奋性毒性、缺氧和氧化性等损伤后,神经系统的APP表达增加。
s-APPα695、751预处理培养大鼠胚胎海马神经细胞后,细胞对兴奋性毒性和葡萄糖耗竭损伤的耐受力增加。一方面,上述sAPPα能降低兴奋性毒性,因而减少兴奋性神经损伤;另一方面,sAPPα可以通过激活某些抗损伤信号通路相关基因表达。实验证实,APP可以通过其N端结构域,调节激活小胶质细胞的丝裂原活化蛋白激酶(MAPK)信号通路。同样,MAPK信号通路也可以被各种神经营养因子信号激活,而神经营养因子也能通过MAPK信号通路,减少兴奋性毒性、代谢性、氧化性损伤和Aβ神经毒性等损伤,保护神经细胞。s-APPα还能诱导培养原代海马细胞中核转录因子NF-κB信号通路的激活,促进某些靶基因产物表达,减少代谢性和Aβ神经毒性引起的损伤。sAPP的神经抗损伤的保护作用在动物水平研究也得到证明。如预先将s-APPα695和751注入动物侧脑室,则能减少脑缺血动物海马神经元的损伤和死亡。
(六)细胞表面受体样作用
β-APP是跨膜蛋白,可能参与信号转导。全长βAPP具有单跨膜结构,可能是一种细胞表面受体。研究发现,在AD患者的神经炎斑周围或中心存在许多细胞因子参加的免疫反应。研究认为,βAPP分子可能是细胞因子类的受体。
三、APP翻译后的加工
各种组织细胞都表达APP,只有脑组织能对APP进行特异加工。存在膜结合全长的APP蛋白是加工为Aβ的决定因素,APP分子加工有两条途径,涉及三种分泌酶(α-,β-,γ-分泌酶,α-,β-,γ-secretase)的裂解作用,三种分泌酶的剪接位点和APP翻译后的加工途径见图5-3-3。
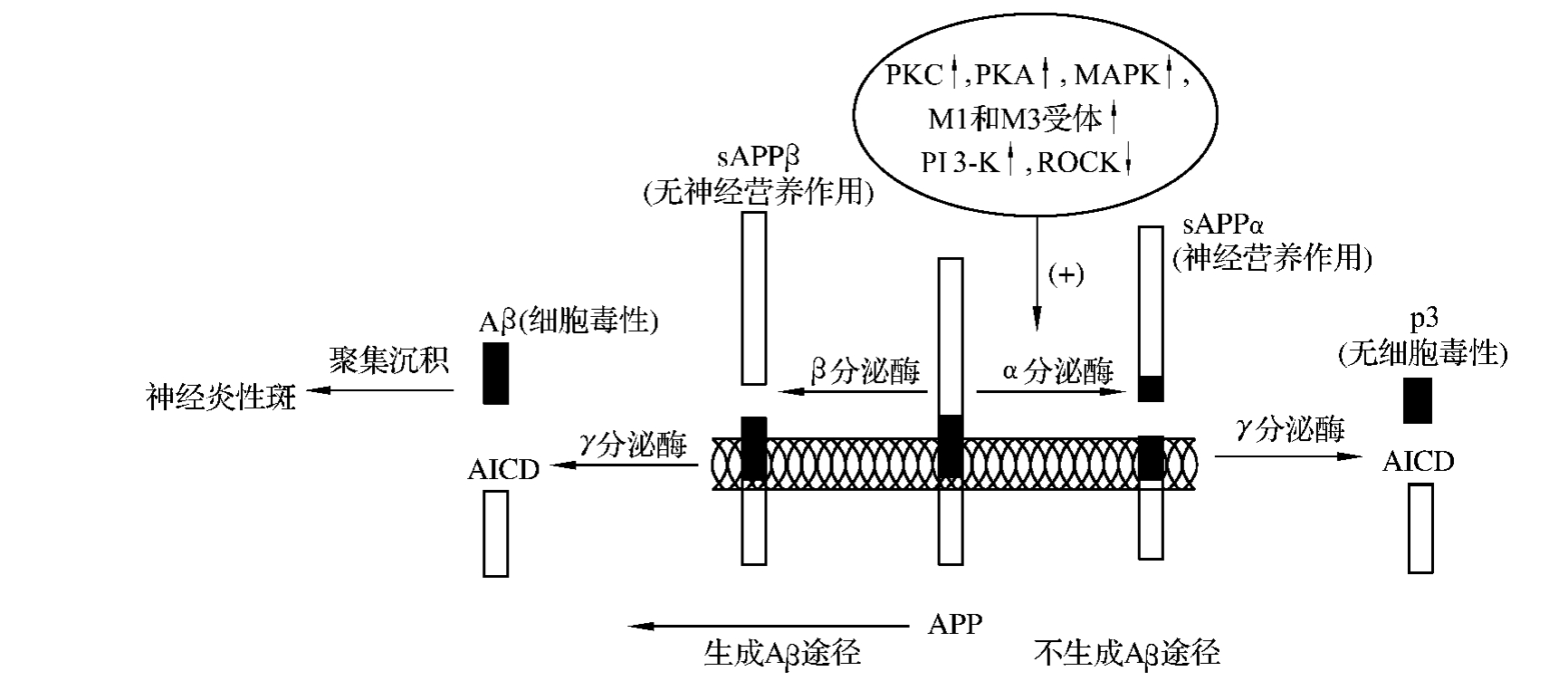
图5-3-3 Aβ分子中三种分泌酶的剪接位点和APP翻译后的加工途径
(一)非淀粉样肽源性途径
又称为结构性分泌途径。主要由α分泌酶参与。
APP正常代谢时,大多数的APP在α分泌酶作用下,Aβ区的Lys16~Leu17位点氨基酸之间发生裂解,裂解部位位于Aβ的序列内,生成100 kD的N端大的、可溶性胞外片段(sAPPα),和一个9 kD的跨膜片段C83。C83片段再经γ分泌酶作用下裂解为较小的片段P3和相应APP胞内片段(APP intracellular domain,AICD)。由于Aβ区段切断故无完整的Aβ形成,不具备形成淀粉样蛋白沉积的能力。不产生、蓄积Aβ。这是β-APP的主要加工途径。
非淀粉样肽源性途径由于α分泌酶从Aβ分子内部进行分解,避免了完整Aβ分子序列的产生,且sAPPα可对神经细胞产生神经营养和神经保护作用。增加sAPPα的分泌或提高α分泌酶的表达,成为AD研究的重要内容。
(二)淀粉样肽源性途径
APP的另一加工途径称为淀粉样肽源性途径,而全长度的Aβ是由该途径产生的。在该途径中APP由β和γ分泌酶共同作用,可产生Aβ。
APP先在Aβ序列的第一位氨基酸部位经β分泌酶水解。β分泌酶裂解β-APP的596~597位肽键,产生一个大的N端片段(sAPPβ)和保留含有完整Aβ部分的C端区小的跨膜片段(C99),后者再受γ分泌酶作用,使Aβ肽段的39~44之间的肽键裂解,产生含39~43个氨基酸的Aβ多肽和另一胞内片段AICD。γ分泌酶大多都在Aβ区的40或42位裂解产生Aβ40和Aβ42。正常时,绝大多数为Aβ40。当APP基因突变时,APP产生Aβ42增多,可能导致AD发生[13]。
因此γ分泌酶是产生Aβ的关键。因为Aβ的C端最后几个氨基酸的疏水性都很强,Aβ的C端越长越易沉积。脑内斑块主要由Aβ42或43组成,血管基底膜老年斑主要含Aβ40肽。说明γ分泌酶对Aβ的裂解位点受组织局部因子影响。家族性AD相关的APP基因突变,可能引起APP蛋白质空间构象改变,会对γ分泌酶的Aβ的裂解位点及裂解活性有影响。
研究表明减少APP的表达量、调节APP裂解、抑制Aβ聚集、促进Aβ降解和清除,都是减少Aβ的毒性作用、治疗AD的可能策略。
(崔 行)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






