第二节 神经元之间相互作用的方式
一、突触与突触传递
神经系统由大量的神经元构成。这些神经元之间在结构上并没有原生质相连,仅互相接触,其接触的部位称为突触。根据信息传递媒介物的理化性质不同,突触可分为化学性突触和电突触两类,前者的传递媒介物是神经递质,后者传递的媒介物则是局部电流。
在电镜下观察到,化学性突触一般由突触前膜、突触间隙、突触后膜组成。根据神经接头处有无紧密的解剖学关系,可分为定向突触和非定向突触两种模式。定向突触末梢释放的递质仅限于局部的突触后成分,如经典的突触传递和神经—肌肉接头的兴奋传递过程;非定向突触末梢释放的递质则可扩散到距离较远和范围较广的突触后成分如交感神经—心肌接头。
一个神经元的轴突末梢经多次分支后其末端膨大呈杯状或球状,称为突触小体,与突触后神经元的胞体或突起相接触。一个突触前神经元可与许多突触后神经元形成突触,一个突触后神经元也可与许多突触前神经元的轴突末梢形成突触。一个脊髓前角运动神经元的胞体和树突表面就有1 800个左右的突触小体连接,这些突触联系可发生兴奋效应,也可产生抑制效应。
(一)经典的突触传递
1.经典突触的微细结构 电镜下观察到的突触前膜和后膜较一般神经元膜稍厚,约7.5 nm,间隙为20~40 nm(图4-2-1)。突触前膜的胞浆面附有致密物质,呈锥形突向胞浆,称为突触前致密突起(presynaptic dense projection),被认为是容纳突触小泡且与突触前膜相融合形成胞吐的特定膜结构区(激活区)。突触前致密物质有多种纤维丝组成,包括脑血影蛋白(fodrin),肌动蛋白和突触蛋白(又称突触素,synapsin)等。在前膜内侧的轴浆内含有较多的线粒体和大量囊泡又称突触小泡,小泡的直径为20~80 nm,内含高浓度的化学递质。大部分的突触小泡不能在轴浆内自由移动,而是通过突触蛋白被锚定于细胞骨架丝的网络上。
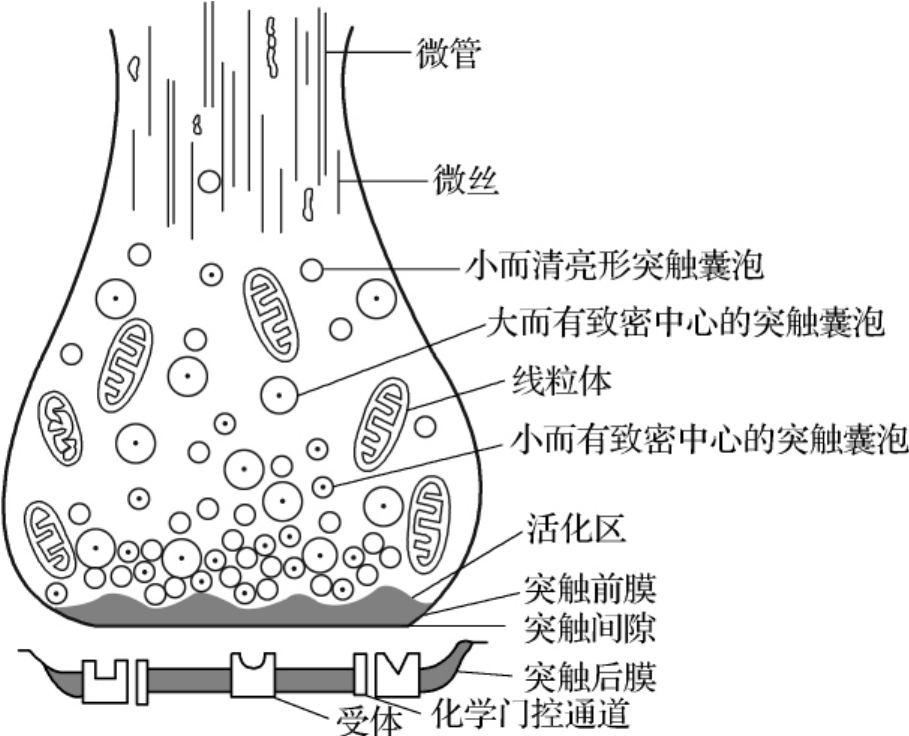
图4-2-1 经典突触微细结构的示意图
突触蛋白(synapsins)是一组具有神经元特异性的磷酸蛋白,分布于的神经终末处,位于突触前轴浆内的突触小泡膜表面。突触蛋白在调节神经递质的释放和神经元早期发育、再生等方面起着重要的作用。近年来,突触蛋白在神经系统疾病的研究中得以广泛应用。
不同突触内所含突触小泡大小和形态不完全相同,突触小泡一般分为三种:小而清亮透明的小泡,内含ACh或氨基酸类递质;小而具致密中心的小泡,内含儿茶酚胺类递质;大而具致密中心的小泡,内含神经肽类递质。前两种突触小泡分布在靠近突触前膜的部位,与前膜融合后经特定膜结构区域(激活区)迅速释放递质,在其相应的突触后膜上则存在着相应的特异性受体或化学门控通道。后一种突触小泡则均匀分布于突触末梢内,并从突触末梢所有部位释放递质。
小而具致密中心的小泡释放儿茶酚胺类递质则需要长达50 ms的时程;小而清亮透明囊泡释放的ACh与Ca2+通道有关;大而致密中心的小泡释放则与有较高阈值、高电导、慢失活的L型Ca2+通道有关,因此可能只有在神经末梢接受较高频率刺激时,可激活L型通道,才会引起单胺类递质和神经肽的释放。
2.经典突触的电—化学—电传递过程突触前神经元的神经冲动传导至神经末梢时,突触前膜发生去极化,达到一定水平时,前膜上的电压门控Ca2+通道开放,细胞外Ca2+进入突触前神经末梢,导致轴浆内Ca2+浓度瞬时升高,可触发突触小泡与质膜发生融合,以至最后发生泡裂外排等一系列过程。在Ca2+进入突触前膜后数毫秒,就可触发小而清亮透明的小泡破裂,突触小泡内的神经递质即从前膜以量子形式释放,递质进入突触间隙,经扩散抵达突触后膜;递质与后膜上的特异性受体结合,引起后膜对某些离子通透性的改变,诱发突触后神经元发生一定程度的去极化或超极化。这种发生在突触后膜上的电位变化称为突触后电位(postsynaptic potential)。
关于进入突触前膜的Ca2+如何导致突触小泡释放递质的过程,机制十分复杂,涉及很多特殊蛋白质的参与。目前所知,Ca2+触发突触小泡释放递质需经动员、摆渡、着位、融合和出胞等环节(图4-2-2)。安静时突触小泡被突触蛋白锚定在细胞骨架丝上,即突触蛋白的一端与囊泡结合,另一端与细胞骨架丝结合,使突触小泡不能自由移动。当进入前膜轴浆内的Ca2+浓度升高时,Ca2+与轴浆中的钙调蛋白(calmodulin,CaM)结合为Ca2+-CaM复合物,可激活钙调蛋白依赖的蛋白激酶Ⅱ(Ca2+/CaM激酶Ⅱ),Ca2+/CaM激酶Ⅱ是一个由两种不同亚单位组成的复合体,存在于神经末梢内的突触小泡的表面。活化的Ca2+/CaM激酶Ⅱ,可激活突触蛋白,使突触蛋白发生磷酸化后与细胞骨架丝的结合力减弱,突触小泡与细胞骨架丝解离,成为可移动的突触小泡,这一过程称为动员(mobilization)。用基因敲除法仅证明在突触小泡释放过程中主要起调节作用的是突触蛋白。
游离的突触小泡向活化区移动的过程,称为摆渡(trafficking)或称停靠,该步骤依赖于轴浆中称为Rab3的一类小分子G蛋白的帮助。这些Rab3蛋白与GTP结合形成Rab3-GTP复合物,以Rab3蛋白羧基末端与突触小泡结合。在引渡突触小泡到活化区的过程中,Rab3蛋白将GTP水解为GDP而获能,用以阻止逆向移动;当发生突触小泡融合和出胞时,Rab3-GDP与突触小泡分离并释放出GDP,Rab3蛋白再重复使用。
被摆渡到活化区的突触小泡在与突触前膜发生融合之前须固定于前膜上,这一过程称为着位(docking)。参与着位的蛋白包括突触前膜上的靶蛋白(t-SNARE)和突触小泡膜上的突触小泡蛋白(v-SNARE。又称synaptobreven或vesicle associated membrane protein,VAMP);目前已鉴定脑内的t-SNARE有突触融合蛋白(syntaxin)和SNAP-25两种。当突触小泡膜与突触前膜靠近时,存在于膜上的突触小泡蛋白(v-SNARE)便与两种靶蛋白(SNAP-25和突触融合蛋白)结合,形成一个三合体蛋白,从而完成着位。突触小泡着位后,如果轴浆中的Ca2+浓度不高,融合和出胞则不能发生。这是由于突触小泡膜上还存在一种能发生融合钳制(fusion clamp)的蛋白,即突触结合蛋白(synaptotagmin,或称p65),可阻碍融合和出胞作用。当轴浆内高Ca2+情况下突触结合蛋白发生变构,消除其对融合的钳制作用,于是两膜得以融合而引起出胞。递质出胞是通过突触小泡膜和突触前膜上暂时形成的融合孔(fusion pore)进行的,它与缝隙连接水孔通道十分相似。在出胞过程中,孔道迅速由约1 nm扩大到50 nm,递质快速从突触小泡释出。在中枢,递质通过融合孔释放在0.2~0.5 ms即可完成。
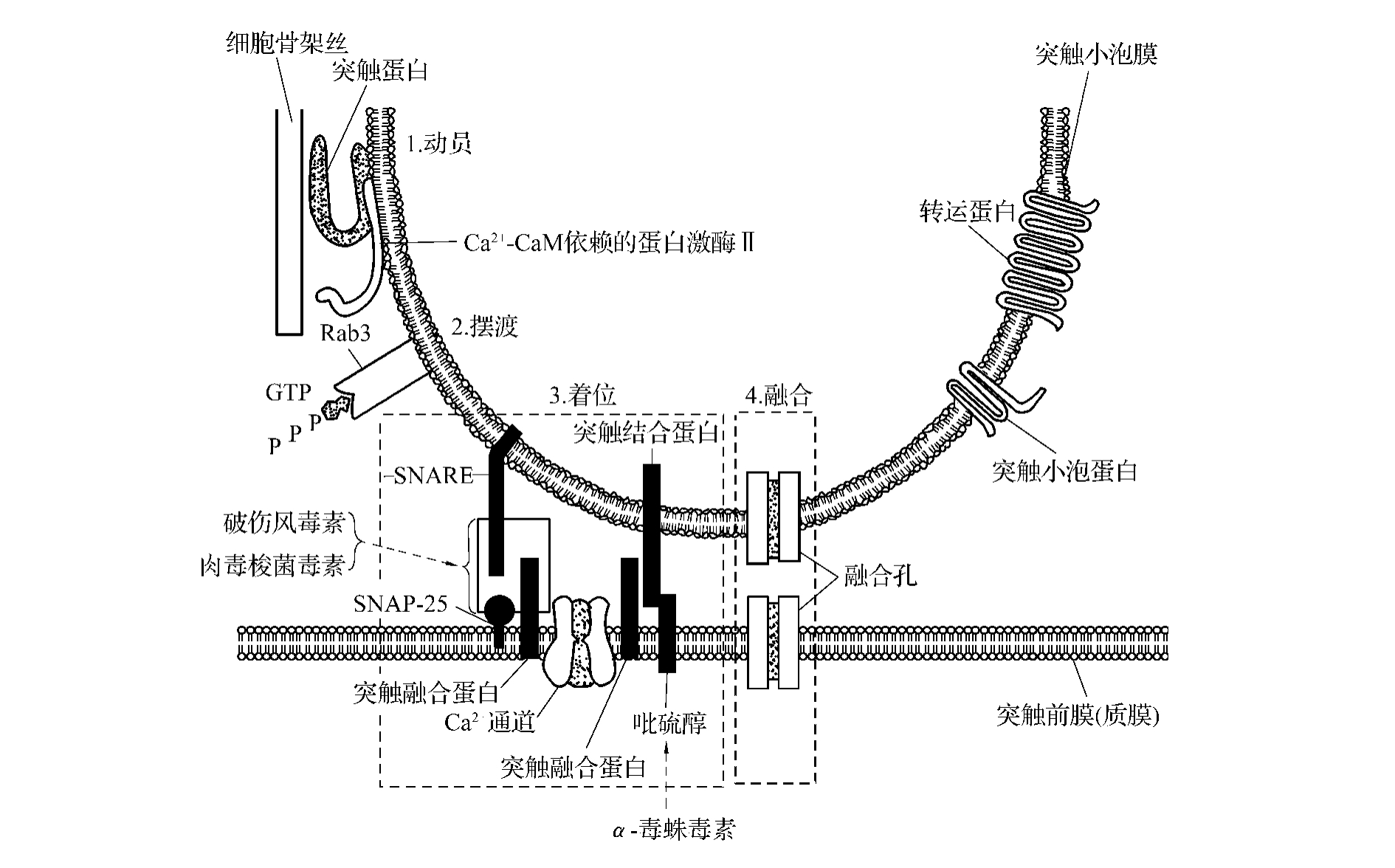
图4-2-2 突触传递过程中突触小泡释放递质的示意图。图示突触传递过程中突触小泡在Ca2+的触发下,需经动员、摆渡、着位和融合等一系列步骤才能将其中的递质释放至突触间隙中。图中的突触小泡蛋白是酪氨酸激酶的底物,经磷酸化后可调节递质释放,虚线箭头表示多种神经毒素(如破伤风毒素、肉毒梭菌毒素、α-毒蛛毒素等)的作用部位
3.突触后电位 根据突触后膜发生去极化或超极化,可将突触后电位分为兴奋性和抑制性突触后电位。还可根据电位时程的长短分为快、慢突触后电位。
(1)兴奋性突触后电位 突触后膜在某种递质作用下发生局部去极化电位变化称为兴奋性突触后电位(excitatory postsynaptic potential,EPSP)。如图4-2-3A所示,将记录微电极刺入脊髓前角伸肌运动神经元的胞体内,当在该神经元所支配的伸肌的一束Ia类传入纤维上给予单个电刺激时,经短暂的潜伏期(约0.7 ms),可观察到该运动神经元发生了EPSP(图4-2-3B)。EPSP形成的机制是某种兴奋性递质与突触后膜的特异性受体结合后,使配体门控通道(化学门控通道)开放,后膜对Na+和K+的通透性增大,尤其是对Na+的通透性增高,Na+内流大于K+外流,导致局部膜去极化。EPSP的形成还可能与Ca2+通道开放引起Ca2+内流有关。递质的释放量与进入轴突末梢内的Ca2+量呈正相关。如果细胞外液中Ca2+浓度增高,或Mg2+浓度降低,递质释放将增多,反之则释放减少。
EPSP的特点:①不具有“全或无”的特点,当刺激强度增大时,参与活动的突触数目增多,使EPSP幅度增大;②呈电紧张性扩布;③没有不应期,可以发生时间和空间总和,当达到阈电位时首先在轴突的始段触发动作电位。因此,EPSP属于一种局部兴奋。
(2)抑制性突触后电位突触后膜在递质作用下发生超极化电位变化称为抑制性突触后电位(inhibitory postsynaptic potential,IPSP)。如图4-2-3A所示,当刺激电极置于屈肌的Ia类传入纤维上时,经过一个较长(1.6 ms)的潜伏期,伸肌运动神经元的膜电位出现了IPSP(图4-2-3B)。IPSP的幅度也随刺激强度增大而增大。产生IPSP的潜伏期较长,说明Ia传入不能直接引起IPSP,必须经过一个或几个中间神经元转递。
IPSP产生机制是在有抑制性中间神经元参与下实现的。一个兴奋性神经元兴奋另一个抑制性中间神经元,后者释放抑制性递质,与突触后膜上受体结合,使突触后膜上的配体门控Cl-通道开放,引起Cl-内流,导致后继神经元的突触后膜超极化,而不易爆发动作电位。IPSP的形成还可能与突触后膜K+通道的开放或Na+通道和Ca2+通道的关闭有关。
(3)突触后神经元的兴奋和抑制突触后膜上的电位改变的总趋势取决于同时产生的EPSP和IPSP的代数和即突触整合(synaptic integration),最终结果决定该神经元的兴奋或抑制。当总趋势为EPSP时,幅度增加到轴突始段的阈电位水平时,便在突触后神经元始段爆发动作电位,并沿轴突扩布至末梢而完成兴奋传导;也可逆向传到胞体,使整个神经元发生一次兴奋,逆向扩布的兴奋将改变神经元胞体的状态。当总趋势为IPSP时,使突触后神经元出现抑制。
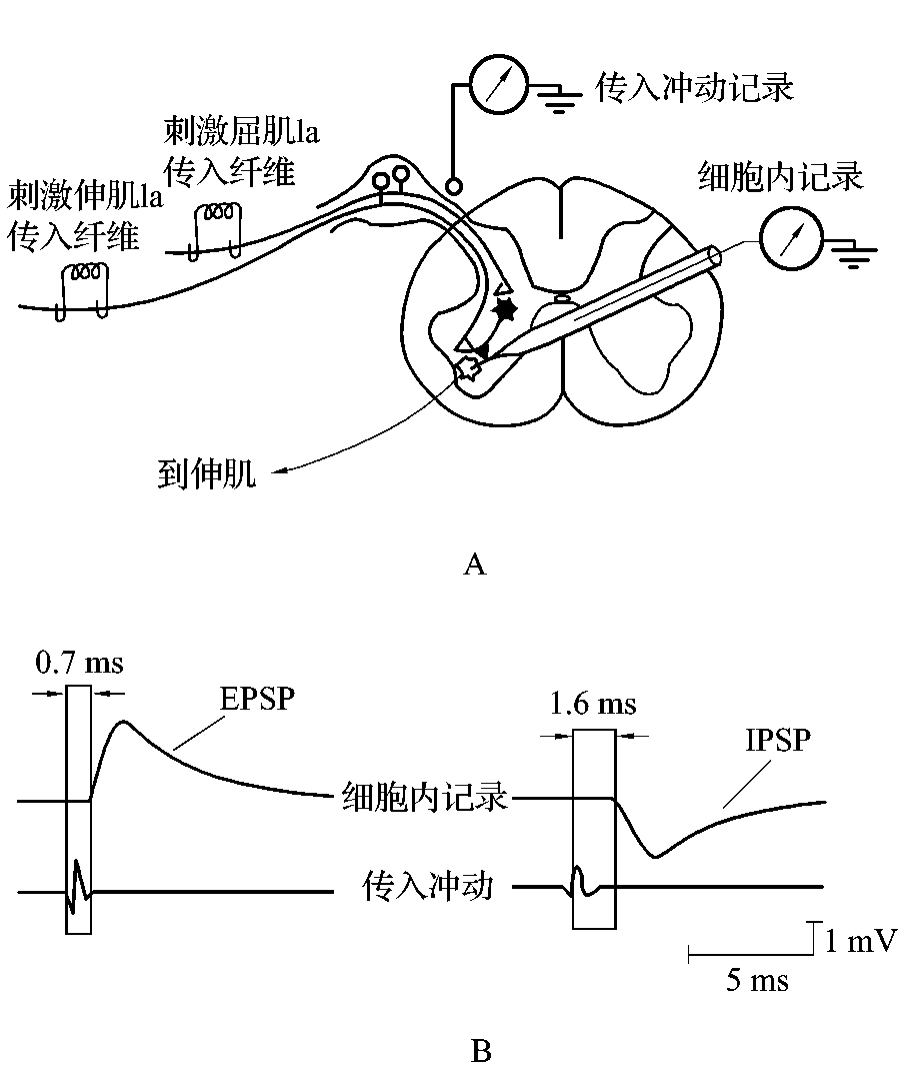
图4-2-3 EPSP和IPSP示意图。A.电刺激伸肌和屈肌的传入纤维,脊髓前角运动神经元胞体膜内记录到的电位变化; B.左图为刺激伸肌后0.7 ms,记录到的EPSP,右图为刺激屈肌后1.6 ms,记录到的IPSP
4.影响突触传递的因素递质的释放、消除及其与受体的结合可受到多种因素的影响。
(1)影响Ca2+内流的因素可改变递质的释放量。
1)神经冲动的频率:若抵达突触前末梢神经冲动的频率增加,神经末梢发生去极化的程度增高,使局部电压门控Ca2+通道开放的数目增多;当细胞外Ca2+浓度升高和Mg2+浓度降低时,该区进入胞质中Ca2+数目增加,促使递质释放增多。
2)突触前抑制:突触前抑制的结构基础是轴—轴型突触。其抑制过程如图4-9所示,轴突1与神经元3的胞体构成轴—胞体型突触,单独刺激轴突1可引起神经胞体产生一个一定幅度的EPSP(图4-9B实线)。轴突2与轴突1构成轴—轴型突触,当仅有轴突2兴奋时,神经元3不产生反应。如果先刺激轴突2,使轴—轴型突触活动一定时间后,再刺激轴突1,此时,神经元3产生的EPSP比单独刺激轴突1产生的EPSP明显减小(图4-9B虚线)。EPSP减小表明神经元3受到了抑制。突触前抑制的发生机制是由轴—轴型突触活动时引起的,轴突2末梢释放的兴奋性神经递质使轴突1末梢发生去极化,膜电位值变小。一定时间后轴突1兴奋时,神经元3的EPSP幅度明显减小。研究表明,突触前抑制的产生有三种可能的机制:①轴—轴型突触的前膜释放的递质是γ-氨基丁酸(GABA),GABA与膜上的GABAA受体结合后,可引起Cl-电导增加。由于轴突1的轴浆内Cl-浓度较细胞外高,Cl-外流的结果使轴突末梢发生去极化而膜电位下降,时程缩短,结果进入轴突1末梢Ca2+减少,由此而使兴奋性递质释放减少,导致神经元3 EPSP幅度也就随之减小。②在某些轴突末梢(轴突1末梢)上还存在GABAB受体,GABA与轴突1末梢膜上的GABAB受体结合后,经G蛋白介导,使膜上K+通道开放,K+外流的结果,使复极化加快,轴突1末梢的Ca2+内流减少,而产生抑制效应。③在兴奋性末梢(轴突1末梢),通过激活某些促代谢型受体,直接抑制递质释放。
突触前抑制在中枢神经系统内广泛存在,对于调控感觉传入信息具有重要作用,通过限制其他的感觉传入活动,保证某一生理功能的实现;脑干下行抑制的机制、中枢镇痛机制、电针镇痛机制等均有突触前抑制参与。
3)突触前易化:易化是指兴奋变得容易发生,而突触前易化的发生与Ca2+内流数量增加有关。其发生机制的结构基础与突触前抑制相同(图4-2-4),如果到达轴突1末梢的动作电位持续时间延长,就会引起Ca2+内流增加,由此引发兴奋性递质释放增多,导致突触后EPSP增大,即突触前易化。动物实验发现,5-羟色胺在轴—轴式突触末梢释放的递质,可引起细胞内cAMP水平升高、K+通道因磷酸化而关闭,从而使到达突触前末梢的动作电位持续时间延长、Ca2+内流增加,出现突触前易化现象。
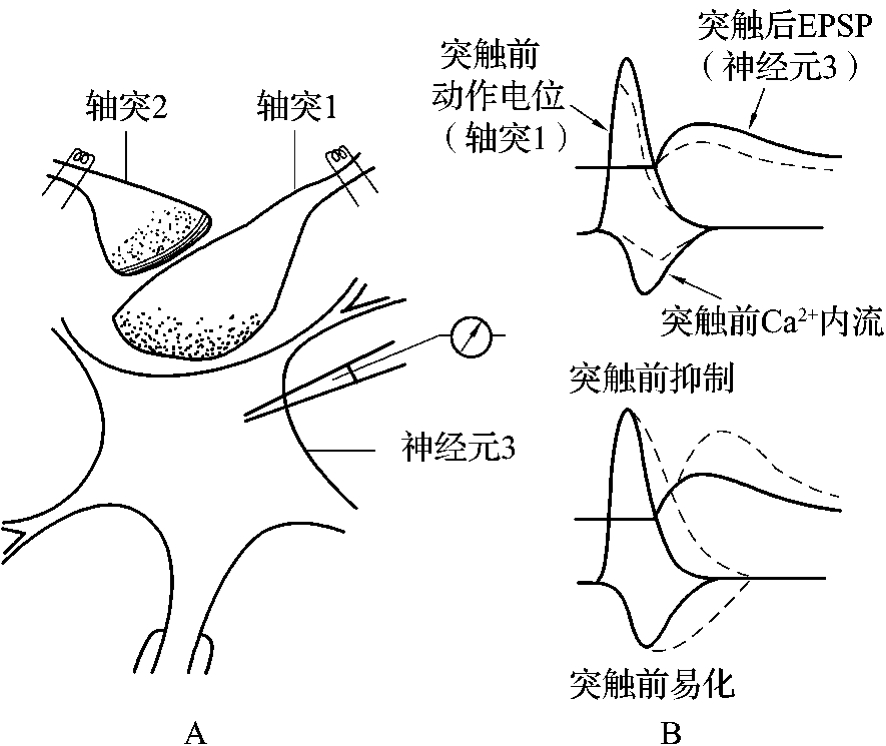
图4-2-4 突触前抑制和突触前易化的神经元联系方式及机制示意图。A.神经元联系方式;B.机制示意图,虚线表示发生突触前抑制和突触前易化时的情况
4)突触可塑性:突触的形态和传递功能可发生较为持久改变的特性或现象称为突触可塑性(synaptic plasticity),即突触传递效率在某些因素的作用下可出现不同程度的持续性增强(易化)或减弱(压抑)。突触可塑性是神经元间信息传递的重要生理调控机制,这些活动改变尤其在脑的学习和记忆等高级功能中具有重要意义。突触可塑性在不同突触的表现形式可能不同,它可能涉及突触前机制或突触后机制,或二者兼有。例如突触前可塑性是通过对神经递质释放过程的干预、修饰,调节突触活动强度的过程。突触活动强度的变化,是通过影响量子的大小,活动区的个数和突触小泡释放概率而实现的。突触前突触小泡活动尤为重要,从动员、摆渡、着位、融合和出胞等环节,每一步都是由一组相互结合的蛋白质共同完成的。突触传递具有多种形式的可塑性表现,主要有强直后增强、长时程增强和长时程压抑、习惯化和敏感化等;其发生机制都与进入突触前末梢的Ca2+量有关。
强直后增强的机制是由于高频刺激时引起Ca2+大量进入突触前末梢,使胞质内Ca2+的结合位点如滑面内质网、线粒体等出现暂时性Ca2+饱和,轴浆内游离的Ca2+浓度持续升高,这种过剩的高Ca2+水平可激活对Ca2+敏感的酶(Ca2+/ CaM激酶Ⅱ),助于突触小泡的动员,使突触前末梢持续大量释放神经递质,导致突触后电位增强。
习惯化是指重复给予较温和的刺激时,突触对刺激的反应逐渐减弱甚至消失的现象。其机制是:是由于感觉神经元轴突末梢受到重复温和的刺激,使突触前末梢Ca2+通道逐渐失活,Ca2+内流减少,突触前末梢释放的兴奋性递质减少,导致与其构成突触的运动神经元和中间神经元上突触后电位减小、甚至消失。
敏感化是指重复出现的较强刺激(尤指伤害性刺激)使突触对刺激的反应增强和延长,传递效率提高的现象。其机制是:由于递质激活了后膜上的腺苷酸环化酶,使cAMP生成增多,后者再激活蛋白激酶A(PKA),使K+通道发生磷酸化而关闭,使该感觉神经元突触前末梢兴奋时产生的动作电位时程延长,Ca2+内流增多,从而使其释放递质的数量增加。敏感化实质上就是突触前易化。
在哺乳类动物中,长时程增强(Long-term potentiation,LTP)被视为学习和记忆的重要机制。最早在海马中引出,后来发现在大脑皮质运动区、视皮层、外侧杏仁核、小脑、脊髓等部位。长时程增强是指突触前神经元受到短时间的快速重复性刺激后,在突触后神经元快速形成的持续时间较长的突触后电位增强的现象。其持续时间要比强直后增强长得多,最长能持续数天。其机制是突触后神经元胞质内Ca2+增加。实验表明,动物的记忆能力与其LTP反应强度有显著相关性,影响LTP的因素或药物可影响学习和记忆过程。
5)突触蛋白:活化的Ca2+/CaM激酶Ⅱ,进一步使突触蛋白激活并磷酸化后,突触蛋白与突触小泡和细胞骨架丝的结合减弱,而促使突触小泡与细胞骨架丝游离下来,成为可移动的突触小泡,这是触发递质释放过程的第一步。
乙酰胆碱、谷氨酸都是Ca2+依赖性神经递质。Masliah[9]等在AD疾病研究中,发现额皮质的突触蛋白含量比正常人降低了48%,同时观察到大量谷氨酸递质在突触处积聚,这可能是突触蛋白含量降低影响了谷氨酸正常释放的结果。Ferre等[10]发现阿尔茨海默病患者的老年斑中存在着营养不良的轴突,这些轴突中不含有突触蛋白,说明这些轴突在控制胞吐和神经递质传递过程中存在缺陷,这种缺陷也许与老年斑的形成有关。突触蛋白可作为突触的特异性标记物已早被应用于阿尔茨海默病的研究。早期研究已发现阿尔茨海默病患者的海马和颞叶皮质的突触蛋白的表达及其磷酸化水平均有所降低。
破伤风毒素和肉毒梭菌毒素B、D、F和G能作用于突触小泡蛋白,肉毒梭菌毒素C作用于靶蛋白的突触融合蛋白(syntaxin),肉毒梭菌毒素A和B则能作用于靶蛋白的SNAP-25。破伤风毒素能阻碍中枢内中间神经元的递质释放,临床上可见破伤风患者常引起痉挛性麻痹,而肉毒梭菌毒素则阻滞神经—肌肉接头的递质释放,导致柔软性麻痹。
(2)已释放的递质通常经突触前末梢被重摄取,或被酶水解而消除,因此凡能加速或减慢对所需递质的重摄取和酶解代谢的因素也能调节和影响突触传递的效应。如三环类抗抑郁药可抑制脑内去甲肾上腺素能神经末梢重摄取,而加强了该递质对受体的兴奋作用。利血平(reserpine)能抑制交感神经末梢突触小泡重摄取去甲肾上腺素,结果囊泡内递质不断减少甚耗竭,使突触传递受阻。而新斯的明(neostigmine)可抑制胆碱酯酶对乙酰胆碱的水解作用,乙酰胆碱持续发挥作用,因而影响胆碱能神经的突触传递。
(3)调节和影响突触后膜受体的因素。在相应的配体发生改变时,突触后膜受体的数量以及受体与配体结合的亲和力均可发生改变,即受体发生上调和下调,从而对突触传递的调节效应。另一方面,由于突触间隙与细胞外液相沟通,因此凡能进入细胞外液的药物、毒素以及其他化学物质均能到达突触后膜的受体部位,若这些物质与受体结合后可激动或阻断受体,则可影响突触传递的效应。目前已人工合成多种受体及其亚型的特异性激动剂和阻断剂(即拮抗剂),这为研究化学性突触传递提供了十分有用的工具药物。
(二)非定向突触的传递
单胺类递质的神经元的突触传递的方式是非定向突触的传递。其部位发生在外周肾上腺素能神经元的轴突末梢和中枢神经系统内。去甲肾上腺素能纤维、黑质多巴胺能神经纤维、5-羟色胺能纤维末梢分支上有大量串珠状的结节状曲张体。曲张体内含大量小而有致密中心的突触小泡,内含有高浓度的去甲肾上腺素(图4-2-5)。曲张体并不与突触后神经元或效应细胞构成经典突触联系,而是分布在效应器细胞附近。当神经冲动抵达曲张体时,递质从曲张体释放出来,以扩散方式到达附近的效应器,与相应的细胞膜受体结合,产生传递效应。(https://www.daowen.com)
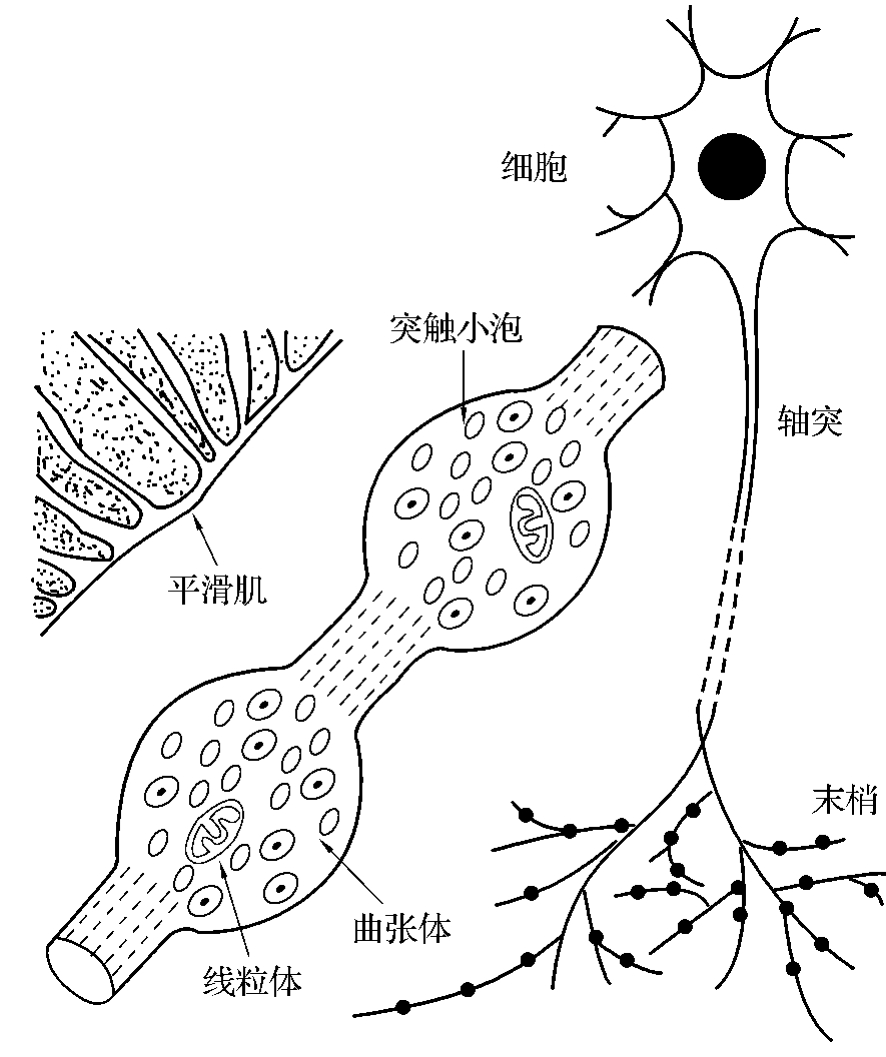
图4-2-5 非定向突触的示意图
非定向突触的传递特点:①无特化的突触前膜及后膜结构;②曲张体与突触后成分之间的距离大于20 nm;③一个曲张体可作用于较多突触后成分,即作用部位分散而无特定的靶点;④递质弥散距离较远,且远近不等,因此传递时间较长且长短不一;⑤递质对信息传递效应取决于突触后成分有无相应受体。
(三)电突触传递
电突触的结构基础是缝隙连接(图4-2-6),两个神经元之间的间隔仅2~4 nm,两侧膜上对称的六聚体水相通道蛋白两两对接,形成了沟通两细胞胞质的细胞间通道。该部位的膜阻抗较低,局部电流和EPSP以电紧张扩布形式进行信息传递,信息传递是一种电传递,故称为电突触。电突触因低电阻,传递速度快,几乎无潜伏期,信号传递一般为双向性的。这种结构广泛存在于中枢神经系统内和视网膜上,可发生在树突与树突、胞体与胞体、轴突与胞体、轴突与树突之间,具有促进不同神经元产生同步活动功能。
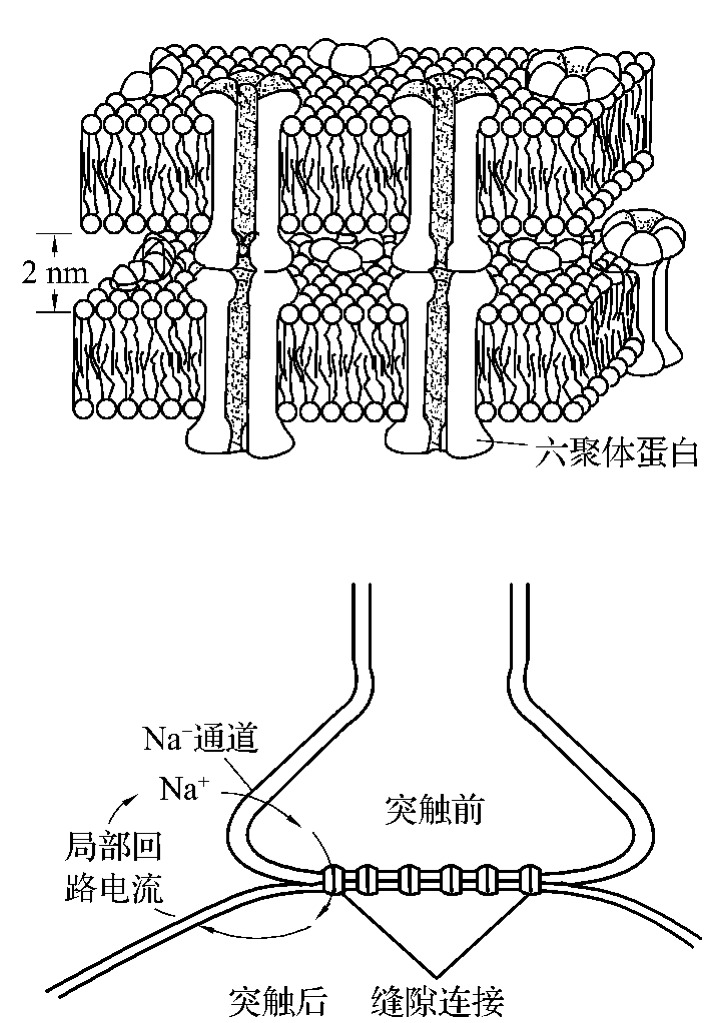
图4-2-6 缝隙连接示意图
二、神经递质和受体
(一)神经递质
1.神经递质的概念 神经递质(neurotransmitter)是指由突触前神经元合成并在末梢处释放,能特异性作用于突触后神经元或效应器细胞上的受体,使突触后神经元或效应器细胞产生一定效应的信息传递物质。神经递质应基本符合以下条件:①突触前神经元应具有合成递质的前体和酶系统,并能合成该递质;②递质贮存于突触小泡内,当兴奋冲动抵达末梢时,小泡内递质能释放入突触间隙;③递质释出后经突触间隙作用于后膜上特异受体而发挥其生理作用;人为施加递质至突触后神经元或效应器细胞旁,应能引致相同的生理效应;④存在使该递质失活的酶或其他失活方式(如重摄取);⑤有特异的受体激动剂和拮抗剂,并能够分别模拟或阻断该递质的突触传递作用。
2.递质的共存 近年来发现一个神经元内可以存在两种或两种以上的神经递质,称为递质共存,共存递质的组合形式通常是一种经典递质与一种或多种神经肽的共存。其意义在于协调某些生理过程。如支配唾液腺的副交感神经末梢释放的递质是乙酰胆碱/血管活性肠肽(ACh/ VIP),ACh能引起唾液腺分泌,VIP则可致舒张血管,增加唾液腺的血供,并能增强唾液腺的胆碱能受体的亲和力,二者共同作用,引起唾液腺分泌大量稀薄的唾液(图4-2-7)。交感神经末梢释放的递质是去甲肾上腺素/神经肽Y(NE/ NPY),NE促进唾液腺分泌,NPY主要收缩血管,减少血供,结果唾液腺分泌少量黏稠的唾液。
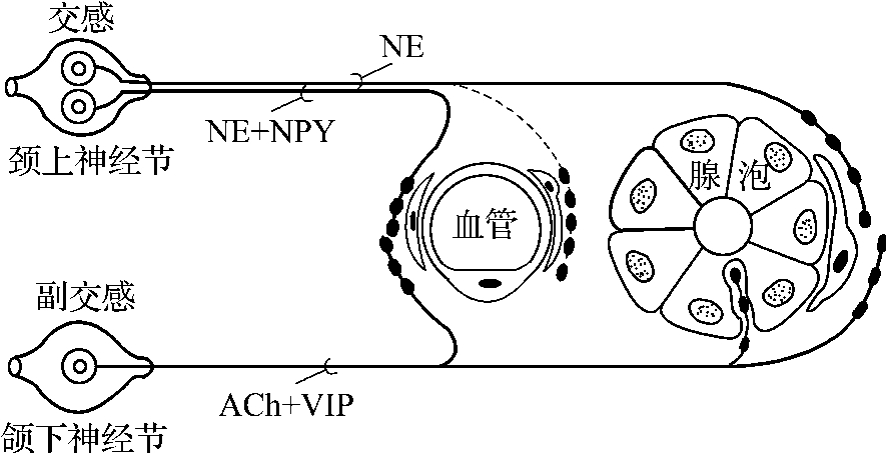
图4-2-7 唾液腺中递质共存的模式图(ACh/V IP共存) NE:去甲肾上腺素;NPY:神经肽Y;ACh:乙酰胆碱;VIP:血管活性肠肽
3.神经调质是突触传递的调节物 神经调质(neuromodulator)是指神经元产生的化学物质,也作用于特定的受体,但它们在神经元之间并不是起直接传递信息的作用,而是调节信息传递的效率,起到增强或削弱递质效应的作用,此类物质多属肽类物质。调质所发挥的作用称为调制作用。递质在某些情况下也可起到调质作用,而在另一种情况下调质又发挥着递质作用。
(二)受体
1.概念 受体是指存在于细胞膜或细胞内能与某些化学物质发生特异性结合并诱发生物效应的某些特殊生物分子。神经递质必须与相应受体发生特异性结合才能发挥作用。能与相应受体发生特异性结合并产生生物效应的化学物质称为受体的激动剂。能与特异性受体发生结合,但不产生生物效应的化学物质称为受体阻断剂。
2.受体的多样性 不同配体有不同的受体;每个配体又有数个受体亚型,这种受体的多样性不仅使得同一种递质和受体在不同的脑区具有不同的生物学效应,而且在同一突触部位也具有不同的动力学特征,使突触表现出功能可塑性。目前主要以不同天然配体进行分类和命名,如胆碱能受体、肾上腺素能受体等,各类受体又可按其作用机制再分为促离子型受体和促代谢型受体。
3.突触前受体 存在于突触前膜上的受体称为突触前受体或自身受体,他们与受体结合后,多数是抑制突触前递质的进一步释放。例如肾上腺素能纤维前膜上的α2受体属于突触前受体。突触前受体的生理作用就在于调节神经末梢递质的释放量,当神经末梢释放的去甲肾上腺素在突触前膜超过一定量时,去甲肾上腺素便与突触前膜的α2受体结合,对突触前膜释放去甲肾上腺素起负反馈性抑制作用,递质的分泌量进一步减少。若应用α2受体阻断剂,使负反馈性抑制作用被阻断后,再刺激肾上腺素能纤维,神经末梢合成和释放去甲肾上腺素明显减少。
4.受体的调节 膜受体蛋白的数量和递质结合的亲和力在不同的生理或病理情况下均可发生改变。从药理学的观察发现配体作用时间长或递质释放过多时,可以降低其效能,出现受体功能下调。其主要原因是受体发生内化使受体数量减少,亲和力也逐渐降低。内化的受体可以在细胞内分解,也可在在内质网重新组装成功能性受体通道。受体在突触后膜上也可发生侧向运动,而改变突触的传递功能。当递质分泌不足时受体还可发生上调,受体数量将逐渐增加,亲和力也逐渐增高。受体这种动力学变化是形成突触功能可塑性的原因之一。
(三)主要的递质和受体系统
1.乙酰胆碱及其受体 在外周以ACh为递质的神经纤维称为胆碱能纤维(cholinergic fiber)。在中枢以ACh为递质的神经元称为胆碱能神经元(cholinergic neuron)。
胆碱能神经元在中枢分布极为广泛,如脊髓前角α运动神经元、丘脑后部腹侧的特异性感觉投射神经元、脑干网状结构上行激动系统的各个环节、尾核、基底神经核(NBM)、边缘系统的梨状区、杏仁核、海马等也都有胆碱能神经元。
分布有胆碱能受体的神经元称为胆碱敏感神经元(cholinoceptive neuron)。中枢胆碱能受体有M受体和N受体。M受体主要是M1受体,占脑内M受体总量的50%~80℅。作用机制与G蛋白耦联有关。N受体由不同的亚单位构成,属于离子通道型受体。
中枢胆碱能系统几乎参与神经系统所有的调节功能,包括学习和记忆、觉醒与睡眠、感觉与运动、内脏活动以及情绪等多方面的活动。例如上行网状激动系统主要为单胺类和胆碱能纤维,它是维持觉醒和产生意识状态的基础(图4-2-8)。一旦这个系统受损,就可发生意识障碍。
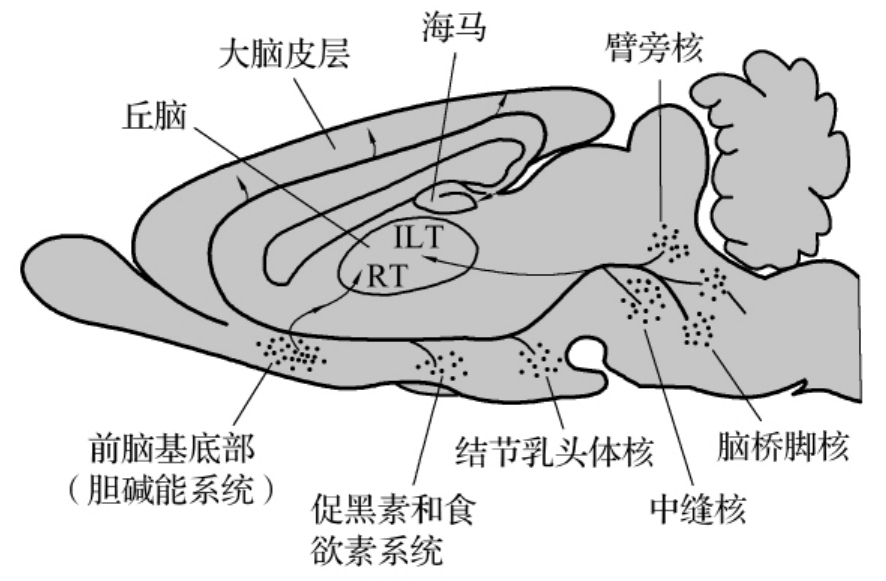
图4-2-8 上行网状激动系统由上位脑干、下丘脑和前脑基底部细胞群的轴突示意图。RT示:丘脑网状核; ILT示:丘脑髓板内核。
皮层和海马的胆碱能纤维多数来自基底前脑,特别是中隔核和基底核这些核团的胆碱能神经元具有广泛而弥散的纤维投射,可支配皮层、海马、杏仁核和脑干。近年来在标记ACh的N型受体研究中发现,AD患者由于基底神经节胆碱能神经元退行性变使皮层的胆碱乙酰转移酶(choline-acctyl-transferase,ChAT;俗称胆碱乙酰化酶choline acetylase,ChAc)减少50%以上。ChAT是人体内ACh合成的关键酶,ChAT减少导致胆碱能神经元合成和释放ACh递质减少。ACh作用于突触后膜表面受体引起生理效应后,即与受体分开,游离于突触间隙,大部分ACh在乙酰胆碱酯酶(AChE)作用下,水解成胆碱和乙酸而失去活性。新近研究证实AD患者脑内神经纤维缠结(NFT)和老年斑内AChE活性显著提高,ACh被大量水解而造成皮质层ACh含量进一步减少。由于中枢胆碱能系统的作用减弱,直接影响中枢神经系统的记忆功能,表现为患者早期记忆力减退。
2.儿茶酚胺及其受体 在外周神经系统中,除支配汗腺的交感神经和骨骼肌的交感舒血管纤维属于胆碱能纤维外,多数交感神经节后纤维释放递质为去甲肾上腺素。这种释放去甲肾上腺素为递质的纤维称为肾上腺素能纤维。在高等动物中交感神经节后纤维释放的递质不含肾上腺素,原因是神经末梢中缺乏合成肾上腺素必需的苯乙醇胺氮位甲基移位酶,不能将去甲肾上腺素甲基化而生成肾上腺素。但在中枢神经系统中,除了具有分泌去甲肾上腺素递质的神经元外,还有末梢释放肾上腺素递质的肾上腺素能神经元。中枢内的去甲肾上腺素能神经元的主要功能是参与心血管活动、情绪、体温、摄食、和觉醒方面的调节。中枢内的肾上腺素能神经元可能在心血管活动发挥调节作用。
能与肾上腺素和去甲肾上腺素结合的受体称为肾上腺素能受体。多数的交感神经节后纤维释放的递质是去甲肾上腺素,它对效应器的兴奋性或抑制性作用取决于效应细胞上肾上腺素能受体的类型。该类受体有β受体和α受体两种类型,β型又分为β1、β2和β3三个亚型,α型又可分为α1、α2两个亚型。肾上腺素能受体的效应除与受体类型不同有关外,还与受体在器官上的分布特点有关。有的效应器细胞仅有α受体,有的仅有β受体,有的二者均有。
脑内的α2受体主要是突触前自身受体的作用,延髓心血管运动中枢内α2受体兴奋,减弱交感神经的活动,起到降压作用。突触后膜α1受体激动时,神经元去极化产生兴奋效应;而突触后膜α2受体激动时,神经元趋向超极化产生抑制效应。
目前β受体阻断剂的研究进展很快,并已广泛用于临床。例如,心绞痛患者应用普萘洛尔(心得安)可降低心肌代谢活动,得到治疗的效果。但普萘洛尔可阻断β1、β2和β3三种受体,用药后会引起支气管痉挛。丁氧胺(心得乐)对气管平滑肌的β2受体阻断作用很强,而对心肌β1受体阻断作用较小。阿替洛尔、心得宁主要阻断β1受体,对支气管平滑肌的β2受体阻断作用很小,在伴有呼吸系统疾病的患者,应采用阿替洛尔、心得宁,可避免发生支气管痉挛。β3受体主要分布于脂肪组织,与脂肪组织分解有关。
动物实验进一步表明,给患有AD的小鼠长期使用β2受体激动剂后,小鼠大脑皮层和脑部海马区域形成了更多的老年斑,AD的病症更为严重;反之,给模型小鼠长期使用β2受体阻滞剂后,老年斑数量明显减少,病程也得到有效延缓。
3.多巴胺及其受体 多巴胺(dopamine,DA)也属于儿茶酚胺类,有D1~D5五种受体,都是G-蛋白耦联受体。中枢多巴胺能神经元胞体主要存在于中脑和间脑,即位于红核后方的网状结构内、黑质致密部、丘系上细胞群、中脑腹侧被盖区、下丘脑。投射系统包括:黑质—纹状体通路参与基底神经节的运动调节、中脑—皮质—边缘系统通路参与精神活动、中脑—边缘多巴胺系统及其支配伏隔核通路是形成药物依赖的部位。在脊髓中尚未发现多巴胺神经元。脑内的多巴胺主要由黑质合成,沿黑质—纹状体投射系统分布,在纹状体内贮存,其中以尾核含量最多,对纹状体神经元起抑制作用。破坏黑质或切断黑质—纹状体束后,纹状体内多巴胺含量降低,与震颤麻痹的发病有关。
4.5-羟色胺递质及其受体 5-羟色胺(5-hydroxytryptamine,5-HT)的合成底物是色氨酸,不易透过血脑屏障,中枢和外周神经系统的5-HT分属两个独立系统。受体有5-HT1~5-HT7七个亚型受体,除5-HT3是离子通道型受体外,其余大多数是G-蛋白耦联受体。在中枢神经系统5-HT1型受体占优势,5-HT2型受体主要分布在外周。
中枢神经系统的5-HT能神经胞体主要集中于低位脑干的中缝核内。其主要功能为调节痛觉、精神情绪、睡眠、体温、性行为、垂体内分泌功能。5-HT系统损害可导致痴呆患者认知功能减退和行为情感异常,尤以后者较为明显。AD患者的尸检研究均发现,脑组织内5-HT代谢失调[11]。临床常用的5-HT1A受体激动剂丁螺环酮(buspirone)具有抗焦虑和抗抑郁作用,5-HT1B、5-HT1D受体激动时可使脑动脉收缩,它是治疗偏头痛药物的靶受体。
5.组胺及其受体 组胺受体有H1、H2和H3三种,多数H3受体为突触前受体,通过G-蛋白介导抑制组胺或其他递质释放。胞体位于下丘脑后部的结节乳头核内,纤维分布中枢所有部分,包括大脑皮层和脊髓。其功能可能与觉醒、性行为、腺垂体分泌的功能、血压、饮水和痛觉调节有关。
6.氨基酸类递质及其受体 分为兴奋性递质(谷氨酸、门冬氨酸)和抑制性递质(γ-氨基丁酸、甘氨酸)两类。
(1)兴奋性递质 ①谷氨酸在中枢内分布极为广泛,大脑皮层、海马和脊髓背侧部分含量较高,谷氨酸受体有促离子型受体(再分为KA、AMPA、NMDA受体三个类型)和促代谢型受体(11种亚型)。谷氨酸可能是感觉传入纤维和大脑皮层内兴奋性递质。②门冬氨酸在小脑、丘脑和下丘脑的含量最高,大脑皮层和纹状体内较少。
(2)抑制性递质 ①γ-氨基丁酸(GABA)在大脑皮层的浅层和小脑皮层的普肯野细胞层含量较高,其受体有促离子型受体和促代谢型受体(GABAA、GABAB和GABAC 3种亚型)。脑内存在两种GABAA受体结合位点,高亲和力结合位点在大脑皮质Ⅰ~Ⅲ层、丘脑内外侧膝状体和小脑颗粒层最密集;低亲和力结合位点位于大脑皮质Ⅳ层、海马、杏仁核、丘脑、黑质和小脑分子层。GABAA受体是氯离子通道受体,通道开放时,Cl-内流,引起突触后膜超极化。GABAA受体的突触后抑制效应具有抗惊厥、抗焦虑和镇静作用。GABA对背根神经节细胞的去极化作用使初级感觉传入纤维的末梢产生突触前抑制,减少或阻断感觉信息的传入。GABAA受体通道开放时间和频率受内源性物质或药物调制,GABAA受体与GABA、安定、巴比妥和印防己毒素结合后调节受体通道开放或关闭。GABAB受体分布于中脑和小脑。GABAB受体激动时可激活腺苷酸环化酶,抑制电压门控Ca2+通道开放,促进K+通道开放,K+外流增多,而使膜超极化,因此突触后膜GABAB受体激动产生IPSP。GABAC受体也是Cl-通道受体,主要分布在视觉传导道路上。GABA能神经元的纤维投射有:纹状体—黑质投射、纹状体—苍白球投射、小脑—前庭外侧核投射、黑质—丘脑投射、丘脑底部—苍白球投射和下丘脑乳头体—新皮质投射等。②甘氨酸在线粒体合成,主要分布于脊髓(图4-2-9)和脑干中,对运动神经元起抑制作用。甘氨酸受体是Cl-通道受体,又称士的宁敏感受体,可被士的宁和印防己毒素所阻断,可引起强烈的肌痉挛。
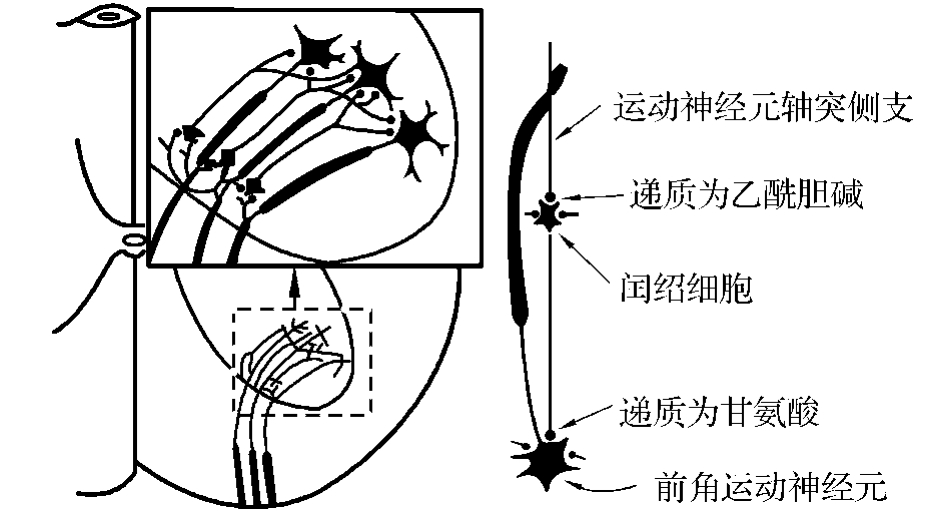
图4-2-9 脊髓前角中间神经元的甘氨酸递质作用部位
7.神经肽及其受体 神经肽以调制、递质或激素的形式发挥作用。主要的神经肽有速激肽、阿片肽、下丘脑调节肽、神经垂体肽、脑—肠肽。①速激肽包括六个成员:P物质、神经肽A、神经肽K、神经肽α和神经肽B,其受体有NK-1、NK-2和NK-3三种,分别对P物质、神经肽K和神经肽B敏感,都是G-蛋白耦联受体。P物质在脊髓慢痛传入通路中很可能是第一级突触的调质;在丘脑,它可发挥对神经内分泌调节作用;在小肠它还可参与肠肌反射。②阿片肽包括β-内啡肽、脑啡肽和强啡肽,其受体有μ、κ和δ三种,均为G-蛋白耦联受体。β-内啡肽在下丘脑、丘脑、脑干、视网膜和腺垂体主要起抑制调制作用。脑啡肽在脑内和胃肠道可发挥神经递质作用,在脊髓后角可与痛觉传入的调制有关。③下丘脑调节肽和神经垂体肽,大部分激素及其受体存在于下丘脑以外的脑区,发挥神经递质作用,参与感觉传入、运动传出和智能活动的调节。④脑—肠肽是在脑内和胃肠道内双重分布的肽类物质,主要有缩胆囊素(CCK)、血管活性肠肽(VIP)、神经降压素、胃泌素释放肽。脑内有两种CCK,即CCK4和CCK8,受体为CCK-A和CCK-B;具有抑制摄食行为等多种作用。VIP和神经降压素受体均为G-蛋白耦联受体。VIP存在于血管运动神经纤维和胆碱能神经纤维中,具有舒张血管的作用及加强乙酰胆碱作用的功能。
8.嘌呤类递质及其受体 主要有腺苷和ATP。腺苷是中枢神经系统中的一种抑制性调质,其受体有A1、A2A、A2B和A3等四种类型,均为G-蛋白耦联受体。ATP在体内具有广泛的受体介导作用,其受体有P2Y、P2U、P2X和P2Z。
9.NO递质气体 分子NO,可自由透过细胞膜,作用于细胞内的靶分子。NO能直接结合并激活鸟苷酸环化酶,还能通过多种非cGMP依赖性途径发挥生物效应。NO由血管内皮细胞释放的内皮舒张因子(EDRF),也在脑内产生。NO具有调节脑血流而间接影响神经细胞功能、促进或抑制递质释放、参与突触的可塑性、参与了正常生理学过程中的长时程增强(long term potentiation,LTP)与长时程抑制和学习记忆[12]、参与痛觉、嗅觉及视觉的信号转导。某些神经元含有一氧化氮合酶,是催化L-精氨酸产生NO和L-胍氨酸的专一酶,使精氨酸生成NO。在病理情况下,脑内NO过量的释放对神经元可产生毒性作用,它通过产生大量羟自由基(OH-)和二氧化氮自由基(NO2),抑制LTP从而影响学习记忆。
(周玉琴 张孟业)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







