第二十二章 今日脾脏外科
自1590年Rosetti施行第一例脾脏切除术以来,脾切除术一直是处理脾外伤和脾脏疾病的标准术式。由于脾切除后多数病人病程经过顺利,能恢复健康。故长期以来,外科学界一致认为脾脏并非生命所必需,留之无用,去之有益。直到1952年,King和Schumacker发现脾切除术后凶险性感染(overwhelming postsplenectomy infection,简称OPSI),人们才开始意识到脾脏并非没有功能,并应用现代医学手段对脾脏功能开展了较深入的理论和临床研究,揭示出脾脏是一个有着多种功能的重要器官,奠定了现代脾脏外科的基础。尤其是近20年的研究,已使脾脏外科发展到了一个新的阶段:在充分了解脾脏的功能和切除或保留脾脏的利弊的前提下,开展各种保脾手术、切脾手术、脾移植术,以使患者既获得最佳的疗效,又尽可能地恢复或接近生理状态。
同时,随着各种新技术应用于脾脏外科,一些新的治疗方法,如腹腔镜脾切除术、部分脾栓塞术治疗脾功能亢进等已经在临床逐渐开展,也为脾脏外科的研究开辟了新的领域,并将促进脾脏外科的发展。
第一节 脾脏的生理功能
一、储血和造血功能
(一)储血功能
人类脾脏的被膜没有平滑肌,当脾脏内的血管扩张时,可以储存几百亳升的血液,交感神经兴奋时,血管收缩将血液压入血循环,不过,正常人体脾脏较小,其容积只有150~200m L,故这种功能并不十分重要。脾脏有两个区域即静脉窦和脾髓储存血液。另外,当脾脏膨胀时,很多血细胞储存于脾髓,使血循环中的红细胞数略为降低。收缩时可增加全身血液红细胞压积1%~2%,这种能力对人体激烈运动或应激状态有一定帮助。
脾脏还能储存大量的血小板,可达全血中的1/3。正常人输入一定量的血小板,其中约30%储存于脾脏中,黏附在网状纤维上而不受破坏,并可重新进入血循环。
(二)造血功能
胚胎时期,脾脏的髓质能产生红细胞。胎儿出生后,脾脏推动这种能力。此时脾内淋巴组织成分逐渐增多,许多淋巴细胞进入小动脉周围的结缔组织中,由髓样器官转变为淋巴器官,因此出生后脾脏主要产生淋巴细胞、浆细胞和单核巨噬细胞。但是,当患某些疾病,如胎儿成红细胞增多症或骨髓造血功能严重受损时,脾脏可重新产生红细胞。
二、滤血和毁血功能
(一)滤血功能
脾脏位于血液循环的中心地带,每分钟可有5%的血量通过脾脏,正常成人每天流量约为300L。其中,10%的脾动脉血直接汇入静脉窦,90%的血流经红髓。血液在红髓内由小梁动脉分出的笔毛动脉经脾索、脾窦而回流入脾的小梁静脉。脾脏这种大流量、低流速的微循环方式使其能对血液作充分和选择性的过滤。脾髓边缘带和脾索是滤血的主要场所。循环血中的单核细胞进入红髓的边缘带和脾索中,可以停留并转变为巨噬细胞而发挥吞噬作用。脾脏对红细胞不是机械性的滤过,而是有选择性的。正常的血液成分能顺利地通过脾脏,颗粒性抗原(如细菌)和有缺陷的、衰老的或脆性增高的细胞则被扣留,由巨噬细胞清除。
(二)毁血功能
脾脏是清除衰老红细胞的主要场所。红细胞衰老的表现为细胞膜的Na、K-ATP酶活性下降,红细胞脆性增加,膜脂流动性降低,膜骨架蛋白带1和带2即血影蛋白(spectrin)降解和含量减少。研究表明脾脏过滤和清除衰老的红细胞主要有3种方式:①剔除(culling):从循环中挑剔和去除畸型的、凝集的或带有抗体的红细胞。②去核(pitting):清除红细胞内部无用或有害的物质(如网织红细胞中的“残核”、Heinz氏体、Howell Jolly氏体)。③表面再塑形(surface remodeling);去除红细胞膜上多余的成分或部分膜,将靶细胞形态重新改变成正常的双凹盘状的红细胞。
脾脏因种种原因增大时,血流通过脾脏更缓慢,可由正常时的5min延长至1h,这将影响血细胞的代谢,导致血细胞葡萄糖缺乏,高能磷酸减少,钠泵衰减或代谢损伤。故脾肿大、脾功能亢进时,因其毁血机能增强而引起血细胞减少。
而脾切除后,由于脾脏的滤血、毁血、储血作用丧失,可出现血小板增多,循环血中衰老和畸形的红细胞增多,并可影响血液流变学,出现血液成分的流动性降低,黏滞性增加。
三、脾脏的免疫功能
脾脏是人体最大的外周淋巴器官,占全身淋巴组织总量的1/4左右,也是惟一能滤过血液的淋巴组织。所有抗原物质从静脉进入体内时,脾脏是发生免疫应答的主要场所,可产生多种免疫活性细胞和免疫因子,也是抗体的主要产生部位,对感染免疫和肿瘤免疫均有重要的影响。
(一)脾脏产生的免疫物质及其作用
1.免疫活性细胞
(1)T淋巴细胞:脾脏中T细胞占40%,T细胞受抗原刺激后,分化增殖,形成许多效应性T细胞和细胞毒性T细胞。前者可释放多种淋巴因子,直接或间接地产生免疫作用,后者则能直接对靶细胞,如肿瘤细胞发挥直接的、连续的杀伤作用。对人的外周血及全身各免疫器官中T细胞亚群分布的研究发现,脾脏中的抑制性T细胞(Ts)比例最高,达45%,辅助性T细胞则只占10%,故脾脏在免疫调节中有着不可忽视的作用。
(2)B淋巴细胞:B淋巴细胞在脾脏中含量最多,约占脾内淋巴细胞总数的55%左右。受抗原刺激后,B细胞可分化增殖为浆细胞,进而合成各种免疫球蛋白,发挥特异性体液免疫作用。其中,脾脏的边缘区有全身最多的表面抗原为Ig M+、IgD+及CD21+的特殊B淋巴细胞亚群,它们是合成和分泌Ig M的主要细胞。因此,脾脏是早期和最大量产生特异性Ig M的主要场所。
(3)巨噬细胞:脾脏中有大量的巨噬细胞,它是一种多潜能细胞,不仅参与机体的特异性和非特异性免疫反应,而且是联系两种免疫反应的桥梁细胞。巨噬细胞活化后可直接识别或借助于抗体和外源性凝集素识别、吞噬、杀伤微生物和肿瘤细胞等靶细胞。此外,它还可以合成和分泌多种具有重要免疫调节作用的细胞因子。例如白细胞介素1(IL-1),已被证实具有促进T细胞分化增殖,诱导Th细胞产生白细胞介素2(IL-1)和B细胞产生抗体等作用。
(4)K细胞、NK细胞和LAK细胞:这3种细胞在脾脏中也有相当数量。K细胞仅在有抗体(IgG)参与的情况下才对靶细胞发挥杀伤作用,故又称抗体依赖性杀伤细胞(ADCC),它对肿瘤细胞、胞内寄生微生物的细胞,以及寄生虫等都有一定的杀伤作用。NK细胞是天然杀伤细胞,在红髓中分散存在,在白髓中限于脾小结的主发中心,它无需抗体协助,能杀伤多种肿瘤细胞。LAK细胞又称淋巴因子活化的杀伤细胞,是在IL-2的诱导下形成的,其不同于其他的杀伤细胞的最突出特点是具有广谱的抗肿瘤效应,不但能溶解对NK敏感的靶细胞,而且也能溶解对NK不敏感的各种自体和同种异体的实体瘤细胞。
(5)树突状细胞:脾脏中淋巴组织树突状细胞(LDC)的数量是全身最多的。此细胞虽无表面免疫球蛋白,也无Fc和C3 b受体,无吞噬能力,但有一条很长的突起,具有明显的黏附性,而且脾脏中这类细胞几乎100%都具有丰富而稳定的Ia抗原。因此,LDC不仅有吸附和保留抗原的作用,同时可利用酶将抗原裂解为小片断,并与Ia抗原结合,从而有提呈抗原的作用。特别是对可溶性抗原,此种细胞能发挥很大的辅助作用。
2.免疫因子
(1)Tuftsin:Tuftsin又名吞噬素,是由Najjar等于1970年在Tufts大学首先发现并命名的一种四肽物质(苏-赖-脯-精),它并非由脾脏直接产生,而是在脾脏内由内羟基肽酶和白细胞膜酶裂解IgG分子上的一小段肽而形成的,现已可人工合成。Tuftsin的主要作用是增强白细胞、单核—巨噬细胞的活性,包括趋化和吞噬能力,尤其是促进单核—巨噬细胞对细菌、异物的吞噬和消化功能。有较强的抗感染免疫作用。近年的研究表明,Tuftsin还能增强巨噬细胞、中性粒细胞和NK细胞对肿瘤细胞的杀伤活性,有一定的抗肿瘤作用。故国外已开始试用Tuftsin提高先天性Tuftsin缺乏患者和脾切除患者的抗感染免疫功能,并试用于治疗晚期肿瘤病人,且获得了一定的疗效。因脾切除后Tuftsin将明显减少或消失,故测定Tuftsin水平是评价脾脏功能的一个重要指标。
(2)补体成分:补体系统由多种成分组成,现共有18种,主要由单核—巨噬细胞系统产生,脾脏富含巨噬细胞,是补体系统多种组成的重要产生部位。补体系统活化后可发挥促吞噬、中和及溶解细菌等免疫作用和免疫调节作用。同时,肿瘤免疫中的补体依赖性抗体细胞毒作用也需要补体的参与。脾切除后补体旁路途径活性下降,并与肺炎球菌导致的OPSI有关。
(3)免疫核糖核酸:免疫核糖核酸(IRNA)是致敏机体的淋巴细胞和巨噬细胞的胞浆中蕴藏的一类核酸。IRNA释放后可将抗肿瘤的细胞免疫反应传递给正常非致敏的淋巴细胞,使之成为效应细胞而直接发挥抗肿瘤作用。由于脾脏含有大量的淋巴细胞和巨噬细胞,是IRNA的重要产生部位,因而多由荷瘤动物或肿瘤患者的脾脏提取IRNA。实验和临床研究表明IRNA可调节肿瘤宿主的细胞免疫反应,有一定的治疗价值。
(4)P因子:P因子又称备解素,是补体旁路途径中的一个重要组成部分,主要由脾脏合成,P因子是一种糖蛋白,分子量19 000~22 000。现已公认P因子在补体旁路激活途径中起稳定C3、C5转化酶的作用,可增强C3旁路活化功能,发挥抗感染作用。脾切除后外周血P因子水平降低。
(5)内源性细胞毒因子:内源性细胞毒因子(ECF)是从人和牛的脾脏中分离出来的一种细胞毒因子,具有免疫监视作用,可直接抑制肿瘤细胞的RNA合成而发挥抗肿瘤免疫作用。
3.脾切除后的抗体的免疫功能的改变 由于脾脏具有以上多种免疫物质及特殊作用,因此被认为是免疫系统的一个重要组成部分,一般认为,脾切除后抗体的免疫功能将发生下述改变:
(1)巨噬细胞活性下降,尤其是对未能调理的颗粒。
(2)淋巴细胞在血中的停留时间延长。
(3)血清Ig M减少。
(4)补体旁路活性下降。
(5)Tuftsin产生减少。
(6)自身抗体活性增强。
(7)Ts细胞减少。
(8)对胸腺非依赖2型(T 1~T2)抗原的初次反应能力下降。
(二)脾脏与感染免疫的关系
自1952年King和Shumaker发现OPSI以来,人们开始认识到脾脏与感染免疫有着极其密切的联系,并对脾切除后机体免疫功能的变化及其与OPSI发生的关系进行了研究。OPSI是脾切除后凶险性感染,可发生于术后数周至数年,一般以术后3~5年多见,发生率平均为1%,3岁以下儿童和血液病患者切脾后则更高。其临床特点是陷匿性起病,开始仅有轻微的咽痛和发热,继而骤然高热、头痛、恶心呕吐,乃至昏迷、休克,常伴有DIC(弥漫性血管内凝血)和肾上腺出血综合征,可在数小时至十几小时内死亡,死亡率可高达50%~80%,尸检可发现双侧肾上腺出血、内脏出血等。致病菌以荚膜肺炎球菌为主,约占50%,其次为嗜血流感杆菌、脑膜炎球菌,少数为大肠杆菌和金黄色葡萄球菌。
研究表明,脾脏发挥抗感染免疫作用主要依赖其两大功能,即滤过吞噬和产生抗体。脾脏切除后,继发的免疫缺陷有Tuftsin产生减少,巨噬细胞吞噬活性下降,血清Ig M减少,补体旁路活性下降等,这些改变导致机体抗感染能力下降,故易发生OPSI。近年来的研究还发现脾脏在对抗原的初次反应和再次免疫反应中扮演重要角色,尤其是对胸腺非依赖2型(TI-2)抗原的免疫反应,初次反应发生在脾脏边缘带。TI-2抗原一般为多糖,是肺炎球菌、流感嗜血杆菌和脑膜炎球菌荚膜的抗原成分。由于对TI-2抗原的初次免疫反应依赖于脾脏,故不难理解为什么脾切除后易发生OPSI,以及为什么OPSI的致病菌主要是肺炎球菌、流感嗜血杆菌和脑膜炎球菌等荚膜细胞了。
(三)脾脏与肿瘤免疫的关系
由于脾脏对肿瘤免疫表现出多样性的影响,以及研究对象和方法的不同,对脾脏与肿瘤免疫的关系尚无一致的认识。但就现有的资料而言,脾脏中存在抗肿瘤和免疫抑制两种因素,且在肿瘤发展的不同阶段,这两种因素分别处于主导或从属地位。
1.脾脏中的抗肿瘤因素 脾脏是机体最大的免疫器官,具有完成过滤和处理抗原的血液动力学基础。其独特的微循环,有利于吞噬异物,还能产生免疫活性细胞和各种抗体,并能独家产生具有抗感染和抗肿瘤作用的Tuftsin。切除脾脏可导致机体抗肿瘤水平下降,肿瘤出现早且生长快,外周血Ts增多、Th减少,细胞免疫功能下降,宿主生存期缩短。而补充脾脏、脾脏细胞、Tuftin等则可增强荷瘤宿主的抗肿瘤免疫功能。如:给晚期肝癌病人移植正常的同种异体脾脏,术后病人一般情况好转,NK细胞活性增高,AFP下降,B超和CT均示癌块有不同程度的缩小,平均生存期较自然生存期延长2倍以上。给荷瘤小鼠腹腔注射正常的同种异体脾细胞,可增强腹腔巨噬细胞的抗瘤活性,延长动物的生存期。癌症病人的脾细胞在体外用IL-2活化后,形成LAK细胞,在体内、外均有较强的抗肿瘤作用。给荷瘤动物注射天然或合成的Tuftin,可增强巨噬细胞破肿瘤的能力,抑制肿瘤生长,减少转移的发生率,延长动物生存期。因此,脾脏确有一定的抗肿瘤免疫作用。
2.脾脏中的免疫抑制因素 机体发生肿瘤后,由于肿瘤细胞自身可释放免疫抑制物质,以及通过肿瘤细胞与免疫系统间复杂的相互作用,诱导机体的免疫系统处于抑制状态,使肿瘤细胞得以逃逸宿主的免疫监视,可在宿主免疫功能受到抑制的条件下增殖。研究表明,脾脏可参与肿瘤宿主免疫抑制状态的诱导形成。有报道说,在接种肿瘤细胞前,或接种5d后切除脾脏,可抑制肿瘤生长,减少转移结节数量,延长荷瘤小鼠的生存期。其他研究则认为:脾抑NK细胞活性,脾脏产生的抗瘤抗体与肿瘤的某些成分结合,形成抗原—抗体复合物而推动抗瘤作用,脾脏可产生并释放免疫抑制因子,脾脏还含有大量和Ts细胞及Ts前体Ts细胞的成熟部位和再循环库,荷瘤状态下脾脏中的Ts细胞可激活并大量释放。因而,脾脏又有抑制肿瘤免疫反应,有利于肿瘤的发生和发展的一面。
3.脾脏抗肿瘤和免疫抑制因素的转化 宿主的免疫状态随着肿瘤的发生和发展,将发生一系列复杂的变化。脾脏作为免疫系统的一个重要组成部分,其对肿瘤免疫的影响也不是一成不变的。Jasnis发现:荷瘤小鼠的脾细胞在肿瘤早期有特异的抑制肿瘤生长的作用,而对于进展期肿瘤,脾细胞则促进其生长。Bear等的研究显示,荷瘤小鼠的脾细胞对进行性生长的肿瘤的免疫应答经过几个明显的阶段:①对肿瘤细胞无明显的细胞毒性作用(0~5d)。②对肿瘤细胞有较强的细胞毒性作用,并对肿瘤诱导的Ts细胞的抑制作用有一定的抵抗能力(7~12d)。③对肿瘤细胞的细胞毒性作用较弱,并能被肿瘤诱导的Ts细胞完全抑制(14~20d)。④特异性地抑制细胞毒性作用(18~20d以后)。Nordland则发现小剂量接种肿瘤细胞时,有脾小鼠的肿瘤生长受抑制。而大剂量接种时,有脾小鼠的肿瘤生长较快。并认为脾脏可能通过两种方式来调节肿瘤免疫,即产生肿瘤抗体和Ts细胞。接种小剂量肿瘤细胞时,以产生抗瘤抗体为主。反之,则以产生Ts细胞为主。笔者对胃癌病人脾静脉血和外周静脉血T淋巴细胞亚群及免疫抑制因子水平的研究表明:人类脾脏对肿瘤免疫的影响也是双向的,且有明显的时相性。癌症早期时,脾脏通过释放Th细胞,主要表现为抗肿瘤免疫作用;癌症进展期以后,脾脏则通过释放Ts细胞和免疫抑制因子,反而抑制肿瘤免疫反应。
四、脾脏的其他功能
脾脏除了是一个重要的免疫器官外,还有一定的内分泌功能。研究证明脾脏对性激素、肾上腺皮质激素、甲状腺激素均有不同程度的调节作用,这些激素在脾切除后均有不同程度的改变。此外,脾脏还是VIII因子产生的一个重要部位,同种异体脾脏或脾细胞移植均可使重症血友病甲病人血中VIII因子水平提高,临床症状缓解。
总之,数十年的研究,尤其是近10年的研究,使我们对脾脏的认识有了根本性的转变,脾脏已由一个无用之物成为有多种重要功能的器官,并使外科学界在涉及脾脏的问题上采取了更为慎重的态度。可以预见,随着对脾脏功能研究的进一步深入,我们对脾脏的认识将会更全面、更准确,并对临床工作起到更好的指导作用。
第二节 脾 破 裂
脾脏位于左上腹深部,受胸部、腹壁及背部保护。在腹部闭合性损伤中,有20%~40%的病人发生脾破裂,脾破裂85%以上是由外伤引起的,医源性损伤和自发性脾破裂不足15%。
人类处理脾脏损伤的历史据文献记载可追溯至400余年前。1590年Rosetti最早为1例腹部贯通伤,脾脏部分暴露于伤口的病人,成功地进行了脾脏切除术。1678年Matthias给一腹部自杀,脾脏暴露于伤口3d的病人,用丝线结扎脾蒂后切除伤脾。1892年Riegner首次给一名腹部闭合损伤、脾脏横断性破裂的病人施行脾脏切除手术。由于脾脏破裂后出血量大,难以自愈,且保守治疗后仍有较高的延迟出血率,死亡率高。而手术切除全脾操作较简单,止血可靠,近远期并发症少。故1911年Kocher在外科学手术教科书中首次明确提出:“脾切除后对机体没有危害,因此,当脾损伤时就应切除这个器官。”此后的近70年中,这一观点几乎完全统治着脾脏外科学界。在临床实践中,绝大多数外科医师处理脾脏损伤时,全脾切除术是惟一的术式,即使是正常脾脏的小浅表裂伤,甚至手术探查时出血已自止,仍不假思索地切除全脾,其主要依据就是“脾脏并非生命必需”。
另一方面,对脾损伤施以保留性脾手术,也有200年的历史。1787年Dorsch成功地为一名腹部贯通伤的男性病人施行了脾大部切除术,此病人术后存活23年。1867年Pean做脾部分切除,也获成功。1892年Sames、1895年Zikoff分别对1例脾破裂成功地施行了脾修补术。但是,由于当时认为脾脏没有什么功能,加上脾切除术被公认为是治疗脾破裂的标准术式,这类难度大、风险多的保留性脾手术难以得到广大外科医师的重视和采纳。1919年Morris和Bullock经详细的临床观察,发现脾切除后病人对感染的易感性增加,使医学界对脾脏的免疫功能有了初步的认识。但真正引起医学界广泛关注并以浓厚的兴趣对脾脏功能进行系统研究,则是由于1952年King和Schumacker首先报道脾切除后可导致严重的全身性感染,即脾切除后凶险性感染(overwhelming postsplenectomy infection,OPSI),故1979年美国第三十九届创伤外科年会上称这一发现是现代脾脏外科发展史上的里程碑。随后的研究发现脾脏是一个有着多种功能的重要器官,尤其是抗感染免疫功能。近10年来,多种保留性脾手术得以创制,并逐渐为广大医师所认同、采纳。进入20世纪90年代后,随着对脾功能研究的深入,以及随着施行各种保留性脾手术经验的积累,对脾破裂的处理已有了较为成熟和统一的原则。即“抢救生命第一,保留脾脏第二。”在最大限度确保挽救病人生命的前提下,根据具体情况和条件,采用非手术、各种保留性脾手术或全脾切除术等不同的方法处理脾破裂病人,尽可能保留脾脏及脾脏功能,以使病人尽可能恢复或接近生理状态。
一、病因和分类
根据脾破裂的病因,可将脾破裂分为外伤性、自发性及医源性三类。
(一)外伤性脾破裂
外伤是脾破裂的首要原因,占所有脾破裂的85%以上。外伤性脾破裂又可分为开放性和闭合性两类,且以闭合性损伤多见。开放性脾损伤多由划刺、子弹贯通和爆炸等所致,闭合性脾损伤则多见于交通事故、工伤、高处坠落和暴力打击等。据统计,1950年以来,我国78个单位报道的13 533例腹部外伤中,脾破裂占36.7%,居各种腹部外伤之首。
(二)自发性脾破裂
自发性脾破裂是指无明确外伤史而发生的脾脏突发性或隐匿性破裂,占全部脾破裂病人的3%~4%。自发性脾破裂有病理脾和正常脾自发破裂之分,但多为各种原因所致充血性脾肿大、疟疾、脾血管瘤等,白血病、淋巴瘤、脾动脉粥样硬化等则较少见。
(三)医源性脾损伤
医源性损伤系由于手术操作或医疗器械使用不当所致,约占全部脾切除术病例的1%~1.5%。其中,绝大多数为手术中损伤,如胃大部切除、结肠切除、左肾切除及食管裂孔疝修补术时,探查、牵拉、拉钩或其他器械误伤脾脏均可引起。其次可见于胸腹部侵入性检查和治疗,如胸腔穿刺、腹腔镜检查和针灸等;另外,产科操作可引起新生儿脾破裂。
二、分型和分级
为了便于判断掌握脾损伤的严重程度,有必要对脾破裂进行分型和分级。
(一)传统分型
1.中央破裂 系脾实质的深部破裂,表浅实质及脾包膜完好,而在脾髓内形成血肿,致脾脏逐渐增大,略为隆起。这类脾破裂转归有三;一是出血不止,血肿不断增大,裂口加重以致于真性破裂。二是血肿继发感染。三是血肿逐渐吸收或机化。
2.包膜下破裂 系脾包膜下脾实质周边部分破裂,包膜仍完整,致血液积聚于包膜下。故临床上仅有左上腹不适或轻度疼痛,没有腹腔内出血迹象,不易觉察。如出血自止,血肿可逐渐被吸收,形成纤维化肿块或外伤性脾囊肿。如脾实质继续出血,致血肿张力超过包膜承受力或由于病人活动及轻微外力均可使包膜破裂而发生延迟性脾破裂,可引起急性大出血。
3.真性破裂 指脾包膜与实质同时破裂,发生腹腔内大出血,占临床所见脾破裂85%以上。出血量一般与破裂程度成正比,大的撕裂或粉碎性破裂,伤及脾门及脾蒂血管者可由于出血凶猛而致患者于短期内死亡。已被凝血块堵塞的裂伤,在血压回升,体位改变或血块溶解时也可再度出血。
(二)改良的分级与分型
由于上述传统的脾破裂分型不能准确地反映脾破裂的严重程度,20世纪80年代以后,随着保留性脾手术的兴起,国内外学者进一步提出了能较准确反映脾损伤程度的改良的脾破裂分级分型,现介绍其中著名的两种分级分型标准。
1.Schackford-Feliciano分级
1级:包膜撕裂或轻度的脾实质裂伤——缝合修补。
2级:包膜撕脱——缝合修补和局部应用止血剂。
3级:严重脾实质破裂或穿透性弹伤或刺伤——缝合修补或脾切除。
4级:严重的实质星状破裂或横断或脾门损伤——部分脾切除或全脾切除。
5级:粉碎性或多发性脾损伤——脾切除。
2.Buntain CT显像分型
Ⅰ型:脾包膜局限性破裂或包膜下血肿,无明显脾实质损伤。
Ⅱ型:脾包膜单处或多处破裂并伴有脾实质(横形或纵形)破裂,但未伤及脾门和大血管,或有实质内血肿。
Ⅲ型:脾单发或多发性深部(纵形或横形)断裂伤,伤及脾门及脾段主要血管。
Ⅳ型:脾脏完全破裂、断裂或脾蒂离断。
并用A表示不伴其他脏器损伤,B表示伴有腹腔内其他脏器损伤,B1表示伴有腹内实质性脏器损伤,B2表示伴有腹内空腔脏器损伤,E表示伴有腹外脏器损伤。
三、临床表现
(一)症状
临床症状的轻重,取决于脾脏损伤程度,就诊早晚,出血量多少以及合并伤的类型。脾包膜下破裂或中央破裂的病人,主要有左上腹部疼痛,呼吸时加剧,腹痛在受伤后立即出现。经一中间缓解期后再度发生腹痛的,多提示脾脏由不完全破裂发展到完全破裂。疼痛多由左上腹扩展到全腹,但仍以左上腹为甚,疼痛多为持续性剧痛,亦可为绞痛、隐痛、割裂痛、胀痛等,偶呈阵发性,并可放射至左腰部或左肩部,深呼吸时加重。部分病例左肩部皮肤出现一感觉过敏区,称Kehr氏征,系脾窝积血、积液或血块聚积,刺激左侧膈肌,通过第四颈交感神经传入大脑,产生错觉所致。腹痛剧烈时常伴有反射性呕吐。
病情发展,可迅速出现失血性休克症状,如烦躁、口渴、心慌、耳鸣、四肢无力、呼吸急促等。若合并脑外伤、胸外伤等时,上述症状可被掩盖。
(二)体征
病人表情痛苦,弯腰屈背。如出血量大,常有血压下降、脉搏增快、神志淡漠、面色苍白等出血性休克表现。检查常可发现左季肋部皮肤破损、血肿、肋骨骨折等,或可见身体其他部位的外伤。腹部可因大量积血而膨隆,如为脾包膜下血肿或原有脾肿大疾病,常能触到肿大的脾脏或囊性包块。完全性脾破裂早期仅有左上腹压痛,局部腹肌紧张。随着腹内积血量的增多,可出现弥漫性腹膜炎体征,如全腹明显肌紧张、压痛、反跳痛,并以左上腹为著。按压左胸锁乳突肌后缘锁骨上两横指处,病人可有剧烈痛感,此为Saegesser征。
脾浊音界可增大,且较固定,如腹内积血较多,可有移动性浊音。脾周有大量血凝块时,左腰通常有较固定的浊音,称为Balance征。
医源性脾损伤常于术中发现异常出血,检查脾脏可见裂口或创面,脾周有积血或凝血块,拭去后可发现脾脏破裂创面。手术结束时如再仔细检查脾脏,则诊断不难。
四、诊断
外伤性脾破裂的诊断一般不难确立。大量失血的单纯脾破裂病人,根据外伤史,有无失血性休克、腹痛、左上腹压痛及腹膜刺激征,能很快地作出诊断。
然而,失血性休克并非脾破裂所特有,肝脏、腹内空腔脏器、骨盆、后腹膜等损伤均可引起失血性休克,且常伴有腹痛、腹部压痛及反跳痛,故脾破裂常需与其他腹内脏器损伤、腹膜后损伤、骨盆骨折等相鉴别,诊断脾破裂时也常需考虑有无合并其他脏器损伤。
若脾破裂创口小,出血量小,或包膜下破裂出血已停止,病人常无休克表现,腹部症状、体征也较轻微,此时脾损伤的诊断往往较困难,可选用以下几种检查方法协助诊断。
(一)诊断性腹腔穿刺
这是临床最常用的简便、安全、阳性率高的方法。用9号空针于左兰氏点处穿刺,方向朝左髂窝,抽出不凝固血液即为阳性。但未抽出不凝血液并不能判断为无腹内出血,因为腹内积血少于200m L,腹穿阳性率低于20%,积血500m L时,阳性率也只有80%左右。让病人向穿刺点侧卧,选择不同部位反复穿刺可提高阳性率。并应注意缓慢匀速进针,以避免穿刺针刺入肠道。
(二)诊断性腹腔灌洗(DPL)
腹穿阴性而又高度怀疑有腹内脏器损伤的病人,可行DPL,其论断符合率为97.2%,并发症低于1%。(www.daowen.com)
病人平卧,排空膀胱,在脐下3~4cm处切开皮肤,将无菌导管针仔细刺入腹腔,抽出管芯,将腹腔透析管置入,或切开腹膜直视下将透析管送入盆腔,荷包缝合腹膜,固定导管。灌洗前若抽出不凝血液即为阳性,则无需灌洗。若阴性者在10min内按成人1L、儿童500m L,婴幼儿10m L/kg灌入无菌生理盐水。方法为将输液瓶倒挂并与透析管连通,使生理盐水流入腹腔,再将瓶放正,置于床面以下,使腹腔内液体借虹吸作用流回输液瓶内。瓶中液体可进行计数、镜检、培养等检查,如灌洗液体中RBC大于100索氏单位,可视为阳性。
(三)B超检查
B超分辨率较高,腹腔积血100m L即能确认。一般认为探查时发现脾前有液性暗区,脾实质出现不规则的裂隙暗带,脾脏呈现双道轮廓征,均有助于脾破裂的诊断。
(四)X线检查
必须在病人情况允许时方可进行。多采用立位透视,可见脾区阴影扩大,脾轮廓模糊,左侧膈肌抬高,活动受限等征象。仅适用于病情稳定、无休克的病人。
(五)其他检查
放射性核素扫描、CT扫描、血管造影、腹腔镜检查等均可提示脾脏损伤的征象,但均不作为常规检查手段,且仅适用于病情稳定的病人。
五、治疗
由于已认识到脾脏有许多重要的生理功能,尤其是免疫功能,现代脾脏外科对于脾损伤已确立了基本的处理原则,即在抢救生命第一的前提下,尽可能保留脾脏及其功能。但保留脾脏仅适用于生理脾脏,至于病理脾脏则不主张保留。下文中介绍的各种保脾方法仅限于生理脾脏。
(一)非外科治疗
1.适应证 ①仅限于脾包膜和实质的表浅伤和小的脾包膜下血肿。②病人年龄大于50岁。③诊断明确的闭合性单纯脾外伤,确证无腹内其他脏器损伤。④病情轻且稳定,或临床症状逐渐好转。⑤血液动力学指标稳定,输血不多于2~4单元,且无凝血机制障碍。⑥B超和CT监测血肿不扩大或积血不增加。⑦具备随时中转手术治疗的条件。⑧具备重症监护病房(ICU)。
2.方法 在满足上述所有条件的前提下,方可慎重试行非手术治疗。
(1)监护与治疗:病人置于监护病房中,绝对卧床休息,禁食24h以上,持续胃肠减压、输液,以维持水电解质平衡及给予营养支持、输血(量不超过40m L/kg)。治疗期间应持续监测血压、脉搏、心电图、血氧饱合度、中心静脉压和尿量,并使之维持在正常水平。定期反复进行临床体验、腹腔诊断性穿刺或灌洗、血红蛋白和红细胞压积测定、体温测定、白细胞计数、检查凝血功能及血小板计数、血清电解质及尿素氮和肌酐测定、B超或CT扫描等,必要时做血管造影检查。并注意使用抗生素和止血药。直到症状和体征消失,红细胞压积稳定在32%以上且持续72h以上。一般需监护2~7d,平均5d左右。然后住院观察及卧床休息2~3周,无异常发现方可出院。出院后禁止剧烈活动和体力劳动3周。
(2)中转手术:在非手术治疗期间出现下列情况之一者,必须手术。①腹痛和压痛加重,甚至有腹肌强直等腹膜刺激征者。②48h内输血超过4个单元或24h内超过每千克体重40m L,血液动力学指标仍不能稳定者。③监测中红细胞压积稳定24h后又下降6%以上,或又降至25%者,输血2单元不能迅速纠正。④监护期间发现合并有其他腹内脏器较严重损伤者。
鉴于非手术治疗脾外伤有一定风险,只能在有条件的医院谨慎施行。
(二)手术治疗
脾损伤的诊断一经确立,宜行手术治疗,尤其是伴有失血性休克和合并腹内其他脏器损伤者,更应急诊剖腹探查。对于原因不明的腹内出血,如伴有失血性休克,且积极治疗短期内不能纠正或进行性加重,亦应在抗休克治疗的同时急诊手术探查。
脾损伤手术的目的是及时止血,抢救生命。进腹后初步吸出腹内积血,应迅速探查脾脏,明确诊断后立即控制出血,并排除腹内其他脏器合并伤。控制出血时,宜用手、脾蒂钳或止血带暂时阻断脾脏的血运,切勿盲目钳夹,以避免误伤胰尾、胃、结肠和保留脾脏所需的血管。处理伤脾时,应在确保病人生命安全的前提下,根据脾损伤的部位、程度、范围,选择手术方法。在病人情况和脾损伤情况允许的前提下,宜尽量选用原位保脾的手术方法。无法保留时,可选用全脾切除加1/3自体脾组织大网膜内移植。病理脾脏则应切除全脾。
1.化学粘合止血
(1)适应证:①轻度表浅裂伤。②范围较小的撕脱伤。③未伤及大血管的单纯裂伤。
(2)材料:①纤维蛋白组织粘合剂。②快速医用ZT胶。③PW喷雾胶。
(3)方法:将脾脏游离,显露创面或裂口,用棉垫或纱布垫拭清血液后,表浅损伤可将粘合剂喷在创面上,较深的裂口则可将粘合剂注入裂隙中,立即用手轻轻加压,使部分粘合剂溢出裂口边缘,可有封住作用。其中,快速医用ZT胶常用于表浅创面,而纤维蛋白粘合剂则用于较深的裂伤,两者合用可加强效果。涂敷粘合剂后应紧压5min以上,随后徐徐放松,有出血可重复原法,无出血亦应再观察10min以上,确信已达到止血效果方可关腹,并应于脾窝处放置引流管,以观察有无术后出血。
2.物理凝固止血
(1)适应证:①浅表的裂伤。②脾包膜撕脱伤。③较深但未伤及大血管的裂伤。
(2)材料:①激光手术器。②微波组织凝固器。③红外线光凝器等。
(3)方法:游离脾脏,显露伤口,控制出血后拭去创面血流,血凝块及游离的脾组织,用激光、微波或红外线手术器使创面组织凝固变性或碳化而止血。其中,激光、红外线仅适用于较浅表的创面,微波手术器则可用于较深的裂伤。微波手术器使用的方法是将电极针插入距裂口边缘1cm的脾实质中,深部略超过裂口底部,通电凝固30~45s,依同法沿裂口边缘每隔1~1.5cm插入电极针凝固,直到裂口边缘一周的脾组织凝固成带,即可达到止血效果。
3.脾破裂缝合修补术
(1)适应证:①小而浅的脾实质裂伤。②较深的II、III级脾损伤,但未伤及大血管且裂口较整齐者。
(2)手术要点:①进腹后探查确诊为脾损伤后,术者迅速用左手控制脾蒂(图22-1),制止继续出血,吸净腹内积血,清除血凝块。②充分游离脾脏,术者右手将脾脏向前内下方托起,助手则将数块棉垫或纱布垫置入脾窝,显露脾损伤裂口,进一步明确可予以修补。③直视下清除游离失活的脾组织,用粗丝线和细而长的大圆针间断缝合脾裂口,缝线一起打结,打结前可塞入明胶海绵或大网膜(图22-2)。对于较深大的裂口,可先行水平褥式缝合,再行结节缝合,并用明胶海绵加垫,以防缝线切割脾组织。④将脾脏还纳入脾窝,取出海绵垫,清洗腹腔,观察创口无出血10min以上,方可关腹。脾窝应留置1~2根引流管。
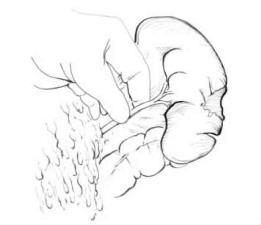
图22-1 控制出血
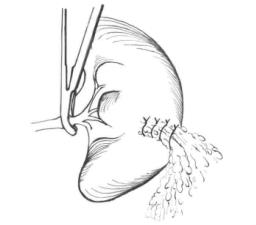
图22-2 以大网膜填塞后打结
(3)注意事项:①应全面探查,如发现合并空腔脏器破裂,则禁止行修补术,而需切除全脾。②判断脾脏裂口能否缝合,应将裂伤大小,深度与术者的技能和经验综合考虑,务求安全。③缝合修补失败时,应当机立断地根据具体情况改行脾部分切除或全脾切除加脾组织大网膜内移植术。④术后48~72h应严密观察血压、脉搏及引流物情况。
4.可吸收网罩捆缚止血术
(1)适应证:①脾包膜大面积撕脱伤。②脾包膜下血肿。③不宜缝合修补的较深大脾实质破裂。④脾修补后仍有持续少量出血者。
(2)方法:①游离脾脏,控制脾蒂,吸净腹内积血,清除血凝块。②用粗肠线剪成30cm长,共15~20根,一端一起打结,然后肠线互相编结成网(图22-3A)。③将编好的网从脾上极往下套住脾脏,均匀用力收紧另一端肠线,直到裂口紧密吻合,打结后即将脾脏捆缚套牢(图22-3B)。④确证已止血后还纳脾脏,观察10min以上无出血后,可放置引流管并关腹。
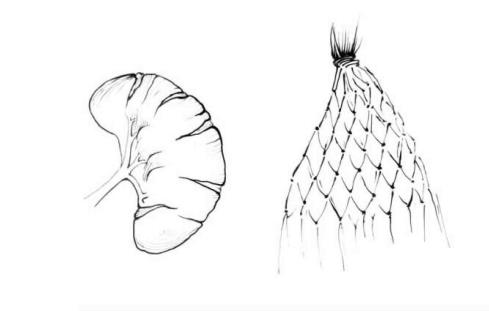
图22-3A 肠线编结成网
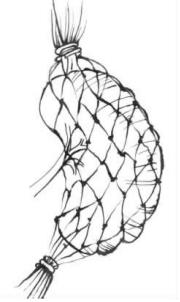
图22-3B 将脾脏捆牢
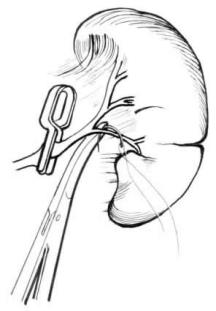
图22-4 结扎相应受损区的血管
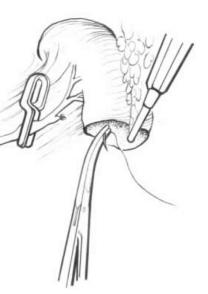
图22-5 脾脏断端止血
5.部分脾切除术
(1)适应证:①脾上部或下部无法缝合的深而大的裂口,切除损伤的上部或下部。②脾上部和下部均有难以修补的裂伤,可切除损伤部分,保留中部。③脾门处某一叶、段血管损伤,脾脏相应区域已出现明显的血运障碍,应切除相应部分脾脏。④局限于上部或下部的脾实质内血肿。
(2)手术要点:①游离脾脏,控制脾蒂并将脾脏托出,确定需施行小部分脾切除、半脾切除或大部分脾切除。②仔细解剖脾胃韧带和脾门,结扎相应区域的血管(图22-4),待血运障碍及良好的明确界限出现后,确定相对无血管平面。③自相对无血管平面,向血运良好的健侧退缩0.5cm,切开脾包膜,用微波刀、超声刀或刀柄切开脾实质,断端血管予以钳夹结扎(图22-5),直到切除部分脾脏。④脾脏断面以7号丝线U形交锁缝合(图22-6),并用游离带蒂大网膜覆盖。⑤清洗腹腔,还纳脾脏并观察10min以上无出血后,可放置引流管并关腹。
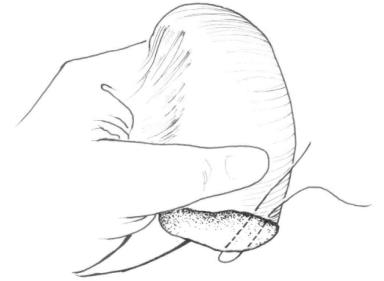
图22-6 断面U形交锁缝合
(3)注意事项:①合并空腔脏器穿孔者,应放弃部分脾切除术,改为单纯全脾切除术。②决定是否行部分脾切除术应综合考虑病人的一般情况、脾损伤程度和术者的能力,力求安全可靠。③脾断面经处理血管后,可能出血甚少,但仍应常规行U形交锁缝合,以利安全。缝线打结要松紧适度,以避免出血或割伤脾组织。④术后48~72h应严密监测血压、脉搏和引流情况。⑤60岁以上的病人不宜施行部分脾切除术。⑥保留的脾脏应为原脾1/3以上。
6.自体脾组织大网膜内移植术
(1)适应证:①脾损伤为闭合性,未合并空腔脏器破裂者。②严重的多处裂伤,无法修补或部分切除者。③脾蒂血管损伤合并脾上部损伤者。④脾蒂离断,病情不允许行异位全脾或部分脾脏移植者。
(2)手术要点:①吸出积血,迅速控制脾蒂,游离脾脏后予以切除,将切除的脾脏置入4℃的无菌平衡液中。②妥善结扎脾蒂血管,缝合脾窝处后腹膜,吸净腹内积血,清除血凝块,彻底清洗腹腔和盆腔。③清洗腹腔的同时,1~2名手术人员将脾被膜剥除(图22-7),取原脾1/3的脾脏切成脾组织片或碎块,切片和切块前宜放去脾内积血并清洗,脾片以3cm×2cm×0.4cm为宜,脾块以1cm ×1cm×0.5cm为宜(图22-8),切好后浸入4℃平衡液中。④将大网膜展平,提起大网膜前叶,剪一小孔后,将脾片或脾块均匀置入大网膜内,缝闭小孔,以圆针细线固定各1针(图22-9),还纳放平大网膜即可关腹。是否放置引流可视脾窝渗血有无而定。
(3)注意事项:①脾组织移植量应为原脾的1/3左右,过少脾功能难以保持,过多则易导致移植物成团,腹腔粘连等。②脾片或脾块不宜过大、过厚,以免移植物中心缺血坏死及继发感染。③移植部位以大网膜两层间为首选,因其范围大,血运丰富,易于使移植物成活。其他部位如皮下、肌间等,虽有报道,但不宜施行。
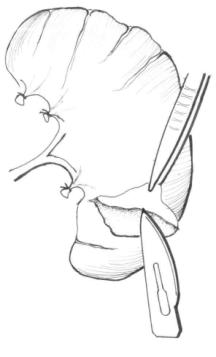
图22-7 剥除脾脏被膜
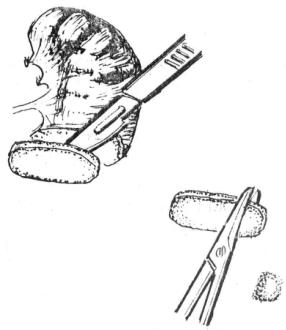
图22-8 将脾脏切成块或片状
7.单纯全脾切除术
(1)适应证:①开放性脾损伤者。②合并有腹内脏器穿孔的脾损伤者。③病理脾自发破裂或外伤者。④年老体弱或一般情况差,不允许施行保脾手术者。
(2)手术要点:①进腹后尽可能吸净积血,同时迅速探查是否为脾损伤,确认后立即控制脾蒂。②游离脾脏,将其向前内下方托出腹腔,脾窝以数块海绵垫充填,确定需切除全脾后分离韧带,结扎离断脾蒂及胃短血管。③切除脾脏,脾窝止血后,用丝线间断缝合后腹膜。④彻底清洗腹腔,于脾窝处置1根引流管后关腹。
图22-9 将脾块或脾片均匀置入大网膜内
(3)注意事项:①处理脾蒂时切勿大块盲目钳夹,以避免损伤胰尾。②脾动脉与静脉宜分别多重结扎,必要时再加以缝扎。③处理胃短血管宜靠近脾脏一侧,以避免损伤胃壁,术后发生胃瘘。
总之,脾损伤的治疗应以抢救病人生命为首要任务,在此基础上尽可能保留脾脏及其功能。所有保留脾脏的术式仅适用于闭合性单纯脾损伤的病人,合并腹内空腔脏器破裂或损伤的为病理脾脏时,则应切除全脾。保留脾脏的具体术式的选择,应根据病人的耐受力,脾损伤的程度、部位、范围,医院的设备条件,术者的经验和技能综合考虑。切勿因一味强调保留脾脏或强求施行某一种术式而危及病人生命,这是临床工作者在处理脾损伤时应遵循的原则。
第三节 与脾脏有关的其他疾病
脾脏与某些疾病密切相关,如门脉高压症、胃癌、某些血液病等,治疗这些疾病时如何处理脾脏常常是临床工作中有争议的难点。近10年来,国内外就此进行了较全面的研究,本文仅介绍其中的基本事实和较成熟的观点。
一、肝硬化门脉高压症巨脾是否应保留
由于认识到脾脏有重要的生理功能,尤其是免疫功能,国内有不少单位认为肝硬化门脉高压所导致的巨脾仅是充血肿大,不属病理脾。故分别开展了大部分切除加断流、分流术,并认为切除脾大部术式的保脾手术可达降低门脉压力,又能保留脾脏免疫功能的双重目的。但是,近来更深入的研究表明:①脾脏本身能促进肝脏纤维化,参与并加速硬化过程,起不利作用。②门脉高压巨脾属病理脾,用形态测量学方法对巨脾纤维化程度进行了病理组织学分级,发现Ⅱ、Ⅲ级巨脾的免疫学功能已明显下降而无保留价值,可以保留的Ⅰ级脾仅占28%。③肝硬化病人保脾手术后的免疫学指标测定证明其功能下降。④门脉高压手术时保留脾脏增加了手术的难度,且会增加再出血的机会。⑤门脉高压症脾功能亢进。基于以上结果,多数学者认为门脉高压巨脾不宜保留。
二、胃癌根治术时是否联合切除脾脏
鉴于脾脏具有重要的免疫功能,而癌症病人免疫功能的强弱又对其预后有重要影响,国内外对胃癌根治术是否附加切脾有较大的争议。围绕这一问题,近年来国内外学者开展了深入和全面的研究,研究的焦点包括:①胃癌病人脾门淋巴结转移率如何。②胃癌病人的脾脏在肿瘤免疫中发挥何种作用,切除或保留脾脏对胃癌病人的整体免疫机能影响如何。③切除或保留脾脏对提高胃癌病人生存期是否有利等方面。综述研究结果:①胃癌位于远端、中部或近端总的脾门淋巴结转移率分别是0~3.5%、6.6%~25%、24%~76%。其中Ⅰ、Ⅱ期分别为0、0.1%、0~3.1%。Ⅲ、Ⅳ期分别为1% ~6.2%、6.4%~31%、24%~95%。②Ⅰ、Ⅱ期胃癌病人脾脏中自然杀伤细胞(NK)、巨噬细胞(Mφ)活性高于外周血,辅助性T细胞(Th)比例亦高于外周血,切脾后病人外周血NK活性、(Mφ)活性下降,Th细胞减少,抑制性T细胞(Ts)增多,即整体免疫功能削弱。Ⅲ、Ⅳ期胃癌病人脾脏中NK细胞活性、Mφ活性,Th比例均明显低下,甚至低于病人外周血,而Ts比例则明显高于外周血,还大量产生并向血液释放免疫抑制因子,此时联合切脾,病人术后整体免疫功能不受影响或有轻度增强。Ⅰ、Ⅱ期病人手术时保留脾较切脾者5年生存率有明显改善。而Ⅲ、Ⅳ期病人手术时保脾较切脾者术后1、2年生存率为低。
综上所述,目前对于早期胃癌,在胃癌根治术时趋向于保留脾脏,而对于进展期胃癌,尤其是中、上部进展期胃癌则趋向于行根治术的同时联合切除脾脏,以保证根治的彻底性。
三、脾切除对某些血液病的治疗作用
血液病常与脾脏有密切的关系,脾切除术已逐渐成为某些血液病的主要治疗方法。目前公认有较好疗效的血液病主要是遗传性球形红细胞增多症(HS)、血红蛋白H病(Hb H)和原发性血小板减少性紫癜(ITP)等,但脾切除有严格的适应证。
(一)遗传性球形红细胞增多症(HS)
1.脾切除原理 HS主要是红细胞结构异常,呈球形,导致红细胞膜脆性增强,可变形性显著降低。当球形红细胞从脾索通过缝隙进入脾窦时,遭到扣押或破坏,而导致临床上的贫血、溶血性黄疸和脾肿大。因为脾脏是红细胞破坏的主要场所,故脾切除有效。
2.手术适应证 脾切除是HS的主要治疗方法,并有明显疗效,故凡是确诊HS,临床有贫血及脾大,Hb在100g/L以下者,都应施行脾切除术。
(二)血红蛋白H病(Hb H)
1.脾切除原理 Hb H以血管外溶血为主,51 Cr测定脾肝比值大于2,脾内定位指数增高,说明血管外溶血又以脾脏溶血为主。脾切除去除了破坏红细胞的主要场所,因此临床有一定疗效。
2.手术指征 目前内科对此病唯一的治疗方法是大量长期输血,可使含铁血黄素沉积,引起各种并发症,脾切除是治疗Hb H病的有效方法。适应证包括:①Hb大于80g/L。②年龄大于3岁。③51 Cr测定红细胞寿命缩短,脾内死亡指数增高,脾肝比值大于2。④输血量大而效果差。⑤巨脾伴脾功能亢进。
(三)原发性血小板减少性紫癜(ITP)
1.脾切除手术 ITP是一种自身免疫性疾病,已知这种抗血小板抗体(PAIgG)是一种75型免疫球蛋白,属IgG型,存在于血循环中,致使血小板破坏过多,引起紫癜。其特点为血小板减少伴有毛细血管脆性增加,引起全身出血。脾脏是产生抗血小板相关抗体的主要器官,又是破坏血小板的主要场所,故多数病人脾切除后血小板计数可迅速上升。
2.手术指征①慢性ITP超过6个月,内科治疗失败,或对皮质激素、免疫抑制剂有应用禁忌证者。②急性ITP应用大剂量强的松、丙种球蛋白等治疗无效,出血严重危及生命者,可行紧急脾切除。③51 Cr标记血小板检查血小板被滞留和破坏的场所,提示血小板主要被阻留在脾脏者。
虽然脾切除是治疗上述几种血液病的有效方法,但因血液病对病人手术耐受力、凝血机制影响甚大,故应十分重视术前准备工作,包括:①成分输血。如血红蛋白病可输入浓缩红细胞,溶血性贫血应输入洗涤红细胞,血小板减少性紫癜可输入浓缩血小板。②预防感染。一般于术前3d开始用抗生素。③皮质激素的应用。长期使用皮质激素的ITP和自身溶血性贫血病人,术前1d及手术日应加倍用量,肌注与静脉并用,术前再给予维持量,以防止肾上腺皮质功能衰竭和减少术中出血。手术后的治疗则以预防感染和预防出血为主。术后的治疗均应请血液病专科医生协助进行。
第四节 脾脏外科研究展望
脾脏功能尚未完全揭示,新技术与新的学科交叉还在不断进行,对脾脏外科的基础和临床研究也将不断深入。目前,有以下新的发展趋势:
1.腹腔镜脾脏切除术 国内外已有较多报道,涉及ITP、门静脉高压症、脾淋巴瘤及外伤脾等。初步结果显示其安全可行,与传统手术相比具有创伤小、病人恢复快等优点。
2.部分脾栓塞(PSE)治疗脾功能亢进 原来这种方法国外多用来做巨脾切除前的术前准备,现在国内有多家医院用来替代脾脏切除术。初步认为PSE可改善外周血象、降低门脉高压、缓解脾大、治疗消化道出血、改善肝功能、缓解腹水,与外科切脾比较,能保留脾脏的正常免疫功能和预防感染的能力,具有简便、安全、效果显著、创伤小、并发症少、费用低廉等优点,是治疗脾亢进的好方法,可以成为替代外科脾切除的首选的治疗方法。
3.非手术治疗儿童单纯性脾脏外伤 2003年有文献报道,儿童脾脏损伤后可采用保守疗法,其成功率可达90%。脾损伤后采用保脾手术是儿外科近年来最重要的进展之一。但直到1971年,人们还认为脾损伤后非手术治疗死亡率会高达90%~100%,常规脾切除是当时的标准治疗方案。到20世纪初,开始有一些保守治疗的零星报道,实验研究也提示脾切除后可能会带来严重的感染,但并未引起人们注意。Upadhyaya和Simpson进行了一项临床实验,共52名儿童采用保守治疗,结果表明单纯脾裂伤能够自行愈合。研究者称,该研究结果令人信服,并将成为脾脏损伤治疗选择的转折点。此后越来越多的研究表明了脾脏损伤后保守治疗的安全性,并取代了常规脾切除术。目前初步认为,儿童单纯脾脏损伤后采用保守治疗安全有效。
4.其他基础和应用研究 美国研究人员利用健康小鼠的脾脏基层组织中的细胞注入糖尿病小鼠体内,并因此再教育患病小鼠的免疫系统,使它们可以接受兰氏小岛细胞的植入。但是小鼠意外地可以开始产生它们自己的兰氏小岛细胞。如果小鼠被给予专一性脾脏细胞,他们可以从其他脾细胞区别他们所缺少的CD45特殊分子。科学家相信,这将可以使兰氏小岛基层组织再生。这个新的突破还处于非常早期研究阶段,仍然需要许多研究工作,然后才能应用于人类身上,但这已经给糖尿病患者带来了希望的曙光。
(黄 韬 仇登波)
参 考 文 献
1 Bohnsach.Jf The role of the spleen in resistance to infection..Ann Rew Med,1986,37:49
2 Chu DZ,Nishioka K.Tuftsin increases survival in murine peritoneal carcinomatosis.J Biol Responses Mde,1990,9:264
3 Korkusuz P,Dagdeviren A,Asan E.Immunophenotypic analysis of human spleen compartments.Ann Anat 2002 Sep;184(5):431~41
4 Grayson MH,Chaplin DD.Localization of T and B lymphocytes to the white pulp of the spleen is independent of L-,E-,and P-selectin.Scientific World Journal 2003 Jun 9;3:484~96
5 Andrej AR,Scott RP.The spleen:another mystery about its function.Am J Physiol Regul Integr Comp Physiol 2003 Jun;284(6):R1378~9
6 Upadhyaya P.Conservative management of splenic trauma:history and current trends.Pediatr Surg Int.2003 Nov;19(9-10):617~27
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。





