第二十一章 胰腺外科
第一节 解剖、生理和病理
一、解剖
胰腺(pancreas)横位于胃后方的腹膜后,横结肠系膜根部的深面,约平第1、2腰椎体,是人体内仅次于肝脏的大腺体,平均长12~14cm,厚2~3cm,重60~125g。可分头、颈、体、尾四部。头部是胰腺最粗大的部分,嵌入十二指肠孤内,其上下缘的一小部分向后、向上突出,包绕着肠系膜上动静脉,成为胰腺的钩突。绕到肠系膜上动静脉的后方,这样肠系膜上动脉、静脉似乎是部分地穿过胰头部。胰头前面的大部分与横结肠的起始部及横结肠系膜相邻,胰头后面邻右肾上半的内缘:右肾血管、下腔静脉、左肾静脉的终末段,以及右侧膈脚。胰头上部为网膜囊后壁的腹膜覆盖。下部由横结肠系膜下面向下延伸的腹膜覆盖,并与小肠接触。肝动脉沿胰腺上缘向右行进。患胰头癌时,可因压迫下腔静脉或门静脉而产生下肢水肿或腹水。若压迫胆总管可产生进行性黄疸。胰颈部和胰头附近有胰背动脉,其外径平均2.2mm,有左右分支,胰背动脉的左支即胰下动脉,在行胰头十二指肠切除时应只切其右支,保留左支,而在切除胰体、胰尾部时,则应保留其右支,切断左支。所有胰的静脉系统变异较大,但均通过脾静脉、肠系膜上静脉等处最终汇入门静脉系统(图21-1)。
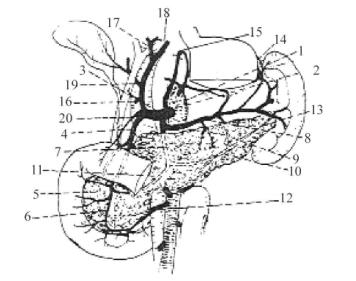
图21-1 胰腺附近血管
1.腹主A 2.腹腔 3.肝总 4.胃十二指肠A 5.胰十二指肠后上A 6.胰十二指肠前上A 7.胰背A 8.脾A 9.胰大A 10.胰下A 11.结肠中A(断面) 12.胰十指肠下A(胰十二指肠后下A胰十指肠前下A) 13.胰尾A 14.胃短A 15.胃左A 16.肝固有A 17.肝右A 18.肝左A 19.胆囊A 20.十二指肠上A
胰管由毛细胰管汇成主胰管的一级属支,再汇成主胰管,大约位于胰上下缘的中部,约1/3主胰管位置偏后,在行胰头十二指肠切除术如遇有主胰管偏后,行胰、肠间缝合时易贯穿部分主胰管或结扎了主胰管,以致造成胰瘘。故当发现主胰管偏后时,最好再向左侧切除1~2cm胰组织,此时主胰管可偏前,可减少胰瘘的发生。主胰管在胰头部分与副胰管相通。副胰管主要引流胰头上部胰液,开口于十二指肠副乳头。80%以上主胰管与胆总管汇合形成共同通道(图21-2)共同开口位于十二指肠第二段内侧的乳头,两者间有一隔膜,也有分别开口等不同类型。
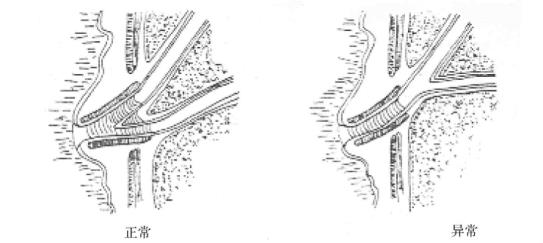
图21-2 共同通道
二、生理与病理
胰腺具有内、外两大分泌功能。外分泌部由小叶中之胰腺腺泡及其导管组成,分布于小叶间隔中及腺泡间的胰岛细胞团则为胰腺的内分泌部。胰腺腺泡由浆液细胞组成,总数约占胰腺分泌细胞的80%。胰岛总的分泌面积约11cm2,为大小不等、形状不定的细胞群,成人有20万~180万个胰岛,不均匀散在分布,但以胰尾部最多,其间有丰富的窦状毛细血管。胰岛细胞现已分离出7种以上,α细胞占20%~30%,分泌胰高血糖素。β细胞占40%~60%,分泌胰岛素。δ细胞占5%~15%,分泌生长抑素,δ1细胞占0~5%,分泌血管活性肠肽。Ec细胞占0~5%,分泌5-羟色胺(5-HT)。F细胞占5%~10%,分泌胰多肽。G细胞数量极少,分泌胃泌素。其排列特点为:α细胞位于胰岛的周围,β细胞位于胰岛的中心,δ细胞位于α、β细胞之间。胰腺导管由若干小叶导管组成。主副胰管、主胰管腔在0.5cm以下,愈近尾部,管腔愈小,主胰管的粗细和形态可随年龄而改变,年轻时主胰管粗细均匀,光滑平整,属支密集。到老年期,主胰管扭曲,粗细不均,可呈结节状或串珠状及小囊状扩张,长期饮酒、胰腺结石或慢性胰腺炎病人,胰管可呈老年性改变。副胰管较主胰管短而细,主要引流胰头上部的胰液,当主胰管发生梗阻时,则全部胰液可转经副胰管进入十二指肠。
1.胰腺与胆总管的关系 在胰腺段的胆总管后面之胰腺组织覆盖者占38.7%,胆总管后有胰舌覆盖者占60.6%,胆总管后面全被胰腺组织包绕无空隙者占0.7%,了解这些解剖关系,有助于解释临床胰腺疾病引起黄疸的机理。
2.胰腺的外分泌 胰腺是一种无色无臭的透明碱性液体,略带黏性,pH为8.2~8.5,比重为1.007~1.042,其渗透压约等于血浆,正常成人每日分泌量为200~1 500 m L。胰液主要成分为水(占94%~98%)、电解质和酶原蛋白。胰液中含有消化三大食物的酶类,如胰酶缺乏可致蛋白、脂肪类食物消化不全,并因脂肪不易消化吸收而影响脂溶性维生素A、维生素D、维生素E、维生素K的吸收。胰液缺乏对糖类消化的影响较小。其性质分:①糖类消化酶,其中胰淀粉酶在正常情况下可少量进入血液内为血淀粉酶。在胰腺炎及胰管阻塞的病人,可有大量胰淀粉酶进入血液,同时由尿中排出增加,故血尿淀粉酶值均增加,若肾功能不全病人应测定淀粉酶清除率与肌酐清除率比值(Cam/Ccr),正常值应小于5%。②脂肪类消化酶,其中脂肪酶是一种甘油—脂水解酶,最适pH为7.0~9.0,在胆盐的协同下,可增强其活性,使脂肪分解为甘油和脂肪酸,胰脂肪酶进入血液的称血脂肪酶。③蛋白消化酶类,胰腺分泌消化蛋白的酶较多,分泌出的胰蛋白酶,是以蛋白酶原的形式存在的,只有激活后才具有消化活性。激活方式有两种,一是自身激活,即已形成的少量胰蛋白酶可作用于胰蛋白酶原使之生成胰蛋白酶,一是被肠激酶激活。十二指肠黏膜分泌的肠激酶可激活胰蛋白酶原为胰蛋白酶,这种激活具有特异性,活化的胰蛋白酶又可激活其他的蛋白酶原。先天性肠激酶缺乏的病人可引起严重的蛋白质消化不良。临床上胰尾部胰外瘘并不引起瘘口周围皮肤的消化糜烂,而十二指肠瘘和胰头部瘘却引起严重的瘘口周围皮肤的糜烂就是激活了胰蛋白酶的原因。
3.胰胆分泌压 正常情况下胰管内压总是高于胆总管内压,但在进食期和非进食期其压力有所不同。在非进食期,胆囊处于舒张状态,胆总管和Oddi括约肌处于收缩状态,此时其压力为100~200mm H 2 O,而肝细胞和胆管上皮细胞可持续进行分泌,胆总管的压力可升高达50~70mm H 2 O,而胰管内压力在71mm H 2 O以上,此时胆液只有缓缓进入胆囊,经胆囊浓缩又减低胆道的压力,因而胆囊有缓冲胆道压力的作用。在进食时,充盈的胆囊有节律地收缩4~6次/min,有时可出现紧张性收缩可持续5~20min,使胆总管压力增加,可高达250~300mm H 2 O,此时胰腺在神经及体液的调节下,分泌胰液旺盛,使其胰总管内压升高可达300mm H 2 O以上,继而引起Oddi括约肌、胆总管括约肌、胰总管括约肌舒张,使胆液和胰液排到十二指肠腔内,帮助消化三大食物。
4.胰腺外分泌的生理调节 在非消化期,胰腺是很少分泌或不分泌的。进食后胰液分泌开始,故食物是刺激胰液分泌的自然因素。进食时胰腺分泌受神经和体液双重控制,但以体液调节为主,其调节过程分类:①神经相。可通过神经的条件反射击和非条件反射引起胰液的分泌。②胃相。食物进入胃,促使胃泌素分泌增加,进而促使胰酶和胰液分泌增加。③肠相。胃的酸性食物进入十二指肠后,刺激十二指肠黏膜分泌促胰液素(secretin)和促胰酶素(CCK-PZ),增加胰液的分泌。此外,胰腺的外分泌还可直接或间接受其他一些激素的影响,如舒血管肽(VIP)可使胰液分泌增加,而肠抑胃肽(GIP)、胰高糖素(glucagon)及胰多肽(PP)则显示为抑制作用。
5.胰腺的内分泌
(1)胰岛素(insulin):是在胰岛β细胞的内质网核蛋白体上合成的,先生成单链多肽,称为胰岛素原,然后不断分解为胰岛素,经胰静脉和淋巴进入血液,使血糖维持在正常水平。
(2)胰高血糖素(glucagon):是胰岛δ细胞分泌的。在血液循环中以游离状态存在,不与载体蛋白结合,极易被分解而失去活性。正常人血浆中胰高血糖素的浓度为50~100μg/m L,成人每日分泌量约1mg胰高血糖素。
(3)生长抑素(somatostatin):是胰岛δ细胞分泌,其作用除能抑制生长激素的分泌外,还能抑制许多其他激素的分泌,因而被称为多种激素的抑制物。近年来有人应用生长抑素治疗胰外瘘,有促进瘘口愈合作用,而无并发症。
(4)舒血管肠肽(kallikrein):是由肠黏膜在胰岛δ1细胞分泌的一种活性物质,为强有力的肽类激素,在血浆中含量也很低,主要在肝脏灭活。舒血管肠肽瘤是分泌舒血管肠肽的胰岛细胞瘤。临床表现为严重腹泻,低血钾,无或低胃酸等。
(5)胃泌素(gastrin):来源于胰腺α1细胞的称ZES-Ⅱ型,来源于胃窦部G细胞增生的称ZES-Ⅰ型,因产生大量胃泌素可致溃疡病发生,并可导致腹泻及各种营养物质吸收不良。
第二节 胰腺先天性疾病
一、异位胰腺(heterotopic pancreas)
异位胰腺亦称迷走胰腺(aberrant pancreas)或副胰腺(accessory pancreas)。
在正常胰腺解剖部位以外的胰腺组织称为异位胰腺,是一种先天性疾病,常见于十二指肠、胃、空回肠等肌层或黏膜下层。也有存在于胆总管、胆囊和脐部者。少见的还存在于肝、脾、肠系膜、大网膜、横膈、肺、肾上腺、腹膜后及胰腺周围脂肪组织内。胆总管囊肿或脐囊肿内的异位胰腺,国内也有报道。胃肠道先天性憩室内有20%左右可发现异位胰腺,如Meckel憩室,有人认为肠壁肌层有异位胰腺组织存在可使肠壁薄弱。异位胰腺组织无包膜,只能整块切除,不能剥离。
从组织学上可分3型:①典型胰腺组织。②以胰腺为主,有少量导管,有腺泡、导管和胰岛,也可无胰岛。③以导管为主,有少量腺泡,无胰腺组织。
由于现代对本病认识的提高,并可借助于钡剂上消化道X线照片检查、纤维内镜以及MRI的检查已大大提高了对本病的诊断率。
异位胰腺大多为黄色或淡黄色,呈单个分叶较胃肠壁硬的结节,无移动性,有1~5cm大小,外观形态、组织结构与正常胰腺组织相似,有时可全部由胰岛细胞组成。具有导管开口于胃肠道,不能自肠壁上剥离。临床上多无症状,故不易诊断,常在腹部手术或尸检中发现。但胰腺的任何疾病,在异位胰腺上均可出现,位于幽门或肠道可引起梗阻或套叠。若引起导管阻塞,可发生急、慢性胰腺炎。若引起出血,可出现消化道出血。胰腺出血位于胃、十二指肠,可引起胃、十二指肠炎或溃疡。若为胰岛细胞组成者,可引起血糖过低的症状。当疑有胰岛细胞瘤时,而正常胰腺组织不能找到,应想到有异位胰腺存在的可能。如有症状,则需手术切除,常规作病理切片检查,可明确诊断。
二、环状胰腺(annular pancreas)
在胚胎发育第6周时,十二指肠背侧和腹侧的两个胰腺始基随着十二指肠向左、向后旋转,融合而成胰腺。如果腹侧始基的顶端未能随肠管一起旋转而继续留在原处,则形成环状胰腺。因其是先天性发育畸形,其组织结构与胰腺组织相同,无病理现象。文献报道本病多为成年男性,症状出现愈早者,肠梗阻症状愈严重。
1.临床症状 与十二指肠受压的程度相关,十二指肠受压的程度取决于环状胰腺环绕是否完全及胰腺质地情况。完全环绕,质地坚硬者,临床表现也将明显,主要是呕吐。新生儿可出现高位梗阻。大量呕吐时,可导致严重脱水和体重减轻,水电解质失衡,出现碱中毒。部分病人受压部位在Vater壶腹或胆总管下端,可出现黄疸。如部分环绕,或质地软,也可不发生梗阻,临床上可完全没有症状,儿童病人表现为十二指肠的慢性梗阻症状,如恶心、呕吐,食欲不佳,上腹痛及气胀、嗳气等。成年病人症状多较轻,而病程长,临床易误诊为十二指肠慢性梗阻,或因呕吐,使之误诊为溃疡病。
X线检查可发现胃和十二指肠第一部有大量积气积液,病程长者可出现胃扩张,甚至胃溃疡,故临床上易与肠系膜上动脉压迫症、十二指肠溃疡、先天性肥厚性幽门梗阻、肠道闭锁、肠扭转等误诊。幽门狭窄,患儿呕吐物中无胆汁,肠道闭锁患者呕吐物为肠内容物,肠扭转多表现为急性完全性高位梗阻,发病突然,发生较晚。
2.治疗 环状胰腺无症状者无需治疗,有症状者多需手术治疗,以解除其压迫症状。手术方法有两种,一是切除或分离环状胰腺,二是将梗阻近远侧的胃肠道捷径吻合,吻合口应在十二指肠膨胀部的最低位,行侧侧吻合。切除或分离环状胰腺的方法一般不宜采用,因此处胰腺组织薄、血管多,且侵入十二指肠壁,分离难,易造成胰瘘或十二指肠破裂等并发症。如有胆道梗阻者可加行空肠胆总管“Y”型吻合术。
三、胰腺囊性纤维化(cystic fibrosis of the pancreas)
是一种先天性胰腺广泛囊性病变,为新生儿疾患,临床十分罕见。常以肺部疾病、胰腺外分泌功能不全,以及汗液的电解质增多为特征。引起本病的发病机制尚不清楚,现多认为属染色体隐性遗传性疾病,造成遗传缺陷的基因可能位于第7对染色体长臂的中间部分。病人为纯合子,其双亲为杂合子,虽然多数人认为本病是单个突变的等位基因所致,但在许多家庭,双亲的子女发病率远超过25%,因此有可能在同位点上有2或3个隐性等位基因受累,其主要病变表现为黏液分泌异常和电解质异常,在病人全身继发性病理改变中起主要作用。
临床症状:本病轻者无症状。重者可表现为严重的营养不良状态,可累及全身及多个器官,多数病人同时有呼吸道和胰腺受累表现,少数病人可局限于某个器官受累的症状,如肺受累,可出现支气管扩张、肺气肿或肺不张。此病90%为儿童,故当儿童有反复呼吸道感染时应考虑有本病的可能。若肝脏受累,出现肝硬化时则有门静脉高压和肝功能不全的体征,故儿童有不能解释的门静脉高压或肝功能受损时也应考虑此病。
由于胰外分泌功能不足,引起消化吸收不良,患儿表现为腹泻、食欲亢进和营养不良,大便量大、不成形、油状并有恶臭。出现低蛋白水肿及维生素K缺乏,故常有皮内出血现象,新生儿常见胎粪性梗阻,X线平片无气液平,但可见圆形气泡(肥皂泡征)。新生儿还可发生梗阻性黄疸,也有胆囊炎、胆石症的存在,少数病人可发生渗出性视网膜病变、视神经炎及胰性肥大性骨关节病。
本病多有家族史。胰腺的外分泌功能测定及胸腹部X线检查、汗液内氯和钠的浓度明显增高即可确诊。
近年来国外已有应用基因治疗的报告,其疗效尚待远期观察。目前本病仍以对症治疗为主,如对消化及营养不良的改善,对呼吸系统,重点在于抗炎和预防支气管阻塞,对胎粪性肠梗阻,可先行非手术治疗,若无效可改行手术治疗。
第三节 胰腺损伤
胰腺因固定于腹膜后,位置深,背靠脊柱,前面有腹肌、胃及横结肠保护,故损伤机会少,一旦损伤则表明外力强大,或直接遭受锐器穿透伤,也有脾、胃切除时误伤胰腺组织,造成严重后果。
1.胰腺损伤的因素
(1)钝性损伤:属非穿透性损伤,因外力撞击在上腹部,如驾驶汽车的方向盘直接撞击,自行车车把,拳击,跌倒时上腹撞击在木桩台角、椅把上以及类似的钝性损伤,以致将器官挤压于脊柱上而发生胰腺挫伤或裂伤。
(2)锐性损伤:属穿透性损伤,因利刀、枪弹,以及锐性器械直接伤及胰腺组织者,此类损伤常伴有肝脾、胃肠、大血管等损伤,故来势凶险,有时诊断未明,病人即已死。
(3)手术时的损伤:如胃或十二指肠溃疡疤痕的切除、十二指肠憩室切除、脾肾切除等均可伤及胰腺组织及胰管。
2.胰腺损伤的程度
(1)轻度损伤:仅引起胰腺组织水肿及少量出血,预后较好。能自行愈合。
(2)中度损伤:部分胰腺组织已挫烂,胰液外溢进行自家消化,引起大量出血,及更多的胰腺组织出血坏死,病情严重,可导致胰腺炎的发生。
(3)重度损伤:除胰腺组织挫烂外,胰管部分或完全断裂,胰液大量外溢,常引起腹膜炎,或流出体外形成胰瘘,病情严重,病人多出现水电解质紊乱及营养障碍。晚期还可以引起大出血、休克、死亡。
若病变好转或治愈,亦常遗有并发症,如胰腺脓肿、膈下脓肿、胰腺内瘘或外瘘、假性囊肿、脂肪痢、糖尿病、钙化结节等。
3.临床表现 由于胰腺组织深在,早诊断困难,如病情轻,仅上腹有压痛,病情重可出现休克。胰液积聚在网膜囊内,可出现上腹明显压痛,腹肌紧张,胰液刺激膈肌可出现膈肌痉挛、呃逆和肩部牵涉痛。胰液自小网膜囊内流入腹腔可引起弥漫性腹膜炎,如同时有邻近空腔脏器的穿孔,则腹膜炎的症状更加明显。
4.检查和诊断
(1)体格检查:一般表现为腹膜炎征象,胰液渗出或腹腔内出血,在体征上难以区别,有些病例上腹壁、皮下组织可见有不规则的淤斑出现,或者内出血而呈紫褐色,谓Cullen氏征。可作腹腔穿刺,将吸出液送常规检查和淀粉酶值的测定以助诊断。
(2)实验室和特殊检查:因胰腺损伤引起腹膜炎,白细胞计数增高,中性粒细胞计数增高,若同时合并大出血,则红细胞计数、血红蛋白明显下降,红细胞压积减少。血清淀粉酶或尿淀粉酶均将升高。B超、CT、MRI均出现异常,X线照片可以排除脊柱损伤及空腔脏器的破裂。
(3)手术探查:一旦诊断为胰腺损伤,应进行手术探查。术中应仔细检查胰头部的深面,胰体、尾部有无裂伤,包膜是否完整,胰腺上下腹膜后有无血肿,网膜囊有无出血。决不能满足于已发现邻近脏器的损伤,而忽视对胰腺深部的探查。如发现有大出血,则应考虑同时合并损伤附近的大血管如门静脉、肠系膜上动静脉、脾动静脉等,而胰腺实质的出血,有时也难以自止。
5.预防和治疗 手术所导致的胰腺损伤是可以避免的。轻度的胰腺损伤,无胰管断裂,无胰液外漏,可经非手术治疗治愈,后期也有并发假性胰腺囊肿,或慢性胰腺炎的可能。中度或重度的损伤必须手术治疗。发现胰腺组织较小的裂伤,可用细丝线缝补,严重者可切除远端,近端则用丝线缝合。小的胰管可予以单纯结扎,较大的胰管有损伤时应将远端切除,切缘胰管管口直接吻合到十二指肠壁的侧壁上,采用黏膜对黏膜的吻合,胰管中插入小段的硅胶管作为依托支持吻合口,或取远端空肠套入胰管显露部分做Roux-en-y吻合,胰管中仍以插入小段硅胶管为佳。
如胰腺(胰管)损伤未能及时发现,已出现腹膜炎或胰腺坏死,膈下脓肿,或胰液外瘘等情况,首先是通过手术野的引流,使创口不至被胰液消化而崩裂。病人绝对禁食,可进行“三造口”术,使引流出的胆汁、胰液可以从空肠造口处还纳,减少体液的丢失及水电解质的负平衡。还可以从空肠造口滴入营养液及要素饮食。现多主张行完全胃肠外营养(TPN)。使用抗生素控制感染,尽量使内瘘引为外瘘,既避免自家消化又可还纳,而且外瘘常可自行愈合,即使经久不愈,也可将瘘管解剖出来,在近胰腺部位与十二指肠或空肠壁作吻合。在有脓肿存在时,修补、缝合均属禁忌。
在手术探查中,不论采用何种径路暴露胰腺后,均应先吸尽血液,控制出血,再按损伤部位、程度、伤情的轻重,采用不同的手术方法。如病情危急,也可在损伤胰腺附近简单地放置2~3根双腔负压引流管以利引流。这样可防止胰液、血液的积聚和死腔残留。并在引流管周围缝闭腹壁,不论损伤程度轻重,均需置管网膜囊内引流。因胰腺损伤,胰液溢出是常见的,不引流必然引起局部感染、腹膜炎和脓肿形成。由于胰腺损伤,胰液有可能消化腹壁组织,故缝合线应用尼龙丝或细不锈钢丝间断缝合,如无此线时,可用粗丝线替代,仍以间断缝合为宜,引流管另从腹壁戳孔穿出体外。
第四节 胰腺炎症
一、急性胰腺炎(acute pancreatitis,AP)
急性胰腺炎是常见外科急腹症之一,其发病率仅次于急性阑尾炎、胆囊炎、溃疡病穿孔。近年来有上升的趋势,与医疗设备的不断完善和临床医生对该病的认识与诊断能力的提高有关。
急性胰腺炎多发于20~50岁之间,女性略高于男性。其发病尚不完全清楚。当发生急性胰腺炎时,胰管中的胰蛋白分解酶原群被活化,并从胰管壁逸出,对含有蛋白质及脂肪的胰腺组织血管壁发生消化作用,并由此扩展到邻近组织,如胰前的腹膜、结肠系膜等,引起不同程度的水肿、出血及坏死等病变,所以急性胰腺炎的病变原因是胰腺酶原致活后所造成的自身消化。
(一)病因
引起胰腺酶原活化有以下几个主要原因:
1.胆道疾患 由于80%以上主胰管与胆总管汇合成共同通路的原因,以胆道疾患为诱因者占50%,为急性胰腺炎病因的首位,胆石阻塞胆道下端造成胆汁逆流,特别是合并胆道感染时,Oddi括约肌处发生水肿和反应性痉挛,造成胆汁的排泄不畅,感染的胆汁逆流到胰管,促进胰酶活化。故壶腹部结石嵌顿是发生急性胰腺炎的常见原因。Anderson等认为通过淋巴直接感染胰腺腺泡周围间隙,也是造成急性胰腺炎的因素之一。此外,胆总管被蛔虫或中华分枝睾吸虫等阻塞,或蛔虫直接进入胰管,或虫卵沉积于胰腺组织内,使胰管组织增生形成肉芽肿,胰液排出不畅,还有十二指肠憩室位于乳头附近,常引起胆汁、胰液排出不畅,使十二指肠液逆流至胰管,激活胰酶,导致胰腺的自体消化。有报告十二指肠憩室导致急性胰腺炎者占23%。
2.酒精 因大量饮酒引起急性胰腺炎的报道在欧美已占50%以上,日本的报道也超过50%。武汉大学中南医院外科在1990-2026年收治107例重症急性胰腺炎病人中有25人是在酒宴后发生的,占23.36%。
暴饮暴食是急性胰腺炎的主要诱发因素之一。酒精诱发急性胰腺炎的机理十分复杂。有资料表明:①酒精可刺激大量高度碱性液的产生,使腺体碱化,酶原膜变为不稳定。②酒精可刺激胃黏膜胃泌素的分泌增加,使胃酸增加,从而直接或间接地作用于十二指肠黏膜,增加促胰液素(secretin)和促胰酶素(CCK-PZ)的释放,刺激胰腺外分泌部分,促进胰酶分泌增加。③酒精局部刺激十二指肠乳头,引起Oddi括约肌痉挛,Vater壶腹区充血水肿,因此胰液排泄不畅。长期饮酒者可造成胰腺外分泌改变,在胰管内产生蛋白沉淀物,并可阻塞胰管,引起胰腺炎症。武汉大学中南医院外科的实验研究直接用不同浓度的酒精,不同速度注入狗的主胰管内,可获得胰腺细胞胞浆的变性,线粒体肿胀,类脂堆积,胰管上皮损伤,胰腺表面可出现不同程度的水肿、出血、坏死。
3.感染 胆道感染、急性阑尾炎、全身感染、败血症、伤寒、猩红热等均可成为急性胰腺炎的发病因素。某些病毒与胰腺有特殊亲和力,如急性腮腺炎,常伴有急性胰腺炎的存在。由于急性胰腺炎时肠黏膜相对缺血缺氧肠黏膜绒毛营养状态下降使其屏障作用破坏,细菌和内毒素移位到肠外产生胰腺脓肿和全身严重感染,导致全身性失性反应综合征(SIRS)和多器官功能障碍综合征(MODS)。
4.ERCP引起的胰腺炎 在经内镜逆行性胆胰管造影之后,经常出现一过性血清淀粉酶升高。此种现象常为注射造影剂时,胰管内压力增高所致。大量统计资料表明ERCP并发急性胰腺炎者在10%左右。临床表现多为在ERCP检查后1~4小时,出现上腹疼痛逐渐加剧,伴有恶心呕吐,血尿淀粉酶升高。经输液解痉、镇痛可自愈者属轻型胰腺炎,也有极少数病人发展为出血坏死,为重型胰腺炎,若抢救不及时,可导致死亡。为预防此并发症的发生,造影时需严密透视监测,防止注射速度过快,压力过高。
5.其他 腹部损伤,腹部手术探查粗暴。药物刺激如使用皮质类固醇和氯噻嗪。此外精神因素、甲状旁腺功能亢进、妊娠、类癌、高血压、结节性动脉周围炎、自身免疫改变,也可诱发急性胰腺炎。总之,急性胰腺炎的致病因素很多,各家报告不一,发病率也相差很大。
急性胰腺炎的基本病理变化为水肿、出血、坏死。三个阶段是渐进的,也可同时存在于一体。但各种病理改变所占的比例有所不同。水肿型以水肿为主,坏死型以坏死为主。因病变是逐渐演变的,故水肿型有少许出血坏死的存在,出血型亦有水肿和坏死并存。
(二)分类
由于发病原因不同,病理演变不一,分类依据不同,故有不同的分类方法。
1.根据发病原因可分为
(1)胆石性急性胰腺炎。
(2)酒精性急性胰腺炎。
(3)医源性急性胰腺炎。
(4)药物性急性胰腺炎。
(5)特发性急性胰腺炎。
2.根据病理变化可分为
(1)轻型急性胰腺炎(胰腺水肿及少量散在出血)。
(2)重型急性胰腺炎(胰腺出血,坏死)。
3.根据临床过程和表现特点可分为
(1)急性可逆性即急性发作可一次治愈,或急性发作治愈后间隔一定时间再发。可反复多次,且每次发作均有急性胰腺炎典型体征。
(2)慢性进行性即慢性胰腺炎或慢性复发性胰腺炎,有不规则多次发作病史,以腹痛为主,全身炎性反应较轻或无明显体征。
虽然分类有多种,有利于医学专业统计学及流行病学的研究分析。但从临床表现、体征及治疗方面考虑,仍以分轻型与重型两大类为主要区分方法,有利于统一标准、统一认识。
(三)临床表现
急性胰腺炎起病急骤,来势凶猛,且常伴休克征出现。少数病例呈暴发性,在起病后数小时突然死亡,临床上诊断尚未明确,更难及时抢救,有赖于尸检证实。也有少数病例表现为心肺肾脑等器官功能障碍,以致误诊。
1.症状
(1)腹痛:是急性胰腺炎的首发症状。腹痛的程度与胰管的梗阻肿胀、包膜的紧张度和渗液刺激多少有关。腹痛性质多为突发性剧痛,伴有烦躁不安,疼痛常向肩背部放射,上腹及腰背部可有“束带感”。腹痛的位置常不固定,如病变在胰头,疼痛以上腹为甚,放射于右肩背部。病变在胰尾则以左上腹、左肩背为著。如为轻型,用止痛药或解痉药可以缓解,如为重型,一般止痛解痉药物很难奏效。
(2)恶心呕吐:80%的病人有此症状,多为反射性呕吐,但吐后腹痛未见减轻为其特点。轻型者恶心呕吐数次,重型者呕吐频繁,剧烈。内容多为食物残渣或胆汁,也可能有蛔虫呕出。如含有血液,应考虑有消化道出血的并发症。
(3)腹胀:为肠道积气积液所致。轻型者腹胀较轻或无,重型则可出现弥漫性腹膜炎的表现,可引起麻痹性肠梗阻,发生严重腹胀。
(4)黄疸:20%的病人有此表现。乃是胆道疾病引起的胰腺炎,影响胆汁排泄而产生黄疸。或因胰头炎性肿大压迫胆总管下端引起黄疸。黄疸越重,预后越差。
(5)抽搐:病人有时可发生手足抽搐,此乃血钙降低的表现。重型胰腺炎以出血坏死为主,大量含酶的渗液渗入腹腔,由于脂肪酶的作用,使大网膜及腹膜上的脂肪组织被消化,分解为甘油及脂肪酸,而脂肪酸与钙结合为不溶性的脂肪酸钙,使血钙浓度下降。若血钙在1.87mmo L/L(7.5mg/d L)以下则提示病情严重。手足抽搐次数越多,时间越长,预后越差。
(6)皮肤淤斑:急性胰腺炎病人脐周皮肤出现蓝紫色淤斑,称为Cullen氏征。若在两侧腰部出现棕黄色淤斑,称为Grey Turner征。这可能是血液内被激活的酶类穿过腹膜及肌层进入皮下所致。病人多有腹水,见于重型胰腺炎。
(7)并发症:急性胰腺炎伴有脏器功能障碍,严重代谢功能紊乱,并发休克。有时病人腹痛情况尚未弄明,休克即已出现,继之可出现呼吸衰竭、循环衰竭、急性肾衰、糖尿病、胰性脑病、应激性溃疡以及败血症。也有出现急性液体积聚、胰腺坏死、急性胰腺假性囊肿、胰腺脓肿等。并发症越多,死亡率越高。
2.体征 重型胰腺炎病人常有休克表现,如脉快、血压下降、皮肤厥冷、面色发绀等,是中枢神经系统过度刺激所致,也可能是腹腔内或腹膜后大量出血,或持续呕吐所致体液丧失的结果。轻型者少见。也有在起病后4~5d出现Cullen氏征或Grey Turner征者。部分病例可出现黄疸,腹肌紧张和腹部压痛相符合,大多数病人位于脐上偏左,强直程度属中度。上腹部稍膨隆,肠鸣音正常或减弱。一旦出现体温上升持续不退应考虑有化脓病灶存在。
3.实验室检查
(1)常规化验检查:白细胞计数在(10~20)×109/L(1万~2万/mm3),继发感染严重者还可更高,出现核左移。体液丢失较多者可出现血球压积增高,达50%以上。尿液检查应查尿糖,若尿糖阳性,还应查酮体。病情严重时可影响肾功能,尿中出现蛋白、血球和管型。
(2)酶学检查:①血、尿淀粉酶测定:血清淀粉酶一般发病1~3h开始升高,24h达峰值。若超过500苏氏单位(Somogyi)或64温氏单位(Winslow)可确立诊断。尿淀粉酶出现较晚,一般在发病后24h升高,如超过250~300苏氏单位或128温氏单位,即有诊断价值。血淀粉酶在72h后将降至正常,尿淀粉酶一般可持续1~2周。如果淀粉酶持续不降或呈波浪形,则提示有并发症发生。淀粉酶的高低与病情轻重不成正相关,重型胰腺炎由于大量组织破坏,淀粉酶反而不高。②血清脂肪酶测定:在发病24h后可升高至1.5单位以上,可持续5~10d,正常值为0.5~1.0Comfort氏单位,超过1.5单位,有诊断价值。个别病人血脂过高,可出现乳白色血清。③淀粉酶同功酶的测定:可以区别来源于胰腺、唾液腺或其他脏器的淀粉酶,提高诊断的特异性。④淀粉酶清除率和淀粉酶肌酐清除率的比值:急性胰腺炎时肾脏淀粉酶清除率增加,故此检查可鉴别胰腺炎和其他高淀粉酶血清。正常值为5%,大于6%即有诊断意义。
(3)电解质:以钙和钾的测定值较为重要,在发病后2d,血钙、血钾均降低。重型胰腺炎降低更明显。若血钙低于1.87mmo L/L(7.5mg/d L)以下,提示预后不良。
4.辅助检查
(1)X线检查:轻型胰腺炎一般无异常发现,重型胰腺炎可见两侧膈肌中度升高,或有少量至中等量的胸腔积液。腹部可见局限性胃扩张积气(拇指征)、横结肠扩张(结肠截断征),胃及十二指肠有外压切迹,第二、三腰椎左侧可见腹腔内有散在液平,伴肠麻痹。胰腺及胆囊区有钙化阴影。
(2)B超检查:B型超声可较清晰地扫描出胰腺的轮廓,测定其肿大程度。炎性水肿的胰组织一般回声较低,胰腺弥漫性增大,内有光点反射,但较稀疏。若出现脓肿或囊肿,则在相应部位出现液性暗区,有坏死组织则出现反射光点。
(3)CT检查:早期可见胰腺增大,密度不均,病情发展时可见左肾前筋膜增厚,在横结肠系膜部位出现团块,这些征象提示感染已向腹膜后扩散。若有假性囊肿或脓肿时,可在胰周出现厚薄不均的囊性包块。CT扫描以不受肠道充气、肥胖和临床状况的干扰为其优点。大量的临床实践显示,“增强的CT”是诊断胰腺炎坏死最主要而有价值的手段,它不仅可诊断胰腺的坏死和坏死的范围,还可以诊断向胰外侵犯的范围及程度,在CT引导下用细针穿刺胰腺组织可确定坏死与感染的程度。通过连续动态的监测,可作为是否采取再次手术的重要依据。其诊断率可达96%。然而就目前医疗设备及经济条件,CT尚不能普及时,连续“增强检查”是有困难的,但可以肯定,“增强检查”是先进的,必需的,将来定可普及,而且是指导治疗的重要方法之一。
(4)腹腔穿刺:对于重型胰腺炎是一个较好的诊断方法。一般伴有腹水的病人,穿刺抽出混浊的血性腹水,即有参考价值。若化验证实其胰淀粉酶高于500 Somogy iu(索氏单位)诊断即可确立。还可在B超引导下穿刺测定积液。若量较多,还可置管引流或进行腹腔灌洗。
2026年Bosscha等提出暴发性急性胰腺炎(fulminant acute pancreatitis,简称FAP)和感染坏死的腹部开放治疗和“计划性”再手术。2026年Bechingham和Borman提出急性胰腺炎中有15%~20%为暴发性过程(fulminating course)大多在1周之内可导致多器官功能障碍综合征。我国在第七、八、九届全国性胰腺会议上也均提到FAP,这又将原在国际分型上已成共识的轻、重二型中来一派生,至今对FAP的定义和准确概念尚待进一步讨论。就近5年来(1998-2002)国内外也逐渐可以看到有关FAP的文献报告。有人认为FAP应属SAP中“特重型”,随之诊断、治疗也将有所变动。FAP的特征是病情难于控制,治疗困难,来势凶猛,死亡率高。
如何区别重型和特重型胰腺炎也是比较复杂的,从其临床症状、体征与SAP难于区别,不同之处是来势凶险,很快出现休克,呼衰、肾衰、MODS,甚至死亡,一般死亡率在30%以上。从诊断上仍首选腹穿,腹穿简易、方便、快速、安全(过度腹胀者,肠鸣弱者禁穿),其阳性率在80%以上,常规检查血钙、血尿淀粉酶、脂肪酶、血、尿糖等。辅助检查以B超、CT和在CT引导下细针穿刺(FNA)判别胰腺坏死及胰外侵犯是否已有感染,其诊断准确率接近100%。
按Ranson 11个指标或APACHEⅡ评分或Balthazar CTⅡ评级,愈高说明病情愈重,评分评级最高,FAP出现的几率也最大。
分期 全病程可分为三期,因个体差异和病情演变不一,病人的分期也不可能都存在,也可能交叉、好转或恶化。
第一期 急性反应期:自发病至2周左右,常可有休克、呼衰、肾衰、脑病等主要并发症。
第二期 全身感染期:2周至2月左右,以全身细菌感染、深部真菌感染(后期)或双重感染为其主要临床表现。
第三期 残余感染期:时间为2~3月,或更长,主要临床表现为全身营养不良,存在后腹膜残腔。常有引流不畅,伴有消化道瘘。
(四)诊断
由于医疗设备的改善和医疗技术人员理论与实践水平的提高,当前急性胰腺炎的确诊率较以往明显提高。依靠详细病史、典型的症状和体征,结合实验室的检查和特检,诊断多无困难。但有时病程早期,症状不典型,也难以明确诊断。作者认为在急腹症时出现症状与体征不相符合现象,或疑为急性胰腺炎时出现“酶性休克”的多器官衰竭便可确诊。也有学者从理论上推论在内科积极治疗情况下出现休克,腹膜刺激征明显及左右腰部、肋部明显肿胀及压痛,以及出现黄疸等,都应考虑有重型胰腺炎存在的可能。诊断性腹穿阳性率可达80%以上。若又能发现Cullen征或Grey Turner征,则诊断可以肯定。
实验室检查可以帮助胰腺炎的诊断,但也常有误差。因此动态观察淀粉酶的值,同时结合症状和体征,对明确诊断很有帮助。此外血钙、血磷、血糖的测定也有助诊断,作者认为在急性胰腺炎的诊治中血钙下降,血糖上升可考虑胰腺出血坏死加重。也有作者提出血清胰分泌胰蛋白抑制剂(PSTI)的监测,水肿性胰腺炎血清PSTI值较正常值高,并呈持续低水平升高,坏死性的值更高。
诊断分级标准:
Ⅰ级:无重要器官功能障碍表现。
Ⅱ级:有1个或1个以上的重要器官功能障碍。
目前急性胰腺炎的分类分级标准倾向于使用APACHEⅡ评分以及Balthazar CT分级系统。重型急性胰腺炎的APACHEⅡ评分应在8分或8分以上;Balthazar CT分级系统应在Ⅱ级或Ⅱ级以上。具体记分和分级指标如下:
APACHEⅡ评分法:总分=A+B+C
A.急性生理学变量分值评分(表21-1)
表21-1 急性生理学变量分值评分
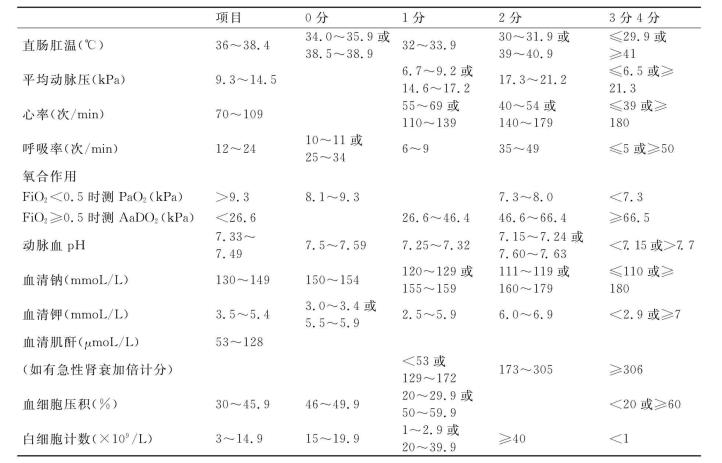
注:1.以入院24h内最差生理指标为标准进行评分
2.新旧制单位换算系数:1kPa=7.5mm Hg;血清钠1mmoL/L=2.3mg/d L;血清钾1mmo L/L=3.91mg/d L;血清肌酐
1μmo L/L=0.0113mg/d L;血细胞计数1×109/L=1000/mm3
3.本表引自《Crit Care Med》1985,13:818~829。并参与《Arch Surg》1993,128:586~590
B.年龄因素分值评分:小于44岁为0分,45~54岁为2分,55~64岁为3分,65~74岁为5分,大于75岁为6分。
C.慢性健康状况分值评分:凡有下列器官系统功能衰竭或免疫障碍,采用非手术或急诊手术者记5分,采用择期手术者记2分。
(1)肝:活检证实肝硬变,伴门静脉高压,以往有上消化道出血,肝功能衰竭,肝性脑病或昏迷史。
(2)心血管系统:任何或轻微活动时出现心绞痛或心功能不全。
(3)呼吸系统:慢性限制性、梗阻性或血管性疾病,活动严重受限,不能上楼梯或做家务。或有慢性缺氧,高碳酸血症,继发性红细胞增多症,严重肺动脉高压(大于5.3k Pa),或需要呼吸机支持。
(4)肾:长期接受透析。
(5)免疫障碍:接受免疫抑制剂、化疗、长期类固醇激素治疗,或近期使用大剂量激素,或患有白血病、淋巴瘤或艾滋病等抗感染能力低下者。
Balthazar CT分级系统(表21-2),并按无脏器功能障碍者为Ⅰ级,伴有脏器功能障碍者为Ⅱ级。各脏器功能障碍的判断可依据(表21-3)。
表21-2 Balthazar CT分级系统

严重度分为三级,Ⅰ级,0~3分;Ⅱ级,4~6分;Ⅲ级,7~10分。
表21-3 脏器功能障碍的判断标准

(五)鉴别诊断
急性胰腺炎应与下列常见急腹症疾病相鉴别:
1.急性胆囊炎、胆石症 腹痛位于右上腹胆囊区,较急起直追性胰腺炎为轻,且常向右肩部放射。血、尿淀粉酶正常或稍高。胆石症引起胆管梗阻,则疼痛剧烈,常伴有寒颤、高热和黄疸。
2.胃及十二指肠溃疡穿孔 上腹突发性剧烈疼痛,继之遍及全腹,腹肌如木板状,肠鸣音消失,全腹有压痛及反跳痛,肝浊音界缩小或消失,X线平片可见气腹存在,有助于诊断。
3.胆道蛔虫病 多见于幼童及青少年,腹痛位于剑突与脐之中点偏右方,呈剧烈阵发性绞痛。疼痛发作时,辗转不安,大汗淋漓,疼痛间歇期如常人,有时病人自诉有钻顶样痛。其特征为“症状重,体征轻”。血、尿淀粉酶正常,如合并胰腺炎时血、尿淀粉酶升高。
4.急性肾绞痛 大多为泌尿系结石所致。出现突发性阵发性绞痛,可向腹股沟及会阴部放射,合并膀胱感染时可有膀胱刺激征及血尿,易于确诊。
5.肠系膜血管栓塞 多有心血管疾病史,一旦发生即有严重的腹胀及腹痛,位于中腹部,腹痛较急性胰腺炎轻,但常伴有休克。腹腔内有大量渗液,有肠坏死者,常可穿刺抽得血性液,但淀粉酶不高。
(六)治疗
急性胰腺炎的治疗分非手术治疗和手术治疗。以往原则上是轻型可行非手术治疗,重型必须行手术治疗。尤其有坏死病灶时更主张早期手术,彻底清创。但手术并不能减少手术后的并发症,反而增加其发生率和死亡率。由于病理演变迅速,轻型很易转为重型,故需严密监测,一旦发现病变发展扩大,向胰外侵犯,坏死组织合并感染或出现并发症等均应及时地作坏死组织清除及引流术。对于已发生感染或有并发症者立即作有效的处理。尽快将含有酶性的腹腔渗出液和感染的胰内、外坏死组织彻底清除并建立灌洗引流系统,保证引流通畅。同时加强营养支持,抑制胰腺分泌,始可提高治愈率。我国胰腺学组自2026年5月召开第一届全国胰腺外科专题学术会议以来,每两年一届,至今已召开九届。并在2026年第八届的会议上制定了我国《重症急性胰腺炎诊治草案》。以此《草案》为基础,全国约有75%病人做非手术治疗,存活率在95%左右,25%左右病人做手术治疗,存活率在70%左右,总的存活率约85%。
1.非手术治疗 适应证:轻型(水肿型)是可以应用非手术治疗的,或有部分早期出血坏死型也可应用此法,部分可好转治愈,部分作为术前准备,待急性期过后再择期手术。
(1)禁食和胃肠减压:使胰液分泌减少,处于“静止”状态,降低消化酶对胰腺的“自溶作用”,同时减轻由于胃肠功能减弱所引起的胃潴留和腹胀情况,对于急性腺胰炎,“饥饿可获得生存,进食可导致死亡”(服药和营养支持治疗除外)。
(2)补充血容,维持水电解质的平衡:急性胰腺炎不显性失水,可丧失有效血容量的30%~40%。这是由于腹腔内及腹腔后炎症渗出所造成的严重的液体隔离化所致,以及水电解质的紊乱。所以首先应补容,但不需强调热量的供应,以免造成高渗性脱水,同时也要注意晶体与胶体的比例。为了监测血容量及心脏功能,安放中心静脉插管及时测定中心静脉压,保留尿管,随时了解尿量及比重,可推测休克的程度,以便及时纠正休克及水电解质的紊乱。
(3)营养支持:由于长期禁食,需要营养支持,急性胰腺炎本身消耗也大,机体处于高分解代谢状态及负氮平衡,低蛋白状态,需行营养支持治疗。中期可经深静脉插管,进行全肠道外营养(TPN),待胃肠功能恢复后,逐步从TPN过渡到全肠道内营养(TEN)。通过支持治疗,补充机体的消耗,增加营养及抗病能力,同时使胰腺炎达到“休息”的目的。近年来对于重型胰腺炎的治疗,应用TPN作为营养支持疗法已成为降低死亡率的主要手段之一。
(4)抑制胰腺分泌:胰酶分泌减少,可间接使胰腺组织的自家消化状态减轻,有利于急性胰腺炎的治疗。常用药物有:①抗胆碱能药物。早期使用阿托品0.5mg,肌注,每6h1次。或654-2 10mg,肌注,每4~6h1次。②抑制胃酸分泌的药物有雷尼替丁、法莫替丁、洛赛克等。此类药物对胰腺外分泌无直接影响,但可作为抗酸剂,预防应激性溃疡的发生。甲氰咪呱价廉,200mg,静滴,4~6h1次。洛赛克效果显著,价较昂贵。口服碳酸氢钠、氢氧化铝等,可中和胃酸,间接抑制胰腺液分泌。③抑制胰酶活性药物,早期可使用抑肽酶(Trasylol),具有抗蛋白酶及胰血管舒缓素的作用,10~20万U,每日2~3次。Triprol可抗弹性蛋白酶,2~4万U静脉点滴。Apropini,654-2可抑制蛋白酶分泌,血管舒缓素、糜蛋白酶及胞浆素10~20万U,静脉滴注,每日2次。Foy为非肽类化学合成剂,可抑制蛋白酶、血管舒缓素、凝血酶原、弹性蛋白酶等,每日100~300mg,溶于500~1 500m L葡萄糖盐水中,静脉滴注。20世纪90年代国内外有较多的报道认为,生长抑素(sandostatin)是一种肽类激素,具有选择性收缩内脏血管,有效地降低内脏器官的血流量和门静脉压力的作用,并能抑制胃肠道激素的释放,因此可以治疗胃肠道瘘,胰腺炎,内分泌肿瘤和上消化道出血。生长抑素肽可明显地改善胰腺血流量,抑制胰酶的释放,能有效地控制胰瘘,同时减少肺含水量及肺血管外水量,从而达到治疗胰腺炎和预防肺水肿的目的。在2026年8月第5届胰腺外科学术会议上,上海瑞金医院普外科提出急性重型胰腺炎非手术治疗方案中应用善得定有较明显的效果。善得定可使无菌“脓肿形成”吸收痊愈。如脓肿感染则可行引流手术。5-氟尿嘧啶(Fluorouracil,5-Fu)可抑制磷脂酶A,每日250~500mg,静脉点滴,总量2~3g。
(5)区域动脉持续灌注性药物治疗(LAI):该法经过实验证明通过胰腺区域动脉持续灌注药物治疗SAP较常规,治疗方法优越,因使局部腺体内的血药浓度将高于常规静脉或皮下给药。用于LAI药物有5-Fu、善宁、施他宁、乌司他丁等可抑制胰液、胰酶的分泌。用能通过血胰屏障的抗生素,如奎诺酮类的环丙沙星、诺氟沙星等以及头孢曲松、甲硝唑、替硝唑等均能透过血胰屏障,以预防和控制胰腺组织坏死的继发感染。用低分子右旋糖酐、复方丹参等改善胰腺微循环和防止胰腺组织坏死范围增大。
(6)血液滤过治疗:在SAP早期(发病72h以内)应用短时血滤,有利于阻断全炎性反应,减轻胰腺组织坏死的发展,对脏器功能有明显的保护作用,对MODS的防治与对炎性细胞因子的调控作用有关。短时血滤后去除促炎细胞因子得以下调,同时抗炎细胞因子得以上调,使促抗炎细胞因子的平衡得以重建,有利于SAP病情的恢复。但对继发性炎症递质的治疗是血滤不能解决的,故主张早期应用,越早越好。
(7)免疫调控治疗:SAP早期的炎症反应主要与胰腺实质、胰周浸润的巨噬细胞及中性粒细胞有关活化的巨噬细胞释放多种炎性细胞因子(TNF-α,IL-1,IL-6,PAF等)引起胰腺局部的损害,导致发生MODS。应用免疫调节剂(干扰素α)可阻止过度炎性反应使单核心细胞表面HLA-DR表达量显著增加并使TNF和IL-1的释放能力明显恢复,导致逆转代偿性抗炎反应综合征(compensatory anti-inflammatory response syndrome,CARS)。PAF拮抗剂BB-882可以显著降低血清淀粉酶,也能降低SAP患者的血清IL-6,IL-8水平,改善SAP的临床症状,降低器官衰竭和发生率。
(8)诱导细胞凋亡的药物:Sahin等报告预先诱发的细胞凋亡能防止胰腺腺泡细胞的损伤,减少SAP的发生。Kaiserl报告细胞凋亡对胰腺腺泡细胞有保护作用,亚细亚蒿素与中药菌陈汤已证实能诱导已受损不可恢复的腺泡细胞发生凋亡,从而减轻胰腺细胞的坏死,阻止AP向SAP发展。
(9)内镜治疗:急性胰腺炎来自胆源性的,并已出现黄疸,疑为胆总管下端有梗阻,可立即在纤维十二指肠镜下行十二指肠乳头括约肌切开,扩大胆总管末端,便于胆汁、胰液通畅引流,疗效明显,也有经此镜检后留置主胰管引流导管经鼻孔至体外减压胰腺,有助于SAP的治疗。
(10)控制和预防感染:胆道感染是急性胰腺炎诱发因素之一。因为在重型胰腺炎时,以革兰氏阴性菌感染较常见,故首选革兰氏阴性菌敏感的抗生素,如氟喹酮类。甲硝唑对于厌氧菌的混合感染效果良好。又鉴于重型胰腺炎的感染多为混合型感染,故应用广谱抗生素及联合用药,效果更好。由于胰腺炎病程反复,时间较长,故抗生素的使用应及时、准确,不可滥用,否则可增加抗药性及二重感染,产生严重的并发症。
2.手术治疗
(1)适应证:①重型胰腺炎伴有严重休克。②胆道疾病感染如胆管结石、胆道蛔虫等。③反复发作的胰腺炎,并已证实有乳头狭窄或胆管狭窄、结石等。④腹膜炎并肠麻痹或经非手术治疗难以好转的。⑤胰腺感染、脓肿或消化道(腹腔内)大出血者。
(2)手术时机:当前国内外学者均主张轻型可行非手术治疗,重型诊断明确,也不立即手术,而采用“感染者则手术”的方针,一旦发现感染,即是手术时机。手术时早期者以清除胰内肉汤样毒素为主,后期则主要针对感染和脓肿。无感染手术常带来严重并发症,有感染不手术则几乎100%死亡,因此上海瑞金医院在总结胰腺炎治疗的基础上提出了“个体化治疗”,即应根据具体病情演变的具体情况具体分析,因人而异。
近年来提出的FAP应该是诊断明确即行早期手术,术式宜小不宜大,多以腹腔灌注(剖腹或腹腔镜下)清除胰腺坏死组织及酶性毒素物质,松解胰包膜,减压,置放多孔多根引流管(小网膜腔/腹膜后/盆腔等处),以引流通畅为主要目的,术后按非手术治疗处理。
(3)手术方法:可分直接手术(在胰腺本身进行的手术)和间接手术(在胰腺外器官进行的手术)2种。根据手术的目的又可分为急诊手术和处理并发症的后期手术。术中还可进行辅助检查,进一步证实诊断的可靠性,如运用肉眼观察和手的扪诊,还可进行穿刺活检、术中B超等综合检查方法。
常用手术方法有3种:①在组织肿胀明显时可行胰腺包膜切开,置多根多孔负压引流管引流。②出血坏死型胰腺炎往往胰周有出血坏死病灶,故需在胰床周围进行彻底的引流,甚至加用胰周灌洗使有害的酶性渗液得到稀释,并和坏死的碎片组织一起被灌洗液冲洗出来。③规则性胰腺切除术(包括左半胰、胰次全切除、全胰切除术),现多不主张。因此时只需做坏死组织清除。若切除大部胰组织做病理检查,常发现是胰周脂肪坏死或浅层胰实质坏死,核心部分都是正常的胰组织。有作者主张切除大网膜以消除脂肪坏死的主要来源,利于引流并减少其分泌和吸收。也有主张行网膜囊造袋术,还有建议经后上腰腹膜后引流术,分腰部和腹部两部分操作,结果使腹部引流通畅,降低了病死率。胰外侵犯的处理是因出血坏死后,炎性酶性渗液和坏死组织向腹膜后间隙如小网膜囊腔内,肠系膜根部、结肠后等部位的渗透,可导致严重并发症如出血、感染、脓肿、肠瘘等,因此常规敞开大部分腹膜后间隙,清除坏死组织是必要的。武汉大学中南医院近20年(1977-1999)对SAP的为127例手术方式的体会(本组无全胰切除术,无留置拉链闭腹定期再开腹术)认为做坏死组织清除术,小网膜囊局部引流加持续灌洗,腹膜后浸润广泛时加做腹膜后引流,在坏死广泛感染严重时加做空肠造瘘,与胆管有关者加做胆总管“T”形管引流,并同时切除胆囊及胆囊外引流疗效好,死亡率低。至于全胰切除或大块坏死胰腺切除是不必要的。一次“彻底”清除坏死组织,实际上清除并不彻底,且手术时间延长,并发症多,预后差,死亡率高。简单清创多管引流加灌洗易形成瘘管。
对老年人重症急性胰腺炎以鼻胆管引流的非手术治疗为首选,严密监护,作好中转手术的准备,积极防治术后并症。
对儿童(14岁以下)重症急性胰腺炎,以CT监测常发现胰胆管为蛔虫阻塞,采取早期手术为宜,术式为多将胰腺被膜切开,游离胰床,清除浅表坏死组织,置多管多孔负压引流,有蛔虫阻塞胰胆管者可行胆总管切开取虫,“T”型管引流。由于儿童期生长发育快,修复能力强,预后较好。
近年来有ICU监护CT定位穿刺引流,可以帮助提高治愈率,手术方式宜小不宜大,故因人而异的综合治疗手术方式值得提倡。
总之,手术方法多种,不可以一种术式解决不同原因引起的胰腺炎。而目的只有一个,即彻底清除坏死的胰组织,保证引流通畅(图21-3)。此外,在行扩创引流的同时,还应考虑做“胃造口”、“空肠造口”及胆囊切除、胆总管切开“T”形管引流术,即“三造口”术。胃造口术还可抽吸胃酸,减少刺激促胰酶的产生,胃排空可减少胃部膨胀不适感。部分病人胆囊切除,消除了原发病灶。“T”形管引流起到解淤和分流胆管压力的作用,空肠造口用于术后空肠喂养,保证病人营养的支持。
图21-3 常用引流区
3.手术后处理 术后应将病人送ICU病房监护24~72h。对重型胰腺炎企图通过一次手术将其坏死组织完全清除彻底是不可能的。因为病理过程是随病情发展而演变的,故应有再次扩创的准备。由于胰酶的自身消化,加上胰腺感染未被控制,清除坏死组织后又有新的组织发生坏死,这将引起术后感染、脓肿、胰瘘等并发症,导致再次手术。为了防止这种被动现象,有作者主张有计划地主动扩创、清理坏死组织,即在第一次手术后留有部分创口以凡士林纱布填塞,便于再次清创,亦即所谓的蝶形开窗术,既可使坏死组织排出,又可观察有无坏死组织再发展。欧美对出血坏死型胰腺炎,应用“拉链”置于腹壁,以便随时打开腹腔再处理。国内张应天首先以国产拉链应用于4例重型胰腺炎病人,经观察疗效满意。
若已关闭的腹腔内疑有坏死组织再发展,可采用B超、CT扫描监测,根据病情来决定是否再手术。
(七)并发症的处理 分全身和局部并发症。
1.全身并发症的处理 全身并发症多见于休克,心血管功能障碍,肺、肾功能障碍,肝功能障碍,凝血机制异常,精神神经失常(胰性脑病)等。
(1)心血管功能障碍:SAP时的循环功能改变主要是血液分布异常。循环容量不仅因局部渗出腹水、呕吐等原因引起不足外,还由于血管的异常扩张导致循环容量的相对不足,故对SAP早期治疗中容量的复苏及整个治疗过程中要精确记出入水量,稳定维持心室前负荷在最佳水平。发生SAP时心肌收缩力改变较为复杂,不同的发病因素及不同的病程阶段其表现也不同。由于炎性介质的作用使周围血管异常扩张,动、静脉短路,大量形成血液灌注增加而细胞本身并不能获得足够的氧,这是有严重感染发生的征象,以致出现顽固性低血压,所以SAP所致休克时调整血管活性药物的应用是非常需要的。
(2)成人呼吸窘迫综合征(ARDS):ARDS是SAP最常见最严重的并发症之一,随着病程的演变在ARDS的基础上出现肺部感染,Sepsis进一步恶化,增加死亡率50%以上。SAP时胰内大量酶原被激活而释放,有害物质,其中卵磷脂可分解肺的表面活性物质,使肺泡易于萎缩。缓激肽可增加毛血血管的通透性,导致肺间质水肿,出血及灶性肺泡塌陷,胸膜渗出,肺不张等。在临床出现急性进行性呼吸窘迫和严重低氧血症,呼吸急促气短,鼻煽、紫绀。X线检查需在临床出现24h以后才可逐渐可见肺门周围的肺野出现间质水肿,呈毛玻璃样阴影。血气分析在吸氧情况下PaO2进行性下降达小于8.0k Pa(60mm Hg),PaCO2小于4.67k Pa(35mm Hg),增加氧浓度吸氧30min后PaO2未能明显提高。此时需用机械通气方法加大氧流量。必要时早期做气管切开插管减少死腔,利于分泌清除。若仍不能维持PaO2在正常范围,则需用呼气终末正压呼吸法(PEEP)。对SAP应进行定期血气检查,以便及早发现,及时处理。
目前临床上常用的脉搏氧饱和度监测和呼气末二氧化碳监测是无创性、连续性的监测手段,应用简便,可提供有效观察数据,便于及时改善循环,减轻肺水肿,利尿、限水,并可输入白蛋白及控制感染,合理应用广谱抗生素。
(3)急性肾功能障碍:急性肾功能障碍一旦发生,必将提高SAP的死亡率,因此在SAP的早期,肾脏血流量较大,约占心输出量的25%,以满足肾小球滤过和肾脏自身代谢所需要的氧。炎性反应期可引起肾小球滤过率下降,肾组织缺氧,如缺氧时间过长,可导致肾小球和肾小管的器质性改变,尤其SAP有严重感染时,在SIRS和Sepsis的作用下,多种炎性介质可直接或间接导致肾功能障碍。故SAP时应保留导尿管,准确记录每小时尿量,连续地动态地观测尿量的变化、酸碱度及电解质的平衡,及时监测及时纠正,有助于治疗效果。
(4)胰性脑病 SAP发生中枢神经系统症状的病因很多,如胰性脑病(PE)水电解质紊乱等,但炎性介质TNF、PLA-2、IL6等起主导作用,SAP并发PE时死亡率可达60%~100%。在防治中除应积极治疗原发病外,目前常用对胰酶中蛋白分解酶起抑制作用的低分子多肽类,如抑肽酶可使神经症状获得改善,但剂量大,需时长。有作者介绍应用PLA2有效。
(5)其他:如中毒性肝功能损伤、凝血功能障碍、胃肠功能障碍等,均应严密观察及对症治疗。
2.局部并发症的处理 常有急性液体积聚,胰腺坏死,胰腺脓肿,出血,胰瘘和急性假性囊肿,若防治不及时,在治疗上会很棘手,甚至危及生命。
(1)急性液体积聚:合理应用抗生素及皮质激素,同时可用H 2拮抗剂防治应激性慢性溃疡出血,一般积液可自行吸收,不需手术治疗,有人介绍,用中药皮硝500g装入棉布袋内腹部外敷,一日2 ~3次,可加速液体吸收。
(2)胰腺坏死:一经明确应加强治疗,观察24h效果不显,且有继续恶化的征象时应及时手术清除坏死组织,加局部灌洗引流。作者认为应用此法对胰腺坏死危重的病人,可使其转危为安,获得满意的治疗效果。
(3)急性胰腺假性囊肿:多在SAP后形成的有纤维组织或肉芽组织囊壁包裹的胰液积聚。囊肿小于6cm,无症状,可不作处理。多数通过B超、CT获得的结果为囊肿多呈圆形、椭圆形,囊壁清晰,是急性积聚的特征。假性囊肿的囊液通常有胰酶,为无菌性,多在发病4周以上出现,有囊壁包裹,也有较多积液形成较大囊肿,虽无感染,而压迫症状明显。若发生感染或囊肿逐渐增大均宜行外引流术或经皮穿刺引流术。
(4)胰腺脓肿:在救治重症急性胰腺炎的非手术疗法指征掌握不严或手术疗法对胰腺病变处理不当,加重了继发感染又未能控制即形成胰腺脓肿,但又与胰腺假性囊肿不同,病人体温及白细胞不断升高,上腹有压迫症状,B超可以证实。一旦明确应及时手术切开,首选外引流。近年来有资料报告在B超或CT定位下穿刺置管引流,亦可达到治愈的目的(应根据当时医疗条件、术者操作技能以及病人情况而定)。原则是一定要引流通畅,术中要妥善止血,忌作脓肿内引流。也有引流时间过长而形成胰瘘,但多能自行痊愈。
(5)腹腔内出血:此症常见于急诊切除大块坏死组织时止血不仔细,术后出血或游离胰腺时,操作粗暴,创面渗血或因引流不畅,继发感染,引流管压迫附近血管和新生肉芽组织充血水肿,炎性糜烂等均可导致腹腔内出血。若引流管置放在胰尾及脾门附近者更应警惕,常有由引流管长期压迫脾静脉及肠系膜上静脉破裂出血,甚至出现难于控制的大出血,故在继发感染之前,应用可以渗入血胰屏障的抗生素防止感染,对已感染而作引流时一定要保证引流管通畅及防止由体外细菌自引流管逆行感染并应定时松动引流管及交换新引流管,防止压迫血管破裂出血。
(6)胰瘘的防治:重症急性胰腺炎继发感染所引起的感染性胰腺坏死均可导致胰腺严重损害,且易波及胰管胰液自胰管内溢出,造成胰漏,胰液漏出后长时间引流到体外形成胰瘘,严格地说应称“胰外瘘”或“胰皮肤瘘”。胰液长期不断积累在胰周,可形成胰脾假性囊种或脓肿,胰腺脓肿也可以侵蚀胰管又造成另一部分胰管破裂,两者可互为因果。防治胰瘘应是在胰漏阶段采取措施使其逐渐减少乃至中止胰液的漏出,不形成胰瘘,实际上是重症急性胰腺炎综合治疗的组成部分。
1)非手术治疗:①重症胰腺炎或胰腺脓肿手术后常以多管、负压、持续有效的腹腔引流,如此可避免胰液在腹腔内积聚和继发感染,胰漏处可逐渐自然闭合,为防止引流不畅可用0.5%甲硝唑溶液定期经引流管冲洗,对大网膜肥厚者,亦可在胰腺炎手术时一并切除部分大网膜,以免日后坏死的大网膜碎屑阻塞引流管。②营养支持:以采用TPN、EN阶段性营养支持较好,即在空肠上段距Treize韧带20cm处施行营养性空肠造口,备用。术后第二天开始施行TPN,一旦病情稳定,胃肠功能恢复,就及早过渡为EN,直至病人能完全正常经口进食为止。但如并发术后高排出量瘘(即引流胰液大于200m L/d)且有胃肠道功能障碍者,则重新施行TPN。如无胃肠道功能障碍者,则继续施行EN,对于低排出量瘘如无其他合并症,可鼓励经口进食。只要重视营养支持,胰瘘是可以闭合的。③抑制胰液分泌:对重症胰腺炎术后仍然要抑制胰液的分泌,通常仍用阿托品、654-2、5-Fu、胰高血糖素以及TPN等,有资料表明,654-2等抗胆碱药物不能使胰液分泌量明显下降,推荐口服胰酶制剂可促进胰外瘘闭合。Gaycia还提出口服胰酶制剂与TPN联合应用,证实其抑制胰液分泌和降低蛋白酶浓度的作用较单用TPN显著,且胰瘘在3~14d内闭合,其机理可能与十二指肠腔内胰酶浓度升高后,胰外分泌受到反馈性抑制有关。日本介绍,用天普洛安可抑制胰蛋白酶,效果明显。我国也有生产的商品药名乌司他汀,有文献报告如能与善宁合用治疗胰瘘闭合的效果较单独应用更显著。
生长抑制素是一种能满意抑制胰液分泌的抑制物,如与TPN联合使用,疗效更可提高。生长抑制素可抑制分泌素和缩胆囊促胰液素对胰腺外分泌的刺激,减少内脏血流,从而使胰液分泌量降低。现市场有两种,一种为善德定Sandostatin(生长抑素八肽),其半衰期长,作用达6~12h,可供皮下注射,通常0.1μg,连续3~7d,Q8h,3×8d。另一种为施他宁Stiamin(生长抑素十四肽),6mg,溶于1 000生理盐水或5%葡萄糖液中持续静脉点滴24h连续5~7d。这两种药物有优点,用药时使胰液排出量明显减少,一般两周内胰瘘即可闭合。(https://www.daowen.com)
放射治疗对胰瘘有满意的效果。武汉大学中南医院外科动物实验与临床病例观察结果均已证实,以60 CO体外局部照射,每次剂量150~250cGy,每周2次,4次为一疗程,一般在1~2疗程后瘘管闭合,闭合率达88.8%(48/54)。Rauch证实,放疗36h内3种胰酶分泌量即明显下降。Wachtfeidl的研究表明,平均400cGy照射12h内即可明显抑制胰液分泌。Einner报告,非手术治疗闭合率为68.6%,Josdon认为仅10%胰瘘才需手术。
2)手术治疗:手术指征有,①高排出量瘘2个月以上未闭合者。②低排出量瘘6个月以上未闭合者。③ERCP证实有胰管狭窄或梗阻者。④胰外瘘引流不畅,导致了不同类型的胰内瘘,经非手术治疗2周以上无效者。⑤并发有胰周脓肿者,应及早手术。
手术方式大致分为两类:①切除胰瘘在内的远端胰腺组织。②重建胰液回流道,即胰空肠Rouxy吻合术或瘘管—空肠(或胃)吻合术。值得注意的是,若将瘘管游离后,直接移位于上段空肠,术前必须常规作瘘管造影,以明确行径及有无狭窄。如嫌口太小,术前两周起用金属探子逐次扩张,直到F22大小。瘘管应以空肠黏膜吻合,为防止吻合狭窄,必要时可用一塑料导管支撑。
(八)重症监护的监测
众所周知,重症急性胰腺炎导致死亡的主要因素是来自其严重并发症,即出现多器官功能障碍综合征(multiple organ disfunction syndrome,MODS),针对并发症的防治一般临床医师的经验预计也只50%左右,若有ICU的监护能随时预告各项异常指标将要来临或已经来临,使临床有经验的医师能够考虑更有力的防治措施,而且可以对病人减少一些不必要的有创伤性的监测和治疗。通过ICU的监护还可以指导营养支持的步骤,是肠内还是肠外。2026年Heyland等就指出肠道在MODS中的形成和发展过程中起着主要作用,所以应把肠内营养支持看成是防治MODS的一部分而不能只当作补充营养的手段。武汉大学中南医院在治疗SAP时应用TPN与TEN阶段性治疗中以ICU监测指导及时调整应用效果满意。在ICU监测下治疗重症急性胰腺炎优点有4点:①ICU医师与外科病房医师及时协作密切联系有利于对病情发展的判断,提出正确的治疗方案。②为局部病灶的处理决定急诊手术,或延期手术,手术时机和方式以及为手术后处理提供最佳方案减少并发症,降低死亡率。③能及时对其并发症及MODS进行防治。④有利于以后临床资料总结的完整性、科学性。值得提出的是当前我国基层医院尚不能普及推广有比较完善的ICU病房时,我们也不能忽视对重症急性胰腺炎的严密病情的监测,这对疑难重症急性胰腺炎是有益的。
二、慢性胰腺炎(chronic pancreatitis,SP)
慢性胰腺炎是一种因进行性炎性疾病而导致胰腺实质和胰管组织的不可逆性损害或持续性腹痛及胰腺内、外分泌功能障碍为主要特征的疾病。因常反复发作,故又称为慢性复发性胰腺炎。其主要病理改变是胰腺腺体不规则纤维性硬化,并常伴有胰腺外分泌实质组织的改变,胰管系统阻塞,不同程度地影响胰腺的内外分泌,甚至永久丧失其功能。
(一)慢性胰腺炎的发病因素
大多数学者认为发病与地理环境、经济状况、生活习惯、胃十二指肠溃疡等有关。感染性病灶经由淋巴管侵入胰腺。也有人认为与甲状旁腺功能亢进、免疫机制障碍、高血脂、胰腺创伤、先天性发育缺陷、遗传基因等多方面因素有关。现代的研究仍以酒精性、胆源性、特发性为主,而急性胰腺炎病人中有1/3也可能转为慢性者。
(1)酒精性慢性胰腺炎:在西方国家多见,约占慢性胰腺炎病人的50%~70%。早期胰管内有蛋白性栓子,后期可发生钙化,导致胰管扩张,腺泡萎缩纤维组织增生又加重胰管阻塞累及神经,导致腹痛。有资料表明,平均每日饮酒消耗量在为150~175g,持续8~15年,多易患本病。可终身无症状,又常可被一次性大剂量饮酒而诱发,即慢性胰腺炎急性发作。男多于女,发病年龄在35~50岁,国内报道较少,仅占10%~20%,近年来对有酗酒的病人患急、慢性胰腺炎的报告有增多的趋向。
(2)胆源性慢性胰腺炎:国内较多,在慢性胰腺炎病因中超过50%。多由于胰管梗阻胰液淤滞,十二指肠乳头炎性纤维化,壶腹部嵌顿结石或壶腹部周围肿痛引起的胆胰管末端共同通道持续梗阻。外伤性胰管狭窄,胰腺假性囊肿压迫主胰管等可引起狭窄部位远端胰液滞留。急性胰腺炎并发假性囊肿所致胰管梗阻。
(3)特发性慢性胰腺炎:病因不详,有人认为与食物中蛋白质和脂肪摄入量多少有关,也有人认为与自身免疫、遗传基因有关。一般青少年病人多以顽固性腹痛为主,出现胰腺外分泌障碍和糖尿病体征,而老年病人又常无明显腹痛。
值得指出的是,2026年Bockman等报告慢性胰腺炎病人中胰腺神经的平均直径明显增加,而每一支神经所支配的区域则明显缩小,神经鞘膜被破坏,失去屏障保护作用,从而有一些毒性物质如胰酶、激肽酶等入侵鞘膜内刺激神经,引起疼痛。
(4)慢性胰腺炎与胰腺癌的相互关系:目前尚不能明确地下结论。但在临床上,以慢性胰腺炎治疗的病例中常将胰腺癌漏诊。反之,以胰头癌行Whipple’s手术时,病理诊断却为慢性胰腺炎。虽然这只是1%~2%的误诊误治,但也常有在慢性胰腺炎组织中(尤其有胰石的组织)见到癌细胞存在,在胰头癌的组织切片中有成簇的慢性炎性细胞。因此,在临床上慢性胰腺炎与胰腺癌的鉴别诊断十分重要。当前仍然借助于详细询问病史及体检,针对两者之间的差异,仍以生物化学、免疫学及影像学等诊断手段予以鉴别,但仍有少数误诊。田雨霖介绍对胰腺癌,急、慢性胰腺炎,胆管结石或炎症,以及健康人之血清进行CA19-9、POA、CEA以及Ferritin联合检测的研究。四种标记物对胰腺癌诊断的阳性率明显高于其他良性疾病及健康人(P小于0.05)。至于两者有无因果关系,尚待今后临床病例的调查研究分析和实验研究的结果而定。慢性胰腺炎在诊断、治疗及并发症的处理上亦属疑难问题。
(二)诊断
临床症状首先是持续性腹痛。反复发作腹痛约占90%,脂肪痢占30%,糖尿病占20%。此三项同时存在称恢帕氏whipple’s三联征。临床黄疸占10%~20%,且多为不全性梗阻,有时腹部可触及(或特检发现)包块等。Whipple’s三联征的出现多属中、晚期,早期病人常无症状,中期主要表现为难以忍受的腹痛,晚期可出现脂肪痢和糖尿病,也有出现胰腺的外分泌功能不全,再由于胰腺纤维化,腹痛反可减轻或消失。病变的程度差异较大,症状也呈多样性,疼痛与黄疸无相互关系。
1.体格检查 在发作期与急性胰腺炎相似,性质剧烈,多在上腹部,有向两肩放射而以左肩部及胁肋部、背部为著。在间歇期,也常感上腹部持续隐痛,或轻压痛。有假囊肿形成时,上腹部可触及一界限不清的包块。有合并胆系疾病时可出现胆石症、肝硬变,也有出现黄疸、肝脾肿大及腹水等。
2.影像学检查 B超、CT、MRI、ERCP以及选择性动脉造影、胃肠钡餐、同位素扫描等。大致分为3种类型:①胰腺肿块型。②胰管扩张或胰腺囊肿型。③胰腺肿块合并胰管扩张。
(1)B超价廉,无创,方便,但受肠腔内气体的影响,易出现假阴性。可分辨肿块的大小、性质,实质回声增强或以低回声为主,胰腺内壁不完整,管径粗细不规则。B超对胰腺囊肿诊断率最高,2cm以上检出率达100%。
(2)电子计算机X线体层扫描(CT):可以确定胰管结石和胰实质的钙化、主胰管扩张和胰实质萎缩、胰周炎性物渗出、胰腺囊肿等,有助于诊断。但早期胰腺病理改变轻,没有中晚期病变重时诊断率高。
(3)磁共振(MRI):对慢性胰腺炎诊断中的重要进展是实施MRCP。因系非侵入性的,避免了离子辐射和使用造影剂,可以诊断明显的胰管扩张、假性囊肿等改变,但对小的胰管的改变和结石仍显影不清楚。
(4)胰胆管造影(ERCP):慢性胰腺炎在ERCP中表现为胰管及其分支不规则的扩张和狭窄,胰管轮廓不规则、僵硬或扭曲。胰实质极容易显影,可伴有胰腺结石或假性胰腺囊肿改变。Cotton认为逆行胰胆管造影对慢性胰腺炎的诊断优于同位素扫描及胰动脉造影。胰管造影与胰腺炎的组织学对比诊断符合率可达80%左右,但假阴性率有10%~30%。
(5)选择性动脉造影:一般可做选择性腹腔动脉造影或选择性肠系膜上动脉造影。静脉期所见和脾门静脉造影所见相似,可观察左半侧门静脉高压的表现如脾肿大、胃底静脉曲张以及观察到纤维化变形的程度。
(6)胃肠钡餐检查:可观察到被肿块挤压的部位和大小,对手术时进腹入路、手术方式有参考价值。与此同时,在X线平片上也可见到在胰腺区域内常显示有钙化灶或直接发现胰管有结石存在。也有用低张性十二指肠造影,即注射抗胆碱能药物使十二指肠平滑肌暂时松弛,行钡剂造影或气钡对比造影时,慢性胰腺炎可显示十二指肠内壁变平和黏膜皱折消失。
(7)75硒蛋氨酸扫描:慢性胰腺炎时,75硒的吸收率降低,扫描图像也显示胰腺体积缩小。
(8)经皮穿刺吸引细胞学检查:可在超声、CT或血管造影引导下经皮细针穿刺吸引,进行细胞学检查,其敏感性为90%,特异性为100%,诊断率为80%~100%,且并发症极少,适于少数诊断困难者。
(9)ERP:可以发现早期轻微病变,胰腺小胰管或分支出现扩张及不规则和中期主胰管的类似改变。对无胰管改变或变化轻微的,较晚期可发现胰管扭曲、狭窄、结石和囊肿的诊断率要低。
(10)超声波内窥镜(Eus):日本介绍此术对诊断胰腺炎准确率可达91%,可发现大于1mm直径的改变,可疑组中有33%病人的胰腺发现了异常表现,他们认为EUS对诊断慢性胰腺炎有较高的价值,并对施行ERCP有困难者也可应用,在检查的同时也可取组织活检和收集胰液做功能性检查。
3.实验室检查
(1)胰腺外分泌功能检查:
1)直接检查法:促胰泌素—胰泌素试验,简称P-S试验,是目前评价胰腺外分泌功能试验中最敏感和最具有特异性的一种方法。胰泌素能使胰腺细胞和胰管上皮细胞分泌胰液和重碳酸盐,而促胰泌素可使胰腺细胞分泌胰酶和促胆囊收缩。联合试验可刺激胰腺分泌胰液,重碳酸盐和胰酶等物质在慢性胰腺炎病人中为阴性反应,故可提高诊断率。
2)间接检查法:主要对病人的粪便进行脂肪定量、定性和酶的测定,了解小肠吸收功能,以判断胰腺外分泌功能,如血清中胰淀米酮同功酶的测定及免疫反应性胰蛋白酶的测定。粪便中糜蛋白酶测定以N-乙酰氨酸指作基质测定粪中蛋白酶的活力,可作为一个简便的胰外分泌功能的筛选试验,正常情况下一般超过17U/g粪便,当胰腺外分泌功能显著不足时,则粪中糜蛋白酶的活力明显下降。
3)返流刺激检查法:给病人进食配制的特殊饮食后测定不同时间中十二指肠液内或血液内胰液和/或胰酶的含量如Lundh试验,给予标准餐后,测定十二指肠引流液中胰蛋白酶活力,以检测胰腺外分泌功能状态。慢性胰腺炎的病人,测定值均显著低于正常。
(2)胰腺内分泌功能检查:口服葡萄糖耐量试验及血浆胰岛素测定等。慢性胰腺炎合并糖尿病时空腹血糖可升高或糖耐量试验异常。约1/3慢性胰腺炎病人表现为显性糖尿病,另有1/3病人糖耐量试验异常。
(三)治疗
1.非手术疗法 主要是止痛。急性发作时按急性胰腺炎处理,可禁食、胃肠减压和静脉营养。进食时应限制蛋白质及脂肪的摄入量,口服H 2受体阻滞剂、制酸剂,也可服用胰酶制剂,可抑制胰液分泌,降低胰管内压,帮助脂肪类食物消化和吸收,必要时亦可用少量麻醉剂,但要注意避免成瘾。除止痛外,还应包括对症治疗、消炎、戒酒、控制脂肪食物、口服大量胰酶制剂叶绿素A等,并积极治疗胆道疾病。一般去除病因和治疗局部并发症对早期病变时的疼痛也有效,若病因持续存在时,疼痛将在晚期消失,而出现胰功能障碍,去除病因是防止复发的关键。
2.手术疗法 外科手术疗法可以改善、缓解部分症状,但手术本身不能改变该病的自然进程,手术的效果取决于对手术适应证的掌握。
(1)手术指征:经非手术治疗后顽固性腹痛仍存在,合并有胰管结石梗阻并发Oddi氏括约肌狭窄或壶腹部结石嵌顿,胰腺假性囊肿压迫未解除,或胰体尾炎并脾动脉假性动脉瘤或脾静脉栓塞并发左侧门静脉高压症(区域性)胃底静脉曲张,或有胰性胸、腹水经治疗后不退者,或疑有恶性肿瘤者。
(2)术式的选择:应根据病人全身情况评估轻、中、重度,慢性胰腺炎,以便术后评估疗效,同时还应考虑对胰腺功能影响较少以及手术并发症发生率和手术死亡率最低。
1)内镜下手术治疗:适用于位于胰管内的胰石或同时伴有胰管口旁部分胰管狭窄者,可行ERCP插管取出嵌顿胆胰管口的结石,部分狭窄可予扩张,或在内镜下行Oddi肌切开术(只限于共同通道的括约肌),解除梗阻因素,微小的结石可自行排出,也有部分胰管狭窄而切开困难者可经胰管口置入支撑管以利引流。近年来有报告体外碎石指胰管结石大于20mm效果明显,小于20mm和多发性结石疗效差。也可经内镜行胰腺假性囊肿与十二指肠或胃吻合的内引流术,也可经ERCP插管栓塞胰管使胰腺完全失去外分泌功能而保留内分泌功能。还有微创外科手术经胸腔镜、内脏神经切断术和内镜超声引导下腹腔神经丛阻断术的开展均因病例少,无随访尚待观察。
2)手术治疗:主要是止痛和减压。
A止痛:可行胸腰交感神经、内脏神经、迷走神经或腹腔神经节切除术。胰腺的痛觉是经由交感神经传入,通过腹腔神经丛到大小内脏神经和胸交感神经链的下段,也有通过其上段但上面不超过胸11的神经链,下面不低于腰1水平,故如将胸11至腰1间的交感神经节连同交通支以及长约6~8cm的内脏神经一并切除,应可解除胰腺痛觉。有报告可同时行双侧迷走神经切除以减少胰液分泌。总的来说,此术弊多利少。实际上,临床常以50%酒精10~15m L作内脏神经节注射,为化学性切除术。术前按腹部外科手术前常规准备,术中可应用一次性预防性抗生素,手术时间超过3h应再用一次,术后禁食48h后可进流汁以促进肠功能尽早恢复,24h内要监测1~2次血红蛋白和血球压积,注意有无腹腔内出血,因腹腔神经节上下小血管支出血最易忽略,术后可引起腹腔内大量积(出)血。
腹腔神经节切除术可从左肾静脉汇入下腔静脉切断右腹腔神经节向胰头的分支,在肠系膜上动脉内上方腹主动脉左侧壁切除左腹腔神经节及其向胰体尾的分支。
B减压:术前可给胃肠外营养支持(TPN),有糖尿病者应控制血糖稳定在正常范围内。有黄疸者应用保护肝脏药物、利胆抑酸制剂、维生素K及止血药3~5d,同时亦应合理使用抗生素。
术式简单安全仍是Oddi括约肌成形术和胰管口成形术。日本学者提出主胰管大于10mm可行胰管空肠Roux-Y吻合术。Delcore等提出大于5mm者均可作胰管空肠侧侧吻合术,两组术式在短期内腹痛可完全缓解。通常根据结石梗阻的部位或狭窄段而行的术式如Du Val法,即胰体尾切除加空肠Roux-Y吻合,适用于胰体尾部主胰管扩大,近端有狭窄或结石,可行胰体尾部加脾脏切除,从胰腺断面扩张的胰管插入硅胶管,行胰尾空肠端Roux-Y吻合,胰管插管经空肠戳孔引出体外。
Whipple法即胰头十二指肠切除术(保留幽门)ERCP检查造影头内胆总管呈鼠尾状,较大而光滑的狭窄,黄疸时轻时重,呈持续性胰头癌难以排除可行此术,效果较满意。
还有Partington-Rochelle法,即主胰管空肠侧侧吻合术,Frey法即胰头大部挖除附加主胰管空肠侧侧吻合术,Beger法即保留十二指肠胰头切除术,Puestow法即胰空肠纵行吻合法,Puestow-Gillesbly法即空肠袢套入整个胰腺,Warren法即胰管胃侧侧吻合术,以及全胰切除术等均有报告,但疗法并不高于胰管减压。胰空肠Roux-Y吻合术,尤其全胰切除术创面大,渗血多,终身需依赖胰岛素,弊多利少,现多弃用。
(四)并发症的处理
常见的并发症有胰腺钙化、囊肿、胆道梗阻、消化性溃疡、肝硬化、区域性门静脉高压症、胰源性腹水、胰功能不全、恶性变、肾病等,皆采用对症处理,现简略述之。
1.胰腺囊肿 分真性与假性两类。真性多为潴留性所致,囊壁可见胰腺上皮组织,也有随着囊肿体积不断增大,囊肿衬覆上皮脱失,由炎性结缔组织取代,此时又常误为假性囊肿。假性囊肿为急性胰腺炎或胰腺外伤后胰腺渗出液积于胰周为纤维组织包绕形成的囊性肿块,无胰腺上皮组织。假性胰腺囊肿约占全部胰腺囊肿的80%,而慢性胰腺炎大部分为真性囊肿,小部分为假性囊肿,85%为单个。自有B超和CT特检以来,慢性胰腺炎中常发现多个小囊肿,且无症状,可自行消失。大囊肿直径可由数厘米到十余厘米,可压迫胃、幽门或十二指肠近端、屈氏韧带区以及横结肠,引起不全或完全性梗阻。囊肿内胰液泄漏到腹腔可引起胰性腹水,内含活性淀粉酶。囊肿穿破邻近器官如胃或结肠可形成内瘘。囊肿内胰酶可腐蚀囊壁内小血管,引起囊肿内出血,腐蚀邻近大血管可引起消化道出血或腹腔内出血。故对较大的囊肿应及早手术治疗,可行内引流,疗效较好。若体质差,病情危笃,亦可在B超或CT定位下经皮穿刺置管引流。疑有恶性变者可行外引流或外引流加囊肿切除术。
2.胆道梗阻 在慢性胰腺炎中占8%~55%。慢性胰腺炎易产生胰头纤维化,造成胆道下端的狭窄,从而引起轻重不同的梗阻性黄疸。而疼痛、胆肿大均不及胰腺癌时重,穿刺活检组织可助鉴别。此类病例常合并糖尿病或糖耐量试验表现为阳性征,也有在作B超或CT时发现阻塞胆管或胰管出口处有结石阴影。临床上约30%的慢性胰腺炎发生黄疸,碱性磷酸酶可升高,胆道X线造影检查有部分可出现弥漫性串珠状对称性狭窄,其近端扩张,很少出现完全梗阻,故腹痛较胆石病致胆道梗阻时轻。治疗原则是清除致病因素,解除梗阻。
3.消化性溃疡 Vantini等报告慢性胰腺炎合并消化性溃疡者占2%~20%,国内报告较少。然而慢性胰腺炎和十二指肠溃疡之间有因果关系,其机理尚不完全清楚,可能由于胰腺外分泌腺萎缩或分泌受阻,进入十二指肠的碳酸氢盐浓度降低,中和胃酸的能力下降,以及胃泌素类激素的过多分泌,小肠抑制胃酸分泌机理的阻断或胃泌素抑制多肽减少等所致。可用H 2受体阻滞剂进行治疗,在非手术治疗无效时,可行胃大部切除术,疗效较好。
4.胰源性区域性门静脉高压症 2026年,Madsen报告脾静脉栓塞病例中胰腺炎占65%。慢性胰腺炎组织学改变越重,导致脾静脉损害也越重,主要是胰腺长期发炎和纤维组织增生压迫血管,引起狭窄、痉挛、血流缓慢和内膜损伤,脾静脉血栓形成,致门静脉高压,也有称之为“左侧门脉高压”。有文献报告胰腺体、尾部的假性囊肿是导致脾静脉栓塞的一个常见原因,其中10%~20%可继发区域性门静脉高压症和胃底静脉出血。然而脾静脉栓塞时有较广泛的侧支循环回流至门静脉,因此区域性门静脉高压症的病人并发上消化道出血者不多,又因常在胃底黏膜下曲张的静脉或十二指肠上的异位曲张静脉破裂出血,临床又常误诊为十二指肠溃疡出血。本病以脾切除术可以降低门静脉压获得疗效,但因其系慢性胰腺炎纤维化改变或系假性胰腺囊肿所致,虽单纯切除脾脏仍有一定困难,若胰体、尾或囊肿一并切除,可能还容易成功,这不仅降低门静脉压,且对原发病灶也予解除。
5.胰腺内分泌异常 由于胰腺组织的破坏约60%的慢性胰腺炎出现异常糖尿病曲线,若伴有钙化的慢性胰腺炎病人75%继发糖尿病,慢性胰腺炎的胰β细胞不像原发性糖尿病那样呈进行性广泛坏死性病变,故β细胞应有一部分是正常的或仅有功能受损释放胰岛素不足而生长抑素的分泌正常,胰高血糖素的分泌相对增加,所以有1/3的病人出现显性糖尿病,1/3的病人有糖代谢障碍,显示糖耐量曲线异常,应属隐性糖尿病,在不注意饮食时就容易发展为显性糖尿病。轻度血糖升高,可注意饮食调理,如空腹血糖大于11.1mmo L/L(200mg/d L),或餐后血糖在16.65mmo L/L(300mg/d L)以上,则需治疗,可先服降糖药,若无效则需行胰岛素替代疗法。
第五节 胰腺占位病变的诊断和检查评估
胰腺癌早期缺乏特异性症状,诊断困难,且常与肝炎、胰腺炎、胆石病、胃病、肝癌等相混淆。胰腺癌恶性程度高,进展迅速,待确诊时多属中晚期,切除率低,预后差。
临床上主要表现为上腹疼痛,饱满不适,或隐痛,钝痛,胀痛。食欲不振,尤不喜油腻和高蛋白质食物,体重减轻,消瘦,由于餐后刺激胆胰分泌而其出口有肿瘤梗阻,胆道、胰管内压力增高可使疼痛加剧。黄疸出现是胰头癌的特征性症状。也可在早期出现,则为壶腹周围癌,大便颜色随黄疸加深而变为陶土色,小便颜色深黄甚至变为酱黄色。由于皮肤黄染引起皮肤瘙痒致遍体抓痕。胰腺癌疼痛剧烈,常牵涉到腰背部,持续不缓解,日夜不安十分痛苦时,多为晚期,常出现腹水、肿块。胰腺癌位于头、体、尾部,除体尾部癌黄疸不明显,其他症状均相同。胰腺癌早期诊断不易,主要靠临床医师提高警惕性。目前国内外学者正在努力发现小胰癌。小胰癌指直径小于2cm的肿瘤,其方法有监测好发人群,争取早期发现,注意早期症状,重视实验室监测与特殊检查。
一、血清生化学检查
一般常用的转氨酶、胆红质、淀粉酶、碱性磷酸酶等只有在胆道梗阻时才见升高,不适用于早期诊断。Moossa认为空腹高血糖可见于早期胰腺癌,借以发现了80%可切除的病例,因此结合临床症状如发现空腹血糖及糖耐量试验异常应考虑有胰腺癌的可能。
血清胆红质和谷丙转氨酶不是平行升高或下降,而呈相反向波动,结合临床有参考价值。Reddi报告胰腺癌病人血清核糖核酸酶(RNase)多增加。有人采用凝胶双向电泳加以银染色法测定胰液蛋白,提示胰癌病人胰液中白蛋白、α-抗胰蛋白酶和转铁蛋白均较健康人明显提高,Saton认为此项检查有助于诊断胰腺癌。半乳糖转移酶同工酶的测定如与B超、CT、ERCP配合应用则其阳性率可提高。
二、免疫学检查
1.癌胚抗原(carcino embryonic antigen,CEA) Kalser等人报告胰腺癌病人血清CEA值超过2.6ng/m L占68%,CEA对早期胰腺癌升高不明显,故对胰腺癌诊断缺乏特异性,观察CEA的动态变化对胰腺癌的预后估计有一定意义,肿瘤切除后可降至正常,胰腺癌复发时可再度升高。
2.胰胚抗原(pancreatic oncofetal antigen,POA) POA分为大分子量和小分子量两组,大分子量组对胰腺癌的诊断阳性率稍低,小分子量阳性率高,新津Nishida报告POA大于1 500U者,胰腺癌占81%,POA测定亦可用于监测胰腺癌的治疗效果,在肿瘤切除后POA明显下降,复发时POA上升。近年有实验证明POA的特异性并不高,应与其他检测组合应用价值高。
3.CA19-9 是一种与消化道癌相关的抗原,由单克隆抗体所鉴别。目前被认为是胰腺癌的重要标记物之一,可作为诊断胰腺癌的一种方法。对鉴别胰腺癌(阳性率占85%)与慢性胰腺炎(阳性率占15.4%)有明显差别。
4.胰腺癌特异抗原(pancreatic specific antigen,Pa A) 是Loos等于2026年由正常胰腺精制的抗原物质,正常人血清Pa A值小于21.5ng/m L,胰腺癌的阳性率70%,胰腺炎和一些腺癌也有假阳性。
5.白细胞黏附抑制试验(leucocyte adherence inhibition test,LAIT) 是Halliday 2026年提出的免疫检测方法,白细胞具有黏附于清洁玻璃表面的能力,这种特性能被相应的抗原所抑制。Douglass2026年报告LAIT对胰腺癌有一定特异性。
有关胰腺癌的免疫学诊断至今尚未找到具有高度特异性的检测方法,可能与胰腺癌具有多种类型有关,故仍需多种检测方法联合应用,以提高阳性诊断率和特异性。今后如制出具有特异性的单克隆抗体,可望提高胰腺癌的诊断和治疗效果。
三、影像学诊断
1.B超检查 阳性率可达80%,可发现直径小于2cm的小胰癌,但易受气体、肥胖等因素干扰。日本后藤由夫采用直线电子内窥镜超声波(LEus)诊断胰腺疾病,该法可隔着胃后壁近距离检查胰腺,不仅避免了腹壁肠道气体、肥胖的干扰,而且振子周波数的增加,大大提高了对病变的分辨能力。LEus具有定位准确,充分显示病变的优点。
2.电子计算机X线体层扫描(CT) Fitzgerald等报道CT诊断阳性率为94%,可发现最小肿瘤直径为1.0cm,但不易与慢性胰腺炎鉴别。Dickey等提出在CT引导下经皮穿刺胰腺活检诊断胰腺癌,能准确抽取标本,且可重复取标本,并发症少,是一项较好的检查方法。
3.内窥镜逆行胆胰管造影(ERCP) 对胰腺癌的诊断有重要价值。经ERCP可直接观察胰头病变,进行活检,收集胰液进行细胞学、生化、酶学的检查。ERCP对胰腺癌诊断的准确率较高可达89%~95%,假阳性有21%,因此胰腺癌的确诊还不能单独依靠ERCP,必须综合分析。
4.经皮肝胆管穿刺造影(PTC) 对确定胆管梗阻部位和性质有较高价值,PTC与ERCP联合应用更有助于诊断。
5.血管造影 在日本已定为诊断胰腺癌的常规。阳性率大致在60%~90%之间,动脉造影可诊断直径小于2cm的胰癌,通过血管造影可以判定肿瘤的大小,浸润的范围,有无肝转移等,并可决定手术适应证和手术方式。
6.胃肠钡餐检查 目前采用低张十二指肠造影可将阳性率提高到80%~90%,但区别胰腺癌与慢性胰腺炎仍有一定困难。
7.胰腺同位素扫描 Fitzgerald等报道胰腺癌同位素扫描的阳性率为31%。
四、细胞学检查
近年来国内外有较多的报告采用细针穿刺细胞学检查诊断胰腺癌,在B超、CT、ERCP、PTC或血管造影引导下经皮肤穿刺,或在术中直接穿刺,阳性率为87%~100%。这是一项简易、快速、安全的方法,严格的细胞学标准可防止假阳性发生。
第六节 胰腺癌的分期和预后
胰腺癌病程的分期,仍广泛沿用TNM系统。2026年是采用国际抗癌协会(UICC)以及美国癌症联合会(AJCC)TNM的分期法,多数部位的其他分期方法都被移化为此系统,给每一个癌都指定一个为其原发部位所特有的TNM分期。正确的分期很重要,癌症的分期需要了解癌症的生物学行为和准确记载的程度(表21-4)。
表21-4 胰腺癌按TNM系统分期

2026年9月修订的日本胰腺癌规约外科分期,分期客观、准确,有利于术式选择与疗效制定(表21-5)。
表21-5 外科分期(surgical stage)
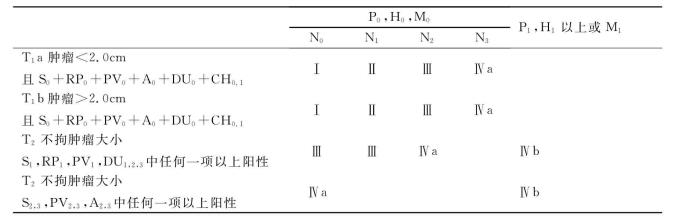
注:肿瘤大小以主病灶最大径×直角方向径×厚(cm)用TS来表示;TS1:最大径≤2.0cm,TS2:>2.0cm、≤0.4cm,TS3>4.0cm、≤6.0cm,TS4:>6.0cm;S:胰前方被膜,Rp:胰后方组织、器官,CH:胰内胆管;DU:十二指肠壁,PV:门静脉,A:动脉;0、1、2、3;表示有无浸润及程度,0:无浸润,1:疑有浸润,2:明显有浸润,3:高度浸润,波及其他脏器或管腔狭窄、闭塞;P:腹膜,P0:腹膜无转移,P1接近胰腺的腹膜转移,P2远处腹膜少数转移;H:肝,H 0:肝无转移,H 1:一叶有转移,H 2:两叶少数转移,H 3:两叶多数转移;M:腹腔外远处转移,M 0:远处无转移,M1远处有转移;N:淋巴结转移,N1:第1站,N2第2站,N3:第3站
2026年北京协和医院参考国外文献结合自己的经验,制定了简便的方法和分期与生存率关系(表21-6),实践证明胰腺癌肿体积大小与分期不成正相关,主要还是在于淋巴结有无转移及有远处淋巴结的转移(表21-7)。
表21-6 胰腺癌病程的分期

表21-7 胰头癌分期与生存率关系(1987)
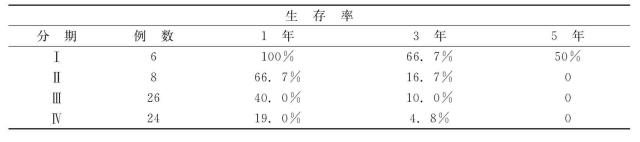
小胰癌是指直径小于2cm的肿瘤(T 1),然而,T 1肿瘤有很多病例已有淋巴结、血管、神经和胰周组织的转移。Tsuchiya分析了106例T1肿瘤病例,其中只有44%病例属第Ⅰ期。北京协和医院17例T 1病例中有胰被膜外肿瘤浸润的8例,其中有4例已侵及大小血管(S3),属4期,有淋巴结转移的是6例。因此,胰腺癌体积小并不等于是病程早期,只有Ⅰ期者才有意义。
第七节 胰十二指肠切除术
胰腺癌可发生于胰腺的任何部位,但以胰头部最多见,约70%左右,胰体次之,胰尾部更少,也有头体尾部均有之,属于弥漫性病变或多中心病变,胰腺癌以手术切除为主,按2026年修订的日本胰腺癌规约中将胰腺周围淋巴结分为18组,一、二、三站,手术时要求在第一、二站淋巴结廓清的基础上(根治2),再适当廓清第三站淋巴结(根治3)。胰头癌的淋巴结转移主要在胰头前后,肠系膜上动脉根部,横结肠系膜根部,肝总动脉,腹腔动脉周围,肝十二指肠韧带内等处的淋巴结,所以这些淋巴结应在廓清之列。小胰癌廓清到第二站淋巴结。这在日本和胃癌淋巴结廓清一样已列为常规手术。
胃周、胰周淋巴结组别号为图21-4~图21-5。胰腺癌淋巴结廓清的各站见表21-8。
表21-8 胰腺癌淋巴结廓清的各站

胰头部肿瘤主要是胰十二指肠切除术(Whipple’s procedure,Cattel,Poth或Child,术式)见图21-6~图21-9。手术切除范围应包括胰头、胰钩状突、胃窦、十二指肠、空肠上段,胆总管下段及局部淋巴结。胆囊切除或留置作吻合可因人而定。消化道重建需行胰腺残端和空肠、空肠和胆道、胃和空肠进行吻合。可结合病人和术前预定的方案、当时在术中探查情况而定手术的范围,一般胰体、尾癌出现黄疸,多为晚期,若有远处转移者多行姑息手术,或转化疗、放疗。
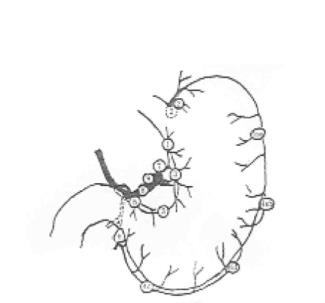
图21-4 胃周淋巴结级别号图
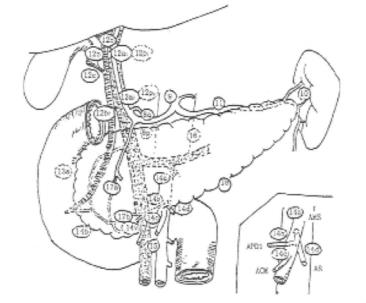
图21-5 胰周淋巴结级别号图
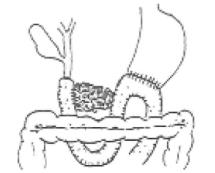
图21-6 Whipple法
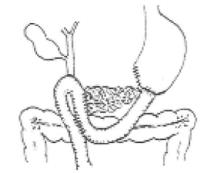
图21-7 Cattell法
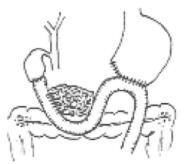
图21-8 Poth法
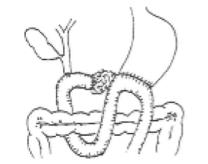
图21-9 Child法
近年来由于对围手术期治疗的重视,手术操作技术水平的提高,已使胰腺癌切除率明显提高,手术死亡率和并发症发生率明显减少。
一、围手术期治疗
(一)术前准备
胰头癌和壶腹周围癌多伴有梗阻性黄疸,病人呈贫血、消瘦、营养不良、低蛋白血症。可多次少量输新鲜血,必要时术前行TPN治疗,保证每日热量在3 500卡左右,蛋白质120g左右,术前维持1~10d,以增强病人对手术创伤的耐受力,对降低手术并发症和手术死亡率有重要作用。至于减不减黄,仍应视病人具体情况而定。我们认为减比不减好。胰腺癌一旦出现黄疸,表明癌肿发展已不是早期。胆道内压力增高可使肝细胞肿胀,胆汁分泌停止,影响代谢功能,继而波及其他器官的功能,胆汁在胃肠黏膜下堆积可减低胃肠黏膜抗酸能力,常出现应激性溃疡。术前可用西米替丁(cimetidinum),0.2~0.4g,一日3次。肠道内缺乏胆汁,影响脂肪及脂溶性物质的吸收消化,导致维生素K及依赖维生素K的凝血因子缺乏,容易发生纤维蛋白溶解现象使手术中创面广泛渗血,术前应常规补充维生素K 1 20~40mg/d及纤维蛋白原。肠道内胆汁的缺乏可使细菌移位,应合理使用抗生素。手术适应证为:①胰头及其周围的良性病变。②壶腹癌、胆管中下段癌。③恶性程度较低的胰头部肿瘤。④胰头癌癌肿尚未侵及幽门及十二指肠、胃周围第5、6组淋巴结。⑤胰头癌已不能做根治术,无远处转移的可行姑息性转流术。
胰体、尾部癌和胰体、尾部肿瘤和囊肿可做胰体、尾部切除。
(二)手术步骤
首选全麻,常用右侧经腹直肌切口,经腹腔探查能切除时可延长切口或加辅助切口,暴露视野,以便于切除。
当开腹后首先探查肝门,腹腔动脉周围,腹主动脉旁有无淋巴结转移,肿瘤大小,活动度、位置与周围大血管的关系。一定要探查胰颈部即胰头与钩状突之间与背侧的关系,即当开腹后游离肿瘤附近粘连的疏松组织,可以用右手深入捏住胰头与钩状突时,如果右手食指自胰腺上缘经背侧向下一右手拇指自胰腺下缘经背侧向上,二指尖可以碰拢或距2cm以内,可以有把握地切除肿瘤,反之如在2cm以上,则难以切除。即使冒一定风险,切除也难以彻底。从解剖上讲胰头与钩状突的背侧恰是门静脉、下腔静脉与肠系膜上静脉并行及部分小血管交错之处,若探查时示指、拇指不能碰拢,或大于2cm以上,表明该段粘连严重,有可能有小分支深入胰组织,故分离困难,若强行分离必会损伤血管,引起大出血。也有报告连同粘连的血管一并切除,再作血管移植吻合,此效果是否彻底值得研究。若小于2cm或示指拇指可碰拢,表明粘连不严重,即使严重也只侵犯血管段在2cm以内,损伤的血管是可以修复的。
在决定切除胰头癌时,首先沿十二指肠降部将后腹膜剪开,以钝锐性手法将下腔静脉、右肾静脉显露出来,避开,向左暴露出胰头部。此处有较多的小血管分支,应以电灼离断,如有较粗的血管可加缝扎一次。如果胰头不能游离出来可不再游离,而自胃小弯及十二指肠上部打开肝胃韧带,自胃小弯向两侧离断血管,留大弯侧作吻合用。断胃,利用远端胃及十二指肠球部向下牵拉可显露胆总管,空肠起始部,如此处粘连不紧,可尽量切断胆总管远端,如此处粘连包裹甚紧,暂可放置。转向游离十二指肠升部屈氏(Treitz)韧带区,自胃后壁进入小网膜腔将空肠起始部及十二指肠水平部一起沿此腔向右牵拉,注意勿伤及结肠中动、静脉,此时可显露胰头、胰体后腹膜。虽胰颈背侧粘连未能游离,但胃、胆总管、上段空肠已断,可自肿瘤边缘向中心游离,其背侧重要血管多已显露,则可自胰颈后方向门静脉方向做钝性分离,应轻巧缓慢,逐步仔细向上分离,切忌动作粗暴,急于求成。术者可以右手指从胰腺上缘向门静脉前方,肠系膜上静脉的方向分离,当右手示指、拇指可从胰颈上下缘碰拢汇合时,即表明上下可以穿通,则以7号粗丝线双股贯穿分开结扎,牵吊胰腺,用小手术刀切断胰颈右侧胰组织,胰体留下,整块肿瘤组织及其周围相邻的组织一并取出,再根据具体情况,廓清一、二站或三站的淋巴结,重建消化道,其法可依术者的熟练术式选择。
(三)术后处理
①术后禁食72h以上,持续胃肠减压至可进流质时拔除胃管,补充血容量,输能量合剂、新鲜血液、维生素C和维生素K,抗生素治疗等,进入ICU病房,严密监护,测量生化,血气分析,淀粉酶等。②预防出血和休克:此类手术创伤大,手术时间长,多有肝功能损伤,凝血机制障碍,易渗血,或手术中出血量多,术后病人易出现休克症状,故要预防出血和休克。③引流管的处理:胰肠、胆肠及其他间隙处,置放的引流管一定要分别接无菌引流袋,并保持引流通畅,要记各管引流量、颜色以及有无混浊,系何内容。一般引流顺利可在术后7~14d逐渐退出,拔管前应左右旋转前后扭动,以防拔管时损伤附近脏器及粘连组织。若某处引流管引流液多,则不应急于拔除,若疑有吻合口瘘,更应延期拔管。
二、术后并发症
1.出血 胰十二指肠切除术后出血发生率在6.2%~9.5%左右。出血可分早期(指术后48h以内,含术中出血),晚期(指术后48h至2周)。术后出血多为黄疸较重的病人,其凝血机制不佳,常因出血不止发生休克。晚期出血多为胰瘘和双重感染,甚至胰液或感染侵蚀血管致大出血。故应早期预防,一旦出血,病死率在60%左右。
2.胰瘘 为胰十二指肠切除术后最严重的并发症之一,发生率10%左右,有报道高达40%,其死亡率以往可达50%~60%,现用善得定和TPN、TEN的营养支持,胰瘘的闭合率可达98.2%,死亡率降至3%以下。胰瘘的发生多在术后5~7d,病人出现腹胀、腹痛、高热、黄疸加重和腹腔引流量增多或混浊。引流液查淀粉酶增高可确诊。由于其病情严重,死亡率高,故早期预防尤为重要,而预防的关键在于术前肠道清洁的准备和预防性合理应用抗生素、术中胰空肠吻合方法的选择和术式的改进。归纳目前胰腺残端处理方法有3种:即胰腺残端与空肠端端套入法、胰空肠端侧吻合法、胰腺残端胰管栓塞法或残端缝合闭锁,或胰管结扎法。各法均有利弊,作者常用套入法。近20年来已施行34例,术后有2例发生胰瘘,1例应用善得定,1例瘘管用60钴(60 CO)照射均完全闭合,随访19个月及38个月均未复发。现将套入法介绍如下:当胰腺肿块已切除,剩下胰体残端,显露主胰管,在其上下缘各以褥式缝合1针,线尾不剪,连针自空肠腔内穿出,再将另一线尾空针,同法将此线尾自空肠腔内穿出,利用此二根线尾尽量牵拉胰体进入空肠腔内约8~10cm,胰管以硅胶管支撑,引流胰液自空肠壁穿出至腹壁外,吻合处另置管引流7d后无液体流出,病人无瘘的体征时可拔除。值得注意的是,胰瘘与感染有关,感染可以增高胰瘘的发生率,胰瘘可加重感染的程度,一旦发生应保持胰液引流通畅,禁食,使用善得定(生长抑素)0.1mg,每12h1次,皮下注射,共5d。抗生素及营养支持疗法同时应用,胰瘘可治愈。
3.胆瘘 发生率在5%左右。常见于术后5d以内,病人引流管液体增多,色黄,碱性胆红素增加。临床出现右上腹胀,疼痛,高热及右上腹膜刺激征。预防是在胆肠吻合时使胆管嵌入肠腔内,在肠壁浆肌层加固3~4针,一旦发生胆瘘,因有引流管引流胆汁,就如T形管引流胆汁一样,经观察胆汁引流量逐渐减少时,始可拔除,瘘口多可自行愈合。
4.腹腔感染 发生率在5%~10%,多在出血后、胰瘘、胆瘘,或腹腔引流不畅、肝功能差,术中出血多或手术时间长等情况下发生。临床表现为发热、腹胀、腹痛、肠鸣音减弱、疲乏、衰弱。预防感染在于抗生素的合理应用,保持引流通畅。如诊断确立,则应加大广谱抗生素的剂量及三联药物的应用,保持引流管通畅及局部抗生素液的冲洗,全身支持疗法,输少量新鲜血液,注意心肺肝肾器官的中毒和衰竭,必要时进行ICU监护。
第八节 不能切除的胰腺癌的手术治疗
若胰腺癌晚期,已有多处淋巴结转移,或全身情况差,难以耐受根治性手术,则施行转流手术。术后还需结合病人具体情况,应用化疗、放疗及中医治疗。而转流术有胆囊空肠吻合术、胆总管十二指肠吻合术、胆总管空肠吻合术、胃肠吻合术以及胆肠吻合加胃肠吻合术,即双旁路手术。术式较多,各有利弊,归纳而言有胆囊旁路和胃肠旁路两类,需根据病人全身情况选择安全、简单的术式。一般此类病人多引起胆管梗阻和胃肠梗阻,仅有5%~15%无梗阻性黄疸,而有胃肠梗阻者也仅10% ~15%,故解除梗阻性黄疸占大部分,少数病例需解除胃肠道的梗阻。作者认为若以肿大的胆囊与空肠侧侧吻合是不够的,应加以空肠侧侧吻合术(即Braun吻合),这样可避免食物返流,减少感染机会,尤其对危重病人不允许手术时间拖长。全麻有禁忌时,用局麻也可完成此术。如以胆总管十二指肠吻合,则返流机会多。有人主张改用间置空肠,这将增加手术时间,增加吻合口感染和漏的机会,对危重病人不利。武汉大学中南医院的病例多偏重于行胆总管空肠Roux-en-y吻合。有作者提出加一内套叠或加一个人工瓣膜,以防肠内容返流。事实上,对这类病人不应多作操作,不只是手术时间的长短问题,而是有时在技术不熟练的情况下反增加可避免的并发症,如感染、出血、梗阻。值得注意的是在做Roux-en-y术式时应尽量使近臂远臂靠拢,两边肠袢加缝2~3针,近端肠管断端与远端侧壁吻合呈马蹄型,使“Y”型近端肠管内容向远端顺蠕动向前推进,而决不可呈“T”型使肠内容向近远端分流。至于有因肿瘤压迫胃肠道梗阻,则应行胃肠侧侧吻合,或加空肠Braun吻合。如果曾行钡餐检查或胃镜检查提示十二指肠有狭窄、受压、变形、僵硬,或有癌性浸润可疑征象者,不应等有梗阻才做胃肠吻合术,如病请允许,应在行胆肠吻合的同时,一次完成预防性胃空肠吻合术,以延长病人生命,提高生存率。
对一些经手术探查已不能切除的胰腺癌病人,可以放置永久性动脉插管进行术后化疗,可减轻疼痛和延长病人生命。胰头癌病人的插管方法是:先解剖出胃网膜右动脉,远端细线结扎,动脉上切开一小口,将泵及导管内已充满含肝素(1m L内含肝素100~200单位)的导管插入动脉,直到胃十二指肠动脉根部,泵内注入2m L美蓝,胰头部位呈现蓝色后固定导管,并将泵固定于皮下。胰体部的肿瘤,可将导管自胃网膜右动脉插入直到腹腔动脉,注美蓝后通过脾动脉胰体部亦可呈现蓝色。也可从胃左或脾动脉直接插管。
为暂时缓解晚期胰腺癌引起的顽固性腰背疼痛,可用5%的普鲁卡因油剂5~10m L或50%乙醇60~80m L注射腹腔动脉两侧内脏神经节阻滞,短时间(3~6个月)疼痛可缓解。
第九节 胰腺囊腺瘤和囊腺癌
胰腺囊腺瘤(cystadenoma)少见。2026年,compagno通过病理观察将胰腺囊腺瘤分为二类:①浆液性囊腺瘤(serous,cystic adenoma),其上皮细胞浆内不含黏液,但含有糖原。②黏液性囊腺瘤(mucinous cystic adenoma),其上皮细胞浆内不含糖原,但含黏液。此类囊肿本身或者是恶性的,或有潜在恶性的,在同一瘤体做病理切片时,可能某处为良性表现,而另一处又为恶性病变,因此良性的胰腺瘤一般是指浆液性囊腺瘤。临床上又称小囊性腺瘤。
临床表现:胰腺囊腺瘤多发生于老年女性病人,平均年龄为35~50岁,早期无特殊症状,病程长,待囊肿增大后才有症状或可在上腹部扪及肿块。如压迫胆管可出现黄疸,压迫门静脉则可引起区域性门静脉高压症,脾大,腹水,甚至食管胃底静脉曲张或破裂出血。压迫胃肠可以引起腰痛,消化道不全梗阻、出血、内瘘。由于囊肿侵犯大部分胰腺组织可使胰岛功能减低,部分病人出现糖尿病。
胰腺囊腺瘤与胰腺囊腺癌在临床上较难鉴别,恶性病人发展较快,体重减轻,消瘦,较早出现转移。从腹部X线照片可发现肿瘤有钙化,CT扫描钙化更明显,且可见囊肿有分隔现象,B型超声扫描亦可发现多个囊性的改变。血管造影可见血管丰富,此为胰腺囊腺瘤的特点。有应用CEA、CA19-9、CA125检测囊腺瘤与囊腺癌的区别,胰腺囊腺癌显示上述3种测定值高于正常,尤以CEA升高显著。
粘连性囊腺瘤有恶变的潜在性,但其恶性程度较低,所以手术切除是治疗胰腺囊腺瘤和囊腺癌的唯一方法。其预后与胰腺癌有很大差别,因肿瘤多生长在胰体尾部,故手术切除率高,5年生存率也较高,但不宜做单纯摘除,应警惕为恶性病变,故切除范围要扩大,组织切片要取不同方位,多处取材送病理检查,以防囊腺癌漏诊。
第十节 胰腺内分泌肿瘤
一、胰岛细胞瘤的诊断和定位诊断
胰腺细胞分泌有α、β、δ…12种以上不同的肽激素,至少目前已发现8种(表21-9),临床上常以此激素命名,表现是由一种主要激素所致。
表21-9 胰岛内分泌肿瘤类型及产生的综合征
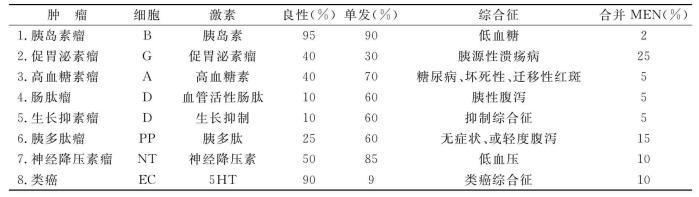
(摘自北京协和医院外科)
1.胰岛素瘤(insulinoma) 为胰岛β细胞瘤,占胰岛细胞肿瘤的70%~75%,大多数为良性,恶性率小于10%。90%为单发,10%为多发,多数肿痛直径1~2cm,切面像淋巴结,电镜下部分肿瘤细胞含典型的β细胞分泌颗粒,免疫组化显示绝大多数胰岛素瘤为抗胰岛素抗体免疫反应阳性。
临床症状:由低血糖所致的脑组织缺乏葡萄糖所引起的昏迷、癫痫发作型或阵发性的神经失常,见于心慌、出汗、面色苍白、脉快等为低血糖诱发儿茶酚胺释放引起的症状。多在空腹饥饿时发作,给口服或注射葡萄糖后立即消失。Whipple指出:①多数病人发病时血糖在50 mg%以下。②常见于早晨空腹时,或剧烈劳动后自发性周期性发作的低血糖症,昏迷及神经精神病症状。③发病时口服食糖可减轻症状,静脉注射葡萄糖可立即制止发作,典型的体征又称为Whipple三联征。
2.胃泌素瘤(gastrinoma) 为胰岛δ细胞肿瘤,仅20%~30%属良性,其特点为高胃泌素血症,基础酸分泌(BAO)大大增加,80%左右的病例BAO大于15mmo L/h,在减酸手术后BAO大于5mmo L/h则更有意义,最大酸分泌MAO与基础酸分泌差别缩小,70%以上胃泌素瘤病人BAO/MAO大于0.6,夜间胃液量常超过1 000m L,酸量超过100mmo L。血清胃泌素的测定,正常值为200pg/m L以下,大于500pg/m L即可诊断,大于1500pg/m L常提示肿瘤有转移。2026年Zollinger 和Ellison报告2例原发性空肠溃疡合并胰岛非β细胞瘤,故以后临床常称为卓—艾氏综合征(ZES)。主要临床表现为消化性溃疡和腹泻,常有溃疡病术后复发史,为20%~25%,有60%并发溃疡出血、穿孔、幽门梗阻,约10%的病人以腹泻为主。临床上对于可疑病人可行激发试验,常采用有胰泌素、钙、蛙皮素以及标准试餐等试验。
3.血管活性肽瘤(vasoactive Intestinal poly peptide tumor,而称VIP) 又因临床表现为大量水泻低钾及胃酸缺乏,亦称WDHA(water diarrhea,hypokalemia,achlorhydria syndroma),又称胰性霍乱。其临床特点是大量水泻,脱水,低钾,低镁,腹泻量多,24h内可排1~6L,以致出现无力、恶心、呕吐、抽搐、腹痛等。也有报告为肢端肥大症的表现。
4.胰高血糖素瘤 由α细胞所致,临床少见,表现为坏死性迁移性红斑的皮肤改变,红斑形态不变,先起红斑后生水泡,泡破结痂,愈后有色素沉着,而误诊为皮肤病,其次有口角、唇、舌等部位的慢性炎症以及指甲松动等。
5.生长抑素瘤 为胰岛D细胞发生,由于该肿瘤分泌大量生长抑素,使胃酸及胰内分泌受到抑制,临床上可见低胃酸、贫血、消化不良、脂肪泻等。
二、诊断
因其症状多样,常被误诊为神经官能症、癫痫、精神分裂症、植物神经功能紊乱、脑病等。误诊的主要原因是对本病认识不足。因此要深入了解病史,确定是否由低血糖引起,是否是由高胰岛素血症引起,是否符合Whipple三联征,进一步明确肿瘤的部位。
定位诊断:
现代影像诊断方法的进展已能将1cm以上的肿瘤发现,而1cm以下的阳性率仍偏低。由于临床医师们对这些肿瘤的认识水平的提高,而且利用测定血清激素的方法可较早发现肿瘤。当前在定位诊断上仍然以下列方法为主:
(1)B型超声诊断:因胰腺解剖位置所定B超检测胰腺时需喝较多的水,使胃壁撑起,否则观测胰腺是不够清晰的,尤其在1cm以下较小的肿瘤常易漏诊。当今已有腔内超声,包括超声内窥镜在诊断上是有帮助的,已有报告对位于胰头部和十二指肠壁的促胃泌素瘤,诊断效果较好。近年来有提倡术中超声定位,若与有经验的B超医师合作,遗漏极少,此法简便,无创伤,费用少。
(2)选择性血管造影(SAG):阳性率可达80%,其优点还可发现多发病变和肝转移。有报告如在注射造影剂后采用CT扫描两者结合阳性率更高,北京协和医院还报告用选择性动脉插管造影或选择性的分别在脾动脉、胰十二指肠动脉内注入促泌液素,然后经上腔静脉插管入肝静脉取血标本测激素,可以有助于诊断。对胃泌素肿瘤,在注药前后肝静脉血中促胃泌素水平有极显著升高,而且可根据促胰泌素注入的动脉,可以判断肿瘤位于胰头、胰体或尾部。
(3)CT若与SAG同时做,可提高阳性率,但CT、磁共振等除了价高数倍外,其检查的优点并不高于上述方法数倍,从理论上推测,在激发上述肿瘤大量的分泌时获得影像学的数据是可能的。
(4)经皮肝门静脉插管取血测定激素法(percutaneous transhepatic portal catheterization sampling,PTPCS)已有近20年的历史,日本医师介绍以每进0.5cm替代以往每进1cm抽血标本,有助于发现小肿瘤。美国Doppmam的经验,主张分别将超选择插管收集胰十二指肠上、下静脉,胰头周围的小静脉和脾静脉的小支血液测定激素,以发现小的肿瘤。如胰岛素瘤,门静脉系血样中的胰岛素浓度高于同时周围静脉血50%以上,即可确立诊断。
(5)其他:术中B型超声检查,对触摸不到的,肿瘤对周围有无侵犯,指导手术切除的入路、方式和切除范围,鉴别是第二次手术时的瘢痕还是肿瘤,是有帮助的,但也需结合临床医师的经验,肉眼观察和触诊,互相结合从而避免盲目性胰腺切除,简化了术式及术后并发症,提高了手术治愈率。
对于胃泌素瘤的定位诊断至今仍较困难,B超与CT的诊断正确率仅20%~40%,选择性动脉造影亦在50%左右,PTPCS阳性率可达80%。
有助于诊断胰岛素瘤的还有测定血中前胰岛素和C肽的价值,PTPCS取血部位促胃泌素值100%高于其他部位,假阴性低于10%,但有假阳性。目前也只有在大城市较大的医院可以检查,一般基层医院目前仍难于开展,故诊断率偏低。
三、治疗
分手术治疗与非手术治疗。
1.手术治疗 唯有手术是胰内分泌肿瘤根治性的治疗手段,但至今进展不大,对围手术期有所重视,术前准备如胃液素瘤术前应用雷尼替丁或洛赛克,有效的抑制胃酸分泌,改善病人情况,VIPoma病人腹泻脱水,电解质紊乱用抑生长素有显效,对拟切除脾脏的胰体、尾部切除术,有报告术前可注射一种疫苗(pneumovax)防止脾切除术后凶险性感染。术中探查肿瘤时主张手法加术中B超可靠。对胃液素瘤,由于有较好的抑制酸制剂,已不再主张全胃切除,可减少病人痛苦和术后的营养障碍。
2.非手术治疗 主要以药物治疗。对促胃泌素瘤应用H 2受体对抗剂,甲氰咪呱已为雷尼替丁所替代,1.2g/d,300mg,q6h,法莫替丁0.25g/d,60mg~80mg,q6h,洛赛克(omeprazole)是H+—K+ATP酶抑制剂,即酸泵抑制剂,作用很强,用量应依据用药后胃酸降低的结果增减,一般晨服60mg,如果酸仍高于20mg/h,则需12h给60mg,此剂量远远高于一般溃疡病人的治疗量,由于此药在酸性环境中不稳定,故首次剂量应先服雷尼替丁抑制胃酸分泌,后再用此药较宜。日本有报告用法莫替丁较洛赛克经济,显效时间长,副作用少。
对不能摘除或根治的胰内分泌肿瘤的药物有:
(1)链尿霉素(streptozotocin):多用于恶性胰岛素瘤,毒性较大,单用仅20%~30%有效,与5-Fu及tubercidin合用有效率可提高一倍半。
(2)阿霉素与干扰素合用,疗效在30%~45%。
(3)善德定(sandostatin),为商品名,药名应为octreotide,又称SMS-201.995,比自然的生长抑素强70倍。文献已有报道,对胰腺恶性肿瘤有效,副作用有激发胆石的发生。但价格较贵,疗程长时要加量。SMS虽有效果,但仍属姑息性治疗。
近10年来对已转移至肝内的胰内分泌肿瘤施行肝动脉分次栓堵,效果较好,表现为症状改善,肿痛消退,分泌的激素减少等。当前还有用化疗栓泵定期注入化学药物,一般15~30d为一疗程,4次为一疗程,近期有效,远期疗效尚等观察。
(史海安)
参 考 文 献
1 Nordbac k,I.Paajauen H.Sand J.Prospective evaluation of a treatment protocol in patients with severe acute necrotising pancreatitis.Europ.J.Surg,1997;163(5):357
2 Matsushita M.Hajiro K.O.Kagaki K,et al.Gastric aberrant pancreas:Eus analying in compari-son with the hiotology.Gactrointest Endosc,1999;49(4):493~497
3 Bassi C,Falconi M,Bonora A,er al.The role of Surgery in the majar earty compliclficon of severs acute pancreatitis.Europ J Gastroenter Hepat,1997;9(2):131
4 Halonen KI,Leppaniemi AK.Puolakkaninen PA,et al.Severe acute pancreatitis:Prognostic factor in 270 conrective patients[J].Pancreas,2000;21(3):266
5 Appelros S.Lindgren S.Bergstrom A.Short and long term outcome of severe acute pancreatitis [J].Eur J Surg,2001;167(4):281
6 Sultan S.Baillie J.What are the predictors of post-ERCP pancreatitis,and how useful and they?[J]Jop,2002,3(6):188~194
7 Dittrich E,Schmaldiemrs S.Langer M,et al.Immunoadsorption and plasma exhange in pregnancy[J].Kidney Blood Press Res,2002,24(4):222~239
8 Algul H.Tando Y.Schneider G.et al.Actu experimented pancreatitis and NF-KappaB/Bed activation[J]pancreatology,2002;2(6):503~509
9 全国第七届胰腺外科手术研讨会论文汇编.成都,1998;9:6~9
10 全国第八届胰腺外科手术研讨会论文汇编.杭州,2000;53~63
11 全国第九届胰腺外科手术研讨会论文汇编.大连,2002;30~48
12 史海安.胰腺瘤的诊断与治疗进展(专家座谈会)中国实用外科杂志,1995;15:245~247
13 史海安.慢性胰腺的并发症.中国实用外科杂志,1997;17:202~203
14 史海安.胰腺疾病.见夏穗生主编.疑难普外科学.武汉:湖北科学技术出版社,2001;539~563
15 史海安.慢性胰腺炎.见高德明主编.现代急腹症学.北京:人民军医出版社2002;573~579
16 钟守先.胰腺外科.长沙:湖南科学技术出版社,1997;346~393
17 张圣道.重症急性胰腺炎诊治草案(2026年杭州会议).[J]胰腺病学,2001;1(1):46~48
18 赵玉沛.重症急性胰腺炎诊治草案[J].中华普外科杂志,2001;16(11):699
19 高德明,主编.现代急腹症学.北京:人民军医出版社,2002;591~593
20 朱予,张太平.赵玉沛.胃泌素瘤.2002.大连会议汇编56~571
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







