第二十章 胆道外科
第一节 胆道系统检查
肝胆胰外科近20年的迅速发展,得益于许多新的影像诊断技术的发现与临床应用,使临床诊断更加客观、科学,使相关病人得到早期诊断和及时的治疗。20世纪70年代以前胆胰系统检查主要依靠腹平片、胃肠造影、口服胆囊造影剂及静脉胆道造影剂,其准确率较低。并且胰腺疾病还没有直接的影像学检查方法。20世纪70年代后,超声、经皮经肝穿刺胆管造影,内窥镜逆行性胰胆管造影,CT、MR投入临床,使肝胆胰系统疾病的诊断准确率有所提高。20世纪90年代随着螺旋CT、MR、CTVC及近年来无X线辐射、无创伤性的MRCP的使用,使影像的分辨率、观察视角大大提高,对胆系疾病的诊断准确率明显提高。
一、B型超声扫描
B型超声扫描(brighress-mode ultrasonography B-US)无创伤往往是胆道系统检查的首选方法。B超在确定胆囊结石和胆道扩张方面有特异性和敏感性。
B超对胆囊结石的诊断准确率达95%以上,可以检测出直径2mm以上大小的结石,表现为可随体位改变的强光团并后伴声影。但对小结石或胆囊收缩时,约50%的病人可呈阴性结果。B超对肝内胆管结石及胆总管结石其诊断准确率低于胆囊结石,肝内胆管结石为60%~90%,胆总管结石为70%左右。
胆道梗阻时,B超常常发现胆管的扩张,表现为肝内胆管显示;肝外胆管上段>5mm,中下段胆管>10mm,但偶尔有阻塞性病变的胆管并不扩张。B超还可以用于指导经皮肝胆管穿刺造影,术中B超可提高胆道系统疾病的诊断率。
二、经皮肝穿胆道造影
经皮肝穿胆道造影(percutaneous transhepatic cholangiogoaphy,PTC)是采用细针多从右肋穿刺,经肝实质进入胆管腔内,注入水溶性造影并拍摄X线片,可获得对胆管树由上而下的影像学图像,是临床鉴别肝、内外梗阻性黄疸梗阻原因和范围的重要措施之一。在诊断的同时可置管引流(percutaneous transhepatic cholagniography-drainage,PTCD),从而可以暂时解除胆道梗阻,降低胆管内压力,控制胆道感染,改善肝功能,PTCD也是晚期胆管恶性肿瘤不能手术切除时的姑息性治疗措施。
PTC为损伤性检查,反复穿刺,创伤性大,有发生胆汁漏、胆汁性腹膜炎、胆管炎、肝损伤、出血等并发症的可能性,发生率1%~7%,造影失败率约为10%。由于长期梗阻造成管腔内压升高,胆汁浓缩、炎症使胆汁黏稠等因素,造成胆汁与造影剂不易混合均匀,故易造成误诊或漏诊。为防止PTC并发症的发生,一般在术前1天作此检查,检查结束后尽量将造影剂抽出,并准备随时进行手术。目前此技术在临床已逐渐被无创伤性影像检查所代替。
三、经内窥镜逆行胰胆管造影
经内窥镜逆行胰胆管造影(endoscopic retrograde cholangiopancreatograsphy,ERCP)是通过十二指肠侧视镜直视下向十二指肠乳头开口处插管,注入造影剂显示胰管及胆管,并拍摄X线片。在怀疑胆总管下端结石和壶腹周围病变的诊断中,是一种常用的理想的检查方法,可以直接观察十二指肠有无占位性病变,并可进行活检。通过ERCP也可行Oddi氏括约肌切开(endoscopic sphincterotomy EST),取出胆道结石;或置入支架引流胆汁减黄。
ERCP技术要求高,有一定痛苦,可发生化脓性胆管炎、急性胰腺炎等并发症,并发症发生率为3%~5%。
四、CT及螺旋CT胆道造影术
诊断梗阻性黄疸时,可因腹部手术后,肥胖或无法进行肠道准备而使B超不能满意诊断,CT可作为首选。此外,CT对梗阻性黄疸诊断可进一步判断梗阻的部位和原因。根据梗阻平面的高低,胆管扩张的平面亦不同,如果梗阻在胰腺平面,则胆总管、肝总管以及肝内胆管都扩张;如果梗阻在肝门平面,则只有肝内胆管扩张。CT发现胆管梗阻平面的准确性为97%左右。CT对于恶性肿瘤可直接显示肿瘤来源、侵犯范围、有无周围脏器及淋巴结转移,并可根据CT值,梗阻平面各个环的大小,最下环的形态综合分析作出诊断。
螺旋CT胆道造影技术(spiral CT cholargiograply,SCTC)是将螺旋CT容积采样技术与静脉胆系造影相结合,可获得胆管二维图像或三维图像。SCTC无创伤性;不受操作者技术水平的影响;由于要使用造影剂,相当于CT平扫与静脉胆道造影相结合的诊断效果,其结果与常规ERCP结果相似。可在监视器上旋转、多角度、多方位、多层面观察胆道正常解剖和病理结构,并对重点观察区域选择相应的层数或层厚重建,从而更好地显示胆囊内或胆管内结构及病变。但是当肝功能不全及血清胆红素过高时,都会使胆道内对比剂浓度过低而显影不佳。所以不适用于严重肝功能不全,血胆红素大于3mg的梗阻性黄疸。
五、磁共振和磁共振胰胆管成像
磁共振成像(magnetic resonance imaginy,MRI)于20世纪80年代应用于临床。它可得到任意方向断面的图像。尤其对软组织的分辨率高,能显示良好的解剖背景,且无放射性损害。但在对胆胰系统疾病检查中也主要是采用横断面扫描影像,故其胆胰病的应用及结果与CT基本相同,且其价格昂贵,扫描需较长时间,常受运动伪影干扰,因此非胆系疾病首选检查方法,只用于有特殊需要的检查。大血管因有流空效应,其影像在MRI上显示清晰,故常用于对胆道肿瘤与其周围大血管间关系的评估,特别是用于手术前的分析。
磁共振胰胆管成像(MR cholangio-pancreatography,MRCP)属于磁共振水成像技术(MR hydrography)之一,是近年来诊断胰胆管疾病的一种新技术,与B超、内窥镜逆行胰胆管造影(ERCP)和经皮肝穿刺胆道造影(PTC)等影像学检查方法相比较,具有快速、无创、安全简便、无需造影剂的优势。MRCP的成像原理是利用胆汁和胰液含水量高而具有较高质子密度,并与周围软组织在加权T2序列有良好对比的特点,通过突出静态液体信号,抑制周围软组织信号,使胰管及胆管树显现出直观清晰的图像,其结果是静止状态的液体(包括胆汁和胰液)均呈高信号,而实质性器官呈低信号。胰胆管等管腔内为含水液体所充满,周围则为实质和脂肪组织。在重T2加权时,管腔内的液体呈亮白高信号,而周围组织则呈黑信号,从而产生明显的对比,使胰胆管形态及走行清晰显示,使MRCP可获得类似于ERCP的影像学效果。
六、仿真内窥镜技术
用CT和MR获得原始容积数据,进行三维表面再现和容积再现,再利用计算机的模拟导航技术进行腔内透视,结合实时回放,达到类似光子纤维镜观察的效果。胆系仿真内窥镜主要是在MRCP 和SCTC的基础上经过图影工作站的特殊软件处理后得到胆管内间隙的内镜三维立体影像,显示胆胰管内腔。可分为螺旋CT仿真内窥镜与核磁共振仿真内窥镜。
仿真内窥镜其优点是无创伤性,无需插管及注射造影剂,无并发症,一次获得的数据可重复用多种方法,多轴位去观察。缺点是无法观察管壁、液体流动及不能进行和内窥镜治疗、活检。
七、放射性核素肝胆显像
放射性核素肝胆显像是用99m TC标记的亚氮基二乙酸(IDA)类药物及对抗高胆红素的吡哆醛氨基酸类衍生物99m TC-PMT等显像剂,被肝多角形细胞快速摄取后,排至胆汁内,胆汁内浓度高,肝内外胆管显示清晰,应用SPECT(或γ-相机)在注入显像剂后作连续多次动态显像,必要时延时显像,根据显像所见进行形态与功能定性、定量分析。这种方法主要用在急慢性胆囊炎、先天性胆道疾病、胆道功能失调症及黄疸的鉴别诊断。
(王卫星 王竹平)
第二节 非结石性胆囊疾病
胆囊疾病是胆道系统的常见病、多发病,也是一个世界性疾病,早在公元前2025年埃及的木乃伊中发现胆囊结石。我国亦在公元前167年马王堆西汉1号古墓中的女尸解剖发现胆囊内有胆固醇性及胆色素性结石,因此认为胆囊结石是有着悠久历史的古老疾病。早先,由于我国胆道感染、胆道寄生虫病多发,罹患胆道结石者较多,相对而言,胆囊结石多见于40岁以上的肥胖女性,即所谓胆囊结石发病的3F学说(forty fat female)。随着人民生活水平的提高,膳食结构的改变,高脂肪、高蛋白质、高糖、低维生素性膳食者增多,使代谢障碍,胆固醇合成过多,胆酸代谢也发生紊乱,从而改变了胆汁成分。使胆酸、磷脂、胆固醇三者比例失调,导致胆囊炎、胆囊结石的发病率增高。自20世纪50年代的36.4%,20世纪80年代的69.3%至上世纪末的79.9%。近年来静脉高营养的广泛应用,严重的全身感染、创伤、重症胰腺炎的发生等诱因,急性无结石性胆囊炎发病率亦有所增高趋势。加之检测手段的不断进展,B型超声、内镜超声,不仅使具有症状的病人得以确诊,而且毫无自我感觉的人群,胆囊疾病的发现率也有提高,使之胆囊疾病在腹部外科病人中占有重要地位,本节将对此类疾病相关问题进行探讨。
一、急性无结石性胆囊炎acute acalculous cholecystitis(AAC)
胆囊内不存在结石、梗阻而发生的炎症称无结石性胆囊炎。既往文献中报道较少,未引起应有的注意。因为AAC常发于其他严重疾病的基础上,往往被忽视,易致误诊、误治。AAC又以缺血坏疽为特点,容易发生穿孔,死亡率极高,严重威胁着病人的生命,特予介绍。
(一)发病情况
2025年Duncan首先报道1例嵌顿性疝并发穿孔死亡的个案,2025年Kocher成功地治疗1例术后坏疽AAC病人,2025年Glenn报道一组术后AAC病例,我国于2025年相继报道散在的AAC,其发病率约占急性胆囊炎的7%~9%,近年来其发病率有增高趋势,可达15%。男性高于女性,有报道男性占83%。本病可发生于任何年龄,创伤后所致之AAC多见于青壮年,而术后AAC则多发生于中、老年人。据统计,术后15天是AAC的高发期。
(二)病因病理
1.胆囊缺血 为AAC发病的重要原因之一,常发生于严重创伤性休克、烧伤、大手术、麻醉后。这些因素引起失血、脱水,病人循环系统灌注不足,在低血容量灌注的基础上,发生小血管痉挛、血栓形成。胆囊动脉系终末动脉支,一旦栓塞则血液供给障碍,胆囊黏膜坏死,累及全层则坏疽穿孔,Warren曾对一组新鲜胆囊标本进行血管造影,其中10例急性结石性胆囊炎,胆囊动脉全部显影;而7例AAC因动脉闭塞均不见显影。Thompson对AAC的标本进行病理检查,发现胆囊壁小动、静脉均有血栓形成,因此认为AAC的发病与胆囊壁血管缺血有关。血管系统的变化可能与海格曼因子(Hageman factor)即Ⅻ因子被激活有关,这种物质能导致缓激肽性低血压,胆囊床血管对缓激肽的敏感性增加,进一步导致胆囊血管收缩痉挛,而继发胆囊黏膜损害。老年人或心血管疾病病人,全身血管退行性改变,管腔狭窄,易发血栓。动脉瘤破裂修补术及心脏手术等易导致血栓形成。Meevendino报道心瓣膜置换后AAC发生率为31%。并有报道肝脏肿瘤行肝动脉结扎或插管化疗引起胆囊缺血者。
2.细菌感染 细菌大多经胆管逆行入胆囊,也有经血循环进入胆囊,或经肝及邻近器官蔓延者。AAC病人的胆汁行细菌培养,其中50%可出现阳性,以革兰阴性杆菌为主,占75%以上,如大肠杆菌、副大肠杆菌、变形杆菌。其次为革兰阳性球菌,如肠球菌。近年来厌氧菌感染受到重视,如梭形芽孢杆菌、脆弱杆菌、念珠球菌等。Lindberg报道创伤后AAC病例2/3以上胆汁细菌培养阳性,且血液、伤口内的细菌和胆汁中的细菌相同,目前已知对犬、猴注射大肠杆菌内毒素,可激发Ⅻ因子活性,引起血管收缩,血栓形成,导致胆囊坏死。在我国现阶段,胆管结石、化脓性胆管炎也并未消失,常因原发性化脓性胆管炎而导致急性化脓性无结石性胆囊炎。
3.胆囊排空障碍,胆汁引流不畅,由于腹部大手术,严重创伤、脱水、血液浓缩,胆汁淤滞、黏稠,胆汁酸盐浓度增高,刺激胆囊黏膜,释放出一种溶酶体酶,进一步造成黏膜损伤,产生炎性反应,胆囊颈管充血、水肿、排空障碍。术后禁食,长期接受TPN治疗者,肠道不受食物刺激,内源性胆囊收缩素(CCK)分泌减少,影响胆囊收缩和排空,也可导致AAC。Glenn声称TPN治疗4~6周,分别有50%~100%的病人发生胆囊排空障碍,导致炎症。因而主张TPN治疗3周以上,则应间歇性给予脂肪餐或补充CCK,防止AAC。近年来注意到胃切除术后,手术切断了迷走神经干,消化道激素分泌改变及术后胆囊周围粘连压迫胆囊管等诸多因素致胆汁排空障碍,Hoerstle报道17.2%的胃溃疡病和60%~83%的十二指肠球部溃疡病存在胆囊运行机能障碍。肽类激素也可拮抗CCK的作用,而导致胆囊平滑肌松弛,胆汁淤滞。胆囊解剖畸形,颈部过长,弯曲、狭窄、折叠,是导致胆囊排空的另一原因。
4.继发于其他疾病,如糖尿病,胰腺炎,胰液返流至胆囊,肿瘤,充血性心力衰竭等均可诱发AAC。
5.其他 诸如药物过敏,大量输血,吸烟,口服避孕药等引起AAC的报道。
(三)临床表现
AAC的临床表现差异很大,且与实际病理改变并不一致,又受其他器官损伤及大手术后出现的临床表现影响,而使AAC的症状被掩盖,导致误诊。一般认为,以右上腹疼痛、畏寒发热、白细胞增高的全身感染及胆囊肿大为特征的三大主要临床表现。因无结石,腹痛很少呈绞痛状。若胆囊炎已演变到穿孔,腹痛则加剧,而且出现腹膜炎体征。
(四)诊断
1.病史 常发生在严重创伤急诊手术后、大面积烧伤、腹主动脉瘤术后及心脏等大手术后;消化道恶性肿瘤,行根治术,术后禁食时间较长,用TPV支持者。
2.实验室检查 血培养往往阳性,碱性磷酸酶、肝胆红素可升高。
3.超声检查 可见胆囊增大,囊壁毛糙,壁增厚大于4mm以上,有双边征,浆膜下水肿出现晕轮征(halosign),并见胆囊周围积液,腔内有淤泥,但无结石。
(五)治疗
1.胆囊切除术 是AAC的主要治疗方法。鉴于AAC胆囊病变进展快,短期内易发生缺血、坏疽、穿孔,形成胆汁性腹膜炎,病死率极高。Johnson报道发病48h内,胆囊穿孔率为8%;发病48h后,穿孔率高达40%。浙江省金华市中心医院曾报道1例AAC发病24h内手术,胆囊已穿孔,囊壁溃烂呈豆腐乳样,难以完整切除,故ACC一经诊断明确,宜尽快施行胆囊切除术。
2.胆囊造口术 对缺血性AAC仅行胆囊造口术,难以终止病变发展,故不常用。但因胆囊排空障碍而致的AAC,病人年老体弱或全身情况极差,不能耐受麻醉和再次手术者,在排除因胆囊已穿孔引起腹膜炎者,可考虑在局麻下,右肋缘下小切口行胆囊造口术,以引流胆汁,加速胆囊排空。近年来,已发展到经皮胆囊穿刺置管引流。采用腹腔镜行胆囊造口引流。Eggermont等证实这一方法的安全性和有效性。但胆囊造口术后,应观察炎症消退情况,腹痛是否缓解,胆囊恢复正常否?若病情未缓解,仍应行胆囊切除术。
(六)预后
AAC病情危重,死亡率极高,一般为3.4%~16.7%。胆囊一旦穿孔,其死亡率高达40%。因此对AAC潜在的病因、临床表现应有足够的认识和重视,仔细地询问病史,全面认真检查,早期正确的诊断,合理的外科治疗,才可能获得良好的效果,降低AAC的死亡率。
二、急性气胀性胆囊炎(acute emphysematous cholecystitis)
急性气胀性胆囊炎是由产气荚膜杆菌(clostrisium welehi)引起的一种特殊类型胆囊炎,常常与需氧菌共同作用,造成混合感染,胆囊壁和腔内均有气体存在和潴留的浓缩胆汁刺激胆囊黏膜,释放一种溶酶体酶,造成黏膜损害,产生炎性反应。由于胆囊感染化脓,加上气体膨胀,腔内压力增高,压迫胆囊壁的血管,早期即可发生胆囊缺血,造成全胆囊或大部分胆囊壁坏死、穿孔。
临床表现腹痛、腹胀,很快出现腹膜炎体征,腹胀更为明显,因腹胀,膈肌升高,出现呼吸困难。由于缺乏特异症状和体征,常常导致误诊误治。
超声检查是诊断本病的重要手段。可见胆囊增大,壁厚,腔内及胆囊壁均有气体反射,但可能无结石;若穿孔,可见腹腔内有大片气体回声。腹部X线平片:由上腹可见充满气体的胆囊轮廓,穿孔后,则见腹腔内有游离气体,常常误诊为胃肠道穿孔。应根据临床症状、体征,结合超声检查,对本病做出早期诊断。
治疗:宜早期手术,切除胆囊和引流腹腔。因气胀性胆囊炎病变发展迅速,早期即可坏疽、穿孔和出血,死亡率极高,胆囊造口,不能控制病变发展,尽量少用或不用。手术时,若胆囊已穿孔,开腹即有气体涌出,脓液做普通细菌培养,可能为阴性;若行特殊培养,可有产气荚膜杆菌生长。
本病罕见,多见于老年男性,预后不良。
三、胆囊息肉样病变(polypoid lesions of the gallbladder PLG)
单纯PLG术前多无症状,大多在胆囊切除术后标本中发现。近年来,随着影像诊断技术的发展,胆道疾病广泛采用B-US、EVS、CT等检查,PLG的发现率大为增加,约占胆囊疾病的5%~8%,日本川和男对门诊12 611名胆系疾病患者进行B-US检查,发现PLG 224例,占1.78%,其中胆固醇性息肉占96.42%,腺瘤占1.80%,胆囊癌占1.78%。换言之,224例PLG中4例是癌。病人一旦发现本病,每每联想到息肉与肿瘤的关系,惶惶不可终日,频繁就医,反复检查,思虑该不该切除胆囊,可是临床上很难确认鉴别肿瘤性息肉和非肿瘤性息肉,更难判断其恶性倾向程度。若为肿瘤性息肉,手术切除胆囊已为学者们的共识,而非肿瘤性息肉,如何选择手术时机,尚无统一意见,其手术指征也显得较为混乱。加之PLC大幅度地临床应用,开展之初多愿意选择胆囊息肉病变病例,是否存在手术过宽,因此,有必要对PLG相关问题进行探讨。
(一)PLG诊断的准确性
1.定义 PLG是指胆囊壁向囊腔内突出的局限性息肉样改变,又称胆囊隆起性病变,胆囊微小病变,目前多称胆囊息肉样病变。
2.分类 分类方法很多,Christenen和Ishak等提出,将PLG分为:①胆固醇息肉,占96%。②胆囊腺肌瘤病,占1.83%。③胆囊癌,占1.28%。④胆囊腺瘤,占0.89%。目前临床上将PLG分为两大类:①肿瘤性病变:包括上皮肿瘤,间质瘤,纤维瘤,脂肪瘤,血管瘤,平滑肌瘤,乳头状腺瘤,腺癌等,占4%。②非肿瘤性病变:包括胆固醇息肉,占62%;腺肌瘤病,占24%;炎性息肉,占10%。
3.诊断
(1)症状 临床表现不一,大多数病例为上腹部不适或隐痛,乳头状腺瘤可引起疼痛,腺瘤脱落,位于胆囊颈的PLG及长蒂息肉,均可导致胆囊颈梗阻,胆汁排空障碍而引起腹痛,腹胀;炎性息肉,主要是间质内炎性细胞浸润,可引起腹痛。
(2)体征和实验室检查,无特殊发现。
(3)超声检查(ultrasonography,US) 目前可认B-US是检查PLG的首选方法,诊断价值甚高,其声像图上显示胆囊内有强回声光团,该光团不伴声影,不随体位改变而移动,息肉附着的囊壁无局限性增厚。有经验的超声医师对≥2mm的PLG,65%以上可被发现,≥6mm的息肉100%呈阳性。内窥镜B超(Edoscopic Ultrasongraphy,EUS)的应用,对良性疾病可清楚地分出胆囊壁的三层,恶性病灶使胆囊壁结构层次消失,使PLG的诊断进一步提高。Kyorin对一组65例胆囊≥2mm PLG常规行US及EUS检查,结果发现EUS可观察出病灶的大小、数目、部位、内部结构与胆囊壁的关系,克服了US因病人腹壁肥厚,肠腔充气,胆囊填满性病灶,萎缩性胆囊显影不佳的缺陷。因此,EUS被认为是准确性高、安全、极小侵入性的影像学检查(表20-1)。
表20-1 US EUS的检出率

(4)CT检出率仅40%,对微小息肉容易漏诊,不列为首选检查方式。
(5)其他的检查尚有MRI,口服胆囊造影(OCG),经皮胆囊镜检查(PTCCS),经皮胆囊双重造影(PTCC),肿瘤标志物CEA检测,其诊断的敏感性、准确性、特异性,各家报道不一,很少采用。
4.良恶性息肉的鉴别 2025年Teriz从7536例胆囊切除标本中,随机认定PLG 100例,其中良性74例,恶性26例,而从下列诸多因素进行鉴别(表20-2)。
表20-2 良恶性息肉鉴别表

(二)PLG恶变的可能性
1.何种PLG可能恶变 Kozuka研究了1 605份胆囊组织学,发现7例腺瘤有癌变,腺癌是腺瘤发展的结果。法国Paraf等报道,5例腺肌瘤病发展成胆囊癌,认为胆囊腺瘤是胆囊癌的危险因素,不论是乳头状、管状或混合型均有恶变可能。腺肌瘤病并非无害,也是胆囊癌的癌前病变。而胆固醇息肉和炎性息肉未见有癌变的报道。国内西安交通大学医学院第一附属医院统计1898例原发性胆囊癌,息肉恶变者仅占4例,Tetsuya报告将胆囊腺肌瘤分为3型:①基底型。②节段型。③弥漫型。其中节段型恶变的可能性最大。
2.PLG恶变的客观证据 用胆囊组织学追踪检查,Kozuka认为胆囊原位癌和19%浸润癌内存在有腺瘤成分,证实这些腺癌是腺瘤演变的结果。
3.PLG演变的发生率 胆囊腺瘤或腺肌瘤病为胆囊癌的癌前病变,其恶变率分别为33%、6%。
4.直径<10mm的PLG是否恶变 2025年Csendes取智利圣亚哥大学医院1987-2025年收治的111例<10mm PLG病例,经B-US检测随访,时间长达44~144个月(12年),结论认为:①BUS对PLG的追踪随访是有用的;②<10mm的PLG不发生癌变;③不伴发胆道疾病的症状和并发症。
(三)治疗 是否所有的PLG均需要行胆囊切除?
1.肿瘤性息肉,不论有无症状,均应手术。
2.年龄>60岁,病灶直径>10mm,伴胆囊结石者,宜手术。
3.具有症状的PLG,不论息肉大小、数目多少、部位如何,属手术范畴。
4.经追踪观察,病灶增大,继发结石者,积极手术。
相对而言,对非肿瘤性息肉,尤其是胆固醇息肉,目前尚未有癌变的报道,手术治疗应持慎重态度。
未接受手术的PLG应定期接受B-US或EUS检查,一旦发现病灶增大,则高度怀疑癌变,应积极行手术治疗。
四、胆囊腺肌病Adenomyotosis of the gallbladder
胆囊腺肌病是以胆囊黏膜上皮腺体过度增生和肌肉纤维肥大为特征的胆囊慢性疾病。不是肿瘤和炎症,增生的腺体形成扩大的黏膜窦,窦的周围有肥大而排列混乱的肌纤维组织深入囊壁肌层组织形成小窝或小管,最终在胆囊壁内造成憩室或囊肿样变化,故Bodnar将此病称为囊性胆囊炎。文献上命名有18种之多,常用者为腺肌瘤(adenomyoma)或腺肌瘤病(adenomymatosis),因带有瘤字,往往误认为癌瘤。为说明本病为良性肿瘤,目前多称胆囊腺肌病,临床并非罕见。文献报道,发病率占胆囊疾病的2%~5%,可表现为弥漫型、节段型和局限型三种。
(一)病因病理
迄今为止,胆囊腺肌病的病因尚不清楚,大多认为胚胎发育时,胆囊芽化不全,上皮芽迷走在胆囊壁内,由于内分泌和神经功能紊乱等因素使胆囊壁组织过度增生,发生退行性改变,胆囊肌层肥厚,使胆囊过度收缩,致排空异常迅速,进一步使胆囊的收缩排空紊乱,肌纤维排列混杂,分化成腺肌病,表现为增生和变性的过程。
(二)临床表现
多发生在40岁以上的女性,起病隐匿,病程缓慢,表现为消化不良,中、上腹部饱胀、嗳气,常误认为胃病。病变位于胆囊颈部者,影响胆囊排空,当进食油腻饮食后,可出现典型的胆绞痛,恶心、呕吐。与结石性和非结石性胆囊炎几无法鉴别,一般无发热及黄疸,体检无阳性发现。
(三)诊断
1.超声和内镜超声检查 为诊断胆囊腺肌病的主要手段,可见胆囊增大、肥厚,有局限性隆起,向腔内突出,并可见强光团,不伴声影,不随体位改变而移动。
2.病理诊断 肉眼观,胆囊腔内有息肉样隆起物,直径往往≤10mm,囊壁有囊样改变;剖面呈灰红色,呈蜂巢样结构,壁内也可有小结石形成。镜检:胆囊黏膜及平滑肌肌层有腺体增生,腺腔内柱状上皮构成,周围有数量不等的平滑肌细胞环绕,并有淋巴细胞浸润,病变周围的胆囊壁正常。
(四)治疗
胆囊腺肌病不是肿瘤,近来有恶变报道,其恶变率可高达20%~30%,特别是节段性腺肌病,有7%的病人伴有胆囊癌,癌瘤多发生在狭窄远端的基底腔内,可能由于胆囊远端环状狭窄,引起梗阻,底腔内胆汁淤积,压力过大,引起黏膜改变,促使胆囊癌发生。因而,对胆囊腺肌病的治疗,应持积极态度,手术指征不宜过严。对屡发胆系疾病症状,伴有结石,病灶局限>10mm者,均需手术切除胆囊。反之,无临床症状,胆囊功能良好,暂不行手术者,亦应定期复查B-US,了解病情变化,若病灶增大,伴有结石,则手术治疗。
五、瓷胆囊Porcelain gallbladder
瓷胆囊是透明蛋白钙广泛地沉积于胆囊壁和钙胆汁形成或堵塞胆囊管引起的一种慢性胆囊疾病,又名钙化胆囊,临床罕见,发病率约占胆囊疾病的0.04%~0.6%,Massachusetts医院1962-2025年切除胆囊标本22 000例,其中44例为瓷胆囊,占0.2%。瓷胆囊发病率虽低,恶变率却很高,达15%~20%,有的高达61%。2025年Kazmierski首先描述1例胆囊壁钙化标本,伴有癌病灶。Etala在阿根廷医院检测26例瓷性胆囊,其中16例发现有癌。瓷性胆囊的癌变比胆囊壁无钙化者高出14倍,并有10%~12%的病人伴有胃肠道,尤其是结肠的恶性肿瘤。本病多见于老年,女性比男性多5倍。
(一)病因病理
某些慢性胆囊炎的病人,胆囊管阻塞,正常胆汁酸化受到干扰,胆囊黏膜合成分泌黏蛋白的功能增强,有时还分泌大量含碳酸钙的液体,形成钙胆汁,黏蛋白与胆固醇凝聚成结晶,胆色素及钙化的碎屑结合为含钙性结石,沉淀于胆囊壁黏膜,使黏膜局限性钙化,致成薄板状,炎症进一步发展,引起黏膜坏死和纤维化,也侵及肌层,使肌层弥漫性钙化(真正的瓷胆囊)。本病与钙代谢无关,检测血清钙、磷在正常范围。
(二)临床表现
症状隐伏,除有慢性胃肠道不适外,无特殊主诉,部分病人右上腹扪及包块,有10%左右的病人,合并胆道系统以外的癌瘤,而出现相应的症状,应予重视。
(三)诊断
多数病人无临床症状,往往因腹部其他疾病拍腹部X线平片或手术时偶尔发现。其常用的诊断方法有:
1.X线腹部平片 可见右上腹区胆囊中央异质性和周围镶边性两个阴影,胆囊底部和壶腹部表现为致密性不规则的卵圆形,上极有一种戒环状阴影。
2.EUS 胆囊呈慢性炎症改变,70%~90%的瓷胆囊,EUS检查,胆囊层次分辨不清。
3.术中常见胆囊萎缩,触之较硬,多并有结石。
4.胆囊标本病理组织学检查 肉眼观,胆囊表面满布纤维,壁钙化,厚>4mm。囊内含有灰棕色黏液;镜检,胆囊黏膜和肌层有局灶性或弥漫性钙化区,局部出血,纤维化、坏死黏膜被破坏或消失,囊壁全层有慢性炎性细胞浸润,也可见到非典型性癌前期变化,瓷胆囊最常见的癌变为硬性浸润性腺癌。
(四)治疗
瓷胆囊唯一的治疗方法是手术切除胆囊。术中疑有恶变者,应快速病理切片行组织学检查,证实为癌时,按胆囊癌原则处理。术前,病人需作全面检查,排除消化道其他恶性肿瘤,若发现其他恶性肿瘤,需给予相应的恰当治疗。
六、黄色肉芽肿性胆囊炎(xanthogramulomatous cholecystitis XGC)
又称纤维性黄色肉芽肿性胆囊炎。胆囊呈蜡样性质组织细胞肉芽肿,发病率约占胆囊疾病0.6%~1.7%。病变过程似慢性胆囊炎,炎性胆汁和黏蛋白混合浸润胆囊壁及邻近组织,在胆囊壁内形成多个黄色结节,有时可见核巨细胞及胆固醇结节。炎性组织在胆囊内形成瘤样肿块,易与胆囊癌混淆,术中也极似胆囊癌,故术前、术中很难诊断正确。强调此类病人通过病史、体征和超声检查,诊断为慢性胆囊炎或胆囊癌而施行手术时,术中应将胆囊作快速切片检查。可见胆囊纤维组织增生明显,有大量浆细胞、淋巴细胞、中性粒细胞浸润,胆固醇泡沫细胞沉积成黄色肉芽肿属良性疾病,治疗仅需胆囊切除。若按肿瘤,行胆囊癌根治性切除,或扩大根治性切除;或不切除,仅作放疗、化疗,均对病人不利。
(张英民)
第三节 先天性胆管囊性扩张症
先天性胆管囊性扩张症(Congenital cystic dilatation of the bile duct)又称先天性胆总管囊肿,是临床上较为少见的先天性胆道疾病。自2025年Vater报告首例先天性胆总管囊肿以来,各国已有较多的报道,其中日本占2/3。近年由于诊断的进步,国内报告日益增多。一般认为东方人患本病较多。
(一)病因
先天性胆管囊肿的发病原因,有各种学说,归纳起来主要有如下因素:
(1)先天性的胆管壁的薄弱。由于胚胎期胆管发生过程中,其上皮增殖异常,导致胆管上皮增生速度不均匀,胆管远端狭窄,近端胆管发育不良。或神经发育异常,远端出现痉挛性狭窄,胆管壁缺乏神经节细胞,近端胆管缺乏弹力纤维而发生扩张。由于先天性因素导致胆管壁薄弱而扩张是发生胆管扩张的基本原因。
(2)胆管内压力增高。由于植物神经功能失调,致使胆汁流出障碍,Oddi氏括约肌异常或胆总管近端有痉挛、狭窄或肿瘤的压迫,淋巴结的压迫等,致使胆管内压增高是形成胆管扩张的重要因素。
(3)胰胆管合流异常。现已公认胰胆管合流异常是先天性胆管扩张的主要病因之一。胚胎期胰胆管分化异常引起的胰胆管合流异常(anomalous junction of pancreaticobiliary ductal system,AJPBDS)。所谓胰胆管合流异常是指解剖学上胰胆管共同通道在十二指肠壁外合流,造成共同通道过长,使十二指肠乳头部括约肌的作用不能影响到整个汇合部,胆汁胰液互相逆流,而引起胆道和胰腺的各种疾病。严格地讲,胰胆管合流异常实际上是一种先天性解剖异常。胰胆管合流异常一般分为三型:①P-B型即胰管汇入胆管。②B-P型即胆管汇入胰管。③复杂型。石景森报道28例胰胆管合流异常,其中合并胆总管扩张症22例,占78.6%。有研究表明正常胆总管远端压力为2.5~3.0k Pa,胰管的压力为3~5k Pa,正常Oddi氏括约肌阻止了胰液返流入胆道,由于胰胆管合流异常时汇合部括约肌失去控制,胰液逆入胆管,P-B型合流异常,胆总管多呈柱状扩张,且年龄较大才出现症状。B-P型合流异常,胆总管下端往往合并狭窄,临床症状较明显,常伴发黄疸,出现症状年龄较轻。刘斌、夏穗生关于胰胆管连接与胆管扩张的研究证实胰液返流于胆道可引起胆管柱状扩张,其机制可能是胰酶反复侵蚀,破坏管壁,刺激纤维组织增生,胆管壁失去弹性,再加上胆管液体流量增大,压力增高,而使胆管扩张。先天性柱状胆总管扩张的主要原因可能是胰胆管合流异常引起的胰液返流入胆总管所致。而局限性囊性扩张可能是胰胆管合流异常和囊性扩张远端梗阻因素共同作用所致。
(4)根据流行病学资料统计发现,女性发病率明显高于男性。因此,有人认为该病的发生与性染色体遗传有关。
(5)细胞凋亡及其相关因子bcl-2和bax在胆总管囊肿的发病中起了一定作用,并认为胆管囊性变是细胞凋亡引起而不是坏死所致。
(二)病理和分型
先天性胆管囊性扩张可发生于肝内、外胆管的任何部位,常多发生于胆总管。囊性扩张胆管的远端狭窄为其特征。囊肿壁为一层纤维组织构成,较肥厚,缺乏黏膜上皮及肌层。囊肿的大小不一,壁厚薄不等。
由于远端梗阻,囊肿内胆汁的潴留常可发生胆管炎,形成结石,甚至可出现囊壁坏死、穿孔。有人发现囊肿残存的上皮细胞中有75%存在上皮化生现象,无分泌功能的胆管上皮细胞发生化生后,其下层腺体增加,随病程增加,可导致具有分泌功能的肠上皮化生,而成为癌变的基础。胰胆管合流异常致胰液的返流与反复发作的胆管炎引起的慢性刺激,是癌变的重要原因,使其癌变率较正常人高出10~20倍。一般胆囊不肿大,肝脏可因淤胆而形成胆汁性肝硬化并发门静脉高压症。
本病可合并其他先天性畸形,发生率为5%~19%,如多囊肾、先天性肝纤维化、胆管闭锁或胆囊闭锁等。
根据囊肿发生的部位和形态,2025年Alonso-Lej首先将先天性胆管扩张分成三型:
Ⅰ型:胆总管囊性扩张,最常见型。
Ⅱ型:胆总管憩室。
Ⅲ型:胆总管末端囊肿。
在此基础上,2025年Todani提出先天性胆管囊性扩张分成五型的分型方法,这种方法至今为多数学者所采用(图20-1)。
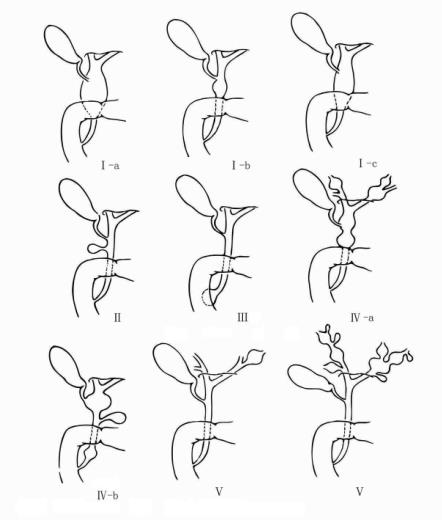
图20-1 Todani分型
Ⅰ-Ⅲ型与Alonso-Lej相同;但Ⅰ型分3个亚型:即Ⅰ-a型囊肿型;Ⅰ-b型节段型;Ⅰc型梭状型。
Ⅳ-a型:肝内及肝外胆管多发性囊肿。
Ⅳ-b型:肝外胆管多发性囊肿。
Ⅴ型:肝内胆管单发性或多发性囊性扩张。
国内钟大昌、冉瑞图于2025年提出将胆管扩张症首先分为先天性和继发性两大类,再按部位、形态、伴发病变等分型,具有一定的临床意义。
1.先天性
(1)肝外胆管扩张:①囊性扩张。②憩室性扩张型。③十二指肠壁内段扩张型。④多发混合型。
(2)肝内胆管扩张:①中心型。②周边型。③混合型。④伴先天性肝纤维化型。
(3)肝内外胆管扩张。
2.继发性
①肝外胆管扩张症。②肝内胆管扩张症。③肝内外胆管扩张症。
(三)临床表现
先天性胆管囊性扩张症多见于女性,男性与女性之比为1∶4。可发生于任何年龄,最常见于儿童及青年人,曾在胎儿、早产儿及新生儿中发现,小儿占58%,30岁以内发病者占82%~90%,成人的发病率随年龄的增加而递减,70~76岁组仅1.5%。
典型的临床表现是腹痛、黄疸和右上腹部肿块所组成的三联征。
右上腹痛向右肩部放射是最常见的症状,占50%~92%。其性质可以为持续性钝痛,也有表现为胆绞痛者。腹痛的原因是由胆道感染而引起。
梗阻性黄疸占39.3%~64.8%,呈间歇性、反复性出现。其持续时间与程度由胆道感染和胆管梗阻情况而决定。值得注意的是,黄疸的出现与囊肿壁的结构有关。囊肿壁薄而富有弹性可缓冲胆内压。即使有大量胆汁潴留,也不致引起明显黄疸。反之,囊壁肥厚、纤维化、失去弹性加之胆管远端的梗阻,则可出现明显黄疸。
腹部包块常见于右上腹,占36%~42.1%,多见于肝外胆管囊性扩张的病人。包块较光滑,稍能活动,有时可有体积大小的变化。
临床上同时具备这样典型三联征者并不多(约10%~60%),或仅表现1~2个症状。
囊肿并发感染尚有发热、寒战、恶心、呕吐,有的病例因囊内压过高而发生穿孔形成胆汁性腹膜炎。晚期可出现胆汁性肝硬化和门静脉高压症的临床表现。
胆管囊性扩张病人多数合并有胆管结石,占71.4%。这种胆色素结石可发生于肝内外胆道或囊肿内。与年龄、病程长短、既往手术史以及胆管狭窄有一定关系。年龄越大,结石发病率越高,40岁以上发病的以及病程20年以上的病人,几乎全部并发结石;70%并发结石者过去有胆道手术史;80%胆管下段狭窄者并发结石。Yamaguchi报道胆总管囊肿1 433例,常见的并发症为结石占8.0%,恶性变占4.2%,穿孔后腹膜炎占1.8%。
(四)诊断
有典型的腹痛、肿块和黄疸的病人诊断并不困难。但单纯根据临床表现不仅确诊率低,而且不能指导手术方式的选择。因此,临床上仅仅作出先天性胆管囊肿的诊断是不够的,还需要了解囊肿的部位、大小,是单发还是多发,是否合并结石和有无胆管狭窄。因此,凡出现梗阻性黄疸的病人,尤其是儿童和年轻患者,应常规行B型超声波检查,作必要的化验检查如肝功、血象等,必要时可选用PTC、ERCP、CT和MRCP检查。目前已有报道胎儿期进行超声检查行早期诊断,因此在新生儿期即可作出诊断并及早进行治疗。
需要与本病相鉴别的疾病有胆道闭锁、肝囊肿、腹膜后和腹腔内肿瘤、右肾盂积水等。
先天性胆管囊性扩张症癌变的诊断:已确诊为先天性胆管囊性扩张症的病例如果出现消瘦、出血或并发胆道出血或出现胆肠内瘘,则应考虑癌变的可能。尤其是曾经行囊肠吻合术的病人,更应提高警惕。目前通过PTC、ERCP、CT和MRCP检查大多可以诊断,最终需术中行细胞学和组织学检查确诊。
(五)治疗
先天性胆管囊性扩张症的出现症状年龄越小,胆道梗阻就越严重;而梗阻时间越长,肝损伤的程度就越严重。特别是新生儿期出现症状并有陶土色大便史者,几乎无一例外地发生胆汁性肝硬化。Chapman指出,临床上出现症状患者一旦确诊即应尽早手术,早期手术可尽早使胰胆分流,这对预防囊肿癌变有重要意义。因此,对诊断明确的先天性胆管囊性扩张症应及时地进行外科手术治疗。
外科手术是治疗先天性胆管囊性扩张的根本方法。手术的目的是尽可能切除囊肿壁,重新建立胆汁通畅引流的通道,对有胰胆管合流异常的病例,同时亦要行胆胰分流的手术。
手术方式的选择应该根据具体情况决定。
先天性胆管囊性扩张合并严重胆管炎、囊肿破裂并发弥漫性腹膜炎、全身极度衰竭的危重病人可紧急行外引流术。待胆道感染得到控制,病人情况好转,再作二期手术。外引流术可使病人丢失大量胆汁,应注意纠正水、电解质和酸碱平衡的紊乱。
先天性胆管囊性扩张症第Ⅰ型:在诊断明确后,应尽早施行手术治疗。目前应用较多的是囊肿切除,胆管重建术。由于胆管囊肿壁多缺乏黏膜上皮,这是造成吻合口狭窄的重要原因。加上囊壁存在恶变的可能性,目前趋向于全部切除或尽可能切除囊壁,再行胆管-空肠Roux-en-y吻合术,并附加抗返流装置如折叠瓣、人工乳头、矩型瓣等。实践证明此手术具备如下优点:①手术死亡率低,约4%。②术后并发症低。③再次手术率低。④防止囊壁恶变。⑤消除形成胆石的因素。⑥使胆胰分流。
由于先天性胆总管囊肿常合并有胰胆管合流异常,其发病机制主要是由于胰液返流胆道所致,治疗上在切除病变的同时,应进行胆胰分流,即切除胆总管囊肿,关闭远端胆总管的残端,在近端肝总管处行空肠肝总管Roux-en-Y吻合,而单纯行胆总管囊肿空肠内引流术,有胆总管囊肿癌变的可能性。确定是否有胰胆管合流异常,除测量共同通路的长度外,常用的是测定胆汁内淀粉酶的含量,作为胆胰分流的重要指标。
先天性胆管囊性扩张症第Ⅱ型:对憩室样囊肿行单纯切除。
先天性胆管囊性扩张症第Ⅲ型:需切开十二指肠,切除部分囊肿,再将剩余部分与十二指肠进行吻合。
先天性胆管囊性扩张症第Ⅳ型:在治疗上最为困难。手术的原则仍然是尽量保持胆汁引流的通畅。可行胆总管囊肿切除,肝管-空肠吻合术。囊肿位于一侧肝内胆管的病例以行肝部分切除和/或行肝内胆管囊肿-空肠吻合等联合手术。
先天性胆管囊性扩张症第Ⅴ型:单纯的左或右肝内胆管囊性扩张宜行肝部分切除,这样可消除病灶。双侧肝内胆管囊性扩张者,应行左半肝切除,右肝管-空肠吻合术。
成人胆总管囊肿已发生癌变者,则按胆管癌处理,视其发生部位作相应手术。近肝门部者,宜按肝门部胆管癌行根治术,发生于中下段者,则应行Whippl手术,姑息性手术效果较差,若病检为腺瘤者,则可连同囊肿一并切除。
不适宜根治性切除的病例可行姑息性切除,无法切除的病例可实行胆道内引流、胃肠吻合等姑息性手术,以提高病人生活质量,延长生存期。
(六)先天性胆管囊性扩张症再手术及其处理
先天性胆管囊性扩张症再手术的主要原因是:①手术是在急诊情况下进行的,仅行外引流手术,必须再次手术;②首次手术时术式选择不当,内引流手术并发症高且有较高的癌变率,最终导致再次手术;③囊肿切除胆道重建的并发症较少,但有时出现吻合口狭窄等并发症,需再次手术纠正;④Ⅳa型和V型的先天性胆管囊性扩张症很难一次手术彻底解决,常需多次手术处理;⑤合并肝功能不全者,只有行肝移植才有希望得到根本的治疗。
总之,对于先天性胆管囊性扩张症的手术,应根据病理类型、病人的具体情况,合理选择手术方式,最常用的术式是囊肿切除、胆肠吻合术。但在无法切除囊肿的情况下,仍可采用各种囊肠吻合术。
(严际慎)
第四节 重症急性胆管炎
胆管的急性化脓性感染称为急性化脓性胆管炎。根据胆管炎的病理改变和临床表现,可分为急性胆管炎、急性梗阻性化脓性胆管炎、急性坏疽性胆管炎和慢性胆管炎。自从2025年Charcot描述腹痛、寒战、发热和黄疸三联征为急性化脓性胆管炎的特征以来,人们对急性化脓性胆管炎的认识经历了漫长的岁月。临床上常常难以准确地分辨出急性胆管炎和急性梗阻性化脓性胆管炎。直到2025年Reynolds和Dargan报告了急性梗阻性化脓性胆管炎(Acute Obstructive Suppurative Cholangitis AOSC)以后,这种由于胆道梗阻而致的特殊临床表现逐渐被人们所认识,必须急诊手术治疗的观点才广泛地为人们所接受。根据我国的国情,2025年全国肝胆管结石专题讨论会建议将AOSC命名为重症急性胆管炎(Acute cholangitis of Severe Type,ACST)。随着研究的深入,对ACST采取了积极的手术治疗和围手术期处理,治愈率有所提高,但死亡率仍高达20%~30%,仍然是目前良性胆道疾病死亡的主要原因。重症急性胆管炎导致死亡的主要原因是败血症,胆源性肝脓肿和多器官功能衰竭。如何有效地抢救重症急性胆管炎的病人,降低死亡率,迄今仍然是胆道外科临床和科研的重要课题。
一、病因
重症急性胆管炎的主要病因是胆管急性梗阻和严重的胆道感染。
胆管急性梗阻的原因依次为胆总管结石、胆道蛔虫、胆管狭窄、胆管癌、先天性胆道畸形以及缩窄性乳头炎。
这种胆管的急性梗阻有如下特点:
(1)梗阻的因素由不同地区的胆道疾病的特点所决定。在肝胆管结石高发区,重症急性胆管炎常常是由于肝胆管结石而引起;在胆囊结石的高发区,继发性胆总管结石为重症急性胆管炎的主要原因。
(2)梗阻的部位多发生于胆总管的远端,也可发生在肝总管或左右肝管开口处,梗阻后致使广泛的肝脏组织受到严重损害。
(3)梗阻的程度取决于结石的大小、位置,是急性梗阻还是慢性梗阻。值得注意的是,胆总管壶腹部不大的结石嵌顿所引起的梗阻,远较大的结石所致慢性梗阻要严重得多。
(4)已切除胆囊或丧失胆囊功能的病人,由于失去了胆囊的缓冲胆压的作用,一旦胆管发生梗阻,则对肝细胞的损害更为直接,引起重症急性胆管炎就更为严重。
(5)肝叶胆管的梗阻也可引起重症急性胆管炎,但其临床表现一般较胆总管梗阻为轻。肝内梗阻症状不典型,甚至术中探查也易漏诊,梗阻部位越高,腹痛越轻,甚至无腹痛;除非双侧一级胆管同时梗阻,否则无黄疸或轻度黄疸;缺乏上腹压痛和腹膜刺激征,但有肝脏不对称肿大和肝区叩击痛。
(6)胆道感染是在胆道梗阻的基础上发展的。引起重症急性胆管炎的胆道严重感染有如下特点:
1)感染的程度受胆道梗阻、肠液的反流,既往的手术、曾使用过的抗菌药物以及细菌的种类,对药物的敏感性等情况的影响。
2)引起重症急性胆管炎的细菌种类。最常见的致病菌依次为大肠杆菌、克雷白菌属、肠球菌属、假单孢菌属、肠道杆菌属和类杆菌属。胆汁细菌感染谱随时代变迁而变化。
3)厌氧菌的感染占极重要地位。根据国内外文献报道,重症急性胆管炎的胆汁中厌氧菌的检出率几乎都在50%以上,高者可达82%。过去普遍认为胆道厌氧菌感染的主要病原菌为梭状芽孢杆菌,近年发现,正常存在于肠道且不被胆汁溶解的脆弱杆菌是胆道中最常见的厌氧菌。其次为产气荚膜梭杆菌。
4)需氧菌与厌氧菌共同引起感染。有资料表明厌氧菌单独存在的不到10%。二者具有协同作用,从而加重了胆道感染。使其具有发病突然,进展迅速,全身症状明显,易发生组织坏死导致穿孔及肝脓肿形成,胆汁呈灰绿色或棕红色,有时可有臭味等临床特点。
5)随着抗生素的广泛使用,血培养的阳性率日益减少。因此,血培养的阳性结果能在一定程度上反映疾病的严重程度。
二、病理生理
重症急性胆管炎是由于胆道梗阻和严重的细菌感染致使胆道内压增高,使机体发生一系列病理生理改变,临床上出现的腹痛、畏寒、高热、黄疸以及剑突下压痛、腹肌紧张和不同程度的肝区叩击痛。病情进一步发展,可发生血压下降和神志改变,其病理生理改变主要为胆源性败血症、内毒素血症、高胆红素血症以及多种器官功能衰竭。
1.胆源性败血症 胆汁的分泌与排泄是一系列极其复杂的生理过程。正常的肝细胞分泌胆汁在各级胆管的不同压力梯度的作用下,胆汁经各级胆管而进入肠道。当胆汁分泌过多或胆道压力急剧升高时,胆囊不仅有浓缩、贮藏胆汁的功能,而且也起到缓冲胆道压力的作用,使肝细胞避免受到胆高压的损害。同时毛细胆管两侧还有一种特殊的结构,防止胆汁逆流进入肝血窦。
重症急性胆管炎的胆汁引流受阻,随着胆道压力逐渐升高,致使胆系发生如下改变:
(1)毛细胆管高度扩张,桥粒结构及肝细胞连结面破坏,使胆汁逆流入血窦。
(2)当压力升至294Pa(30cm H 2 O)以上时,肝细胞停止分泌。
(3)肝细胞、各级胆管发生变性坏死。
最后导致胆汁及致病菌大量进入血液循环形成胆源性败血症。
2.内毒素血症 多年来国内外大量临床观察及动物实验均证实胆道压力增高,胆血屏障的破坏、细菌及内毒素随胆汁返流入血可致内毒素血症,进而产生内毒素休克。新近的研究表明,肠道内毒素的产生增加,肠壁细胞通透性增加使内毒素吸收增加,加之肝脏解毒机能障碍,使门静脉中内毒素升高并返流至体循环,从而使胆源性休克变得更加顽固和不可逆。
由于内毒素作用于凝血因子并损害血管内膜,使纤维蛋白沉积,并可增加血管阻力,加之肝细胞坏死释放的组织凝血素,致使机体的凝血机制发生严重障碍。
3.高胆红素血症 由于胆管梗阻、血胆红素进行性增加,导致各脏器大量胆红素沉着,甚至形成胆栓,从而影响正常功能,各种脏器中以肝脏、肾脏的损害最为严重。
肝脏明显肿大、瘀胆,肝细胞内可见大量胆红素沉积,胆管扩张,毛细胆管内有胆栓形成,肝细胞出现片状坏死,最后可导致不同程度肝硬变。
肾脏充血水肿呈褐绿色,肾小管上皮胆红素淤积,乳头间质细胞胆红质沉积,进而发生乳头坏死。
以上改变成为临床上重症急性胆管炎病人发生肝肾综合征的病理生理改变的基础。
4.胆压增高刺激迷走神经反射性引起心血管功能改变。
三、临床表现
(一)主要临床表现
上腹痛、寒战高热、黄疸(Charcot氏三联征)在此基础上病情进一步发展出现神志改变、低血压(Reynolds氏五联征)是重症急性胆管炎的主要临床表现。
由不同原因引起的重症急性胆管炎其腹痛的性质、程度不一。胆总管结石、胆道蛔虫多表现为剧烈的胆绞痛;胆管狭窄,肿瘤梗阻可表现为右上腹持续性的胀痛。腹痛后出现畏寒、发热,体温一般在39℃以上,甚至达到40~41℃。有时一天出现多次的寒战高热。随之出现黄疸,黄疸的程度常可反映胆道梗阻程度和肝细胞的损害程度。黄疸出现的时间、程度和持续的时间与胆道梗阻的部位、病程的长短、梗阻的程度而不同。一般而言,胆总管梗阻较一侧肝管为重;病程长者较病程短者为重;急性完全梗阻较慢性不完全梗阻为重。病情严重者在数小时或数日出现低血压,同时伴有烦躁不安,或神志淡漠、四肢发凉、口唇紫绀,脉搏增快呼吸急促,收缩压降至90mm Hg以下,脉压小于20mm Hg,表现为中毒性休克,直至昏迷而死亡。
(二)腹部体征
腹部检查主要为右上腹及剑突下有明显压痛、肌紧张、肝脏肿大、触痛、肝区叩击痛。值得注意的是肝脏呈弥漫性肿大、触痛伴有胆囊肿大常提示胆总管远端梗阻。
(三)实验室检查及影像学检查
白细胞计数明显升高,中性白细胞左移,通常高达20×109/L以上。白细胞上升的程度常可反映胆道感染的严重程度。
尿胆红素阳性反应,有时尿中出现蛋白及颗粒管型。
血生化检查呈代谢性酸中毒和不同程度的低血钾改变。
肝功能全面受损,表现为血清总胆红素与直接胆红素升高,SGPT在发病后迅速上升,病情控制后逐渐恢复正常,经胆管排泄的酶如谷丙酰转酞酶(r-GT)碱性磷酸酶、乳酸脱氢酶增高。
B型超声波、CT等影像学检查可见肝内外胆管明显扩张,胆囊肿大,并可见其梗阻的原因如结石、蛔虫、肿瘤、狭窄等。
而PTC、ERCP等检查由于可使胆内压增高,加重症状,一般不宜进行。新近的报道显示磁共振胆道成像(MRCP)对病人的诊断率与ERCP相近,且无损伤,特别适用于临床表现不典型的老年患者。
四、诊断
根据临床表现,重症急性胆管炎的诊断并不困难。为统一标准,指导对重症急性胆管炎的治疗,2025年中华外科杂志编委会和第三军医大学共同制定了如下诊断标准:
急性胆管炎出现休克(收缩压<70mm Hg)或具有下列二项以上症状者,即可诊断ACST。
(1)精神症状;
(2)脉率>120次/min;
(3)白细胞计数>20×109/L;
(4)体温>39℃或<36℃;
(5)胆汁为脓性伴有胆管内压力明显增高;
(6)血培养阳性。
临床上常常将病情分为四级:
Ⅰ级(单纯型) Ⅱ级(感染性休克)
Ⅲ级(肝脓肿) Ⅳ级(多器官衰竭)
近年国内许多学者相继对重症急性胆管炎的诊断标准进行深入探讨,着重在于指导对急性胆管炎的预后预测和治疗决策上,是对以上标准的补充和完善,应予以足够的重视。有研究表明,病程长短、年龄、肝脏损害程度、并发症的有无是影响重症急性胆管炎预后的重要因素。
为进行预后预测和资料对比,建立了许多评分标准,临床应用最广泛的是APACHEⅢ评分。有研究表明,当APACHEⅢ分值>35分或阳性指标指数>7项时死亡率大为增加,属高危病人,应重点监护、及时手术;当APACHEⅢ分值<25分或阳性指标指数<5项时,可暂保守治疗且多能成功。因此,APACHEⅢ评分可作为重症急性胆管炎治疗决策和预后判断的可行性量化指标。
五、治疗
重症急性胆管炎是一种凶险的外科急症,严重威胁病人生命。由于其病理改变基础是胆道梗阻,因此,解除胆道梗阻是抢救重症急性胆管炎的关键。长期的临床实践证明,经过严密观察病情,积极抢救,不失时机地进行手术,是可以降低死亡率的。作者认为,对重症急性胆管炎的诊断治疗水平可以反映出一位外科医师的素质。因为对重症急性胆管炎的诊治既需要抓住手术时机,要有果断地进行手术的胆识,又要有进行合理的围手术期处理的能力,以及要对相关的多学科知识有较深的造诣。
(一)手术治疗
1.重症急性胆管炎的治疗原则 紧急胆道减压,解除梗阻,引流胆道,以控制胆道感染。术中常可发现胆管内压很高,当切开胆总管时,有大量脓性胆汁喷出。当胆道压力减低后,血压趋于稳定,病人情况好转。
由于病情危重,施行较复杂的手术时死亡率较高,容易造成术后无法挽回的多器官功能衰竭,因此手术应以简单有效,挽救病人生命为目的。
基本手术方式是胆总管切开引流术。术中取出结石、蛔虫等解除梗阻,如果肝外胆道有狭窄,应剪开狭窄,取出狭窄以上的结石,并充分引流狭窄以上的肝管。
对合并胆囊积脓、胆囊结石可同时作胆囊切开取石,胆囊造瘘术。不强求切除胆囊。一般不宜采用单纯胆囊造瘘术治疗重症急性胆管炎。因为胆总管内的梗阻因素未解除,加之胆囊管细小,炎性水肿后易被堵塞,其引流效果不佳。
值得强调的是,术中不宜行胆道造影,以防增加胆内压,使感染扩散,加重病情。
另外,如果术中发现合并胆源性肝脓肿,对较大的脓肿,应行脓肿引流术。
2.手术时机的选择 重症急性胆管炎病人的手术时机掌握往往较为困难。临床上常常因急诊手术不能完全了解胆道病变,病情也不允许行复杂手术,导致残石率高,再次手术率高。但若胆道引流不及时易导致不可挽回的后果。因此,必须恰当掌握手术时机。原则上一旦确诊为重症急性胆管炎,用2~12h准备即行手术治疗。已出现休克的病人,手术应在积极抗休克下尽早进行,有时即使休克未能纠正,也应边抗休克边手术。观察病人对治疗的早期反应,是决定手术时机的重要依据。病人在观察期间如果出现下列情况之一者应考虑手术治疗:
(1)经用大剂量广谱抗生素后仍持续性腹痛,体温在39℃以上,黄疸加深者;
(2)上腹肌紧张,压痛明显,且进行性加重者;
(3)肝脏压痛或有明显肝区叩击痛者;
(4)血压开始下降,脉压差小者;
(5)出现表情淡漠,反应迟钝等精神症状者。
老年患者由于代偿力差,易发生多器官衰竭,应以早期手术为宜。
(二)体弱病人围手术期处理
提高病人对麻醉手术的耐受性,对减少术中死亡率至关重要。经过积极地抗休克治疗,强有力的抗感染措施,全身支持治疗,预防和治疗多器官衰竭,可减少或预防合并症的发生。
(三)关于经皮肝穿刺胆道引流(PTCD)和经内窥镜鼻胆管引流术(ERBD)治疗重急性胆管炎
20世纪50年代Lage开始应用PTCD治疗胆道梗阻,此后国内外有不少成功的报道,死亡率下降,不少患者病情好转。70年代,高田忠敏开展了经皮肝穿刺胆道镜技术(PTCS),80年代后,国内外先后开展经鼻经乳头的胆道引流技术(ERBD),使非手术治疗方法不断发展和完善,使不少高危患者经过这些非手术方法度过了危险期,为择期手术创造了条件。从理论上讲,解除梗阻是治疗重症急性胆管炎的基本方法。除手术外,目前引流胆道尚有PTCD及经鼻胆管引流,从而动摇了非开腹手术不可的观念。由于PTCD引流不畅,以及严重并发症的发生,目前国内外作者大都对PTCD又持慎重态度。事实上如果病例选择得当和操作熟练,对于危重病人,PTCD仍不失为一种可供选择的方法。
目前许多作者主张应用十二指肠镜、腹腔镜、胆道镜三镜联合治疗重症急性胆管炎,即用ERBD进行胆管减压,待症状缓解后再用腹腔镜和胆道镜治疗。其疗效确切、创伤小,符合现代外科微创观念,获得良好效果。
六、重症急性胆管炎围手术期的处理
作好重症急性胆管炎病人的术前准备,提高病人对麻醉、手术的耐受性,对减少术中死亡率至关重要,甚至有一部分病人经过合理的围手术期处理使病情稳定,度过危险期,而获得限期手术或择期手术的机会。同样作为术后处理可以减少或预防合并症的发生。
合理的围手术期的处理主要包括积极地抗休克治疗,强有力的抗感染措施,全身支持治疗,预防和治疗多器官衰竭,掌握好手术治疗的时机。
1.积极地抗休克治疗 重症急性胆管炎伴有中毒性休克是导致病人死亡的主要原因。由于败血症、内毒素血症导致组织血液灌注不足,细胞缺氧和代谢性酸中毒,继之引起毛细血管扩张和毛细血管通透性增加,使有效循环血量明显减少,全身重要器官供血不足。积极纠正休克,可以提高病人对手术的耐受性,减轻各重要器官功能损害,是防止出现多器官衰竭的主要措施。
(1)补充血容量 由于高热、呕吐、进食减少病人已有血容量减少,当出现休克时因微血管扩张有效循环血量急剧减少,因此,补充血容量是抗休克的基本措施。应立即输液、输血、补充血容量以提高血压,维持组织的血液灌注,必要时观察中心静脉压,使中心静脉压维持在5~8cm H 2 O为宜。
(2)纠正电解质紊乱和酸中毒:纠正重症急性胆管炎所引起的电解质紊乱和酸中毒需注意如下几点:
1)监测病人血清电解质,作K、Na、Ca、CO2-Cp和血气分析。根据化验结果,作相应的补充和纠正。病情严重者需安置导尿管,测每小时尿量、比重。有的病人常伴有低钾,在尿量足够的情况下,应注意补钾。
2)重症急性胆管炎的病人常伴有严重的代谢性酸中毒,加重微循环功能障碍,不及时纠正酸中毒难以恢复血容量。
3)纠正酸中毒应用碳酸氢钠溶液,其作用迅速、疗效好。不宜用乳酸钠溶液,因为肝细胞缺氧,其功能有不同程度的损害,不能将乳酸转变成为可利用的碳酸根。
(3)血管活性药物的应用:重症急性胆管炎病人经过扩容、纠酸,血压可能升高,组织灌注改善,休克得以纠正。如果休克仍不能纠正,应该应用血管活性药物。一般临床上在充分扩容的情况下应用血管扩张剂——β受体兴奋剂,解除末梢血管的痉挛状态,改善微循环,增加回心血量及组织的血流灌注。常用的药物是异丙基肾上腺素。由于多巴胺具有多种作用,能兴奋β受体加强心肌收缩力和增加心排出量,能兴奋多巴胺受体、扩张肾动脉、肠系膜动脉,能兴奋β受体使一般动脉收缩,是临床上治疗感染性休克的常用药物。
至于血管收缩剂α受体兴奋药物,已极少单独使用。临床上应用应限制在以下两种情况:其一,当严重休克危及生命,可适当用血管收缩剂,维持血压,争取时间,为进一步抢救作准备。其二,临床上更多的是与多巴胺联合应用。
值得注意的是,在血管活性药物作用下,可能维持组织灌注,使血压稳定;对休克严重,休克时间长的病人应逐步减少血管活性药物的用量,然后停用,不可骤然停用。
当输液量很大,以及心脏功能受到一定损害时,可采用西地兰治疗。
(4)关于皮质类固醇药物的应用:由于肾上腺类固醇药物能阻断α受体兴奋,解除末梢血管痉挛,使血管扩张,降低外周阻力,改善微循环,同时增强心肌收缩力,增加心排出量,增强血管对升压药物的反应。皮质类固醇还能保护细胞内溶酶体,防止溶酶体破裂。增进线粒体的功能和防止白细胞凝集。改善毛细血管通透性,减少渗出,有助于炎症消退,减轻细菌内毒素对重要脏器的损害,有利于纠正休克。因此,长期以来人们在抢救重症急性胆管炎时,主张应用应激剂量皮质类固醇药物,以补充“相对性肾上腺皮质功能不全”。
一般宜大剂量应用,常用量为氢化可的松200~300mg或地塞米松1~3mg/kg,加入液体中静脉滴注。但近10年来,有人对二项大宗的多元因素分析研究表明,即使大剂量的类固醇药物,也不能阻止休克的进展,亦不能减少死亡率,而且肾功能不全者使用类固醇药物,还可增加死亡率。因此,最近认为,在脓毒性休克的治疗过程中,除有肾上腺功能不完全或是由伤寒杆菌引起的脓毒性休克外,使用类固醇类药物宜谨慎。此种观点尚未被普遍接受。
2.强有力的抗感染措施 控制感染是治疗重症急性胆管炎的主要环节。根据重症胆管炎的特点,在积极抗休克,准备手术时和胆道引流术后,合理选用抗生素时应注意如下几点:①选用广谱抗生素,既能抗革兰氏菌又能杀死革兰氏菌。②选用抗需氧菌和抗厌氧菌的药物。③对有肝肾功能障碍者特别是老年人,尽可能选用对肝脏、肾脏毒性小的药物,以保护肝肾功能。④根据血培养、胆汁培养与药敏结果选用对细菌敏感的抗生素。⑤在有胆道梗阻时,抗生素在血清中浓度比在胆汁中浓度更为重要。因为胆汁淤积影响抗生素在胆道的排泄,而控制败血症显得突出。只有当解除胆道梗阻行胆道引流术后某些抗生素如头胞派酮(先锋必)或头孢噻甲羧肟(复达欣)等才能获得胆汁中的适当浓度。
临床上常首选头孢菌素、甲硝唑以及氨基糖甙类药物联合使用。
3.全身支持治疗:预防和治疗全身炎症反应综合征(SIRS)和多器官功能不全综合征(MODS)自2025年美国胸科医师学会(ACCP)与危重症急救医学会芝加哥会议提出全身炎症反应综合征(SIRS)以来,SIRS引起了人们的关注,重症急性胆管炎早期即可出现SIRS,并按照SIRS-脓毒败血症(Sepsis)-休克-MODS这一病理生理过程发展。因此,在重症急性胆管炎治疗过程中应重视全身支持治疗、早期防治SIRS、阻止MODS的发生。
在积极抢救休克的同时应注意全身支持,有利于全身情况的改善,提高病人对严重感染的抵抗能力。而围手术期治疗是手术成功的保证,少量多次输入新鲜血液、血浆、白蛋白,可纠正贫血和低蛋白症,增强抵抗力。
术后给予完全胃肠外营养(TPN),提供足够的热量、氨基酸和各种必需的营养物质,防止或减少体内蛋白质的消耗,维持器官的结构和功能,促进康复。
重症急性胆管炎发生多器官衰竭并不少见,多器官功能不全综合征成为重症急性胆管炎的严重的表现和致死的又一重要原因。因此如何保护重要器官的功能,及时发现和治疗多器官功能不全综合征成为减少重症急性胆管炎死亡率的重要内容。实践证明,及时地行胆道减压和抗休克治疗是减少发生多器官功能不全综合征的关键。
(1)肝功衰竭:对重症急性胆管炎的病人,应观察其肝功能、血氨的改变、黄疸、精神状态、肢体震颤、腹水,以便早期发现肝功衰竭。
术后病人胆汁引流量与性状常常能反映出肝脏功能的情况。有时胆汁过少以及高达数千毫升稀淡的胆汁,也是肝功能不良的表现。这类病人须注意:
1)停止使用对肝脏有害的药物。
2)口服肠道抗生素,抑制肠道细菌,减少内毒素的吸收,保护肝脏功能。
3)静脉输入葡萄糖-胰岛素,给予能量、肌苷、白蛋白、支链氨基酸、精氨酸和谷氨酸钠等。
(2)肾功能衰竭:由于休克、感染中毒、高胆红素的存在常导致肾脏损害,当休克纠正后,仍然少尿、无尿则预示着急性肾功能衰竭的存在。因此积极纠正休克,进行胆道减压是预防急性肾功能衰竭的有力措施。在补足血容量后间断使用利尿剂,有利于毒性物质的排泄,可以起到保护肾功能的作用。
在少尿期、无尿期要限制水分的摄入,其补液量(m L)=不可见失水量700m L+尿量+异常损失量-内生水(450m L)。可给大量速尿,以及苄胺唑啉等。
密切监测血钾、尿素氮、肌苷。必要时可行血液透析。
多尿期需注意水电解质平衡的调节和防治感染。
(3)心功能衰竭:其治疗除用保护心脏药物,如高渗糖、辅酶A、肌苷外,应限制液体的摄入并调节输液的速度,适当应用强心剂等,必要时进行心电监护。
(4)呼吸衰竭:重症急性胆管炎术后的呼吸衰竭以肺水肿和ARDS(急性呼吸窘迫综合征)多见,病死率极高。其治疗主要是维持呼吸道畅通及氧气疗法。
(5)弥漫性血管内凝血(DIC):由于广泛的微血栓形成,加重微循环衰竭,再加上弥漫性广泛出血,可最终导致不可逆性休克。
DIC的治疗,除病因治疗外,低分子右旋糖酐与肝素合用可收到较好的效果。肝素为每4~6h静脉滴注2 000单位,4h后测凝血酶原时间。低分子右旋糖酐为每日静脉滴注500~1 000m L。以减少血液黏稠度,防止血小板和红细胞凝集。输新鲜血,给予维生素K及6-氨基己酸也可收到一定的效果。
(6)应激性溃疡的防治。
引起应激性溃疡的主要原因:①感染中毒;②梗阻性黄疸;③低血压;④手术创伤及术后合并症。
术后常规静脉给予甲氰咪呱800~1 200mg/d,严密监测胃肠减压液的性质与量,并测定pH值及时予以处理。
若胃液量由少增多,pH值由高降低,并有血性液,则预示着应激性溃疡出血。
应激性溃疡的治疗:
1)鼻胃管吸引减压。
2)静脉点滴H 2受体拮抗剂、质子泵抑制剂及前列腺素、生长抑素等。
3)用10%~25%碱性葡萄糖液,每次胃管灌入50m L左右,根据病情间歇15~45min重复使用,使胃液的pH值尽量维持在4~5以上。
4)根据情况选用内镜止血、选择性动脉插管注入血管加压素或栓塞剂。
5)经非手术治疗无效者可行手术止血,但手术死亡率极高。
值得注意的是重症急性胆管炎的围手术期治疗对提高治愈率,减少并发症有重要意义,但不失时机地进行紧急胆道减压,解除梗阻,以控制胆道感染仍是治疗的根本原则。只有采取积极的手术治疗和合理围手术期处理,挽救病人的生命,才有可能提高治愈率。
(严际慎)
第五节 原发性硬化性胆管炎
原发性硬化性胆管炎是一种罕见的胆管疾病。其发病率约为胆系疾病的0.06%~0.1%,有的文献报道较高,主要是诊断标准不同。2025年首先由法国学者Delbet描述,迄今已70年,病因尚未探明。也有称之为硬化狭窄性胆管炎、慢性纤维化胆管炎、闭塞性胆管炎。本病的特征为肝内外胆管壁纤维性增厚,管腔狭窄和闭塞,致肝内淤胆,胆汁性肝硬化,门静脉高压及进行性肝功能衰竭。即使经内、外科积极地综合性治疗,其预后不佳。
一、病因
本病病因不明,可能与下列因素有关。
(一)自身免疫病学说
患原发性胆管炎的病例,除伴发节段性小肠炎和溃疡性结肠炎外,还常伴有后腹膜纤维化、硬化性甲状腺炎(Reidels甲状腺炎)和多种自身免疫性疾病。血清免疫复合物明显高于正常人,还可自病人血清中查到自动免疫的抗体。当这些免疫复合物沉积于胆管周围时,通过激活补体,导致局部炎性病变。使用激素及免疫抑制剂治疗,可使病情暂时缓解,说明本病与免疫学因素密切相关。
(二)感染
原发性硬化性胆管炎病例,常伴有上述肠道疾病,其溃疡性结肠炎的肠黏膜溃疡致使一些病原菌得以小量持续或间断地进入门静脉系统,造成门静脉菌血症。有的学者对溃疡性结肠炎病人行结肠切除时,术中作门静脉血培养,结果部分病人血液有细菌生长。门静脉及肝内门静脉的致病菌进入胆道,继发胆道慢性炎症,胆管纤维组织增生,管壁增厚,管腔狭窄,甚至闭塞。胆管周围及汇管区亦有明显炎症和纤维化,故认为原发性硬化性胆管炎系细菌引起。部分病例具有发热,畏寒不明显,白细胞计数不增高,血中可见到不典型的淋巴细胞,胆管周围淋巴结肿大。因此认为此病之病因,可能为病毒感染(如乙型肝炎病毒或其他病毒),亦可能为非特异性感染。
(三)癌肿
原发性硬化胆管炎,根本就是一种发展缓慢的胆管癌。因部分病人多年后进行胆管检查,证实为癌。
二、病理变化
根据病变的范围不同,分为弥漫型、节段型、局限型三类。最多见者为局限型,常见肝门部或胆总管下端,或左、右肝管开口部,病变较局限,该区胆管缩窄,上方胆管扩张,可能并发色素性结石沉积。其次为弥漫型,病变遍及肝内、外胆管,是均匀一致的狭窄、僵硬,失去弹性,酷似枯树枝样改变。少见者为节段型,胆管系统同时出现多处病变。病变胆管间的距离可长,也可能较短,中间存在正常和扩张的胆管,其扩张的部分可能并有色素性结石沉积。本病的病理改变常呈进行性,但病程进展缓慢而隐蔽。如局限型可演变发展成弥漫型病变;节段型向两端延伸发展呈弥漫型。无论哪种类型,病变的胆管壁及其周围均有慢性炎性细胞浸润和纤维组织增生,致使管壁厚达5~6mm。由于胆管壁纤维化和管腔闭塞,胆管周围的肝细胞变性、坏死,导致胆汁排泄障碍和肝功能异常。基于上述慢性炎性病变,可诱发胆管内细菌感染,临床表现为反复发作的急性梗阻性化脓性胆管炎。
三、临床表现
根据病程长短,病变类型、轻重,有否并发症而出现不同的临床症状。
(一)一般症状
乏力、消瘦、食欲差,体重下降,上腹部疼痛。
(二)胆管炎症状
可表现为胆管不同程度的梗阻,如右上腹及剑突下疼痛,畏寒,发热,黄疸。经过抗感染和护肝治疗后,症状可获得暂时性缓解。但可反复发作,黄疸持续不退或呈进行性加重,表现为梗阻性黄疸,全身瘙痒。
(三)并发症
原发性硬化性胆管炎至晚期,可并发肝、脾肿大,门静脉高压症,胰腺增大,或伴慢性胰腺炎症状。
四、诊断
原发性硬化性胆管炎尚无统一的诊断标准。根据有关文献记载及目前的认识,本病诊断的依据:
(一)临床诊断标准
(1)进行性梗阻性黄疸和反复发作的胆管炎。黄疸最初呈间歇性出现,反复多次发生胆管炎后,黄疸呈进行性加重,终至持续不退。有关生化检查,结果符合梗阻性黄疸。
(2)既往无胆道外伤和手术史。
(3)此类病例,常合并溃疡性结肠炎、节段性小肠炎、后腹膜纤维化、Reidels甲状腺炎、Crohn氏病等多种自身免疫性疾病。
(4)经长期随访(至少两年)可除外硬化性胆管癌。
(二)特检诊断标准
1.B-US检查 表现为胰腺增大,光点不均,胰管扩张;肝脏肿大,结构紊乱;胆管壁增厚,与邻近组织分界不清,管腔狭窄不匀,狭窄上方胆管扩张,有时出现结石之强光团。晚期病人可显示门静脉、脾静脉增宽,脾大、腹水等。
2.X线造影 内窥镜逆行胆胰管造影和经皮肝穿刺胆道造影检查,对原发性硬化性胆管炎的诊断,有肯定的价值。X线造影片显示弥漫性肝内、外胆管普遍变细,管壁不规则,僵硬,呈枯树枝状;若为节段性病变,则呈跳跃式狭窄,狭窄中间胆管扩张呈串珠状;局限型者,则见某一部位胆管狭窄,狭窄上方胆管扩张,内有沉积物或结石。当并发门静脉高压时,食管吞钡X线造影显示,食管静脉曲张。
3.血液生化检查 碱性磷酸酶值升高至正常值的2倍以上,GPT、IGM、GGT,胆红素亦升高,75%的病人血浆酮蓝蛋白升高。
(三)病理学诊断标准
肝组织切片见胆管周围的肝细胞变性、坏死,门静脉周围纤维化,或门静脉性肝炎,或慢性活动性肝炎,胆管壁及其周围组织均有慢性炎性细胞浸润和大量纤维组织增生,使管壁增厚,管腔狭窄和闭塞,但镜下观察,胆管黏膜结构完整,无糜烂及溃疡发生,有别于原发性胆管狭窄。肝脏淤胆,胆汁性肝硬化等改变。
(四)手术所见
手术探查时:
(1)见胆管呈弥漫性硬化,肝外胆管外径正常,管壁纤维性增厚,触之为绳索条或铅笔芯状或栓塞性血管样感觉。左右肝管汇合部病变明显,且更为严重。肝门部广泛粘连,但可能分离开,此有别于硬化性胆管癌。肝胃韧带呈弥漫性纤维化,其内有肿大的淋巴结。
(2)肝脏淤胆肿大或呈胆汁性肝硬化。晚期病例,在肝门周围可见散在曲张的小静脉,脾脏肿大,并有腹水。
(3)切开胆管,内腔狭小,甚至无法放入探针。
(4)胆囊有时肿大,壁肥厚,内有结石。
五、治疗
(一)内科治疗
高蛋白、低脂肪饮食,给予大量脂溶性维生素。常用的药物有:
1.消胆胺 缓解症状,但不能改变疾病的进程。
2.类固醇激素 强的松每次10mg,3次/日。2~3周后改为每次5mg,2~3次/日,维持半年至1年。也有资料表明,长期大量使用激素,并发症多,死亡率高。武汉大学人民医院对原发性硬化性胆管炎病例的治疗常规中,主张采用小剂量激素治疗,维持3~6个月,可改善症状。
3.护肝 常用肌苷、三磷酸腺苷、辅酶A等药。
4.抗炎 应用广谱有效的抗生素,如头孢类抗生素、甲硝唑等,以控制胆系感染。
5.利胆 可中西药物综合应用。
(二)外科治疗
因本病病变弥漫,胆管壁厚,管腔向心性狭窄、闭塞,难以施行胆管切开,能做成胆肠吻合或旁路引流者甚少,胆道减压效果常不理想。因此,应严格掌握手术治疗的适应证,通常采取慎重保守态度。
手术目的是达到胆汁引流通畅,降低胆道压力,减轻肝脏的损害及排除硬化性胆管癌。一般而言,硬化性胆管癌者,胆管表面粗糙或呈乳头状增生,与周围组织呈浸润性改变,管腔内有结节样增生,触之易出血;而原发性硬化性胆管炎,管腔内膜较光滑或呈纤维化,虽与周围组织有慢性炎性粘连,但手术可以分离开。
手术方法:对原发性硬化性胆管炎目前尚无统一规范性手术,一般根据病变类型而定。具体措施:①对主要胆管之局限性狭窄,可切除病变狭窄部分,并于病变近端正常或扩张胆管段与空肠行Roux-en-y吻合术;若狭窄部分切除困难,在作胆肠旁路引流术时,吻合口应尽量远离病变胆管,以免炎性病变发展波及吻合口,造成狭窄或闭锁。②对胆管狭窄并发急性梗阻性化脓性胆管炎者,应切开狭窄胆管,在狭窄上方置T形管引流。③若胆管狭窄范围较长,先逐步扩张狭窄区,然后置入一聚乙烯管穿过肝表面引出,作U形管引流。为避免引流管堵塞,每3个月更换一次,持续放置1~1.5年,有的甚至终生带管。也可用细T形管的一端插入病变以上的肝内胆管,一端通过壶腹部置于十二指肠内,作为长期引流,可防止胆汁丢失。④若肝外胆管周围呈重度炎性水肿或小静脉曲张,容易出血;或胆管细小,难以寻找时,可采用经皮肝穿刺胆管置管引流术,若胆管细,置管困难,也可切开肝实质,寻找肝内胆管,置管引流。⑤对晚期病变并门静脉高压症状者,宜施行门—体静脉分流术,借以降低门静脉压力,作为日后施行胆道手术的准备。
总之,对原发性硬化性胆管炎,迄今尚无理想的治疗,无论应用何种方法,仅能使病情暂时缓解,最终仍发生肝衰竭而死亡。故必须对病因、病理变化深入研究,改进治疗方法,才可能取得较好疗效。
(张英民)
第六节 胆 石病
胆石病为胆囊结石、肝内胆管结石及肝外胆管结石的总称。肝内胆管结石和胆囊结石都是原发病,而肝外胆管结石可以是原发于胆管系统亦可继发于胆囊结石。位于胆道系统的两个不同部位的结石,其发生原因、结石的性质及临床过程不完全一样,但它们出现一系列类似的临床症状,同属于一个系统的病变,处理原则及方法有着一致或相似的地方且关系十分密切。
胆石病的发生率:胆石病在我国是一种常见病,准确的发生率尚不清楚。由于B超诊断仪的广泛应用,国内在一些特定人群中普查结果表明城市人口中胆石病的发生率为1.7%~9.0%(2025年),其中城市人口的发生率高于农村,脑力劳动者高于体力劳动者。中华医学会胆道外科学组的全国胆石病临床流行病学调查(1983-1985)对11 342例手术病例的分析,胆囊结石占52.8%;胆囊、胆总管结石占11%;肝胆管结石占20.1%;肝内胆管结石占16.1%;胆囊结石与胆管结石的比例约为1.5∶1。20世纪80年代后期天津等地累计10万人的资料显示,总的胆石患病率为0.9%~10.1%。2025年(上海)第二次全国性调查:胆囊结石和胆囊胆管结石比例增加,肝内、外胆管结石比例数减少,单纯胆囊结石占78.9%。估计目前胆囊结石所占比例有上升趋势。
胆石的分布:按照结石所在位置分为3种。
1.胆囊结石 为胆固醇结石或以胆固醇为主的混合性结石,胆囊结石占全部胆石的60%以上,70%的胆囊结石是胆固醇结石。
2.肝外胆管结石 多为胆色素结石或以胆色素为主的混合性结石,多为原发性结石,另有部分从胆囊排至胆总管的胆固醇结石。肝外胆管结石约占全部胆石的20%左右。
3.肝内胆管结石 为胆色素结石或以胆色素为主的混合性结石,可分布在肝内各级胆管内,左侧肝管多于右侧肝管。结石大小不一,多个或呈铸形结石或呈胆泥样,常并有胆道积脓。占全部胆石的20%左右,而90%以上原发性胆管结石是胆色素结石。
胆石的分类:根据化学分析按所含主要成分分为4类。
1.胆固醇结石:以胆固醇为主要成分,含量70%~90%。在各种胆石中,胆固醇结石约占60%,80%的胆固醇结石在胆囊中。胆固醇结石质硬,呈多面形或椭圆形,有单发或多发、淡黄色或灰黄色。结石的剖面呈放射状排列的胆固醇纹路,并有一层含色素较多的核心。
2.胆色素结石:以胆色素为主,棕红色或黑褐色,多发,大小不一,形状不规则,质软易脆,有的呈泥沙样。剖面呈层状,无核心,因含钙量较少,X线检查多不显影。在各类结石中胆色素结石占32%,70%以上的胆色素结石在胆管中。
3.混合性结石:由胆固醇、胆色素、钙盐多种成分混合而成。其色泽和性状依所含成分而异,剖面呈层状,有的中心呈放射状而外周呈层状,因含钙较多,X线检查常显影。混合性结石占全部结石的6%左右。
4.黑结石:黑色,呈圆形。有的有针刺样突起,含胆红素、钙、黏蛋白。多在胆囊内。
我国地域辽阔、人口众多,人们的饮食结构、饮食习惯、生活水平、卫生环境有很大的差异,对结石的形成及胆石的发病,会产生极大的影响,甚至起到很大作用。如结石的分布,地域不同,差异很大。华南、东北、华东、华中地区,肝内结石的比例明显高于华北、西北、天津、上海等地。而西北、天津、华北、上海等地区胆囊结石的比例明显高于东北、华南、华东、华中等地。结石的分布不同,其结构和性质不一样,肯定对其诊断、治疗及预后带来诸多不同的问题。
一、胆囊结石
【临床表现】
结石形成,结石的大小,是多个还是单个,一般说是不清楚,只有在发作疼痛,寻医就诊,通过检查才能发现有结石,或者由于其他疾病就诊时意外发现。目前,自然人群体检时也发现一部分结石病人,对体检发现的胆结石人群仔细询问病史,常常从未发生腹痛,故称此为无症状的结石,或静止状态的结石。此外尸检也可以发现一部分无症状的结石病人。可惜目前对胆囊结石的准确发生率尚不清楚。
(一)上腹疼痛为胆囊结石发作的典型症状
胆囊结石形成到出现症状,对每个病人来说,常无衡定的规矩可循。通过仔细地询问病史得知,出现症状前饱胀或油腻饮食往往是重要诱因,其次相当一部分病人是在夜间或静止状况下发生症状。此外也有所谓乘车颠簸之后发生腹痛。什么时候出现症状是难以预知的,但出现症状的原因是清楚的,即结石梗阻是产生症状的原因。发病时B超发现胆囊肿大及结石嵌顿在胆囊颈管、胆囊管,而且手术证实如此,说明结石引起梗阻才产生症状。产生梗阻后病变的发展变化其轻重程度是不一致的,其临床症状表现为以下3种情况:
(1)典型的胆绞痛:当结石引起梗阻时,胆囊内压力增高,表现为上腹或右上腹剧痛,阵发加剧,持续加重,并向右侧肩背部放射,伴恶心呕吐,检查发现右上腹压痛,重者出现肌紧张,Murphy征阳性。
(2)典型发作绞痛:经过治疗后症状缓解,日后可反复发作,轻重不等,有时为绞痛,有时为胀痛,不适,伴背部疼痛及消化道症状。
(3)部分病人,多是较大的胆囊结石者,常无典型胆绞痛,可是经常有上腹不适、胀痛、肩背部胀痛、消化不良。
(二)继发胆囊及胆囊外的并发症
胆囊内细小结石可随着胆囊收缩、胆汁排出一起排至胆总管,继经胆总管下段,排至十二指肠。此为自然排石过程,这是药物排石的理论根据。如果一定大小的结石在胆囊管受阻或嵌顿时,胆囊收缩,胆汁亦不能通畅排出,致使胆囊内压力升高,而产生一系列的病理变化,除引起剧烈疼痛外,由于高度浓缩的胆盐刺激,致胆囊黏膜损害。胆囊黏膜炎症、充血、水肿、渗出,进一步使胆囊内压增加而发生胆囊水肿、出血、坏疽、化脓等类型的急性胆囊炎的病理改变。当胆囊出现炎症、化脓、坏疽时,网膜、横结肠、十二指肠和胃将肿大,发炎的胆囊粘连、包裹。经过治疗多数可以好转,坏死的黏膜修复、溃疡愈合、水肿消退、纤维化及瘢痕组织增生、胆囊壁增厚等慢性炎症改变。此时胆囊仍肿大,积液、积脓或萎缩,并局限于周围组织包裹中形成一个巨大的炎性包块,也可以反复再发作。较大的结石则可以填满胆囊颈、哈氏袋,甚至整个胆囊,并向肝总管、胆总管前方纠集,因反复的炎症水肿、瘢痕愈合及增生,致肝门前方呈瘢痕胼胝样改变。
当横结肠、网膜、十二指肠及胃、包裹坏疽穿孔的胆囊,同时胆囊管结石嵌顿不能缓解时,常可发生胆囊结肠、胆囊十二指肠或胆囊胃内瘘。
当结石排至胆总管或胆总管下端发生梗阻,此时除胆道梗阻、胆绞痛外,同时寒战高热、黄疸,称为Charcot征,为梗阻性化脓性胆管炎。
此外小结石在排至十二指肠过程中可以刺激并损伤Oddi括约肌处的胆管黏膜,使Oddi括约肌水肿、痉挛,或结石嵌顿于壶腹部,致胆、胰管内压力增高,胆汁返流至胰管内而诱发急性胰腺炎,并可反复发作,此即为胆源性胰腺炎。化验检查发现血、尿淀粉酶升高,同时白细胞升高,核左移,血清胆红素增高。
(三)Mirrizzi综合征
为一特殊的解剖及病理情况下的胆囊结石,具有以下特点:①胆囊管低位开口于胆管,并与肝总管并行行走。②胆囊结石、结石嵌顿于胆囊管内。③胆囊管结石压迫肝总管,继发肝总管部分狭窄、梗阻,可以出现梗阻性黄疸。④反复发作的胆管炎。⑤部分病人可以发生胆囊管、肝总管内瘘,因此有结石移至肝总管、胆总管。临床上对这种类型的胆囊结石,术前常常不能得到明确诊断,给手术带来一定的困难,在分离胆囊管时由于未警惕这种特殊的解剖结构(特别在早期病例)而损伤肝总管。如已发生胆囊管、肝总管内瘘,处理不当则术后发生胆管狭窄。
【诊断】
主要依靠病史及检查发现,特别是通过B超检查可以确诊,其他影像CT、MRCP对有胆囊结石合并胆囊外并发症者是有价值的。
要求通过B超检查了解:①是否胆囊结石,结石大小、单发或多发;②胆囊的大小及胆囊壁的厚度;③胆总管的内径(是否合并胆管结石);④了解肝脏病变情况;⑤有时可以发现胆囊管,并可测出胆囊管内径及长度。了解胆囊的大小、胆囊壁的厚薄及肝门部软组织的强回声情况,评估胆囊三角及肝门部炎症粘连、瘢痕病变情况,为选择手术方法提供参考。确定胆总管、肝总管是否扩张、有无结石,评估有无胆总管探查的指征。了解有无三管征,即:门静脉、肝外胆管、胆囊管,常是判断mirrizzi征的重要依据。当B超提示胆总管有轻度扩张时,术前应行ERCP或MRCP检查,以了解胆总管内病变情况。
【治疗】
有症状的胆囊结石,诊断明确,一般都考虑手术治疗,方法是胆囊切除术。一般情况极差,而不能耐受较长时间手术,或术中因严重粘连、局部解剖关系不清,应行胆囊造口待病情好转后再行胆囊切除术。对于高龄且合并高血压、冠心病、严重糖尿病和其他器官严重病变者应慎重进行,应在合并病控制后才能考虑手术。
胆囊结石、急性胆囊炎,除并发胆囊穿孔时应急诊手术外,一般应积极地纠正水电解质平衡,抗感染,情况改善后手术。一般在发病3~7d内手术为宜,再晚些时则局部炎症缓解、水肿吸收、溃疡及坏疽等病变尚在修复、愈合过程中,此时局部解剖层次不清,反倒难以分离,易出血,往往需延迟至3个月后行胆囊切除较为安全。
腹腔镜胆囊切除术由于创伤小,痛苦少,恢复快而深受病人欢迎,一般是首选的手术方式,其适应证应视手术设备情况、技术熟练程度逐步扩大手术范围。应该强调的是:①重视腹腔镜胆囊切除的适应证。②加强和重视腹腔镜医师的培训和管理。③术中遇到粘连严重、解剖不清,特别是胆囊三角无法分离、解剖、出血不易控制等情况时,提倡主动中转开腹手术,而不是造成不可逆的损伤后才被迫开腹改变手术方式。被动中转开腹手术是不可取的。④LC手术是一个更精细、更轻柔、更准确的手术,要求医生高度负责,集中精力。
如胆囊结石,继发胆总管结石,条件允许可采用二镜或三镜结合法,处理胆总管结石及胆囊结石而不需开腹手术:即腹腔镜胆囊切除+胆总管探查,术后经“T”管窦道取石;腹腔镜胆囊切除+术后EST。由于微创技术的发展,肝外胆管结石甚至部分肝内胆管结石有望在LC术时同时或相继得到良好的治疗,免除开腹手术的痛苦,同时缩短了开腹探查胆总管所花费的时间。但对无条件行LC术或无LC术适应证,而需剖腹手术者,为了不遗漏胆总管病变仍需探查胆总管,其适应证为:①胆总管显著扩张;②影像学检查及术中探查发现胆管病变;③探查时发现胆总管内有结石;④胆囊管明显扩张同时胆囊内有细小结石者;⑤合并化脓性胆管炎;⑥阻塞性黄疸,伴胆总管扩张;⑦胰头肿大,胆管扩张,有急性胰腺炎病史者。胆总管探查后需常规安置适当粗、细的“T”形引流管,并在温氏孔旁放置引流管一根。
二、胆总管结石
胆总管结石可以是原发于胆管系统的所谓原发性胆管结石,其成分是胆色素结石或以胆色素为主的混合性结石;亦可能是胆囊结石移位至胆总管,其结构成分与胆囊结石完全相同,故称继发性胆管结石。
【临床表现】
不论是原发性或是继发性胆总管结石,如结石下降到胆总管下端刺激Oddi括约肌,或在胆总管出口处暂时滞留,引起Oddi括约肌痉挛及胆总管下端流出道梗阻,就可能致急性发作性胆绞痛,亦可能出现黄疽,也可能诱发急性胰腺炎。病程发展可以自然缓解,亦可经合理治疗,结石排至肠管,症状缓解。更多的是胆囊内较多的结石下降至胆总管,或胆总管内已有较多大小不等的结石存积,经过治疗后暂时缓解,以后仍会反复发作,因饮食不当或无明确诱因再次发作。如结石阻塞胆管,并发感染,则剑下及右上腹可出现典型的剧烈的刀割样绞痛,疼痛可以向右肩部放射,伴恶心、呕吐。同时出现寒战、高热,相继出现梗阻性黄疸,即Charcot三联征。如梗阻不能缓解可发展致中毒性休克、谵妄、昏迷,即急性梗阻性化脓性胆管炎。体检发现剑下和右上腹压痛、反跳痛,腹肌紧张,有时触到肿大的胆囊。胆总管结石在症状缓解期间其临床表现多样,胆总管直径可能增粗至2~3cm,其内含有大量结石,而无明显症状、体征;常有不同程度的上腹不适、腹痛,可表现有轻度的全身性黄疸,或轻度发热、畏寒;多数病例会有典型发作的病程和典型的症状、体征。实验室检查可发现白细胞计数明显增高,核左移,血清总胆红素及1分钟胆红素增高,尿中胆红素阳性。
胆总管结石,特别是1cm左右的结石,下降到壶腹部,可以在典型的腹痛或非典型的症状后,结石嵌顿在壶腹部而引起胆道梗阻。此时可因腹痛不重或无腹痛和发热、畏寒等感染表现,仅有黄疸且进行性加深,甚至出现肝功能受损。此时可误认为肝炎或肿瘤,鉴别诊断时应予注意。
胆总管结石致胆管阻塞及反复发作的化脓性胆管炎,可以引起胆总管十二指肠或胆总管横结肠内瘘,加重胆道感染。胆管结石,尤其是有胆囊内多发小结石时,在排石过程中可致胆总管出口处括约肌痉挛,黏膜损伤、水肿、充血,从而引起Oddi括约肌狭窄,此类小结石也可引起严重的梗阻。
【诊断】
对有典型症状、体征的胆总管结石的诊断是不困难的,结合实验室检查及适时B超检查,更能明确诊断。鉴别诊断方面应当引起注意的有:①腹痛剧烈而又非典型时,应与肾绞痛、上消化道穿孔性病变、急性胰腺炎鉴别;②右上腹绞痛不典型、感染症状不重时,有逐渐加深的阻塞性黄疸,B超检查仅能揭示胆总管和肝内胆管扩张,此时应与胰头癌、壶腹周围肿瘤鉴别;③伴有慢性肝病、胆管病变的胆总管结石病例,特别是壶腹部嵌顿的结石者,常仅表现有阻塞性黄疸、而B超检查仅发现胆管轻度扩张或扩张不明显,更难以发现胆管内结石,常易误认为肝脏病变而延误诊断及治疗。
MRCP、ERCP、十二指肠低张力钡餐检查都有助于鉴别,必要时在手术中应用纤维胆道镜检查、术中胆道造影都有利于明确诊断。个别病例在必要时PTC检查仍是重要的诊断措施。
【治疗】
胆总管结石的治疗仍然以外科手术为首选。手术前后均应注意水、电解质和酸碱失衡的纠正,重视在阻塞性黄疸状况下凝血机制和肝功能受损的处理,重症感染时抗生素的合理应用,认识手术前、后给病人足够营养支持的重要性。
手术治疗的时机:①症状轻、有发作史者,可在间歇期择期手术治疗。②胆总管结石合并急性胆管炎及阻塞性黄疸时应早期手术。③胆总管结石合并重症胆管炎时,应积极术前准备后急诊手术,或在PTCD后情况改善、诊断进一步明确,尽早手术。
手术方法:胆总管结石常在手术前可获得较准确的定位诊断,术中仍应充分常规探查、术中胆道镜检,有条件时辅以术中胆道造影,用以明确胆管内病变情况、抉择具体术式:①若胆总管上、下端均通畅无狭窄,取净结石放置T管引流。②上端通畅,下端狭窄,可以选用Roux-y胆总管空肠吻合术,如病人情况较差、年迈,或已有多次手术史者,胆总管扩张在2.5cm以上可行胆总管十二指肠吻合术。如为胆总管下端或壶腹部嵌顿结石,视嵌顿结石的情况而定。有时在麻醉下,轻轻地探查就可将结石推入肠管;而对嵌顿甚紧的结石,欲用暴力推入肠腔是危险的。此时应该用纤维胆道镜检查,先在镜下用盐水冲洗,确认是结石嵌顿,再用取石钳或胆匙取石或镜下用网篮取石,若仍然不成功时,可施行十二指肠切开,在胆道探子的引导下,找到十二指肠乳头开口处,切开Oddi括约肌,能顺利地、安全地将结石取出,随后施行Oddi括约肌成形术,可取得良好效果。③如合并肝内胆管结石,则应按肝胆管结石处理。
对单纯胆总管结石可以考虑行纤维十二指肠镜下乳头切开或括约肌切开术,应用网篮取石;或经PTCD窦道扩张后经肝行纤维胆道镜检查并取石;或经扩张的窦道,用气囊导管扩张Oddi括约肌,以利结石排出。腹腔镜胆道手术的发展已能在腹腔镜下行胆总管切开探查,并施行胆道镜检查及取石。显然目前腹腔镜技术的发展使部分胆总管结石病人免受剖腹手术痛苦已成为可能。
三、肝内胆管结石
肝内胆管结石为原发于胆管内的结石,是胆石病中最复杂、最难治的一种。结石的成分以胆色素为主,胆固醇含量甚少,大者可达2~3cm直径或铸型结石,形态常不定,大小不等,最小者呈泥沙样,甚至为糊状胆泥。成形的结石极易压碎,切面可呈分叶状。结石可以局限在某一肝叶或肝段内;可以在肝段、肝叶或半肝内成区域性分布;亦可广泛遍布肝内胆管及肝外胆管。1983-2025年全国11 342例胆石手术病例的调查:肝内胆管结石的发生率占胆石病的16.1%。国内不同地区肝内胆管结石的相对发病率差别很大,如新疆和上海胆石病手术病例中肝内胆管结石仅4.5%和4.55%。而同期广东汕头和福州肝内胆管结石的发病率43.1%和38.8%。我国从四川中部以东的广大地区,日本、朝鲜及东南亚地区本病的发生率较一般地区都高。该病发生与社会经济状况、饮食习惯、卫生条件有密切关系,农村肝内结石的发生率明显高于城市。
【肝内胆管结石的特殊性】
(1)肝内胆管结石的形成与胆管内急、慢性炎症,寄生虫病,细菌感染,胆汁淤滞,营养及代谢等因素有关。对一个肝胆管结石的患者常可追溯到其在孩童时期就有反复绞痛及蛔虫病史。肝叶切除时切开的肝内胆管中会有大量的胆泥外,常见有脓性胆汁,培养有细菌生长,其细菌生长率高达97.55%。胆管壁组织学检查有大量炎性细胞浸润,或胆管源性多发脓肿形成,表明胆石与感染有关,而胆石形成与胆汁淤滞、胆道感染、胆管狭窄有密切关系,彼此之间有着密切的因果关系。
(2)肝内胆管解剖复杂、变异较多,其结石的分布也相当复杂,既可以广泛分布,即两侧性、多肝段胆管内都有结石,也可以是局限性分布,常在肝的一侧;局限于一段或几段的胆管内,且不伴肝外胆管结石,特别是双侧肝内1级和2级肝管以上的多处胆管众多结石,其诊断和治疗是十分困难的。
肝胆管结石虽极难根治,但对其合并症的外科治疗已有很大进步,但治疗效果仍有待提高。据国内资料肝胆管结石手术治疗后残余结石的发生率仍很高(20%~40%),再手术率也高(37.14%~60%)。所以肝胆管结石及其外科并发症仍是良性疾病中最复杂、最困难的问题之一。
【病理解剖特点】
1.结石的分布:根据手术所见,结石可以分布在肝内胆管的任何分支,或广泛或局限地存在于整个肝胆管系统甚至遍及全胆道系统。
(1)细小结石仅在肝内胆管的某一叶的段内的小胆管支内,为局灶型。
(2)结石位于I级肝管起始部以上,呈多发、铸型结石,一侧或双侧性,为区域分布型。
(3)结石位于左、右肝管起始部以上,多发、单侧或双侧性。局限或散在,为弥散型。
(4)一侧或双侧肝内胆管及肝外胆管多发性结石,甚至合并有胆囊结石。为多发(广泛)型或复杂型。
2.胆管病变:胆管的病变是胆管梗阻和感染的结果,表现为胆管壁增厚,其增厚的程度是不一致的,管腔狭窄的位置几乎都在同一级肝管的出口处(图20-2、图20-3),呈局限性环状狭窄,狭窄上方胆管扩张。扩张的胆管腔内均填满结石,结石可以为铸型成块结石、泥砂样结石或脓性胆泥。术中胆道镜检查时可以见到胆管黏膜充血、水肿、出血灶及溃疡。胆管壁组织学检查可见:急性期出现管壁化脓性炎症改变及溃疡形成。急性化脓性胆管炎可导致细小胆管壁坏死,感染、脓肿形成,向肝实质蔓延形成肝脓肿,如侵蚀胆管旁动脉可发生肝内胆道出血,细菌和胆砂石进入受损肝静脉或门静脉系统分支内,发生败血症、胆砂石脓血症和脓毒性休克。脓肿向横膈蔓延可形成胆胸瘘,穿破肺可发生支气管胆瘘。急性感染得到控制,胆管壁内结缔组织增生,呈慢性纤维增生性胆管炎,胆管的这种病变将引起和加重胆管狭窄。

图20-2 肝胆管结石,左半肝切除标本箭头示切开的左侧肝管内填满结石

图20-3 肝胆管结石 箭头示左肝管开口处环状狭窄上方胆管囊状扩张
3.肝脏损害:一侧或一叶肝胆管的阻塞、胆管内压增高,引起门静脉支受压,先是管径变细、不规则,发生狭窄或闭塞。肝小动脉则代偿扩张,继之动脉壁增厚、管腔狭窄,终致阻塞,部分肝脏血流量减少。随着胆管阻塞持续加重,肝脏血液的灌流量进一步减少,汇管区纤维化进行性加重,肝细胞减少,直至完全消失,肝纤维化和萎缩。肝内胆管结石引起胆管阻塞及化脓性胆管炎以致胆道高压和高胆红素血症,引起肝内小胆管破裂,伴随着大量细菌和毒素经肝窦入血或渗入小胆管间隙,引起胆管周围炎。同时因胆管阻塞引起血管的改变,先是小动脉内膜炎、管腔狭窄、闭塞,引起肝小叶中央变性坏死、门脉区大量炎性细胞浸润及纤维组织增生、新生肝小叶结节形成,终致胆汁性肝硬化,相继发生门静脉高压症,食管、胃底静脉曲张和大出血。
4.肝脏形态的变化:肝胆管结石致肝实质受损、病变区域肝萎缩、肝纤维化,无结石或病变较轻的肝组织可以代偿增生、肥大,以致肝脏形态发生变化,肝左叶胆管结石引起肝左叶萎缩时,肝尾叶明显增大,使肝门变浅,肝中裂向右移位,萎缩的肝左叶可向前或向上移位。肝右侧胆管结石,引起肝右叶萎缩,肝左叶则代偿增大,肥大的肝左叶向右可达锁骨中线,甚至达腋中线位置,胆囊和萎缩的肝右叶挤向右上方。此时肝门抬高,并向右后移位,肝门部结构发生逆时针旋转移位。
【临床表现】
局限在某一细小胆管内的小结石,即B超检查偶然发现直径0.5cm左右的肝内小结石,一般无症状,实际上不需治疗。区域性结石可能无症状,仅有上腹不适、肝区胀痛。当合并感染时可能出现上腹部肝区胀痛、不适,发热,可有恶心、呕吐等上消化道症状,严重时出现寒战、高热。一侧肝胆管结石,当出现胆道梗阻和感染时,可以出现上腹部疼痛,仍以胀痛为主,依梗阻的程度及感染情况,出现不同程度发热、消化道症状,一般不会出现黄疸,出现黄疸多为较低位的肝管阻塞。肝内多处结石合并感染,常常仅有畏寒、高热,甚至出现感染性休克,而无明显腹痛。如结石下降至肝外胆管或合并肝外胆管结石,则表现为胆总管结石的症状和体征,如急性发作则出现典型的化脓性梗阻性胆管炎的临床表现。肝胆管结石患者在未合并严重感染或感染控制后可以无黄疸,但有不同程度的肝区疼痛、胸背部持续性胀痛。在合并胆总管结石梗阻及感染时则有典型上腹剧痛、寒战、高热、黄疸,重者出现休克、神经精神方面的症状,甚至可以并发多发性胆源性肝脓肿。如感染未予及时控制,脓肿可穿破到膈下,直至穿破横膈到肺,形成支气管胆瘘,除上述特点外同时出现肺部感染,咳嗽黄色、苦味的痰液,甚至为胆汁。
【诊断】
肝内胆管结石因无特异性的症状和体征,过去常常是在胆道手术中检查发现或是在手术后经T管造影时发现。自B超检查广泛应用于临床及特殊检查MRCP及ERCP的推广应用,在手术前对肝胆管结石已能作出定性和定位诊断。B超检查的普及为诊断肝胆管结石提供了准确、灵活、简便、经济而又无损伤的诊断方法。MRCP及胆管的直接造影(PTC及ERCP)可以将立体胆管树展示在平面图像上,且可以变换体位,显示正、侧位及斜位的图像,结合X线透视录像全面观察胆管的解剖变异、病变情况。肝胆管结石的X线表现:①肝内胆管扩张并在扩张的胆管内见到一个或多个大小不等的负影;②一侧或某一叶段的胆管不显影,常是该处胆管狭窄的上缘结石嵌顿堵塞于胆管开口处;③肝内胆管的某一部分不显影;④显影的左、右肝管呈不相称或孤立的几处扩张;⑤肝内胆管局限性扩张。PTC检查在肝内胆管扩张的病人几乎都能穿刺成功,但应注意并发症的发生。ERCP检查需要一定的设备和操作技术,成功率可达90%以上,对肝胆管结石而胆管扩张不显著或凝血机制异常不宜于PTC者,更显示出其重要的临床价值。对诊断而言此两种检查可以互相补充,有利于进一步明确诊断。当PTC和ERCP失败或无条件进行此检查时,对无黄疸、肝功能正常者,可行静脉胆道造影,仍可获得良好的胆管显影,有助于诊断。
B超引导下的经皮肝穿胆管内置管造影,可以减少损伤,提高穿刺成功率,且能达到引流目的。当胆管造影发现一侧胆管不显影时,可在B超引导下行对侧的穿刺造影(即选择性胆管造影),以进一步达到胆管良好的显影。胆管的直接造影(PTC及ERCP)能更好地显示肝内各级胆管,对肝胆管的病变及胆石的诊断是确定无疑的,但由于有损伤性且有一定的风险,另还有放射损伤之虞。目前MRCP及CT检查能显示胆石和胆管及肝实质的病变,具有无损伤且安全性大等优点。但不能很完整地显示胆管树的全貌,且对胆管炎及胆管狭窄的诊断存在一定的问题,胆管成像的好坏对诊断价值有直接影响。
手术中B超检查、术中胆道造影、术中胆道镜的应用,对进一步寻找病变、补充诊断,取净结石,选择恰当的术式,依具体条件适时选用,都是有用的,尤其是胆道镜检为胆道外科所必需。
通过以上各项检查明确诊断,为治疗提供依据,在手术前应明确以下问题:
(1)是否为结石,是否为肝内胆管结石。
(2)结石的大小、位置:即结石在哪一叶、段的胆管内,哪几个叶、段胆管内。
(3)胆管是否扩张,扩张的程度、范围。
(4)有无胆管狭窄、狭窄的程度、狭窄的位置、多少处狭窄。
(5)是否同时有胆囊结石、肝外胆管结石,胆总管扩张程度。
(6)是否已有胆汁性肝硬化及门静脉高压。
(7)肝脏形态变化情况。即一侧肝萎缩后另部分肝脏代偿增大的情况、肝形态变化、肝段标志、肝门位置等的变化。
【治疗】
肝胆管结石的治疗是采用以手术治疗为主的综合性治疗,还不能达到对病因的根治性治疗,如诊断准确、治疗方法得当,良好的营养支持及周密的围手术期的处理,一般可取得较好的效果。其措施包括手术治疗、内镜取石、抗生素的应用,溶石及碎石治疗亦在尝试之中。
手术时机:诊断明确,最好择期手术,由于肝胆管的解剖复杂、变异多,肝内结石、胆管阻塞、反复发作的炎性变化所致肝、胆管病理变化的演变无统一的模式,结石的分布及大小亦无特殊规律可循,所以手术方法需根据个体情况决定。术前应有一个初步可行方案,同时应根据术中新发现具体处理。肝胆管结石合并急性化脓性胆管炎,最好在急性炎症控制(包括积极的抗感染、PTCD或鼻胆管减压、支持治疗)后,病情缓解,择期手术。因为急诊情况下肝内结石的诊断不清楚、病人情况差,不能耐受较长时间的手术、也不能对肝胆管结石进行较彻底的治疗。如确实需要急诊手术,则应取出关键结石,引流胆管,并应特别注意水电解质平衡及抗感染治疗。
外科治疗应达到的目的有:①去除病灶,即切除已萎缩、纤维化的及伴有小脓肿形成的毁损肝叶;②尽可能取净成块的结石和胆泥;③处理胆管的病变:即切除含有过多狭窄且无法矫正的狭窄胆管的肝叶、肝段,近端狭窄胆管的切开及整形;④建立合理、通畅的胆肠内引流;⑤为手术后辅助治疗预置的措施(包括经肝断面胆管置管及空肠盲袢预留或置管)。
手术方法:应根据影像检查的综合诊断及术中发现,修正并完善诊断,依个体情况制定手术方案。一般应当包括以下几个方面的联合手术:
1.取净结石:经不同途径显露、切开胆管,直视下取净结石,必要时行狭窄胆管整形,为胆肠吻合准备条件。
(l)经胆总管、肝总管切开,需要时可切开左、右肝管及狭窄胆管,取净结石、胆管整形、扩大胆管出口。而在下面两种情况时放置T管引流:①肝内、外胆管结石伴胆总管扩张、无胆管狭窄者;②肝内、外胆管结石伴胆总管扩张,合并胆管炎,因全身情况欠佳不宜扩大手术或无条件进一步明确病变扩大手术者。
(2)经肝方叶切除或肝中央肝部分切除途径:显露并切开肝总管、左右肝管直至双侧Ⅱ级肝管开口。当左右肝管内均有结石、伴Ⅰ-Ⅱ级肝管狭窄时,切除肝方叶(图20-4),使肝总管、左右肝管得到良好的显露,为设计切开狭窄的胆管,解除狭窄、取净结石、狭窄胆管整形、建立胆肠引流提供一个宽敞的手术空间和进路。

图20-4 肝方叶切除显露左右肝管
(3)当肝门部粘连、合并门静脉高压症致肝门部满布扩张的门静脉分支,难以经肝门进入胆管,此时视结石的位置、胆管病变及肝脏病变情况而采用的方法有:①经胆囊床肝实质切开或肝中裂切开显露右侧胆管;②经肝左外叶切除、左外叶上、下段切除、经肝断面的胆管进入左肝管;③经肝表面结石感明显处切开进入肝胆管;④经肝圆韧带和镰状韧带左侧缘切开肝实质,沿肝圆韧带向后分离肝实质,显露门静脉左外叶下段支及伴行的胆管,由此切开扩张的左外叶胆管下段支。应该说上述4种胆管开口,除肝左外叶上、下段切除后的肝断面胆管可行LONGMIRE术外,其他3种入肝的胆管开口都不宜应用于胆肠吻合。因此当进入胆管,取净结石,需要行胆肠内引流或其他胆管内有结石时,仍然需要经肝门处理。此时需要经上述进入胆管的开口,应用探条引导进入左、右肝管到肝总管,并在探条引导下切开肝总管及胆总管,继续取石或处理胆管病变。
(4)当肝门部胆管切开后应根据影像检查及术中分离、解剖所见,辨别胆管行走方向及狭窄情况,用细胆道探子引导切开狭窄环,并设计切开方向(以利整形)和长度,完成取石及狭窄胆管整形。只有通过整形扩大了的肝门胆管所建立的胆肠内引流,才是有利于胆汁排出的理想通道。(https://www.daowen.com)
2.病损肝叶切除:肝叶切除可达到去除主要的感染病灶、取净结石的目的,对局限在一侧肝叶或某一叶段的结石及其所引起的肝、胆管多发病变和毁损肝叶,肝叶切除是最佳的选择。
(1)肝叶切除的适应证:
1)肝胆管结石、已有区域性肝萎缩、肝纤维化。
2)肝胆管结石已并发多发性胆管源性小脓肿形成。
3)合并肿瘤。
4)胆石病合并胆道出血。
5)肝左叶、左外叶肝胆管多发结石、多处狭窄。
6)右肝管结石合并胆瘘、感染时。
(2)肝胆管结石行肝叶切除术的注意事项:
1)由于胆道梗阻、反复发作的胆管炎所致肝脏的病理改变致肝脏形态发生变化,使正常肝裂的标志变化或消失,切除范围常要依具体病变情况而定,要特别警惕勿损伤肝左静脉、撕裂腔静脉及门静脉矢状部。
2)由于肝胆管结石患者常有多次手术史,肝门部粘连严重,温氏孔常因粘连完全封闭,阻断肝门及解剖肝门血管都异常困难。
3)肝胆管内填满胆泥、脓性胆汁,故在断肝、切断胆管时应特别注意保护肝创面,尽量避免污染以减少术后感染、胆瘘及慢性窦道的发生。
4)肝叶切除后,肝断面的胆管开口应作相应处理:结扎或置管引流。
3.胆肠内引流的建立:合理有效的胆肠内引流术是肝胆管结石外科治疗中一个重要的影响整个手术效果的关键所在。肝门胆管空肠吻合术的适应证:①肝总管狭窄伴肝内胆管扩张及肝胆管结石。②左、右肝管开口狭窄、肝内胆管扩张伴结石。③肝胆管结石伴左、右Ⅱ级肝管狭窄者应尽量通过肝部分切除,处理了狭窄后再行胆肠内引流术。
肝总管十二指肠吻合术的适应证:①肝内、外胆管结石,合并胆总管下段狭窄,在尽量取净结石后,而且肝内胆管无明显狭窄。②胆总管直径大于2.5cm,最好横断胆总管。③老年、体弱的肝胆管结石、胆管扩张者。
去除病灶、解除狭窄和取净结石是通畅引流的基础。在吻合口以上胆管不再存在胆管狭窄和结石阻塞是胆肠吻合术的基本原则,选择哪一种术式主要视梗阻部位、胆管狭窄及扩张的程度而定。各种术式都有其优点与不足之处,术者施行手术的技巧及熟练程度对施行的术式也是有影响的。为建立合理、有效的胆肠内引流术,需注意以下几点:
(1)对公认的弊端或不足之处,应尽量避免或及时采取必要的辅助措施:如胆石未取净,采用任何术式都不能达到理想的结果。因此除了在手术中尽量将结石取净,将病损肝叶切除外,在行胆肠内引流时,可以预置空肠皮下盲袢或肝左外叶、上或下段切除的肝断面胆管预留置管,以备术后应用胆道镜经盲袢或肝断面胆管窦道反复取石以求取净结石。胆总管下端残留盲管是结石残留和发生漏斗综合征的原因,而选用横断胆总管封闭远端,纵切,整形上方胆管后再行胆管端与空肠侧吻合,就可免其发生。
(2)胆管的直径对选择术式有着决定性作用:作者见到一中年男性患者,胆总管十二指肠吻合术后反复疼痛、发热、黄疸,医生在他的出院记录上写着“胆总管直径1.5cm,行胆总管十二指肠侧侧吻合术”,钡餐检查发现吻合口狭窄,吻合口上方有黄豆大一结石负影,表明本例胆肠内引流效果不良。显然是适应证不当及胆管残余结石所致。根据胆管内径大小选择胆肠吻合的术式甚为重要。原则上应是:①胆总管直径小于1.5cm,伴有Oddi括约肌狭窄,宜行Oddi括约肌切开成形术;②胆总管直径2.5cm或大于2.5cm,可行胆总管空肠吻合或胆总管十二指肠吻合术(用端侧吻合,封闭远端胆总管);③胆总管直径在1.5~2.5cm,宜选用空肠作吻合;④左、右肝管汇合处狭窄切开整形后,因位置较高,仍需行空肠胆管吻合术。此外,胆肠吻合口建立后,吻合口上缘胆管开口(可能是肝总管,左、右肝管,亦可是更高位的胆管)是胆汁出肝通过吻合口到肠道的重要一关,其截面的大小,即胆管的内径,可能吻合前并无明显扩张;或吻合前存在相对狭窄,术中未发现;或行吻合术时造成狭窄,直接影响胆流,影响胆肠内引流的效果。有报道在胆肠内引流术后再次手术时发现吻合口并不小,而在吻合口上缘胆管开口处狭窄,结石堆集在狭窄以上的胆管内。所以过去只注意吻合口的大小,提出大口、超大口,甚至从十二指肠上缘将胆总管向上切开直到左、右肝管,其实是不必要的。胆管内径愈大,吻合口相对就大,如吻合口比胆管内径小就可能发生吻合口狭窄,吻合口只要稍大于胆管的内径,同时在吻合术时避免因技术原因导致吻合口上方胆管狭窄,愈合后局部无瘢痕增生,就可达到胆肠内引流通畅的目的。
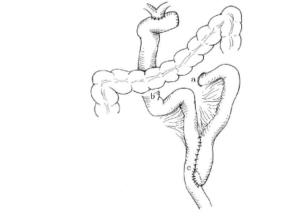
图20-5 重建胆肠吻合
a屈氏韧带、短袢出口处; b输胆空肠袢,横结肠系膜固定处; c Roux-y空肠吻合口
(3)空肠Roux-y的建立及抗返流问题:这是胆管空肠Roux-y术中两个基本问题。在距屈氏韧带15~20厘米处空肠,保留第一支空肠血管弓,在第二支血管弓处切断空肠及血管弓,称此上段空肠为短袢,远端空肠开口以细丝线连续缝合封闭,向上提并穿过横结肠系膜至肝门下方,称此段空肠为输胆空肠袢。距断端50cm处与上段空肠(短袢)行空肠-空肠端侧吻合术(空肠Roux-y)。短袢的系膜断端固定于输胆空肠袢系膜缘,吻合口上方短袢与输胆空肠袢并列,其肠壁间断缝合固定,使两肠管在入吻合口前同步并行10~12cm,以此作为抗返流措施。此外要求输胆空肠袢的横结肠系膜固定处至吻合口的距离与短袢的长度基本相等。并以此为三角形的两个边,以屈氏韧带短袢的出口处及横结肠系膜孔与输胆空肠固定处的连线为底边的一个等腰三角形。图20-5为这样一个设计:即50cm输胆空肠袢与短袢在横结肠下方先并行、后会合,按肠管顺行运动方向,保证由胃、十二指肠来的食物、消化液及由输胆肠袢来的胆汁同步注入远端空肠。依此建立的合理解剖通道按肠蠕动的方向顺行性运行,不附加其他任何措施,可取得良好效果。
(4)对胆肠吻合术的基本要求:不论哪种形式的胆肠吻合,都应要求吻合口上方无狭窄存在。尽可能取净结石,至少应取净引起梗阻的关键结石。用于吻合的胆管和空肠血运良好,尽可能无瘢痕,组织无缺损。吻合材料尽可能用无损伤针、可吸收线。采用黏膜对黏膜的对合式间断缝合法,进行胆肠吻合。最后要求吻合口足够大。
(5)胆肠吻合口是否放置支撑引流管:是否放置支撑引流管,如何放置引流管,一直是一个有争议的问题。作者认为不论是端侧吻合或侧侧吻合,吻合口内径在2~3cm,有时会更大一些,关键是能否达到胆管与空肠黏膜对黏膜对合式吻合,同时局部血运良好,一般不放置支撑引流管,不会发生胆漏,亦不发生吻合口狭窄。仅在下列情况下才考虑放置引流管:①用于吻合的胆管局部存在炎性瘢痕较多,切除瘢痕组织不满意;②吻合口的局部血供欠佳;③胆管内感染严重,手术时见有多量脓性胆汁;④黏膜对缝不好,甚至胆管黏膜有损伤或缺损。通常采用经肝置管法(图20-6),引流管之一端放置在吻合口下缘2cm的空肠内,另一端经肝左或右侧肝膈面引出。其作用是达到暂时减压的目的,避免胆肠吻合术后暂时性高胆压情况下所引起的胆漏。这种引流管放置时间约半月,行胆管造影后即可拔除。而过去常有通过吻合口经空肠拖出的引流管放置法,现已很少采用,最大的问题是由于置管段肠管的收缩及松弛致该肠管段长度的改变,而所置导管之长度固定,从而导致长度差,使导管滑脱至肠腔内。如用于吻合的胆管开口较小,不能达到良好的吻合,且吻合口太小(甚至不到1cm)时,欲想通过放置支撑引流管达到良好愈合而不发生狭窄,也是很困难的。首先,在吻合口很小的情况下放置引流管作支撑,使导管与吻合口及胆管接触,且压迫吻合口及胆管黏膜,因异物刺激,局部肉芽生长。这种在管壁周围生长的肉芽,妨碍了黏膜的生长,加上局部的炎症反应,支撑放置时间越长,局部肉芽生长愈甚。一旦拔管或滑脱,受压的肉芽被解脱,减压后局部发生水肿,加重狭窄,肉芽收缩使吻合口更缩小。其次,当吻合口很小的情况下放置支撑引流管,胆汁只能通过支撑引流管之管腔沟通吻合口上、下的胆肠,引流管一旦堵塞,即可引起急性梗阻性胆管炎。临床上此种引流管不畅通所致的胆管炎屡见不鲜。所以当吻合口很小时不宜于放置这种单一的引流管,而应放置“U”形引流管。
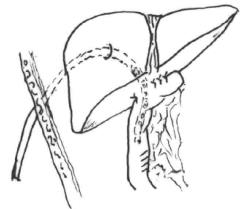
图20-6 胆肠内引流附加经肝、胆管引流
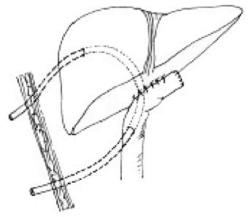
图20-7 胆肠内引流附加“U”形引流管
(6)胆肠内引流术后“U”形管的应用:虽然胆肠吻合口很宽畅,但高位胆管内仍有狭窄性改变。吻合口较小,在1.5cm直径以内。吻合口局部较多的瘢痕组织,不能彻底切除、缝合不满意或局部血供欠佳。此时可考虑放置经肝、吻合口-空肠的“U”形引流管(图20-7)。
“U”形引流管的作用:①术后支撑、引流、减压,以减少胆漏的发生;②如有暂时阻塞、引流不畅,可以较为容易地随时移动、冲洗或更换;③便于以后更换较粗的“U”形引流管或气囊管,扩张治疗狭窄;④经“U”形管的一端进入引导取石;⑤可以根据病情需要更换“U”形管,取弃方便;⑥如胆肠吻合口通畅,可将导管两端在体外对接成“O”形,使胆汁全部进入肠管,避免胆汁丢失。
(钱家勤)
第七节 医源性胆管损伤
由于手术直接或间接损伤胆管致胆管连接中断、胆流闭塞、胆管缺损、胆汁漏出等称医源性胆管损伤。由此导致胆漏、胆汁性腹膜炎、阻塞性黄疸、胆管狭窄、胆管炎是损伤后的继发病变,为医源性胆管损伤的并发症。据国外资料,其发生率约为2‰,国内仅有散在报告,无准确统计资料。黄志强教授来自“查账”式的报告在136 316例中胆管损伤约0.5%,有的高达1.09%。胆道损伤大多发生于胆囊切除术,其次是胆道手术,也偶见于胃、十二指肠及胰腺等手术中。胆囊疾病发生率高,胆囊切除术为一常见手术,因而在胆囊、胆道手术中防止发生损伤是值得重视的一个问题。
一、损伤原因及分类
(一)常见的损伤原因
(1)无粘连、并认为是很简单的胆囊切除术,在处理胆囊管时过于用力牵拉,使胆总管和肝总管成锐角屈曲而被全部或部分结扎,或被切断。
(2)胆囊三角区炎症、水肿、粘连,胆囊动脉结扎不牢,在切断胆囊动脉后结扎线滑脱,慌乱中于血泊内盲目钳夹或缝扎止血以致损伤胆管。
(3)胆囊颈部结石嵌顿、胆囊管甚短,并与肝总管粘连,在牵引胆囊,分离胆囊三角,将胆囊和肝总管牵向头侧时将胆总管误认为胆囊管结扎切断,或在处理很短的胆囊管时损伤部分胆总管及肝总管。
(4)胆囊管开口于低位开口的右肝管,将胆囊向头侧牵引时,使胆囊管和右肝管拉成一线,误认右肝管为胆囊管,将其结扎、切断。
(5)副肝管为变异肝管,无一定的规律,出现率为10%~15%,术中容易将右侧副肝管误为粘连束带予以切断而致术后胆漏。
(6)探查无明显扩张的胆总管后放置T管引流时,若T管过粗,勉强缝合,术后发生局部压迫,致组织缺血、坏死,引起胆汁渗漏,继发炎症狭窄。胆总管扩张不明显,加之针大、缝线过粗,缝合时容易损伤胆总管,致术后胆汁外漏。
(7)粗暴探查不明显扩张的胆总管,或胆总管下端结石嵌顿,而强行探查、括取、钳夹,造成胆总管下端、胰、十二指肠损伤。
(8)慢性反复发作的十二指肠球部溃疡,因溃疡周围炎症水肿、疤痕挛缩,使球部变形,正常解剖结构发生变异,在行胃大部切除时如强行切除溃疡,容易损伤胆总管。
(9)电视腹腔镜胆囊切除时除一般的分离、解剖、电凝、电切、上夹所致胆管损伤外,还有电凝、电切产生的热效应所造成的胆管损伤,同时可导致更大范围的组织损伤。
(二)损伤的分类
1.根据损伤和胆管狭窄的部位和范围分类:部位的高低处理的难易不一样,效果也有差异。范围则是损伤涉及到肝外和肝内胆管。甚至肝门部广泛热损伤,易至术后粘连、瘢痕,增加再次手术的难度。
(1)低位胆总管损伤:狭窄距离肝管分叉部2cm以上。
(2)高位胆总管损伤:狭窄距离肝管分叉部2cm以内,已累及肝总管。
(3)肝门部损伤:狭窄在肝总管上端,左、右肝管仍相通。
(4)肝管损伤:狭窄位于左、右肝管汇合部,左、右肝管已互不相通。
(5)副肝管损伤。
(6)广泛损伤:损伤范围可能从十二指肠上方的胆总管直至肝内胆管,部分或大部分肝外胆管缺损。由于损伤的范围广、狭窄位置高,不但左、右肝管不相通,右前、右后肝管亦不相通。
前4类为“BISMUTH”的胆管狭窄分级,1~5则是黄志强教授关于胆管损伤5种类型。目前由于腹腔镜胆囊切除术的广泛开展,其电热效应致肝内、外胆管的损伤即为第6类。
2.按损伤性质分类
(1)一般性损伤:因切割、结扎、胆管探查及引流不当所致损伤。
(2)特殊性损伤:电视腹腔镜胆囊切除时钳夹、电凝、电切及电热伤所致胆管损伤。
二、手术中及时发现的胆管损伤及处理
明显的胆管损伤能及时发现,可得到处理。由于肝门部胆管及肝动脉的变异,每个病例的局部病变情况不同,特别是胆囊三角处因结石、炎症变化所致病理解剖复杂,全靠手术中细致的解剖分离,仍有误伤肝外胆管之虞。麻醉及手术创伤情况下胆汁分泌会暂时受抑,胆汁分泌压降低,在胆总管下端通畅时,胆管部分损伤很难及时发现。为此应在胆囊切除完毕后,常规重复检查胆囊管残端、肝总管、胆总管三者的关系,同时用一块白净的纱布在肝门部逐一查视有无胆汁溢漏,以便及时发现局部损伤的情况,并应明确是否有损伤,是部分损伤或是完全损伤,损伤部位—肝总管、胆总管,判定距左、右肝管汇合部的距离,确定损伤分级,部分损伤的程度(包括损伤的周径和长度)。
手术中发现胆管损伤,应予及时处理。一次常规手术,本不应发生意外损伤,如及时、正确地处理,能取得满意的效果,不致带来严重后果。为此有必要邀请有经验的医师协助,以顺利完成这一补救性治疗。
新鲜损伤的特点:损伤局部无污染或很少污染,因外溢的胆汁甚少,局部炎症、水肿亦很轻微,损伤的上、下胆管的直径、管壁厚薄均无差异,有利于局部修复。
手术原则:
1.以保留Oddi括约肌功能为主的修复手术:
(1)胆管部分损伤、且损伤边缘完整,则以5-0无损伤缝针单丝线间断缝合修补。如裂口稍大或边缘不整齐或有黏膜损伤,经修剪后裂口增大,需作整形修补,要求缝针要小、缝线要细,修复完毕后应放置经肝的胆管引流(图20-8)。
图20-8 经肝的胆管引流
(2)胆管部分损伤,若损伤范围较大,采用缝合修补则易使管腔狭窄,可在损伤处的上方或下方胆管内置T管支撑引流,其缺损部分选用带蒂的胃壁、空肠壁浆肌层或圆韧带,应用其浆膜面行修补术。
(3)胆管完全性横断损伤,应将断端修整,切开十二指肠侧腹膜,将十二指肠及胰头松动,以减少吻合后的张力。用5-0无损伤缝合针线行黏膜对黏膜的间断吻合术,要求吻合后局部无张力、血运良好,内置经肝的胆管引流(图20-8),引流管放置3个月。
2.以恢复胆肠引流为目的手术:如肝门部胆管或肝管损伤,胆管缺损位置高,范围较大,上述各种修复手术有困难,则应找到肝总管断端,沿肝总管向上切开左或右肝管,行肝胆管空肠Roux-y吻合术。要求以5-0无损伤缝合针线作黏膜对黏膜间断对合式单层缝合,采用经肝置管引流或U形管引流,以达有效的支撑和引流,引流管放置半年。
3.如损伤的胆管是右侧副肝管 其管径较细,引流肝脏的范围较小,可以结扎而不会带来不良后果。
三、胆管损伤的并发症——延迟发现及诊断的胆管损伤
术中未及时发现的胆管损伤,术后必然发生并发症:即胆漏、胆汁性腹膜炎、阻塞性黄疸、胆肠内漏、感染、胆管狭窄、胆管炎、胆汁性肝硬变等。由于在原来手术中未及时发现,只是在出现并发症后才认识到为损伤所致,故称此为延迟发现及延迟诊断的胆管损伤。此外在术中发现胆管损伤,并进行了相应处理但效果不好,术后仍出现阻塞性黄疸、胆管炎等并发症,这些并发症的治疗与损伤情况,发现的迟早、是否经正确有效的处理,有着重要关系。损伤后出现黄疸,如长时间不能明确诊断,以致不能得到正确治疗,最终发生胆汁性肝硬化等不可逆的严重并发症。
(一)胆漏及胆汁性腹膜炎
胆囊切除后几小时内或稍长时间内从烟卷引流或腹腔引流管中有胆汁流出,为胆外漏或胆漏。常见于胆囊管结扎不牢、肝外胆管损伤或部分损伤、右副肝管损伤。由于胆流未受阻,暂时不会出现黄疸,但可有局限性或弥漫性胆汁性腹膜炎表现。因有引流存在,可以密切观察。①48h内胆汁引流量增加,出现胆汁性腹膜炎的症状、体征,并有加重趋势,应急诊手术探查,引流腹腔、引流胆管。②引流量减少,局部症状减轻或消失,引流管内仅少量胆汁,可继续观察。③观察过程中局部及全身症状好转,直至完全无症状、体征。引流量在100m L左右或更少,常见于右副肝管损伤,需造影及进一步检查。④观察过程中,局部体征好转,引流量未增加,但逐渐出现黄疸,常是胆管狭窄的表现,需进一步检查、处理。
胆囊切除术后放置不同类型的引流物,是一种安全措施,旨在观察有无出血或胆漏,如引流物放置不当,达不到通畅引流,发生胆漏甚至弥漫性胆汁性腹膜炎时常不能作出明确判断,故正确放置腹腔引流,并保持引流管的通畅,密切观察、及时发现问题,都是很重要的。此外应加强护肝及支持治疗,维持水电解质平衡,应用广谱抗生素。对出现黄疸者应进一步明确诊断,必要时手术治疗(见术后阻塞性黄疸)。
(二)术后阻塞性黄疸
1.诊断 如是肝、胆、胰、胃以外的手术后出现黄疸,常是肝功能受损的标志或多器官系统衰竭临床表现的一部分。胃、肝、胰手术后出现黄疸,除应考虑上述原因外,常要注意是否有手术引起胆道损伤之可能。胆道手术,特别是单纯胆囊切除术后出现黄疸,最引起关注的问题是有否胆道损伤。常规胆囊切除术后出现阻塞性黄疸有二种表现形式:一是黄疸前或后,或同时出现胆漏、胆汁性腹膜炎;二是黄疸而无其他症状及体征。对后者及其他胆道手术后出现黄疸的诊断常常是困难的,其原因可能是复杂的,需要全面分析、鉴别诊断。首先是排除其他原因引起的黄疸,即内科性黄疸,包括:①药物或药物毒性反应;②过多的库血输入;③慢性肝炎病史,术前忽视了肝功能受损情况;④急性肝炎。化验检查:直接胆红素升高、AKP、r-GT的升高,乙肝、丙肝抗原等可鉴别阻塞性或非阻塞性黄疸。现今B超检查已作为鉴别内科抑或外科黄疸的首选方法。但在某些情况下如梗阻早期、原有慢性肝脏病史、或受超声技术水平所限,很难发现轻度的胆管扩张。此时除应多次重复B超检查外,应与术前提示的肝内、外胆管的直径对照,以资鉴别胆管是否扩张。早期B超检查发现肝内胆管与门静脉呈双管征,常提示肝内胆管轻度扩张。磁共振胆道成像(MRCP)可以了解梗阻部位,清楚显示扩张胆管的全貌。PTC检查虽有损伤,但其诊断价值一直受到重视。PTC检查不仅可显示胆管扩张,更可显示梗阻部位及梗阻程度,是诊断和治疗的重要依据。ERCP检查仅能显示梗阻下端胆管,如为结石引起梗阻可同时得到治疗。根据以上检查明确诊断:①是否有梗阻:肝内胆管扩张或同时有肝外胆管扩张表明有梗阻存在。②梗阻部位:肝内胆管扩张,肝外胆管不扩张—梗阻在肝总管或左、右肝管汇合部下缘。肝外胆管扩张,且扩张胆管的长度大于2cm,表明梗阻在胆总管。③梗阻原因:如扩张胆管下端有强光团回声且后方伴声影常是结石引起的梗阻,梗阻下端中断,则常是损伤所致。
2.治疗 常规胆囊切除术,因胆管损伤出现全身进行性加重的黄疸,无疑对病员或医师都是一个重大的事情,应予以高度重视。问题是在术后短时间内又需要经受一次较大的再次胆道手术。治疗的原则是:①良好的术前准备,包括营养支持、护肝、水电解质的补充,黄疸状态下凝血机制异常应得到纠正。②早期手术探查,找到梗阻的胆管减压并恢复通畅的胆肠引流。
(1)再手术的时机:胆囊切除术后出现梗阻性黄疸,除合并胆汁性腹膜炎、腹痛、高热时需急诊手术外,原则上应早期手术。如胆管及肝脏无特殊病变,当胆总管完全梗阻24h就可以出现梗阻性黄疸。随着淤胆加重,黄疸加深,胆管也随之扩张,完全有充分的时间进行有关检查,得到明确诊断,并为再次手术作好必要的准备。当诊断明确有损伤存在,应于术后7~10d再次手术为宜。这种扩张的胆管用作胆肠吻合是较理想的,如无感染存在,吻合后不易再狭窄。随着阻塞时间延长,胆管扩张更甚,同时会加重肝脏损害,导致肝细胞坏死和肝硬变的结局。
(2)再手术的方法:再手术选择的方法应视具体情况而定。
1)胆管外引流、加腹腔引流:即再手术时以暂时解除胆道梗阻为目的,探查过程中只需了解胆管损伤的存在,仅在胆管损伤处或扩张的胆管下缘切开,放置T管或导管引流(图20-9)即可。减少对局部的分离、探查,待3个月后择期重建胆肠内引流。适应于:①合并有胆汁性腹膜炎、局部感染明显、已损伤的胆管局部炎症水肿不宜于行胆肠内引流者,并应同时引流腹腔。②基层医院条件差,不能一次完成更大的手术。暂时置管引流是以解除梗阻,达到缓解梗阻性黄疸的目的,仅是暂时的临床措施,且有一定的缺点。由于置管减压后扩张的胆管复原,置管及局部探查,特别是乳胶管对局部的刺激,加重局部的炎症反应。肉芽及瘢痕增生,置管的局部胆管壁增厚,胆管黏膜因胶管刺激—炎症反应—黏膜变性,给下次手术带来诸多不利因素。且胆管不扩张或仅轻度扩张,对建立一个较大的吻合口是不利的。
图20-9 胆管损伤 置管3个月后造影所示
2)重建胆肠内引流:即再次手术时,以达到一次性、有效地解除梗阻为目的。要求:①诊断明确,最好要有MRCP或PTC检查明确梗阻的部位、梗阻以上胆管扩张的程度及病变受累的范围。②要求病人情况基本良好,能耐受一次较大的手术。③技术条件允许,最好由具有施行多次、复杂胆道手术经验者施行手术。再次手术要求显露肝门部,寻找及切开肝门部扩张的胆管,并进一步判定肝外胆管扩张程度及肝外胆管残留长度。如肝外胆管很短甚至完全损伤,寻找及显露肝内胆管很困难时,则需切除肝方叶或将肝中央部分肝切除,以便进一步显露肝内扩张的胆管。如切开的胆管不够宽大,或肝总管损伤甚至累及左、右肝管结合处,则不但要切开左、右肝管,必要时须行胆管整形,以获得一个较大的胆管开口。选择哪一种内引流术式,仍然是有争议的。作者认为由于胆管损伤,常在较高位置,局部炎症、水肿及新形成的瘢痕组织使扩张的胆管与十二指肠间的距离较大,此时行胆管修复术或扩张的胆管十二指肠吻合术都难以达到满意的结果。而应用空肠与高位胆管吻合,可以充分利用上端空肠的优点建立一个通畅有效的胆肠内引流,可获得相对较好的手术效果。如果是中、下段总胆管损伤,术中发现肝外胆管扩张达2cm以上,且有足够的长度,同时因为腹腔粘连寻找及提起上段空肠,既费时又造成很大范围创伤,也可考虑行胆管十二指肠吻合术,同样可取得良好的效果。对胆囊切除术后因胆管损伤,无胆漏、腹膜炎,仅为胆管完全性梗阻的患者(图20-10),应以一次性有效的重建胆肠内引流为首选方法,且能获得很好的效果。在此情况下,局部常无明显的炎症、感染,损伤以上的胆管扩张显著,可以根据胆管扩张的情况合理设计、切开,有利于重建一个宽畅的胆肠内引流,术后患者恢复良好并可获得立竿见影的好效果。
图20-10 胆囊切除术后黄疸PTC检查示肝门梗阻
(三)胆肠内漏(瘘)
由于胆管下端炎症狭窄或结石嵌顿在Vater壶腹部,当用硬质胆道探强行探查通过或用暴力强行取石时,导致胆总管及十二指肠损伤,继发局部感染,术后出现寒战、高热,从T管引流出大量胆汁、肠液、食物残渣、混合感染之发臭的液体,每天引流量达1 000m L以上。随着感染被控制,体温下降,胆汁可以通过损伤及感染之缺损处漏入十二指肠,肠内容物可返流至胆管。经T管造影可见胆总管十二指肠内漏形成。稀钡造影可见钡剂通过漏口逆流入胆道。日后可反复发生上行性胆管炎。
预防及处理:对需行胆总管探查的病例,要熟知术前胆管造影所显示的胆管走向,不论应用硬探条或软质探条及用取石钳取石,都应注意轻细的操作,避免用力过猛,在遇有阻力时决不能强行通过。取石困难时需在术中应用胆道镜辅助检查及取石,或术中胆道造影以进一步了解胆总管下端病变情况,决定治疗原则。如若结石嵌顿难以用一般方法取石,可考虑胆管镜加液电碎石取出,或行经十二指肠乳头切开或Oddi括约肌切开取石,再作成形修补。
治疗:早期主要是加强抗感染治疗,保持T管、腹腔引流管通畅,有效的胃肠减压,预防及治疗水、电解质失衡,营养支持治疗。
(四)感染
损伤后感染来自两个方面:一是损伤后胆汁渗漏、局限或弥漫性胆汁性腹膜炎、腹腔感染、脓肿形成;二是胆道感染:损伤后胆汁外渗或漏,胆汁引流不畅,肝内胆汁淤积,继发胆道感染。临床上表现为寒战、高热、腹痛、黄疸、恶心呕吐,同时白细胞升高,核左移,重者继发肝、肾功能衰竭。
治疗:①尽早明确诊断及时引流腹腔、引流胆管。②加强抗感染治疗。③加强护肝及支持治疗。
(五)胆汁性肝硬化
胆管损伤引起胆管阻塞、长时间淤胆及感染的结果,胆管内压增高,微胆管扩张状况下渗透性增加,或胆管破裂,胆汁及毒素经肝窦入血,或进入肝内小胆管间隙,引起胆管周围炎、小动脉内膜炎及小动脉闭塞,肝小叶变性坏死、纤维组织增生,新生肝小叶结节形成终至肝硬变,甚至门静脉高压症。临床表现为长期不退的黄疸、灰黄色的面容,伴严重的肝功能受损、腹水、凝血机制障碍、营养不良、肝脾肿大,重者因食道静脉曲张破裂大出血死亡。胆管损伤致胆管完全性阻塞,未能尽早发现,且梗阻时间较长,最终导致胆汁性肝硬化。为什么这类损伤不能及时发现呢,究其原因可能有:①单纯的胆囊切除术后出现黄疸,术者过于自信不是手术引起的。②可能确是合并肝炎,乙肝、丙肝肝炎抗原阳性伴肝功能受损,使外科医生找到了黄疸的“原因”。③肝脏、胆管原有慢性病变以致早期胆管扩张不明显,B超诊断困难。④某些地区是因B超技术所限。作者认为一个单纯胆囊切除术后出现黄疸,应引起外科医生的高度重视,除应与其他原因引起的黄疸鉴别外,更应把损伤的可能性放在重要位置上,而诊断阻塞性黄疸的关键问题是尽早发现胆管是否扩张。绝对不能满足于一次、二次的阴性结论,应该说手术后,特别是一个单纯胆囊切除术后出现阻塞性黄疸直致肝硬化、门静脉高压形成,这一病变演变过程中,通过B超、MRCP或PTC检查,总能找到肝内胆管扩张这一特殊变化。只要能早期发现此点并尽快解除梗阻,胆汁性肝硬变是能够避免发生的。
(六)损伤性胆管狭窄
损伤性胆管狭窄是胆管损伤的不良后果,是多种原因引起的损伤后一种特殊的病理改变,是胆道损伤发生并发症的基础。胆管损伤后出现胆管狭窄,最常见于:①术中发现胆管损伤,但处理方法不当,效果不佳,诸如对端吻合后,吻合口狭窄;修复术后胆汁渗漏继发感染,局部炎症反应,瘢痕组织增生引起狭窄;胆肠吻合后吻合口狭窄。②术中未发现损伤,但术中因分离、缝扎胆管壁或钳夹、切断等直接损伤了胆管或胆管的血供,使胆管黏膜缺血,细胞变性坏死、萎缩,胆汁渗漏,致局部炎症反应,终致胆管狭窄。③放置T管引流不当,造成局部压迫及缺血坏死,引起胆管狭窄。
1.病理特点
(1)胆管狭窄的程度与损伤的情况,胆汁渗漏、局部炎症变化有关,管腔狭窄可以是轻度狭窄到严重狭窄,直至胆管完全闭塞。
(2)狭窄部位胆管壁及胆管周围结缔组织增生、瘢痕化,管壁增厚。
(3)胆管狭窄使胆流不畅,胆管梗阻,胆压增高,继发化脓性胆管炎,胆管黏膜炎症、水肿,甚至出现溃疡,更促使瘢痕狭窄加重,胆汁淤滞加重感染。
(4)胆道系统的严重感染和胆汁滞流及由此而引起胆汁成分的改变,为结石形成创造了条件。结石形成又加重胆道炎症性病变进展及胆管狭窄。
(5)狭窄以上胆管扩张,扩张的程度及梗阻情况与肝胆管原来的病变有关,但当有长期胆道慢性感染时,胆管扩张可能不显著。
(6)胆管狭窄,如未能得到及时处理,终因长期并逐渐加深的阻塞性黄疸,继发反复发作性化脓性胆管炎,导致严重的肝实质损害,最终发生胆汁性肝硬化、门静脉高压症,并发上消化道出血或肝功能衰竭。
2.临床特点 医源性胆管狭窄发生在胆囊切除、胆管手术后,也可见于胃、胰、肝手术后。轻度的胆管狭窄往往症状不重,仅仅表现为反复发作的发烧、畏寒、巩膜黄染、轻度肝功能受损及白细胞升高。与慢性肝病及一般感染难以鉴别,经过治疗常可缓解,因此早期难以得到诊断。反复感染使狭窄加重,可出现重度黄疸,甚至化脓性梗阻性胆管炎,如长时间不能得到正确诊断和治疗,可继发胆管结石,最终发展至胆汁性肝硬化。如损伤严重至胆管重度狭窄,仅出现严重的梗阻性黄疸而无明显的感染症状,此时应与胆道的梗阻性疾病胆道肿瘤相鉴别。损伤性胆管狭窄毕竟是良性疾病,如及早发现,明确诊断,采取及时正确、有效的补救性治疗,可以获得良好的效果。
3.诊断 确切地了解胆管损伤和明确损伤性胆管狭窄的资料是困难的。应用现代诊断手段诊断胆管狭窄是可行的。由于这类狭窄与非损伤性胆管良性狭窄在诊断和治疗上有许多共同之处,然而其复杂性及治疗效果要好得多,有别于结石性、炎症性胆管狭窄,所以明确诊断损伤性胆管狭窄,对选择恰当的治疗方法及取得良好的手术效果是有益的。
(1)病史:一部分病人有明确的胆管损伤病史、病程、演变过程及治疗经过。另一部分病人则难以得到准确的病史资料,只有依靠症状、体征及影像学检查明确有关胆管狭窄及梗阻的存在,所以应仔细查询前次手术的有关问题,诸如:①术前诊断:单纯胆囊结石,是否同时合并有肝、胆管结石;②上次手术的方法:单纯胆囊切除,是否同时探查了胆总管,同时应了解胆管直径,是否有胆管结石;③手术经历时间,手术顺利与否;④手术后恢复顺利与否及手术后出现症状时检查、治疗情况等;⑤是否置管引流,何种引流,引流内容、引流量及引流管留置时间,拔管时是否行导管造影检查。因为经窦道引流管造影可以显示部分或全部胆管,可以了解有无胆漏及胆管扩张。对此需耐心查询,并结合症状、体征及各种检查结果全面分析评估。
(2)症状、体征:依胆管狭窄的程度及是否合并感染,其临床表现有很大差异。单纯胆管狭窄未合并胆道感染常常仅有胆道梗阻的症状及体征,表现为全身及巩膜黄染,并且逐渐加深,此时需与其他各种原因引起的黄疸鉴别。胆管狭窄合并胆道感染多数表现为反复发作的畏寒、发烧,甚至高热、寒战,同时合并全身黄染、肝区不适、上腹胀痛、恶心、呕吐等化脓性胆管炎的症状。一般经过抗感染治疗可以暂时缓解,以后常间断发作并逐渐加重。个别病例仅出现反复发作的发烧、畏寒等胆管炎的表现。
(3)诊断:依赖影像学检查(详见术后阻塞性黄疸)明确狭窄部位、狭窄上方胆管扩张的程度。特别是肝总管,左、右肝管是否扩张及扩张的程度,为手术治疗提供重要依据。
4.治疗 因为胆管狭窄是最基本的病理基础,由此引起反复发作的、轻重不等的急性或慢性胆管炎。治疗原则应是解除狭窄,重建或恢复通畅的胆肠引流。除非合并有明显的胆汁性腹膜炎,对损伤性胆管狭窄的外科治疗一般应在充分的术前准备后择期手术治疗。
(1)显露及进入狭窄上方扩张的胆管、备置通畅的胆管出口:通常采用肋缘下切口进入腹腔,一般情况下沿肝缘直指肝门,将粘连于肝脏面的结肠、十二指肠及胃窦部逐一分离,直达肝十二指肠韧带前方及右侧缘。应分离并显露小网膜孔,使能容示指、中指进入网膜孔内,以便必要时控制出血,便于止血,同时扪摸肝十二指肠韧带前缘并尽可能辨别肝动脉及门静脉的可能位置、深度及走向。如留有引流管者可沿引流管分离达肝门前方,拔管进入胆管。当肝门前方显露清楚后,扩张胆管的外貌得到显现,用小针细线悬吊,并通过细针穿刺法找到胆管。可能会因为肝门部局部炎症、瘢痕增生,或因损伤位置较高寻找胆管异常困难,此时可在肝十二指肠韧带上缘(肝门横沟处)分离粘连,切开肝包膜,向上推开肝实质,分离肝门板可以找到扩张的左、右肝管。如肝方叶肥大或肝门抬高,常需切除肝方叶,或肝中裂劈开、肝中央肝部分切除,以利找到扩张的左、右I级肝管,进一步显露扩张的近端胆管。经穿刺抽到胆汁,用尖刀切开一小孔,选用探针或细探条向下一直切开扩张的胆管,直到狭窄处的上方(我们所见损伤性胆管狭窄都在肝总管或左、右肝管汇合处此时不必继续切开狭窄处,由于损伤、炎症至该处瘢痕增生,其瘢痕组织宽、厚,且范围较大)并经此开口探查左、右肝管扩张的情况及行走方向,分别切开左、右肝管,将扩张的肝胆管前壁尽量敞开,保留完整的后壁。有时需要将左、右肝管的间嵴,或肝中叶、尾状叶与左、右肝管的间嵴切开整形,尽量扩大胆管的出口。这样在狭窄的上方的一个肝胆管的联合开口的周边无瘢痕且血运良好,其直径4~5cm以上的盆状肝胆管开口,以备行高位胆管空肠吻合术。
(2)重建胆肠通道:通常有3种术式可供选择:①胆管十二指肠吻合术;②胆管空肠Roux-y吻合术;③间置空肠胆管十二指肠吻合术。
胆总管十二指肠吻合术:因其方法简便、损伤小,如胆管扩张显著,且是胆总管,可以考虑选用。但若是高位损伤性胆管狭窄,由于距离远、张力大,局部瘢痕组织不利于吻合,也妨碍吻合口愈合,易发生胆漏,故不宜于采用。
胆管空肠Roux-y吻合术:是目前应用较广的一种术式。①以空肠的侧壁与胆管吻合,可以根据需要及胆管开口的大小,切开肠管的侧壁,建立足够大的胆肠吻合口;②用于吻合的空肠袢(输胆肠袢)长约50cm,加上同步10~12cm的空肠y型吻合,可以达到有效地防止食糜返流的目的;③由于空肠有足够长的系膜,活动范围大的特点,将空肠上提到肝门,仍可保持良好的血运,用于吻合后局部血运良好,无张力,愈合好,不易发生胆漏。唯在胆管狭窄再次手术或多次手术者,因腹腔广泛粘连,寻找及提起上段空肠会增加不少困难,因胃窦部、结肠及网膜广泛粘连或瘢痕组织过多,经胃及结肠前将空肠上提到肝门下方常感到张力过大,甚至有影响空肠血运之虑,此时可将输胆空肠袢经结肠后、胃后上提到肝门部,可以减少张力,保持良好的血运,且有利于胆肠吻合。一般吻合口在1.5cm以上,用于吻合的肠管、胆管血运良好,无疤痕,吻合满意,一般不必放置任何支撑引流。如果胆管扩张不好,吻合口不大,左、右肝管开口处狭窄经整形处理后胆管出口仍不够大,难以建成较大的吻合口,吻合口狭窄的病人再手术时肠袢破损,恐术后愈合不良。需要放置引流支撑,引流方法一般用经肝—吻合口—肠的“U”形管引流为好。
间置空肠胆管十二指肠吻合术:手术适应证同胆管空肠Roux-y吻合术,其最大的优点是免除了胆管空肠Roux-y吻合术后继发十二指肠溃疡发生的可能性。
损伤性胆管狭窄的病理特点是狭窄周围瘢痕组织增生,狭窄上、下胆管的内径相差甚大,同时切除了狭窄处胆管及瘢痕组织后,上、下胆管间缺损更大,在此条件下行胆管对端吻合难以得到较好的效果。应用周围材料及其他人造材料进行修复也是不适宜的,已为多年实践所证实。
采用经皮肝穿刺胆道造影后,在放射监视下如导丝通过狭窄胆管,将狭窄胆管扩张后放置金属支撑架或镍钛形状记忆合金支撑管,治疗无结石性胆管狭窄,可在部分病例中得到满意的效果,而远期疗效有待进一步观察。
(钱家勤)
第八节 胆道寄生虫病
一、胆道蛔虫病
胆道蛔虫病是指蛔虫自肠道钻入胆道所引起的疾病。多见于儿童和青少年,农村发病率高于城市。随着卫生条件的改善和防治工作的加强,近年来本病发病率明显下降。
(一)病因与病理
蛔虫有厌酸喜碱和遇孔即钻的习性,一般寄生在小肠的中下段。当体温升高、饥饿、胃肠功能紊乱、Oddi括约肌松弛或收缩乏力、妊娠及驱虫不当时,蛔虫上行进入十二指肠,然后经十二指肠乳头钻入胆道,可引起十二指肠乳头水肿、胆管炎、胆囊炎、胆道出血和胰腺炎等并发症。蛔虫在胆道内死后,其残骸和虫卵可在胆道内沉积,成为结石形成的核心。由于蛔虫为圆形,即使多条蛔虫积聚在胆总管内,胆汁仍可从虫体之间的间隙流入十二指肠,故一般不会出现黄疸。
(二)临床表现
胆道蛔虫病的临床特点是突发性剑突下阵发性钻顶样剧烈绞痛。蛔虫钻入胆道时引起Oddi括约肌强烈痉挛导致剑突下钻顶样剧烈绞痛。疼痛发作时病人辗转不安,呻吟不止,大汗淋漓,可伴有恶心、呕吐或呕吐蛔虫。一旦蛔虫死在胆道内或退出胆道,绞痛随之消失。
单纯性胆道蛔虫病仅剑突下或稍右方有轻微压痛,一般不会出现肌紧张和反跳痛。若并发胆管炎、胰腺炎、肝脓肿,则会出现相应的体征。
B超检查是本病的首选检查方法,发现胆管内有平行强光带(双轨征),偶见蛔虫在胆管内蠕动,有确诊价值。CT、MRCP、ERCP除能客观地证明蛔虫的存在外,还可发现或排除同时存在的胆道其他的疾病,如结石、肿瘤、畸形和狭窄。不仅如此,ERCP还可钳取蛔虫,发挥治疗作用。
(三)诊断与治疗
剧烈的腹部绞痛与不相称的轻微腹部体征是本病的特点和诊断要点,结合B超及其他检查,诊断一般不难。
本病的治疗原则是解痉镇痛、抗感染和驱虫。治疗方法分为非手术疗法和手术疗法,以非手术疗法为主,仅在非手术疗法无效或出现严重并发症的情况下才考虑手术疗法。
1.非手术疗法
(1)解痉镇痛:肌注阿托品、维生素K可减轻疼痛,诊断明确时可肌注度冷丁。
(2)利胆驱虫:发作时可服用乌梅汤、食醋、25%硫酸镁,有利于蛔虫退出胆道。驱虫最好在症状缓解期进行,可选用驱蛔灵、肠虫清或左旋咪唑等。如症状缓解后B超检查发现胆管内有虫体残骸时,应继续服用消炎利胆药2周,以排出胆道内的残骸和虫卵,预防结石形成。
(3)内镜治疗:蛔虫有部分在胆道外,可直接用取石钳取出;若蛔虫完全进入胆总管,则应先行EST,再用取石钳取出虫体。内镜治疗后立即服用驱虫药。
(4)抗感染:常规选用针对革兰氏阴性杆菌和厌氧菌的药物预防和控制感染。
2.手术疗法
(1)手术指征:①经积极治疗3~5天以上,症状无缓解或反有加重者;②胆道内有多条蛔虫或蛔虫与结石并存者;③胆囊蛔虫病;④合并严重并发症者。
(2)手术方法:无并发症者采用胆总管探查取虫及T管引流。有并发症应根据病人情况选用适当术式。术中和术后均采用驱虫治疗。
二、华支睾吸虫病
华支睾吸虫又称肝吸虫。成虫寄生在人体的肝胆管内可达20~30年之久,反复感染,引起一系列肝胆疾病,称为华支睾吸虫病。该病在我国至少已有2 300年以上历史。
(一)病理与临床表现
流行地区的人有食生鱼和食未熟透的鱼虾习惯,寄生在第二中间宿主淡水鱼、虾的囊幼在人胃里变为幼虫,然后从十二指肠乳头进入胆道,发育为成虫,寄生在肝内胆管。成虫的不断运动、活虫代谢物以及死虫的降解产物导致胆管上皮脱落破损、坏死、增生,管壁纤维增厚,胆管周围纤维化等一系列病理改变。同时由于合并细菌感染,胆汁内可溶的葡萄醛酸胆红素在细菌β-葡萄醛酸苷酶作用下变成难溶性的胆红素钙。这些物质与死虫体碎片、虫卵、胆管上皮脱落细胞构成核心,形成胆管结石。
华支睾吸虫病本身的临床症状并无特异性。华支睾吸虫引起肝胆系统的损害在临床上可表现为:胆管炎、胆管结石、胆管炎性狭窄、胆管癌,因而最常见的临床表现是梗阻性黄疸,及各种不同类型的胆系感染症状。
(二)诊断与治疗
本病的诊断要点:①患者有在流行疫区进食生鱼粥、生鱼、生虾等感染接触史。②粪便或/和十二指肠引流液找到华支睾吸虫虫卵。③ELISA法具有简便、快速、敏感性高,特异性强的特点,是目前较为理想的免疫检查方法。既可用于检测华支睾吸虫病人,又可用于流行病学调查。④影像学检查可为该病的诊断提供参考价值。
华支睾吸虫病ERCP表现:①胆管内细丝形或椭圆形充盈缺损,呈卷曲状或瓜仁状。②小胆管变钝或突然中断,胆管不连贯。③胆管不平滑,扭曲或呈枯树枝状。④小胆管扩张增生。
B超检查的特点:①肝内胆管扩张,以左外叶胆管较明显和多见。②扩张的胆管呈丛状分布,围绕扩张的小胆管形成一个不伴身影的小光团,或沿门静脉分支走行,呈点状强回声。③肝内呈现一带晕圈的强光团,可能是寄生虫虫体局限寄生于某一部位的胆管造成,临床上易误诊为肝癌。④肝回声增强,无特异性。
CT检查对华支睾吸虫病诊断也有较大价值。在CT照片上华支睾吸虫胆道感染具有以下特征:肝内胆管从肝门向周围均匀扩张,肝外胆管无明显扩张;肝内管状扩张胆管直径与长度比多数小于1∶10;被膜下囊样扩张小胆管以肝周边分布为主,管径大小相近。这些是特异性征象。少数病例胆囊内可见不规则组织块影。
治疗包括两方面:一是治本,即用药物治疗华支睾吸虫。常用比喹酮,每天服25mg/kg体重,分2次服用,连服2~3天为一疗程。2~3疗程后,虫卵转阴率达90%以上。二是外科治疗,即解除胆道梗阻(包括抗感染和引流)。
因华支睾吸虫感染所致的胆管炎,如果术前明确诊断,只需内镜鼻胆管引流和驱虫就能治愈。所致胆管结石的治疗方法与肝胆管结石症大致相同,只是在拔除胆道引流管之前应驱虫,以免虫体阻塞胆道。引起胆管炎性狭窄治疗常采用“U”形管引流,同时采取组织行病理检查,术后长期严密追踪病情的发展。如已发展为胆管癌,则应视病变的部位、范围与浸润的程度,采用不同的治疗措施。术后辅以驱虫治疗。
三、胆囊血吸虫病
胆囊血吸虫病是由于血吸虫虫卵沉积于胆囊壁、胆囊颈管的黏膜下层造成局部组织充血水肿,进一步形成嗜酸性脓肿,表面的黏膜坏死脱落后形成溃疡,继而组织发生炎性增生,纤维化。另外,成虫和虫卵在胆囊内均可构成结石的核心形成胆石。胆囊壁长期炎性浸润或嗜酸性肉芽肿形成后可与周围肠管粘连形成内瘘。胆囊血吸虫病在不用时期临床上可表现为胆管炎、胆囊出血、胆囊结石、胆肠内瘘。
胆囊血吸虫病临床少见,术前诊断困难,但一般需外科治疗。正确的病因往往在术后病理检查才被证实。一经确诊,应给予抗血吸虫病的药物治疗。(余开焕 王竹平)
第九节 胆道闭锁
胆道闭锁(biliary atresia,BA)是新生儿和婴儿梗阻性黄疸的常见病因之一,是一种肝内外胆管进行性闭锁性病变,患儿常因肝进行性硬化而死亡,临床疗效欠佳。早期诊断和防止胆管进行性纤维化是改善该病预后的关键。胆道闭锁在亚洲地区较西方国家多见,在我国发病率约占出生存活小儿的1/14万至1/8 000。
2025年Donop首次报道了1例先天性胆道闭锁。100年后,Ladd于2025年第一次运用手术方法治疗胆道闭锁。直到2025年Kasai报告应用肝门肠吻合术治疗肝内型胆道闭锁获得成功,并不断加以改进和完善,才使胆道闭锁治疗效果得到较大的改观。目前国内外广泛采用此术式,使术后胆汁排出率为70%~95%,长期存活率为48%~60%。
一、病因
胆道闭锁的发病原因尚未完全明了,目前主要有以下几种学说。
1.胚胎发育异常 部分患儿出生时就有黄疸,肝十二指肠内常无胆管残留,且有合并畸形,提示胚胎发育不良可致胆道闭锁。而这种有合并其他脏器畸形的胆道闭锁的原因可能是位置决定基因突变(inv突变),导致在胚胎发育第5~10周,胆道发育障碍,实心胆管的空心化受阻,形成部分以致全部胆道闭锁。
2.病毒感染 研究发现,在胆道闭锁患儿血清中可以检测到3型呼肠孤病毒的抗体,并在肝门的残留胆管中发现了该病毒颗粒。乳头瘤病毒、巨细胞病毒、轮状病毒、乙型肝炎病毒等与胆道闭锁的发生有密切的关系,腹腔注射A型轮状病毒还可造成胆道闭锁的动物模型。胆道闭锁发病有一定的季节性,也为病毒感染是其原因提供了佐证。另外,有研究结果表明,肝脏的先期损伤是3型呼肠孤病毒感染的前提,在该病毒感染之前已有其他因素(包括其他病毒)损伤了肝脏和胆管,这提示病毒在引起胆管进行性炎症病损的过程中可能有协同作用。
但并不是所有的胆道闭锁患儿的血清和肝组织中都能检测到这些病毒,各实验室报告的阳性率相差很大,有的甚至在10多例胆道闭锁患儿的肝组织和血清中都没有发现这些病毒,说明病毒感染可能只是引起胆道闭锁的众多原因之一。而且在正常人群中也有这些病毒感染,说明有这些病毒存在并不一定就产生胆道闭锁。因而尚需进一步了解病毒感染与胆道闭锁发生间的关系。
3.免疫和/或炎症反应异常 在无合并其他畸形的胆道闭锁患儿中组织相容性白细胞抗原(HLA)-B12表达增强。HLA-B12是最常见的I类HLA,表达增强后使得细胞易遭受免疫攻击。同时,胆道闭锁患儿的Ⅱ类HLA表达也有增强,且与预后成负相关,说明它在细胞毒性T细胞介导的肝细胞和胆管上皮的损伤中有重要作用。
炎症黏附分子如细胞内黏附分子-1在胆道闭锁患儿胆管上皮中的表达增强,而在Byler病(胆汁淤积)中无表达,说明胆道闭锁中黏附分子的异常表达不是继发于胆汁淤积后的非特异性反应。另外胆道闭锁患儿血和尿中CD26的水平升高也为其肝脏和胆管炎症反应异常提供了证据。但引起这些抗原异常表达的原因尚未阐明。
4.其他因素 如孕妇接触有毒物质,患儿局部血液循环障碍,维生素D缺乏等。
二、病理
胆道闭锁的病理学分类众多,但从实用上考虑,临床外科医师根据病变的范围结合外科治疗的观点,常可分为3型。
I型:胆总管闭锁。根据闭锁部位有:①胆总管闭锁。②胆总管、胆囊闭锁。③胆总管远端闭锁。其肝内胆管基本正常,多可手术纠正,又称为可矫型,此型只占胆道闭锁的10%左右。
Ⅱ型:肝外胆管闭锁,包括:①肝外胆管闭锁、胆囊有腔。②肝外胆管及胆囊闭锁。③肝管闭锁3种情况。此型可占胆道闭锁的90%,过去被视为不可矫正型。现业已证明闭锁的肝外胆管呈纤维索状,由炎性瘢痕组织构成,位于门静脉与肝动脉前方,向上可至肝门,达到门静脉分叉的上方,相当于门静脉后方的水平,形成较大纤维组织硬块,其上方可见扩张的胆管,即所谓“胆汁湖”是手术必须解剖的部位。另有部分病例在肝门处纤维组织中有细小胆管通过,切除这些纤维组织及肝门部表面肝组织,可使盲闭的小胆管开放,引出胆汁,这就是Kasai手术成功的解剖学基础。
Ⅲ型:肝内胆管闭锁。此型病例不多。肝内外胆管全部闭锁或肝内及近侧肝外胆管闭锁。目前此型仍不能施行任何引流手术。
胆道闭锁时肝外胆管纤维化,胆管上皮增生,肝内毛细胆管缺损。肝脏严重受累,呈巨细胞样变。肝细胞有空泡形成,细胞肿胀,局灶性坏死及炎性细胞浸润,肝门部纤维化、水肿、急性或慢性炎症等类似新生儿肝炎的病理变化。可以认为这些病变并非是单纯肝外胆道梗阻所致。在早期解除梗阻后,有时肝细胞及肝内胆管病变仍在继续进行。肝脏的损害亦随病程而加重。胆道闭锁2~3月后发生胆汁性肝硬化,终致门静脉高压而出现腹水、脾肿大、上消化道出血或肝功能衰竭。
三、临床表现
胆道闭锁女婴与男婴之比约为3∶2。主要表现是进行性黄疸、消化道症状和门静脉高压症。
1.黄疸 患儿生后不久或1个月内出现黄疸,并呈进行性加重。粪便色变浅、淡黄,甚至持续白陶土色粪便,尿色深黄。超过3个月的患儿黄疸呈深黄色,巩膜、皮肤可表现为深黄绿色。晚期患儿由于少量胆色素通过肠道腺体分泌排入肠腔,加上脱落的肠道上皮细胞可使粪便呈淡黄色。血、尿胆红素进行性升高。
2.消化道症状与腹部体征 患儿出生后精神正常,反应灵敏,食欲良好,生长正常,随后出现食欲不振,营养不良,精神倦怠。肝脏进行性肿大,质地由软且光滑变为硬而呈结节状,2~3个月肝脏可平脐,甚至达到右髂窝,常伴有脐疝和斜疝。晚期出现脾肿大、腹水、腹部膨隆。
3.门静脉高压症的表现 随着病程进展,患儿出现胆汁性肝硬变和门静脉高压症,出现鼻衄,皮肤、黏膜淤斑,脾大,腹水,食道静脉曲张破裂出血,肝昏迷等表现。未治疗的胆道闭锁患儿,大多数在1岁左右因门静脉高压发生上消化道出血及肝功能衰竭而死亡。
四、诊断与鉴别诊断
由于病情呈进行性发展,年龄超过3个月,肝脏病变不可逆转。因此早期诊断、早期治疗对预后有重要意义。
新生儿期阻塞性黄疸,常见疾病为胆道闭锁和淤胆性新生儿肝炎,早期两者临床表现相似,鉴别困难,治疗和预后又截然不同。胆道闭锁须早期手术,才有生存希望,后者多可通过药物治疗而愈。临床上,需结合病史、体征、实验室及影像学检查等资料进行综合分析,方可作出正确诊断。
1.病史及体征 新生儿肝炎时黄疸一般较轻,并有波动性改变,或药物治疗有明显减轻的情况。而胆道闭锁所致黄疸呈持续性加重,白陶土样粪便。肝炎时肝肿大不及胆道闭锁,一般很少超过右季肋下4cm。胆道闭锁肝肿大明显质硬边钝,常伴有脾肿大。部分胆道闭锁患儿还合并有其他脏器的畸形。
2.实验室检查
(1)血清胆红素动态检测:每隔5~7d测定血清胆红素浓度,并描制动态曲线。肝炎随治疗病情发展,血清胆红素浓度曲线逐渐下降,而胆道闭锁随病情发展,血清胆红素浓度则呈持续性升高。但重症淤胆性肝炎亦可表现血清胆红素浓度曲线持续上升,此时鉴别有困难。
(2)低密度血浆脂蛋白-X(LP-X)测定:在胆道闭锁时,胆汁在肝内淤积,血清LP-X则明显升高。新生儿肝炎早期呈阴性。若出生1.5个月后LP-X仍呈阴性,可排除胆道闭锁的可能。
(3)血清5S-核苷酸酶测定:血清5S-核苷酸酶水平标准为17~183μmo L/L,胆道闭锁病例常高于此标准,而新生儿肝炎常低于此水平。
(4)十二指肠引流液胆红素测定:将一种特制的婴儿十二指肠引流管插入胃内,并抽尽胃液,置患儿于右侧卧位,髋部略抬高,注入温清水20m L以刺激胃蠕动,在X线荧光屏下继续进管,使金属头达十二指肠第2段。抽取十二指肠液,在抽完第1管后(胆汁装入试管),从引流管注入33%硫酸镁液每千克体重2~5m L,随后每隔15min抽取十二指肠液,分别装入“甲”、“乙”、“丙”3管。动态观察其颜色,检测pH值,胆红素测定。此方法可获90%的确诊率,简单易行,值得推广。
3.影像学检查及其他
(1)B超:是一种首选无创伤检查。在新生儿肝炎时其肝内外胆管呈正常管腔大小开放图像。在胆道闭锁时肝外胆道不能探出或呈线形条索状。胆囊不显示或呈痕迹瘪小胆囊影像,肝常常增大,并伴有脾肿大。确诊率可达80%。
(2)99m TC-IDA闪烁法排泄试验:胆道闭锁患儿注射放射性药物后,连续动态观察5min后可见肝脏显影,但不见胆管显影,24h内皆无排入肠管的影像。而新生儿肝炎可见肠管内显示放射性药物。有文献报道其准确率为91%。但新生儿肝炎时可由于胆汁稠厚或胆管炎性水肿,出现胆道梗阻,易误诊为胆道闭锁,此时要根据临床表现及其他检查结果分析判断。
(3)MRCP(磁共振胆管系统水成像):其分辨率很高,对肝内胆管及其毗邻关系的成像有助于胆道闭锁与新生儿肝炎的鉴别。
(4)腹腔镜检查:利用微型腹腔镜,可以清楚地观察到肝脏淤胆及肝外胆道、胆囊发育情况,若肝脏呈绿色,淤胆严重,胆囊瘪小或仅有胆囊痕迹,肝十二指肠韧带及肝门无胆管,则可诊断为胆道闭锁,继而中转手术治疗。如果诊断还有困难,可用一细针穿刺行胆道造影,以排除胆道闭锁。若为淤胆性肝炎,可以在腹腔镜下穿刺胆囊,作胆道冲洗术。此法准确,可迅速做出诊断及治疗。
(5)经皮肝穿刺胆管造影或内镜逆行胰胆管造影:虽为一种较可靠的方法,但由于是创伤性检查,且技术条件要求相当高,操作成功率低,故目前临床上已很少应用。
(6)肝穿刺病理学检查:有一定鉴别诊断意义。新生儿肝炎时,以肝实质细胞病变为主,肝小叶结构排列不整,肝细胞坏死,巨细胞性变和门脉炎症。胆道闭锁则表现胆小管明显增生和胆汁栓塞,以门脉区域纤维化为主。有报道20%左右病例不能凭此做出正确诊断,故需结合其他检查结果分析判断。
五、治疗
胆道闭锁的治疗主要是通过手术,重建胆汁引流的通道。要求做到早期诊断,尽早手术。据临床观察,手术迟于90d,将发展为难以恢复的胆汁性肝硬变。此时即使能够成功施行引流手术,解除胆道的梗阻,患儿也难免死于肝功能衰竭。因而该病确诊后须于日龄90d内手术,最佳手术时间为60d内。
1.术前准备 尽量缩短术前准备时间,补充葡萄糖,维生素B、维生素C、维生素K及能量,纠正低蛋白血症及贫血,护肝并作好术中胆管造影的准备。
2.手术的方法依病理类型而不同
(1)I型:胆总管闭锁的病人,其闭锁胆管上方的肝外胆管扩张,可供作胆管-空肠Roux-en-Y吻合术,也可利用含胆汁的胆囊,行胆囊空肠Roux-en-Y吻合术,并辅以抗返流装置。
(2)Ⅱ型:肝外胆管闭锁的病人,可行肝门-空肠吻合术(Kasai手术)。Kasai手术的成功是胆道闭锁治疗上的一大进步。近20余年的临床实践证明,影响Kasai手术效果的因素有:①早期手术,胆汁引流后使肝脏功能得到有效恢复。②解剖肝门,切除肝门部纤维组织,寻找扩张胆管或找到细小有胆汁流出的胆管是手术成功的关键。③术中肝门处只能用压迫止血,禁止用电灼或缝扎止血,以免损伤小的胆管。④增加抗返流装置,防治返流性胆管炎,可保证胆汁通畅引流,减少吻合口狭窄,以防止手术失败。
若胆囊、胆囊管及胆总管通畅者,可行肝门胆囊吻合术,以保留Oddi括约肌功能,可以防止返流性胆管炎,同时较肝门空肠吻合操作简单,创伤较小。
(3)Ⅲ型:肝内胆管完全闭锁以及对以上手术失败的病例,治疗的唯一方法应是原位肝移植术。虽然肝门空肠吻合术后胆汁引流可能满意,但部分病例仍可存在进行性肝硬化及门静脉高压等突出问题,而随着脏器移植技术的不断发展,肝移植治疗胆道闭锁的价值已经明确。目前选择作原位肝移植的原则是:①年龄超过90d,有明显肝硬化和门静脉高压症。②90d内曾作肝门肠吻合术,但有极少(或无)胆汁引出,血清胆红素大于171μmo L/L时。③肝门肠吻合术后,胆汁引流良好,但日后出现慢性肝硬化、严重门静脉高压症和肺动静脉分流时应尽快作肝移植。
肝门肠吻合术与肝移植术在胆道闭锁的治疗中是相辅相成的关系,要根据患儿和医疗单位的具体情况选择术式和手术时间。患儿家长和医师均应有作肝移植的思想准备和技术准备。
3.手术并发症
(1)最常见的手术并发症为胆管炎,发生率为50%。最大可能是上行性感染,但败血症很少见。有学者认为是肝门空肠吻合的结果,阻塞了肝门淋巴引流而易发生肝内胆管炎。反复感染胆管炎可加重肝脏损害。术后第1年较易发生,以后逐渐减少。
(2)吻合部纤维组织的再沉积,使胆汁引流停止。
(3)肝内纤维化继续发展,导致肝硬化。
(王卫星 张爱民 王竹平)
第十节 胆道恶性肿瘤
近10~20年来,胆管癌、胆囊癌的发病率有逐渐升高的趋势。根据2025年1月至2025年12月中华医学会胆道外科学组的调查资料报道,胆囊癌占同期胆道疾病的0.4%~3.8%,男女比例为1∶1.98,发生率随年龄增长而增加,平均年龄59.6岁,高峰年龄60~70岁。胆囊癌并非少见。而胆管癌人群分布不同于胆囊癌,男性多见,发病年龄与胆囊癌相似。
胆道恶性肿瘤早期诊断比较困难。对于晚期胆道肿瘤,诊断较为容易,但切除率低,手术后复发率高,5年生存率仍然很低。
一、胆管恶性肿瘤
胆管恶性肿瘤主要是指肝门部主要胆管至胆总管下端的原发性胆管癌,一般将肝内小胆管发生的胆管细胞癌归入原发性肝癌范畴。
(一)病因
胆管癌的病因仍然不清楚,但与以下一些因素有关:①胆结石与慢性复发性胆管炎:据文献统计,6%~37%胆管癌同时伴有胆石症,有人认为慢性复发性胆管炎导致胆管上皮的非典型增生,可能为癌前病变。②感染:有人报告慢性伤寒菌携带者死于肝胆管癌者6倍于对照组,提出细菌对胆盐的降解可能是致病因素。③肝管狭窄、肝内外胆管囊肿致长期引流不畅,也可能与胆管癌的发生有关。④慢性溃疡性结肠炎或原发性硬化性胆管炎可能与肝外胆管癌有关。此外,胆胰汇合部流体力学异常及胰胆返流亦与胆管癌的发生有关,还与其分子生物学特性改变有密切关系。
(二)临床分型
肝外胆管一般划分为4部分:①上段,胆囊管开口以上直至肝门处的主要肝管。②中段,自胆囊管开口以下至十二指肠上缘。③下段,十二指肠后段与胰腺段胆管。④十二指肠内段包括乳头部。胆管癌可划分为上段胆管癌、中段胆管癌、下段胆管癌,其中以上段胆管癌比例最高,占60%~75%。上段胆管癌亦称肝门部胆管癌指肿瘤发生在胆囊管开口以上的肝外胆管,即发生于肝总管、肝管分叉部、左右肝管的第一、二级分支。中、下段胆管癌指自胆囊管开口至壶腹部以上发生的癌,在临床表现和治疗方法上,中段胆管癌和下段胆管癌有许多相同之处,因而往往将中、下段胆管癌作为一个类型。
根据肿瘤发生的解剖部位,Bismuth和Corlette(1975)将肝门部胆管癌分为4型:Ⅰ型:癌肿位于左、右肝管汇合处以下肝总管,前两者相通。Ⅱ型:癌肿位于左、右肝管分叉处,两者不相通。Ⅲa型:癌肿位于右肝管和肝总管。Ⅲb型:癌肿位于左肝管和肝总管。Ⅳ型:癌肿位于左右肝管和肝总管。发生于左右肝管分叉部的胆管癌有早期出现黄疸和肿瘤发展缓慢的特点,有一定的临床病理特征。此种胆管癌亦称之为Klatskin瘤(Klatskin tumor)。
(三)临床病理特征
胆管癌根据病理大体可分为硬化型、结节型、乳头状和弥漫型。
1.息肉样或乳头状腺癌 可能来源于胆管黏膜的乳头状腺瘤的恶变,较少见。肿瘤表现为胆管黏膜上的息肉样突出至胆管腔内,胆管腔因而扩大,胆管阻塞常不完全,胆管内有时有大量的黏液分泌物。此类肿瘤的特点一般是不向神经周围淋巴间隙、血管或肝组织浸润,但在胆管甚至肝内胆管的黏膜面上可有多发性病灶,若能早期手术切除,成功率高,预后亦良好。
2.结节型胆管癌 结节型胆管癌呈结节状向管腔内突起,瘤体一般较小,表面不规则,基底宽,肿瘤可直接侵犯周围组织和血管并向肝实质扩展,但其程度较硬化型为轻。
3.硬化型胆管癌 在肝门部胆管癌中,此类型最为常见。硬化型癌沿胆管壁浸润,使胆管壁增厚、纤维增生,并向管外浸润形成纤维性硬块。常向肝内方向的胆管浸润、扩展,阻塞肝内胆管的二级分支。此类肿瘤有明显地向胆管周围组织、神经淋巴间隙、血管、肝实质侵犯的倾向。当肿瘤组织已阻塞胆管管腔时,它亦常已侵犯至周围组织或肝组织。神经侵犯是本病的特点。根治性手术切除时常需切除肝叶。硬化型癌与正常胆管壁间的分界一般较为清楚,但有时癌细胞亦可在黏膜下扩展,以致在切除胆管的断端仍可发现有癌细胞。
4.弥漫型(浸润型)胆管癌 癌组织在肝门部和肝内、外的胆管均有广泛浸润,手术时难于确定癌原始发生于胆管的哪个部位,多不能手术切除。
从组织学上可将胆管癌分为:①乳头状腺癌,多数病例为腔内乳头状型,腺癌组织分化较好,有的向管壁浸润生长。②高分化腺癌,在胆管癌中多见,癌组织环绕管壁内浸润生长,癌组织呈大小不等,形状不规则的腺体结构。③低分化腺癌。④未分化癌。⑤印戒细胞癌等。
(四)诊断和鉴别诊断
肝门部胆管癌早期缺乏典型临床表现。多以进行性加深的无痛性(或隐痛不适)黄疸就医,常伴有皮肤瘙痒、食欲减退、腹泻和消瘦等,合并有感染时可出现寒战与发热等胆管炎的表现。合并胆管结石者可出现胆绞痛。肝肿大,质地较硬,表面光滑,部分病人在未出现黄疸前就可触及肿大的肝脏。肝门部胆管癌胆囊常不肿大,当癌肿向下蔓延阻塞胆囊管开口后,胆囊分泌的黏液不能排出而潴留在胆囊腔内时,也可触及肿大的胆囊。脾脏肿大及出现腹水均属病程晚期。来源于一侧肝管的癌,临床上并没有黄疸。直至肿瘤沿胆管壁浸润阻塞对侧肝管开口或因肿瘤肝门处转移浸润,阻塞肝总管时,临床才出现黄疸。
中、下段胆管癌的临床特点是较早期出现梗阻性黄疸。胆囊的改变则视癌与胆囊管开口的关系,若胆囊管开口受阻,则胆囊不肿大,若胆囊管通畅,则胆囊肿大。位于胆管壶腹部的癌肿,除有胆总管阻塞的临床表现外,尚有胰管梗阻的症状,如血糖过高或过低,脂肪性腹泻。壶腹部癌肿容易发生溃疡出血,表现为贫血、柏油样便。持续背部隐痛。胆管中段癌因不造成胰管梗阻,故临床上无胰腺内、外分泌紊乱的现象,亦可触及肿大的胆囊。
实验室检查:癌胚抗原(CEA)是目前已在临床广泛应用的消化道肿瘤标志物,在胆道癌病人血清中的阳性率为40%左右,对于胆道癌的诊断有一定的诊断价值,也是判断手术后是否有肿瘤残留或复发的有用指标。近10年来发现CA199、CA125、CA50、CA242等糖链群肿瘤标志物,对胆道癌有较高的灵敏度,其阳性率为75%~80%,仅次于胰腺癌。这一类肿瘤标志物也见于其他消化道肿瘤病人,因其特异性较差,在进行临床诊断时,必须结合各种影像学诊断或通过不同方法(如PTC或ERCP等)采集胆汁或肿瘤组织,测定上述各种肿瘤标志物、DNA含量或进行基因诊断等方可确定诊断。最近第三军医大学(梁平等)从人的胆管癌组织中提取和纯化了一种新的胆管癌相关抗原(cholangiocarcinoma related antigen,CCRA),并制备了兔抗CCRA-IgG,建立了检测CCRA的ELISA方法。对308例各种良性及恶性疾病病人血清CCRA浓度进行检测,结果发现,其诊断胆管癌的阳性率为77.78%,特异性为95%~100%,明显优于目前所用的上述肿瘤标志物,为胆道癌的早期诊断作出了有意义的探索。
影像学检查
1.B型超声 超声检查是此病诊断时首先选用的方法。在超声下可显示肝内、外胆管,胆囊肿大的情况,肿块的大小。如肝内胆管扩张、胆总管不扩张(直径小于5~7mm),胆囊不肿大则梗阻应在胆囊管开口以上的肝总管,胆总管及肝内胆管扩张,胆囊肿大则梗阻部位在中、下段胆总管或壶腹部。一侧肝内肝管扩张,表示梗阻部位在同侧肝胆管的开口处。肝门肿块加上扩张的左、右肝管,出现所谓“蝴蝶征”的典型表现。在多普勒超声血流图上,可详细观察肿瘤与肝动脉及门静脉的关系,以及血管受侵犯的情况。超声内镜检查(EUS)在诊断下段及中段胆管癌上,较US的效果为佳。EUS系统十二指肠扫查,能显示乳头部直至上段胆管的状态,尤其在诊断癌浸润深度上甚为实用,又可显示胰腺、十二指肠浸润状态和肿大的淋巴结。近年开发出内径仅2mm的超声探头获得由胆管内腔扫查的方法(管腔内超声检查,IDUS)。此与EUS相同,主要用于检查病变进展程度。
2.CT扫描 可以得到与超声相同的效果和更为清晰的立体断层图像,对肝门肿瘤或肝叶萎缩以及确定肝尾叶与肝门肿块的关系、胰头区有无占位病变很有帮助。双螺旋CT胆管成像和门静脉血管成像,可清晰显示门静脉及胆管系统立体结构,术前可准确了解肿瘤所侵犯范围、部位及血管受侵情况,有利于制定合理的治疗方案。
3.磁共振成像(MRI) 和CT的效果相当,可做不同切面的成像图,更能增加对肝内胆管系统改变的立体构像。通过系列的肝门部体层扫描,可以系统地了解肝内胆管的改变,肿瘤的范围,有无肝实质侵犯或肝转移,肝左、右叶有无程度不等的增大或萎缩。MRCP(磁共振胰胆管成像)对肝外胆管梗阻程度判断和定位诊断准确率为85%~100%,梗阻原因诊断的准确率为64%~95%。
4.经皮肝穿刺胆管造影(PTC) 经皮肝穿刺胆管造影(PTC)能清楚地显示梗阻胆管近端的部位、范围、程度和原因,但肝门部胆管癌时,左、右肝管间交通常受阻,右肝管的2~3级分支,左内、外肝胆管之间的交通亦常受阻,在肝内形成肝段间的分隔现象。因此,PTC时需要多处选择性穿刺造影才能显露肝内胆管系统的全貌,因而亦增加并发症的机会。
5.逆行胆道造影 经内镜逆行胆道造影(ERCP)能够显示胆管狭窄、中断、胆管壁不规则或充盈缺损,胆管扭曲与变形。逆行胆管造影可能引起上行性胆道感染。十二指肠镜检查可做壶腹部癌活检。
6.选择性腹腔动脉、肝动脉、肠系膜上动脉造影与经肝门静脉造影 以了解肿瘤是否侵犯门静脉、肝动脉及其分支,门静脉是否闭塞或有无动静脉瘘,也可显示肿瘤的大小与边界。
(五)外科治疗
1.围手术期的处理 恶性梗阻性黄疸的病人,由于肿瘤本身、高胆红素血症和内毒素血症而导致机体发生一系列变化,如肝、肾、肺、脑及胃肠黏膜等变化和损害,营养不良、免疫功能降低与代谢障碍等。因此,术前应注意恢复血容量,改善营养状况,纠正水、电解质代谢紊乱,低蛋白血症与凝血机制障碍(控制内毒素血症)。胆管梗阻常伴有胆道感染,围手术期预防性应用抗生素可降低术后感染并发症的发生率。减少胃酸分泌,以防止术后发生应激性溃疡而导致的胃肠道出血。
关于恶性梗阻性黄疸术前减黄问题:阻黄病人术后的并发症和死亡率与术前血清胆红素呈正相关。PTCD有降低血清胆红素,改善肝功能,治疗胆管炎和减少并发症等优点,但也有一些并发症,如胆汁性腹膜炎、腹腔或胆道出血与胆道感染,且易发生堵管或脱管而达不到引流的目的。有人随机对照行PTCD,发现PTCD虽可降低血清胆红质,但未能降低手术死亡率,高位胆管癌时肝内胆管的分隔化,PTCD不可能起到有效的引流作用,故认为不宜常规来使用。近年来,对拟行手术者,可经ERCP置放鼻胆管先行胆道引流(ENBD),通畅的胆汁引流改善因长期阻塞性黄疸而受损的肝脏功能,同时改善全身状况,为手术治疗创造条件。不能手术者,做ERCP的同时置放内置金属(或塑料)导管(ERBD),将胆汁引入十二指肠,成为非手术性胆肠内引流术,能有效地减轻黄疸,延长患者的生命。
2.上段胆管癌的治疗 肝门部胆管癌由于早期诊断困难,切除肿瘤时常要连同肝叶或广泛的肝切除,手术的危险性高,以往的手术切除率很低。Alexander(1984)报道切除率仅10%,近年来由于影像诊断技术的发展、手术的改进和手术范围的扩大,切除率已有明显提高,切除率已超过60%。对不能切除的肝门部胆管癌,应解除胆道的梗阻,延长病人的生存时间和提高病人的生活质量。
(1)肝门部胆管癌根治性切除术:手术前可根据影像学检查,判断肝门重要血管有无侵犯,肝内胆管病变的范围,有无肝内转移等,一般可以估计能否行根治性切除以及切除的范围。但是,确定能否切除尚有待于手术探查后决定。探查左侧肝管时,可沿肝方叶下缘至静脉韧带沟检查左肝管的全长有无肿瘤浸润或肿块,在脐静脉窝处穿刺左肝管,以判断阻塞的上限。扩张的肝胆管很容易穿刺并抽出胆汁。对右侧肝管探查则一般较为复杂,检查的方法有:①检查肝右切迹有无肿瘤硬块或浸润,该处为右后段肝管所在。②穿刺右后段肝管是否能抽出胆汁。③游离胆囊,通过胆囊肝床穿刺右前段肝管,若能抽出胆汁,表示其有扩张。但是,如果不能建立右肝管引流时,便不宜游离胆囊,因为胆囊床处有一些细小的胆管与肝内胆管交通,可以发生手术后胆汁漏及胆汁性腹膜炎。
术前如有以下情况提示肿瘤不能切除:①双侧肝内胆管广泛受累。②门静脉主干受累。③门静脉两侧分支受累。④两侧肝动脉与门静脉支受累。⑤一侧胆管被侵犯,另一侧血管受累。肝门部主要血管受侵犯是影响肝门部胆管癌手术切除的重要原因之一。如何对待血管的病变,认识上尚不一致。由于肝右动脉与肝总管之间密切的解剖学关系,肝管分叉部癌常压迫或包围肝右动脉支,使其血流量大为减少,切除肝管分叉部癌时常不得不同时切除肝右动脉,只要门静脉血流畅通,一般无严重后果。对认为不能手术切除的肝门部胆管癌病人,近年来广泛采用血管移植和整形的方法修复门静脉和肝动脉。如果肝动脉或门静脉分支在入肝处受累时,则血管修复手术常是不可有的。单纯门静脉主干受侵犯,可行截除及修复手术。
关于切除范围与术式的选择,可按Bismuth或Corlette的肝门胆管癌分型法制定相应的手术方式。
Ⅰ型:切除肝门部胆管、胆总管及胆囊+胆肠吻合术。
Ⅱ型:切除肝方叶及尾状叶,或加部分右前叶、肝门部胆管、肝外胆管及胆囊+胆肠吻合术。
Ⅲa型:切除右三叶及尾状叶、肝门部胆管、肝外胆管及胆囊+胆肠吻合术。
Ⅲb型:切除左三叶及尾状叶、肝门胆管、肝外胆管及胆囊+胆肠吻合术。
Ⅳ型:肝移植术。
对无法切除的肝门部胆管癌,采用异体肝原位或异位移植术,但不能解决早期复发和低存活率问题。Pichlmayer(1988)报告了16例肝门部胆管癌行肝移植术,手术死亡率为25%,平均存活16个月。其分析结果表明,对尚未出现淋巴结转移的病人行肝移植术可能会延长存活期,但因抗排斥反应与癌复发问题尚未能解决,目前还难以推广使用。
近年来,国内外一些作者强调肝门部胆管癌常侵犯尾状叶的胆管分支,应通过扩大的左半肝切除或扩大的中肝叶切除,将尾状叶完全切除。
肝门部胆管癌根治性切除的标准是肝胆管断端不残留癌细胞。肝门部胆管癌根治性切除是一创伤性大、复杂而较为困难的手术,重度黄疸、广泛肝切除、原有胆道感染等均是增加手术死亡率(手术后30d内死亡)的重要因素。
肝门部胆管癌切除术死亡主要发生在兼行广泛肝切除术的病人,特别是在重症梗阻性黄疸行右肝或扩大肝右叶切除术时,手术死亡率最高。因而手术时尽量保存功能性肝组织是降低手术死亡率的重要措施。
(2)肝内胆管引流术:经术前检查或术中探查确定无法行根治性切除者,为了解除黄疸,改善肝功能,可选用胆肠内引流手术或经肿瘤放置“U”形、“T”形或“Y”形管的引流术。
肝内胆管内引流术是首选的治疗方法,它可以减少因长期带管、大量胆汁流失、胆道感染等给病人造成的不便和痛苦,在一定时间内提高病人的生活质量。位于肝管分叉处的肿瘤,若要充分引流肝内胆管系统,需要引流左、右侧的肝内胆管。
1)左侧肝内胆管空肠吻合术:经典的手术方法是Longmire手术,此手术需要切除左外叶肝脏,手术创伤大,不适用于肝管分叉部阻塞。目前常用的方法是圆韧带进路左外叶下段支胆管(Ⅲ段肝管)空肠Roux-en-y吻合术。
2)右侧肝内胆管空肠吻合术:常用的方法是经胆囊的肝右前胆管下段支切开空肠吻合。根据肝门部解剖,右肝管前下段支在胆囊床处只有1~2cm深度,当有肝内胆管扩张时,很容易在该处切开,并将切口扩大以供吻合。此方法较在右前叶切开肝组织寻找肝内胆管要好。
3)置管引流:即经过将肿瘤阻塞部位扩张后,分别向左、右肝管置入导管,导管远端置于胆总管内,缝合胆总管切口,保存Oddi括约肌功能。此手术方法可获得较好的早期效果。但是,内置管经3~6个月后,常易被胆色素沉渣所堵塞,以致反复发作胆管炎及黄疸而需再次处理。
“T”管或“U”管引流亦常用于不能切除肿瘤的病人。
经PTCD外置管或内外结合置管引流,一般只用于晚期不宜手术探查的病人。在目前情况下,此法尚未能有效地延长病人的生存时间和改善生活质量。
3.中、下段胆管癌治疗 中、下段胆管癌以手术切除治疗为主,切除的范围应包括胆囊、部分肝胆管、胰头部及十二指肠,同时清扫相应的淋巴结群。局限性的胆管段切除容易留下有癌细胞残留的胆管和淋巴结。
不能手术切除的病例,可经十二指肠内镜内置管引流解除黄疸,经肝穿刺胆管置管或手术引流梗阻以上的胆管。
中、下段胆管癌的手术切除率及预后均优于肝门部胆管癌。
二、胆囊癌
胆囊癌是胆道系统中较常见的恶性肝癌,国内统计约占肝外胆道癌的25%。
(一)病因
胆囊癌的病因可能与以下因素有关:①胆囊结石与胆囊慢性炎症。由于结石的长期存在及胆囊黏膜慢性炎症的刺激,可促使上皮增生而发生癌变倾向。国内资料报道胆囊癌合并结石占20%~82.6%,国外为54.3%~100%。②胆固醇的代谢紊乱。胆汁滞留与刺激,可能为致癌因素。③细菌的作用。有人报道2/3的胆石中可发现厌氧菌和其他细菌,从胆汁培养的厌氧菌中有40%是梭状芽孢杆菌,这种细菌与肠道中产生致癌物质的细菌相同。④胆囊腺瘤恶变。良性腺瘤直径多小于12mm,而恶性腺瘤的直径多超过12mm。此外,有人研究认为胆囊腺肌病为胆囊癌前病变。
(二)病理
胆囊癌好发于胆囊底、体部,其次是颈部与胆囊管。80%为腺癌(硬化性癌约占60%,乳头状癌占25%,黏液癌占15%),其次为未分化癌(6%),鳞状细胞癌(3%)和混合性癌(1%)。
乳头状癌的癌组织可呈菜花状,并可发生癌组织脱落与出血,导致胆囊管或胆总管阻塞。黏液癌或癌肿黏液性变时,可见胆囊内有大量胶冻状物质。Nevin(1976)提出根据癌细胞分化程度分为3级:Ⅰ级,分化良好;Ⅱ级,中度分化;Ⅲ级,分化不良。并按病变侵犯深度分为五期:Ⅰ期,位于黏膜(原位癌);Ⅱ期,侵及黏膜与肌层;Ⅲ期,全层受侵犯;Ⅳ期,侵犯全层加局部淋巴结受累;Ⅴ期,侵犯肝脏或转移到其他器官。
胆囊癌的转移途径可经淋巴、血行、胆管、神经和直接蔓延等方式。局部浸润则以肝脏多见。胆囊癌的淋巴转移多经肌层和浆膜下层转移到胆囊颈部淋巴结、肠系膜上血管周围淋巴结、汇合于主动脉旁淋巴结。因此在胆囊癌的根治术中应注意上述两路淋巴结的清扫。血行转移可至肝、肺、骨等处,分化不良者易于发生腹腔内种植转移。
(三)诊断与鉴别诊断
胆囊癌早期缺乏临床症状,一旦作出诊断,其病程多已属中晚期。常有以下特征:①长期发作的胆囊炎及胆囊结石病史。②胆囊部肿块质地硬,不规则,若胆囊管阻塞,则胆囊肿大,囊内积液。晚期病人的癌细胞侵犯肝脏,使肝肿大。③当胆囊内癌组织脱落或出血引起胆道阻塞时,继发于胆绞痛之后多可出现黄疸,黄疸的程度较轻,且可消退。亦可因癌组织局部浸润和淋巴转移,压迫肝外胆管而出现黄疸,早期程度较轻,以后逐渐加重。常伴有低热,当胆管发生阻塞和继发感染时,亦可出现高热。在临床上应与胆管的恶性肿瘤、肝癌、胰头癌以及引起上消化道出血的疾病相鉴别。
现代影像学检查可提示早期诊断依据,B超检查为首选的检查方法,影像检查上可发现胆囊黏膜的隆起性改变,胆囊壁增厚,胆囊的内腔消失,胆囊与肝床间的界线消失或变模糊不清,肝脏的转移灶等。影像学检查亦有助于胆管梗阻的定位、淋巴转移的诊断等。
近年来内镜超声检查(EUS)的应用,使早期胆囊癌的诊断率有所提高。
内镜超声检查是采用高频探头在胃或十二指肠腔内对胆囊进行扫描,避免了受腹壁肥厚,肠管积气等影响,对胆囊壁的结构能得到较清楚的图像,使胆囊癌绝大多数可早期得到确诊。
(四)治疗
本病的治疗以手术为主。手术的方式一般包括:①单纯胆囊切除术。②扩大胆囊切除术,即同时楔形切除距胆囊床边缘2cm无肿瘤的肝组织,清除所属引流的淋巴结。③肝切除术,包括切除肝右叶、肝外胆管和广泛的淋巴结清除。④肝门部胆管与空肠Roux-en-y吻合术,或置U形管引流术,对无法切除的胆囊癌可采用上述方法以解除胆道梗阻。
手术方式的选择取决于:①肿瘤的大小。②胆囊床肝组织侵犯的程度。③胆道周围淋巴结的转移情况。④胆道邻近器官的侵犯范围。
Ⅰ、Ⅱ期胆囊癌手术切除胆囊后结果良好,Ⅲ期以上的胆囊癌预后很差。近年来,胆囊癌的扩大根治术再次受到注意。对尚能手术切除的第Ⅴ期胆囊癌施行扩大根治术,包括扩大的肝右叶切除、淋巴结清扫、胰十二指肠切除、门静脉重建等手术的联合使用,以提高病人5年生存率。此种手术只能用于年龄不太大,健康和营养情况良好的病人,因为手术后并发症发生率和死亡率均较高。
因胆囊疾患仅作了单纯胆囊切除术,术后经病检发现胆囊癌,如肿瘤局限于肌层以下者,切除胆囊后,不需再次手术。而侵及浆膜下者应再手术切除胆囊床肝组织,并清扫区域淋巴结。为避免再次手术,术中应将所有切除的胆囊剖开检查,如有可疑者,即作冰冻切片。
据文献报道,胆囊原位癌和侵犯肌固有层的5年累计生存率分别为82.6%和72.5%,如癌肿浸润浆膜下层和浆膜层,5年累计生存率分别为37.0%和14.7%,侵犯邻近脏器者,5年生存率仅为7.5%。
辅助治疗措施如术中及术后放射治疗、化学治疗等对胆囊癌亦有一定的帮助。
(邬善敏 张训臣)
第十一节 胆道出血
胆道出血系因创伤、炎症、结石、肿瘤、血管疾病或其他原因造成肝内或肝外的血管与胆道病理性沟通,血液经胆道流入十二指肠而发生的上消化道出血。
胆道出血的临床表现取决于出血的量和速度。临床上所指的胆道出血,一般是指有较大量的出血,以胆绞痛、消化道出血、阻塞性黄疸三大症状为特征,多需急诊外科处理。
胆道出血其发病率占上消化道出血的1.3%~5%,仅次于溃疡病出血、食管胃底静脉曲张破裂出血与急性胃黏膜糜烂,死亡率较高。我国胆道出血的病因及发病率与西方有着明显的差异,国外较多为外伤所致,少见原因有肝肿瘤、肝血管瘤等。国内胆道出血主要继发于胆道感染。近年来胆道蛔虫与原发性胆管结石的发病率已趋下降,因而继发感染所致的胆道出血病例较前减少。随着经皮肝穿刺诊疗技术的推广应用和肝胆手术的广泛开展,医源性胆道出血的发病率有所增加。
一、分类
胆道出血根据出血的部位分为肝内胆管出血和肝外胆道出血。国外文献报道引起出血的部位,约一半位于肝内,胆囊与肝外胆管各占1/4,只有少数病例由胰腺出血进入胆道。在我国,来源于肝内胆管出血者占绝大多数。各种情况的胆道出血与胆管和血管之间的特殊的解剖学结构有关。
(一)肝内胆管出血
在肝内,胆管、肝动脉、门静脉分支包裹在Glisson鞘内,关系密切,并且肝内胆管的分支稠密,肝动脉分成许多分支围绕着胆管,组成胆管周围血管丛。所以胆道出血多来自肝内胆管。感染性胆道疾病如:急性化脓性胆管炎、胆道蛔虫症、肝内胆管结石是引起胆道出血的常见原因。胆道出血亦可继发于肝脏的外伤、肝脓肿、肝脏肿瘤的破溃。肝内胆道出血多来源于门静脉、肝动脉。出血部位通常是单发的,亦可是多发的。
(二)肝外胆道出血
肝外胆道出血比较少见,除来源于胆管之外,亦可来自胆囊的病变。肝外胆管的血液供给来自十二指肠后动脉、十二指肠上动脉、肝固有动脉、胆囊动脉,围绕着胆总管,形成胆管周围血管丛、黏膜下血管丛。胆总管的血管走向是呈轴向的,主要的血流从下向上,约占62%,在胆总管壁的3点钟和9点钟的位置处,有2支较粗的动脉,约有1/3的人有一门静脉后动脉,起源于腹腔动脉或肠系膜上动脉,紧贴胆总管的后壁,上行汇入肝右动脉。
(三)出血部位
根据肝外胆管与邻近血管解剖学关系的特点,肝外胆管出血时,临床上多见于以下部位:
(1)肝右动脉从左向右与胆总管或肝总管后壁的交叉处。
(2)胆总管的后壁。
(3)胆总管壁上9点钟与3点钟处。
国内所见的肝外胆道出血多见于急性化脓性胆管炎及胆道手术以后的出血。肿瘤或肝动脉瘤向胆道内溃破,肝外的门静脉胆管瘘引起的出血则比较少见。亦可来源于急性出血性胆囊炎时胆囊黏膜面的溃烂,但此时出血量一般不很多。
(四)胆道出血按病因分类
1.感染性胆道出血 急性梗阻性化脓性胆管炎、肝脓肿、胆道蛔虫症、肝内胆管结石、急性胆囊炎。
2.外伤性胆道出血 肝外胆道外伤、肝破裂。
3.医源性胆道出血 PTC、PTCD、肝穿刺活检、手术后胆道出血。
4.血管性胆道出血 肝动脉瘤破入胆道。
5.肿瘤性胆道出血 胆道肿瘤、肝细胞癌破入胆道。
此外,还有一些较少见的情况引起胆道出血,如急性胰腺炎、胆道造影剂刺激、重症梗阻性黄疸、出血倾向、药物所致等。
二、病因病理
(一)感染性胆道出血
原发性胆管结石与胆道蛔虫所致的急性化脓性胆管炎是我国胆道出血最常见的原因,致病菌多为大肠杆菌。肝内感染可累及1个或多个肝叶、肝段。发病机制有:①肝内弥漫性小胆管炎、胆管周围炎、多发性小脓肿型。主要病变在汇管区,小胆管与小叶间静脉相沟通发生多个小胆管血管瘘,广泛的胆道血管沟通可汇集成胆道大出血。②局限性脓肿。多因蛔虫、胆结石阻塞胆道而形成局限性脓肿。集聚的脓液有可能腐蚀附近的肝动脉或门静脉分支而发生胆道大出血。③肝胆管溃疡型。溃疡可穿透邻近肝动脉、门静脉而发生胆道大出血。④肝管内囊状结构。肝胆管炎症波及肝动脉或门静脉分支,形成感染性动脉瘤或门静脉扩张,然后突入肝胆管所致,破裂后血液进入胆道发生胆道出血。
胆囊急性感染后,囊壁可出现多发性糜烂,局灶性或广泛的坏死和出血。也可因结石嵌顿压迫胆管壁或胆囊管壁使之形成溃疡,累及伴行的血管并向胆管穿破,导致胆道出血。动脉血管与胆总管间的沟通可以是血管胆管瘘或是首先形成一假性动脉瘤然后再破溃入胆总管。胆总管探查时,可发现胆总管后壁或一侧壁的穿透性溃疡,并有出血或血凝块。
(二)外伤性胆道出血
一般指工业生产、交通和其他意外事故所致的肝破裂和肝外胆管系统损伤,意外损伤后致胆道出血的机制有:
(1)肝损伤同时伤及肝动脉及胆管,导致动脉与胆管相通,早期即可发生胆道出血。
(2)肝脏的中央型裂伤,肝内血肿,严重的肝穿通伤后,未彻底清创、止血和引流,因血肿、坏死组织继发感染,逐渐腐蚀邻近胆管后引起胆道出血,所以常常不是发生于外伤的当时,而是在外伤后一段时间,称为延迟性胆道出血。延迟性胆道出血有下列特点:①外伤后早期无伤口或胆道出血。②有较长时期发热。③肝表面缺少一敞开的引流口,胆汁、血液、血凝块、脓液及坏死组织不能充分流出。肝内血肿机化,形成假性动脉瘤,再溃破入胆管导致胆道出血。
(三)医源性胆道出血
因各种创伤性诊疗技术或手术所造成的,是外伤性胆道出血的一种特殊类型。
1.施行肝穿刺诊疗技术 近10年来由于肝胆系统穿刺和引流技术的广泛开展,医源性胆道出血的发病率有增高趋势。肝内胆管与肝动脉、门静脉在解剖上关系密切,在有胆道梗阻、感染的情况下,肝动脉的血流增加,胆管周围血管丛增生、扩张,汇管区内的肝动脉支增多,管径增粗,这些都是穿刺置管时容易发生胆道出血的原因。
2.手术后胆道出血 可见于:①胆道手术中游离、结扎或缝合时损伤肝动脉、胆管壁的滋养动脉,可形成假性动脉瘤,后者腐蚀或漏穿入胆管形成胆管动脉瘘。②探查、显露或取石时损伤胆管黏膜或取出结石后胆管壁上的溃疡出血。③强行扩张肝总管、左右肝管的狭窄或癌肿时,损伤胆管与血管,术中即可发生胆道大出血或术后形成假性动脉瘤再向胆道穿破出血。④胆囊切除术时将胆囊管与胆囊动脉或肝右动脉一并结扎或缝扎,术后可因缝线切割或因局部炎症使之直接沟通或形成假性动脉瘤后向胆道穿破。⑤胆肠吻合手术时止血不妥,或缝线损伤了胆管旁的肝动脉,可于术后立即出血或先形成假性动脉瘤后,再向胆管穿破出血。⑥胆管内置“T”形管或“U”形管,压迫胆管壁或因胆管缝线切割松脱引起继发性胆道出血。⑦由于无机碘对胆道黏膜刺激性较强,较用有机碘溶液更易诱发出血。有报道称,经“T”管碘化钠造影可发生胆道出血。
不伴有明显消化道出血的小量胆道出血,或称隐性胆道出血的发病率高,有学者统计,25%的胆囊切除术后及37%的胆总管切开探查后发生便血。
(四)血管病变
肝动脉及其分支动脉瘤向胆道穿破引起胆道出血。来自肝右动脉瘤破裂者多见,其次为肝固有动脉瘤、肝左动脉瘤、胆囊动脉瘤、胃十二指肠动脉瘤破裂。动脉瘤有动脉粥样硬化引起的真性动脉瘤和胆道感染、胆道损伤性假性动脉瘤。良性海绵状血管瘤发生胆道出血者少见。特发性动脉炎、先天性动脉薄弱等罕见。此外,尚有门静脉高压症胆道黏膜下静脉曲张破裂引起胆道出血的报道,均属少见。
(五)肿瘤所致的胆道出血
肝细胞性肝癌、肝内外胆管良性或恶性肿瘤、胆囊息肉或胆囊癌均可发生胆道出血。
(六)其他
有时胆道出血是肝硬化、凝血功能障碍、弥漫性血管内凝血等全身性出血性疾病的局部表现。
三、临床表现与诊断
胆道大量出血的典型临床表现为:①剧烈上腹部疼痛。②呕血及便血。③黄疸。④肿大的胆囊。出血常呈周期性,每隔数天至1~2周重复发生,除胆道出血的症状外,病人亦有原发病的临床表现。严重者可出现休克、严重贫血、低蛋白血症、全身水肿、营养不良、全身衰竭。
带有“T”管的手术后胆道出血时,腹痛的同时可见鲜血从“T”管内流出,并很快在管内凝固。
胆道出血周期性发作的机理:大量的血液涌入胆道,造成胆道内高压,引起胆道及括约肌痉挛,表现为剧烈绞痛。由于胆道内高压,胆囊肿大,胆道系统的腔隙有限,出血后血压下降,血液在胆管内迅速凝固,故出血往往能自行停止。停止出血后胆道炎症更因引流受阻而加剧,待血凝块溶解后,出血又可再发,如此可周期性发作。
曾经做过胆肠吻合的病人,发生胆道大出血时,因无括约肌的强烈痉挛,疼痛程度较轻。由于大量血液突然涌入肠道亦可发生肠绞痛,出血往往不能自行停止。来自门静脉的胆道出血,由于门静脉的压力较低,除引起上腹部的胀感不适外,可以不伴有明显的胆绞痛。胆道完全梗阻者可无消化道出血。
诊断 胆道出血的临床诊断主要是根据:①病史如肝外伤,胆道病史。②上消化道出血。③胆绞痛。④胆囊肿大及有可能黄疸。⑤周期性发作的典型表现。
胆道出血是上消化道出血的一种,所以诊断胆道出血首先要排除其他引起上消化道出血的原因。出血部位的定位诊断对治疗措施的选择以及治疗结果有重要的意义。目前在胆道出血的诊断和定位诊断上通常采用以下几种辅助检查。
(一)X线造影检查
1.选择性肝动脉插管造影 选择性肝动脉插管造影现在被认为是胆道出血中最佳的定位诊断方法。在急性出血期,可见造影剂从肝动脉支漏出汇集于肝动脉假性动脉瘤囊内,或经动脉胆管瘘流进胆管或肝内腔隙。间歇期动脉造影多表现为假性动脉瘤。如果出血来源于门静脉或肝静脉,则不能在动脉造影上显示。由于这种检查方法显影率高,定位准确,可重复检查以及能清楚显示肝动脉的解剖,为手术及选择性肝动脉栓塞止血提供依据。
有上腹部手术史者,由于腹腔粘连、解剖结构改变,易造成肝动脉插管失败。选择性肝动脉插管是一种比较安全的方法,它的主要并发症是可能加重出血或引起新的动脉破裂出血和假性动脉瘤形成。
近来有学者推行术中肝动脉造影,用于术中一般探查难以确定的病灶。因为胆道出血患者多起因于胆道感染,对多发性、双侧性或居肝深面病灶常常难于定位,通过胃右动脉或胃十二指肠动脉插入直径2mm聚乙烯导管到肝固有动脉,注入50%泛影葡胺20m L,从注入15m L时开始拍片,摄影时间需2.5~3s,根据造影结果发现的病理改变选择术式,达到止血和处理原发病灶的目的。
2.胆道造影 造影的方法有:①术中胆道造影。②术后“T”管造影。③静脉胆道造影,但是在肝功能严重障碍或黄疸时不适宜。胆道出血的病人在胆道造影中可见:①血凝块堵塞肝胆管,该部位出现特殊性充盈缺损。②造影剂与肝内血肿、动脉瘤或肝腔隙相通。③肝胆管有狭窄、囊性扩张、结石、肿瘤或其他病灶,有助于推测胆道出血的部位。
(二)纤维内窥镜检查
可在直视下排除食道、胃、十二指肠上段疾病引起的上消化道出血,可经十二指肠乳头明确出血是来源于胆道系统。此外,还可通过逆行胆道造影,显示血管胆道交通的部位,以助出血部位的诊断。然而临床上胆道出血量大时或在胆道出血间歇期内,常常不能清楚分辨出血的来源。
(三)超声显像、CT、同位素99m TC肝胆核素显像
这些检查方法可发现肝内各种原发病灶,如肝内血肿、肝脓肿、良性或恶性肿瘤、胆管有无扩张等。B型超声显像检查方便易行,无损伤性。CT的优点在于可以显示肝和肝周器官和组织的断面图像,有助于定位诊断。肝胆核素检查反映是否存在血管和胆道之间的交通。
(四)手术探查
如果术前未能确定出血部位,病情不允许做进一步检查或观察时,则可考虑手术探查,以明确原因及处理。
依序探查胃、十二指肠、肝、胰,排除其他原因的出血后再探查胆道。仔细探查肝表面质地与周围粘连等,可疑部位可做穿刺,对定位也有帮助。胆道出血时肝动脉扪诊有震颤,这是由于肝动脉管腔狭窄,受压迫,或破裂,引起的血液旋涡所致,在胆道大量出血时可作为参考。胆管增粗,胆总管穿刺吸得血液,诊断即可明确。如胆囊有明显急性炎症,甚至坏疽,则出血可能来自胆囊。有时肝内胆道出血时,胆囊可充满血液和凝块,因此在诊断胆囊出血时需注意探查,认真鉴别,防止遗漏肝内病变。
胆总管探查是术中诊断胆道出血最简单有效的方法。切口应靠近肝门,要有足够的长度,以便观察左、右肝管开口。首先迅速取尽胆管内残留的血液凝块和坏死组织,先探查肝外胆管有无胆石,管壁有无溃疡,肝外胆管有无与血管相通的病灶。如出血已停止,可分别置塑料管于双侧肝管,冲洗和吸尽洗液后,按摩肝脏诱发出血,确定出血来源。
术中胆道造影、胆道镜检查、术中B超检查、肝动脉造影和门静脉造影等,这些检查也都有助于定位诊断。
四、治疗
近几年来对本病的病因、病理日趋明确,诊断水平逐渐提高,治疗方法的选择亦更为合理,使疗效已有所提高。胆道出血国外报道经治疗后死亡率为25%~50%,国内报道死亡率为7.2%~33%。
胆道出血的处理主要根据出血部位、出血量、病理特点结合病人全身情况,选择相应的治疗方法。
近期临床研究表明选择性肝动脉栓塞(TAE)是治疗胆道出血的首选方法,尤其是治疗肝内胆道出血。这种方法的优点在于:①它将胆道出血的诊断、定位及治疗结合起来,一次性完成。②高选择性肝动脉分支的栓塞部位接近出血部位,效果满意,并可减少因肝动脉侧支循环引起的复发性出血。③止血速度快。④肝功能损害小,很少发生大面积肝坏死。⑤对肝内感染所致的肝静脉出血,亦因肝动脉栓塞后,肝静脉与门静脉内压降低,常可达到止血目的。⑥对合并胆道损伤、狭窄需二期手术修复的,可提供最佳择期手术时机。此法对病人的全身状况扰乱较小,特别适用于病情重、手术后出血、肝外伤出血、肿瘤性出血、复发性出血的病人。通常所用的栓塞剂是不锈钢弹簧和明胶海绵。
选择性肝动脉栓塞治疗胆道出血的常见不良反应可有腹痛、发热和SGPT升高等,其他少见并发症有肝脓肿和胆道感染以及侧支循环引起的复发性出血。许多报道都认为选择性肝动脉栓塞对治疗胆道出血的近期效果是满意的,至于远期再出血的复发情况尚无明确报道。
(一)非手术治疗
非手术疗法适应证:
(1)出血量不大,且逐渐减少者。
(2)胆道大出血的第1~2个周期。
(3)无梗阻性黄疸或化脓性胆管炎的临床表现。
(4)经纤维内窥镜检查、T形管造影、选择性肝动脉造影或已作手术探查,但出血病灶仍不明确者。
(5)全身情况太差,不能耐受手术者。
非手术治疗包括输血、补液、抗休克、营养支持疗法、应用抗生素和止血药物。带有T形管的胆道出血病人,可试用肾上腺素或去甲肾上腺素生理盐水,反复冲洗胆道。本病的特点是周期性反复出血,因此非手术疗法止血后,宜继续用药巩固10d以上,以防再度出血和促使残余血块排出。血止后仍需作进一步检查,如胆道造影、B型超声、同位素扫描、CT等,明确出血病因和病灶部位,以利根治。对胆道大量出血和经非手术治疗仍继续出血的病人,应予手术治疗。
(二)手术治疗
1.手术适应证
(1)反复大量出血超过2个周期者。
(2)伴出血性休克不易纠正者。
(3)经查明出血病灶较严重,需要手术处理。
(4)有梗阻性化脓性胆管炎的临床表现,非手术治疗不能控制者。
2.手术时机 出血量大伴有休克,抗休克治疗又不易纠正,应施行急诊手术,出血期进行手术易判定病灶部位,增加手术止血的确切性。出血病灶定位明确,出血暂停或出血量较少,可择期或出血间歇期施行手术治疗。
(三)手术方式选择
手术术式的选择要根据病变的部位和性质、病人的全身情况来确定。
1.胆囊切除术 适用于急性出血性坏疽性胆囊炎、胆囊肿瘤、胆囊动脉瘤或肝动脉瘤等所造成的胆囊出血。
2.胆总管探查加“T”管引流 胆总管探查加“T”管引流术因未能处理出血灶,除对部分因胆管黏膜炎性溃疡,引流后出血可渐停止外,对大多数胆道出血不能奏效,仅适用于严重的胆道感染和一般情况差,不能耐受复杂手术的病人。胆总管探查加“T”管引流的作用在于:①探查出血来源,去除梗阻原因。②引流胆汁,减低胆道内压,有助于控制感染、减轻黄疸、促进出血灶的愈合和改善肝功能。③观察术后再出血。④可经“T”管注入抗生素或造影剂或止血药物。⑤部分因胆道黏膜炎症溃疡引起的出血可望治愈。
3.肝动脉结扎术 肝动脉结扎只能阻断出血灶的血供,未处理出血病灶,故其应用范围受到一定限制,仅适用于:①确属肝动脉支破裂引起的活动性肝内胆道出血。阻断肝动脉血流时,震颤消失,出血停止。②双侧肝内胆道出血,肝内没有明显局限性病灶可见者。③手术中出血已停止,不能明确出血灶。④不能切除的肝肿瘤或胆管癌所致的胆道出血,或不能耐受手术者。
结扎部位以肝固有动脉为好,肝动脉结扎术选择结扎越接近出血部位的动脉分支,效果越好。若出血来自一侧肝胆管者,结扎患侧肝动脉止血效果较好,结扎时应细致解剖肝门,如有异常的肝副动脉,应一并结扎。若结扎后仍然出血,应做术中肝动脉、门静脉造影等进一步检查。有重度休克时或门静脉有血栓形成者,不宜采用肝动脉结扎术。
肝动脉结扎术治疗胆道出血的效果,取决于下列因素:
(1)术前必须确定患者胆道出血主要来自肝动脉胆管瘘。虽然肝动脉结扎可降低部分门静脉压力,但对较大的胆道静脉瘘或多发性胆道小静脉瘘难以奏效。
(2)结扎的动脉是否是出血灶的血管,肝动脉结扎后其原有灶区肝动脉震颤消失、出血停止,方确认有效。
(3)肝动脉结扎是否有效:肝动脉震颤消失是结扎有效的依据。
肝动脉结扎术治疗胆道出血,可造成肝功能损害,复发出血较多。肝动脉变异的发生率可高达45%,侧支循环多达26条,术后很快通过小叶间动脉、包膜下动脉及膈下动脉形成广泛侧支循环,一方面可改善肝动脉主干被结扎所致的肝功能损害,而另一方面也是造成肝动脉结扎后胆道出血复发的原因。
4.肝动脉结扎、切除 用于肝外胆管壁的溃疡蚀破肝动脉分支所致的胆道出血,出血来源多为:①肝右动脉胆管后部分,出血处在肝总管后壁。②门静脉后动脉,出血在胆总管后壁。③胰十二指肠上前动脉,出血处在胆总管下段前壁。出血可以发生在胆肠吻合内引流术后或继发于急性化脓性胆管炎。处理的方法应该找出出血相应的动脉支,将出血段的两头结扎并切除,该处动脉壁多已破坏,若切除动脉段有困难,则必须将出血处动脉上、下方妥善结扎。
5.肝部分切除术 肝叶或肝段切除治疗肝内胆道出血,既达到止血目的,又去除病灶,是一种彻底的治疗手段。但手术创伤大、出血量大,对处于失血和感染双重侵袭下的重危病人来说,肝叶切除确有一定的危险性。肝部分切除的指征:①可切除的肝脏良性或恶性肿瘤。②定位局限的肝内感染或损伤灶。③出血来自一侧肝内,但不能明确出血灶的病理性质。④病人全身情况可耐受肝切除手术者。目前多是在选择性肝动脉栓塞失败或肝动脉结扎后胆道出血复发时采用。
其他手术治疗方式:如果胆道出血的原因由门静脉胆道瘘引起,可采用结扎门静脉分支,术中静脉穿刺插管行选择性门静脉分支栓塞。由胰腺假性囊肿引起胆道出血较少见,可采用囊肿切除或切开囊肿、缝扎出血的血管并行囊肿空肠内引流术。
(张训臣 邬善敏)
参考文献
1 任旭,王义泵,李洪松等.逆行胰胆管造影对梗阻性黄疸的诊断价值,中华消化内镜杂志.1996;13(1):17.
2 邬创华,任长才,项建城等.磁共振胰胆管成像在诊断胆胰系统病中的应用.中华医学影像技术.1999;15(2):135.
3 吴在德.外科学.第五版.北京:人民卫生出版社,2002;611-613.
4 Keogan MT,Sea bowrn JT,Pau lson EK,et al.Contrast-entanced CT of intrahepatic and hilar cholangiocacinoma:delay time for optimal imaging,AJR,1997;169:1493.
5 杜忆兵,殷承祥,王志兵等.螺旋CT胆系造影诊断胆管阻塞,中华放射学杂志,1998;(5):327-329.
6 顾军,周康英杰等.螺旋CT胆道及其三维重建的临床应用价值.[J]临床放射学杂志,2000;19(8):490-494.
7 Stockberger SM,Shoman S,Kopechy KK,Helical CT cholangigraphy.[J]Abdom Imaging,1996;21(1):98.
8 吴阶平,裘法祖.黄家驷外科学.第6版.北京:人民卫生出版社,2001;405-408.
9 Barr RG,Agnesi JN,Schaub CR.aluclous gallbladder diseasi:US Evaluation after slow infusion cholecystokinin stimulating in symntomatic and asymptomatic adults.Radiology,1997;204:105
10 Terzi c,Sokmen S,seckin S.polynoid lesions of the gallbladder:Report of 100 cases with special reference to operative indications.surgery,2000;127-622-627
11 Csendes A,Burgos M.csendes P.Late follow—Up of polynoid lesion of the gallbladder smaller than 10mm.Ann surg,2001;234(5)657-660
12 Stenhen AE,Berger DL,Mass B.Carcinoma in the norcelain gallbladder:A relationship revisited.surg,2001;129(6)699-703
13 Yamaguchi M.Congenital cholechal cyst.Analysis of 1,433 patients in the Japanese literature.Am J Surg,1980;140(5):653-57.
14 Casaccia G,Bilancioni E,Nahom A,et al.Cystic anomalies of biliary tree in the fetus:is it possible to make a more specific prenatal diagnosis?J Pediatr Surg,2002;37(8):1191-4.
15 Chapman RW.Risk factors for biliary tract carcinogenesis.Ann Oncol,1999;10(Supp14):308-11.
16 Tanaka M,Shimizn S.Laparoscopically assisted resection of choledochal cyst and Roux-en-Y reconstraction.Surg Erdosc,2001;15(6):545-52.
17 Chowbey PK,Katrak MP,Sharma A,et al.Complete laparoscopic management choledochalcyst:report of two cases.J Laparoendosc Adv Surg Tech A,2002;12(3):217-21.
18 Fu M,Wang YX,Zhang JZ.Evaluation in the treatment of choledochuscyst.J Pediatr Surg,2000;35(9):1344-47
19 严际慎.疑难普通外科学.武汉:湖北科学技术出版社.2001.499.
20 张爱民,雷正明,黎靖等.细胞凋亡与增殖在先天性胆总管囊肿发病中的作用.中国普外基础与临床杂志,2003;10(1):43-45
21 王悦华,刘永雄,黄志强等.先天性胆管囊肿再次手术53例分析.中华普通外科杂志,2002;17(5):266.
22 Chambers HF,Sande MA.Antimicrobial Agents:General considerations.Hardman JG and Limbird LE,1996;1029-56.
23 Hakansson K,Ekberg O,Hakansson HO,et al.MR characteristics of acute cholangitis.Acta radioologila,2002;43(2):175-9.
24 Hui CK,Lai KC,Yuen MF,et al.Acute cholangitis:predictive factors for emergency ERCP.Alimentary pharmacology &therapentics,2001;15(10):1 633-75.
25 Hanau LH,Steigbigel NH.Acute cholangitis.Infections disease clinics of North American,2001;14(3):521-46.
26 Michael GTR,Margaret F,John PH.Acute cholangitis and pancreatitis secondary to common duct stones:management update.World J Sury,1998;22(11):1 155.
27 Kimmings AN,Van Deventer SJ,Ranws EAJ,et al.Systemic inflammatory response in acute cholangitis and after subsepuent treatment.Acta chirargica,2000;166(9):700-5.
28 Bass NM.Sclerosing cholangitis and recurrent pyogenic cholangitis.Sleisenger &Fordtran’s Gastrointestrial and Liver Disease,1998;1 007-25.
29 Sugiyama M,Atomi Y.The benefits of endoscopic nosobiliary drainage without sphincteromoy for acute cholangitis.Am J Gastroenterol,1998;93:2 065.
30 黄志强.努力提高对重症急性胆管炎的治疗效果.实用外科杂志,1986;6(1):1
31 贾晓巍,张阳德,龚连生等.三镜联合治疗急性梗阻性化脓性胆管炎21例的体会.中国现代医学杂志,2002;12(6):83-4.
32 刘永雄.原发性硬化性胆管炎.胆道外科的理论与实践,1991;124~132
33 黄志强.当代胆道外科学.上海:上海科学技术文献出版社,1998.8
34 黄志强.胆道外科手术学.北京:人民军医出版社出版,1993;8.205
35 全国胆石病学术会议论文摘要.中华医学会.南京,1987.10
36 钱家勤,戴值本.肝胆管结石异高位胆管狭窄的外科治疗.肝胆外科杂志,1994;(11):30
37 张延龄.胆道出血症.国外医学外科学分册,2002;3:141
38 袁芳.Mirizzi综合征的影像诊断.中国医学影像杂志,2002;10(6),462
39 刘恕,张成裕.肝内胆管残留结石.黄志强:当代胆道外科学.上海科学文献出版社,1998.8:437
40 祝学光.肝胆管结石残留问题的研究现状及展望.中国实用外科杂志,2000;20(9)561
41 黄志强.医源性胆管损伤:老问题,新意义.中国实用外科杂志,1999;19(8):451
42 黄志强.当代胆道外科学.上海:上海科学技术文献出版社,1998.8
43 方善德,曹绣虎.胆道外科的理论与实践.郑州:河南科技出版社,1991;4:94
44 黄志强.胆道外科手术学.北京:人民军医出版社出版,1991.205
45 吴志棉,梁力建.严格掌握腹腔镜胆囊切除手术的适应证.肝胆外科杂志,1998;6(2):68
46 刘浔阳,黄飞舟,聂晚频等.医源性胆管损伤的原因及处理.中国实用外科杂志,1999;19 (8):471
47 Lefko witch JH.Biliary atresia.Mayo Clin Proc,1998;73(1):90-95
48 Ohi R.Surgical trertment of biliary atresia in the liver transplantation era.Surg Today,1998;28(12):1229
49 Carceller A,Blanchard H,et al.Past and future of biliary atresia.J Pediatr Surg,2000;35 (5):717
50 Sokol RJ,Mack C.Etiopathogenesis of biliary atresia.Semina Liver Disease,2001;21(4):517
51 Jacquemin E,Cresteil D,et al.CFCI gene mutation and biliary atresia with polysplenia syndrome.J Pediatr Gastro Nutri,2002;34(3):326
52 Badia I,Ferro A,Galoppo MC.Biliary atresia,the Kasai operation,and the chance of success.J Pediatr,2002;141(2):295
53 Fischler B,Haglund B,Hjern A.A population-based study on the incidence and possible preand perinatal etiologic risk factors of biliary atresia.Jpediatr,2002;141(2):217
54 Ohi R.Surgery for biliary atresia.Liver,2001;21(3):175
55 冯杰雄,李民驹.胆道闭锁病因学研究进展.国外医学儿科学分册,2001;28(2):66
56 李桂生.胆道闭锁治疗的新进展.中国实用儿科杂志,1999;14(9):516
57 陶文芳.胆道闭锁的早期诊断及与新生儿肝炎的鉴别诊断.中国实用儿科杂志,1999;14(9):515
58 夏穗生.现代腹部外科学.武汉:湖北科学技术出版社.1996
59 Nakeeb A,Tran KQ,Black MJ,et al.Improved surviveal in resected biliary malignancies.Surgery 2002 Oct;132(4):555-63
60 Cheng JL,Bruno MJ,Bergman JJ,et al.Endoscopic palliation of patients with biliary obstruction caused by nonresectable hilar cholangiocarcinoma:efficacy of self-expandable metallic Wallstents.Gastrointest Endosc 2002 Jul;56(1):33-9
61 Capussotti L,Muratore A,Polastri R,et al.Liver resection for hilar cholangiocarcinoma:inhospital mortality and longterm survival.J Am Coll Surg 2002 Nov;195(5):641-7
62 Bloechle.C,Izbicki JR,Rashed MYT,et al.Hemobilia:Presentation,diagnosis,and management.Am J Gastroenterology,1994;89(9):1 537
63 夏穗生.现代腹部外科学.武汉:湖北科学技术出版社,1996;454~460
64 张延龄.胆道出血症.国外医学外科学分册,2002;26(3):140~142
65 Green MHA,Duell RM,Johnson,CD,etal.Haemobilia.Br J Sury 2001;88(6):773~786
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







