第十九章 肝脏外科
第一节 肝 损 伤
在腹部创伤中,肝损伤较为常见,占腹部外伤的25%。肝脏是腹腔最大的实质性器官,质地脆而缺乏弹性,周围韧带的固定限制了它的退让余地,尽管位于右侧膈下和季肋深面,受到胸廓和膈肌保护,仍可在肋骨无损伤的情况下发生肝创伤。人自高处坠落,暴力虽未直接伤及肝脏,但仍可因惯性的反冲及应力作用,使肝脏发生严重的撕裂伤。在肝脏因病变而肿大或变性时,受外力作用更易受损伤。
肝损伤后常伴有严重的出血性休克,因胆汁漏入腹腔引起胆汁性腹膜炎和继发感染,如处理不及时或不当,后果严重。据报道其总死亡率为10%,严重肝外伤死亡率高达50%。因此,严重肝外伤的处理仍是一个重要课题。
一、肝外伤分类
(1)根据致伤的原因不同可将肝损伤分两大类。①开放性损伤:因锐性外力如利刃、枪弹或弹片贯穿胸腹壁而损伤肝脏。②闭合性损伤:多因钝性外力如打击、挤压、车祸、爆震或高处跌伤等原因使肝脏受到间接冲力作用而损伤。(图19-1)

图19-1 肝外伤的类型
1.肝包膜下血肿 2.肝实质挫伤 3.肝实质离断伤 4.肝中央破裂 5.肝实质毁损伤
(2)根据肝脏损伤的情况判断、治疗方法、预后及疗效的评定进行分类,目前尚无统一公认的标准(图19-1)。按临床所见我们将肝外伤分为下列五度:Ⅰ度为肝包膜撕裂和实质破裂深度不足1cm;Ⅱ度为肝实质破裂深度在1~3cm,包膜下血肿不超过10cm或肝周围型穿通伤;Ⅲ度为肝实质破裂深度3cm以上,包膜下血肿达10cm或更大,或为中央型穿通性伤;Ⅳ度为肝一叶损坏,或较大的中央型血肿;Ⅴ度为肝后腔静脉破裂,广泛的肝双叶损伤。
(3)根据临床需要,将下列情况定为严重肝损伤:①肝破裂有重大肝实质破坏长10cm,深3cm以上。②多发性中等度破裂,有或无血肿。③星状破裂。④肝静脉和肝后腔静脉损伤。
二、病理
肝外伤的主要病理改变是肝组织破裂出血、胆汁外溢和肝组织坏死。大量出血导致循环量减少,出现不同程度的休克。呼吸动作可以加重创伤组织撕裂出血。胆汁外渗引起腹膜刺激症状和继发性胆汁性腹膜炎。大量血液和胆汁积聚于第三间隙,引起脉速、电解质紊乱,可能有代谢性酸中毒,肾功能衰竭和休克肺等。肝中央型破裂系中央的实质破裂,肝表层组织损伤不明显,因此可以形成巨大的肝内血肿,造成较广泛的肝组织坏死和创伤性胆道出血。肝包膜下血肿大小不等,有时可容纳2 000 ~3 000m L血液。
一般而言,肝右叶遭受创伤的机会较左叶高出5~6倍。因右肝膈面向前上方呈穹隆状,且右肝的表面积和体积均较左肝叶大,下胸及上腹部受挤压伤时,右肝呈向上的折力,下胸部肋骨骨折或前腹壁创伤时,肝右叶首当其冲。在所有的肝损伤中,右膈顶部占38%~42%。
三、临床表现
肝损伤之临床表现取决于肝损伤的病理类型及范围。损伤程度及病理类型不同,肝外伤的临床表现也不尽一致,主要病象是腹腔内出血和腹膜刺激症状。
肝表浅裂伤出血和胆汁外渗不多,甚至无胆汁明显外渗,在短期内多能自行停止,临床上一般仅有上腹部疼痛,可随时间推移症状减轻或消失。
中心型肝挫裂伤或贯通伤,多有广泛的肝组织碎裂和肝内较大的胆管及血管断裂,腹腔内较多的出血和胆汁,病人可有不同程度的休克、腹部剧痛、腹肌紧张、腹部压痛,同时常伴有恶心、呕吐、脉速、面色苍白等。这些症状如不处理,可随出血量的增多、胆汁外溢增加而加重。
严重肝脏裂伤或合并有大血管损伤时,由于大出血,伤员往往在伤后短期内即出现严重休克及意识不清,腹壁逐渐膨隆、脉细速、呼吸困难等,如处理不及时常因失血过多而死亡。
肝包膜下血肿和中心型破裂因血液和胆汁局限在肝包膜下或肝实质内,无腹肌紧张,有时可触及到右上腹局限性压痛包块,肝肿大变形。叩诊肝浊音界扩大,伤员呈进行性贫血。如血肿与胆道相通,可表现为胆道出血。如因肝包膜张力过大而突然破裂,可出现急性腹痛和内出血等症状。如血肿出现继发性感染则出现肝脓肿的临床表现。
肝外伤的同时可伴有右下胸皮肤擦伤和皮下淤血,也可能因肋骨骨折产生皮下气肿。
体格检查时,除有失血性休克外,腹部有不同程度的肌紧张、压痛和反跳痛、肝区叩击痛,以及肠鸣音减弱或消失等腹膜刺激症候群。如腹腔内有大量出血和胆汁,可有明显的移动性浊音。血液、胆汁刺激膈肌可引起呃逆和右肩牵涉痛。腹腔内大量积血时,直肠指检直肠膀胱陷窝饱满和触痛。
在注意肝外伤的同时,要注意检查其他合并伤,否则因漏诊而延误治疗,导致严重后果。
四、诊断
开放性肝损伤的诊断多无大困难。闭合性肝损伤伴有严重的腹腔内出血及腹膜刺激征,只要想到有肝损伤的可能,诊断一般也不难。程度较轻的包膜下出血有时与腹壁挫伤较难鉴别。特别当闭合性肝损伤合并有胸、腹部严重复合伤时,由于伤势重,病情复杂,往往不易确定有否肝损伤的存在。因此应结合受伤的情况、临床表现和各种必要的诊断辅助方法迅速作出判断,以便制定紧急治疗方案,避免延误病情。
1.腹腔穿刺 腹腔穿刺是目前临床上最常采用的一种安全、有效和操作简易的诊断方法,诊断阳性率可达90%左右。如为闭合性损伤包膜下出血或腹腔内出血量少时,腹腔穿刺诊断可能有困难。
2.腹腔穿刺灌洗术 Elering和Fischer积极主张采用腹腔穿刺灌洗术,尤其是对少量腹腔内出血者在诊断上很有帮助。其方法是用18号粗针在腹直肌外侧,腹部四个象限内穿刺。如能抽出不凝固血液,即为阳性。如抽不出血液,则用细导管经穿刺针插入腹腔内,进行抽吸。如仍抽吸不出,则用无菌等渗盐水经导管注入腹腔内(每次用量按20m L/kg体重计算),适当摇动伤员腹部,使溶液均匀散布腹腔,2~3min后,再将液体吸出,进行检查。若液体完全澄清为阴性。若红细胞>0.1× 1012/L,胆红素>2.73μmol/L,白细胞>0.5×109/L者为阳性,说明腹腔内出血可能。诚然,灌注法阳性,少量的腹腔内出血,仅为一种判断方法,并不是手术适应证,是否有手术适应证还需结合外伤、临床表现和其他检查的综合分析而定。
3.B型超声波检查 对于肝包膜下血肿、中央型肝挫伤和腹腔内积血积液的诊断有较确定的价值。
4.实验室检查 定时检查红细胞计数、血红蛋白和红细胞压积容积等。在肝损伤早期,红细胞计数、血红蛋白和红细胞压积容积可能接近正常,但随着病情的发展,腹腔内出血量增多会逐渐下降。白细胞早期即可升高,损伤后10h内,可升高150%~300%。血清GPT、GOT值在损伤后几小时即可升高,因GPT选择性地在肝内浓缩,损伤后大量释放出来,所以GPT较GOT更具有特殊诊断意义。
5.X线检查 对肝损伤的诊断不如腹腔穿刺迅速、简单、直接、可靠,但有些疑难病例,如发现右下胸肋骨骨折、右侧膈肌抬高,肝脏阴影增大弯形,升结肠阴影向内侧移位,均提示肝损伤内出血的可能。
还有一些特殊的检查方法,如选择性肝动脉造影、放射性核素肝扫素、CT、MRI等,对危重伤员不能采用,但对休克不明显、全身状况较好或损伤后有并发症者有一定帮助。如肝内血肿、膈下感染、肝组织缺血坏死、胆道出血、肝脓肿等,常需要借助这些方法作进一步的检查及病灶定位。
对某些病情复杂的伤员,高度怀疑有肝破裂时,应采取积极态度,及时施行剖腹探查。
肝外伤伴合并伤者,可增加诊断上的困难,死亡率亦高。Madding报告肝钝性伤伴有合并伤者占65%,而穿通性伤者仅有5%,因钝性伤暴力较大,损伤广泛,虽然其他器官损伤的表现可掩盖肝外伤,而事实上常因其他器官损伤行剖腹探查手术时,可发现肝外伤。反之,有肝外伤者亦不能忽略其他器官的合并伤。
五、治疗
(一)复苏
肝外伤休克的发生率为15%~16%,因此严重肝外伤治疗的首要步骤是积极复苏。
1.补液 是治疗严重肝外伤的重要措施之一,给林格乳酸盐溶液,经中心静脉或大的肢体静脉输入,因肝外伤可合并下腔静脉损伤,故输液通道以选择上肢静脉为好。由于低温不利于凝血,手术室准备温篮,使液体经升温至40℃,然后输入,待血型确定后再输入全血。
2.输血 无疑是治疗肝外伤出血休克的重要措施,由于紧急补血量大,一般常用库血;可以引起输血有关凝血病,大量输库血是凝血机制缺陷的主要原因,成分输血或间断地给予新鲜冰血浆,监测凝血酶原时间和凝血激酶时间,使之维持在正常范围。
3.急诊剖胸阻断降主动脉术 早在10多年前已被大力推广应用,开始用于胸部穿通伤的临危病例,逐渐扩大应用于出血性腹部外伤,严重肝外伤大量失血。此种术式对于抢救因大血管出血处于垂危状态的病例是合理的。①使有限的血容量再分配至上半身,改善心脏和脑的灌注;②减少进行性失血;③提供无血的手术野,易于显露腹部出血的血管。
尽管由于这类病例抢救的成功率低,不少人对采用这种手术持批评态度,但大多数作者经实验和临床研究,证实急诊剖胸阻断降主动脉对出血抢救手术的肯定价值和长期效果。但必须严格掌握手术适应证。
急诊剖胸阻断降主动脉的操作方法与注意事项:Elerding认为急诊室初步复苏失败,应经左侧第五肋间剖胸,于膈上暂时阻断降主动脉,直至补足血容量。必要时可分两组进行手术,一组有经验的外科医师负责腹部显露,另一组剖胸阻断降主动脉。止血后放松主动脉钳是一项临危的操作,放钳前应恢复充足的血容量,以免促发心跳骤停。但是主动脉阻断补给过多液体,将使左心室或右心室过度扩张,影响协调收缩,同时要认识到防治低温、酸中毒和凝血病,与血管修补止血同样重要。
遇外伤性血腹病例,如未行剖胸,收缩压在10.67kPa以下,可于横膈主动脉裂孔处,先触扪并压迫腹主动脉,直至血容量得到改善。
(二)手术治疗
严重的肝外伤必须施行手术治疗,抢救肝外伤的基本原则是:加强复苏;立即手术止血;清除失去活力的组织;积液、积血和胆汁的通畅引流;术后的支持处理。其核心是手术。
Pachter把手术归纳为7个处理步骤:①暂时压迫外伤处以迅速止血,直至酸中毒和低血容量得到纠正。②阻断肝门三联。③指捏法显露肝损伤深部。④直视下结扎和修补损伤的血管和胆管。⑤清除失活的肝组织。⑥必要时用有活力的带蒂大网膜堵塞肝损伤死腔。⑦广泛而通畅引流。
1.切口选择 手术切口最好能避开开放伤口,另作切口进入腹腔,以保证伤口一期愈合。一般多采用右上腹旁正中或上腹部正中切口,以便于处理右肝损伤,可作经右侧第七或第八肋间的胸腹联合切口。上腹正中切口的优点,可以直接向盆腔延长,亦可向上延长,必要时沿胸骨中线劈开胸骨,以更好地显露膈上及肝后腔静脉等。
2.手术处理
(1)探查:开腹后首先吸尽腹腔内积血和胆汁,搜索出血来源,必要时剪开镰状韧带、三角韧带,甚至冠状韧带。在未判明肝伤口前,切忌牵拉或翻动肝脏,否则可使填压在下腔静脉或肝静脉撕裂口上的凝血块脱落或因翻动暴力撕大裂口,导致难以控制的大出血。手术时若肝创面已无出血,仍应探查裂口,因在这些裂口中可能有肝组织碎块、血凝块、深部有活动性出血或胆管的损伤,若不处理,就可能发生一些严重的术后并发症。另外裂口周围有些肝组织是否已失血供,也需将裂口敞开才能查清。发现有活动性出血,可以在吸引器帮助下寻找出血血管,钳夹或缝合止血。如视野不清,可用纱布垫压迫暂时止血或暂时迅速阻断肝门,使手术野清晰以利探查。如阻断肝门后出血仍不能停止,要考虑有肝静脉或腔静脉的损伤,且病人濒危于休克状态,应急速地阻断上腹腹主动脉(腹腔动脉平面以上)。如见有大量静脉出血应阻断下腔静脉,准备进行全肝血流阻断后血管修补或肝切除术。
(2)伤缘整齐的浅刺伤、切伤或浅裂伤:已不出血者仅放置引流即可。如有活动性出血,用单纯间断缝合或间断褥式缝合将伤口闭合止血,一般较浅的肝损伤,均能达到止血目的(图19-2)。
(3)深裂伤:伤口深度在3cm以上者称为深裂伤,此深度常累及Glisson氏系统管道的三级分支。单纯缝合常不能奏效,缝合后看来表面出血停止,但深部常遗有死腔,极易继发性聚积血液、胆汁,形成人为的中心型爆炸伤,术后可能并发感染和胆质血症。如果腔内有较大的血管和胆管断裂而未处理,血液经死腔进入胆道,便可在临床上发生常见的周期性胆源性消化道出血,给术后的治疗造成极大的困难。深裂伤应在暂时阻断肝门控制出血的情况下,清除失活的肝组织及凝血块,敞开伤口,在直视下将较大血管、胆管一一结扎止血,然后再将伤口对口缝合。为了消灭死腔和压迫小血管的出血,伤口内可用带蒂的大网膜松松填塞固定(图19-3)。我们更多推荐的是边缘缝合可用褥式或间断方式缝合,伤口敞开,不必对合,腔内放置橡皮管引流,可防止死腔的形成和减少感染发生。如直接止血困难,尤其在较大的星芒状裂伤病例,可试行阻断肝动脉,如能控制出血,则可结扎相应的肝固有动脉或其分支(左、右肝动脉),达到止血目的,再以带蒂大网膜松松填塞或将肝伤口分边缝合。
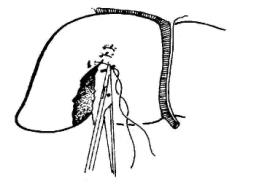
图19-2 表浅肝裂伤的缝合

图19-3 肝裂伤大网膜填塞缝合
关于肝动脉结扎术,Aaron结扎肝动脉治疗肝外伤60例取得较好效果,随后Flint在540例肝外伤治疗中,采用肝动脉结扎术94例(17%),失败15例,死亡率达47%。肝动脉结扎对低血压的病例,可引起肝灌注减少,导致肝缺血,产生肝坏死或脓毒症。因此不少人并不支持肝动脉结扎术,近年来热衷此手术者已减少。但是对中心型肝破裂和深部穿通性伤,一般止血方法效果不好时,仍可考虑选用选择性肝动脉结扎术。
暂时阻断肝门(Pringle法)即阻断肝门三联来控制肝实质的大出血,在肝损伤手术处理中有很大的实用价值。阻断肝门可以作为一种寻找出血来源的方法,又可作为在控制肝实质出血下进行无血手术操作的有效措施,目前也广泛用于一般性肝切除手术。阻断肝门最简单的方法是以示指、拇指压迫,也可用导尿管、止血带或腔静脉钳。常温下,阻断肝门时间15~30min是安全的。究竟能阻断多长时间是公认安全的,目前还不清楚。有的认为其安全期可达1h以上。Feliciano治疗肝外伤30例,平均阻断肝门三联30min,其中超过1h的3例,术后肝功能提示异常,但均于几天内恢复正常,未发生肝衰竭。但值得一提的是,有不同程度肝硬化病变者,则需据情而定。
(4)隧道状贯通伤:这种损伤的处理,构成外科的特殊问题,入口或出口常位于肝脏的后面、上面或裸区。首先要显露出口、入口。小口径的枪弹损害较小,手术时出血多已停止或有少量血液、胆汁渗出。除出口处明显的失活肝组织应切除止血外,弹道内勿需清创,用吸引器吸去陈旧血块及胆汁后,如无大出血或溢胆汁即证明未伤及大血管及胆道,只需在弹道两端(出、入口)各放入引流管,充分引流,在肝周再加引流即可。如出血不止,且血管较多,应打开死腔或隧道进行直视下止血或结扎相应的血管,或行肝叶切除术。总之,隧道状贯通伤以引流为原则,不得填塞或表浅缝合,以免遗留死腔,增加术后并发症的机会。
(5)肝断裂伤或粉碎性肝挫裂伤:这种肝损伤在临床上并不少见,肝损伤后常因巨大裂口,所剩肝连接部并不多,易于作肝切除,但必须明确切除的目的是为了止血或去除失活的肝组织,切面不需经过正常的肝组织。因而常采取非典型肝叶切除术,严格地说应该称为清创切除术,即切除失活组织,止血,通畅引流。
此类肝损伤伤员,常在外伤、失血、休克的沉重打击下,机体状态差,难以承受较大手术负担,因此手术尽量避免再次大的创伤,采取克制性手术,只要能达到清创切除术的目的即可。事实上,有些肝叶切除术完全可以肝动脉结扎来代替,然后进行清创处理,包括肝桥切断去除,充分引流肝周区。
(6)肝包膜下血肿:肝包膜下小的血肿虽然可以吸收,但也有扩大或破裂出血的危险,而且如不切开,难以估计肝实质的损伤程度和范围,所以,肝包膜下血肿不论大小,均应切开。表浅者用温盐水纱布垫压迫后,渗血可止,难以压迫止血的创面,可用电凝止血,表浅出血一般效果较好;深部裂伤,可按肝深裂伤处理,首先清除失活组织,在直视下结扎止血,缝合创面或创面直接引流。
(7)中心型破裂:剖腹后可见肝脏局部凸起或一叶、一段肿大变形,常合并有包膜下血肿或无,借穿刺造影或术中B超证实诊断。如有死腔存在或肿大变形仍在发展、消化道出血等,应切开探查,在直视下止血,缝合血管和胆管后,以带蒂大网膜充填或敞开后置橡皮管引流。如止血困难,可行肝动脉结扎,仍不能止血时,有必要作肝切除术。
(8)肝门损伤:肝门的肝动脉、门静脉撕裂伤常发生威胁生命的大出血,切开腹膜后即有大量血液及凝血块涌出,往往在尚未弄清情况前,伤员情况已迅速恶化。在此情况下应停止一切程序性腹内操作,迅速用左手经肝下小网膜孔控制肝十二指肠韧带阻断血流,吸尽腹腔内积血后可用静脉钳、导尿管或止血带阻断,阻断时间不超过20min,间歇2~3min,重复阻断,加速输血,待伤员情况好转后判明损伤部位进行处理。如为肝动脉出血,可直接结扎;如为门静脉出血,尽可能予以修补,血管移植或肠系膜上静脉-门静脉吻合。近年来已有报道急性结扎门静脉成功的病例,成活率约80%。一般情况下我们并不推荐此种方法。肝外胆道损伤,一般性裂伤可置“T”管引流,缝合后经“T”管注水检查其他损伤遗漏的胆管。断裂伤时可作胆肠吻合术,重建胆汁的正常排泄出路。
(9)肝静脉和肝后腔静脉撕裂伤:肝静脉和肝后腔静脉损伤可引起致命的出血,这些大静脉壁薄,且被肝组织包绕,止血和修补均很困难,肝外伤伴下腔静脉损伤的死亡率高达60%~100%。
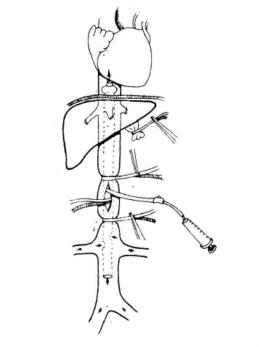
图19-4 下腔静脉置管分流术
这些大血管损伤的诊断并不困难,当阻断肝门时,若大出血仍持续不止,应考虑到腔静脉或肝静脉的创伤。为显露肝静脉和肝后腔静脉,有人在直视下钳夹肝上、下腔静脉,此法对于已处休克状态的病员不利于静脉回流,心脏充盈,可引起心律失常和停搏。也有人采用单纯腔内分流维持心脏静脉回流,但难以控制出血。近年来人们采用肝后腔静脉气囊分流术,即先用纱布填塞压迫出血处,阻断肝门,迅速游离右半结肠、十二指肠及胰头,向内侧牵拉,暴露并游离出肾静脉以上的下腔静脉,在该处置止血带,在两条止血带间纵形切开下腔静脉,将预备好的顶端有30m L气囊的硅化分流塑料导管沿切口向上插入下腔静脉,顶端置于膈上水平,气囊内充气或注入生理盐水30m L以阻断下腔静脉近心端和压迫附近破裂肝静脉,另一端置入下腔静脉内远心端,收紧止血带,至此,即阻断了全部肝血流,身体下半部的静脉血经腔静脉内的分流管回入右心(图19-4)。也可以经大隐——股静脉插气囊导管至肝后腔静脉,导管(24Fr)内径为4.8mm,外径为7.9mm,经动物实验证明,此种方法右心房排出量仅减少30%,气囊导管法是有效的。但此类操作复杂,费时久,出血多,患者难以忍受。有人仍主张采用清创后填塞法,待患者情况稳定后,再改用腔静脉钳钳夹出血处,然后修补损伤血管。
(10)填塞止血法:采用填塞方法用于肝创面止血已有60多年的历史,因纱布填塞止血违反外科清创引流原则,虽可达到暂时止血目的,但因纱布容易与创面肉芽组织交织,取出时易出血,取出后遗留下来的空腔又是积液储脓的死腔。在填塞过程中及凝血变硬后可导致周围组织压迫坏死,造成胆瘘、感染及再出血等,故受到许多学者的反对。但临床上至今仍因有些难以止住的出血用纱布填塞治疗取得较满意的效果。我们提出下列情况适用填塞疗法:①肝切开或选择性肝动脉结扎后有渗血。②肝叶切除后有渗血。③广泛性肝包膜下血肿。④广泛性双叶肝损伤。⑤医生的肝手术技能水平及医院的设备条件差。
(11)肝外胆道减压引流术:严重肝损伤破裂时采用肝外胆管减压术,如胆总管“T”管引流或胆囊造瘘术,作为手术处理中的一项原则,以防止胆瘘、胆汁性腹膜炎和继发性的延迟性出血。其理由是肝组织清创时只能将主要的胆管结扎,损伤本身,术后咳嗽、呕吐或使用止痛剂如吗啡等均能引起奥狄括约肌痉挛,使胆道内压力增高,可使未结扎小胆管胆汁溢出,形成胆汁性腹膜炎、胆瘘等。同时还可以通过“T”管注水(用肠钳阻断胆管远端)检查肝伤面有无遗漏未结扎的胆管,可以防止术后胆瘘或胆道出血等严重并发症。而“T”管也可作为日后了解肝胆内部情况的一个造影检查途径。特别要提及的是,肝外伤对口缝合后,最严重并发症是术后胆道出血。主要是创面较大的胆管未结扎,对口缝合后又形成死腔,血块堵塞的血管因血块液化再次出血流入死腔经过漏扎的胆管进入消化道,形成周期性出血。因此,经“T”管加压注水检查创面胆管是一种有效的方法。
(12)引流问题:肝外伤的引流问题已争论80多年。反对者认为凡引流者其肝周感染发生率高,肝外伤常规放置引流管是不适当的。但是在大量的临床病例中,我们发现除表浅的轻度肝外伤缝合后无明显渗血者不需放置引流外,一般重度肝破裂均需闭式引流。肝损伤放置腹腔引流是肝损伤手术处理死亡率明显降低的重要因素之一,可以减少渗出血液、胆汁在腹腔内聚积所致的感染,可以减少死腔的形成。引流管以橡皮胶管为宜。烟卷引流只能维持24h有效容易堵塞。双腔管负压过大,管壁塌陷,腹腔内组织堵塞内孔,常常效果不佳。引流管在术后3~4天无渗出物时拔出。
3.肝损伤的术后处理 除周围性肝浅表裂伤外,肝深部裂伤、断裂伤、广泛肝挫伤而行广泛的清创切除术、肝动脉结扎术、肝叶切除术或纱布、大网膜填塞术后,都有不同程度的代谢紊乱和肝功能损伤,凝血机制也会出现不同程度的障碍。这些与创伤程度,肝切除范围,失血量多少,休克时间长短和术后并发症有直接关系。
代谢紊乱在术后5~7天内最严重,一般在3周后才基本恢复。因而术后5~7天内应积极进行护肝治疗,防止出血、休克、感染、肠麻痹和肝功能衰竭。每天给予200~250g葡萄糖,即由静脉输入10%葡萄糖液2 000m L和5%葡萄糖盐水500m L,每1 000m L液体中加入维生素C 1g,每日肌注维生素K 10~15mg和维生素B1 100mg。给予广谱抗生素防止感染,持续胃肠减压,减轻腹胀,密切观察引流液中有无血液、胆汁。必要时补充血浆白蛋白、血浆或鲜血,有利于肝功能恢复,注意水、电解质平衡,尤其要防止缺钾症。术后尽量避免给予有损害肝脏的药物。对有出血倾向或渗血严重伤员,除术中创面仔细止血和及时输血外,术后要给大量维生素K和止血药物,必要时可输新鲜血和纤维蛋白原,以增加凝血作用。对有肝昏迷早期症状的伤员,应给予谷氨酸钠、谷氨酸钾或精氨酸并控制蛋白的入量。肝动脉结扎及肝叶切除伤员术后要持续给氧。(于昌松)
第二节 肝脏感染
各种原因所致肝脏感染后,因处理不及时或处理不当而形成脓肿,称为肝脓肿。肝脓肿都是继发的,临床上有细菌性肝脓肿和阿米巴性肝脓肿。
一、细菌性肝脓肿
细菌性肝脓肿常指由化脓性细菌引起的感染,故亦称为化脓性肝脓肿。肝脏由于接受来自肝动脉和门静脉的双重供血,并通过胆道与肠道相通,故发生感染的机会很多。但由于肝脏有丰富的血液供应和网状内皮系统强大的吞噬作用,因而化脓性肝脓肿并不经常发生。
(一)病因
引起化脓性肝脓肿的最常见菌种是大肠杆菌和葡萄球菌,混合感染次之,链球菌、产碱杆菌少见,偶有厌气菌感染。胆管源性者以及经门静脉播散者以大肠杆菌最多见,其次为厌气性链球菌。经肝动脉播散,以葡萄球菌尤其是金黄色葡萄球菌为常见。
化脓性肝脓肿是一种继发性病变。病原菌可由下列途径进入肝脏。
1.胆道系统 这是目前最主要入侵途径,也是化脓性肝脓肿最常见的原因。胆囊炎、胆管炎、胆管结石、胆管狭窄、扩张或肿瘤阻塞、蛔虫、华支睾吸虫等所致的梗阻,化脓性炎症均可引起上行感染,形成肝脓肿。
2.门静脉系统 坏疽性阑尾炎、痔核感染、胰腺脓肿、肠炎、脐部感染及化脓性盆腔炎等可引起门静脉炎、脱落的脓毒性栓子进入肝脏,形成肝脓肿。但由于外科诊疗技术的发展和抗生素的临床应用,这种途径的感染已大大减少。
3.肝动脉 机体内任何部位的化脓性疾病,如急性上呼吸道感染、亚急性细菌性心内膜炎、骨髓炎和痈等,病原菌均可由肝动脉进入肝脏,因机体的抵抗力下降,细菌在肝内繁殖成多发性肝脓肿。
4.腹内脏器感染的直接蔓延 如化脓性胆囊炎、急性胃十二指肠穿孔、膈下脓肿、肾周围脓肿等,病原菌可经淋巴系统侵袭肝脏。
5.外伤后继发感染 尤其是开放性肝损伤时,细菌直接进入肝脏发生脓肿,闭合性损伤,肝内血肿容易导致内源性细菌感染,若有胆管断裂则感染的机会更多。
此外,如肝动脉结扎术,介入性肝动脉栓塞,肝动脉及门静脉插管进行化疗药物灌注,均可促成医源性肝组织的坏死感染。
(二)临床表现
细菌性肝脓肿表现为急性炎症过程,但临床表现常被原发疾病的症状所掩盖。由于肝脏的血运丰富,一旦发生化脓性感染后,大量毒素进入血液循环,引起全身脓毒症反应。主要表现为寒战、高热,体温在38~40℃之间,脉率快,伴有大量出汗,肝区疼痛是因为肝被膜呈急性膨胀和炎症刺激的结果。同时由于脓毒症反应,病人有乏力,食欲不振,恶心和呕吐等症状。
检查时常有肝脏肿大,肝区压痛。并发于胆道梗阻的病人,常见有黄疸。其他原因的化脓性肝脓肿,一旦出现黄疸,表示病情严重,预后不良。
(三)诊断
在急性肠道或胆道感染的病例中,突然发生寒战、高热、肝区疼痛以及肝区压痛和叩击痛,应想到有肝脓肿的可能,需进一步检查。
实验室检查,白细胞明显升高,有左移现象或毒性颗粒出现。谷丙转氨酶、碱性磷酸酶升高。肝功能也可出现异常。
X线检查可见肝脏阴影增大,右侧膈肌升高,活动受限,肋膈角模糊或胸腔有少量积液。
B超检查在临床上有重要的诊断价值,常可明确肝脓肿的大小、部位,单发还是多发,结合临床表现常是诊断肝脓肿的重要依据。当然还有CT、磁共振等,但均不及B超简单、方便、安全和非介入性,并不给病人带来痛苦。细菌性肝脓肿应与阿米巴肝脓肿、肝癌、右膈下脓肿等相鉴别。结合病史、体征、临床表现和各种检查,鉴别一般并不困难。
(四)治疗
细菌性肝脓肿为一继发性疾病,如能早期确诊,早期治疗原发病灶和加强术后处理,这种疾病是可以预防的。早期肝脏感染,能及时给予大量抗生素,加强支持疗法,及时治疗原发病灶,常可防止肝脓肿形成。
1.一般治疗 对于急性期肝脏感染,脓肿尚未形成或多发性小脓肿,宜采取非手术疗法,即积极治疗原发病灶,同时使用大量抗生素和全身支持疗法,控制感染,积极补液,纠正水、电解质紊乱,给予多量维生素,多次小量输血、血浆纠正低蛋白血症,改善肝功能,增强机体抵抗力。
2.手术治疗 脓肿切开引流是治疗脓肿的基本原则,如果脓肿形成,在一般治疗的同时,应积极进行脓肿切开引流术,常用的手术途径有以下几种。
(1)经腹腔切开引流:此种方法最常用,引流充分而有效,同时还可以探查原发的病灶进行处理。对化脓性胆管炎病人,同时可做胆总管引流。
(2)腹膜外脓肿切开引流。位于肝右叶的前侧和左外叶肝脓肿,与前腹膜发生紧密粘连,可采取前侧腹膜外进路引流脓液,可减少对腹腔的污染。
(3)后侧脓肿切开引流:位于肝右叶膈顶部或后侧的脓肿,可采用后侧腹膜外脓肿切开引流。病人取左侧卧位,左侧腰部垫一沙袋。沿右侧第十二肋骨稍偏外侧作一切口(图19-5),切除一段肋骨,在第一腰椎棘突水平的肋骨床区作一横切口,显露膈肌,用手指沿肾后脂肪囊向上分离,显示肾上极与肝下面的腹膜后间隙直达脓肿(图19-6)。用穿刺针沿手指方向刺入脓腔,抽得脓液后,用血管钳顺穿刺方向插入脓腔,排尽脓液,再用手指扩大引流,冲洗后,置入双腔负压引流管,再缝合伤口。
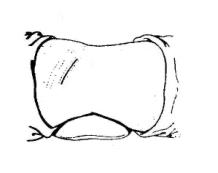
图19-5 后侧脓肿皮肤切口
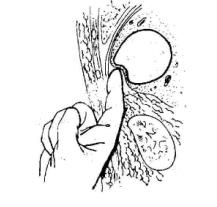
图19-6 示指经肾上极与肝下面的腹膜后间隙直达脓腔
对于慢性壁厚的肝脓肿,引流后脓壁不塌陷,长期留有死腔者;肝内一叶一段胆管结石反复感染,肝组织已严重毁损无功能者,可考虑作肝叶切除术。
二、阿米巴性肝脓肿
阿米巴性肝脓肿是肠阿米巴病最多见的并发症。其主要并发症为不规则长期发热,肝脏肿大,肝区疼痛,全身逐渐消耗和消瘦等。
(一)病因
阿米巴性肝脓肿是由溶组织阿米巴所引起的。有的在阿米巴痢疾期形成,有的发生于痢疾之后数周或数月,也有长达二三十年之久。当人们吞食阿米巴包囊污染的食物或饮水等经胃液消化,在肠内释放原虫并大量繁殖,侵犯结肠黏膜形成溃疡,常见于盲肠、升结肠等处,少数侵犯乙状结肠和直肠。
寄生于结肠黏膜的阿米巴原虫,分泌溶组织酶,消化溶解肠壁上的小静脉后,原虫侵入静脉,随门静脉血流进入肝脏。原虫也可以穿过肠壁直接侵入肝脏,或经淋巴管到达肝内。一小部分存活原虫在肝内繁殖,引起肝组织充血炎症,继而原虫阻塞门静脉末梢,造成肝组织局部缺血坏死,又因原虫产生溶组织酶,破坏静脉壁,溶解肝组织而形成脓肿。
(二)病理变化
阿米巴性肝脓肿多为单发,脓腔多较大。脓肿分三层,外层早期为炎性肝细胞,随后有纤维组织增生形成纤维膜;中间层为间质;内层中央为脓液。脓液内充满溶解和坏死的肝细胞碎片和血细胞,典型的阿米巴肝脓肿呈果酱色,较黏稠,无臭,一般是无菌的。阿米巴滋养体在脓液中很难找到,但在脓肿壁上常能找到阿米巴滋养体。
(三)临床表现
本病的发展过程一般比较缓慢,急性阿米巴肝炎期较短暂,继之为较长时期的慢性期。主要为发热,肝区疼痛及肝肿大。体温多持续在38~39℃,常为弛张热或间歇热,在肝脓肿后期,体温可正常或仅低热。如继发细菌感染,体温可达40℃以上,伴有畏寒、多汗、食欲不振、腹胀、恶心、呕吐,甚至腹泻、痢疾等症状。病人伴体重减轻,衰弱乏力,消瘦,贫血等亦常见。约10%~15%出现轻度黄疸。
肝区有明显叩击痛,较大的右肝脓肿可出现右下胸部膨隆,肋间饱满,局部皮肤水肿与压痛,肋间隙增宽,肝右下脓肿时可见右上腹膨隆,有压痛,右上腹肌紧张或扪及包块。少数病人可出现胸水。
(四)诊断
对有长期不规则发热,出汗,食欲不振,体质虚弱,贫血,肝区疼痛,肝脏肿大有压痛或叩击痛,特别是伴有痢疾病史时,应疑为阿米巴性肝脓肿。当然缺乏痢疾病史,也不能排除本病的可能性。下列几点对确诊具有重要意义。
(1)新鲜大便反复检查,寻找阿米巴包囊或滋养体。
(2)乙状结肠镜检查,发现结肠黏膜有特征性凸凹不平的坏死性溃疡,或愈合后的瘢痕,自溃疡面取材,可能找到阿米巴滋养体。
(3)B超检查,在肝脏发现不均质的液性暗区,与周围肝组织分界清楚。
(4)超声定位肝穿吸得典型的果酱色无臭脓液,有重要诊断价值。
(5)血液检查,白细胞增高,肝功能可正常,偶见谷丙转氨酶、碱性磷酸酶轻度升高,少数病人胆红素可增高。
(6)血清学检查,间接血凝法较灵敏,阳性率可达90%以上,故对阿米巴性肝脓肿的诊断有一定价值。
(7)诊断性治疗,经上述检查,高度怀疑本病者,可试用抗阿米巴药物治疗,如治疗后临床症状,体征迅速改善,则可确诊。
阿米巴肝脓肿与细菌性肝脓肿的鉴别要点,参见表19-1。
表19-1 阿米巴肝脓肿与细菌性肝脓肿的鉴别要点

(五)治疗
阿米巴性肝脓肿病程长,消耗大,病人全身情况差,常有贫血和营养不良,在治疗上应给高碳水化合物、高蛋白、高维生素和低脂肪饮食,纠正贫血,同时给予抗生素治疗。最重要的是用抗阿米巴药物治疗,并结合穿刺抽脓,必要时采用外科治疗。
1.药物治疗 灭滴灵对肠道阿米巴病和肠外阿米巴原虫有较强的杀灭作用。对阿米巴性肝脓肿和肝炎均有效。毒性小、疗效高,成人每次400~800mg,一日3次,连服5~7日为一疗程。儿童每日每千克体重50mg,分3次服,连服7日。疗效可达96%。服药期间应禁忌饮酒,偶有恶心、腹痛、皮炎、头昏及心慌,不需特殊处理。
盐酸吐根碱(依米丁)对阿米巴肝脓肿有良好效果。吐根碱对阿米巴滋养体有较强的杀灭作用。成人每日0.06g,肌肉注射,连续6~10日为一疗程,总剂量不超过0.6g。必要时可重复应用,但需隔30日。本品毒性大,可引起心肌损害,血压下降,心率失常等。此外还有胃肠道反应,肌无力,神经闪痛及吞咽、呼吸肌麻痹。由于该药毒性大,目前多用灭滴灵或氯喹啉。
氯喹啉对阿米巴滋养体有杀灭作用。口服后肝内浓度较高,排泄也慢,毒性小,疗效高。成人每次口服0.5g,一日2次;2日后改为0.25g,一日2次;14~20天为一疗程。偶有胃肠道反应,头昏,皮肤瘙痒。
2.穿刺抽脓 对脓腔较大,积脓较多,或病情较重者,应在抗阿米巴药物治疗下进行穿刺排脓。穿刺次数视脓量而定,一般在脓液转为稀薄,且不易抽得,超声检查脓腔很小,体温降至正常时可停止穿刺(图19-7)。

图19-7 肝脓肿穿刺
3.手术治疗 下列情况可考虑手术切开引流。
(1)经抗阿米巴药物治疗及穿刺排脓后高热不退者;
(2)脓肿伴有继发细菌感染,经综合治疗不能控制感染者;
(3)脓肿穿破入胸腔或腹腔并发脓胸或腹膜炎者;
(4)左外叶肝脓肿,抗阿米巴药物治疗不见效,穿刺易损伤腹腔脏器或污染腹腔者。
三、肝结核
肝结核是一种继发性疾病,常继发于体内其他脏器的结核。肝结核因缺乏较典型的临床症状和特异性的检查技术,常常在手术中或尸检时发现和证实。术前常诊断为肝占位性病变,影像诊断难以与其他肝实质性占位性病变相鉴别。常误诊为肝癌。
粟粒性肺结核病人,肝结核的并发率为50%~80%。有人统计还高于此数字。有人说近年来由于抗结核药物的发展,结核病已有了很大的控制,肝结核在临床上少见。然而同济医科大学附属同济医院2026年一年中因肝占位病变剖腹探查中,经病理切片证实有6例为肝结核,看来并不少见。
(一)病因
本病主要继发于肺、肠道或其他部位结核经肝动脉、门静脉等播散到肝脏。有时原发病灶深在、较小或已痊愈,往往不易发现。此外,还可通过淋巴系统或从肝邻近器官结核病灶侵入肝脏。
(二)病理
肝结核按发病部位可分两类:
1.肝浆膜结核 又称结核性浆膜炎,即肝脏包膜被结核病浸润,呈广泛肥厚性改变,形成所谓“糖皮肝”;或在肝包膜上发生粟粒性病灶,有人也把这归属于结核性腹膜炎的一部分。
2.肝实质结核
(1)肝脏粟粒性结核:此型最多见,为全身血行播散性粟粒性结核的一部分,病变为小而孤立呈灰色结节散布于全肝。其病理特点是含有明显的多核巨细胞,外周有淋巴细胞浸润。
(2)肝结核瘤:当粟粒性结核融合成单个或多个结节时,称肝结核瘤,临床上少见。肝结核瘤中心为干酪样坏死,色黄,类脂质增多,状如奶酪。镜下组织细胞先呈混浊肿胀,继而细胞浆发生脂肪变性,细胞核溶解碎裂,直到组织完全坏死。病灶周围逐渐出现肉芽组织,形成纤维包围。在一定条件下可发生软化或液化,形成结核性肝脓肿。
(3)肝内胆管结核:是肝结核病中最少见的一种,主要患者是儿童,其来源可能是结核性肝脓肿破入胆道所致。病变为局限性,也可沿胆管播散。
(三)临床表现
肝结核临床表现仍为一般结核感染的常见表现,如畏寒,发热,夜间盗汗,乏力,纳差等,肝脏肿大同时伴肝区疼痛,在肿大的肝上可触及结节性肿块,有压痛,少数病人可出现黄疸。此外,还有原发灶的结核病症状和体征。
(四)诊断
肝结核常无特殊症状和体征,临床上诊断比较困难。因此本病只有通过详细了解病史,反复分析症状和体征,结合寻找身体其他部位的结核病灶,再结合实验室检查和一些特殊检查的资料,加以综合分析,才能作出判断。最终诊断常依赖于病理切片检查的结果。
(五)治疗
肝结核的治疗一般以内科治疗为主,供给高蛋白、高碳水化合物、高维生素、低脂肪饮食,在提高机体抵抗力的支持疗法的基础上给予抗结核药物。常用的抗结核药物有链霉素、异烟肼(雷米封)、乙胺丁醇、利福平等。
结核瘤引起的肝占位性病变,如病变局限于肝的一叶或一段,而无全身其他器官活动性结核病(如肺结核),肝功能良好,可考虑剖腹探查,作肝叶或段切除术,同时进行抗结核治疗,防止结核菌扩散和恢复。(易继林)
第三节 肝脏良性肿瘤
肝脏良性肿瘤一般认为是临床上少见或罕见病种。但由影像检查的发展普及,如血管瘤、肝囊肿等肝脏良性肿瘤并不少见。
根据肝组织的胚胎来源不同,肝脏良性肿瘤可分为三大类(表19-2)。
一、肝血管瘤
肝脏血管瘤是一种较为常见的肝脏良性肿瘤。较其他内脏血管瘤多见,疾病可以发生在任何年龄,但临床上绝大多数发生在成人。血管瘤可以单发或多发,无蒂或有蒂,多见于肝表面。小的血管瘤如针尖大,较大的如红枣、核桃大,大的可似胎儿头大,严重者可占据整个肝脏甚至向腹腔膨出。小者不产生任何临床症状。肝血管瘤的组织发生,多认为起源于肝内的胚胎性血管错构芽,由于某种因素作用,引起肿瘤样增生而形成。
有些统计数字表明该病发病率男性稍多于女性,但大多数报道则说女性是男性发病率的6倍。这可能是由于女性患者肝血管瘤较大,故常表现出临床症状而就诊获得诊断。
表19-2 肝良性肿瘤胚胎组织学分类

(一)病理学
肝血管瘤一般单发,仅10%的病例为多发。绝大多数病例肿瘤直径小于4cm,但也常见较大的肿瘤。病变可以发生在肝脏的任何部位,有时会长在包膜表面。从表面看来病变为红色或紫色斑块,而肿瘤切面呈海绵状,组织相对较少,并有大量暗红色静脉血。血管瘤有时出现退行性变。时间较长的血管瘤中可见新鲜的或陈旧的血栓或瘢痕组织,偶尔还可见钙化灶。这种退行性变发展到最后,血管瘤形似纤维瘢痕,亦即“硬化性血管瘤”,有些甚至完全钙化。
显微镜下观察,海绵状血管瘤由衬以扁平内皮细胞的大小不等之血管腔构成。病灶常为孤立肿块,同周围肝组织分界清楚可分。当然偶尔出现的肿瘤中有胆管或局灶性肝实质陷入。
(二)临床表现
肝血管瘤发展缓慢,病程可达数年至数10年之久。直径小于4cm的血管瘤很少在临床上表现出症状。直径4cm或更大的血管瘤患者中约40%主诉有症状。多数人因作B超检查或其他疾病作腹部手术时偶然发现。当肿瘤逐渐增大后,主要表现为肝脏肿大或压迫胃、肠道邻近器官,引起上腹部不适、腹胀、腹痛、食欲减退、恶心、嗳气等症状。较大的肝血管瘤,随着血管瘤的增长可表现:腹围增大、腹块和肝肿大。如肿瘤破裂则出现失血性休克或急腹症症状。也有在肝内形成动静脉瘘。
肝血管瘤最危险的并发症是血管瘤破裂。婴幼儿自发性破裂较多见,因此,对新生儿肝血管瘤确诊后,应尽早治疗。
有些病人,尤其是较大的肝血管瘤,可以出现消耗性的凝血病,血小板减少症,低纤维蛋白原血症之类的并发症,引起出血及溶血而死亡。也有因回心血量增多,心脏负担加重,导致心力衰竭而死亡。
(三)诊断
以往对较小的肝血管瘤的诊断比较困难,如直径4cm的既没有临床症状,也难以到医院检查,目前由于影像诊断技术的发展,普查及体检病人数量增多,使其发现率较以往大大提高,特别对较大的肝血管瘤,通过临床表现、B型超声、肝动脉造影、CT或放射性核素肝血池扫描或MRI等,同时结合AFP的检查结果分析,一般不难作出正确诊断。本病临床表现的特点是:肿瘤生长缓慢,病程长,对全身影响小,早期无任何症状,随着肝血管瘤长大,可出现腹块、上腹胀痛、嗳气、肝区轻度隐痛等症状。腹块的特点是:表面光滑,质地中等硬或柔软,有弹性可压缩,无明显压痛,肿块与肝脏相连,可随呼吸上下移动。肝功能多正常。部分病人可出现贫血、血细胞和血小板减少,特别是巨大肝血管瘤临床上常会出现凝血功能障碍的症状和表现。
临床上本病在诊断过程中应与肝癌相鉴别。因为肝癌是我国常见恶性肿瘤之一,临床上不少将肝血管瘤误认为肝癌者不在少数,尤其是小血管瘤、小肝癌更易混淆。其实,应用现有的诊断手段,一个细致、有经验的医生是容易鉴别的。
(四)治疗
肝血管瘤的治疗取决于肝血管瘤的大小、多少、部位、病理变化及生长速度,对于小于3cm以下的、生长慢的、无临床症状者,可追踪观察;对于大于4cm以上,同时伴有临床症状、生长速度快的,可根据病人情况选择方法进行治疗。
单发性肝血管瘤,或病变局限于一侧,作一叶或半肝切除;病变范围已超过半肝,余肝明显代偿增大,无肝硬化,肝功能正常,全身情况良好者,可作肝三叶切除。
对多发性肝血管瘤或病变范围极大,或已侵犯大部肝组织,无法手术切除者,可作肝动脉结扎,根据病变范围可作肝左或肝右或肝固有动脉结扎,经结扎后肿瘤可变软缩小,特别对囊状血管瘤疗效更满意。对于小的多发性肝血管瘤,术中可采用贯穿缝扎法,比切除简单,效果良好。如做胆囊摘除或其他上腹部手术,条件允许时,可采用此法同时治疗肝小血管瘤。
目前临床上同时常采用经股动脉插管至肝血管超选择性动脉栓塞治疗肝血管瘤。对于难以切除侵犯广泛或侵犯肝门部肿瘤,取得较满意的效果,也可以在肝动脉结扎或肝动脉栓塞术后,待肿瘤缩小,再进行二期手术治疗。
二、肝囊肿
肝囊肿是一种比较常见的肝脏良性疾病。它可分为寄生虫性和非寄生虫性肝囊肿。前者以肝包虫病为多见;后者又可分为先天性、创伤性、炎症性和肿瘤性肝囊肿,其中以先天性肝囊肿最常见,通常指的肝囊肿就是先天性肝囊肿。由于近年来影像诊断技术的发展和普及,肝囊肿在临床上并不少见。
也有人将先天性肝囊肿称为真性囊肿;创伤性、炎症性和肿瘤性肝囊肿称为假性囊肿。由于肿瘤性囊肿在临床上罕见,所以在这里主要讨论先天性肝囊肿。
(一)病因
先天性肝囊肿的病因尚不清楚。一般认为起源于肝内迷走的胆管,或因肝内胆管和淋巴管在胚胎期的发育障碍所致。也有人认为可能为胎儿患胆管炎、肝内小胆管闭塞,近端小胆管逐渐呈囊性扩大;或因肝内胆管变性后,局部增生阻塞而成。
(二)病理学
肝囊肿一般是多发性的,单发性少见。小的直径数毫米,大的可占据整个肝叶,有的囊液可达10 000m L以上。囊肿呈圆形或卵圆形,多数为单房性,也有呈多房性,有时还有蒂。囊肿有完整的包膜,表面呈乳白色,也有呈灰蓝色,囊壁厚薄不一,厚者可达0.5~5cm,内层为柱状上皮细胞,外层为纤维组织,被覆有较大胆管血管束。囊液清亮透明,或染有胆汁,如囊内出血时,可呈咖啡色。囊液呈中性或碱性,含有少量蛋白、黏液蛋白、胆固醇、红细胞、胆红素、酪氨酸和胆汁等。多发性肝囊肿很少引起门静脉高压和食管静脉曲张,但可合并胆管狭窄、胆管炎和肝炎。
(三)临床表现
先天性肝囊肿生长缓慢,小的囊肿可无任何症状,临床上多数是在意外体检B超发现,当囊肿增大到一定程度时,可因压迫邻近脏器而出现症状,常见有食后饱胀、恶心、呕吐、右上腹不适和隐痛等。少数可因囊肿破裂或囊内出血而出现急腹症。若带蒂囊肿扭转时,可出现突然右上腹绞痛。如囊内发生感染,则病人往往有畏寒、发热,白细胞增高等。体检时右上腹可触及到肿块和肝肿大,肿块随呼吸上下移动,表现光滑,有囊性感,无明显压痛。
(四)诊断
肝囊肿的诊断并不困难,除上述临床表现外,B超是首选的检查方法,对诊断肝囊肿,是经济可靠而非介入性的简单方法。放射性核素肝扫描能显示肝区占位性病变,边界光整,对囊肿定位诊断有价值。CT检查可发现1~2cm的肝囊肿,可帮助临床医师准确病变定位,尤其多发性囊肿的分布状态定位,有利于治疗。在发现多发性肝囊肿的同时,还要注意肾、肺以及其他脏器有无囊肿或先天性畸形,如多囊肾,则对确诊多囊肝很有帮助。
在诊断巨大孤立性肝囊肿过程中,应注意与卵巢囊肿、肠系膜囊肿、肝包虫囊肿、胆囊积水、胰腺囊肿和肾囊肿相鉴别。只要考虑到了,一般容易鉴别。同时还要注意与肝海绵状血管瘤、肝癌等相鉴别。临床上误诊的并不罕见。
(五)治疗
对于小的肝囊肿而又无任何症状者,可不需特殊治疗,但对大的而又出现压迫症状者,应给予适当治疗。肝囊肿的治疗方法包括囊肿穿刺抽液术、囊肿开窗术、囊肿引流术或囊肿切除术等。
1.囊肿穿刺抽液术 在B超定位下进行经皮穿刺,进入肝囊肿内,尽量抽出囊液,此法只适用于表浅肝囊肿。抽液后常易复发。临床上并不常采用,仅对一些巨大肝囊肿又不能耐受手术者采用。反复多次穿刺抽液应严格无菌操作,以免发生感染。
2.囊肿开窗术 即在剖腹术下将囊肿部分切除,吸尽囊液,切缘仔细止血后,囊腔开放。华中科技大学同济医学院附属同济医院近年来应用腹腔镜进行囊肿开窗术取得较好的效果,大大减轻了病人的痛苦。开窗术适用于单纯性囊肿,疗效满意,但也有少数病例开窗小,一定时间后周围组织粘连封堵而复发。对囊腔与较大的胆管相通,囊液有多量胆汁者必须缝合胆管。对并发感染或囊内出血或染有胆汁时,术后需放置通畅引流,待囊腔缩小或塌陷萎瘪后,可拔出引流管。
3.囊肿内引流术 对囊壁坚厚的囊肿可考虑作内引流术,如囊肿空肠Y型吻合术,吻合口必须够大,Y臂不少于60cm,以免发生逆行感染。目前选择此法治疗逐渐减少,因开窗或摘除方法不仅效果好,手术也不困难。
4.囊肿摘除术 带蒂的囊肿可行囊肿切除术。即使非带蒂的巨大肝囊肿,也并非一定要做肝叶切除。当吸尽排空囊内液体后,囊肿立即缩小,手术操作空间大,且囊肿壁与肝组织间有明确界线易于剥除,并不多见大的胆管和血管穿入囊内。囊肿摘除手术一般并不困难,预后良好。多发性肝囊肿仅限于处理引起症状的大囊肿,可按单纯囊肿处理。
三、肝细胞腺瘤
肝细胞腺瘤为肝细胞良性增生,通常发生于正常肝脏内。在2026年引入口服避孕药之前该病极为罕见。化学类固醇激素避孕药问世以后,肝细胞腺瘤的报道越来越多,几乎无一例外的为口服避孕药的女性。有人研究认为,避孕药可促使肝细胞灶性坏死,结节增生,最后发展为肝脏腺瘤。过去许多被称为“良性肝细胞瘤”或“微小变异性肝细胞瘤”的,实质上是指“肝细胞腺瘤”。
(一)病理学
肝细胞腺瘤一般为单发结节,偶尔可为多发病灶。大部分“多发性腺瘤”或“腺瘤病”实质上是结节性再生性增生。肝细胞腺瘤病灶呈球形,大部分直径5~15cm,但大的可达30cm之巨。许多腺瘤鼓出肝脏表面,并常有大血管行走。少数肿瘤有蒂。肿瘤切面与周围的肝脏边界清楚,通常无包膜。颜色为从黄色到鞣草绿色或棕色。肿瘤中常有坏死和出血。
镜下肝细胞腺瘤由良性肝细胞组成,排列成片状和条索状,无肝腺泡结构。肿瘤细胞与正常肝细胞大小相同或略大。胞核规则一致,核浆比例正常,几乎看不到分裂相。肝窦常常受压,内壁覆盖扁平细胞。
超微结构显示,肝细胞腺瘤的肿瘤细胞与正常肝细胞相似,但细胞结构简单,细胞器和毛细胆管较少而胞浆中糖原及脂肪较多。同样,肝窦内皮细胞数目也较少,结构也较简单。
(二)临床表现
肝细胞腺瘤发展慢,病程长,早期可无任何症状,既往多数病人在上腹部其他手术时偶然发现。近年来由于影像诊断学的普及,发现较过去多,尤其是广泛使用类固醇避孕药后,但是临床上常难与肝癌相鉴别。
当肿瘤逐渐增大,压迫邻近器官时,可有明显症状,如上腹胀满不适、恶心、食欲减退,或微隐痛等。肿瘤表面光滑、质硬,多无压痛。如发生瘤内出血,则可出现右上腹疼痛、贫血、黄疸或畏寒、发热、上腹痛、白细胞计数增高等。如腺瘤破裂出血,则会出现急腹症,严重者可发生休克。
(三)诊断
术前诊断十分困难,在影像检查中常表现为肝占位性病变。但本病发展慢,病程长,自觉症状轻,病人全身情况好,AFP反复检查阴性。再结合CT、磁共振、血管造影等检查,可以作出初步的诊断。但有些病例常常需要病理切片,甚至多次反复切片才能确诊。
(四)治疗
凡经检查发现肝内有占位性病变,实质性或囊性感,拟诊为肝良性肿瘤者,不论其有无临床症状,均应争取及早手术治疗。因肝细胞腺瘤虽属良性肿瘤,但有破裂出血的危险。在个别病例还有癌变可能,有的术前还难以与肝癌相鉴别,因此一旦拟诊为肝细胞腺瘤,务必尽早剖腹探查,争取手术切除。对于近第一、二肝门者,不能将肿瘤完整切除时,也可作包膜内肿瘤切除,近期效果满意,但术后易复发。也可以对无法切除的腺瘤作肝动脉结扎术或加肝动脉栓塞术,对制止肿瘤生长,或防止肿瘤破裂出血,有一定的作用。
对于一些与口服避孕药有密切关系的病例,要停止服用避孕药,常可使肿瘤缩小。
四、肝错构瘤
肝错构瘤是一种极为罕见的肝脏先天性肿瘤样畸形,其病理特点是以肝细胞为主要成分,含有胆管、血管及结缔组织等排列混乱的正常肝组织。
(一)病理
肿瘤常发生于肝包膜下,橡皮一样坚硬,多为单发性,亦偶见多发性。肿瘤有时有蒂,其根部位于肝实质深处。肿瘤的切面呈棕灰色,可见大量的结缔组织,中心呈放射状排列。肿瘤与正常肝组织间的界线较清晰,肝细胞排列不规则,胞核呈团块状融合在一起,胆管上皮和血管多数都已纤维化。
(二)临床表现
本病多见于儿童,早期无任何症状,当肿瘤发展至相当大时,可发现患儿腹部逐渐增大,上腹部可扪及坚硬的包块,无压痛。同时可因肿瘤压迫周围邻近脏器而出现恶心、呕吐、腹胀等症状。
(三)治疗
手术切除是最好的治疗方法。肿瘤虽有假包膜,但与肝组织粘连较紧,故可将肿瘤连同部分肝组织或肝叶一并切除,预后良好。即使不能完全切除,留下部分瘤组织,亦很少有恶变现象。
五、肝畸胎瘤
肝畸胎瘤是一种极为少见的肝良性肿瘤。它由迷走而残留于肝内的原始胚胎细胞所发生,包括二、三种胚层,如皮肤、脑及外来多种组织,表现为腹块。
切面可见囊肿、骨、软骨及毛发等。显微镜下可见到各种胚层的结构,囊壁为含有毛发的胚层,腺体可含有黏液的内胚层,软骨的边缘有呼吸道上皮铺满。此外还有肌肉、骨、脑及神经细胞等成分。畸胎瘤虽然为一种良性肿瘤,但有恶变的可能。
本病多发于婴幼儿,发展缓慢,全身情况良好。主要症状是上腹部包块及肿块压迫邻近脏器所产生的恶心、呕吐、便秘及紫绀等。肿块高低不平,软硬不一,X光检查肿块上常有钙化斑点。
本病治疗的主要方法是手术切除。有不少术后长期存活的报道。
六、结节性再生性增生
结节性再生性增生曾被许多人冠以多种名词,如肝脏结节性钙化、部分结节性钙化、粟粒性肝细胞腺瘤、肝腺瘤病、结节性非硬化性肝等。冠以这些名词的肝脏从形态学上看是非常相似的,它们都有保存下来的肝脏网状支架结构,分散作许多肝细胞结节,结节间为萎缩的肝组织。
该病可以发生于任何年龄的病人,且常与许多肝外的慢性疾病有关,尤其是骨髓增生性疾病、淋巴细胞增生性疾病和胶原-血管性疾病。
在西方国家,结节性再生性增生的可能是引起非肝硬化性门静脉高压症的主要原因。和肝细胞腺瘤相似,一些结节性再生性增生的病人其肝脏结节可增大直至破裂,导致腹腔内出血。
结节性再生性增生病理特点是肝脏呈弥散性结节性改变,一般治疗疗效有限。
七、局灶性结节性增生
局灶性结节性增生,曾经也被称为局灶性硬化、肝错构瘤、良性肝细胞瘤、肝脏混合腺瘤、错构性胆管细胞肝细胞瘤以及肝腺瘤。因易同肝细胞腺瘤混淆而引人注目。通常认为该病是瘤样畸形而非肿瘤。
该病发生于男女两性各个年龄组中,女性多于男性。少数病人有症状,通常自觉上腹部有包块、腹痛。少数病例有门静脉高压症,可出现病灶破裂和腹腔内出血。
局灶性结节性增生常为孤立性结节,外观非常典型。病灶边界清晰但无包膜,肝表面出现脐状凹陷,黄褐色或浅棕色。镜下经病灶中心的切面几乎总能显示中央的“星形”瘢痕组织。大小不等的纤维间隔从中央瘢痕组织放射,纤维间有轻、中度炎症细胞浸润,以淋巴细胞为主。
本病为良性非进展性病变,“恶变”的病例可能常常是误诊,大多数是将肉眼看上去类似该病的纤维板层肝癌误诊为本病。
少数有症状的局灶性结节性增生病人,可采取单纯切除病灶的方法治疗。在临床上影像检查常难以与肝恶性病变相鉴别,故常以肝实质性占位病变剖腹探查。
八、胆管囊腺瘤
该病较为罕见,其临床和组织学检查均类似于胰腺粘液性囊腺瘤。
该病主要见于中年女性,80%的病人超过30岁,其发病年龄高峰在50岁年龄组。
临床上根据肿瘤的大小和实际部位的不同,症状有所不同,以疼痛和腹围增大最为常见。偶尔病人因胆道梗阻而出现黄疸和上行感染。有报道说肿瘤破裂或压迫邻近脏器引起一些临床表现和并发症,包括下腔静脉血栓形成等。
胆管囊腺瘤为多房性,可发生在肝内外胆管的任何部位,但几乎所有的病变都部分地或全部位于肝内。病灶呈球形,直径从2.5~25cm不等。房腔内囊液从清到浊,或为黏液状,或为冰胶状,白色或黄色。镜下胆管囊腺瘤内壁衬以一层分泌黏蛋白的柱状上皮细胞,呈典型的胆管上皮细胞形态;上皮下层为被称为“间质”的组织。
胆管囊腺瘤的起源和组织发生并不清楚。曾有人认为肿瘤来源于异位卵巢组织和胚胎前肠残余。胆管囊腺瘤被认为是癌前期病变。然而,即使与肝脏和胆管其他腺癌患者相比,这些发生于囊腺瘤基础上的囊腺癌,手术切除可能治愈,预后要好。
(于昌松)
第四节 肝脏恶性肿瘤
肝脏恶性肿瘤可分为原发性和转移性两大类。原发性肝脏恶性肿瘤有来自上皮和间叶组织的,源于上皮组织称肝癌,包括肝细胞癌、胆管细胞癌、混合性癌、肝母细胞癌等;源于间叶组织者称肉瘤,如血管内皮瘤、黏液肉瘤、横纹肌肉瘤、未分化肉瘤、间叶瘤等。转移性恶性肿瘤系指全身各器官的原发癌或肉瘤转移到肝脏所致。常见为胃、结肠、胆、胰等,它们可以通过血液、淋巴途径或直接侵犯到肝脏。肝脏恶性肿瘤以原发性肝癌为多见。
一、原发性肝癌
原发性肝癌是一种常见的恶性肿瘤,为癌症致死的重要原因之一,全球每年发病人数达120万人。在世界范围内居男性常见恶性肿瘤第7位,居女性的第9位,在我国列为男性恶性肿瘤的第3位,仅次于胃癌、食管癌,女性则居第4位。原发性肝癌是非洲撒哈拉一带和东南亚地区最常见的恶性肿瘤之一。近年来,B型和C型传染性肝炎在全球的流行导致了亚洲和西方国家肝癌发病率正快速升高。我国原发性肝癌的分布特点是:东南沿海高于西北和内陆;东南沿海大河口及近陆岛屿和广西扶绥地区,形成一个狭长明显的肝癌高发带。通常,男性较女性更易罹患原发性肝癌,我国普查资料表明,男女之比约为3∶1。原发性肝癌可发生在任何年龄,但以中壮年为多见。据我国3 254例的统计分析,平均患病年龄为43.7岁,而非洲班图族人的平均年龄为37.6岁,印度为47.8岁,新加坡为50岁,日本为56.6岁,美国为57岁,加拿大为64.5岁;而在原发性肝癌高发地区主要发生在较年轻的人中,如莫桑比克25~34岁年龄组的男性肝癌发病率约为英、美同龄组白人的500倍。但在65岁以上年龄组中,前者发病率仅为后者的15倍。我国原发性肝癌的比例远较欧美为高,据卫生部统计,我国每年约13万人死于肝癌,占全球肝癌死亡总数的40%。因此,研究原发性肝癌的病因、诊断和治疗是我国肿瘤工作的一项重要任务。
(一)病因
原发性肝癌的病因迄今尚不完全清楚,根据临床观察和实验研究,可能与下列因素有关。
1.乙型肝炎病毒(HBV) 一般说来,相关性研究已证实肝细胞癌的发病率在HBs Ag携带者的流行率呈正相关关系。由于东南亚和非洲撒哈拉地区HBsAg流行率很高(超过10%),所以这些地区的肝细胞癌发生率也是最高的。但在大部分欧美国家的人群中,肝细胞癌发病率低,其HBs Ag携带者的流行率亦低。用克隆纯化的HBV-DNA杂交试验证明,由肝细胞癌建立的肝细胞系,肝细胞癌患者的恶性肝细胞以及长期无症状的HBsAg携带者肝细胞的染色体组中都整合进了HBV-DNA。在非肝细胞癌患者中这种整合现象的存在表明整合不足以发生肝细胞癌。总之,在若干(不同的)人群中HBV和肝细胞癌之间的强度、特异性和一致性的关系,HBV感染先于肝细胞癌发生的明确证据,以及来自实验室研究的生物学可信性,都表明HBV感染和肝细胞癌发生之间呈因果关系。
2.黄曲霉素 黄曲霉素是由黄曲霉菌产生的真菌毒素。主要有四类:黄曲霉素B1和B2、G1和G2。在动物实验中证明黄曲霉素有很强的致癌作用。其中黄曲霉素B1的作用最显著,但对人的致癌作用证据尚不足。不过,流行病学调查资料表明,随着饮食中黄曲霉素水平的增加,肝癌发生率也随之增高。
3.肝硬化与肝细胞癌 肝硬化与肝细胞癌的关系密切,据2026年全国肝癌协作组收集的500例病理资料,肝硬化的发生率为84.4%,而肝硬化亦绝大多数属于大结节型的坏死后肝硬化。大结节性肝硬化常见于非洲和东南亚地区,这些地区为肝细胞癌的高发区。而小结节性肝硬化常见于欧洲和美国的肝细胞癌低发区。大结节性肝硬化的产生多半与HBV有关,并趋向于亚临床,患病的第一信号通常与肝细胞癌有关。因此,有人总结肝癌的发病过程为急性肝炎—慢性肝炎—肝硬化—肝细胞癌。这进一步说明了HBV可通过启动致癌过程,或既充当启动因子又通过与肝硬化有关的肝细胞再生作为后期致癌剂,从而引起肝细胞癌。
4.其他 遗传因素是值得进一步探讨的,江苏启东县调查259例肝癌病人家族,发现有2人以上患肝癌有40个家族,占15.4%。非洲班图族肝细胞癌多见,而居于当地的欧洲人则肝癌少见。另外,还有较多致癌很强的化学物质——亚硝胺类化合物可以诱发原发性肝细胞癌。肝癌病人中约有40%有饮酒史,吸烟致癌的系列研究中某些观察结果表明,肝细胞癌有中等程度增高。有人提示血吸虫与肝癌也有联系。众所周知,在口服避孕药的妇女中患肝细胞腺瘤的危险性增加。综上所述,原发性肝癌的演变过程是多种多样的,因此,对其病因尚无法作肯定性结论。
(二)病理
原发性肝癌大体形态可分为三型:结节型、巨块型和弥漫型(图19-8),其中以结节型为多见。结节型肿瘤大小不一,分布可遍及全肝,多数病人伴有较严重的肝硬变。早期癌结节以单个为多见,多发癌结节的形成可能是门静脉转移或癌组织多中心发生的结果,本型手术切除率低,预后也较差。巨块型呈单发的大块状,直径可达10cm以上,也可由许多密集的结节融合而成,局限于一区,肿块呈圆形,一般比较大,有时可占据整个肝叶。巨块型肝癌由于癌肿生长迅速,中心区容易发生坏死、出血,使肿块变软,容易引起破裂、出血等并发症。此型肝癌也可伴有肝硬变,但一般较轻。弥漫型肝癌较少见,有许多癌结节散布全肝,呈灰白色,有时肉眼不易与肝硬变结节区别,此型发展快,预后差。
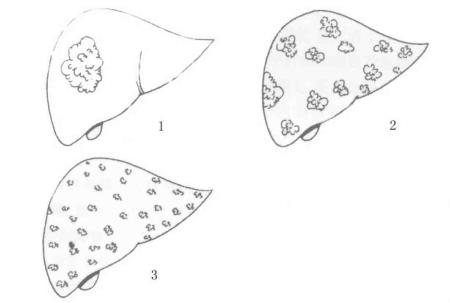
图19-8 原发性肝癌的大体类型
1.结节型 2.巨块型 3.弥漫型
中国肝癌病理协作组根据500例尸检肝癌大体特征的研究,提出了四大型六亚型的分类法。弥漫型:小癌结节弥漫性地散布于全肝,因而此种类型仅在肝癌尸检病例中可以见到。块状型:癌块直径在5~10cm之间,超过10cm为巨块型。根据癌块的数量与形态又分为单块状型、融合块状型和多块状型3个亚型。结节型:癌结节直径在3~5cm之间,又分为单结节型、多结节型和融合结节型3个亚型。小癌型:单个或双个癌结节,直径小于或等于3cm。血清甲胎蛋白阳性者在肿瘤切除后转为正常。从病理组织来看,原发性肝癌也可分为三类:肝细胞型、胆管细胞型和二者同时出现的混合型。肝细胞癌占绝大多数,为85%以上。癌细胞呈圆形或多角形,核大而核仁明显,胞浆丰富呈颗粒状,癌细胞排列成索状或巢状,尤以后者为多见。胆管细胞型肝癌多为单个结节,极少合并肝硬化,血清AFP阴性。肿瘤因含有丰富的纤维间质而呈灰白色,质地实而硬。混合型肝癌:肝细胞癌与胆管细胞癌同时存在,称为混合型肝癌。两种癌细胞成分可以在一个结节中不同区域或混合存在,通常认为源自同一细胞克隆。混合型肝癌多合并有肝硬化,在临床上更多地表现出肝细胞癌的特征。
Anthony根据263例肝细胞癌的细胞形态、排列以及间质多少的不同,将肝细胞癌分为四型:①肝细胞型(77.7%),癌细胞的形态及其排列与正常肝细胞极为相似。②多形细胞型(11.4%),此型癌细胞多种多样,排列不规则,成窦性团块,无小梁和血窦。③腺样型(7.2%),癌细胞呈腺管状结构。④透明细胞型(1.5%),癌细胞似透明细胞,内含有糖原和脂肪。胆管细胞癌较少见,细胞多呈立方形或柱状,排列形成大小不一的腺腔。混合型最少见,癌细胞的形态部分似肝细胞,部分似胆管细胞,有时混杂,界线不清。
原发性肝癌极易侵犯门静脉和肝静脉引起血行转移,肝外血行转移至肝门淋巴结最多,其次为胰周、腹膜后、主动脉旁及锁骨上淋巴结。此外,向横膈及附近脏器直接蔓延和种植性转移也不少见。
(三)临床表现和体征
原发性肝癌的临床表现和体征多种多样,往往在病人首次就诊时多已属晚期。主要原因是除了肝癌生长迅速,在某些病例中肿瘤倍增时间可短至10天内,另外,肝脏体积大意味着肿瘤在被感觉到或侵犯邻近的脏器结构前必定已达到相当大的体积;肝脏大的储备量,使大部分肝脏组织被肿瘤替代前不会出现黄疸和肝功能衰竭。因此,肝细胞癌起病隐匿,并在早期处于静止阶段,难以作出早期诊断;加之缺乏特异性症状与体征,肝脏深藏于肋缘内,触诊时手难于触及,况且肝功能生化检查缺乏特异性变化等综合因素,皆延迟了肝癌的进一步诊断。到发展为大肝癌方始治疗,已无法改变其不良预后。由于肝细胞癌自发地表现出症状时预后已很差,近年来,人们越来越多地把注意力集中到早期诊断上,采用血清AFP检测、B超检查、CT、MRI等有助于早期发现。在高危人群的普查中,可以发现几乎无症状的小肝癌,即所谓的“亚临床期肝细胞癌”,肝癌常见的临床表现是肝区疼痛、肝肿大或腹胀、食欲减退、消瘦、乏力和消化道症状等。
1.肝区疼痛 肝区疼痛是最常见的症状和最常开始的主诉。疼痛多为持续性隐痛、钝痛、胀痛,有时可散发至背部,或牵涉到右肩痛。如疼痛逐渐加重,经休息或治疗仍不见好转,应特别警惕是否患肝癌的可能。疼痛多由癌肿迅速生长使肝包膜紧张所致。如突然发生剧烈的腹痛并伴有腹膜刺激征和休克,多有肝癌破裂的可能。肝硬变患者出现原因不明的上腹部疼痛时,应当怀疑肝细胞癌的可能。
2.腹胀 病人可因腹胀症而自动减食而加速消瘦,体重减轻。当患者腹围增大或全腹胀时,应考虑有中等或大量腹水。在肝硬变患者中出现原因不明的肝肿大或腹水(尤其是血性腹水),应警惕肝细胞癌发生的可能。门静脉或肝静脉癌栓,可出现顽固性腹水或腹胀。
3.食欲减退、恶心、呕吐等消化道症状 典型的肝细胞癌的症状是上腹部疼痛伴不同程度的虚弱、乏力、厌食、消瘦和腹胀,其消化道症状诸如恶心、呕吐、便秘、腹泻和消化不良亦可出现,但这些非特异性表现对诊断帮助甚微。
4.发热 肝区疼痛或不明显原因的发热应怀疑肝癌的可能,因为巨块型肝癌易发生坏死,释放致热原进入血液循环引起发热。
临床上常见的肝癌病人的体征以肝肿大为主要症状占94%以上。如病人在短期内肝脏迅速肿大,肋下可触及肿块,质硬有压痛,表面光滑或有结节感,更易诊断。如肿块位于肝的下部则比较容易扪到,如肿块位于膈顶部,可见右膈肌上抬,叩诊时浊音界也抬高,有时膈肌固定或运动受限,甚至出现胸水。晚期肝癌可出现脾肿大,这是因为原有长期肝硬化病史,脾肿大是由门静脉高压所引起。脾在短期内增大应警惕门静脉癌栓阻塞的可能性。
除上述症状和体征外,有临床肝硬变背景的患者可能出现黄疸,初诊时黄疸可能为轻度,随着病程的发展,黄疸逐渐加深。黄疸多见于弥漫型或胆管细胞癌。癌肿结节压迫胆道或因肝门区淋巴结肿大压迫胆道时,均可出现黄疸。当肝硬变严重而有肝癌的病人还可出现一系列肝硬变的症状,如鼻衄、牙龈出血,以及门静脉高压所致呕血或黑便等。
由于肝癌的早期症状和体征不明显,而且部分病人无症状和体征,所以早期普查已越来越受到重视。
(四)诊断
1.诊断标准 2026年9月在广州召开的第八届全国肝癌学术会议上通过的肝癌诊断标准:
(1)AFP≥400μg/L,持续4周,能排除妊娠、生殖腺胚胎源性肿瘤、活动性肝病及转移性肝癌,并能触及肿大、坚硬及有大结节状肿块的肝脏或影像学检查有肝癌特征的占位性病变者。
(2)AFP<400μg/L能排除妊娠、生殖系胚胎源性肿瘤、活动性肝病及转移性肝癌,并有两种影像学检查有肝癌特征的占位性病变或有两种肝癌标志物(DCP、GGTⅡ、AFU及CA199等)阳性及一种影像学检查有肝癌特征的占位性病变者。
(3)有肝癌的临床表现并有肯定的肝外转移病灶(包括肉眼可见的血性腹水或在其中发现癌细胞)并能排除转移性肝癌者。
肝细胞癌治疗历经令人失望的漫长岁月后,在过去20多年间迎来了诊断和治疗方面的重大进展。自从采用AFP检测以来,肝癌的诊断水平又有了迅速提高,我国临床诊断的正确率已达90%以上。尤其是肿瘤影像技术的显著进步,如血管造影术、CT和超声显像术再加上MRI使肝癌的早期诊断变得更容易。但由于肝癌早期症状不明显,中晚期症状多样化,AFP检测虽然对原发性肝癌诊断有特异性,但在临床上有10%~20%的假阴性,因此,在肝癌的诊断过程中,医务人员必须根据详细的病史、体格检查和各项化验检查以及某些特殊检查结果加以认真分析,从而作出正确的诊断。
肝癌多见于30岁以上的男性,但在肝癌多发地区,发病年龄高峰移向更年轻人群,这与肝炎发生于年轻人群的流行病学特点相吻合。据我国统计3 254例,平均为43.7岁;非洲班图族人的平均发病年龄为37.6岁,在美国则为57岁,故在多发地区肝癌的高发率主要是发生在较年轻的病人。
2.免疫学检查 肝癌诊断上的突破性进展是肿瘤标志物AFP的发现。2026年Abelev利用新生小鼠血清为抗原,制备成抗血清,首先在带有移植性肝细胞癌的小鼠血清中发现此种胚胎性血清蛋白。2026年Tatarinov首先证实原发性肝癌病人血清中存在AFP。此后,血清的AFP检测试验便广泛用于临床上诊断原发性肝癌。
AFP是在胚胎时期在肝实质细胞和卵黄囊中合成的,存在于胎儿血清中,在正常成人血清中一般不存在这种蛋白,即使有也是极微量。但当发生肝细胞癌时,在血清中又出现这种蛋白。肝细胞癌具有合成AFP的能力,对诊断原发性肝癌提供了有力依据。我国率先使用AFP测定进行大规模的肝癌普查,在临床诊断亚临床期肝癌积累了大量资料,阳性率达72.3%,于是给原发性肝癌的早期诊断及早期手术开辟了道路。
肝细胞癌的分化程度与AFP也有一定的关系,高度分化及低度分化的肝细胞癌或大部分肝细胞癌变性坏死时,AFP的检测结果可呈假阴性。有人在分析临床病例的基础上,归纳几点:①AFP在肝细胞癌病人血清中出现占60%~90%,但在胆管细胞癌病人不出现。②在肝转移癌的病人中不出现。③肝脏的良性肿瘤和非肿瘤造成的肝病病人中不出现AFP。④经手术完全切除肝细胞癌后,血清中AFP即消失,随访过程中,AFP又出现阳性时,说明癌肿复发。
目前常用的AFP检测方法是抗原抗体结合的免疫反应方法。临床上常用的琼脂扩散和对流免疫法是属于定性的诊断方法,不很灵敏,但比较可靠,特异性高,肝癌时的阳性率大于80%,若用比较灵敏的放射免疫法测定,可有90%的病人显示有不同程度的血清AFP升高。各种不同方法能测得的血中AFP含量的范围如下:
琼脂扩散法>2 000μg/L
对流免疫法>300μg/L
反向间接血凝法>50μg/L
火箭电泳法>25μg/L
放射免疫法>10μg/L
AFP假阳性主要见于肝炎、肝硬变,占所有“假阳性”的80%。另外,生殖腺胚胎癌因含卵黄囊成分,故可以产生一定量的AFP。除此之外,胃肠道肿瘤,特别是有肝转移者也可能有AFP假阳性出现。
血清AFP虽是诊断HCC的可靠指标,但存在着较高的假阳性或假阴性。随着分子生物学的发展,已经可以采用逆转录聚合酶链式反应(RT-PCR)来检测外周血AFP mRNA,其灵敏度比放射免疫法还高,有助于肝癌早期诊断、肝癌转移或术后复发的监测。
除AFP诊断肝癌以外,较有价值的肝癌标志物探索正方兴未艾。例如:α-L-岩藻糖苷酶(AFU):AFU属溶酶体酸性水解酶类,主要生理功能是参与岩糖基的糖蛋白、糖脂等生物活性大分子的分解代谢。2026年法国学者Deugnier等研究发现,原发性肝癌患者血清AFU升高。AFU超过110n Kat/L(1n Kat=0.06IU)时应考虑为肝细胞癌。在AFP阴性的病例中,大约有70%~85%出现AFU的阳性结果,在小肝癌病例血清AFU的阳性率高于AFP,因此同时测定AFU与AFP,可使HCC的阳性检出率从单侧的70%提高至90%~94%。AFP阴性和AFP升高而不足以诊断HCC患者,其血清AFU的阳性率达80.8%。肝组织活检证实为HCC患者,血清AFU的阳性率(67%)为AFP阳性率(20%)3倍以上。因此,AFU测定对AFP阴性和小细胞肝癌的诊断价值更大。CA199:它是一种分子量为5 000k D的低聚糖类肿瘤相关糖类抗原,其结构为Lea血型抗原物质与唾液酸Lexa的结合物。CA199为消化道癌相关抗原,是胰腺癌和结、直肠癌的标志物。血清CA199阳性的临界值为37k U/L。肿瘤切除后CA199浓度会下降;如再上升,则可表示复发。结直肠癌、胆囊癌、胆管癌、肝癌和胃癌的阳性率也会很高。若同时检测CEA和AFP可进一步提高阳性检出率。癌胚抗原(CEA):正常<2.5μg/L。原发性肝癌可有升高,但转移性肝癌尤多。碱性磷酸酶(AKP):正常<13金氏单位,肝癌中阳性率73.7%,肝外梗阻91.2%。同功酶AKP为肝癌特异,原发性肝癌75%阳性,转移肝癌90%阳性。γ-谷氨酰转肽酶(γ-GTP):正常<40单位,肝癌及梗阻性黄疸皆可升高。5’核苷酸磷酸二酯同功酶V(5’-NPD-V):原发性肝癌70%阳性,转移性肝癌80%阳性。铁蛋白(Ferritn):正常值10~200μg/L,肝癌中升高占76.3%,有报道在AFP<400μg/L的肝癌病例中,70%铁蛋白>400μg/L。从以上介绍不难看出,除AFP外,目前常用的肝癌肿瘤标志物大多缺乏特异性,但有助于AFP阴性肝癌的诊断。
3.超声检查 自超声显像问世以来,使肝占位性病变诊断取得了很大进展。目前,超声显像在检查小病灶如小肝细胞癌方面已成为不可缺少的手段,并正在继续完善以进一步提高分辨力。超声显像根据肿瘤的形状可分为结节型、巨块型和弥漫型三种。①结节型:肿瘤与肝实质分界明显,因此,肿瘤能清晰识别,该型肿瘤可为单发或多发。②巨块型:肿瘤通常较大,直径5cm以上,虽然一般瘤体轮廓可辨,但较模糊。③弥漫型:瘤体不清晰,边界模糊,肝实质内呈弥漫性分布,可看到不均匀、粗糙的异常回声光点。
肝癌的超声回声类型有:①低回声(Low-echo pattern),病灶回声比肝实质为低,常见于无坏死或出血,内质均匀的肿瘤。此型常见于小肝细胞癌、小的转移性肝癌及大的增生结节等。②周围低回声型(low-peripheryechopattern),肿瘤以低回声环与肝实质清晰的分隔,其瘤体内部回声可较周围实质稍高或等同,或者高低混合。③高回声型(high-echo pattern),其内部回声一般比周围实质高,从组织学上可见肿瘤广泛坏死或出血,此型见于有脂肪变性的肝细胞癌。④混合回声型(mixedecho pattern)。瘤体内部为高低回声混合的不均匀区域,可能因在同一肿瘤中出现各种组织学改变所致,此型常见于大肝癌和大的转移性肝癌。超声可显示直径0.3cm的癌结节,直径3~5cm的小肝癌呈圆形或不规则圆形,主要见于结节型肝癌;直径6~7cm的肝癌呈卵圆形团块,多由数个结节融合,边缘可辨认或模糊不清,大于8cm的巨块其形态多不规则;弥漫型肝癌多发生于肝硬化的基础上,肝弥漫性回声增强,呈密集或较密的粗颗粒状中小光点与强回声条索,其间散在多个细小的低回声结节;卫星样结节出现在肝癌大块病灶周围,癌灶部分包膜局部连续中断,有子结节突出;较大的低回声肿瘤边缘呈蚕蚀状,形态不整。小肝癌的超声表现为圆形、椭圆形,直径在3cm以下的结节,分低回声(77.4%)、强回声(16.2%)和等回声(6.4%)。小肝癌的超声图像特征是癌周围有声晕:①低回声(或相对低、弱回声)型,显示后方回声可增强,低回声中仍有少许强光点;大的低回声结节较少见,生长慢,坏死不明显,有门静脉、小胆管中断现象。②强回声型,显示周围有声晕,边缘不规则,内部回声较肝组织增强。③等回声型,显示肿瘤周围有低回声声晕,厚1~2mm或有薄的完整的包膜,侧方有声影,无内收表现;或后方回声稍强,内部回声不均匀。
4.CT影像 电子计算机断层扫描(Computed Tomographye,CT)是借助电子计算机重建不同组织断面的X射线平均衰减密度而形成影像。由于CT是逐层次扫描而且图像密度分辨率高,故与常规的X射线摄影相比有很大优越性和特性。在各种影像检查中,CT最能反映肝脏病理形态表现,如病灶大小、形态、部位、数目及有无病灶内出血坏死等。从病灶边缘情况可了解其浸润性,从门脉血管的癌栓和受侵犯情况可了解其侵犯性,CT被认为是补充超声显像估计病变范围的首选非侵入性诊断方法。肝癌的CT表现,平扫表现:病灶几乎总是表现为低密度块影,部分病灶周围有一层更低密度的环影(晕圈征)。结节型边缘较清楚,巨块型和混合型边缘多模糊或部分清楚。有时也表现为等密度块影,极个别可呈高密度块影,衰减密度值与周围肝脏相似的肿瘤,无论肿瘤大小如何均难以为CT平扫所发现。因此,一般需增强扫描,其目的在于:①能更好地显示肝肿瘤;②发现等密度病灶;③有助于明确肿瘤的特定性质。增强表现:静脉注射碘造影剂后病灶和肝组织密度得到不同程度的提高,谓之增强。包括:①动态增强扫描:采用团注法动态扫描或螺旋CT快速扫描,早期(肝动脉期)病灶呈高密度增强,高于周围正常肝组织时间10~30s,随后病灶密度迅速下降,接近正常肝组织为等密度,此期易遗漏;病灶密度继续下降肝组织呈低密度灶,此期可持续数分钟,动态扫描早期增强图易于发现肿块直径小于1cm或1~2cm的卫星灶,亦有助于小病灶的发现。②非动态扫描:普通扫描每次至少15s以上,故病灶所处肝脏层面可能落在上述动态扫描的任何一期而呈不同密度,极大部分病灶落在低密度期,因此病灶较平扫时明显降低。门脉系统及其他系统受侵犯的表现:原发性肝癌门静脉系统癌栓形成率高,增强扫描显示未强化的癌栓与明显强化的血液间差异大,表现条状充盈缺损致门脉主干或分支血管不规则或不显影。少数病人有下腔静脉癌栓形成。肝门侵犯可造成肝内胆管扩张,偶见腹膜后淋巴结肿大、腹水等。肺部转移在胸部CT检查时呈现异常,比X线胸片敏感。
近年来新的CT机器不断更新,CT检查技术的不断改进,尤其是血管造影与CT结合技术如肝动脉内插管直接注射造影剂作CT增强的CTA(CT-Angiography)、于肠系膜上动脉或脾动脉注射造影剂于门静脉期行CT断层扫描(CTAP),以及血管造影时肝动脉内注入碘化油后间隔2~3周行CT平扫的Lipiodol-ct(Lp-CT)等方法,对小肝癌特别是直径1cm以下的微小肝癌的检出率优于CT动态扫描。但上述多种方法中仍以CT平扫加增强列为常规,可疑病灶或微小肝癌选用CTA和CTAP为确诊的最有效方法。
5.磁共振成像(magnetic resonance imaging,MRI) MRI可以准确地了解腹部正常与病理的解剖情况,由于氢质子密度及组织弛豫时间T1与T 2的改变,可通过MRI成像探明肝脏的病理状态。虽然肝组织成像信号强度按所受的脉冲序列而变化,但正常肝组织一般均呈中等信号强度。由于肝的血管系统血流流速快,在未注射造影剂的情况下就能清楚地显示正常肝内血管呈现的低信号强度的结构。肝细胞癌的信号强度与正常肝组织相比按所使用的以获得成像的MRI序列而不同,肝细胞癌的信号强度低于正常肝组织用MRI成像可以证实肝细胞癌的内部结构,准确显示病灶边缘轮廓,清晰地描绘出肿瘤与血管的关系。由于正常肝组织与肝细胞癌的组织弛豫时间T 1与T 2的差别较显著,因此,MRI成像对单发或多发病灶肝细胞癌的诊断通常十分容易。大部分原发性肝癌在MRI T1加权像上表现为低信号,病灶较大者中央可见更低信号区,系坏死液作p在T 2加权像上多数病变显示为不均匀的稍高信号,坏死液化区由于含水增多显示为更高信号,包膜相对显示为等或高信号,原因是病变内含脂增多。含脂越多在T 1加权像上病灶信号越高。少部分原发性肝癌在T 2加权像上显示为等信号,容易遗漏病变,因而要结合其他序列综合确定诊断。部分小肝癌(<3cm)出血后,病灶内铁质沉积,此种病变无论是在T 1加权像还是T 2加权像上,均显示为低信号。原发性肝癌病变中央区常因缺血产生液化坏死,MRI T 1加权像上坏死区信号比肿瘤病变更低,在T 2加权像上则比肿瘤病变更高。MRI对原发性肝癌包膜显示较CT好,由于包膜含纤维成分较多,无论在T 1加权像或T 2加权像均显示为低信号。尤其是在非加权像上,原发性病变表现为稍高信号,包膜为带状低信号,对比清晰,容易观察。文献报道极少数原发性肝癌病变由于肝动脉和门脉双重供血,在CT双期扫描时相中均显示为等密度不易被检出,MRI由于其密度分辨率高,则可清楚显示病变。
6.肝血管造影 尽管近年CT、超声显像和磁共振显像学检查方面有许多进展,但血管造影在肝肿瘤诊断与治疗方面仍为一重要方法。唯有利用肝血管造影才能清晰显示肝动脉、门静脉和肝静脉的解剖图。对2cm以下的小肝癌,造影术往往能更精确迅速地作出诊断。目前国内外仍沿用Seldinger经皮穿刺股动脉插管法行肝血管造影,以扭曲型导管超选择法成功率最高,为诊断肝癌,了解肝动脉走向和解剖关系,导管插入肝总动脉或肝固有动脉即可达到目的,如疑血管变异可加选择性肠系膜上动脉造影。如目的在于栓塞治疗,导管应尽可能深入超选择达接近肿瘤的供血动脉,减少对非肿瘤区血供影响。肝癌的血管造影表现有:①肿瘤血管和肿瘤染色,是小肝癌的特征性表现,动脉期显示肿瘤血管增生紊乱,毛细血管期示肿瘤染色,小肝癌有时仅呈现肿瘤染色而无血管增生。治疗后肿瘤血管减少或消失和肿瘤染色变化是判断治疗反应的重要指标。②较大肿瘤可显示以下恶性特征如动脉位置拉直、扭曲和移位;肿瘤湖,动脉期造影剂积聚在肿瘤内排空延迟;肿瘤包绕动脉征,肿瘤生长浸润使被包绕的动脉受压不规则或僵直;动静脉瘘,即动脉期显示门静脉影;门静脉癌栓形成,静脉期见到门静脉内有与其平行走向的条索状“绒纹征”,提示门静脉已受肿瘤侵犯,有动静脉瘘同时存在时此征可见于动脉期。血管造影对肝癌检测效果取决于病灶新生血管多少,多血管型肝癌即使2cm以下或更小亦易显示。近年来发展有数字减影血管造影(DSA),即利用电子计算机把图像的视频信号转换成数字信号,再将相减后的数据信号放大转移成视频信号,重建模拟图像输出,显示背景清晰、对比度增强的造影图像。肝血管造影检查意义不仅在诊断、鉴别诊断,而且在术前或治疗前用于估计病变范围,特别是了解肝内播散的子结节情况;血管解剖变异和重要血管的解剖关系以及门静脉浸润可提供正确客观的信息。对判断手术切除可能性和彻底性以及决定合理的治疗方案有重要价值。血管造影检查不列入常规检查项目,仅在上述非创伤性检查不能满意时方考虑应用。此外血管造影不仅起诊断作用,有些不宜手术的患者可在造影时立即进行化疗栓塞或导入抗癌药物或其他生物免疫制剂等。
7.放射性核素显像 肝胆放射性核素显像是采用γ照像或单光子发射计算机断层仪(SPECT)近年来为提高显像效果致力于寻找特异性高、亲和力强的放射性药物,如放射性核素标记的特异性强的抗肝癌的单克隆抗体或有关的肿瘤标志物的放射免疫显像诊断已始用于临床,可有效地增加放射活性的癌/肝比;99m Tc-吡多醛五甲基色氨酸(99m Tc-PMT)为一理想的肝胆显像剂,肝胆通过时间短,肝癌、肝腺瘤内无胆管系统供胆汁排泄并与PMT有一定亲和力,故可在肝癌、肝腺瘤内浓聚停留较长时间,在延迟显像(2~5h)时肝癌和肝腺瘤组织中的99m Tc-PMT仍滞留,而周围肝实质细胞中已排空,使癌或腺瘤内的放射性远高于正常肝组织而出现“热区”,故临床应用于肝癌的定性定位诊断,如用于AFP阴性肝癌的定性诊断,鉴别原发性和继发性肝癌,肝外转移灶的诊断和肝腺瘤的诊断。由于肝细胞癌阳性率仅60%左右,且受仪器分辨率影响,2cm以内的病变尚难显示,故临床应用尚不够理想。
(五)临床分型和分期
原发性肝癌的临床表现常不一致,其病理基础亦有较多差异。因此,许多研究者都希望能制定出一项统一的分型分期方案,以选择治疗、评价结果和估计预后。
1.按AFP浓度的分型方法 肝癌病人血清AFP浓度的高低与肿瘤组织的病理类型有密切联系,血清AFP的高低反映了肝癌一定的生物行为,也在某种意义上反映了病期早晚。血清AFP的浓度和动态变化分为三型:
(1)高AFP型:AFP在10 000μg以上,并持续在此种高浓度以上;
(2)中AFP型:AFP浓度介于高低两型之间,其上升幅度缓慢,每3~4月上升1 000μg/L左右;
(3)低AFP型:初诊时AFP在200μg/L以下,并在整个病程中AFP浓度不高。
临床分析认为,AFP越高,发展越快,切除机会越少,生存期亦越短。
2.按肝功能和临床表现的分期方法 Primaek研究了乌干达的肝癌病人,认为门静脉高压与血清胆红素的变化对肝癌的预后至关重要。所以他的肝癌分期方法是:
Ⅰ期:无腹水、门静脉高压和体重减轻,总胆红素<34.2umol/L(2mg/dl);
Ⅱ期:有腹水和/或中度体重减轻,无门静脉高压,总胆红素<34.2umol/L(2mg/dl);
Ⅲ期:体重严重减轻;有门静脉高压,总胆红素>34.2umol/L(2mg/dl)。
3.我国通用的肝癌分期方法 2026年9月在广州召开的第八届全国肝癌学术会议上正式通过了“原发性肝癌的临床诊断与分期标准。”分期标准见表19-3。
表19-3 原发性肝癌临床分期标准
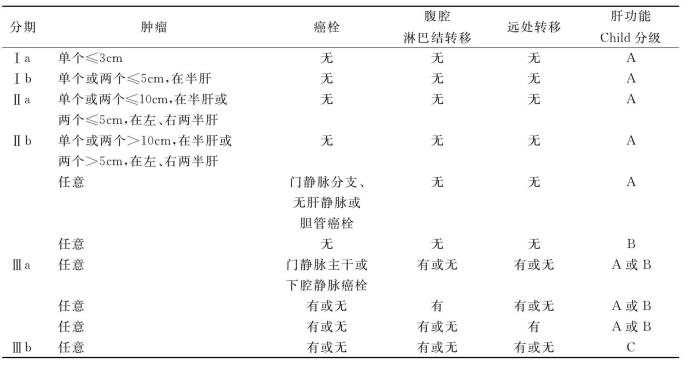
Ⅰa:单个肿瘤最大直径≤3cm,无癌栓、腹腔淋巴结及远处转移;肝功能分级Child A。
Ⅰb:单个或两个肿瘤最大直径之和≤5cm,在半肝,无癌栓、腹腔淋巴结及远处转移;肝功能分级Child A。
Ⅱa:单个或两个肿瘤最大直径之和≤10cm,在半肝或两个肿瘤最大直径之和≤5cm,在左、右两半肝,无癌栓、腹腔淋巴结及远处转移;肝功能分级Child A。
Ⅱb:单个或两个肿瘤最大直径之和>10cm,在半肝或两个肿瘤最大直径之和>5cm,在左、右两半肝,或多个肿瘤无癌栓、腹腔淋巴结及远处转移;肝功能分级Child A。肿瘤情况不论,有门静脉分支、肝静脉或胆管癌栓和/或肝功能分级Child B。
Ⅲa:肿瘤情况不论,有门静脉主干或下腔静脉癌栓、腹腔淋巴结或远处转移之一;肝功能分级Child A或B。
Ⅲb:肿瘤情况不论,癌栓、转移情况不论;肝功能分级ChildC。
4.TNM分期方案 国际抗癌联盟(UICC)在2026年制定的肝细胞癌TNM分期方案基础上,对原方案中Ⅱ、Ⅲ期的标准作了一些修改,于2026年提出了新的TNM分期方案。主要依据体检、医学影像学和/或手术探查所见T(原发肿瘤:大小、数目及侵犯血管情况)、N(区域淋巴结)、M(远处转移)的情况。
T 1:单个肿瘤,≤2cm,无血管侵犯。
T 2:单个肿瘤,≤2cm,侵犯血管;或多个肿瘤,局限于一叶,≤2cm,无血管侵犯;或单个肿瘤,>2cm,无血管侵犯。
T 3:单个肿瘤,>2cm,侵犯血管;或多个肿瘤,局限于一叶,≤2cm,侵犯血管;或多个肿瘤,局限于一叶,>2cm,伴或不伴血管侵犯。
T 4:多个结节,超出一叶;或肿瘤侵犯门静脉或肝静脉的主要分支;或侵犯除了胆囊以外的邻近脏器;或穿破内脏腹膜。
N0:无淋巴结转移。
N1:有局部淋巴结转移。M0:无远处转移。M 1:远处转移。并进一步分为Ⅰ~Ⅳ期:
Ⅰ期:T 1、N0、M 0Ⅱ期:T2、N0、M 0
Ⅲ期A:T 3、N0、M 0
Ⅲ期B:T1、N1、M 0;T2、N1、M 0;T3、N1、M0Ⅳ期A:T 4所有N、M 0
Ⅳ期B:所有T、所有N、M1
虽然肝癌的TNM分期考虑了肿瘤、区域淋巴结及远处转移等因素,但要有手术探查及病理结果才能作出,而多数是不能取得病理学检查的。尽管肝癌TNM分期Ⅰ期的术后远期生存率较高,但临床发现≤2cm肝癌例数的比率很低,临床发现属于Ⅰ期者约占3%,而多数已发展至Ⅲ~Ⅳ期,即使发现的小肝癌也多达Ⅱ~Ⅲ期,因此真正意义上的早期肝癌是少见的。由于在我国的原发性肝癌中,有80%~90%合并肝硬化,因此不同于其他实质肿瘤可以较直接应用TNM分期。
欲做好此项工作,需仔细的病理学检查。因有无血管浸润与分期关系很大,病理检查时需注意小血管情况,TNM分类为国际通用的肿瘤分类标准,现已将其列入肝癌的诊疗规范之中,今后我们应积极采用,有利于国际交流。
(六)治疗
原发性肝癌是我国常见的恶性肿瘤,近年来诊断和治疗水平有了很大的提高。目前对肝癌的治疗和其他恶性肿瘤一样,采用综合疗法,包括手术切除、放射治疗、化学药物治疗、免疫疗法及中医中药治疗等。一般对早期肝癌采取手术治疗为主,并辅以其他疗法,对暂时不能切除的肝癌可经肝动脉插管化疗栓塞缩小后再切除,明显增加了手术切除率,减少了手术死亡率。因此,如何及时、正确地选用多种有效的治疗方法,或有计划地组合应用,是目前值得十分重视的问题。
1.手术治疗 目前全球比较一致的意见是:外科手术切除仍是治疗HCC的首选方法和最有效的措施。现代科技的高速发展,带动了外科技术的迅速进步,也使人们对肝癌切除概念不断更新。当今的肝脏外科已不存在手术禁区。肝脏外科手术治疗将在下一节介绍。
2.导向化学药物治疗及栓塞疗法 近年来,原发性肝癌的诊断和治疗由于基础和临床研究的不断进步,已取得了突破性进展。经过积极合理的综合治疗,使肝癌治疗水平又上了一个新台阶,确切地说,不能切除的肝癌通过导向化学药物治疗缩小后可再切除。另外,联合药物化疗研究的结果颇令人乐观。
(1)经肝动脉化疗(TAI)和栓塞(TAE)治疗肝癌:正常肝脏血供25%~30%来自肝动脉,70%~75%来自门静脉,而肝癌的血供90%~99%的来自肝动脉。因此,栓塞后肝癌的血供可减少90%,致使肿瘤坏死、液化、缩小,获得良好的疗效。肝动脉化疗栓塞术被公认为非手术治疗的首选方法,主要适用于不能切除的肝癌,特别是以右叶为主,或术后复发而无法手术切除者。对于不能根治切除的肝癌,经多次肝动脉化疗栓塞治疗后,如肿瘤明显缩小,应积极争取及时手术切除,使患者获得根治的机会。对于可一期根治性切除的肝癌,特别是直径小于5cm单个结节的肿瘤,宜积极予以及时手术切除,一般可不考虑术前应用肝动脉化疗栓塞。在切除术后辅以肝动脉化疗栓塞为主的综合治疗可清除可能残存的微小病灶并预防术后的复发。鉴于肝癌存在多中心发生及高复发率,肝癌根治性切除术后采用积极的干预,治疗,预防术后复发是提高肝癌疗效的重要手段。肝癌根治性切除术后可采用多种方法的综合应用以预防复发。其中肝动脉化疗栓塞是切实可行的手段,其主要作用是进一步清除肝内可能残存的肝癌细胞,降低复发高峰期的复发率。肝动脉化疗栓塞对播散卫星灶和门静脉癌栓的治疗有一定限度,更难控制病灶的远处转移。为了达到长期防治的目的,需与其他治疗方法特别是生物治疗联合应用,以期在肝癌切除术后充分调动机体的生物学抗肿瘤机制,消灭残存的肿瘤细胞,并进一步阻断肝癌的复发。
1)联合化疗:常用药物为5-氟脲嘧啶、丝裂霉素、阿霉素、顺铂等。经临床观察,联合药物化疗优于单一用药化疗,证明联合用药有增效作用。局部化疗优于全身化疗。近年来,用微型血管化疗泵植入皮下,间歇性化疗药物注射也获得了满意的疗效。
2)TAE:是在肝动脉造影技术进步的基础上开展的,采用Seldinger技术,将导管超选择性地置入肝左、右动脉内进行栓塞、化疗。TAE具有以下的优点:①同时进行肝动脉造影,以明确病灶的部位、范围,发现B超、CT不能发现的病灶和病灶血供来源,因肿瘤的血供可来源于迷走动脉,如肠系膜上动脉(多数为肝右叶肿瘤)、胃十二指肠动脉(多数为肝左叶肿瘤)。②选择适应证范围较宽,对较晚期的病例或肿瘤累及全肝或门静脉肝内有癌栓尚可进行TAE治疗。③同时可以进行化疗,使用针对肿瘤细胞不同周期有效的抗癌药物且高浓度地达到肿瘤部位,较全身化疗药物的浓度可提高2~3倍,且副作用明显降低,其疗效更佳。较常用的是碘油类和碘化油或碘苯酯,可以选择地滞留在肿瘤血管甚至卫星结节的肿瘤血管内,保留时间在半年以上,达到长期栓塞和阻止侧支代偿形成的良好效果。
(2)门静脉化疗:由于门静脉血供在肝癌生长中的重要作用及肝癌细胞对门静脉系统的易侵入性,经门静脉注入化疗药物可选择性进入并作用于肿瘤生长最活跃的细胞,抑制癌细胞增生,控制肿瘤生长。在肝癌伴有门静脉癌栓的情况下,门静脉化疗更有其特殊重要的价值。在肝动脉阻断的情况下,随着门静脉对肿瘤血供的代偿性增加,经门静脉注入的化疗药物能更多地进入肿瘤组织。此外,化疗药物在低压、低流速的门静脉系统中缓慢流动,增加了肿瘤细胞接触化疗药物的时间,使药物在局部停留得更久。虽然有研究证明,肝动脉化疗时,对药物摄取远高于门静脉化疗,但是在肝动脉血流阻断的情况下,经门静脉化疗能显著地提高疗效。
(3)经化疗泵化疗和栓塞治疗肝癌:化疗泵是一种植入式药物输注系统,其基本设想在于让抗癌药物有选择性、高浓度、大剂量地进入肿瘤组织,从而提高抗癌效果,减少毒副作用。皮下植入式输液器(化疗泵的前身)于2026年由Blackshear首先设计研制,70年代后期应用于临床。我国于上世纪80年代中期研制成功,继而应用于临床,目前已广泛应用于中晚期肿瘤的治疗,获得了较好效果。化疗泵的应用范围较当初明显扩大,可用于:①肿瘤的化疗。②通过化疗泵注入栓塞剂(主要是液态或末梢性栓塞剂,如碘化油),栓塞肿瘤供血血管。③通过化疗泵注入免疫调节剂,对肿瘤进行免疫治疗。④通过化疗泵注入造影剂进行肿瘤血管造影。⑤通过化疗泵注入镇痛药物用于晚期肿瘤的镇痛。化疗泵已广泛应用于多种肿瘤的治疗,如肝癌、乳腺癌、胃癌、胰腺癌和直肠癌等。其中,最常应用于肝癌的治疗。在肝癌的治疗中,化疗泵植入途径可分为肝动脉、门静脉和肝动脉-门静脉双途径。一般在术后两周开始灌注化疗。术中也可化疗一次。若肝动脉与门静脉同时置泵时,注药化疗可同时进行也可交替进行。
3.射频消融术(Radio Frequency Ablation,RFA) RFA引入我国只是近几年的事,但早在上世纪80年代中期,日本学者就已将其应用于临床。只不过当时是单电极,肿瘤毁损体积小,疗效也欠佳。经过改良,RFA双电极、伞状电极、冷却电极、盐水增强电极等陆续面世,使RFA在临床上的应用有了质的飞跃。其治疗原理为:插入瘤体内的射频电极,其裸露的针尖发出射频电流,射频电流是一种正弦交流电磁波,属于高频电流范围。此电流通过人体时,被作用组织局部由于电场的作用,离子、分子间的运动、碰撞、摩擦产生热以及传导电流在通过组织时形成的损耗热,可使肿块内的温度上升到70~110℃,细胞线粒体酶和溶酶体酶发生不可逆变化,肿瘤凝固性坏死。同时为了防止电极针尖部周围组织在高温下碳化影响热的传导,通过外套针持续向针尖部灌注冰水,降低其温度,以扩大治疗范围和增强疗效。对于肝癌合并肝硬化者,由于肝纤维组织多,导电性差,热量不易散发,可形成“烤箱效应”,所以RFA治疗原发性肝癌的疗效好于继发性肝癌。RFA的最佳适应证为直径≤3cm病灶,少于5个的肝血管瘤病人和原发性、继发性、术后复发性肝癌患者,特别是肿瘤位于肝脏中央区、邻近下腔静脉或肝门的肿瘤,肝功能不低于Ⅱ级,病人一般情况尚可。由于RFA有多电极射频针,实际上对肿瘤直径在5cm左右的患者也可进行治疗。每周治疗一次,每次治疗1~3个病灶,每个病灶治疗12~15min。肝癌治疗方面,RFA治疗后肿瘤的完全凝固坏死率为60%~95%,肿瘤直径越小者完全坏死率越高。目前报道RFA治疗的最大肿瘤为14cm×13cm×13cm。多数临床病例报道RFA治疗后1、3、5年生存率不亚于手术组,且术后复发率显著低于手术组。另外,较RFA先应用于临床的经皮激光治疗和经皮微波固化治疗,其治疗原理与RFA相似,都是使肿瘤组织产生高温,形成坏死区。但插入瘤体内的光纤和微波电极周围组织,在温度升高后常伴随组织碳化,阻止了能量的输出,无法达到使肿瘤全部坏死的效果。两者治疗的适应证与RFA相似。RFA以其适用范围广、痛苦小、安全、疗效可靠、可反复治疗,甚至可以在门诊进行治疗而成为微创治疗的新兴生力军。而经皮激光治疗和经皮微波固化治疗在肝脏外科中的应用似趋于冷落。但RFA治疗费用昂贵,并且难以与手术治疗的彻底性和PEI的普及性相比,还有待于进一步发展和完善。
4.冷冻治疗:2026年Cooper首先报道采用液态氮冷冻治疗恶性肿瘤。2026年Southam发现冷冻治疗肿瘤能够使患者获得对该肿瘤细胞的特异的免疫性,从而确立了冷冻治疗后产生免疫功能的设想。随着冷冻设备和技术的进步,近十几年来,冷冻治疗外科有了很大的发展。目前的冷冻治疗已经不仅广泛应用于各种体表的良性肿瘤的治疗,还广泛地应用于内脏的良恶性肿瘤的治疗。如胃癌、肺癌,直肠肛管癌和肝癌等。冷冻不仅能直接杀伤肿瘤组织细胞,而且还可以产生免疫效应。冷冻肿瘤细胞坏死后,可产生特异性肿瘤抗原,刺激机体产生特异抗体,通过抗体肿瘤细胞的免疫反应消灭残留的癌细胞。肝癌冷冻治疗常用的制冷剂有液氮(-196℃)、二氧化碳雾(-78℃)、氟利昂及氧化亚氮(笑气)等。目前最常用的制冷剂是液氮。液氮无色,无味,不易燃,易操作,它的气体无毒,无刺激性。是否能达到对全部肿瘤的有效低温是能否彻底杀死肿瘤细胞的关键。一般认为-40℃~-60℃足以杀死肝癌细胞,而-20℃则未能杀死肿瘤细胞,从而使肿瘤周边部位术后肿瘤复发。肝癌的冷冻治疗一般采用液氮冷冻治疗机,先选择合适的探头(根据肿瘤大小和部位),将冷冻探头刺入病灶内至适当深度,降低冷冻探头的温度至最低点,使肿瘤组织冷冻成固形冰块,达到所需要的范围。如有可能,应先阻断肿瘤区的血液供应,然后冷冻,如此即可避免肿瘤的血行扩散,易于使肿瘤组织制冷,且不至于引起全身温度过于降低。能否将肿瘤细胞彻底地冷冻致死是冷冻治疗肿瘤成功的关键。因此医生应熟悉达到冷冻坏死的各种因素及其过程,才能根据肿瘤的大小、部位和组织类型等进行冷冻治疗。动物实验和临床研究表明,快速冷冻和缓慢复温的模式对组织细胞具有最大的破坏力。多次冻融比单次冻融的效果好。降温速度应为每分钟100℃左右的梯度差急速冷冻,复温速度则应以每分钟1~10℃的温度梯度缓慢复温。在这种条件下,对组织细胞的破坏程度最大。冷冻时间应为每次5 ~15min。
5.免疫治疗 2026年Burnet提出肿瘤免疫监视概念以来,世界各地纷纷开展肿瘤免疫治疗实验的研究和临床观察。经过20多年的研究,基本上一致认为肿瘤的免疫治疗对消灭残癌,减少复发,改善机体的免疫状态有发展前途。目前,免疫治疗原发性肝癌有前途的方法还是非特异性免疫治疗。非特异性免疫治疗肿瘤的基本原则是:①提高机体免疫功能。②调节机体免疫状态,使其恢复正常。③用单克隆抗体等免疫手段结合药物或毒素进行治疗。免疫促进剂或调节剂种类繁多,如卡介苗、短小棒状杆菌等微生物制剂,或转移因子、干扰素肿瘤坏死因子以及白细胞介素-2(IL-2)等生物制剂。近年国内外对肝癌的免疫治疗,采用一种过继性免疫疗法,即将肿瘤患者的淋巴细胞经淋巴因子IL-2诱导,再经体外培养诱导为非特异性杀伤细胞,然后,将这种淋巴因子激活的杀伤(LAK)细胞回输给患者。Rosenberg等报道LAK疗法对肝癌尤其有效。
从免疫治疗原发性肝癌的资料分析,归纳如下:①原发性肝癌除其他治疗手段外,辅以免疫治疗有很大的帮助。②免疫治疗中的非特异性免疫治疗有发展前途,如干扰素、肿瘤坏死因子以及IL-2。③利用肝癌细胞的单克隆抗体结合化疗和毒素局部使用。④中草药的免疫促进及调节还应进一步地研究。
6.酒精瘤内注射治疗(PEI) 对无法手术切除的原发性肝癌,可在B超引导下用无水酒精注射治疗,这是一种安全有效的方法。
(1)适应证:无水酒精适用于肿瘤直径小于2cm的肝癌,结节总数不超过3个的小肝癌患者。直径3cm以上的肝癌常有肿瘤包膜浸润或血管侵犯,可以获得满意疗效。
(2)术前准备
1)应详细了解肝肿瘤的位置、大小、包膜与血管、胆管的关系,肝外血管侵犯和肝外转移情况。
2)术前检查肝、肾功能、出凝血机制。
(3)操作方法:
1)操作设备:①超声导向设备,选用有导向穿刺装置的超声探头。②22号穿刺细针或PTC细针。③99.5%以上的纯酒精、局麻药等。
2)操作步骤:①在B超引导下反复取不同方向体位比较,选择适宜穿刺部位穿刺进针点。②常规消毒铺巾。③穿刺针刺入皮内后在超声引导下向肿瘤部位穿刺,抵达肿瘤后拔出针芯,接上无水酒精注射器,注入无水酒精。较大的肿瘤可采用多方向、多点、多平面穿刺,注射操作者感到注射区内部有一定压力乃停止注射,退出穿刺针。为避免无水酒精沿针道溢出刺激腹膜产生一过性疼痛,可在退针时注入局麻药2~3m L以减轻或防止疼痛。④酒精注入剂量:2cm以内的小肿瘤,一般2~5m L;直径3cm以上的肝癌,每次10~20m L。每隔4~10天,一般7天一次。如体质较好可以耐受者,可每周2次,一疗程4~6次。无水酒精注射后副作用少,有一过性局部灼痛,半数病人注射当天有低至中等发热。梗阻性黄疸病人穿刺易损伤胆管引起胆汁外漏,或穿刺后出血。近来随着超声设备不断地更新,技术操作水平的提高,超声介入治疗正向新的高度发展,已不仅限于瘤内酒精注射方法,改进瘤内应用药物也多样化。经皮醋酸注射(PAI)和经皮热盐水注射(PSI)都是自PEI衍生出来的治疗方法。前者杀灭肿瘤的原理亦是使细胞蛋白质变性、凝固性坏死,但醋酸在瘤体内的均匀弥散优于无水酒精;后者的治疗原理是利用煮沸的生理盐水直接杀灭肿瘤细胞,而热盐水冷却后成为体液的一部分,相对于无水酒精和醋酸无任何毒副作用。两者治疗的适应证与PEI相似。虽然有资料称PAI和PSI的疗效好于PEI,但目前尚缺少它们的大宗临床病例报道,其近、远期疗效有待进一步观察。
7.中医中药治疗 我国已普遍开展中医中药治疗原发性肝癌。在临床上运用更多的是中医辨证施治,根据肝癌病人的主征、舌苔、脉象,运用祖国医学的理论进行辨证,从整体观念出发,采用扶正培本为主,着重调动机体的抗病能力,比较注意处理如局部与整体,扶正与祛邪关系的治疗原则,经探讨初步发现,中药仍以采用健脾理气药物为好。对不能切除的肝癌,我们采用中药和化疗相结合,使肿瘤在一定程度上受到抑制,发展缓慢。中药治疗肝癌有一定的前景,但目前仍处于探讨阶段。
二、继发性肝癌
继发性肝癌或肝转移癌在西方国家多见。
许多脏器的癌肿均可转移到肝脏,尤以结肠直肠癌、胃癌、胆囊癌、胰腺癌、子宫癌和卵巢癌等较为多见。此外,乳腺、肾、肺、鼻咽部的癌肿也常转移到肝脏。
继发性肝癌的临床表现常以肝外原发性癌肿所引起的症状为主,但也有部分病人出现消瘦、乏力、肝区疼痛、肝区结节和肿块,甚至黄疸和腹水等。继发性肝癌AFP多为阴性。Iwatsuki及Starzl(1988)报告411例肝切除中,123例(30%)是属肝转移癌切除,其中90例(73%)是结肠直肠癌病人,切除术后的1~5年生存率分别为88.1%、69.3%、50.0%、38.9%、35.8%,因而肝切除术治疗肝转移癌只是应该如何选择此项手术的问题。现在看来,如原发病为恶性程度较低的结肠癌,转移癌块小而局限,可以连同原发灶一期手术切除,但最近也有主张分期手术的,第一次只切除原发癌,术后应有一段时间化疗或放疗后,癌肿有些缩小,病人一般情况好转,再行二期手术切除。另外,对单一的转移灶或局限某一叶,无腔静脉或门静脉侵犯,年龄与健康情况适合手术,无明显肝硬化均有手术适应证。
肝切除术治疗肝转移癌在严格的选择之下,手术死亡率较低,而有25%~30%的病人可望生存5年而无肿瘤复发。Former等(1984)在其连续247例结肠直肠癌病人的75例肝切除术治疗肝转移的病人中,根据病理改变分为3期:
Ⅰ期:肿瘤局限于已切除的肝脏部分,无主要肝内胆管和血管侵犯;
Ⅱ期:有局部扩散;
Ⅲ期:有淋巴结或局部以外的转移。
属于Ⅰ期的37例病人,3年生存率为66%,Ⅱ期病人为58%。通过影响治疗结果的多因素分析,Former认为最重要的是病情的分期。对不能切除的肝转移癌,尚采用:①经皮选择性肝动脉栓塞术;②植入性化疗泵肝动脉化疗;中西医结合治疗均有一定疗效。
(易继林)
第五节 肝脏外科手术概述
直至目前为止,治疗肝癌的最有效方法仍是手术切除。原发性肝癌手术切除的效果与肿瘤大小,有无合并肝硬变,肿瘤有无包膜,地区因素有密切关系。近年来原发性肝癌的治疗效果有明显改善,在很大程度上是由于诊断技术的进步,使得更多的早期肝癌病人接受手术的结果。复旦大学中山医院对肝癌的早期诊断经验是:①定性诊断加以定位诊断才是完整的诊断方法。②定性诊断以AFP和AFP异质体检测为主,必要时可以结合肝功能和其他肝癌标志物检测。③定位诊断以B超检查为主,结合CT、MRI和肝动脉造影或碘油造影加CT等。④在确诊仍有困难而又高度怀疑肝癌时,可在B超引导下细针穿刺细胞学检查,对及早确诊有帮助。近年来由于开展肝癌普查工作,早期肝癌病例大大增多,手术切除率从原来的25%提高到50%以上。但手术切除治疗原发性肝癌仍存在问题,如大量就诊病人属中晚期肝癌,手术切除率低。因此,手术切除仅占原发性肝癌的少数,远期疗效尚不满意。此外,原发性肝癌大多伴有肝硬变,手术切除率低,手术死亡率高,同时还存在多中心癌的问题,虽属早期,术后复发率高,疗效仍不理想,所以,使手术的作用受到限制。尽管如此,目前,手术切除仍作为肝癌的首选治疗。
一、肝脏应用解剖
肝脏是人体最大的实质性脏器,重约1 200~1 500g,主要位于右侧季肋部,仅有小部分位于左侧季肋部。肝脏是由肝实质和两个不同的管道系统组成,血运非常丰富。肝内管道系统一为Glison系统,一为肝静脉系。前者包含有门静脉、肝动脉和胆总管,三者包裹于一结缔组织鞘内,经肝脏的脏面横沟处进入肝实质内(称第一肝门);后者是肝脏的输出静脉,收集肝脏的回心血液,经肝脏后面的腔静脉窝注入下腔静脉(称第二肝门)。
肝脏的表面结构,肝脏呈楔形,右侧钝厚而左侧扁窄。分膈、脏两面和左、右、前、后四个缘。膈面有镰状韧带,左右冠状韧带和左右三角韧带,脏面有肝胃韧带、肝十二指肠韧带、肝结肠韧带和肝肾韧带,这些韧带起到固定肝脏作用。进行肝叶切除时,必须相应地分离某些韧带,才能充分显露肝脏。肝十二指肠韧带中有门静脉、肝固有动脉和胆总管,又称肝蒂,可控制肝脏血流,减少出血。
肝脏的分叶,从门静脉系统注射腐蚀标本上看,肝脏有三个主裂、二个段间裂和一个背裂。正中裂起自胆囊切迹,向后上方止于下腔静脉的左壁。它将肝脏分成左、右两半。裂内有肝中静脉经过。左叶间裂起自脐切迹向后上方止于下腔静脉的左壁,左膈面以镰状韧带为界,脏面以左纵沟为标志,它将左半肝分为左外叶和左内叶。裂内有肝左静脉的叶间支经过,门静脉左干的矢状部和囊部也位于其中。右叶间裂自肝的右下缘斜向右后上方止于下腔静脉的右壁,它将右半肝分成右前叶和右后叶,裂内有肝右静脉经过。此外,还有左段间裂和右段间裂,它将左外叶和右前后叶各分成上下两段。背裂位于肝脏后上缘的中部,尾状叶的前方,是肝静脉进入下腔静脉之处。
以上肝裂将肝脏分成五叶八段,即左外叶、左内叶、右前叶、右后叶和尾状叶,尾状叶为第Ⅰ段,左外叶上段为第Ⅱ段,左外叶下段为第Ⅲ段,左内叶为第Ⅳ段,右前叶下段为第Ⅴ段,右后叶下段为第Ⅵ段,右后叶上段为第Ⅶ段,右前叶上段为第Ⅷ段(国际通用的Couinaud分段法)(图19-9)。
根据上述的分叶、分段,肝切除可作相应的肝段切除或联合肝段切除,也可根据切除的范围命名为右半肝切除术、左半肝切除术、左外叶切除术等。如同时切除右半肝和左内叶,也称为右三叶切除术;同时切除左内叶和右前叶,称为中肝叶切除术。
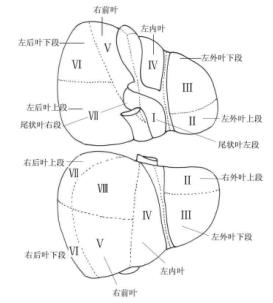
图19-9 肝脏的分叶分段
1.肝脏的脏面观 2.肝脏的膈面观
二、术前准备和术后处理
(一)手术适应证
根据定位和定性诊断结果,肝癌诊断明确,肿瘤位置明确有可能切除者,病人应无黄疸和腹水,心肺及肾功能无严重损伤,估计能耐受手术,肝功能代偿良好,血清总蛋白在60g/L左右,A/G比例为(3~2)∶1,凝血酶原时间正常,ALT应在正常范围,若略有升高,仍可考虑手术。如升高超过正常值1倍以上,则不宜手术。AFP>500μg/m L持续1个月或AFP>200μg/m L持续2个月不伴活动性肝病(即无血清ALT、胆红素或凝血酶原时间异常,同时排除妊娠及生殖腺畸胎瘤,也应争取手术探查。有下列情况的不宜剖腹探查:①肝癌已有远处转移,如肺、骨、脑等处的转移。②病变为弥漫型或第一、二肝门已受侵犯。③病人有明显的黄疸、腹水、浮肿或恶病质。④合并有严重的肝硬化或肝功能有严重的损害。⑤合并有明显的门静脉高压症,如食管、胃底静脉曲张或腹壁静脉明显扩张等。⑥有严重的出血倾向,凝血酶原时间低于50%。
(二)术前准备
1.原发性肝癌的病人大多合并有肝硬变,因此术前必须作好充分的准备,使病人安全度过手术期,并防止术后并发症。手术前应详细检查病人的全身情况,了解心、肺、肾和肝功能。对合并肝硬变或估计切除半肝以上者,术前短期内应给予高蛋白、高碳水化合物和高维生素饮食,口服维生素B1、维生素C、维生素K等;对禁食的可静脉注射葡萄糖溶液,以增强全身抵抗力和改善肝功能。
2.血浆蛋白低时,应输给血浆或白蛋白使血清总蛋白在60g/L以上。
3.术前放置胃管。
4.备好新鲜血,以免输入大量库血而造成凝血机制紊乱。
5.麻醉:一般采用气管内插管,在手术中还必须充分给氧,避免缺氧和低血压。术中输液输血以上肢为宜,以避免下肢输血时,因快速加压输血引起下腔静脉压增高而导致肝静脉压的增高,使肝切面渗血加重。大量输血后还应适量给予10%葡萄糖酸钙。术中可酌用各种凝血药物。
6.体位与切口选择:病人的体位对良好的手术显示甚为重要。根据肿瘤的位置确定合适的体位。我们常规经右肋缘下斜切口或作“人”字形切口常常可以得到良好的显露。近来,由于拉钩器械的改进,采用悬吊式拉钩,将整块右侧或左侧胸壁拉起来,手术野显露甚佳,目前大多数肝手术已无需开胸,从而减少了术后胸腔并发症的发生。
(三)手术方法的选择
原发性肝癌的手术切除通常有肝段切除或联合肝段切除或左外叶、左半肝、右半肝、右三叶、左三叶、中肝叶切除(图19-10)。(https://www.daowen.com)
术式的选择应取决于肿瘤的大小、部位、单个或多个、有无肝硬变及轻重,以及肝的代偿功能和病人的全身情况。手术切除应力求以较小的手术范围和最小的手术危险性而获得较好的远期效果。
肝段切除常用于病变较小而又不需要作肝叶或半肝切除者,如右肝下叶肿瘤可作Ⅴ、Ⅵ段联合肝段切除,右肝上叶可作联合Ⅶ、Ⅷ段切除。肝段切除通常在B超引导下,可在阻断肝门控制肝血流后距离病变2~3cm处切肝,用手术刀在预定的肝切线上切开肝包膜和表浅肝实质,钝性分开肝实质,遇到血管和胆管结扎、切断,如此边离断肝组织,边结扎、切断血管和胆管,直到肝组织完全离断为止。留下的胆管、血管结扎。肝创面可采用褥式或间断缝合。近年来由于新的手术器械问世使术中出血减少,如ND、YAG、激光刀、超声刀、水刀和氩气刀等应用临床后,几乎已能切除伴肝硬变所有部分的实体肿瘤。肝切面可用纤维蛋白粘胶剂或纤维蛋白黏膜网粘贴,效果良好。也可将肝创面敞开。有资料报道,近10年间施行肝癌切除1 480例中,瘤径小于5cm者已无手术死亡。小肝癌切除后5年复发率为72.3%,说明肝癌切除后复发率仍很高。近年来临床开展的肝癌切除后复发再手术切除是提高疗效的一种积极方法。对不能切除的大肝癌经介入疗法缩小后再切除,获得了第二期手术机会。
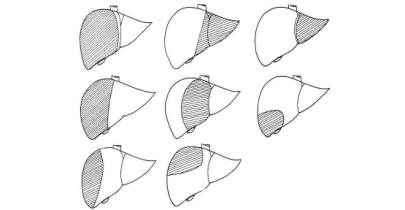
图19-10 各种类型肝切除术的术式示意图
(四)术后处理
1.密切观察病情,注意防止低血压、缺氧、出血、少尿、腹胀和肝昏迷等情况。
2.护肝治疗,应适当输白蛋白、少量新鲜血液及护肝药,以利肝脏的修复。
3.给予广谱抗生素预防感染。
4.术后24h内给氧,并持续胃肠减压。
5.保持腹腔引流管通畅,根据腹腔引流液多少于术后5~7日拔出。
6.防止肺部感染,术后鼓励病人作深呼吸咳嗽排痰,给予雾化吸入,以防肺炎等并发症。
(五)术后并发症及其防治
肝切除术后常见的并发症有出血、感染、胆瘘及肝功能衰竭等。
1.出血 术中和术后出血是肝脏手术最严重的并发症,也是引起肝切除死亡率高的重要原因之一。术中出血往往是由于不熟悉肝内解剖或在手术操作中损伤大血管造成。因此,在肝切除过程中,必须熟悉肝内血管分布及其解剖部位。我们认为,在处理第二肝门时,不必将肝静脉完全解剖出来,只要认清肝静脉的走向,在肝静脉的主干上连同肝组织缝扎。在作右半肝或右三叶切除时,如过度牵拉肝组织,往往容易使肝短静脉断裂或直接损伤下腔静脉,引起大出血。如遇此情况时,术者应立即用手指压住下腔静脉破口,吸尽血液,然后用无损伤线作破口修补。我们从实践中体会到,这种处理方法是比较安全的,可预防误伤大血管而造成大出血。术后出血原因很多,常见的有:①术中止血不彻底。②血管结扎线脱落。③肝断面部分肝组织坏死,继发感染。④引流不畅,创面感染。⑤出血倾向,凝血功能障碍。为避免术后出血,在作肝切除时应按肝内血管分布规律进行切肝,肝断面的出血点应用细丝线逐一缝合结扎,避免作大块肝组织束扎法;分离韧带时,应仔细止血;为了避免结扎线脱落,对较大的血管应结扎两道。术后继发大出血时,应立即进行手术止血。
2.膈下脓肿 肝切除后,由于创面大,创腔渗液多,有时可能混有胆汁,如果手术引流不当,术后引流不充分,或过早拔出引流管都有可能继发感染,形成膈下脓肿。我们在肝切除术后常规采用双套管持续负压吸引,引流通畅,很少出现膈下脓肿。如出现膈下脓肿,应立即手术治疗,充分引流。
3.胆瘘 肝切除术后断面可能渗出少量的胆汁,如充分引流,往往会很快减少而停止。如果引流量在1周内仍不减少,而且日渐增多,这说明有较大的胆管漏扎或结扎线脱落。胆瘘的治疗,最重要的是使漏出的胆汁充分引流到体外,以免形成弥漫性腹膜炎。如有较大胆管损伤或结扎线脱落时,除对腹腔充分引流外,需将胆管缝合结扎,并作胆总管T管引流,减低胆道压力,促进瘘口愈合。
三、肝脏外科手术
(一)肝癌切除需注意的问题
(1)探查肝脏要注意以下问题:确定肿瘤是否能切除,如有明显的肝硬变,右半肝切除要慎重,如左半肝有代偿增大,肝功能代偿良好时,可作右半肝切除。否则作肝肿瘤局部切除或肝段切除。第一或第二肝门有侵犯时,应放弃一般手术切除法而采用无血切肝术,如肿瘤在肝裸区侵犯到下腔静脉,也不要勉强作一般方法切除,以免造成不良后果。小肝癌的术中定位一般采用B超。手术切除应力求较小的手术范围和最小的手术危险性而获得较好的远期效果。切除时应距肿瘤边缘2~3cm,边界不清楚要3cm以上,对合并有肝硬变时,切除范围不应超过全肝的50%,即作右半肝切除时也应慎重考虑最好是作范围较小的局部切除。一般认为以切除正常肝的70%~80%,余肝是可以代偿的。
(2)肝脏病变与肝切除量:肝脏具有很旺盛的再生代偿能力,正常肝脏切除左三叶或右三叶后,余肝迅速代偿增生,最后达到接近于肝脏原来的体积。但当肝脏有明显肝硬变时,余肝再生能力便受到限制。在计划肝的切除量时,更重要的是衡量剩余肝组织量及其功能代偿状态。因此,在合并肝硬变的肝癌病人,不宜行右半肝切除(右半肝约占全肝体积的60%~65%)。如果需切除,应尽可能保留更多的肝组织,所以一般不作规则的肝右叶切除。
(3)手术中控制出血问题:目前,控制肝脏血流的方法有:①肝外血管结扎法。如作左半肝切除,先在第一肝门处结扎门静脉左支、肝左动脉和左肝管,然后作规则性左半肝切除。此方法在解剖第一肝门时比较费时,手术时间长,分离血管困难,出血多,现已较少采用。②常温下间歇阻断肝门切肝法。用橡皮管将肝十二指肠韧带全部阻断,使肝脏暂时缺血,然后沿预定的肝切线直接切开肝组织,再边分开肝实质边结扎所有的管道。每次阻断时间10~15min,如肿瘤未切下,可松开橡皮管3 ~5min,然后再作第二次阻断。一般阻断2次,已可完成切肝操作。
(4)原发性肝癌手术操作必须轻柔,避免挤压肿瘤,以免发生癌细胞医源性播散。
(二)肝楔形切除术
肝边缘均比较薄,凡肝边缘部位的较小病变或作肝活组织检查时,均适宜作肝楔形切除术。
病人取平仰卧位,采用右肋缘下切口。进腹探查后,用穿以中号丝线的直针或大弯针在预定切除线外1.5cm处,作一排贯穿肝组织全层的间断交锁褥式缝合。在预定的肝切线上切除肝病变组织,肝切面的较大血管和胆管用丝线结扎。再在上述褥式缝线的外缘,用中号丝线作贯穿肝组织全层的间断缝合,收紧打结,使两侧肝切面对合。于肝切口下方放置一引流管。
(三)肝部分切除术
肝部分切除术又称局部肝切除术,它不涉及肝门的大血管和胆管,只是将通向病变部位的血管分支和胆管切断、结扎。这种手术常用于病变较小而又不需要作肝叶或半肝切除者。特别对病变较小而又合并严重肝硬变者,最适宜这种手术方法治疗。如右肝下部的局限性肿瘤常作肝部分切除术。手术时暂时阻断第一肝门可减少出血。
病人取左侧卧位,右侧垫高,使身体向左倾斜30°~45°。采用右肋缘下切口。进腹探查,了解肝脏病变范围。适当分离肿瘤邻近之冠状韧带及三角韧带,使肿瘤充分游离。以F8#橡胶导尿管绕过肝十二指肠韧带,阻断肝动脉和门静脉血流,开始行肝切除术。用手术刀在距离病变2cm处切开肝包膜和浅层肝实质,用手指或刀柄分离肝实质,遇有血管或胆管逐一钳夹、切断、结扎,也可用血管钳逐步将肝实质连同肝内血管和胆管钳夹、切断、结扎。如此边分离肝组织,边切断、结扎血管和胆管,直到肝肿瘤完全切下。肝肿瘤切除后,放开肝门阻断,仔细检查肝切面的出血点和胆漏,用细丝线作“8”字缝合。待肝切面完全止血后,用温盐水冲洗肝切面及手术野,然后用一片带蒂或游离大网膜覆盖肝切面,并用细丝线缝合固定于肝切面的四周及中央部。最后在肝切面下放置一根双套管引流。
(四)肝左外叶切除术
肝左外叶位于左叶间裂的左侧,膈面镰状韧带为界,脏面以左纵沟为标志。凡病变局限于肝左外叶,病人情况允许,可作肝左外叶切除。
病人取平仰卧位。作上腹部右腹直肌切口或正中切口,也可作左肋缘下斜切口。进腹探查确定行肝左外叶切除后,即将肝圆韧带切断、结扎。用血管钳夹住肝圆韧带断端,把肝脏轻轻往下拉,显露镰状韧带,在靠近腹前壁剪开镰状韧带。注意应保留一定宽度的镰状韧带,以便在肝切除后覆盖肝断面之用。分离至肝顶部处,将左外叶向下轻推,在靠近肝面剪开左冠状韧带,结扎切断左三角韧带。此时,肝左外叶完全游离。
在镰状韧带的左侧0.5~1cm处切开肝包膜,并且钝性分开肝实质,遇血管或胆管逐一钳夹、切断、结扎。沿左纵沟深处分离左门静脉矢状部,用刀柄将肝组织轻轻向左侧推开,解剖出从矢状部外侧缘发出到左外叶的2~3支门静脉支,用血管钳钳夹、切断、结扎。伴随左门静脉支行走的左外叶肝动脉和肝胆管也同时切断、结扎。然后向肝后上方分开肝实质,在左冠状韧带起始部深面2~3cm,离肝上缘约3~4cm处,即可见到肝左静脉。用刀柄沿肝左静脉方向轻轻向左侧推开肝实质,但不必将血管周围的肝组织完全剖离,即以血管钳穿过肝左静脉底部,连同肝组织夹住、切断,并以丝线结扎两道。余下的左上缘肝组织连同其中的左后上缘肝静脉用血管钳一并夹住、切断、结扎。这时肝左外叶则完全离断。
左外叶切除后,肝切面可用热盐水纱布垫压敷止血,如发现肝断面仍有出血或胆汁外漏,即用细丝线作“8”字形缝合结扎。将镰状韧带向下翻转,覆盖肝断面,并用丝线缝合固定。如镰状韧带的宽度不够,也可用肝胃韧带或大网膜覆盖肝断面。检查无出血后,于左膈下放置一根双套管引流,自腹壁另作戳口引出,并妥善固定。然后按层关腹。
术中注意要点:①左三角韧带内往往有血管存在,切断后应作缝合结扎,结扎要牢靠,以免术后结扎线脱落发生出血。在分离结扎左三角韧带时,还应注意勿损伤胃贲门部。②在处理左外叶门静脉支时,务必认清这些门静脉支的解剖关系,切不可将肝门横沟内的门静脉左干或门静脉矢状部结扎,否则可能引起左内叶的缺血坏死。如在处理过程中,不慎分破血管引起出血,不要急于用血管钳乱夹,以免误伤门静脉左干,可立即用手捏住肝十二指肠韧带,控制出血,吸净血液,认清解剖关系,再行止血。③肝左静脉常与肝中静脉合并进入下腔静脉。为了避免损伤肝中静脉,应在肝左静脉汇入肝中静脉之前予以结扎。此外,肝静脉壁比较薄而易破,在处理肝左静脉时,万一发生破裂大出血,术者应立即用左手食指压住出血点,吸净血液,再用大弯圆针作深入肝组织的“8”字形缝合,即可止血。④用镰状韧带或大网膜覆盖肝断面时,务必使覆盖物紧贴肝断面,以免术后覆盖物与肝断面之间遗留有死腔而引起血肿或感染等并发症。⑤肝左外叶切除时,可以在肝门阻断下切肝,这样出血少,操作简便,时间短;但由于左外叶肝比较薄,解剖清楚,容易控制出血,也可以不用肝门阻断而直接切肝,效果亦满意。
(五)肝尾状叶切除术
肝尾状叶又称Spigel叶或Couinaud分段中的第Ⅰ肝段。尾状叶与其周围的肝组织之间,大部分有明确的界限,有独立的血管系统和胆管引流,故被视为一独立的肝叶。其左侧有肝静脉韧带裂,前方为第一肝门,后方为下腔静脉。尾状叶的主体部分位于下腔静脉左前缘,有尾状突伸向右侧,但其与右肝分隔并不明显。
尾状叶动脉支多为左、右各一支,部分人群有3支,尾状叶肝动脉支位置最浅。尾状叶门静脉支多为左、右2支,分别来自左、右门静脉干,部分人群可有第3支供应尾状突。尾状叶的胆管引流为2~3支,尾状突胆管支多和右侧支汇合至右后段胆管支。尾状叶静脉引流的解剖变异较大,数目和位置难以预测,而且此处静脉较短,位置深,是尾状叶切除术时最困难和最危险的部位。
尾状叶切除术中,游离和切断尾叶静脉常见困难在于如肝硬变门静脉压力升高时,此处的侧支循环血管多,游离时出血较多;并且硬化的肝右叶质地变硬、变厚,不易翻转显露肝后的下腔静脉。再者,此处肿瘤较大或位置较高时,可以压迫下腔静脉,肝静脉的下腔静脉入口处。若仅为单纯的血管受压和推移,一般尚可分离;若已有侵犯,则不可能施行单独的尾状叶切除术。手术前行B超或MRI检查,术中B超检查评定血管受累的情况,是很重要的。血管受侵犯常是不能完成切除手术的主要原因。
尾状叶切除术的适应证:①局限于尾状叶的肝良性肿瘤;②尾状叶原发性肝内胆管结石伴狭窄;③局限于尾状叶的原发性肝细胞癌无肝内转移,无主要肝静脉或下腔静脉侵犯。
当肝脏肿瘤不局限于尾状叶时,常须附加左肝或右肝切除术。尾状叶肿瘤已影响下腔静脉与肝静脉夹角处时,此时须显露和分离肝中静脉进入下腔静脉处的背侧面,也须切除肝左叶和结扎切断肝左静脉,否则难以达到目的,强力牵拉和盲目分离可能造成难以控制的出血。肝脏肿瘤侵犯部分尾状叶或尾状叶仅有小的转移癌结节,可行尾状叶部分切除术。
尾状叶切除术手术方法迄今未能定型,主要是手术入路问题。根据肿瘤大小、位置不同可选择或配合使用肝前左侧入路、肝后右侧入路或肝段联合切除三种途径。
手术在全麻下施行。病人取仰卧位,采用“屋顶式”人字形切口,充分显露腹上部和膈下区。可先切开肝圆韧带、肝胃韧带,根据术前检查及术中探查结果,确定肿瘤范围和尾状叶切除的可行性,必要时配合使用术中B超,了解有无转移灶及血管侵犯情况。
1.肝前左侧入路法 先向上剪开镰状韧带,直至肝左静脉与下腔静脉汇合部的前方和左侧,注意勿误伤下腔静脉。再向左剪开肝左侧冠状韧带的前叶,钳夹、切断、结扎左三角韧带,再剪开左冠状韧带的后叶,直至静脉韧带与下腔静脉相连处,充分游离肝左外叶。将其叠起向右方牵开,暴露尾状叶左段。注意保留副肝左动脉。以F8#橡胶导尿管绕过肝十二指肠韧带,便于牵引显露肝尾状叶,必要时阻断肝血流。沿肝十二指肠韧带的左缘,分离出肝固动脉和肝左动脉,沿动脉分离、切断、结扎其通向尾状叶的细小动脉分支。肝动脉支多为1支,有时亦可有2~3支。尾状叶的胆管和门静脉支可暂不予处理。
将肝十二指肠韧带向右下牵拉,显露肝下下腔静脉。切开下腔静脉表面的腹膜及腹膜后组织,暴露下腔静脉的前侧,在下腔静脉前面向上分离,将尾状突和尾状叶右段从下腔静脉分开,此时常需结扎肝右叶通向下腔静脉的一些肝短静脉。选择尾状突或尾叶右侧的适宜部位,切断尾状叶(图19-11),断端缝合结扎止血。
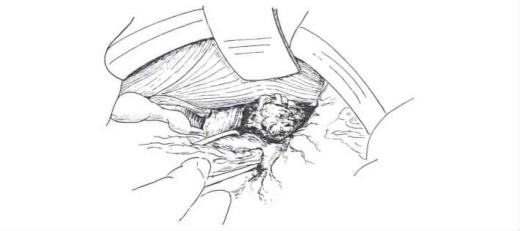
图19-11 剪开肝胃韧带并游离肝左外叶折叠并向右牵引肝左外叶,充分显示肝尾状叶上的肝细胞癌
注意切除范围不应超出肝右切迹。切断下腔静脉前方通向尾状叶的肝短静脉,并将尾叶从肝横沟的后缘分离,注意不要突破肝门横沟的肝门板,以免损伤门静脉。注意尾状叶左段的静脉回流可能多达2~3支。尾叶肝静脉常较短而粗,在有肿瘤的情况下,往往是明显扩张、壁薄,与下腔静脉十分贴近,常规方法难以处理。较安全的方法是分离下腔静脉周围组织至尾叶静脉汇入处周径清楚后,选择一大小和弯度合适的无创性血管钳,夹住部分下腔静脉壁,远端钳夹后切断,贯穿缝扎止血,以4-0血管缝合线连续缝合关闭,尾叶静脉近端及部分下腔静脉壁(图19-12)。
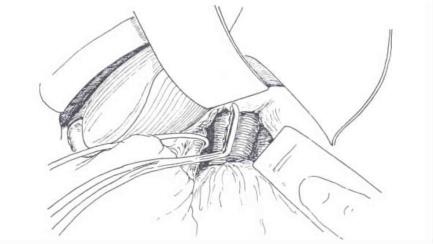
图19-12 以无创血管钳部分夹下腔静脉,切除肿瘤
向前翻转尾状叶,注意不能用力过猛。沿尾状叶上缘将其与肝门横沟的后缘,即第一肝门的后缘分离,注意辨认门静脉分叉部和左干横部的后壁。尾状叶的门静脉支和胆管支变异较大,术中注意分离。由于胆管支、门静脉支较深,若显露困难时,可考虑改行肝左叶加尾状叶切除术。切断胆管支和门静脉支后,再将尾叶顶部与肝左静脉和肝中静脉的后壁分开,若肿瘤已侵犯肝静脉,则肝左叶切除不可避免。此时再进一步处理尾状叶肝静脉,方式如前所述,最后将肝尾状叶从肝左叶的连接处分离,肝断面妥善止血。
也有学者在显露肝后下腔静脉后,将尾状叶转向右侧,切开下腔静脉左侧之腹膜后组织,显露肝后下腔静脉后间隙(即所谓“出血峡谷”),再将尾状叶继续向右翻转,切断、结扎与下腔静脉之间的肝静脉属支,直至尾叶仅由肝实质桥与右侧相连,常规切断此肝实质桥,切除尾叶。
2.肝后右侧入路法 在充分游离肝脏左右叶的韧带后,将肝右叶翻向前内侧,然后自下向上解剖肝短静脉,将肝后面与肝后下腔静脉充分游离开,直至3支主要肝静脉和下腔静脉汇合处,再从下腔静脉前向左侧解剖,找到尾状叶的肝静脉,在直视下切断、结扎之。此时,整个肝脏仅与主要肝静脉和肝蒂相连。再在肝门处解剖肝动脉和门静脉供应尾状叶分支。然后采用Pringle法阻断肝门,从肝后面切除尾状叶。在肝尾状叶切除后的断面处可以清晰地看到3支主肝静脉。
3.联合肝段的尾状叶切除 如果尾状叶的病变侵犯了肝后下腔静脉或尾状叶相邻的肝段(Ⅳ、Ⅲ、Ⅵ、Ⅶ肝段),可先游离、解剖和切除受累的肝段,再切除尾状叶。必要时可先行左半肝或右半肝切除。还可以利用半离体肝切除和离体肝切除术的方法,切除肿物后再将肝脏植入原位。
尾状叶切除术还应注意以下几点:①离断尾状叶至肝板的分支血管,可将肝板向下牵拉,以利显露尾状叶血管,注意不能损伤肝板;②肿瘤实质的显露及切除,可按上述方法进行,也可沿第Ⅳ段右边缘,顺Glison鞘劈开肝实质,既利于尾状叶的显露和切除,也可方便解剖并保护肝中静脉;③在肿瘤较大时,应注意勿损伤肝中静脉后壁,若显露肝中静脉困难,则应加行肝左叶或肝右叶切除术。
(六)肝中叶切除术(第Ⅳ段切除术)
肝中叶包括左内叶和右前叶,按Couinaud分段法,包括肝第Ⅳ、Ⅴ、Ⅷ段,其左侧以镰状韧带为界,前缘为肝脏的前缘,后缘为第一肝门的横裂。系Ⅳ肝段的下部可称为Ⅳb段,即通称的方叶,上部可称为Ⅳa段。肝中叶脏面为第一肝门所在,膈顶部为肝静脉与下腔静脉汇合处,背面紧贴下腔静脉,由于其与诸多重要结构紧密相连,致使肝中叶切除术较为复杂。
肝中叶切除术的适应证:①原发性肝癌位于左内叶及右前叶。②转移性肿瘤位于肝中叶。③胆囊癌侵及肝中叶。肝中叶切除,既保持了肝脏处于无瘤状态,还可以保留右叶和左叶的功能性肝实质。若为除去左内叶的病灶,切除整个左半肝,将导致不必要的20%的有功能的肝实质丢失。在临床工作中,多行改良式肝中叶切除术,切除范围主要包括第Ⅳ、Ⅴ肝段和部分第Ⅷ段。现主要叙述第Ⅳ段肝段切除术。
手术在全麻下施行。采用右肋缘下切口,或双侧肋缘下“人”字形切口。探查腹腔及肝脏,确定行肝中叶切除术后,先切断结扎肝圆韧带,再切断结扎镰状韧带,常规行标准胆囊切除术,然后打开肝十二指肠韧带的前层腹膜,解剖肝十二指肠韧带,确认胆管汇合处及肝动脉分叉处。以F8#橡胶导尿管环绕悬吊肝十二指肠韧带,肝动脉向上解剖至分叉处后,再继续沿肝左动脉解剖以确认营养左内叶的小分支。该分支通常是在肝左动脉深入圆韧带基底部进入肝实质前发出,在近肝实质缘从左肝管前越过。此时,可将此动脉支予以缝扎、切断,注意切勿损伤肝左动脉主干及附近的左肝管。引流左内叶的胆管支通常也正好位于该动脉下,也可在解剖肝门并辨清左、右肝管汇合处后,沿左肝管分离出肝左内叶的胆管支。此小胆管直径约左肝管的一半,需予以缝扎、切断,防止胆漏。
解剖并辨清左、右门静脉分叉后,向前上方向走行的左门静脉干第一分支,通常就是营养左内叶的门静脉分支,确认后应予以钳夹与缝扎。为避免影响残留左外叶的血供,可用一大小和弯曲度合适的无损伤血管钳阻断门静脉左支部分管腔,切断后,以5-0血管缝合线连续缝合关闭此门静脉分支残端(图19-13),再移去血管钳,恢复门静脉左支的血流。此时,通常可在左内叶周围出现无血供分界线,若存在圆韧带交通支血供,则可能无分界线出现。
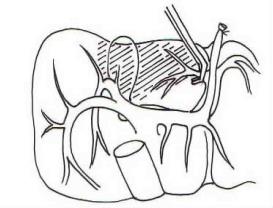
图19-13 以5-0血管缝合线连续缝合关闭此门静脉分支残端
为了完全地阻断肝左内叶的血供,可将圆韧带右缘的腹膜打开,逐一分离其内血管结构,确认门静脉支和小动脉支后,将其离断与缝扎。在圆韧带前面有一小块桥状肝组织,用电刀锐性分离后,切面垂直褥式缝合处理,再沿前部向圆韧带基底部分离(图19-14)。在肝圆韧带的末段深部,有两根细小的肝胆管,予以切断结扎。此时,即在左外叶左内叶间打开一间隙。注意沿圆韧带右缘解剖分离,则不会对左外叶的血管、胆管造成损伤。
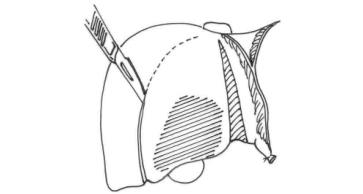
图19-14 电刀锐性分离后,切面垂直褥式缝合处理,再沿前部向圆韧带基底部分离
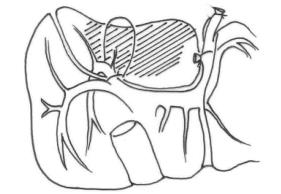
图19-15 用无损伤性血管钳钳夹后离断
此时,可先在肝脏表面对分界线做出标记,标明切除范围。切断左右冠状和三角韧带,钝性推开肝裸区直达下腔静脉,充分游离肝脏。再从圆韧带镰状韧带右侧开始,切开肝实质。助手可向左轻轻牵引圆韧带,以显露其基底部与切面,与主刀医生相配合。切开肝实质后,即缝扎与离断中、大管腔结构,一般出血较少。若发生出血,可阻断肝十二脂肠韧带。切开肝实质直至肝中、肝左静脉汇合处。仔细辨认肝中静脉后,用无损伤性血管钳钳夹后离断(图19-15),近腔静脉端用5-0血管缝合线连续缝合关闭。此时可配合用Pringle法暂时阻断肝血流。
在肝脏表面自胆囊窝顶部的中点向肝上下腔静脉的左前缘作一连线即正中裂,可在此连线偏左侧0.5~1.0cm处切开肝实质,此即肝左内叶的右侧边缘。在此裂中没有门静脉,仅有肝中静脉。对肝切面上的每一大中管腔均必须予以缝扎,可配合间断阻断肝十二指肠韧带控制出血。在切开的过程中,应将肝左内叶的前部向前上方掀起,以直视肝门的重要结构。切除线必须靠近中线,以免在肝中静脉汇入腔静脉处损伤肝右静脉。左内叶两侧切缘可向上延展到肝上下腔静脉的左缘汇合。此时,可充分显露下腔静脉前部及肝门。左内叶后表面有数支小的肝静脉支汇入下腔静脉。这些分支可能被肝组织缘所包绕,而且较短、壁薄,牵拉易将其撕裂,解剖分离时需注意。找到肝静脉后可用无损伤性血管钳钳夹切断,近下腔静脉端,以5-0血管缝合线缝合关闭。第Ⅳ段完全切除后,可将左右两个切面缝合,肝下放置引流管,也有学者主张不予缝合,而在左外叶和右半肝间的空腔内置入网膜片填充。
切除范围包括第Ⅴ肝段和部分第Ⅷ段的改良式肝中叶切除术的操作步骤与第Ⅳ段切除大致相同,但切除范围扩大。右侧切缘是沿右叶间裂左侧0.5~1.0cm切开肝包膜及实质,注意避免损伤肝右静脉主干,切面上的各管腔应予以妥善处理。
也有学者在切除第Ⅳ肝段时,仅切断结扎肝中静脉的左侧分支,而不切断肝中静脉的主干,但在肝中静脉与肿瘤粘连紧密,或肝中静脉主干穿过第Ⅳ肝段上部实质时,则必须切除肝中静脉主干。切断肝中静脉,一般不会影响第Ⅴ、Ⅷ肝段的回流。第Ⅳ肝段的后方紧靠尾状叶,此两肝段间一般无明显界限,分离时应注意,所有管道结构均应切断缝扎。
(七)右半肝切除术
右半肝切除术又称肝右叶切除术,包括第Ⅴ、Ⅵ、Ⅶ、Ⅷ段联合切除,是肝脏外科中的常用手术。右半肝切除术属于规则性肝切除术。手术方法可首先通过肝门部肝叶管道的解剖和处理之后,再切除该肝叶范围的肝组织;也可先从肝实质开始,沿该肝叶的边界,分离到肝门,再切断该肝叶的管道。后种方法出血较多,根据病情,可配合使用两种方法。由于右半肝切除术手术的范围广泛,技术上比较复杂,故有很多问题需要注意。
右半肝切除术主要适应局限于右半肝叶的良、恶性肿瘤。但术前应注意评估病人肝功能代偿情况,由于右半肝切除术切除肝组织较多,若肝脏存在广泛的肝硬化,术后残留肝组织不足以代偿,则会发生肝功能衰竭。
手术在全麻下施行。病人取仰卧位,右侧可垫高15°~30°,手术切口一般采用上腹部“屋顶”状切口。肿瘤位于右后段时,可选择右侧长肋缘下斜切口,向后伸至右腋后线;肿瘤巨大或肿瘤位于右肝顶部时,必要时可选用右侧胸腹联合切口。仔细探查腹腔,注意腹水,转移灶和淋巴结肿大情况,探查门静脉有无癌栓,肿瘤大小、范围,肝硬变情况,肿瘤与大血管的关系。有条件的,可配合使用术中B超,了解肿瘤与肝静脉、门静脉分支的关系,肝内有无转移灶等情况。探查腹腔时,可切断肝圆韧带,切断镰状韧带、右三角韧带,向上分离至肝静脉汇入下腔静脉处,还可切断肝肾韧带、肝横结肠韧带,充分游离右半肝,以便于操作、探查。
确定行右半肝切除术后,一般首先处理右肝门的各重要管道,先打开Calot三角,分离出胆囊管、胆囊动脉,予切断结扎,可常规切除胆囊,以清楚显露右肝门结构,注意仔细止血。沿胆总管、肝总管向上解剖直至进入肝实质处。分离出左、右肝管汇合处,此处常有肝包膜、纤维组织增厚,确定右肝管后,可结扎、切断之,近肝总管端予以缝扎。注意勿损伤肝总管及左肝管,以免造成胆道狭窄。应注意右肝管的解剖变异较多见,可能不形成右肝管主干而呈分裂型右肝管。此种情况可能造成右肝门部解剖困难,可暂时不在肝外处理胆管,待肝实质分离开后,再在肝内处理,以策安全。
肝右动脉在右肝门处位于右肝管下缘,从左侧经肝总管后方至右肝门,与肝管紧密相贴。可用一橡胶导尿管悬吊肝总管,轻轻牵引肝总管即可见。确定后,可在肝右动脉入肝前处切断、结扎,残端需行双重结扎。若存在除肝右动脉主干外的一些扩张的侧支动脉,应予以逐一分离、结扎,注意仔细操作,减少出血量,门静脉右干在右肝门最深处。离断肝右动脉后,轻轻牵引开肝总管即可见门静脉。门静脉解剖变异较少,偶可见右前门静脉支来自门静脉左干。分离门静脉右干应耐心和细心,门静脉壁较薄,存在肝硬化时,门静脉管径增粗,侧支血管增多,更应耐心和仔细。先沿门静脉主干右侧缘向上分离,至门静脉右干后,再以一直角血管钳绕过血管后方,绕过一牵引带后,将门静脉右干轻轻提起,分离出足够长度。此处切忌勉强张开血管钳前端软组织,以免损伤门静脉,确认清楚门静脉分叉处和门静脉右干后,在两血管钳间切断门静脉右干,近门静脉主干端应以4-0血管缝合线连续缝合关闭,远端缝扎(图19-16)。若门静脉右干很短而粗,不能有足够的距离安全地切断,可先行结扎而不切断,待最后在肝内切断。此时,右半肝与左半肝的分界线即可出现。可用电刀沿该分界线直至肝静脉汇合处做出标记。再进一步游离右半肝,注意避免损伤下腔静脉和附于右肝背面的肾上腺及肾上腺静脉;膈肌上的出血应缝扎止血。游离肝右叶,仅余后面与下腔静脉相连。此时,将肝右叶轻轻向前内侧翻转,可显露肝后段下腔静脉和肝背静脉。肝背静脉包括3~5支肝短静脉,主要引流右侧尾状叶和右后叶,其中右后叶下段支较粗大,此处即第三肝门(图19-17)。由于此处肝短静脉较短,翻转分离时易撕裂出血,应予以注意。在肝外处理肝短静脉时,可在两结扎线之间剪断,不要使用血管钳和止血夹。最后在肝实质内钳夹切断。
图19-16 在无创血管钳间切断门静脉右干,近端以4-0血管线缝闭
图19-17 进一步剪开下腔静脉韧带后,便可显露肝右静脉和肝背静脉
肝外切断肝右静脉最为困难。可先在肝上下腔静脉和肝下下腔静脉(肾静脉分支以上)分别绕以束带,以备必要时阻断下腔静脉。显露肝右静脉必须将肝右叶完全游离,包括切断尾叶静脉和下腔静脉前面的肝短静脉。肝右静脉汇入下腔静脉处通常有一层结缔组织膜覆盖,在肝硬变时,此层膜较厚,应用剪刀将其分离;肝右静脉的后侧壁则有下腔静脉韧带相连,也需仔细剪开,方可显露肝右静脉与下腔静脉汇合处。对此处的解剖最为危险。再以一大小和弯曲度合适的无损伤性血管钳绕过肝右静脉,钳夹住肝右静脉根部(可包括部分下腔静脉壁);肝右静脉远侧端应尽量靠近肝脏钳夹,在二钳间切开肝右静脉,近肝端缝扎,近下腔静脉端以4-0血管缝合线双重连续缝合(图19-18)。此时,右半肝已完成无血管化,左、右肝叶之间分界更明显。
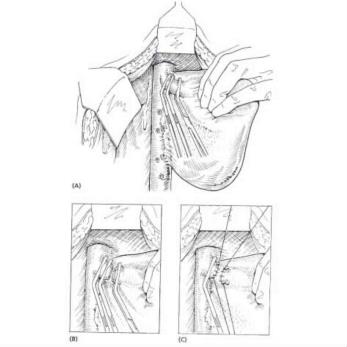
图19-18 肝右静脉远侧端应尽量靠近肝脏钳夹,在二钳间切开肝右静脉,近肝端缝扎,近下腔静脉以4-0血管缝合线双重连续缝合
此时,可在肝右叶后方和上方放置盐水纱垫,使肝右叶移向前下方。沿血供分界线自胆囊窝开始行右半肝切除术。肝实质离断可以使用肝实质离碎技术、挤压法、超声刀等技术和方法。对于肝左叶切面上的肝内管道结构,均应仔细予以钳夹、切断、缝扎,避免术后出血、胆漏等并发症。切除过程中,可配合使用肝十二指肠韧带阻断,以控制出血,减少失血量;切除线也应紧靠门静脉右支和右肝管的残端,以确保所有供应左肝叶结构完好。对于由于技术原因未能在肝外处理的门静脉分支、肝短静脉和肝右静脉,均可留到最后待肝左右叶实质分开后,在肝内处理。
切除肝右叶后,应仔细结扎残留肝断面的管道、出血点,注意有无胆漏。残留肝切面,一般不能直接缝合对拢,多采用大网膜覆盖,局部可采用封闭式负压吸引引流,有学者建议可预防性地放置右侧胸腔引流。
(八)左半肝切除术
左半肝切除术,又称肝左叶切除术,包括第Ⅱ、Ⅲ、Ⅳ肝段切除。尾状叶虽为左半肝的一部分,但标准的左半肝切除的范围通常不含尾状叶。但左半肝恶性肿瘤在行左半肝切除时,则需将其一并切除。
左半肝切除术主要适应于局限于左半肝的良、恶性肿瘤。行左半肝切除时,切除的有功能肝组织约占40%,通常不会发生肝衰。
手术在全麻下施行。病人取仰卧位。取双肋缘下斜切口,可轻度延长右肋缘下切口,以求左半肝与左三角韧带显露良好。开腹后仔细探查腹腔。确定行左半肝切除术后,首先切断肝圆韧带,切开镰状韧带直至肝上下腔静脉与肝静脉汇合处。向两侧剪开部分肝冠状韧带,注意止血,特别是来自膈肌上者,需缝扎止血。以左手将肝左外叶向下方牵引,显露左侧冠状韧带,沿肝左外叶的上缘,切开冠状韧带前叶及后叶,使肝左外叶与膈肌分开。此时,在左手的牵引和钝性分离下,可显露肝左三角韧带予以钳夹,在二血管钳间切断,以丝线结扎或缝扎三角韧带。近膈肌端,应避免过力牵引血管钳,以防断端滑脱缩回肝左外叶较长伸向左上方时,与腹腔上极十分贴近,甚至覆盖脾上极,应注意切忌强力牵引或盲目钳夹,以避免造成脾脏损伤或脾血管断裂出血。将肝左外叶轻轻向右前方牵引翻转,继续予以游离,显露尾状叶与小网膜。继而切断肝胃韧带,以游离肝左叶。注意有小部分病人肝左动脉发自肾左动脉,应予以分离并切断、结扎。
胆囊切除术可选择施行。左侧肝门部的解剖较为复杂,变异较多。显露肝门后,沿肝总管左侧纵行向上解剖,显露左肝管。辨清左、右肝管汇合处后,可钳夹切断左肝管并予以缝扎,但应注意偶有右前肝管或右后肝管可汇入左肝管横部,术中应适当向肝实质内分离显露左肝管,以辨认清楚,尽量靠近左肝管进入肝脏处结扎。切断左肝管后,可清楚显露肝左、右动脉分叉部。在肝左动脉近心端结扎两道,远心端缝扎一道,从中间离断。注意肝左动脉变异更多见,仔细分离后予以相应处理。门静脉左支解剖变异较少,偶可见右前门静脉分支来自门静脉左干横部,尾状叶左门静脉支起自门静脉左干近分支处。切断门静脉左干应在其远端结扎,以保存尾状叶的血供(图19-19)。此时,左、右肝叶间会出现分界线,可用电刀做出标记。
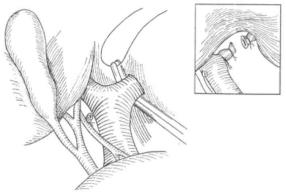
图19-19 断离门静脉左支
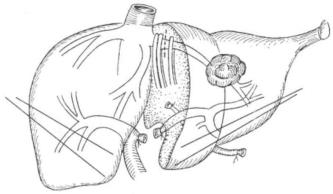
图19-20 断离肝左静脉
也可先预置肝门阻断带,不解剖肝门,按预定切除线切开肝实质,最后分离到肝门时,才钳夹切断进入左肝的管道。此时,各管道系统是在纤维鞘外处理,不需要逐一分离。还可在施行左半肝血流阻断后行左半肝切除。方法为先切开肝门横沟前方之肝包膜,分离肝门板,以一弯血管钳紧贴肝门板在肝横沟后缘穿出,引过肝门阻断带,左手可伸至肝十二指肠韧带后方作为引导,收紧阻断带后,即可控制左肝血流。注意勿损伤肝门板及肝板后重要结构。
将肝左外叶牵向右侧,离断下腔静脉左侧缘表面的桥状肝组织。沿下腔静脉左侧缘分离,显露肝左静脉汇入下腔静脉处,特别注意进入下腔静脉的细小肝短静脉支,应仔细予以缝扎。用特制的弯曲的血管钳夹住肝左静脉近下腔静脉根部,注意前端应自肝左、右静脉间的裂隙中穿出,切勿损伤肝右静脉、肝中静脉,再用一血管钳钳夹肝左静脉近肝实质端。在两钳间切断肝左静脉(图19-20)。近下腔静脉端,以4-0血管缝合线连续缝合关闭。由于肝左静脉走行位置表浅,也有学者在肝脏上缘,镰状韧带左缘处,以长圆弯针作深“8”字缝合1针,以缝闭肝左静脉,减少手术中切开肝实质时的出血,最后在肝实质内钳夹,切断肝左静脉。
肝左叶的切除自胆囊窝开始,沿血供分界线(即正中裂)的左缘进行,以保护右肝结构和肝中静脉免受损伤。可采用多种方法相配合分离肝实质,对肝切面所遇到的肝内管道,均需逐一钳夹、切断、结扎。术中需要切断肝中静脉的左侧分支,若不慎损伤肝中静脉主干,出血难以控制时,可结扎肝中静脉,一般无不良后果。切除左半肝后,残留肝切面应注意缝扎止血,避免出血、胆汁漏。可在残留肝切面边缘行一连续褥式缝合,缩小切面面积。切面用大网膜覆盖,左膈下及肝断面处,应放置引流管,连接负压吸引。
(九)大血管旁的肿瘤切除
第一、二、三肝门处的肝脏肿瘤,特别是恶性肿瘤,与大血管关系密切,位置常较深,局部解剖复杂,手术切除难度较大,特别是在肿瘤与血管粘连紧密,甚至侵犯大血管时,手术常无法进行。临床上此类肿瘤手术切除率较低。
1.第一肝门部肝癌 第一肝门部肝癌,包括左、右肝门处的肝癌,与门静脉和肝胆等分支关系密切。可根据肿瘤的大小、位置以及转移、浸润等情况相应选择左半肝切除术、右半肝切除术、扩大左肝叶切除术或扩大右肝叶切除术。此处不再叙述。对于早期发现的小于5cm的小肝癌,若仍限于局部并有明显边界,或有类似包膜的表现,可行局部切除术。术中根据探查发现,配合术中B超、对小肝癌进行定位。再在肝门阻断的配合下,切开肝实质,钝性分离至肿瘤。在肿瘤的纤维包囊之外进行分离,将其从周围血管、胆道表面分离、切除,可以达到根治性切除的效果。这种手术要求手术者对肝内各重要管道解剖十分熟悉,并根据实际情况灵活掌握,难度较高。
2.第二肝门部肝癌 第二肝门是指主要肝静脉汇入下腔静脉的部位,此处肝脏肿瘤常影响肝静脉和下腔静脉。早期小肝癌常有纤维性包囊,可与肝静脉、下腔静脉分离、切除。但在较晚期肝癌由于肿瘤浸润,侵犯血管,一般难于切除,而且难以达到根治性目的,需选择其他非手术性治疗方法。因此,术前必须进行仔细的影像学检查,明确肿瘤与血管关系,决定治疗方式。
(1)第Ⅱ肝段内侧部肝癌 第Ⅱ肝段的肝癌一般采用肝左外叶切除术治疗。但在部分已行右侧较广泛的肝切除,或右肝因病变而纤维化、缩小的病人,此时肝左外叶呈代偿性增大,切除肝左外叶会严重影响肝功能。此时,则可以选择第Ⅱ肝段切除或局部切除。
手术时,首先切断肝圆韧带,剪开镰状韧带、双侧冠状韧带及左侧三角韧带,充分游离肝左外叶;分离第二肝门裸区,显露肝上下腔静脉的前面及肝左静脉汇入下腔静脉处。以血流阻断带阻断肝门,或行左半肝血流阻断。提出肝左外叶,按第Ⅱ、Ⅲ段之分界,用电刀做出标记;第Ⅱ肝段与第Ⅳ肝段以镰状韧带分界,手术切除时,在保证距离肿瘤1.0~2.0cm的情况,切缘应尽量靠左。沿标记线向第二肝门处切开肝实质,采用肝门阻断法控制出血。切面上通向第Ⅱ肝段的管道,应逐一钳夹切断、结扎。继续向上分离,遇到引流第Ⅱ肝段至肝左静脉的静脉支时,保留肝左静脉主干,结扎该静脉支,钳夹切断余下的肝实质,切除第Ⅱ肝段。若肿瘤贴近肝左静脉主干,或下腔静脉时,应予以仔细解剖,在肿瘤包膜外分离;若已有肝左静脉主支侵犯,则需行肝左叶切除术。
(2)第Ⅳ肝段顶部肝癌 第Ⅳ肝段肿瘤可采用肝中叶切除术治疗。顶部的肝癌与下腔静脉和肝左、右肝中静脉汇入部关系密切,手术中可能损伤下腔静脉和肝静脉,手术难度较高。特别是肿瘤较大,或侵犯肝静脉根部、下腔静脉时,手术非常困难。早期小肝癌一般不至侵犯大血管,故可行局部切除。
手术切口可采用双侧肋缘下斜切口,中线向上延伸并切除剑突,以充分显露膈下区。切断肝圆韧带,切开镰状韧带及左、右冠状韧带,充分显露肝上下腔静脉与肝静脉汇合处。肝门部可放置阻断带备用。可用术中B超检查,判断肿瘤与血管的关系。用电刀标出肿瘤外周肝实质切除范围,用钝性分离或超声刀等方法,从肿瘤下缘开始,逐步向上分离,注意保护主要肝静脉,特别是肝右静脉。钳夹结扎出血处,直至分离至肿瘤背部,仔细将其与深部的静脉分离,切勿损伤肝静脉。最后,切除肿瘤组织。术中注意止血,钳夹时不宜过深,以防损伤深部肝静脉。
3.第三肝门部肝癌切除术 肝脏背面的腔静脉沟内有数目不等的肝短静脉引流至下腔静脉,较粗大的有右后下肝静脉及肝尾叶静脉等,称第三肝门。第三肝门肝癌是较为特殊的肝右后叶肝癌,尤其对于位于肝右静脉主干与下腔静脉夹角之间的肝癌,位置深,且与众多肝静脉相毗邻,手术切除相当复杂,最好有术中B超检查配合手术以准确了解肿瘤与肝右静脉和下腔静脉的关系。
手术在全麻下进行。病人取仰卧位,右侧抬高约30°。取双肋缘下斜切口,进入腹腔经过探查决定做切除手术后,剪开肝镰状韧带及两侧冠状韧带,充分游离肝右叶。向前掀起肝右叶,游离至下腔静脉,仔细分离右肾上腺与肝右后叶的粘着,保存右肾上腺静脉。若右肾上腺的包膜与肝后部肝癌粘紧,可以切除肾上腺的包膜和部分皮质层,以免引起术后早期右肾上腺的转移癌。在肝上下腔静脉和肝下下腔静脉(肾静脉开口的上方)以及第一肝门部安放阻断带,以防术中损伤肝静脉时可以行全肝血流阻断。
术中必须充分游离肝右叶和显露肝右静脉。手术时紧贴着肝右叶的表面,剪开覆盖的一层纤维组织,然后逐步向上方进行,便可以显露肝右静脉壁。沿下腔静脉右侧缘向上分离,逐步结扎肝右叶背部肝短静脉支,包括右后下肝静脉支和右侧尾状叶静脉(图19-21),特别注意游离结扎肝右后下静脉时,应放松肝脏的牵引,以免过分用力翻转使其受损或撕裂下腔静脉。肝右叶与下腔静脉分离后便可以部分向上翻开,显露肝脏背面的肿块和肝右静脉与下腔静脉的夹角,此时可对肝右静脉下缘和深面小心地分离。
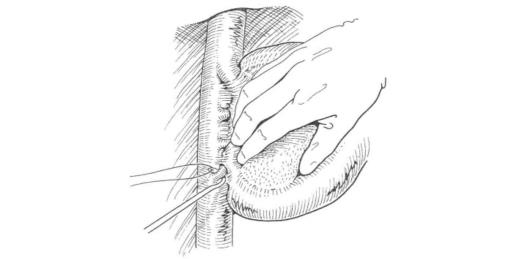
图19-21 沿下腔静脉右侧缘向上分离,逐步结扎肝右叶背部肝短静脉支,包括右后下肝静脉支和右侧尾状叶静脉
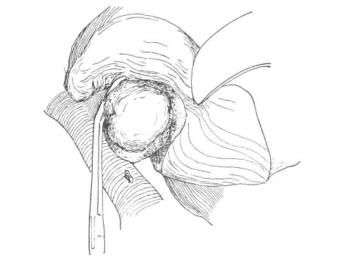
图19-22 微波凝固肝癌周围之切线
于肝门部阻断肝血流(亦可用右半肝血流阻断)后,分离肝实质至与肝右静脉相连处,以无创血管钳钳夹控制肝右静脉与瘤相黏处,切除肿瘤,然后修复肝右静脉的切口和其分支的断端(图19-22)。若肿瘤与肝右静脉的关系很密切,其间并无安全的界限,作部分钳夹阻断时,亦可以将肝右静脉完全钳夹阻断甚至部分下腔静脉,再将肿瘤从肝右静脉分离切除,最后修复肝右静脉和结扎可能被切断的肝右静脉分支。
注意术中靠近肝右静脉和下腔静脉的血管残端均需以血管缝合线连续缝合,肝脏切面注意出血并充分引流。
对于第一、第二及第三肝门部的巨大肿瘤,由于肿瘤紧贴、压迫,甚至侵犯主要出入肝的血管及肝段下腔静脉,用传统肝切除术难以切除肿瘤,可采用体外肝脏病灶切除剩余肝脏原位植入术。此手术是以肝移植术为主要实践根据而设计的,可以提高对肿瘤的切除率,增加对肿瘤切除的彻底性,手术大约分为三步:①全肝切除移至体外。②体外肝脏病灶切除及剩余肝修复重建。③自体余肝原位植入。此种术式操作多而且复杂,手术费时,术中一般需采用静脉转流技术,解决门静脉和下腔静脉系统淤血问题,因此,适应证必须严格掌握。(易继林)
第六节 门静脉高压症
门静脉高压症是由于各种病因使肝脏门静脉系血流受阻,引起门静脉系压力增高(正常门静脉压力在1.27~2.35k Pa之间,平均值为1.76k Pa)至2.45kPa时,而产生一系列症状。这时门静脉系血液淤滞,导致脾胃区和肠区内脏血流缓慢淤滞。临床上表现肝脾肿大和脾功能亢进,腹水及食管胃底静脉曲张或/和呕血、便血等症状。具有这些症状的疾病统称“门静脉高压症”。门静脉高压症时,门静脉压力多增至2.94~4.9kPa,当门静脉压高于3.43kPa时,常可发生曲张静脉破裂大出血,不予处理,死亡率达25%~70%。
一、病 因
门静脉高压症是由各种不同病因所引起的(表19-4)。国内以肝硬化的病因最为常见,约占90% ~95%,其中又以肝炎后肝硬化多见,门静脉性肝硬化,长江流域血吸虫病流行区以血吸虫病肝纤维化为主。其他肝外门静脉阻塞(如门静脉先天性闭锁或狭窄,门静脉海绵样病化及门静脉栓塞等)很少见,其中大多数为儿童。而在国外,如美国,门静脉高压症85%由肝硬化所引起,而最常见的病因是酒精性肝硬化,其次为坏死后性肝硬化,再其次为胆汁性肝硬化。其他肝外阻塞原因亦很少见。
表19-4 门静脉高压症的常见病因

二、分类及发病机制
门静脉高压症的分类方法很多,临床常用的分类是分为肝内型和肝外型,前者临床常见。
(一)分类
1.肝内型 门静脉高压症肝内型主要病理表现是肝硬变或门静脉周围纤维化,按梗阻部位和病理形态不同又可分为窦前阻塞和窦后阻塞两种。前者常见原因是血吸虫病肝纤维化,后者常见原因在国内是肝炎后肝硬化。
血吸虫性肝纤维化的特点,早期是虫卵栓塞肝小叶间汇管的门静脉小分支,引起门静脉内膜炎和其周围的纤维化,使门静脉血流受阻,门静脉压增高。到晚期,继发肝细胞营养不良和肝小叶萎缩及肝细胞结节再生,肝脏代偿性肿大,以肝左叶增大明显。血吸虫病肝纤维化对肝细胞的损害较轻,肝功能影响相对较轻,不论施行脾切除术、断流术或分流术,远期疗效均较满意。血吸虫病肝纤维化主要发生在长江流域的少数血吸虫病流行区。
肝炎后肝硬化是肝内型窦后阻塞最常见的病因,主要病变特点是在肝实质大片坏死的基础上形成的坏死后性肝硬化,肝实质的坏死塌陷处有大量的结缔组织增生和肝细胞再生表现,使肝小叶内肝窦变窄或闭塞,使门静脉血流不易流入肝小叶的中央静脉,血流淤滞导致门静脉压增高。由于是窦后阻塞可使肝小叶间汇管区的动静脉交通支开放,部分肝内动脉血直接流入门静脉小分支,使门静脉压更加增高,减少了门静脉血的向肝灌注量。窦后阻塞也是导致肝内淋巴网受压迫扭曲,从而使肝内淋巴液回流受阻,肝内淋巴管网的压力明显增高,这对门静脉压的增高也有影响。这种肝细胞坏死的肝硬化,肝实质受损害较重,肝脏萎缩较明显,严重者,手术中扪及肝右叶仅如手掌样大小,这样肝脏的代谢功能和再生受到明显影响,肝脏的代偿能力明显受到影响,一旦发生上消化道大出血,或手术创伤,尤其是门体分流术后,常易发生肝性脑病和肝功能衰竭,从而影响了手术的近远期疗效。
2.肝外型 肝外型门静脉高压症不论在国内外均为少见,约占5%~10%。根据阻塞的部位不同,又分为肝外窦前型和肝静脉流出道梗阻型。
肝外窦前型阻塞可发生在门静脉主干的任何部位。常见原因是由于门静脉主干炎症和血栓形成或/和有脾静脉血栓形成,这种肝前阻塞同样使门静脉系血流受阻,门静脉压增高。这类型门静脉高压症的门静脉小分支及窦状隙内压力较低,在门静脉阻塞部位周围可迅速产生侧支循环,血流进入肝内门静脉循环,足以代替正常肝的门静脉血流。常见的病因有腹腔内感染,如阑尾炎、胆囊炎等;门静脉和脾静脉附近的创伤引起门静脉主干的血栓形成;门静脉先天性闭锁或狭窄及海绵样变形。这类肝外型门静脉高压症病人常是儿童或少年,无肝脏损害,健康情况良好,能很好地耐受其循环紊乱的并发症和外科的手术治疗,近远期疗效较理想。
肝静脉流出道梗阻型门静脉高压症较罕见,柏-希(Badd-Chiari)综合征。
(二)发病机制
门静脉高压症的发病机制经近百年的实验和临床研究,逐渐形成三种主要理论体系,即“肝脏结构紊乱学说”、“内脏循环高动力学说”及“递质代谢障碍学说”。
肝脏结构紊乱学说的主要理论根据是,临床多数门静脉高压症患者均伴有各种不同类型的肝硬化,引起门静脉流出道梗阻,使门静脉压力升高,导致门体侧支循环开放,其中食管胃底静脉曲张形成,是导致上消化道大出血基本的局部因素。门体分流术基于这种理论,用降低门静脉压力,达到降低食管胃底曲张静脉压力,预防和治疗门静脉高压症及其上消化道出血。
内脏循环高动力学说,随着对门静脉高压症血液动力学实验和临床研究的深入,发现肝脏结构紊乱学说不是唯一发病机制,Carter发现肝硬变时肝内门静脉和肝静脉称重分别减少25%和51%,而肝动脉却比正常增加15%,说明肝硬化时肝内存在动静脉短路及肝动脉血流量增加。临床用超声多普勒测定门静脉高压症患者的门静脉和脾静脉的血流量高于正常人,还测定心脏指数的结果是心排出量增加,全身动脉系统扩张,阻力下降。说明门静脉高压症病人处于内脏循环高动力状态,用药物心得安可明显拮抗内脏高动力循环,达到降低门静脉压力,预防和治疗门静脉高压症出血。
递质代谢障碍学说的主要理论依据是,肝硬化时肝脏功能受损以及其他原因引起体内许多神经介质、激素等液递物质代谢障碍,导致全身和内脏的血液循环紊乱,引起门静脉血流量增加和阻力升高,形成门静脉高压症。黄萃庭等在动物模型和肝硬化病人血液中证实多种液递物质(如胰高血糖素、胃泌素、雌激素和血管扩张素等)比正常人高,它们在门静脉高压症形成的过程中起着非常重要的作用。其中起主要作用的物质是胰高血糖素,它是引起内脏循环高动力状态的激素。目前,正在深入研究液递物质在治疗门静脉高压症中的作用,探索治疗门静脉高压症的新方法,尤其是发现和选择有效的药物治疗门静脉高压症,以开辟新道路。
三、门静脉系统组成和特点
门静脉高压症并发食管胃底曲张静脉破裂大出血,选用外科手术方法很多,主要分为分流术和断流术。为减少术中的失误和术后并发症的发生率,提高手术疗效,临床普外医生必须熟悉门静脉高压症具有独立门静脉系统循环的特点和门奇静脉之间反常血管解剖特点。
1.门静脉的组成 成人门静脉主干长约7~8cm,内径1.0~1.4cm,在门静脉高压症时内径扩张至1.5~2.0cm。门静脉是由肠系膜上静脉和脾静脉(含肠系膜下静脉)在胰腺头部颈部交界的后方,相当于第二腰椎水平汇合。然后斜向右上方,并经过十二指肠第一部后方,进入肝十二指肠韧带内,在网膜孔前方上升到肝门,分成门静脉左、右支,分别进入肝脏左、右叶。肝动脉和胆总管分别位于它的前方左右侧,下腔静脉在其后方,多数与门静脉中上部成交叉关系,提供了门腔静脉侧侧分流术的局部解剖学基础。有少数存在门静脉后动脉,代替肝右动脉(5.7%)和肝总动脉(1.7%),它们起源于腹腔动脉或肠系膜上动脉。遇到这些粗大的门静脉后动脉存在,不利于门腔静脉分流术的操作,只好放弃这种分流术。这些动脉多数是迂曲的细小动脉,不是供给肝脏某一区域的动脉,只要结扎处理这些动脉,仍可进行分流术。门静脉通过胃冠状静脉、胃右静脉、幽门静脉、副胰静脉及胰十二指肠静脉及胆囊静脉等,接受来自胃大部分、十二指肠、胰头及胆囊的血液。因此,在施行门腔静脉分流术时,必须仔细处理这些小静脉,以免损伤引起出血(图19-23)。
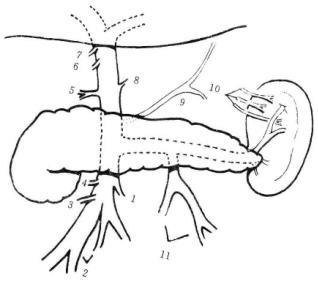
图19-23 门静脉系统属支
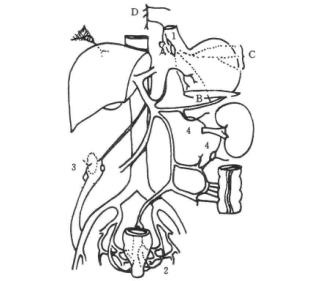
图19-24 门腔静脉系间的交通支
脾静脉:成人脾静脉主干长度平均为9.56(5.5~10)cm,直径平均为1.1(0.4~0.9)cm。在门静脉高压时可扩大延长,扭曲呈曲张静脉球状或团状,直径可达2cm以上。脾动静脉常伴行,脾静脉行径比较恒定,多数位于脾动脉下方及胰腺后横沟中。胃左静脉35%~60%汇入脾静脉,胃短静脉回流入脾上叶静脉或脾上极静脉共占89%;另11%回流入脾静脉主干。胃后静脉出现率为62%~80.6%,汇入脾静脉者为63.2%,汇入脾静脉上极支者为32%。胃网膜左静脉多数汇入脾静脉,少数汇入脾下叶静脉。脾静脉接受胰体尾静脉支约3~13支,平均为7支。肠系膜下静脉沿脊柱左侧上行汇入脾静脉。脾静脉主要接受上半胃、胰体尾及降结肠、乙状结肠和直肠的血液。
肠系膜上静脉:肠系膜上静脉是门静脉系统中最大的属支,通常位于肠系膜上动脉的右侧,收集其属支有胃网膜右静脉、中结肠静脉、右结肠静脉及回结肠静脉,其左侧属支为小肠静脉。Gi Hot将肠系膜上静脉与脾静脉汇合点至回结肠静脉分出处之间的一段静脉称为“外科干”。外科干长度2.2~9.0cm,平均5.6cm。其直径0.5~1.6cm,平均1.15cm。Holyoke认为分流术理想的外科干应具备4个条件:①长度至少应有2cm且无栓塞。②前方及吻合口附近无分支。③外科干前后方无肠系膜上动脉的分支跨过。④动静脉之间应无太多的重叠。而胃网膜右静脉和右结肠静脉合干者较多,称为Henle干。只有这样理想的血管条件适合作肠腔静脉分流术(图19-24)。
2.门静脉的特点 门静脉系统是无瓣的静脉,它的两端均属毛细血管网,但门静脉系统的压力不是均匀一致的,脾胃区的静脉压高于肠区静脉压。门静脉系统在身体内构成独立的循环系统,它与体循环之间发生以下交通支,具有重要的临床意义(图19-25)。

图19-25 外科干属支示意
(1)胃左(冠状)静脉:有多个分支:贲门食管支(食管支、高位食管支或/和异位高位食管支,后者来自胃左静脉或门静脉左支)。胃左静脉主干、食管支、高位食管支及多异位高位食管支均位于胃胰壁内,高位食管支平均距贲门上6.14±3.89cm入食管肌层,多数异位高位食管支在更高位置进入食管肌层右侧,少数入食管后侧及左侧。肝内型门静脉高压症发生胃左静脉及属支曲张率达90%,其出血发生率为60%。而胃底静脉曲张率约60%。
(2)胃短静脉和胃网膜左静脉及胃后静脉:它们是脾静脉的属支,是引起胃底静脉及左侧血管静脉曲张的主要因素之一。胃底浆膜的曲张静脉直径为0.4~1.2cm,胃底黏膜下曲张直径从0.3 ~3.0cm。曲张呈静脉球状。左侧食管胃底曲张静脉发生率达60%,其曲张静脉破裂出血发生率为30%。
(3)脐旁静脉:门静脉血流经脐旁静脉与腹壁上静脉和腹壁下静脉连接,分别流入上腔静脉和下腔静脉。门静脉高压时,这些静脉可曲张而形成海蛇头状脐周静脉曲张(Caput Medusae)或克-包综合征(Cruveillvier-Baumgarten Syndrome)。
(4)直肠下端、肛管交通支:门静脉血流经肠系膜下静脉、直肠上静脉与直肠下静脉、肛管静脉吻合,流入下腔静脉。临床上发现门静脉高压症病人中49%有内痔。
(5)腹膜后交通支:在腹膜后,有许多肠系膜上、下静脉分支与下腔静脉分支形成多个交通支,称为雷济厄斯(Retzius)静脉丛。这些交通支可使腹膜出现明显的类似葡萄酒色痣样色素斑,在肝硬变病人手术时易出血。
(6)异位曲张静脉:近来有不少报告罕见部位如十二指肠、结直肠及小肠的曲张静脉称为异位曲张静脉。近年来由于广泛采用硬化剂注射预防和治疗门静脉高压症合并食管曲张静脉及其出血者,阻断了门体头向侧支,促进了门体尾向侧支的开放,导致异位曲张静脉日益增多。其中以十二指肠球部最常见,结直肠次之,小肠最少见。
3.贲门区曲张静脉的特点 通过手术中的观察和研究贲门区(食管下段和胃底)曲张静脉的解剖组成和组织结构的进展,也是促进各种门奇断流术式发展的重要因素之一。
Yammamoto将贲门区切除进行组织学研究,发现此区有三组静脉丛,即浆膜外曲张静脉丛、肌层内曲张静脉及黏膜下层曲张静脉丛三组。以贲门为界,愈近贲门黏膜下曲张静脉扩张愈明显,远离贲门后黏膜下曲张静脉逐渐减轻。因此,完全的门奇阻断术必须阻断这三组曲张静脉丛。这就是各种联合断流术方法及食管胃底切除术的解剖学基础和组织学基础(图19-26)。
食管胃底曲张静脉出血的部位是研究的重点。Spence通过显微影像方法研究证实,食管曲张静脉发生出血多在下段末3~5cm。其原因是该处曲张静脉分布在黏膜固有层中丰富,曲张静脉的数目和面积均超过食管近端和胃底。相反,后者曲张静脉主要分布在黏膜下肌层和肌层间。食管黏膜上皮层中有扩张血窦样通道与固有层中曲张静脉相交通。因充血和缺氧使食管黏膜萎缩,此种血窦样通道与食管腔之间仅有几个细胞间隔,内镜下所见樱红点、红斑、血窦点和弥漫性泛红黏膜损害。这就是食管末段3~5cm处是出血好发部位的原因。
通过临床观察,门静脉高压症病人出血还有其他原因:胃及十二指肠溃疡、门静脉高压性胃黏膜病变、食管溃疡及食管黏膜撕裂征以及异位曲张静脉出血等,其发生率为20%~50%。这是由于胃黏膜屏障功能发生障碍,其原因是黏膜下动静脉瘘形成,使胃黏膜小动脉壁增厚,小静脉动脉化,使胃黏膜有效血流量减少,又因肝功能受损,使肝脏灭活功能下降,进一步促使胃黏膜对酒精、胆酸或水杨酸等有害物质的敏感性增加,容易发生出血。
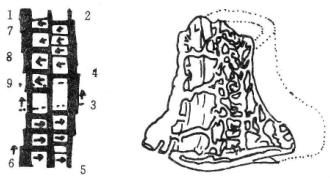
图19-26 贲门反区血流方向及三层静脉丛
四、诊断与鉴别诊断
门静脉高压症病人典型的临床表现是食管胃底静脉曲张、脾肿大和脾功能亢进及腹水,诊断并不困难,大多数平诊病人是这样。然而不少患者是由于急性上消化道大出血如呕血或黑便(或血便)急诊就诊,要正确诊断上消化道出血是来自食管胃底曲张静脉破裂出血,必须肯定地回答:①病人有肝硬变吗?②病人有门静脉高压症和食管静脉曲张吗?③出血是静脉曲张破裂引起或是非曲张静脉所致?根据下列步骤是可以作出正确诊断和鉴别诊断。
(一)病史和体格检查
这是诊断三要素中最基本的要素。多数病人有慢性肝炎、血吸虫病、呕血或黑便及腹水等病史。而无消化性溃疡等其他症状病史,这就初步揭示肝硬化门静脉高压症的可能。体格检查发现有营养不良、贫血面容、蜘蛛痣、掌红斑、腹壁静脉曲张、肝脾肿大、腹水及水肿等部分或多数阳性体征,更提示肝硬化或/和门静脉高压症。
(二)实验室检查
通过实验室检查一系列的结果,可以诊断肝硬化是否存在,并初步确定肝硬变是早期或中晚期,是否有慢性活动性肝炎存在,为手术提供参考指数。
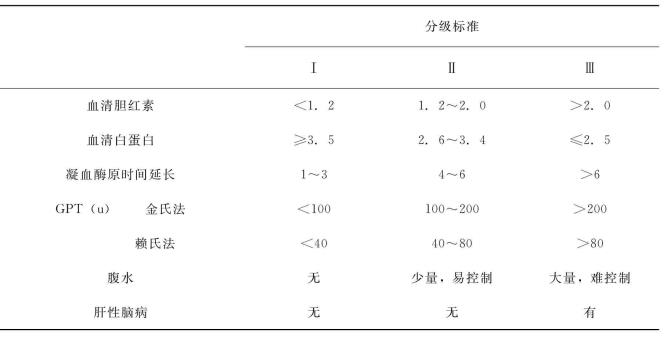
化验检查:乙型肝炎三系(HBs Ag、抗-HBs、HBeAg、抗-HBe、抗-HBc、抗HBc-lg M)、黄疸指数、胆红质、胆固醇、血清蛋白电泳、白蛋白、球蛋白、麝香草酚浊度、硫酸锌浊度、碱性磷酸酶、谷丙转氨酶(GPT)、谷草转氨酶、血氨、钾、钠、氯、钙、锌、铜、铁、甲胎蛋白(AFP)、血糖、尿素氮、肌酐、二氧化碳结合力、出凝血时间、血常规、血小板计数、凝血酶元时间、纤维蛋白原、凝血相及糖耐量、磺溴酞钠(BSP)、吲哚氰绿(ICG)试验等。肝功能检查结果分级见表19-5~表19-7。
表19-5 Child分级

表19-6 肝脏指数分级法
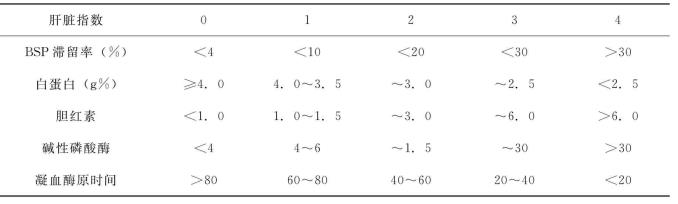
表19-7 我国门静脉高压症肝功能分级
(三)超声波检查
应用B超观察肝脏、脾脏的大小及病变的程度,测量门静脉主干及主要分支和肝动脉的直径、腹水的程度。彩色多普勒可观察肝内血管行走及分布,测量肝动脉、门静脉、脾静脉,肠系膜上静脉和胃冠状静脉的直径、血流速度及血流量;还可了解是否有肝前型门静脉高压症存在,如门静脉血栓或海绵样病变等,为分流术提供参考依据。
(四)食管、胃、十二指肠镜检查
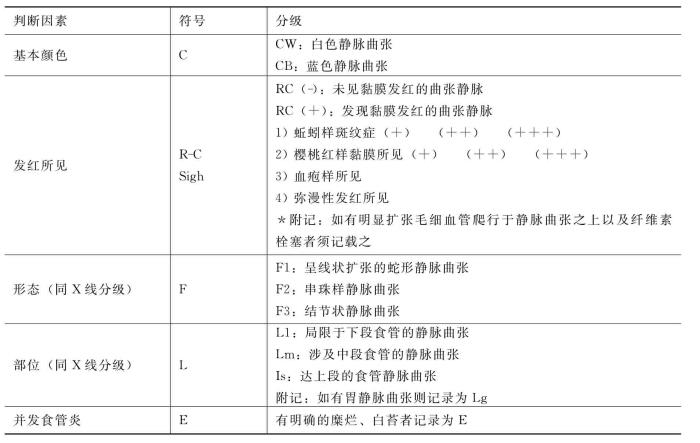
随着可屈性纤维食管胃镜的发展,病人能较好地耐受内窥镜检查,此法操作简单,急诊病人可在病人床边进行。平诊病人可以确定是否有食管胃底静脉曲张存在和曲张静脉的程度,为了对曲张静脉易出血性作出评价,日本门静脉高压症研究会经过多年努力,于2026年规定静脉曲张内窥镜所见记载的标准(表19-8)。
一般认为蓝色静脉曲张出现蚯蚓样红斑症(++、+++)、樱桃红样黏膜(++、+++)、血疱样改变,是易出血的危险信号。曲张静脉的直径大者较小者容易出血。除食管胃底静脉曲张,还可确定是否有其他疾病存在,若为急诊出血病人则可明确出血是来自食管胃底曲张静脉破裂出血约占30%~50%,并可立即施行硬化剂注射疗法。门静脉高压症病人合并上消化道出血其他常见原因有胃、十二指肠溃疡出血约占10%~30%,门静脉高压症的胃黏膜病变出血约占18.2%~22.3%,其次是食管溃疡或炎症、贲门黏膜撕裂综合征等。近来也有不少报道异位曲张静脉破裂出血的病例,最常见部位是十二指肠、胆道,结肠次之,空肠少见。我们曾遇到1例盲肠曲张静脉出血和直肠曲张静脉出血2例。
表19-8 食管静脉曲张的内窥镜诊断标准
(五)上消化道钡剂检查
一般不作急诊上消化道的钡餐造影检查,多数是在出血停止后3~5天可进行病人吞钡X线检查,90%病人显示食管静脉曲张或/和胃底静脉曲张存在,并可确定是否同时有消化性溃疡存在。平诊病人作钡餐X线检查显示食管曲张静脉的程度和累及范围,用来预测曲张静脉破裂出血的可能性,提供是否需要治疗以及适合于非手术疗法还是手术疗法的参考,亦可作为外科手术疗效的评价或再复发出血的预测。一般将食管静脉曲张程度分为三度。
1.轻度 食管曲张静脉限于食管下段,表现为黏膜皱襞增宽,略有凹凸不平或稍有迂曲。管腔边缘略不平整,可见多发性小凹陷或呈锯齿状边缘。钡剂通过顺利。
2.中度 食管曲张静脉累及中下段,静脉增粗迂曲而突入管腔内,正常平行黏膜消失,出现小的圆形或环状透亮区,串珠状或蚯蚓状充盈缺损。食管收缩欠佳,排空稍延迟。
3.重度 食管曲张静脉扩展到全食管,由于肌肉退化,食管明显扩张,不易收缩,腔内出现大小、形状不一的圆形、环状或囊状的充盈缺损,多数缺损相互衔接如虫蚀状或曲张影像。食管收缩明显减弱,钡餐排空延迟。
多数外科医生认为中度和重度食管曲张患者,可作预防性手术。因为预防性手术再出血远远低于内科组,甚至我们在临床观察遇到不少轻度食管曲张静脉患者在内科治疗期间突然发生食管胃底曲张静脉破裂出血,认为保守治疗可控制出血,未及时急诊手术而因出血继发肝昏迷死亡的教训。
(六)血管造影
选择性经股动脉插管作腹腔动脉或肠系膜上动脉造影可显示静脉相,但因摄片时间掌握不佳而致门静脉显影不满意。华中科技大学同济医学院附属同济医院于20世纪80年代开展数字减影血管造影(Digital Substraction Angiography,DSA),能通过微机进行图像处理,使图像分辨率增强。这样DSA能依连续显示动脉相、毛细血管相和静脉相(门静脉、脾静脉、肠系膜及曲张的胃冠状静脉),并清楚地观察造影剂在门静脉内流动的动态情况,对鉴别门静脉高压症的类型、明确出血的部位以及门静脉疾病的诊断很有帮助,同时为手术选择提供依据。
(七)MRI检查
磁共振成像(magnetic resonance imaging,MRI)是利用原子核在磁场内产生共振的原理,加上射频脉冲激励而产生信号,经计算机处理重建成像的新技术。通过磁共振血管造影,采用Siemens 1.5T磁共振仪测定门静脉、脾静脉、肠系膜上静脉及侧支循环曲张静脉的直径和流速流量的改变,有助于术前手术方式的选择与术后手术效果的评价,可提供无创性的重复检查,可作为判断远期疗效的依据,也可以为判断术后再出血手术的原因及再次手术的方式提供依据。对门静脉海绵样变及术后门静脉血栓形成的诊断比彩色多普勒超声准确。
(八)三腔二囊管压迫止血
急性上消化道大出血病人因血液循环不稳定,或无急诊纤维胃镜检查经验,应用简单的三腔二囊管压迫食管胃底出血停止,食管吸液中无新鲜血液,基本确定为食管胃底曲张静脉破裂出血,气囊填塞法既作暂时止血措施,又是一个简单的鉴别诊断方法。
典型的门静脉高压症临床表现,结合实验室检查,一般诊断是不困难的。通过一些特殊检查,如超声检查和钡餐X线拍片,不但可以确定是否有食管胃底静脉曲张存在,而且帮助诊断门静脉高压症的类型。门静脉高压症病人发生急性上消化道出血,通过简易的三腔二囊管填塞可以初步鉴别,再进行急诊纤维食管胃镜检查,既可确定出血的部位,又可确定或排除其他常见的消化道出血疾病,还可行硬化剂注射疗法,暂时停止曲张静脉出血。前述检查步骤既可作为诊断方法,又可作为鉴别诊断方法,还可以作为急救的治疗措施。像超声检查和血管造影检查,不但确定门静脉高压症类型和血液动力学指标,还提供了作分流术或断流术的指征。
(九)肝脏代偿能力的评价
门静脉高压症严重程度主要依据肝脏硬化程度而定,评价肝脏硬化的程度及代偿能力指标较多,这些指标对指导手术方法的选择和预后的评价是很有意义的。
1.肝功能分级 主要有下列三种分级方法供参考。
(1)Child分级:依据5项指标将肝功能分为A级(轻度)、B级(中度)及C级(重度),临床广泛应用(表19-5)。
(2)肝脏指数分级:根据5项指标进行分级,0~2级为肝功能轻度损害,3级为中度损害,4级为重度损害(表19-6)。
(3)我国肝功能分级:我国主要是肝炎后肝硬变,与国外酒精性肝硬化不同。为此,2026年中华医学会外科分会,在武汉制定了我国门静脉高压症肝功能分级标准(表19-7)。
2.肝血流量指标评价 血液动力学研究结果证实,门静脉向肝血流愈少,离肝血流愈多,肝脏的代偿能力愈差,手术后死亡率高,肝功能衰竭或肝性脑病(分流术后)发生率愈高,远期生存率愈低。
(1)Warren分期:根据测定自由门静脉压(FPP)、肝侧门静脉闭塞压(HOPP)、脏侧门静脉闭塞压(SOPP)、肝脏门静脉最大灌注压(MPP)及肝静脉楔压(WHVP)的结果,将肝硬化门静脉高压症分三期(表19-9)。
表19-9 Warren血流动力学的分期

第Ⅰ期 阻断门静脉时,HOPP明显下降,SOPP上升,MPP值最大。说明肝脏门静脉血流量灌注较多,门静脉血液动力学改变最少,肝硬变属早期,肝功能尚正常,适合断流术,不适宜分流术。因门腔分流术后,全肝血流量明显下降,术后肝性脑病发生率高。
第Ⅱ期 门静脉高压介于第Ⅰ与第Ⅱ期之间,门静脉阻断后两侧压力的变化不显著。全肝血流量中度下降,肝动脉代偿较好,适合分流术。
第Ⅲ期 门静脉血流是离肝的,肝窦的血流灌注主要由肝动脉供给。分流术后血液动力学改变不大,但进一步加重肝脏的损害,适合于断流术。
(2)Smith分期:Ⅰ期,门静脉灌注良好。Ⅱ期,门静脉灌注受限,但肝动脉灌注良好。Ⅲ期,门静脉与肝动脉灌注均明显减弱(表19-10)。
表19-10 Smith分期

注:K值为每分钟全肝血流量占每分钟心输出量的百分率。
如术前估计全肝血流量K值基本正常者,不宜作门腔静脉分流术,应作选择性分流术或断流术。
3.血管造影指标的估计 肝血管造影,可动态直接观察影像,了解肝脏血流灌注的情况,对估计肝脏代偿能力有一定价值。但血液动力学和造影分期有其局限性和缺点,故目前临床上采用较少。
(1)肝动脉造影:一型,肝内动脉稍有异常和狭窄。二型,肝内动脉轻度屈曲,肝固有动脉增粗。三型,肝内动脉中度屈曲,肝固有动脉扩张,肝脏缩小。四型,肝内动脉重度屈曲,肝固有动脉变细,肝脏明显缩小。一型及二型适合作分流术,三型及四型适合作断流术。
(2)脾门静脉造影:Ⅰ期,造影剂全部或大部均流向肝脏,门静脉充盈良好。Ⅱ期,造影剂入肝受限,部分流向侧支静脉。Ⅲ期,造影剂入肝严重受限,大部分造影剂进入侧支静脉。Ⅳ期,造影剂全部进入侧支静脉。Ⅰ期和Ⅱ期可作分流术,Ⅲ期及Ⅳ期应作断流术。
(3)肝静脉楔入造影:根据造影剂在肝窦和门静脉充盈的程度和血流方向分为下列几种:①正常,即肝窦床充盈良好,门静脉系统不显影,②门静脉入肝血流受限,肝窦充盈,邻近肝叶的肝静脉、门静脉部分显影。上述①、②两种情况适合作分流术或断流术。③门静脉入肝血流基本消失,造影剂在门静脉系统呈静止状态,有明显门静脉肝内分支充盈。④逆肝血流,造影剂通过肝脏进入门静脉主干。③与④两种情况只适合做断流术。
4.靛青绿(ICG)试验 该试验较BSP排泄试验更敏感、安全和简便,现已成为评价肝脏储备功能的主要试验,对综合评价肝脏的功能储备状况有很大意义。肝脏实质损害时,K15ICG升高,KICG降低。在急性肝炎、慢性活动性肝炎和肝硬化时出现异常。据报道,肝硬化时平均为3K15ICG 5.5%,KICG为0.077,当两者分别大于50%和小于0.04时,预后不良。
(十)食管胃底曲张静脉出血相关因素
探讨预测门静脉高压症合并食管胃底曲张静脉破裂出血的相关因素,采取积极有效的预防措施,达到预防为主的目的,减少出血发生率和死亡率。
(1)引起食管胃底曲张静脉出血的直接因素
1)门静脉压力:正常的门静脉压力在1.27~2.35kPa之间,平均值为1.76kPa。在门静脉高压症时,门静脉压力多增至2.94~4.9k Pa,当压力高于3.43kPa时,常可发生曲张静脉破裂出血。
2)食管曲张静脉直径与出血发生概率呈正相关关系,直径越大,出血率越高。
3)食管曲张静脉颜色:曲张静脉呈红色征是发生曲张静脉破裂出血的先兆或危险征。
4)肝功能分级与出血呈正相关关系,即肝功能分级出血发生率C级>B级>A级。
(2)相关诱发出血的因素
1)药物诱发:常见原因是患者因抵抗力下降易患感冒,而服用含阿司匹林类的西药或中成感冒药,导致食管及胃黏膜应激性溃疡出血,甚至食管胃底曲张静脉破裂大出血。笔者曾遇到患者口服速效感冒胶囊,于当晚出现大出血。
2)饮食不当:少数肝硬化患者仍然大量饮白酒,导致食管胃底黏膜应激性溃疡出血,发展到曲张静脉破裂出血。
3)饮食习惯:少数病人不忌油炸食物,这类食物极易损伤仅一层黏膜细胞保护的曲张静脉发生出血。
4)恶心及呕吐:由于饮食不当而导致胃肠功能紊乱,引起恶心或呕吐,或因行纤维胃镜检查刺激咽喉部,引起恶心或呕吐,导致胸腔与腹腔压力差剧增,诱发曲张静脉破裂出血。
(十一)门静脉高压症性胃病出血
2026年,Sarfeh等总结了他们小组及他人的研究结果,正确地提出了门静脉高压性胃病(Portal hypertensive gastropathy PHG)这一概念。PHG出血占肝硬化者上消化道出血的21%~59%,平均为35%左右。
(十二)异位曲张静脉出血
门静脉高压病患者除了经常发生食管胃底曲张静脉出血外,其他消化道部位的曲张静脉破裂出血,被称为异位曲张静脉出血,从胃窦部到直肠以及胆道均可出现出血,均以便血为主。
上述三种门静脉高压症消化道出血情况以食管胃底曲张静脉出血常见,占50%~60%;门静脉高压症胃病出血平均为35%左右;而异位曲张静脉出血极少见,我们曾遇到1例回盲部曲张静脉出血者。这三种类型的出血,根据患者的病史、出血方式及出血量,最容易诊断的是食管胃底曲张静脉破裂出血,其次是门静脉高压性胃病,最难诊断的是异位曲张静脉出血。前二者在出血时作急诊纤维胃镜大部分可以明确诊断,而异位曲张静脉出血须作血管造影才能明确出血部位。我们曾遇到1例门静脉高压症消化道出血患者,因黑便入院,纤维胃镜发现有食管胃底静脉曲张,经肠系膜上动脉造影发现回盲部静脉明显曲张。
五、食管胃底曲张静脉出血的急诊处理
门静脉高压症病人,70%~80%有食管胃底静脉曲张,其中50%~60%可发生曲张静脉破裂大出血。大量的临床统计资料表明,非手术治疗优于手术治疗。在急性出血期,手术死亡率高,大多主张先行非手术疗法,控制止血率达70%~90%。待出血停止后,再行择期手术。若非手术疗法失败,只要病人无明显黄疸和肝昏迷前兆,应积极施行急诊手术,或亚急诊手术。避免迫求择期手术,而使病人失去了手术机会,导致病人因大出血不能控制而死于出血性休克或继发肝昏迷。
(一)非手术疗法
1.一般处理 门静脉高压症并发危及病人的是食管胃底曲张静脉破裂大出血,是门静脉高压症主要死亡原因,占上消化道出血死亡的第一位,一般病情急,应立即采取积极措施进行抢救。
(1)建立两条静脉通道:一条通道是立即静脉滴入复方氯化钠溶液,补充细胞外液的丧失和钠离子的缺乏。不能仅输入不含钠离子的葡萄糖液,有可能发生水中毒的危险。
(2)急作血常规、血小板、出凝血时间、纤维蛋白原、红细胞压积、肾功能和血氨等化验检查。根据检查结果估计病人失血量、凝血功能和肝功能的状况。
(3)严密监护生命体征,观察血压、脉搏、中心静脉压及尿量的变化,维持血压在12kPa左右,中心静脉压在0.8~1.0kPa,红细胞压积在25%~30%之间。根据这些测定指标,估计病人血液循环的变化和失血量的多少,适当调整输液和输血的速度,维持血液循环的相对稳定。
2.药物治疗
(1)垂体加压素(Vasopressin):属半衰期很短的肽类,有强烈收缩内脏血管,减少心排血量,达到降低门静脉血流量和压力的作用。即10%葡萄糖200m L+垂体加压素20u,20min内静脉滴注完,以后可每4h重复一次,亦可以每分钟0.2~0.4u/m L的速度维持24h。若出血仍继续,可加大剂量每分钟0.5u,但需严密监护心律不齐、外周血管痉挛及肝性脑病的出现。为消除垂体加压素引起冠状动脉和肝动脉强烈收缩产生的副作用,可加入硝酸甘油,开始每分钟100~200μg静脉注射,或舌下含服硝酸甘油。我们同时加酚妥拉明0.2~0.3mg/min静脉滴注,可使肝静脉嵌入压下降28.64%,而下腔静脉压、平均动脉压、脉率及心脏指数均无明显变化。德国临床医师认为大剂量垂体加压素易诱发心律不齐和肝性脑病因而不主张应用,用其凝血酶制剂代替如纤维蛋白原、凝血酶等药物。美国临床医师多用合成的加压素衍生物即三甘氨酰赖氨酸加压素(Triglycglysine-Vasopressin Glypressin),是一种长效剂,能缓慢释放加压素,有较长的血管收缩作用,能持久地降低门静脉压力,副作用少,作用优于垂体加压素。常用量为1~2mg静脉注射,每6h一次,平均用药(7±3)mg,有效率约70%。若静脉推注2mg,使肝静脉楔压(WHVP)和自由门静脉压(FHVP)及差(HVPG)平均下降15%,奇静脉流量下降27%,食管曲张静脉压力平均下降25%。
(2)生长激素释放抑制素(生长抑素Somatostatin):属多肽激素,由肝脏代谢,半衰期仅2~4min。生长抑素有选择性减少内脏血流量的作用,尤其是肝脏。这样能降低门静脉压,并能明显减少食管曲张静脉的流量,对心搏量及血压无明显改变。现临床应用的是人工合成的Sandostatin(商品名善得定,Octreotide),是生长抑素的衍生物,属八肽类,作用与生长抑素相同。据北京、上海和武汉临床应用的观察,止血率达70%~80%。具体用法是首次剂量善得定100ug+10%葡萄糖100m L,10~15min滴注完,接着是500ug+10%葡萄糖1 000m L,维持24h,第2至第6天每天100ug静脉滴注。Somatostatin和Octreotide(Sando-statin)的临床应用在2026年雅典国际胃肠学会议讨论的意见是:①此药能否使WHVP下降,意见不统一,有报告阳性,有报告无变化。②统一意见是此药使奇静脉血流量下降,故可能有治疗作用。③主要优点是此药与垂体后叶素相比,无重要副作用。④前瞻性随机研究结果是输血量减半;气囊压迫使用率下降及急诊手术或急诊硬化剂注射病例数下降,但死亡率无变化。其结论认为急性食管胃底曲张静脉出血中,Octreotide仍是较优先应用的药物治疗,主要是简单和无副作用。善得定不但对食管胃底曲张静脉破裂出血有效,同时对消化道出血的其他疾病也有一定的疗效,如胃及十二指肠溃疡、出血性胃炎等。
(3)心得安(Propranol):为非选择性β-肾上腺素能受体阻滞剂,其作用机制可能是:①阻断β2受体,使心率减慢,心输出量降低,内脏循环血流量相应减少,从而使门静脉流量减少,导致门静脉压降低。②内脏血管壁的β2受体被阻滞,使α受体的兴奋性相对增加,内脏循环阻力增加,门静脉血流量减少,特别是肝动脉收缩,使肝窦内压降低,导致门静脉压下降。③选择性地减少奇静脉血流量为其特点和优点,可达32%,使流入胃上部及食管曲张静脉的血流量减少,曲张静脉壁内压和管壁张力降低,防止破裂出血。临床应用还发现心得安使CO下降,但HVPG下降十分不一致。心得安对肝功能Child A级和B级较好,C级无效为多,心得安使CO下降比P·P下降为甚,故并不是不对肝脏血供有损害的。若用心得安后如HVPG立即下降>20%,则预后好,再出血率下降。初用量为40mg,每天2~3次,以后增至为每天140~280mg,心率减少20%为宜。长期服用,多通过侧支蓄积,出现副作用,恶心、头痛,重者呼吸困难及诱发肝昏迷。停药需逐渐减量,避免突然停药引起曲张出血和心律紊乱等。若有循环不稳定、心衰、窦性心动过缓、代谢性酸中毒及支气管哮喘等忌用。
(4)立止血(Reptilaee):此药是由巴西蛇毒液中经过分离和提纯的类凝血酶和类凝血酶样物质,小剂量注射后仅在出血部位具有促进血小板聚集、类凝血酶和类凝血酶作用,而产生止血效应。Bruch报告3 000例应用立止血成功经验。我们应用临床治疗消化道出血疾病44例,总有效率为86.1%,其中门静脉高压症合并食管胃底曲张静脉破裂出血25例,止血率为76%。临床观察未发现不良反应。此药为针剂,每支1ku,可静脉、皮下和肌肉注射,一般先肌注1ku,随即静脉推注1ku。第2、第3天立止血1ku静脉注射,每日1次,亦可每日2次,每次2ku。立止血还可口服或手术前及术中局部应用,均可获得止血效果或减少术中创面的出血。
(5)凝血酶(Thrombin):本品是从血液中提取的,它能直接作用于血液中的纤维蛋白原,促使转变为纤维蛋白,加速血液的凝固,达到速效局部止血的目的。本品仅口服或局部应用,不能注射。消化道止血,可用注射用水或生理盐水溶解凝血酶,配成50~500国际单位/m L的溶液,口服或灌注。每次2 000~20 000单位,严重出血时可增加用量,每1~6h用一次。
(6)甲氰脒胍(Cimitidine):本药主要是保护胃黏膜,有实验报告有降低胃局部血流量的作用。现在多用法膜替丁(Famotidine)40mg,静脉注入,或洛赛克(Losec)40mg静脉注射,可减少胃酸反流入食管黏膜造成的损害,对控制出血有一定作用。
3.三腔二囊管压迫 应用三腔二囊管压迫胃底和食管下段的出血部位,仍是有效的暂时控制出血的方法之一。止血率可达60%~80%。但拔管后再出血率达21%~46%,有一定并发症发生,如食管胃底压迫性黏膜坏死或溃疡,吸入性肺炎、纵隔填塞及急性窒息等并发症。一般应用前检查管道是否通畅、气囊是否漏气等。一般先将胃气囊充气150~200m L,用300g重物牵引(如空盐水瓶加水100m L),若无再出血,食管气囊不再充气。若继续出血则将食管气囊充气3.99kPa即够。可减轻病人胸闷及纵隔填塞症状,使气囊压迫时间延长12~24h,达到有效止血的作用。亦可注射小量镇静剂如安定10mg肌注。
4.内窥镜硬化剂注射 本方法于2026年Craford和Frenckner首次报道。直到2026年Raschke 及Paquer采用硬式食管镜进行硬化剂注射,取得较好效果,又重新重视起来,并在日本开展此疗法的例数超过外科手术治疗的。
(1)硬食管内窥镜:在长50cm的Negus食管镜末端加一个槽,每次注射突入槽内的曲张静脉后,旋转食管镜压迫曲张的静脉,防止出血和药物流失,使其硬化。其优点是注射准确,出血少。为减少病人痛苦,需全麻。
(2)光导纤维内窥镜:单独用一般内镜进行注射的方法,称一般法。在内镜前端1~2cm以后附加一气囊及注气导管进行压迫食管静脉,使其怒张明显,防止栓子流入体循环,阻止食管蠕动,穿刺后可将气囊推向穿刺点压迫止血的方法,称为气囊压迫法。还有用Olympus生产的ST-EI型开窗导管,套在内镜外,使曲张静脉在导管开窗孔内突出,注射针经导管壁的注射针引导管平行注入静脉腔内,再转动开窗导管压迫注射点防止出血。此方法安全和准确,但因开窗导管较粗,增加病人痛苦。
常用的硬化剂有1%乙氧硬化醇,日本多采用5%氨基乙醇,欧洲多用5%鱼肝油酸钠等,可单独或联合用。注射方法可分为曲张静脉内或旁注射。现多采用联合应用即静脉内注射和曲张静脉周围注射相结合,这样可加快曲张静脉硬化和促使其黏膜增厚而防止再出血(图19-27)。每次可注射不同平面3~4处,每处注射硬化剂2~5m L,总量20~30m L。注射后24h形成静脉血栓,局部坏死,7天左右形成溃疡,1月左右形成纤维化。随着经验的积累,硬化剂注射的止血率达80%~93%,近期复发出血率达25%~52%,一年内死亡率为25%,并发症的发生率为2%~10%,多数为低热、胸骨后疼痛、胸腔积液;严重并发症约4%,多为硬管窥镜所致,如食管穿孔、支气管一食管瘘及肺栓塞等。尽管硬化剂注射疗法现得到广泛普遍的应用,但结论不一。多数认为,可作为暂时的有效止血方法,尤其适合不宜急诊手术,肝功能属Child分级C级(我国分级Ⅲ级)者。出血停止后,再根据病人情况和医院技术条件,对病人作有关手术的检查,如彩色多普勒或血管造影等,综合分析选择适合的手术方式。

图19-27 硬化剂注射
(3)食管曲张静脉套扎:内镜下食管曲张静脉套扎术,是治疗和预防食管曲张静脉破裂出血的有效方法。经过1~5次结扎后,曲张静脉消失率达90%以上。曲张静脉复发率为21%~72.2%。再出血率为13.9%。其并发症发生率为6%~10%,包括吞咽困难,食管溃疡,食管狭窄及败血症等。胃静脉曲张出血是门静脉高压症的严重并发症之一,其内镜治疗的地位和作用尚有争议。前瞻性随机对比研究结果提示,硬化剂注射在预防静脉曲张复发方面优于结扎术,两术结合起来使用显示明显差异。
图19-28 经颈静脉肝内门体分流术
5.经颈静脉途径肝内门体分流术 这种介入方法的分流术简称肝内门体分流术(TIPSS),是近年来用于临床的新技术。首先由德国Richter报告3例,目前国外已作1 000余例,国内已作近200例。TIPSS的适应证有:①门静脉高压症患者合并食管胃底曲张静脉破裂大出血;②病人肝功能属Child分级C级;③门静脉高压症患者属晚期需要施行肝脏移植者;④外科各种手术后再出血者。术前准备包括:纠正凝血功能障碍和低蛋白血症,控制腹水。操作步骤如下:①建立入路,经颈静脉插管建立门-肝静脉入路;②建立肝实质通道,即用带气囊导管扩张肝静脉至门静脉的通道,直径为8~10mm;③完成分流,即在门肝实质通道内置入直径为8~10mm,长5~6cm血管支撑架,使门-肝静脉压力差至3.325k Pa以下,完成分流。并发症有腹腔内出血、胸腔或心包积血。远期肝内门体支撑架栓塞或狭窄,需要再行扩张支架,或重新植入一个支架。这样费用较昂贵,需要一定的设备,且观察到中期疗效不理想,有待进一步改进(图19-28)。
6.预防肝昏迷的措施
(1)清除肠道积血:口服50%硫酸镁30m L,每日1次,用生理盐水或偏酸性溶液灌肠,减少氨的产生和吸收,严禁用肥皂水灌肠,以防碱性环境促使肠道对氨的吸收。
(2)抗生素的应用:口服或经鼻胃管注入,新霉素1g或甲硝唑250mg,每日4次。亦可用新霉素2g或甲硝唑500mg作保留灌肠,杀死肠道细菌,减少氨的产生。
(3)支链氨基酸:一般静脉缓慢滴入250~500m L,改善支链氨基酸与芳香族氨基酸失衡,因氨基酸失衡是肝昏迷的因素之一。
(4)谷氨酸钠11.5g加入5%葡萄糖250m L静脉滴注。在ATP供能的情况下,体内的氨能与谷氨酸合成无毒的谷氨酰氨,使血氨下降。
(5)给氧:门静脉高压症合并上消化道出血时,极易继发胸水或腹水,影响患者呼吸功能,给氧可以增强呼吸功能。失血和低氧血症易加重肝脏损害,诱发肝昏迷的发生。
7.全身抗生素的应用 临床检验证明肝硬化患者血液中极易产生菌血症,同时因网状内皮系统防御机能降低,在合并上消化道大出血时极易合并全身感染如菌血症、败血症及上呼吸道感染,甚至腹水感染等出现。为了防止严重感染加重肝脏的损害,必须联合大剂量广谱抗生素的应用,如先锋Ⅵ号6g,静脉滴注,或西力欣1.5g,静脉滴入,每日2次。若合并严重感染,应改用复达欣2.0g,静脉滴入,每日2次。仍不能控制感染,可选用泰能1.0g,静脉滴入,每日2次。
(二)手术治疗
门静脉高压症合并食管胃底曲张静脉破裂大出血常危及病人生命,但经采取积极的抢救措施后,约70%~90%病人的出血可控制,在县级基层医院因条件限制,约70%可以用非手术疗法控制出血。在城市里较大医院非手术治疗可使90%以上病人出血停止。因此,对门静脉高压症合并上消化道出血的急诊处理,国内外多数学者都主张先采取非手术治疗措施,待出血停止后再行确定的手术方式,以降低手术死亡率,提高手术远期疗效。在我国乃有10%~30%的病人用非手术疗法无效,则需要采取积极的急诊手术或亚急诊手术,避免持续消化道大出血发生肝昏迷或肝昏迷先兆而失去手术机会,挽救病人的生命。手术止血是最好的防止肝昏迷的措施。
1.手术时机 在门静脉高压症合并食管胃底曲张静脉破裂大出血病人手术时机的选择,要根据病人肝功能分级、病人年龄和医院技术条件以及非手术治疗措施的疗效等进行综合分析后,才能较好地选择手术时机和手术方式,同样获得同择期手术一样的疗效。根据我们的经验,急诊手术适应证有:①病人肝功能分级Ⅰ级和Ⅱ级(或Child分级A级和B级);②病人年龄一般在50岁以下;③医院内无内窥镜硬化剂注射等有效的非手术疗法设备条件者;④经非手术疗法后,病人每日消化道出血量在500~800m L者,或病人血液循环系统方面出现轻度波动。急诊手术时机一般选择在48~72h内,这样经过短时间非手术疗法措施亦视为充分的术前准备,改善病人的低蛋白血症和贫血状态,纠正凝血机制障碍和水电解质平衡等全身状况,提高了病人对手术的耐受力,降低了手术死亡率,提高了手术疗效。病人肝功能属Ⅱ级(或ChildB级)者,或病人年龄在50岁以下,经过48~72h积极抢救病人出血量虽有减少趋势,但仍有300~500m L中等量的出血,三腔二囊管拔后又复发大出血者,应在加强支持疗法的同时准备行亚急诊手术,手术时机则在入院后3~7天内,避免持续出血使病情恶化而导致肝昏迷死亡。我们曾遇不少病例,因出血后出现肝昏迷先兆再请外科医生会诊,而错过手术机会,死于肝功能衰竭的教训。肝功能属Ⅲ级(Child属C级)者,不论病人年龄如何,国内外较一致的意见是属内科非手术疗法的绝对适应证。对这种病人无论是内科或外科治疗,死亡率都较高。采用急诊硬化剂注射(EST)或门腔静脉分流术,死亡率均为50%,而门奇断流术相对较低(6/35例),为17.1%。这类病人若不行手术,死亡率达30%~75%,手术是控制出血和防治肝昏迷最有效的措施。手术后要特别注重应用大剂量广谱抗生素如西力欣、复达欣等控制感染。加强护肝治疗和静脉注射利尿剂控制腹水等措施,防治肝昏迷或肝肾综合征的发生,这是降低手术死亡率的关键。近10年来(1984—2026年)使手术死亡率降为3.6%(9/247例死亡),成功的关键是将明显黄疸或/和肝昏迷先兆的病人作为绝对的禁忌证,这样明显减低了术后肝昏迷的死亡率。
2.手术方式 目前国外对急诊手术方式的选择有不同的意见,门体分流术仍是欧美各国主要的手术方式。日本与我国相似,主要以门奇静脉断流术为主。手术方式的选择主要依据病人的肝功能分级而定。肝功能属Child分级A和B级(中国武汉分类属Ⅰ和Ⅱ级)者,病人年龄在50岁以下,欧美各国主要是门腔静脉限制性分类术,吻合口限制在10~12mm,使肝性脑病降为6%,再出血率为8%。这种术式被认为既不同于选择性分流,也不同于非选择性分流的门静脉高压部分减压术。其次是肠系膜上静脉下腔静脉分流术,中心型脾肾静脉分流术很少作,代以远端脾肾静脉分流术,但操作难度大,失血多,仅少数作者报道应用于急诊手术。日本与我国大多数学者主张急诊作断流术,术后脑病发生率低,止血效果确切,远期再出血率与分流术无差异。若在急性出血时,施行急诊分流术,手术死亡率和肝性脑病发生率高,远期再出血率并不明显低于断流术。至于选择何种断流术式,积我们30多年的临床经验,认为贲门周围血管离断术为首选术式。避免联合断流术因创伤大,并发症多,手术死亡率高等缺点。有少数作者主张行经腹或经胸的贲门周围血管离断术或经腹的联合断流术。
六、外科手术方法的评价
自2026年Blakemore、Lord和Whipple等将门腔静脉分流术应用于临床治疗门静脉高压症至今已半个世纪,目前在欧美各国仍是主要的手术方法之一。分流术在我国亦是较广泛应用的手术。
(一)门体分流术
1.门腔静脉分流术 是目前在欧美占支配地位的手术方法,随着实验研究和临床观察,分流术得到了发展。门腔分流术共有三种类型:门腔静脉端侧吻合术、侧侧吻合术和H型搭桥术。国外最普遍应用的端侧分流术,侧侧分流术主要用于治疗严重顽固性腹水病人,国内多数采用“永久”限制性门腔侧侧分流术(图19-29)。
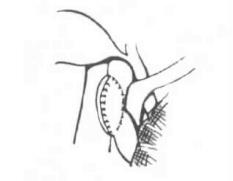
图19-29 “永久”限制性门腔静脉侧侧分流术
限制性门腔静脉侧侧分流术,此术式在北京地区已作600多例,积累经验并作了改进,希望成为“永久”性限制性门腔分流术。它的适应证:①门静脉高压症食管胃底曲张静脉破裂出血;②脾切除或其他手术后再出血者;③患者肝功能分级属Child分级A和B级(中国武汉分级Ⅰ级和Ⅱ级)者。门腔侧侧分流术技术操作在分流术中使手术途径方便,90%的门静脉与下腔静脉呈交叉绕行,游离后两血管距离很近,易于拉拢吻合,尤其是采用特制的三翼无损伤血管钳夹住二血管,使吻合口后壁外翻缝合及前壁间断外翻缝合极为方便。根据动物实验中门静脉压测定范围选择最佳吻合口,如门静脉压力为2.54 ~5.19kPa(260~530mm H 2 O)时,最佳吻合口径为8~9mm,分流后门静脉压降为2.35~2.54kPa(240 ~260mm H 2 O)。这一结果与临床所见相符合,故现一般将吻合口作成9mm。亦有人主张术中测门静脉压大于3.43k Pa(350mm H 2 O),分流口径直接为12mm;门静脉压在2.94k Pa以下(<300mm H 2 O),分流口径直接为8~9mm。为了达到“永久”性限制吻合口在预定范围,在有弹性的血管吻合口周围加一个与吻合口一致约10mm直径的动脉导管,长约32mm,用粗丝线穿通导管,然后放置吻合口处,将丝线打结,使导管圈套在吻合口上,达到“永久”性限制吻合口的目的。用于17例,观察2年无肝性脑病及再出血发生的理想疗效。国内王宇报道202例限制性门腔侧侧分流术,手术死亡率为2.92%,术后食管静脉曲张好转率为87%,再出血率为11%,腹水消失率为85%,3年、5年、10年及15年生存率分别为92.1%、80%、56.9%及41.7%。病人恢复正常工作为77.8%,较国外疗效好。
门腔侧侧分流术还可以用于腹膜-静脉转流失败的顽固性腹水者,对于门静脉高压症同时合并上消化道出血和顽固性腹水的病人,门腔侧侧分流术是最有效的治疗方法。
近年来,国内外学者在限制性门腔分流术的基础上又附加门奇断流术。国外有限制性门腔侧侧分流术或门腔H型桥式分流术,其吻合口都是小口径(8~10~12mm),或分流口径与术前门静脉直径之比小于0.5是合适的,80%以上病例能获得预期的向肝血流。一般分流口径大于10mm时门静脉血流都是离肝的;口径在10mm时,44%可获向肝血流;口径在8mm时,80%为向肝血流。这一术式实验证明和临床观察证明,门静脉部分减压和门奇断流的结果,使再出血率降为8%,因门奇断流术后使门静脉压又微升高,促进向肝血流增加,维持肝的代谢、功能和再生的肝营养因子的供给,从而使肝性脑病的发生率降为6%。
门腔端侧分流术因完全剥夺了肝脏门脉血的灌注,现已很少用。但Orloff一直主张用端侧分流术治疗门静脉高压症上消化道出血,且不受肝功能分级的限制,甚至赞成急诊出血非手术疗法失败者,亦可施行门腔端侧分流术。
2.传统的脾肾静脉分流术 该术式操作难度大于门腔及肠腔分流术,同时作脾切除术纠正脾亢,但因吻合口栓塞率高,术后再出血率高,有的作者已少用。然而国内不少作者认为仍是治疗门静脉高压症及其上消化道出血的手术方法之一。我们在上世纪60年代提倡,现已少用(图19-30)。
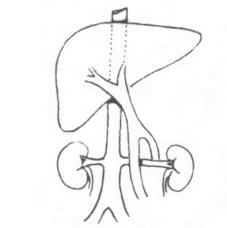
图19-30 端侧脾肾静脉分流术
3.肠腔静脉分流术 肠腔静脉分流术包括肠腔侧端分流术(Clatworthy分流)、肠腔H型桥式分流术(图19-31)、肠腔侧侧分流术(图19-32)及肠腔端侧分流术。
图19-31 下腔静脉、肠系膜上静脉间桥式分流术
图19-32 肠腔静脉侧侧分流术
20世纪50年代初,Marion与Clatworthy首先提出用肠腔侧端分流术治疗小儿先天性门静脉缺如或闭锁导致的门静脉高压症,术后易下肢回流障碍,出现踝部水肿,久立后更明显,现几乎不用。
肠腔H型桥式分流术:虽然避免肠腔侧端分流术的缺点,据Drapanas报道的80例,分流手术后,肠系膜上静脉压力平均下降1.7kPa(174mm H 2 O),约50%门静脉血转流,95%的病人仍保持向肝门静脉血流灌注,脑病发生率为11%。国内一组127例报道,分流后平均门静脉压下降1.11kPa (113mm H 2 O),病人术后均保持向肝血流灌注。手术死亡率为8.9%,肝性脑病发生率为2.2%,复发出血率为14.6%。本术式的优点:①手术野显露较好,易于操作,适于推广;②可作为肠腔侧侧分流术困难时的替代手术;③适合于脾切除术后或断流术后再出血者;④选择架桥的血管最佳口径为肠系膜上静脉的口径即0.8~1.0cm人造血管聚四氯乙烯(Goretex)或真丝人血管或自体颈内静脉等。
肠腔静脉侧侧分流术:这种术式是目前肠腔分流术中应用最广泛的一种,不仅简化了操作过程,最大的优点是使高压的肠系膜上静脉血流直接流入低压的下腔静脉,大大减少吻合口的栓塞机会,使远期再出血率为6.3%,脑病发生率为4.1%,手术死亡率为2.4%,85例中手术成功率达98.8%。如果手术失败,可改用精索或卵巢静脉与肠系膜上静脉行端侧吻合,或取一段自体静脉作H型桥式分流术,亦可改作肠腔静脉端侧分流术。
4.脾腔静脉分流术(图19-33) 此术式据南京医学院附一医院的经验,操作易行,手术野显露好,手术成功率高,手术死亡率为5.56%,肝性脑病为8.1%,再出血率为10%。其优点:①降低门静脉压力仅次于门腔分流术;②当左肾静脉有变异不宜施行脾肾静脉分流术时,可改为脾腔静脉分流术。其缺点:①胰腺肿大、缩短、移位幅度较小;②小肠系膜增厚,脂肪组织增生,侧支循环丰富,游离下腔静脉可发生大出血者,这两种情况不适合作。
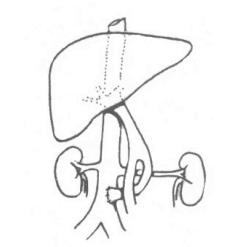
图19-33 端侧脾腔静脉分流术
全门体分流术最大优点是止血效果确切,再出血率在10%左右,比国外疗效高。而最大的缺点是术后肝性脑病和肝功能衰竭发生率高(2.2%~14%),国外达6%~40%。多数在1年内发生,从而影响患者的生活质量。尤其我国以肝炎后肝硬化为主门静脉高压症多见,选择全门体分流术时要慎重考虑。从临床实践中观察到肝脏有不同程度的硬化缩小,超声检查和CT检查也证实。在手术中发现不少患者的肝脏左右明显缩小,无代偿增生,肝脏仅如手掌大小。所以,我们认为,即使这类患者肝脏代偿功能尚属B级,因肝萎缩明显,尚无代偿潜力,肝脏储备功能已达极限,不宜作加重肝脏损害,减少含肝营养因门静脉血转流的全门体分流术。否则术后极易发生肝性脑病或严重的肝昏迷,造成不良后果。
(二)选择性分流术
Warren首先于2026年创立远端脾肾分流术,相继有胃左静脉下腔静脉分流术及选择性脾腔分流术。
1.远端脾肾静脉分流术(图19-34) 这种手术是针对脾胃高压区是引起食管胃底曲张静脉破裂出血的主要原因而设计的。然而通过几支细小的胃短静脉和胃网膜左静脉选择降低食管胃底曲张静脉的压力是不够的,而需要门奇断流术,即结扎、切断胃左右静脉,所以说,选择性远端脾肾分流术实质上是选择性分流术附加断流术的联合手术。达到Warren提出选择性分流的三个生理特征,即选择性食管胃底曲张静脉的减压;保留肝脏的门静脉血灌注;维持肠系膜静脉的高压,避免了全门体分流的缺点。早期临床观察也证实了这一点,手术死亡率为5%~10%,吻合口通畅率为90%,再出血率为7%~10%,脑病发生率为5%~10%,酒精性肝硬变的5年生存率为40%~50%,而非酒精性肝硬变为70%~80%。国内近10年302例的总结,手术死亡率为6%,随访3~10年,复发出血率为7.6%,脑病发生率为1%,生存率为72.2%~100%。近来有报道远端脾肾分流术不仅适合治疗性择期手术,亦可用于急诊手术和预防性手术。但多数作者认为此手术的缺点有:①术后腹水发生率较高,为10%~50%,其中严重者需作腹腔-颈静脉转流术,少数作者认为腹水不是禁忌证的个别成功的报道;②门静脉血栓形成,部分阻塞可消失,完全阻塞可并发下消化道出血,甚至死亡;③手术操作难度大,尤其附加胰脾断离(SPD)后,手术并发症增加,如急性坏死性胰腺炎的报道,但肝细胞坏死由43%降至为12%;④因肿大的巨脾未切除,不少脾功能亢进得不到改善,尤其在我国Ⅲ级以上脾肿大多见,推广受到限制。
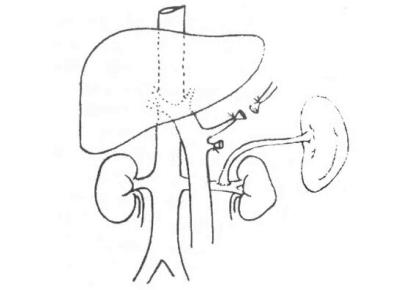
图19-34 选择性远端脾肾静脉分流术
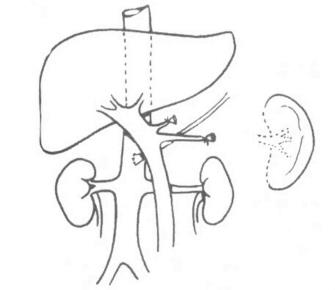
图19-35 选择性胃左静脉腔静脉分流术
2.选择性胃左静脉腔静脉分流术(图19-35) 2026年Inokuchi创立的选择性胃左静脉腔静脉分流术,他认为在日本多是坏死性肝硬变,肝脏损害严重,不能耐受传统的门腔静脉分流术,设计此手术直接有效选择性降低胃左静脉压力,以防止曲张的食管胃底静脉破裂出血,是唯一真正的选择性分流术。手术要点是利用扩张的胃左静脉与下腔静脉间架桥(自体大隐静脉)分流,同时切除脾脏,并将来自脾静脉的头向侧支血管和胃左右静脉间的交通支全部离断。至2026年他已完成258例,手术死亡率为3%,再出血率为8.0%,无肝性脑病。早期吻合口通畅率为86.4%。我们曾作5例,随访10年,无再出血及肝性脑病,彩色多普勒检查显示吻合口通畅。我们认为除采用自体大隐静脉外,可在切脾后游离脾动脉作中联血管,以免术中发现胃左静脉因过弯曲严重、血管壁薄而脆不适宜作冠腔分流术而浪费材料。同时行脾切除纠正了脾功能亢进。国内总共报道不足40例。其缺点主要是胃左静脉条件要求严格,一般直径在0.6~1.0cm之间,主干部无分支要3~4cm长,血管壁不能太薄等,推广应用受限制。
3.远端脾腔静脉分流术(图19-36) 这种分流术多数是由于在拟作远端脾肾分流术时,因巨大脾脏静脉弯曲或移向左肾静脉下方及左肾静脉解剖异常等不适合作此手术,可改为远端脾腔静脉分流术。其优点在于脾腔静脉吻合脾静脉处于顺位,不成角和无胰腺压迫现象,更有利于保持吻合口的通畅。若脾静脉直接与下腔静脉行端侧吻合有困难,可改用以下方法:①远端脾腔端侧架桥分流术,取4~5cm人造血管(Docra),一端与腔静脉行端侧吻合,另一端与脾静脉行端端吻合。②脾腔静脉架桥分流术,即靠肠系膜左侧结扎脾静脉,取长4~5cm,口径1.0~1.2cm的人造血管,分别与下腔静脉和脾静脉行端侧吻合术。此手术的减压较远端脾肾静脉分流术更直接,降压梯度较明显。实际上此手术为远端脾腔分流附加门奇断流术的联合手术。即以选择性分流降低食管胃底曲张静脉的压力,以门奇断流术减少脾胃区高流量血液动力学变化和胃左静脉淤血的来源,明显降低食管胃底曲张静脉的淤血,这样达到防止再出血,保持肠区高压门静脉血向肝灌注,减少肝性脑病的发生率。
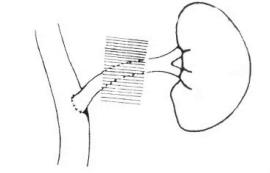
图19-36 远端脾腔静脉分流术
总之,分流术在治疗门静脉高压症中占有一定地位,尤其在欧美占有支配地位,但在日本与我国呈逐渐下降趋势,日本基本放弃全门体分流术,以门奇断流术和选择性分流术为主。我国主张分流术者,首选脾肾静脉和脾腔静脉分流术,因切除巨大脾脏,纠正脾功能亢进。限制性门腔静脉侧侧分流术,适合于脾静脉不宜作分流血管或脾切除术后再出血者。肠腔静脉分流术主要用于分流术后或断流术后(包括脾切除后)再出血者。其中肠腔静脉端侧吻合术,操作较其他型分流术简单,成功率高,疗效同样。多数学者提倡选择性分流术为首选分流术式,该术式虽有其优点,但因其血管条件要求高,多数患者脾功能亢进不能纠正,腹水发生率高,远期疗效难定论,在我国推广应用受到限制。
(三)非分流术
随着门静脉高压症贲门区(包括食管下段和胃底)局部解剖学和组织学研究的进展,认为食管下段2~5cm处,是食管曲张静脉破裂出血的好发部位。近年来,对门静脉高压症血液动力学深入研究,认识到门静脉高压症时,门静脉压力升高是机体代偿功能的表现,是维持门静脉向肝血流灌注的重要保证。现已证实门静脉血中含丰富的肝营养因子(主要是胰岛素和胰高糖素),这些因子是维持肝脏的代谢、功能和促进肝脏再生的重要因子。分流术后减少门静脉血的向肝灌注量的30%~50%,加重了肝脏的损害,同时某些未经肝脏的有害物质直接进入体循环,是全门体分流术后肝性脑病发生率高的原因。而非分流术,如贲门周围血管离断术——断流术理论有:①维持一定的门静脉压力,保持含丰富肝营养因子的门静脉血向肝灌注量,有利于肝脏功能的维持和代偿及肝脏的再生;②脾胃区高血流量和高静脉压是引起食管胃底曲张静脉及出血的主要原因;③食管胃底曲张静脉破裂出血是好发部位。断流术通过切除肿大的脾脏降低20%~40%门静脉血流量和门静脉高压被降低了术前数值的32%,这就相当于Sherif报告脾肾分流术降压率为31%。离断了脾胃区的4组血管:①胃左动静脉主干及属支;②胃短动静脉;③胃后动静脉;④左右膈下静脉,达到减轻脾胃区高血流状和脾胃区的高静脉压,改善食管胃底曲张静脉引流和降低曲张静脉压力,而使其曲张静脉萎陷或减轻,防止曲张静脉破裂出血的目的。因此,20世纪60年代末及70年代初,断流术重新被广泛应用,尤其在我国和日本占有支配地位,这与两国门静脉高压症是肝炎后肝硬变为主的病因学有关。而欧美各国则是酒精性肝硬变为主,因此分流术的效果优于断流术。随着对食管下段和贲门组织解剖研究的深化,早期的断流术被重新认识,且不断发展和完善,在治疗门静脉高压症取得较国外理想的疗效,并在国内占有极重要的地位。其优点有:①适应证广,甚至Child分级C级,有大量腹水而无严重黄疸和肝昏迷先兆者,非手术疗法不能控制出血,亦可施行急诊断流术。②手术创伤较少,对肝脏损害较轻。③手术操作简单,易于基层医院推广应用。④手术疗效较理想,手术死亡率和肝性脑病率均低,复发出血率与分流术无差异,生存率和劳动恢复率较高。⑤远期肝功能改善率较分流术高。⑥脾功能亢进多数得到改善。其缺点:①早期因腹部剥离创面较大,若凝血机制有紊乱者,易并发腹腔内大出血,甚至需再次手术处理。②若行食管或胃横断术者少数发生吻合口瘘,严重者危及生命。③复发出血率有的报道较高,尤其在欧美各国,高达20%~30%,这可能与欧美门静脉高压症以酒精性肝硬变有关。日本的报道最好,仅为1.5%~5.8%,出血率高的原因多数由于断流不彻底所致。
1.曲张静脉缝扎术 这是早期急诊手术方法,如经胸食管曲张静脉缝扎术和经腹胃底浆肌层环切血管缝扎术,因近期复发出血率高,现临床很少应用。
2.脾切除附加胃冠状静脉缝扎术 这是早期的门奇断流术,20世纪60年代主要在我国用于治疗血吸虫病门静脉高压症出血者和预防性手术,纠正脾功能亢进。手术方法是行脾切除后,用粗针粗线盲目缝扎胃冠状静脉,因局部组织肥厚,缝扎不可靠,甚至引起局部血肿,术后再出血率高,70年代后就很少应用于临床。
3.贲门周围血管离断术 我们开展的离断术,目前在国内是应用最多的术式。(图19-37)手术要点:
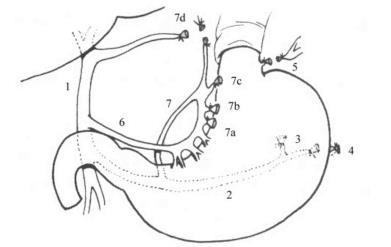
图19-37 贲门周围血管离断术示意图
1.门静脉 2.脾静脉 3.胃后静脉 4.胃短静脉 5.左膈下静脉 6.胃右静脉7.胃左静脉 7a.胃支 7b.食管支 7c.高位食管支 7d.异位高位食管支
(1)左上经腹直肌切口。
(2)脾切除术。
(3)离断4组血管:①胃左动静脉主干及其属支(尤其是高位食管支或/和异位高位食管支,这是离断成败的关键);②胃短动静脉(作脾切除时已离断);③胃后动静脉;④膈下静脉。
(4)游离上半胃及下段食管6~8cm,这样血管离断才能彻底。
(5)胃大小弯侧剥离面浆膜化,防止线结脱落出血和胃底坏死穿孔。近远期疗效较分流术好,手术死亡率急诊为16.7%,择期手术为1.56%,5年再出血率为6.5%,10年为12.2%。5年和10年肝性脑病分别为2.4%和4.2%。
4.新的贲门周围血管缝扎术(图19-38) 该术式是作者在临床实践中所创立的新术式,为挽救食管胃底曲张静脉破裂大出血的危重病人及预防性手术而设计。自2026年至2026年,总共368例,其中预防性手术210例,治疗性手术148例,急诊手术46例,止血率达95.65%,死亡率为1.35%,远期再出血率9.45%。手术要点:
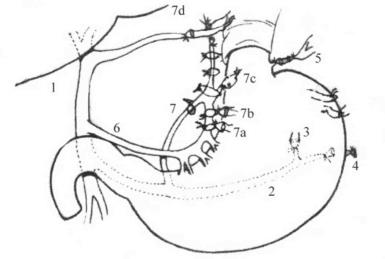
图19-38 新的贲门周围血管缝扎术示意图
1.门静脉 2.脾静脉 3.胃后静脉 4.胃短静脉 5.左膈下静脉 6.胃右静脉7.胃左静脉 7a.胃支 7b.食管支 7c.高位食管支 7d.异位高位食管支
(1)左上腹经腹直肌切口。
(2)脾切除术。
(3)离断,缝扎3组血管:①离断胃短动静脉(作脾切除时已离断);②剪开肝胃韧带,捆绑式的缝扎胃胰壁胃左动静脉主干及属支(尤其是高位食管支或/和异位高位食管支以及上半胃小弯侧前后壁的小分支);③缝扎胃后动静脉及胃底左侧后腹膜的曲张静脉;④保留双侧膈下静脉让其自行分流。
5.横断术
(1)胃底横断术:①首先切除脾脏。②离断贲门下5~6cm胃底浆膜外的所有血管。③在贲门下5~6cm处切断胃底的前后壁全层。④切除胃体大弯侧血管较差的三角形一段。⑤先吻合胃底后壁再吻合前壁。本手术阻断胃壁的反常血流,因手术有污染易并发膈下感染,有吻合口瘘的危险,现已很少应用。(图19-39)
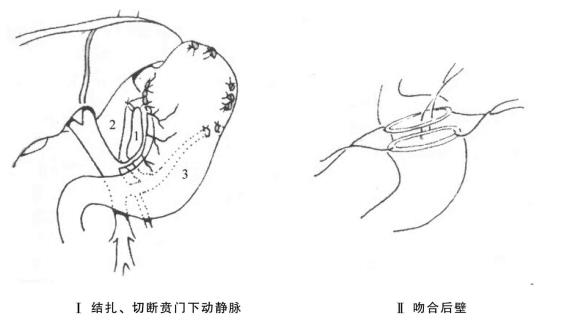
图19-39 胃底横断术
1.胃支 2.食管支 3.脾静脉
(2)经胸食管下段横断术:这是较早期的手术方法,现已很少单独应用于临床。
6.食管下端胃底切除术 根据Yamamoto在切除的食管下端及胃底的标本中,发现此区域有三组曲张静脉丛,即浆膜外曲张静脉丛、肌层内曲张静脉丛及黏膜下层曲张静脉丛,它们之间有广泛的交通支相互沟通。因此,食管下端胃底切除术,完全消除了食管下段及胃底曲张静脉破裂出血的好发部位而止血(图19-40)。手术要点:①第一次手术者,先行脾切除。②离断食管下段和胃底周围丰富的侧支血管。③切除食管下端3~5cm上端胃底5cm。并将胃残端自行封闭,在其上方前壁另作一切口与食管残端行端侧吻合术。本手术适应证主要是曾施行1次或多次门静脉高压症手术后再出血者,不论是断流术或分流术后再出血者。其次是脾切除后或第一次出血者。本手术创伤较大,尤其是再次或多次手术者,若术中发现胃底与膈肌、后腹膜及周围组有广泛致密粘连,且粘连组织肥厚伴广泛的侧支循环形成,手术困难较大。若病人全身情况不佳,可改行胃底血管缝扎术,或条件允许,可行门腔静脉或肠腔静脉分流术。手术中食管胃吻合技术可靠和减少创面污染,手术前后应用广谱抗生素,这是防止吻合口瘘和腹腔感染的主要措施,加强支持疗法,纠正低蛋白血症也是必不可少的。
图19-40 食管胃底切除术
7.联合断流术 主张施行联合断流术者认为,完全阻断食管胃底区域三组曲张静脉丛,才能达到全部阻断门奇静脉反常血流,减少复发出血率的目的。持反对意见者认为,右半胃的血流不流向左半胃,仅行此区周围静脉离断,无需行横断术,同时可避免手术创伤大及吻合口瘘的危险。联合断流术有下列方法。
(1)食管周围血管离断的食管横断术(图19-41)。这手术是日本Surgiura在门静脉高压症病人进行食管胃底静脉造影中发现,该区的血流自胃近端黏膜下静脉逆流向上达肺下静脉水平后穿过食管肌层才汇入奇静脉。为此,断流术血管离断的范围应由腹部胃底延伸到胸腔肺下静脉平面的食管下段,才能达彻底有效的门奇静脉阻断,预防和治疗食管胃底曲张静脉破裂出血。手术适应证:①预防性手术,即食管内窥镜检查发现红色斑,肝功能中血清胆红质3ng/d L以下,血清白蛋白3g/d L以上,凝血酶原时间不超过3s;②治疗性急诊或择期手术血清胆红质5mg/d L以下,白蛋白2.5g/d L以上。手术要点:①切口:病人情况较好者可行胸腹联合切口一期完成手术,若情况差须分二期完成手术。②经胸食管周围血管离断范围12~18cm,30~50支曲张静脉丛,于横膈膜水平横断食管下段,再行吻合。③作幽门成形术。Surgiura报道671例,手术总死亡率为4.9%,急诊为13.3%,择期为30%。术后曲张静脉复发率为5.2%,再出血率为1.5%,10年生存率为72%,这是目前断流术中最理想的疗效。这个手术我国也有不少的报道,疗效较好。但是欧美报道的结果相反,这可能与日本和我国以肝炎后坏死性肝硬变为主,而西方则以酒精性肝硬变为主,病因不同有关。
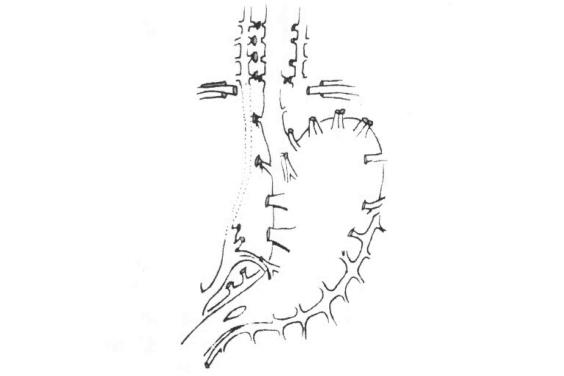
图19-41 食管周围血管离断的食管横断术(Surgiura手术)
(2)经腹食管黏膜横断缝扎的贲门周围血管离断术(图19-42)。该手术是我们改良的Surgiura手术,适应证有:①脾切除后再出血。②门静脉高压症合并食管胃底曲张静脉破裂出血。③门奇断流术后出血。④各种分流术后再出血。⑤病人年龄在60岁以下,肝功能属Child分级A及B级。手术要点:①经腹切口,一期完成手术。②行贲门周围血管离断术。③行食管下段黏膜横断缝扎术,即在贲门上1cm处向上纵形切开食管右侧肌层约4cm,分离黏膜,先缝扎黏膜下及黏膜层的曲张静脉,再在缝扎线之间横断黏膜层,显露食管左侧黏膜下曲张静脉,四重缝扎及间断缝扎无明显曲张静脉的黏膜层和黏膜下层,重新间断横形缝合黏膜层及纵形缝合肌层。本手术的优点:①经腹途径,一期完成手术,减少胸腔并发症。②食管下段黏膜横断缝扎术比Surgiura横断食管瘘及狭窄危险少,45例无1例瘘及狭窄。③远期再出血率低(4.3%),可与Surgiura手术及分流术媲美。
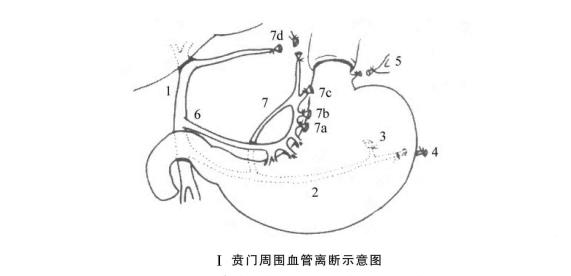
图19-42 经腹食管黏膜横断缝扎的贲门周围血离术
1.门静脉 2.脾静脉 3.胃后静脉 4.胃短静脉 5.左膈下静脉 6.胃右静脉7.胃左静脉 7a.胃支 7b.食管支 7c.高位食管支 7d.异位高位食管支
(3)应用吻合器行门奇断流术:应用吻合器在施行贲门周围血管离断术的基础上再行食管横断术,使联合断流术操作更简易,吻合瘘及狭窄的发生率降低,但术中要切开胃,注意不要污染腹腔,减少感染,可以推广应用(图19-43)。
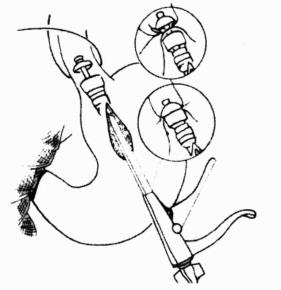
图19-43 吻合器门奇静脉断流术
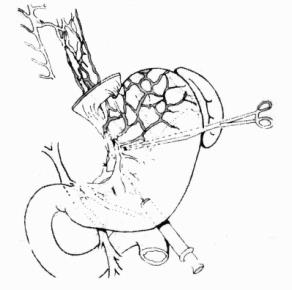
图19-44 胃贲门区静脉栓塞术
(4)胃贲门区静脉栓塞术(图19-44):这种用“TH”胶在术中栓塞胃贲门区曲张静脉的方法,使联合断流术更简易、方便,便于基层医院推广应用。适应证较广泛,适合应用预防性手术及治疗性手术的急诊或择期手术,亦可用于脾切除术后再出血者。手术要点:①行脾切除术;②离断胃后动静脉;③在胃胰皱襞内分离胃冠状静脉主干,结扎门静脉侧支,然后用注射器穿刺胃冠状静脉主干,回抽8~10m L血液,再用另外注射器注入8~10m L“TH”胶。为了防止“TH”异位栓塞并发症,可在注入“TH”胶之前,用特制“U形阻断器”阻断胃冠状静脉—下腔静脉和左肾静脉之异常侧支。在未用“U形阻断器”之前,有发生脑、肺栓塞及胰腺血管栓塞后继发急性坏死性胰腺炎等异位栓塞的少数病例报告,使推广应用受到限制。
(四)讨论
目前国内外对于门静脉高压症合并食管胃底曲张静脉及脾肿大预防性治疗问题意见分歧,一是是否需预防性处理?二是采用内科治疗还是外科手术?三是选用哪种术式比较合适?
1.门静脉高压症是否需要预防性处理 门静脉高压症90%以上是由肝硬化引起,国内主要是肝炎后坏死性肝硬变。日本与我国相似,而欧美各国虽90%以上门静脉高压症是由肝硬化引起的,但病因主要是酒精性肝硬化。目前,欧美各国多数学者及资料统计,认为目前任何预防性疗法均不足取,预防性硬化剂疗法的死亡率较保守疗法为高。而我国和日本多数学者及临床资料统计,认为预防性治疗可以延长病人生命,提高生存率和降低出血病死率。这两种不同观点和结果不同,可能与其肝硬变病因不同有关系。
2.预防性治疗是用内科疗法还是外科疗法 日本和欧美赞同预防性治疗的学者,多数采用内科疗法为主,药物治疗是用目前经验比较成熟的非选择性β受体阻断剂心得安,β1受体阻断剂氨酰心安和β2受体阻断剂ICI118.551等尚处于试验阶段。其次是预防性硬化剂注射疗法,一组报道5年生存率在Child分级A、B级及C级中分别为73%、57%及13%。国内硬化剂注射应用预防性治疗报道不多,而主要是用于急性出血期止血和防止再出血。国内不少学者主张外科治疗,其手术适应证的参考指标:①食管曲张的程度在中及重度。②内窥镜检查食管曲张静脉有红色斑。③脾脏肿大Ⅱ级以上及明显脾功能亢进者。④门静脉及食管静脉压力,如门静脉压3.43k Pa或肝静脉嵌塞压2.0kPa者。⑤肝功能分级属Child A级和B级,年龄在50岁以下。⑥肝硬化病因,血吸虫病肝纤维化手术适应证可适当放宽,肝炎后肝硬化应慎重,酒精性肝硬变者必须戒酒,使酒精性肝炎康复后考虑手术治疗。
3.究竟选择哪种术式较合适 目前国外赞成预防性手术者,多数主张作选择性远端脾肾静脉分流术,在日本多数采用断流术或选择性分流术。而我国赞成手术治疗者,施行断流术者多数选择贲门周围血管离断术。作者认为,选择新的贲门周围血管缝扎术较合适,因创伤少,并发症少及死亡率低,远期疗效与离断术一样安全有效。治疗性手术的选择欧美以分流术(远端脾肾分流术)和肝移植术为主,国内主张分流术者,病人一般年龄在50岁以下,肝功能属Child分级A级和B级,以限制性门腔静脉侧侧分流术,肠腔静脉分流及传统脾肾静脉分流供术者选择。断流术应首选择联合断流术。因为这类手术虽然创伤大,并发症和死亡率相对稍高,但是再出血率最低,较单纯断流术减少10%再出血率,避免再次手术的危险,是值得采用的。作者自己设计的新的贲门周围血管缝扎术附加吻合器模断食管的联合断流术,应用急诊及治疗性手术,现作68例,无死亡及吻合口瘘或狭窄发生,并发症亦少。联合手术,目前仅少数作者选用。总之,门静脉高压症手术选择的原则是:预防性手术应选择简单有效的术式,治疗性手术应选择再出血率最低的,并发症和死亡率相对较低的疗效可靠的术式,尽量避免第二次手术的危险。术后长期内外科监护治疗,有再出血先兆之前采取非手术治疗防止再出血,这样才能提高门静脉高压症手术的远期疗效。
七、门静脉高压症的未来
当前,治疗门静脉高压症的方法众多,虽然药物治疗和硬化剂注射疗法广泛应用,但其复发出血率仍高达30%~50%,仍需进一步行外科手术治疗,不论作分流术或断流术,还是不能完全有效地防止再出血,尤其是肝功能属Child C级者。为此,只有肝移植既能消除原发肝病,又能十分有效地防止再出血。当前美国对食管曲张静脉破裂出血的处理,多数先行硬化剂注射疗法,条件合适者作分流术,提倡远端脾肾分流术,同时严密监护其肝功能。若两种治疗失败,便于选择适当时机尽快进行肝移植,20世纪80~90年代,Child C级者适合肝移植者,5年存活率达60%~70%。目前国外因门静脉高压症进行肝移植者已达10 000例,其中终末期门静脉高压症是首选适应证。肝移植在发达国家目前良性肝病移植1年生存率达90%左右,5年生存率为75%~80%,并有较高的生活质量。目前我国肝移植术已日益普及,适应证中肝硬化病人逐年增加,当前有待解决供肝不足,代价昂贵等问题,并制定手术适应证、禁忌证和等供肝时的治疗问题。
(刘飞龙)
参 考 文 献
1 吴孟超主编.肝脏外科学.第二版.上海:上海科学技术文献出版社,上海科技教育出版社,2000
2 夏穗生主编.现代腹部外科学.武汉:湖北科学技术出版社,1996
3 严律南主编.肝脏外科.第一版.北京:人民卫生出版社,2002
4 叶胜龙.原发性肝癌的非手术治疗.肝脏,2002,7(增刊):76-77
5 Shuichi O,et al.Predictive factores for postoperative recurrence of hepatocellular carcinoma.Gastroenterology,1994,106:1618-1624
6 Tsuneo H,et al.Hepatocellular carcinoma after transcatheter hepatic arterial embolization.Cancer,1994,73:2259-2267
7 Yoshimichi H,et al.Expression of hepatitis C virus in hepatocellular carcinoma.Cancer,1994,73:2253-2258
8 刘树伟,王怀经,徐文香等.肝右后静脉的应用解剖.中华外科杂志,1991,29:708-710
9 沈文律,严律南,罗义刚等.腹内控制肝上及肝下下腔静脉的局部解剖学研究及其应用.中华外科杂志,1994,32:387-389
10 吴孟超主编.肝脏外科学.第二版.上海:上海科学技术文献出版社,上海科技教育出版社,2000
11 余业勤,汤钊献,马曾辰等.肝门区肝癌的手术切除.中华外科杂志,1989,27:157-160
12 徐恩多.肝脏血管系统解剖及其临床意义.中华外科杂志,1965,3:57-60
13 余业勤,汤钊献,马曾辰等.第八肝段切除术30例体会.实用外科杂志,1991,11(5):259-262
14 黄志强.肝脏外科手术学.北京:人民军医出版社,1996
15 Colomma JOD,Shaked A,Gelabert HA et al.Resection of thecaudate lobe through“bloody gultch”.Surg Gynecol Ogstet,1993,176:401-496
16 Elias D,Lasser PH,Desruennes E et al.Surgical approach to segment I for malignant tumors of the liver.Surg Gynecol Ogstet,1992,175:17-23
17 Johnston GW.Treatment of bleeding,varices by oesophageal transaction with the SPTU gun,Ann R Coll Surg Ergl,1997:59:404
18 裘法祖,戴植本,刘飞龙等.贲门周围血管离断治疗食管胃底曲张静脉破裂大出血.中华外科杂志,1983,21:275
19 Inokuchik..Present status of surgical treatment of esophageal varices in Japan:A national survey of 3588 pationts.World J Surg,1985,9:171
20 刘飞龙,夏穗生.断流术中异常侧枝的寻找与处理.腹部外科,1988,1:160
21 Henderson JM,Barnes DS,Geisiger MA.Portal hypertension.Curr Bob Surg,1998,35:379
22 Lo GH,Lai KH,Cheng JS,etal.Emergency banding ligation versus sclerotherapy for the control of active bleeding from esophageal varices.Hepatology,1997,25:1101
23 Sarin SK,Lamba G,Kumar M,etal.Comarison of endoscopic ligation and propranolol for the primary prevention of variceal bleeding.N Engi J Med,1999,340:988
24 Guadalupe Garcil-TSAO.Current management of the complications of cirrhosis and portal hypertension:variceal hemorrhage,ascites,and spontaneous bacterial peritonitis.Gastroenterology,2001;120:726
25 黄筵庭.门静脉高压症外科治疗的现状和未来.中国普外基础与临床杂志,2001,8:255
26 刘飞龙,郝胜华,戴植本等.新的贲门周围血管缝扎术治疗门静脉高压症.中华临床杂志,2003,7:21
27 王海杰,等.临床局部解剖学.北京:人民卫生出版社,2004
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。





