第十四章 胃外科恶性疾病
第一节 胃癌外科
胃癌是常见的恶性肿瘤,近年来其发病率虽有所下降,但其死亡率仍居前列。有关胃癌的基础理论和临床研究均取得了一定进展,但诊断治疗进展并不显著,主要表现在早期胃癌诊断率仍低,进展期胃癌预后较差,其主要原因在于诊断确定时多属晚期,如能在早期确定诊断,则一定能改善预后。
一、致病因素
导致胃癌的因素很多,但就具体病人而言,不可能用单一原因加以解释。已有资料显示,社会经济状况、饮食因素、某些化学致癌物质、遗传因素等在胃癌的流行病学调查中构成重要因素,本章不予赘述。
(一)幽门螺杆菌感染
近年发现,幽门螺杆菌(helicobacter pylori,HP)不仅是慢性活动性胃炎的病原菌,是消化性溃疡和胃黏膜相关淋巴瘤的重要致病因子,而且还可能是胃癌的协同致癌因子。流行病学调查表明,胃癌发病率与当地HP感染率呈正相关。13个国家的3 194例追踪性国际研究结果表明,HP感染者发生胃癌的危险性较非感染者高6倍以上。HP感染与肠型胃癌关系较为密切,从HP感染、慢性浅表性胃炎、慢性萎缩性胃炎、肠上皮化生及异型增生到肠型胃癌的演变过程已经明确,而弥散型胃癌则未见类同的前期变化。
一些研究提示感染HP可产生细胞毒相关蛋白抗原,使胃黏膜产生急、慢性炎症,黏膜上皮损伤,细胞增殖增加,胃液中抗坏血酸浓度降低,游离自由基增加。HP又具有强烈的尿素酶活性,胃液中氨浓度增高,动物实验提示氨与N-亚硝基化合物为共同致癌原,亦为致癌的促进剂,长期感染可导致萎缩性胃炎,引起胃酸降低和细菌过度生长,某些微生物能代谢硝酸盐成为亚硝酸盐。综上所述,HP感染可能协同致胃癌。
(二)癌前期病变
对临床医生而言,需要对病因正确理解并用以指导实际工作的,是胃癌的癌前期病变和具体危险因素的胃良性慢性病变两点。例如胃息肉,在内窥镜普及后,胃息肉的诊断及治疗常是外科会诊的内容。胃息肉可为腺瘤性息肉即真性息肉,或息肉样腺瘤,这是一种新生物,可发生癌变或已存在癌变而活检未发现。故应先作局部切除及病理学检查,若为良性腺瘤则局部切除已足够;如有部分癌变,若限于黏膜层且基底膜完好则属原位癌,分化良好者局部切除亦已足够,但需胃镜多次随访;如已侵入黏膜下层,则应视作进展期胃癌进行处理。显然胃息肉样腺瘤是一种癌前病变。相反,胃假性息肉是胃黏膜慢性炎症时炎性增生性息肉,它常与溃疡病和慢性胃炎并存,都发生在胃窦,并不是一种新生物。若局限多发病变可作胃部分切除术,单发息肉应该用胃镜摘除,其目的主要是确定假性抑真性息肉。术后都应作胃镜多次随访。胃假性息肉不属于癌前病变,是有危险性的胃良性慢性病变。
胃黏膜癌前病变广义而言指胃黏膜发生改变,具有较正常黏膜高的癌发生可能性,也就是所谓“高危人群”。它包括慢性萎缩性胃炎、慢性消化性溃疡、溃疡愈合后瘢痕、胃部分切除术后等;但是狭义而言是从组织学上看,指胃黏膜病变已逐步变为癌细胞。但即使是癌也是原位性并无浸润生长,故组织学上仍不完全符合浸润癌的标准。譬如细胞核与细胞浆体积比率增加,核多形性排列不整齐等。癌前病变的认识可从胃手术切除标本原发癌邻近的胃黏膜病变认知。把癌前病变和异型增生等同看待是不妥的。
慢性胃黏膜病变中以萎缩性胃炎为最常见,它是60岁以上人群难以避免的慢性胃黏膜变化。萎缩性胃炎的诊断随胃镜普及活检增多而增加。慢性萎缩性胃炎若同时伴有恶性贫血则胃癌发生率据说可增加6倍,但临床上两者并存少见。萎缩性胃炎伴有肠上皮化生时,引起病人的恐惧,甚至考虑手术治疗而至外科会诊。实际上是临床医师传给病人错误的信息所造成恐慌。
胃黏膜异型增生WHO(1978)分为3度(轻、中、重),此3度与日本胃活检材料分组中Ⅱ组(良性变化轻度异型变化)、Ⅲ组(良性与恶性细胞皆有界线性损害)、Ⅳ组(已为癌细胞但组织学上不完全符合标准)是一致的。轻度异型增生是再生性和/或增殖性质,完全可能回复正常,仅极少数有肠上皮化生者经一段时间后可能转变为中度和重度。中度异型增生最常见于胃黏膜宽底隆起病变,此种病变很长时间维持不变,故已不能逆转,管状腺瘤即属此。重度异型增生则是一种不稳定病变已属原位癌而组织学上尚不完全符合,因未见浸润生长存在。理论上重度异型增生与癌前病变是可以区分的,但实际上是重叠存在的。值得注意的是病理学诊断重度异型增生时,另一位病理学医师诊断为“早期癌”。内窥镜下凡隆起宽底病损组织学上多为肠型早期癌,而凹陷型者多数是弥散型。在早期胃癌周围黏膜多数可见异型增生和结肠型上皮化生。胃黏膜的萎缩和化生随着老年到来可变为广泛,结果是主细胞逐步大量减少,使胃蛋白酶原Ⅰ产生减少,使血中胃蛋白酶原Ⅰ水平降低(<20ng/L),故胃蛋白酶原Ⅰ降低是萎缩性胃炎的标志。结肠性肠上皮化生是属晚期化生,虽然H.E染色有时也能确定之,但最好是用高铁双胺阿尔西蓝染色,结肠上皮化生处染色成深棕色,提示硫黏蛋白含量多。轻、中二级肠上皮化生仍不需手术治疗,应该定期胃镜随访,每次应多处活检观察组织学是否有逆转或进一步恶化,必须多处活检确定病变范围。胃上皮异型增生之前先有肠上皮化生,由此发展为胃癌后即称为A型;无肠上皮化,直接从胃上皮细胞发生异型增生转变为胃癌者为B型。相对而言早期病变A型预后较B型为好。
胃空肠吻合术后胃镜检查常有吻合口处不同程度的慢性胃黏膜炎性改变,有上皮化生甚至异型增生出现,故有潜在发生胃癌的危险性,如果发生称为残胃癌,大多在术后10~20年发生,也有报告为术后10年,最短发生为7年。迄今无论是BⅠ或BⅡ式术后,或迷走神经干切断加胃窦切除术后都有发生残胃癌的报道。
众所周知,胃癌灶上有溃疡形成称为癌溃疡,而慢性胃溃疡基础上发生癌称为溃疡癌。慢性胃溃疡发生癌变的说法虽已见于教材并广为流传,但实际上是否存在溃疡癌变仍有争论,而且是长久未能得到解决的问题,故是否存在溃疡癌也成问题。临床医生无能力也无暇参加此种争论。值得注意的是胃癌的溃疡面在药物治疗下可能愈合或缩小,症状亦可暂时消失。
(三)癌基因与抑癌基因
胃癌的发生和发展是多阶段、多步骤的过程,不同的基因可能在不同的阶段起作用,也可能通过对细胞凋亡调节的失衡而起作用。理化和生物致癌因素可导致细胞中的原癌基因激活,活化的原癌基因称为癌基因。活化方式主要有基因点突变、扩增、重排或外源性基因的插入等;另一类基因变异表现为基因缺失和点突变,这类基因称为肿瘤抑制基因或抑癌基因,其缺失或突变与肿瘤的发生和发展密切相关。
目前经常检测的癌基因有MET、EGFR、ERBB2、RAS及AKT-2等,抑癌基因有P53、P16、RB、APC和NM23等,其中MET、RAS基因的过量表达发生在癌变早期,MET、ERBB2、EGFR 和AKT-2基因扩增与肿瘤的快速生长有关,NM23和P16基因缺失或表达水平降低与瘤细胞恶性表型有关,BCL-2基因可以抑制细胞凋亡,BAX基因则促进细胞凋亡,野生型P53可促进细胞凋亡,突变型P53可抑制野生型P53,促进细胞增殖,抑制细胞凋亡。有研究表明,在胃癌病例中凡有3个以上基因变异者,大多为分化低、有淋巴结转移和恶性程度高。
二、诊断
胃癌早期得到诊断并非易事。首先,早期胃癌多无症状,除胃窦部早期癌可以出现进食后上腹不适、饱胀或疼痛等非特异性症状外,其他部位胃癌临床上早期大多数可以是没有任何症状的,或有不引起病人注意的症状。其次早期诊断惟有依靠胃镜检查获得早期诊断,而不是吞钡或其他影像学方法。但是即使有胃镜检查,提高早期诊断率也不是轻而易举的,检查医师能否警惕认识早期胃癌损害,是否对任何怀疑部位进行活体组织检查,或常规固定部位多处取材活检,至关重要。有些内镜检查医生不能完全规范施行,因而常常延误诊断。应用电子胃镜检查有录像记录,如此则可复核录像,判断取材部位和方法是否合适。即便是进展期胃癌,临床症状多无特异性,需与胆、胰等疾病相鉴别。
临床外科医师如能经常与病理科医师一起共同对手术标本在固定前进行肉眼观察并取材,则临床医师就能熟悉肉眼病理学表现和组织学检查后结果,更不用说黏膜染色和注射病损部位使之隆起后,圈套式取材等活检方法的使用,对胃镜录像中病损的认识就能大大提高。总之,要达到早期诊断,临床医师应坚持“先检查,后处方”和胃病检查“首选胃镜”这二条原则。胃癌诊断大多先经内科和内窥镜医师之手,故早期诊断仍有赖于临床首诊医师对胃癌的高度警惕和病人自身对建议作胃镜检查的顺应性。延误胃癌早期诊断既有初诊医师问病发药或应因病人要求给药,没有作检查也没有确切诊断即有处方的临床错误,也有不理解早期病变内窥镜检查为首选的检查的原则。病人常常拒绝内窥镜检查是由于不理解这种检查的必要性和畏惧检查心理,也是临床医师对此态度不坚决的后果。目前胃镜检查设施皆已普及,但是内窥镜医师的培养和常规活检检查等原则远远落后于客观需要。
日本自20世纪70年代起手术切除病例中早期胃癌比例大幅度上升,这奠定了日本手术治疗胃癌5年生存率居世界领先地位。早期胃癌发现增多关键在于日本早已奉行“内窥镜优先”(endoscopy first)的诊断方针和例行任何可疑处黏膜活检。胃镜性能和内窥镜技术不断改善,在早期胃癌诊断上已完全取代放射学检查。
首先是胃镜活检方法的改进,原有活检方式取材太少太浅,不能满足需要。1983年Tada和Takemoto创用圈套活检法,能一次取得2~3mm直径黏膜和黏膜下层组织块。先用盐水注射需要活检局部,使黏膜病损处局部突起,盐水应注射于黏膜下层,然后对此人工造成的突起用钢丝圈套器勒断,用夹钳取出。此法对早期胃癌突起型者能完整取下,而且对下凹型早期胃癌直径≤1cm者亦能取下,Tada报告111例仅1例发生出血。
直径较细的广角前视式高分辨清晰度良好的内窥镜已完全取代了旧式内窥镜。
为了诊断胃癌黏膜上微小病损,1966年Yamakawa报告用美蓝染色黏膜诊断早期胃癌。活体染色法最早为Schiller(1933年)用Lugol液染色子宫颈早期诊断宫颈癌,此法称Schiller试验。此法在20世纪70年代用于内窥镜诊断食管癌,并用以区分食管与胃交界;此后又有刚果红染色判断泌酸。内窥镜染色技术现在常用以辨认胃肠道小的病变。
1984年出现电子内窥镜,它包括内窥镜、电视显像和录像,还有摄像系统、电脑等附件。它的最大进步是产生高质量图像,供多位观察者同时观看。电子内窥镜所得到的图像不再经光导纤维传输,而是用电子信号传输。经光导纤维传输的图像质量决定于光导纤维的直径和数目,而电子信号传输的图像光点最少3倍于光导纤维最大可能得到的图像光点,故得到高清晰度高质量图像。电子内窥镜图像可以用图像定量分析,并用光盘刻录。经显示器屏幕观察图像,也有利于诊断和治疗时术者和助手之间配合动作。
放射学检查胃癌中吞钡空气对比造影也有很多进步,虽然早期胃癌的阳性结果远比内窥镜为低,尤其是胃癌近端1/3区只有用内窥镜检查才能诊断;胃前壁病变漏诊率高达39%,而且小于1cm直径病变则不能用此发现。
进展期胃癌诊断中利用超声内镜检查可以判断侵犯胃壁深度、局部淋巴结转移和邻近胆管、肝、肾和肾上腺等重要脏器的结构与胃癌的关系。在内窥镜头上装置有高频超声探头(7.5~10MHz),探头上附有水囊,充水后可检查食管和心脏。在胃腔充水后即可经内窥镜定位下作胃壁B超实时检查。正常胃壁自黏膜至浆膜可见到5层清晰结构,即黏膜浅表面、黏膜层、黏膜下层、肌层和浆膜层。超声内镜对鉴别胃癌与其他良性肿瘤是独一无二的。
三、分期
胃癌的分期的目的与其他肿瘤一样是为了衡量病情的早晚,判断其预后,由此决定治疗方案。而且只有在统一的分期下易于比较不同地区和医院之间治疗的结果。因此分期极为重要,且疑难之处也在此。对胃癌作出正确科学的分期很困难,需要做大量细致的工作,这在多数医院很难做到。
胃癌临床病理分期主要有两大系统,即国际抗癌联盟(Union International Contre la Cancer,UICC)和美国分期和预后委员会(the American Joint Committee for Cancer Staging and end Results Reporting,AJCC)TNM分期和日本癌症研究会(the Japanese Research Society for Gastric Cancer ,JRSGC)的胃癌研究规约。二者均以原发肿瘤分期、淋巴结分期和远处转移分期为主要内容,最重要的区别在于二者对淋巴结分期方法,UICC/AJCC第4版分期中以距原发灶边缘3cm为界将淋巴结转移分为N1 N2,1997年第5版规定以淋巴结转移数目分期:1~6个为N1,7~15个为N2,超过15个为N3;而日本分期历来以胃周淋巴结解剖部位划分为3站若干组。
相当长时期内判断胃癌预后强调病理形态学上分型,对浸润深度和局部淋巴结检查重视不够。1987年公布夏威夷国际胃癌会议结果集中反映的近20年来的进步,会议根据日本胃癌研究会(the Japanese Research Society of Gastric Cancer,JRSGC)15 584例胃癌和美国外科流行病学和结果规划(the Surgical,Epidemiological end Result program SEER-USAN)4 785例分析结果,表明影响最重要因素顺次为侵犯胃壁深度、局部淋巴结转移范围、Borrmann分型、原发癌所在部位(顺次为胃窦、胃体和胃底贲门区),最后才是组织学特征,按预后好坏顺次为乳头状、分化良好、中度分化、未分化和“印戒”细胞癌。因此,除已有远处转移预后很坏外,侵犯胃壁深度和局部淋巴结转移范围是决定预后最重要的因素。但是迄今很多手术切除标本的病理学检查报告对极为重要的侵犯胃壁深度和局部淋巴结转移并无详细报告。这种几十年来一贯不变的根本原因在于临床外科没有对病理检查提出此种要求,而病理学医师并不了解现在胃癌临床上进步。胃癌如已侵犯胃壁全层并穿透浆膜面,此时术中肉眼可见癌灶。问题在于早期胃癌的诊断,即仅侵犯至黏膜下层而并未累及肌层,因为胃癌向深层侵犯并不一定是“齐头并进”的,应该对原发灶间隔多处切面先作肉眼观察,然后选择侵犯最深处作组织学切片检查,否则即使有病理学报告仍可有误。
病理学检查分期最大的困难在于局部淋巴结检查。所见论著报道皆有病例分期,但是都没有具体详细资料回答下列问题:手术标本上是否全数取下淋巴结?是否逐个多张切片检查?是否分组记录阳性淋巴结部位(即N1为胃周边淋巴结;N2为胃左、右动脉、肝总动脉、腹腔动脉、脾动脉和脾门处淋巴结;N3为肝十二指肠韧带、肠系膜上血管、结肠中动脉和腹主动脉旁淋巴结)?故大多数文章报告的分期并不可靠。一般是低估分期,像绝大多数欧美文献所见都是如此。触诊标本淋巴结变硬,无疑可能有转移,但也不尽然,也有可能多平面6张切片仍无转移;另一方面直径小于5mm淋巴结术中肉眼不易辨认,手感也如脂肪一样,也很多已有转移。此种小于5mm直径淋巴结转移可占全数转移淋巴结中2/3。而且这种外观手感并无转移的细小淋巴结切片中可能整个淋巴结皆为癌细胞充盈。因此我们得出术中手感和肉眼判断是不可信的结论,尤其是判断局部淋巴结“无异常”时。
目前国际上也没有对胃癌淋巴结检查做出具体规定,像乳癌UICC规定局部淋巴结组织学检查不能少于10枚,否则即作为PNX看待;每枚淋巴结需3张切片H.E.染色。20世纪70年代日本Soga认为每例切除标本的局部淋巴结最少为30枚,此后德国文献报告对非肿瘤腹部无手术史的尸体作规范性全胃“根治式”切除,所检得局部淋巴结数统计结果也认可30枚数目是“金标准”。至于每枚淋巴结在胃部标本中应做出几张切片检查则并无统一规定,在病理学文献中早就有规定判断淋巴结转移对肿大淋巴结应作取三等份剖面,每一剖面作2张切片检查,其阳性检出率高于3张切片和单张切片结果。我科与病理医师合作对35例胃癌手术的切除标本,经固定、脱脂后共取得局部淋巴结2 691枚,平均每例76.89±27.16枚。每枚淋巴结若大于5mm则作以淋巴结门蒂部三剖面6张切片,若小于或等于5mm则作连续6张切片,然后H.E染色由资深病理学医师读片。结果进展期胃癌局部淋巴结转移率为82.76%,转移淋巴结数最少为2枚(转移度2.86%),最多为73枚(转移度79.35%)。在我们少数病例中可见凡淋巴结转移度≥0.20,则术后大多在3年内死亡。实际上病理学检查胃癌切除标本上局部淋巴结数目是对手术规范化的一个重要的质量控制指标,也是正确分期的一个质控指标。我们自1994年起将胃癌的局部淋巴结病理学检查工作停顿下来,因为病理读片工作量十分巨大而不能持之以恒。1995年始我们对局部淋巴结采用1张切片,免疫组化细胞角蛋白染色方法检查淋巴结转移,发现凡是6张切片H.E染色有转移的淋巴结,无一例外地单张切片细胞角蛋白免疫组化染色能证实有转移;而单张切片免疫组化细胞角蛋白染色有微转移的淋巴结,6张切片H.E可以发生漏检,(1张切片免疫组化法检出率12.68%,而HE染色6张切片为7.68%,p<0.01)。漏检原因主要是微转移灶,在1张切片中往往只有少许(<50个)癌细胞,且分散分布。另一方面大量淋巴结切片检查由于疲劳而漏检的情况也难避免。相反免疫组化染色时癌细胞十分容易辨认,实际上都是年轻外科医师和技术员就能确定是否转移。这样大大减轻了病理检查中高年医师的工作量,使我们局部淋巴结检查工作得以继续下去。1995年Maehara报告了胃癌局部淋巴结微转移的重要意义,对34例因胃癌复发死亡的早期胃癌病例复查局部淋巴结时发现,发生漏检的大多是微转移所致,原先对淋巴结仅作单张切片H.E染色是不可靠的。胃癌局部淋巴结微转移的提出是在20世纪80年代后期乳癌淋巴结转移中有微转移现象才引起注意的,90年代初对乳癌淋巴结微转移的临床意义给予肯定,然后我们才将此方法移植到胃癌的淋巴转移上来。
胃癌局部淋巴结检查中另一个难题是分组。局部淋巴结分组中困难是在处理标本时,对5组与12组、6组与14、15组、7组与9组、8组与9组、2组与部分16组等分组在标本上不易区分。当这些包含在系膜中的局部淋巴结连同胃标本一并切下后,只有手术者在术后几小时内能在标本上辨认其分组解剖关系,如果术中不做出分组标记,即使是手术者也很难在标本固定后次日加以区分。而手术者历经几小时的淋巴结解剖手术后已经十分疲劳,难以继续在术后及时对未固定标本作分组工作,而其他医师即使是第一助手也难以胜任对某些部位的分组。以肝十二指肠韧带肝固有动脉、门静脉和胆总管处淋巴结解剖为例,右侧部分腹膜和淋巴结连同十二指肠球部和13组切除,其内侧部分又连成一片与胃切下。又例如幽门下6组,它与肠系膜上血管旁淋巴结在解剖切除前很易区分,但连同14、15组一起解剖分离后在切除的胃标本上就很难区分了。此种分组上容易产生的错误,带来的是分期上的错误。另一方面日本的分组方法是否合理也引起疑虑。例如胃窦癌,胃周淋巴结5组与肝固有动脉周围12组是连成一片的,而前者属N1,后者属N3。当肝固有动脉分左、右肝动脉较早时,即肝固有动脉很短就迅速分左、右肝动脉,5组与12组有些淋巴结是紧密相连的,因而此种情况下把12组计入N3是不合理的。在局部淋巴结分组上UICC早就提出距离原发灶边缘3cm之内和>3cm的淋巴结来分组,而日本文献并未强调此点。此3cm数字距离是否有科学性都值得进一步研究。有鉴于此,许多学者尝试把阳性淋巴结总数目作为有局部淋巴结转移病例最重要的预后指标。显然这是受到结、直肠癌局部淋巴结转移数目≥4枚时其预后与已有远处转移相似这一事实的影响;此外乳癌局部淋巴结的转移数目也直接与生存率呈显著相关事实都启发了对胃癌的局部淋巴结转移似乎应该从淋巴结的转移数量来分期。1997年UICC/AJCC公布的第5版TNM分期方案主要对淋巴结分期作出重大改变,即从距离改为淋巴结转移数目定量,规定1~6枚转移为N1,7~15枚为N2,超过15枚为N3。这种淋巴结分期方法得到了众多学者赞同,认为优于日本的淋巴结分期方法。实际上这种分期方法也有缺点,未规定淋巴结检查总数和每枚淋巴结切片数的要求。如果只检查5枚淋巴结就不可能有N2、N3分期病例;如果对淋巴结作单张切片就有可能漏检而使分期发生错误。在取得一定数目的局部淋巴结(如每例最少为30枚)后,必需逐枚切片免疫组化染色检查,计算阳性淋巴结总数和转移度。因为即使在日本如1990的Okusa报告433例术后标本淋巴结总数检查总数仅23.4枚/例,显然是总数不够。淋巴结分期必需大量规范化胃癌切除手术病例和规范化取材作组织学检查后才能做到,并在长期完整随访后才能得出结论。为此需要很多医院参加研究才能完成,像日本、德国和丹麦都有全国性规划。另外,由于淋巴结总数不同,相同转移淋巴结数目病人的预后也是不一样的。因此,在量化分析的基础上,引入相对数指标—淋巴结转移度(阳性淋巴结/淋巴结总数,以百分数表示)作为淋巴结分期标准是必要的。
我们对有完整淋巴结病理学检查资料的78例胃癌病人的生存率进行了分析,共切除淋巴结5 388枚,平均每例取得淋巴结69.08±26.66枚(X±SE),最少30枚,最多157枚。多变量逐步回归分析显示,不考虑淋巴结转移度时,浸润深度与淋巴结转移数目进入回归模型,是影响预后的主要因素,阳性淋巴结每增加一枚,其肿瘤相关死亡风险为原来的1.04倍,说明它不能反映风险增加的程度;不考虑淋巴结转移数目时,浸润深度与淋巴结转移度进入回归模型,皆是影响预后的主要因素,其中淋巴结转移度每增加10%,肿瘤相关死亡风险为原来的28.57倍,说明它能反映风险增加的程度;若淋巴结转移数目、淋巴结转移度均考虑在内,则浸润深度、淋巴结转移度可进入回归模型,是影响预后的主要因素,而淋巴结转移数目不能进入回归模型。以上说明淋巴结转移度在判断预后方面优于淋巴结数目。这项研究结果表明,与生存率相对应的淋巴结分期为,N0无淋巴结转移,0<N1 ≤10%,10%<N2≤25%,N 3>25%。
胃癌局部淋巴结的跳跃指N1全数、逐个、多张切片检查无转移,而N2有转移;或N1、N3有转移而N2规范化详细病理学检查未见转移。因此要确认跳跃转移也并非易事。我科35例手术标本,平均每例取得76枚淋巴结,全数逐个6张切片H.E.染色检查中仅有2例为跳跃转移。跳跃转移是存在的,但发生率低。如跳跃转移为常见,则将根本上动摇胃癌R0、R1切除的定义,并对某些病例D2手术是否存在R0切除可能性提出疑问。国内外报道都有胃癌淋巴结跳跃转移的发生率,但大多数没有详细的病理学检查的资料,如淋巴结检查总数和分组数,是否逐个多张切片检查和染色方法等,因此不一定可靠。
胃癌的远处转移术前也常忽视,这并非指CT或MIR未能发现的肝细小转移灶或骨髓穿刺才能发现的亚临床转移癌细胞,是指常忽视的锁骨上淋巴结转移和腹膜陶氏腔转移。锁骨上肿大且有质地异常手感的淋巴结,术前活检常能得到阳性结果,但未有肿大和手感正常的锁骨上淋巴结或活检HE染色阴性病例却可能有此处淋巴结微转移可能,淋巴结微转移时不一定肿大,且目前能普遍应用的只有细胞角蛋白免疫组化染色才易发现。术前如能证实锁骨上淋巴结有微转移的临床意义就是远处转移,也意味着为N3病例。有的病例在术前已能从肛门指检中得到陶氏腔腹膜有转移结果,但是相当多数病例仅在手术探查时才发现该处腹膜肥厚粗糙有细小转移颗粒。手术时如果原发肿瘤已穿透腹膜,在切口限制下任凭摸诊而不用肉眼观察也常常忽视陶氏腔腹膜转移的存在。因此术中用硬质乙状结肠镜放至陶氏腔,直接用长杆活检钳取材活检常能发现手感为“正常”的陶氏腔腹膜已有转移。盆腔腹膜有转移与腹腔清洗液细胞检查找到癌细胞的临床意义不同之处为前者已属远处转移存在而后者则否。另一方面腹膜转移灶是组织切片而腹腔洗液是细胞学检查,后者需要细胞学诊断有经验的医师才较可靠作出诊断。
四、胃癌的规范化切除手术
(一)概念
现在用规范化切除一词而不用根治性切除的理由是因为“根治”仅是人们的愿望,手术能否根治的关键仍在病理分期和手术质量,晚期病例根治性手术不能根本上改变预后。故现在用D1、D2、D3 (D代表解剖,dissection)切除表示手术切除N1、N2、N3范围,原先用R1、R2、R3,此处R意为“根治”,是Radical简写,表示手术根治性及其程度。从字面理解,既然为“根治”就不应该有程度差别。总之是废弃了一个不合理的名词,但手术解剖局部淋巴结范围仍是一样的。其根本原因是有N3转移已属远期转移,手术不能根本上改变预后。胃癌手术治疗预后差的一个原因是对能手术切除病例施行的切除手术不规范,应该达到R0切除的病例并没有施行R0切除手术。所谓R0切除是指无远处转移病例作规范性胃部分或全胃切除,伴同其系膜、局部淋巴结一并切除,不但手术中无肉眼可见残留病变,而且要得到病理组织学检查的确认。R1切除是指手术结束时肉眼观察无癌灶残留,但病理组织学检查发现标本边缘有癌组织。R2切除是指手术结束时肉眼即有癌灶残留可见。病理组织学检查认可应包括标本断端固定后5mm范围纵行取材切片组织学检查无癌细胞;局部淋巴结全数、分组取下,全数逐个对淋巴结片检查,若作D1切除(指N1淋巴结)而N1已有转移,则不能认为是R0切除,若作D2切除(指N 1、N2切除),且N2全数逐个检查完全无转移,此时才确认为R0切除。同样即使作D3切除后,N3已证实有转移,则可认为已有远处转移,虽然作D3切除仍不能认为是R0切除,此种病例应属R1切除,即组织学检查有残余可能。
当原发灶已侵及浆膜层或N3已有转移或局部淋巴结转移度已>20%的晚期病例,手术后即使辅加化疗,也仅少数有5年生存机会。联想到乳癌根治术的命运,有腋淋巴结转移时就意味着大多数病例已有远处转移,而且即使无腋淋巴结转移乳癌病例也已有相当部分病例死于远处转移。因此临床上能发现的乳癌实际上多数已是一个全身性疾病了,手术所起的治疗作用日趋变小。胃癌手术治疗的将来如何尚在未卜。无论如何胃癌在切除胃或全胃同时应该切除其局部淋巴结,在早期胃癌有N1转移时,作D2切除则5年生存率可>90%。这是与未作局部淋巴结一并切除病例相比而言。据JRSGC统计比较自1963~1966年、1967~1973年、1974~1978年、1979~1987年各个阶段的手术治疗共48 513例结果,结论是5年生存率逐步提高,不单是发现病例分期逐步提早,而且也是由于手术扩大切除淋巴结范围所致。能切除病例5年生存率自41.6%升至71.3%;Ⅱ、Ⅲ期也有改善,但Ⅳ期病例反而自26.1%降至18.9%。从该报告可见在25年中全胃切除术应用更为广泛,自16.4%升至27.7%,虽然早期胃癌病例自14.6%升至47.5%,早期胃癌中也有需要全胃切除的;在此期中D2 D3普及占手术病例也自57.8%升至87.2%,同时其总5年生存率也自64.2%升至87.2%。上世纪初德国的统计报告其5年生存率比日本低20%~30%。按日本Maruyama意见存在这种差别根本原因是日本的手术范围较广泛,因而得到正确的病理分期,而欧洲方面由于技术上原因,并未做到D2 D3切除,局部淋巴结切除和检查不足,因而低估分期。曾有认为此系种族差异所致,为此有作者统计分析了当年在夏威夷的美籍日本人胃癌手术疗效,资料表明,这些美籍日本人的5年生存率远比在日本本土者为低而与欧洲相似,由此反驳欧美外科医师认为是种族差异造成疗效不同。欧洲回顾性统计91个医疗中心。1974~1988年资料信访结果有40%无局部淋巴结解剖记录;83%医院对近端2/3区胃癌作全胃切除术,且有69%作脾和部分胰切除手术,但主动脉旁淋巴结从未解剖。统计结果结论是欧洲从未像日本那样普遍施行系统性局部淋巴结切除术,故其预后远远低于日本结果,有淋巴结转移者5年生存率仅12%。但是1993年慕尼黑技术大学外科医院报告中可见胃癌切除的局部淋巴结总数已超过40枚/例,伴同脾胰切除者达55.7枚/例,转移度为0.14~0.44,但大多数病例<0.20。全德胃癌研究综合资料切除淋巴结总数亦超过30枚/例,但最高仅为49枚/例。转移度0.20~0.35。说明欧洲也开始步日本之后赶上。20世纪90年代中期以后,欧美对于适当扩大手术范围能够提高疗效已不再心存疑虑,随之获得了更好的手术疗效,欧美学者近年来总结道:西方应学习东方在胃癌外科方面的经验,包括高危病人筛查、仔细的局部淋巴结解剖和详尽的病理学分期。
应该指出系统性局部淋巴结切除之后,是否能对全数淋巴结逐个检查,并多张切片组织学检查,这又是一个不亚于手术的困难工作。我科都是临床外科医师动手将标本固定、脱脂、染色后亲自取材送检,然后激发病理医师对此工作的注意和兴趣。最后成为病理学检查工作的常规。
(二)切除范围的选择
将胃大、小弯等分为三段,由此得到贲门区(C区)、胃体区(M区)和窦区(A区)。此种JRSGC分区简单易行。原发灶仅限于A区者作远端胃部分切除术,C区才作近端胃部分切除术,位于M区者作全胃切除术。这是指侵及肌层的进展期胃癌,早期胃癌在M区是否按此手术则有分歧。但原位癌在M区肯定不需全胃切除术;侵及黏膜下层如有EUS(内窥镜超声检查)证据则可考虑远端胃部分切除术,但一般仍应作全胃切除术,因为胃切除多少尚属次要,主要是局部淋巴结切除。胃癌作部分切除术后残端可见癌细胞浸润者高达20%,这是胃部分切除不够所致,也与有些胃癌呈弥散性生长有关,如BorrmannⅣ型皮革胃。因而国内有报告中认为胃切断线应距瘤体7cm为妥。实际上如为“皮革胃”,无例外地应作全胃切除术;胃窦癌一旦侵及体部也应作全胃切除术,胃部分切除与全胃切除的差别并不单单是胃部分切除或全胃的不同。更主要的是局部淋巴结切除范围不同,对胃的局部淋巴结切除无实践经验的医师往往对距离病灶多少较重视。由于胃癌切除胃体不足而残余癌应称为胃残癌,用以与残胃癌相区别。
我们对全胃和近端胃部分切除时,以前常规切除左半胰并连同脾脏,目的是能完整地去除10组和11组,持否定态度理由有:①切除左半胰后胰瘘和局部相关合并症增加,这主要见于欧美文献中;②脾切除影响机体免疫功能;③左半胰切除后糖尿病发生可能增加。20世纪90年代后期开始,我们对没有胰腺本身侵犯的病例仅切除脾脏,保留胰腺,但切除脾脏连同脾动脉全长去除保留胰段脾静脉,10、11组淋巴结清除数目上无显著差别。因胰腺供血良好,有胰腺内伴随胰管横行动脉供血,切除脾动脉并无缺血之虞。10余年来我科的病例尚未发生胰瘘及由此发生感染合并症,可能与我们封闭胰断面缝合方法与主胰管结扎有关。胃癌脾脏免疫功能的研究国内已有报告认为进展期时脾脏仅有负性免疫功能作用。因此为了去除局部淋巴结我们在进展期对胃癌仍施行脾连同切除术。
小网膜囊切除方面,全胃切除时应该完整切除,包括横结肠系膜的小网囊面、胰腺表面腹膜和肝总动脉与肝之间的后腹膜。但远端胃部分切除时则左半胰和左半横结肠系膜前面腹膜就未加切除,此时并非完全切除小网膜囊。
当原发灶与肝左叶、胰体尾部、横结肠和/或其系膜粘连,无论是炎性粘连抑癌性浸润应联同切除。此种联合脏器的切除不能误认为是“治愈性”或D2、D3切除。D2、D3切除是指N2、N 3的局部淋巴结切除,由于其需要故联同左半胰和脾切除,但此种脏器同切除与原发灶粘连而联同切除脏器性质不同。
在多数医院术后淋巴结分期病理学检查工作不易进行,因而惟有根据原发灶浸润深度和有否锁骨上淋巴结、陶氏腔腹膜活检来判断有无远处转移。D3切除比D2切除范围明显为广,N3转移即使作D3切除亦不能显著改善预后,故在多数医院胃癌的手术治疗应选择D2切除,早期和进展期皆是如此。
胃窦癌作远端胃部分切除(D2)时切除N1 N2组有1、3、4b.c、5、6、7、8、9组,D3(N3)切除时应增加12、13、14、15组。C区癌近端切除(D3)应包括1、2、3(近端2/3)、4a.b、7、8、9、10、11组,D3切除时应增加16组、111组。M区全胃切除术(D2)包括1、2、3、4、5、6、7、8、9、10、11组,D3切除应增加12、13、14、15、16、111组。
(三)切除手术的关键
D2、D3切除术是上腹部大手术,手术者必需有良好局部解剖知识和熟练的手术技巧,此外应熟悉病理学的肉眼观察表现。此种手术关键在于手术野暴露良好,要达到此点手术体位是关键所在。病人取仰卧位,利用腰桥和床面使其以剑突为中心的上腹部向腹侧凸起,手术床再取头高足低位15°。取正中纵行自剑突至脐下5cm切口,切口长以良好暴露为度,切忌任意横向延长。故体位和正中长切口是良好暴露的关键,可使食管裂孔、腹腔动脉区、左侧肾上腺和肝十二肠韧带距腹壁切口距离较仰平卧位变浅5~7cm。置于头侧的龙门式拉钩将两侧肋弓或剑突处用铁链拉钩拉开虽能使食管贲门部获得较好显露,但术后疼痛明显加剧,故不少人不赞成使用。以剑突为中心反弓式体位不能单凭“腰桥”抬起,必须把手术床以剑突和腰桥为中心,头、尾两侧稍低,然后整个手术床取头高足低位10~15°倾斜。此手术的另一关键是“精细解剖法”。即在解剖裸露肝十二指肠韧带的胆总管、肝固有动脉和门静脉时,或腹腔动脉、肝总动脉、肠系膜上血管和结扎切断胃十二指肠动脉于其起点时,应采用神经外科常用的尖头平镊、神经剥离子和尖刀作锐性精细解剖,切开解剖动脉外层交感神经淋巴板层组织,顺血管纵向分开两片连同胃切除。此种精细耐心的锐性解剖是此手术的另一关键。显然必需熟悉腹腔动脉、肝固有动脉和其分支的各种“变异”,也是使手术时间延长的主要原因。
(四)规范化手术的标志
规范化手术记录不在于写D2或D3手术结论,而是根据以下几点:
(1)结扎支配胃的动脉和静脉应在动脉的起点和静脉的终点。胃左动脉、脾动脉应结扎于其起点,就必需解剖暴露腹腔动脉及其分支;胃右动脉结扎于其起点就必需暴露肝总、肝固有动脉,结扎胃十二指肠于其起点切断,仅保留肝动脉血供,胃右、十二指肠上动脉等分支皆在肝动脉处结扎。为了胃右动脉确切在起点结扎离断,如果不结扎胃十二指肠动脉、十二指肠上动脉是不可能完整切除幽门上区局部淋巴结的,而且费时更多,因为解剖“变异”为常见。胃网膜右动脉亦应结扎于其起点胃十二指肠动脉上,虽然该动脉已经在起点结扎,但是只有这样才能清除幽门下区淋巴结。胃网膜左动脉在近端胃和全胃切除时不需结扎,因为已连同脾和左半胰一并切除,除非要保留脾脏。胃左静脉大多终至于胰体背侧脾静脉汇入门脉处,脾静脉在脾动脉处水平结扎。门脉离胰头颈部进入肝十二指肠韧带后,表面有几支细小静脉支应于结扎,很难确定是胃右静脉抑十二指肠上静脉,也不需去确定,只是结扎裸露门脉即可。
(2)规范化手术另一重要标志是裸露血管和其他器官及组织。它包括裸露“三管”,即胆总管、肝固有动脉和门脉,肝总动脉需保留故也应裸露;胰头颈部壁层腹膜应伴同血管淋巴结组织切除,且连同胃一起,以裸露颗粒状胰组织为标志,还有其附近的肠系膜上血管、结肠中血管(D3术);食管裂孔和膈脚表面腹膜应连同胃切除,裸露有光泽的膈脚筋膜和有肌肉纵行纤维膈脚,在远端胃部分切除术时自食管末端起顺胃小弯直至断胃处的胃小弯纵行肌纤维应裸露,否则何能清除1、3组;小网膜囊全切除是在全胃手术中施行,裸露切除肝总动脉、腹主动脉、Winslow孔和肝尾叶之间小网膜囊背侧后腹膜区,连同胃切除,横结肠系膜的网膜囊面也应连同大网膜胃体切除,并裸露结肠中动脉至其起点。切断脾肾和结肠脾曲腹膜翻起脾和左半胰,再结扎切断肠系膜下静脉,裸露左肾Gerota筋膜及其头侧左肾上腺。此处在肾上腺表面有一些血管伴随16组淋巴结应一并去除,裸露左肾上腺,顺此层次直至腹主动脉和腹腔动脉,并显露之;在腹腔动脉下方即为肠系膜上动脉应解剖显露,去除附于动脉上淋巴结神经组织。如果不解剖显露这些部位,如何能作D3切除?因此结扎离断动脉的解剖部位和裸露一些必需保留的血管和脏器是判断规范化手术的标志。应该指出胃体癌和胃底癌距腹腔动脉、肠系膜上动脉发出处、左肾上腺腹侧皆可能十分接近,而这些部位淋巴结多数皆属N3,但在3cm范围内显然此种分组可能是不合理的。从切除标本上看,从上述N3组织都附连于胃小弯上,因此只有手术者在未固定标本时才明白这是属主动脉而来自N3,而病理医师是无法想象揣测的。同时也反映JRSGC此种分组的缺点,主要是没有考虑到淋巴结引流途径距离来设计胃癌的淋巴结引流,仅考虑正常的胃淋巴引流。
(五)重建方式
需要讨论重建方式仅是全胃切除术后病例。远端胃部分切除术和近端胃部分切除术后,前者用BⅡ式吻合,后者用食管胃再吻合术。值得注意的是近端胃部分切除术后,我们常规做幽门成形术利于胃排空。胃癌手术应该切断迷走神经干,充分游离下段食管并拖向腹腔,以利于切断足够长度食管和“留有余地”以供吻合。因此幽门成形术是必须附加的,否则虽然仅有1/4病例发生胃排空障碍,但这足以使病人饱受其苦,而且使返流性食管炎的发生也增加。全胃切除术后我们一直采用Roux-en-Y术式原因是最简易迅速,病人已经历4h冗长的解剖手术,故尽量采用最简单方式重建,而且这是大多数日本医院常用术式。近10年来不断有报告采用空肠间置P型吻合方式。国外文献有营养状况监测,同位素标记食糜排空监测记录,并与Roux-en-Y术式进行对比的报告。但结果意见并不统一,有认为P型吻合空肠间置可改善食物滞留时间和营养状况,但也有对比研究在营养状况上并无差别。我们未采用P型空肠间置方式原因有十二指肠球部已完全切除,因此有时可能需要作空肠端十二指肠降部侧吻合,费时太多,且是否有肯定效果尚存疑问。
食管空肠采用端侧吻合,首先将食管与两侧膈脚固定防止回缩产生张力,然后封闭空肠端,距断端8cm处空肠距离系膜2cm处(不在系膜对应缘!)切开作口以备吻合,先作黏膜下止血后再将空肠袢上提至食管,将上提的空肠曲横形固定于膈脚上左右各两针。作食管空肠吻合,为单层较稀疏缝合,食管为全层,空肠为浆肌层(黏膜不应缝入),进针距切缘8mm。吻合完成后,可见吻合口后壁有健康空肠壁作衬,而非裸露,再反转空肠端覆盖于吻合口腹侧并固定之。此种吻合口前后左右皆有健康血供良好空肠有浆膜的全层肠壁覆盖,这是防止吻合口瘘最简单可靠方法。
五、化学治疗
早期胃癌D2切除治疗效果满意,而进展期胃癌尤其侵犯浆膜层时手术效果令人失望,因而化疗就频频使用。化疗按其目的和方式分为辅助性化疗、辅加化疗、术前化疗(neo-adjuvant chemotherapy)、全身性化疗、腹腔内化疗和动脉插管选择性术前化疗或(姑息性)化疗。辅助化疗指手术已达到R0切除,由于属进展期病例故术后给予3~6疗程化疗;辅加化疗指手术为R1、R2切除,术后加用化疗;术前化疗指进展期胃癌术前用联合化疗使分期降低或切除率提高;腹腔内化疗用于对症治疗主要用于控制有癌性腹水病例;手术结束前腹腔用含有丝裂霉素、顺铂等药物的温热溶液循环灌洗,即持续高温腹腔灌注(continuous hyperthermal peritoneal perfusion,CHPP),使注入溶液不超过44℃,流出溶液温度在41.4℃,利用高温和药物作用来杀灭腹膜腔内残存癌细胞,以防止或减少腹膜转移,已得到晚期病例生存率有延长的结果,但灌洗时间长短、高热控制、吻合口瘘等的防止都应有预防措施。
过去20年欧美和日本都有前瞻性对比临床辅助化疗的报告,从用单药噻替哌开始,后来用5-FU联合丝裂霉素C,1985年用FAM方案,都有前瞻性对比报告,但结果皆令人失望,效果既不明显又不恒定。分析20年来辅助化疗无疗效的原因,Nakajima认为:①手术切除不彻底残余瘤量过多,尤其是在欧美。②手术死亡率和合并症低,术后病人处良好状况,方可使辅助化疗顺利进行,否则难以接受足够辅助化疗疗程也是辅助化疗效果不恒定的一个重要因素。③化疗方案选择可能也是一个重要因素,单药化疗肯定不如联合用药。但是像FAM方案一度被认为是辅助化疗标准方案,其结果仍令人失望。近来对进展期胃癌进行术前化疗报告增多,它使一部分病例分期下降,切除率提高。如用EAP(Etoposide,Adriamycin,CDDP)有高达70%效应率,其他方案如FAM、PMUE(CDDP,MMC、UFT,Etoposide)也有相当1/3左右晚期病例缓解而手术。
总之辅助化疗虽然临床上仍频频使用,但20年来临床前瞻性对比试验结果不能证明有疗效。其原因可能为剂量、疗程不够;术后合并症不允许及时进行;病例中含有R1 R2手术或很晚期病例;病例对比分析应有详细分期和足够病例数,否则不易确定某些进展病例可能有效。多数研究皆作笼统全组对比分析,主要原因分组后病例数不足。辅助化疗在某些分期病例可能具有辅助化疗目的的疗效,尚待更多研究证实。新近报告的美国西南肿瘤组9 008例胃癌临床观察表明,术前化疗组手术切除率提高,术后复发率下降。
我们常用腹腔内化疗于有浆膜侵犯的进展期胃癌病例,作为术后辅助治疗或辅加治疗,此外用于癌性腹水的对症姑息治疗使腹水减少或消退。阿霉素、顺铂和足叶乙甙为常用药物,但前两者皆可引起腹痛,故应稀释1 500m L生理盐水中滴入腹腔可减轻腹痛。腹腔内化疗用单次剂量一般稍大于全身用量,且多为单种化疗药物给予,间隔时间亦可较全身给药短。
腹腔内热化疗用于手术结束之际,作含化疗药物的生理盐水热溶液腹腔内循环灌注,有报告对晚期病例能延长生存率。但是腹腔内温度是否必需保持41.5℃(初步试验报告中数据)?持续时间是否需120min?吻合口瘘和肠曲高温损伤达到何种程度?皆有待探讨。术后辅助腹腔内热化疗的应用目的是减少术后腹腔内复发,尤其是腹膜广泛转移。值得注意的是临床上也存在尚未侵及浆膜的原发灶,而腹膜已存在远处转移。因此简单地认为侵犯浆膜后才有脱落癌细胞种植转移也是不全面的。腹腔内化疗伴全身化疗已有用于术前病例希望能增加缓解率,提高手术切除率,降低分期和有更多的晚期病例达到R0切除。
结 语
迄今胃癌的治疗仍是以手术切除为主要手段,化疗仅仅是术前、术后辅助治疗。胃癌的手术治疗除早期胃癌时施行D2手术,达到R0切除,则预后相对为好,尤其在无淋巴结转移时则预后较有淋巴结转移后明显为好。晚期或进展期胃癌,如无N2转移,施行D2手术达到R0切除则5年生存率尚有50%以上。胃癌的早期诊断极为重要,是提高生存率主要途径。胃癌的全胃切除D3手术可以说是上腹部最大的手术之一,难度较大,术前病情判断、术前后营养支持,老年伴随病的处理等已成为判断外科整体水平的标志。很多外科医师只追求施行D3大手术,忽视由此带来围手术期的各方面处理,知识局限而不全面,动辄请麻醉科内科会诊,责怪病理医师对局部淋巴结检查马虎而不问自己手术如何,这是影响胃癌外科发展的主要问题。
参 考 文 献
1 Reed PI,Carboni M,Johnston BJ,et al.New trends in gastric.Cancer Backgroundand videosurgery 1990 Kluwer Academic Publishers,Dorhrecht,P.107-173.
2 Siewert JR,Boettcher K,Stein HJ,et al.Prolblem of proximal third gastric carcinoma.World J Surg 1995;19:523-531.
3 Hermanek P,Writekind C.News of TNM and its use for classification of gastric cancer.World J Surg 1995;19:491-495.
4 Maruyama K,Sasako M,Kinoshita T,et al.Pancreas-preserving total gastrectomy for proximal gastric cancer.World J Surg 1995;19:532-536.
5 Adachi Y,Kamakura T,Mormi et al.Prognostic significance of the number of positive lymph nodes in gastric carcinoma.British J Surg 1994;81:414-416.
6 Setoy,Magawa H,Muo T.Impact of lymph node metastasis on survival with early gastric carcer World J Surg1997;21:186-190.
7 Okusa T,Nakane Y,Boku T.et al.Quantitative analysis of nodal involvement with respect to survival rate.Surg,Gynecol,Obstet 1990;170:488-493.
8 Siewert JR,Stein HJ,Boettcher:Lymphadenektomie bei Tumoren desoberen Gastrointestinal trakts.Der Chirug 1996;67:877-888.
9 Maehara Y,Baba H,Ohno,et al.Cytokeratin staining reveals micrometastasis in lymph nodes of early gastric cancer.Surgery 1995;117(4):480.
10 Macdonald JS.Advances in the therapy of gastric cancer.Gastric Cancer2002;5 Sup11:35-44.
11 Hohenberger P,Gretschel S.Gastric cancer.Lancet2003;Jul 26;362(9380):305-15.
第二节 胃非上皮恶性肿瘤
一、胃非何杰金淋巴瘤
淋巴系统外的恶性淋巴瘤约为1/4,胃是淋巴系统外淋巴瘤最常见的器官。胃淋巴瘤约占胃恶性肿瘤1%~5%。原发性胃淋巴瘤指临床上仅有胃病变而无全身性淋巴系统病变者,虽然何杰金氏病有时也可能累及胃,但原发性胃淋巴瘤无例外的皆为非何杰金氏淋巴瘤(non-Hodgkin’s Lymphoma,NHL)。
NHL是免疫系统成分细胞的新生物,其生物学特征差异很大,有些为低度恶性淋巴瘤,即使无治疗可以维持多年。尤其在胃多伴有重度幽门螺旋杆菌感染,如能及时有效治疗黏膜幽门螺旋杆菌感染,此种黏膜相关淋巴样组织(Mucosa associated lymphoid,MALT)低度恶性的淋巴瘤有可能逆转而治愈报告。但高度恶性NHL如果未及时有效治疗,可能仅能生存数周。病毒感染淋巴样组织也可以引起淋巴增殖,如Epstein-Barr病毒、人体B细胞亲淋巴病、人体T细胞亲淋巴病毒。此种病感染引起淋巴增殖多症,在有免疫缺陷时(先天性、HTV感染后或药物引起者),此种感染性单核细胞增多症也可能是致命的,因为可以引起基因突变发生真正的淋巴瘤。
(一)淋巴瘤病理学分类
NHL的分类比HL的分型复杂得多,曾提出过多种分类方案:随着对淋巴细胞及淋巴瘤发生、发展过程的生物学、免疫学、分子遗传学研究的不断深入,淋巴瘤分型方案也不断演变。NHL是一组异质性疾病,它包括多种形态特征、免疫表型、生物学规律、发展速度和治疗反应各不相同的类开动,因此,适应临床应用的分型方案十分重要。在诊断在本病时,必须明确该病例属哪一类型,才有利于临床医生得以较好地预计其发展规律、判断预后及正确地制定治疗方案。
1.美国国立癌症研究所组织制定的工作方案(Working Formulation) 制定工作分型(WF)的原意是使各个不同的分型有一共同的传译体系以便于互相理解及学术交流,但事实上,自人工作分型公布以后,已成为世界各国学者普遍接受并直接应用的分型系统。迄至今日,几乎在所有的国际学术会议上,均统一使用这一分型。旧的病理学分类(Rappaport分类命名)早已被国际通用的NHL组织病理学工作分型(Working Formulation)所替代。见表14-1。
表14-1 Working Formulation分类(NHL的组织病理学)

凡高度恶性者:细胞核无分叶,为母细胞性;中度恶性者可以为滤泡或弥漫性,前者分化为高,后者较低,但前者又为大细胞无分叶,而后者为分叶或混合型细胞,分叶细胞分化程度显然高于未分叶者。低度恶性为小细胞性、分叶和滤泡性结构,即分化度为高者,反之为高度恶性。
表14-2 REAL分类

2.REAL分型方案 来自世界多国的多位病理学家组成了“国际淋巴瘤研究组”,于1994年在Blood杂志上发表了“修订的欧美淋巴瘤分类”(Revised European-American Lymphoma Classfication),简称REAL分类(表14-2),此分类系统中补充了不少新的临床病种(Clinical Entity),而且近几年日益为临床界认识和重视。此分类的特点是:①类型较全面,广泛,包括了不少WF漏组织的类型,补充了WF的不足。②对各型的描述,除形态特征外,还包括较多的免疫表型及细胞遗传学特点或基因突变位点,较好地反映了淋巴瘤研究的新进展。③将急性和慢性淋巴细胞白血病、多发性骨髓瘤、霍奇金病也列入此分类体系。但分类系统较繁复,设备和技术要求较高。
弥漫型大B细胞淋巴瘤最多见,约占31%滤泡状淋巴瘤占22%。MALT淋巴瘤占8%,其他为20%。此分型中列举的新病种有MALT、皮质细胞、边缘区、纵隔B细胞和退变的大T细胞淋巴瘤,共占21%。
(二)淋巴瘤的临床分期
无论hodgkin淋巴瘤或NHL仍皆沿用Ann Arbor分期(表14-3),它表示病程早晚,故对预后和生存期影响更大。(www.daowen.com)
表14-3 Ann Arbor分期

注:E指淋巴系统外器官,S指脾脏
(三)临床表现
任何淋巴瘤来源于淋巴样组织,包括胸腺、骨髓、淋巴结、脾和消化道MALT,胃淋巴瘤即属后者。大多数淋巴瘤都迅速广泛散布,肿瘤细胞贮集到能产生症状时,>90%NHL病人已有广泛散布。
胃NHL引起症状有消化不良、出血、梗阻和穿孔,与消化性溃疡或胃癌表现相似。理学检查可能摸到肿块,吞钡检查和胃镜有各种表现,如胃黏膜皱襞变粗厚僵硬、溃疡病变、突起物和息肉样变,皆由于黏膜和黏膜下瘤细胞浸润所致。可为单一病变,也可为多发病变。胃NHL可以侵犯超过幽门到十二指肠,此与胃癌不同,也可侵及临近器官,胃局部淋巴结也有病变。胃NHL多伴有重度幽门螺旋杆菌感染。
(四)诊断
1.胃镜 自从纤维胃镜检查广泛应用后,就可以作胃黏膜活检取得诊断,故有些病例术前已有明确诊断。但是由于活检时取材位置不当或数目太少,未能正确诊断也是常见的事,这主要是取材太浅,因而误诊为胃癌也常见。
在术中凭手感和外观识别胃癌和胃NHL并非易事,因而常常误诊施行“根治性”胃切除术。其中约1/3病例可能治疗,其余病例如未跟随全身性化疗终将“复发”。
术前胃镜取材漏诊主要原因是NHL病变在黏膜和黏膜下深处,活检取材表浅和未多处取材也是漏诊原因。故再次胃镜取材也是明智的措施。
术中胃NHL常误诊为“皮革胃”,这是由于胃壁浸润增厚,且黏膜皱壁也因浸润而增粗肥厚;有时出现大而深的溃疡形成,常有出血和出血史,这也使内镜医生有顾忌而不作深处活检和多处活检。
2.临床检查及诊断方法 即使胃镜活检确定NHL,在术前诊断中仍需作出分期诊断,故应全面确定全身累及范围。
(1)必要的检查:
1)详细的病史(包括发热、盗汗、消瘦、皮肤瘙痒、乏力)。
2)全面的体格检查,包括淋巴结、咽淋巴环、肝、脾、骨骼。
3)化验检查:血象、血沉、血清碱性磷酸酶、肝功能、肾功能。
4)X线检查:胸片(正侧位),双侧下肢淋巴造影,骨骼压疼部位摄片。
(2)选择性检查:
1)全肺断层摄影常规胸片有异常,纵隔、肺门淋巴结肿大。
2)CT检查及超声检查补充淋巴造影的发现。
3)有下列情况时考虑骨髓活检:碱性磷酸酶升高;原因不明的贫血或其他血细胞抑制;其他的骨病变(扫描或X线);Ⅲ期以上的全身性病变。
4)分期性剖腹探查术,脾切除术。
(3)辅助性检查:
1)肝脾、骨骼、肾等器官的核素显象及肾图;
2)血液生化检查包括血钙及尿酸等;
3)免疫学检查及结核菌试验;
4)镓全身扫描。
(4)淋巴造影:
1)淋巴造影的目的在于寻找腹腔内淋巴结是否受侵。主要用于恶性淋巴瘤的分期;判断放射治疗或化学治疗的疗效;发现疾病是否复发。造影剂可在体内滞留9个月到1年,因此能重复摄片以观察疗效。
2)适应证:恶性淋巴瘤Ⅰ、Ⅱ期必须和下肢淋巴造影,以便了解腹膜后淋巴结有无侵犯;腹股沟病变常伴有腹膜后淋巴结侵犯,因此对腹股沟淋巴结肿大的病例需要进行淋巴造影;NHL病人易有骨髓侵犯,因此宜先作骨髓穿刺或活检,如证实已有骨髓侵犯则不再作淋巴造影术。
3)禁忌证:肺实质病变;碘过敏史;已知Ⅲ、Ⅳ期病变,特别是隔下可扪及肿块者。
3.分期性剖腹检查和脾切除术 以分期为目的剖腹探查术国外不少研究单位已列为必要的检查项目,包括脾切除、肝脏楔形切取活检和针吸活检,如有全身症状、淋巴造影可疑、脾可扪及,病理为混合细胞及淋巴细胞削减型,或属左下颈病变、淋巴结标本血管侵犯者,可接受分期性剖腹探查术。
由于NHL剖腹探查术后并发症比HD为高,转移又无一定规律性,易有淋巴结外侵犯,因此分期性剖腹探查术对NHL的诊断价值较小。
此外,切除脾脏可提高对放疗或化疗的耐受性,并可避免照射脾脏时对周围器官的损伤。
对病期早的年轻女性患者在剖腹探查的的同时应行卵巢固定术,就是将卵巢移位于子宫后方,固定在中线位置,并用银夹作标记。以避免直接照射,保留生育能力。一般是需要照射盆腔内淋巴结时才进行卵巢固定术。
4.CT扫描检查 CT扫描能发现下肢淋巴造影所不能发现的淋巴结组,如肠系膜、隔脚后、胰周,肝门、腹腔动脉旁等淋巴结。CT也能发现脏器病变。但CT扫描有局限性,首先以淋巴的大小来判断有无病变,不能观察内部结构,因此常将一部分反应性增生也误诊为阳性。其次CT显示的盆腔淋巴结不如下肢淋巴结造影明确。由于NHL常侵犯淋巴造影不能显示的淋巴结区域及脏器,如有可能仍应首先考虑CT。对脾脏诊断的假阴性率高,因此对HD病人,CT扫描不能代替剖腹探查术。
由于胸部CT,有时对隐脚、纵隔病变以及气管旁,肺门和主动脉窗等淋巴结肿大的诊断的也有帮助。
(五)治疗
手术治疗仅能切除胃和局部淋巴区,但不可能对其他区淋巴结或器官都作切除,因此手术治疗仅限于ⅠE和ⅡE期胃原发性NHL的有效治疗。放射治疗仅能对胸腹主动脉旁、髂血等旁淋巴区作有效局部治疗,但不能对肝、脾实质性器官作有效局部治疗,且放疗要仔细设计剂量和放射途径,以免肠管和其他敏感器官受放疗损伤。全身化疗对局部和全身淋巴瘤都是有效的治疗,但常引起骨髓抑制和感染并发症,此外化疗使血小板减少也是治疗上的难题。尤在胃NHL,化疗后80%病例可能发生局部出血或大出血,迫使在化疗期中急诊手术。故胃NHL治疗需手术局部切除,又需要全身化疗用以控制全身性淋巴瘤。胃NHL一旦确诊仍需先作胃局部切除,附局部淋巴区切除(确定分期)。术后用全身化疗,不管是ⅠE或ⅡE期或其他分期。因为不作胃NHL局部切除,术后如发生胃出血被迫急诊手术是一种并发症较多的手术。
应避免作全胃切除术,因为全胃切除术后如无营养支持治疗,化疗常因营养不良难以继续。
胃NHL手术不同于胃癌手术,它不需要距病变很远处断胃,允许有残留微小病灶,术后正规化疗都能治疗此种病灶而无局部复发。
放疗也有用于胃NHL,低度恶性常用剂量是35Gy/25天,但中度和高度恶性者剂量加大至45~50Gy。
胃NHL或NHL主要的治疗是全身性化疗。胃NHL施行手术的原因是出血、穿孔和梗阻,此外尤其是巨块型病变,如先用全身化疗或局部放疗都容易引起出血合并症。但是单用手术治疗仅限于Ⅰ期少数病人有可能治愈,因此全身性化疗是主要治疗,而手术治疗仅是辅助作用。治疗方案决定之前必需先有组织病理学检查决定其分型分化程度,即其恶性度,然后通过临床和手术确定分期。恶性度高的NHL目前仍逗留于姑息性治疗,而中度和低度恶性者可达到治愈性治疗效果。
胃NHL分期ⅠE、ⅡE者化疗仍需联合化疗,单一药物化疗由于疗效差早已废弃,常用CHOP方案(第一天:环磷酰胺600mg/M 2,阿霉素40mg/M 2,长春新碱1.4mg/M 2;第1~5天:强的松60mg/M2),间隔3~4周,共6~8疗程。单用手术或瘤体未切除者预后较差,故手术切除后继全身化疗是胃NHL的标准治疗。
二、胃平滑肌肉瘤
胃肉瘤绝大多数是平滑肌肉瘤,约占胃恶性肿瘤的1%。国内文献对此报告并不少,任何年龄皆可发生,多数在40~60岁之间发病,男女相同,其病因不明。
胃平滑肌瘤与平滑肌肉瘤组织学上鉴别常有困难,主要根据瘤细胞中有丝分裂细胞多少来判断良性平滑肌瘤和恶性平滑肌肉瘤,有的以连续10个高倍镜视野下可见有丝分裂细胞>10个则认为是恶性,有的则作瘤细胞记数,如有丝分裂细胞所占比例>10%则可视为恶性。困难在于处于显然为肉瘤的有大量有丝分裂细胞、细胞异形和凝固性坏死病例与甚少有丝分裂细胞和异形细胞之间显然为肌瘤的病例,各家诊断标准不一。术中肉眼诊断更为困难,除非术前或术中能发现血行转移证据。
组织学上有纺锤状细胞和圆形上皮样细胞两型,偶尔同一肿瘤中此两类型瘤细胞都存在。虽然形态学上细胞不同,但临床表现、病程和预后并无差异。
胃平滑肌瘤和肉瘤来源于肌层,临床表现主要是向胃内生长和/或向胃外生长的肿块,后者常误诊为来自胰腺、后腹膜肿瘤,也有误认为来自左肝或脾脏肿瘤,有时胃后壁肿瘤有一蒂与胃相连,肿块坠入腹腔造成诊断上困难,直至剖腹术后才确定。无论如何腹部肿块是常见体征和主诉,肿块也有直径大至30~50cm。我们曾切除胃后壁坠入腹腔巨大肿瘤重8.8kg,当时经多方会诊病理报告为良性平滑肌瘤,2年后出现肝广泛转移灶,才明白病理报告虽历经数家有经验专家会诊仍为错误。较大的此种实质肿瘤内常有囊性坏死液化灶或出血灶,在超声、CT或MRI中有相应的影像,就应该诊断为肉瘤。向胃内生长肿瘤则较早引起病人注意而就诊,因为多引起胃黏膜溃疡形成,常有出血,引起呕血或黑便,出现贫血后果。此外尚有进食后饱胀、消化不良、胃排空障碍。吞钡胃腔照影或胃镜皆可得胃壁肿瘤诊断,但由于胃镜取材不易取得肿瘤本身,故常在术前不易得到组织学诊断。术前误诊为胃癌最为常见。
术前检查应注意有无肝的血行转移,局部淋巴结可能肿大但转移少见。
术中胃良性平滑肌瘤和肉瘤如应用快速切片是不易作出明确诊断的。但此种恶性肉瘤由于无黏膜和黏膜下淋巴转移,也无局部淋巴结转移特点,故切除时只要离肿瘤周边2cm即可;近胃底贲门或胃窦幽门前肿瘤应施行近端或远端胃部分切除术;与邻近器官有紧密粘连时应尽可能连同切除之;局部淋巴结无需切除。若术后病理报告确定为肉瘤或瘤体巨大有坏死出血灶者,应考虑作全身性辅助化疗。
三、胃肠道间质瘤
胃肠道间质瘤(Gastrointestinal Stromal Tumor,GIST)是一类起源于胃肠道间叶组织的肿瘤,占消化道间叶肿瘤的大部分。GIST在恶性胃肠道肿瘤中占1%,恶性胃肿瘤中占2.2%,小肠恶性肿瘤中占到13.9%,结直肠恶性肿瘤中只占0.1%。间质瘤作为一个较新的概念,应该涵盖了以前所谓的“胃肠道平滑肌瘤”或“胃肠道平滑肌肉瘤”。但作为间叶组织发生的肿瘤,胃肠道平滑肌瘤或肉瘤的概念并未被排除,只不过在目前的临床病理诊断中,这类肿瘤只占胃肠道间叶源性肿瘤的少部分。因此,目前我们必须将消化道间叶源性肿瘤由以平滑肌肿瘤为主的观念转变到以胃肠道间质瘤为主的观念。
(一)研究历史命名
胃肠道间叶源性肿瘤在胃肠道肿瘤中只占少数,但却种类繁多,形态复杂。过去由于病理学技术的限制,胃肠道许多混有平滑肌纤维或神经束的梭形细胞肿瘤,常被诊断为平滑肌源性肿瘤或神经源性肿瘤。现在的研究认为其中大多数为c-kit阳性或CD34阳性类似Cajal间质细胞(Interstitial Cells of Cajal,ICC)的间叶性肿瘤,即目前的定义的胃肠道间质瘤,而平滑肌源性或神经源性肿瘤只占极少数。
1960年,Matin等首先报道了6例胃壁的胞浆丰富的圆形或多角形细胞瘤,命名为胃上皮样平滑肌瘤;1962年,Stout报道了69例胃的间叶性肿瘤,称之为“奇异型平滑肌瘤”或“平滑肌母细胞瘤”;1969年,在WHO的肿瘤分类中称之为上皮样平滑肌母细胞瘤,虽因电镜下也未找到平滑肌的证据有所怀疑,但未予足够重视。1983年,Mazur、Clark发现大多数胃肠道间质瘤缺乏平滑肌细胞的特征,提出胃肠道间质瘤概念,将GIST定义为包括生物学行为与起源不明的全部胃肠道梭形细胞肿瘤。自此,胃肠道间质瘤(GIST)概念渐为多数人认识和接受。1998年,Kindblon等研究表明,GIST与胃肠道肌间神经丛周期的Cajal细胞相似,均有c-kit基因、CD117、CD34表达阳性。ICC功能,因此目前认为GIST可能不是起源于ICC,而是起源于ICC同源的前体细胞(间叶干细胞),这也可解释部分瘤细胞中有灶性肌源性标记表达。因此,目前大多数作者不赞同用GIPACT命名来取代GIST命名。现阶段用GIST命名(复数为GISTs)比较恰当。
(二)病理学特点
1.大体形态 肿瘤大小不一,自0.2~44cm不等,起源于胃肠道壁固有肌层,可向腔内、腔外或同时向腔内、腔外生长。向腔内生长可形成溃疡,因此根据肿瘤主体位置可分为腔内型、壁内型、哑铃型、腔外型和腹内胃肠道外型。大多数肿瘤呈膨胀生长,边界清楚,质硬易碎;切面鱼肉状。灰红色,中心可有出血、坏死、囊性变等继发性改变。肿瘤数目可为多个。
2.组织学特点 GISTs主要是由梭形细胞和上皮样细胞构成,两种细胞可同时出现于不同的肿瘤中,但形态学变化范围大。依据两种细胞的多少可分为梭形细胞型、上皮样细胞以及梭形和上皮细胞混合型。肿瘤细胞的排列也呈多样化,以束状和片状排列居多。胃与小肠的形态学变化大,直肠的形态学变化小,大部分为梭形细胞型,交叉束状排列多。肿瘤细胞分化不等,可出现核端空泡细胞和印戒样细胞。
3.免疫组化特点 GISTs免疫组化研究表明CD117(c-kit)和CD34为其重要标志物。80%~100%的GISTsCD117呈弥漫性表达,而平滑肌细胞和神经不表达CD117。60%~80%的GISTs肿瘤细胞中,CD34呈弥漫阳性表达,并且良性的GISTs的CD34表达较高。CD34表达特异性强,在区别GISTs与平滑肌瘤或神经源性肿瘤时具有重要价值。CD34阳性表达时,往往CD117也呈阳性表达。CD117、CD34的表达与肿瘤位置、生物学行为细胞分化及预后无明显关系。此外,GISTs也可有肌源性或神经源性标记物的表达,如2-SMA、desim、S-100等。但阳性率低,且多为局灶阳性。
(三)临床表现
GISTs是胃肠道最常见的间叶源性肿瘤,占胃肠道恶性肿瘤的1%~3%,估计年发病率为1/10 000~2/10 000,多发于中老年患者,40岁以下患者少见,男女发病率无明显差异。大部分GISTs发生于胃(50%~70%)和小肠(20%~30%),结直肠约占10%~20%,食道占0~6%,肠系膜、网膜及腹腔后罕见。
GISTs的症状依赖于肿瘤的大小和位置,通常无特异性。胃肠道出血是最常见症状。而在食管,吞咽难症状往往也常见。部分病人因肠穿孔就诊,可增加腹腔种植和局部复发的风险。
GISTs病人第一次就诊时约有11%~47%的已有转移。转移主要在肝和腹腔,淋巴结和腹外转移即使在较为晚期的病人也较为罕见。转移瘤甚至可发生在原发瘤切除后30年。小肠GISTs恶性程度和淋巴结转移率最高,而食道GISTs恶性程度低。因此,严格来说,GISTs无良性可言,或至少为一类包括潜在恶性在内的恶性肿瘤。
CT、超声内镜、消化道造影可看到并判断GISTs大小、局部浸润、转移、位置等。
(四)诊断与鉴别诊断
根据病人消化道出血或不时的临床表现,结合内镜检查如胃镜、肠镜检查的非黏膜发生肿瘤结果,CT或内镜超声显示的发生于胃肠道壁的肿瘤,可作出初步的诊断。消化道造影可帮助诊断肿瘤在胃肠道的确切位置及大致范围。但临床诊断不足以确诊GISTs。GISTs的确诊最终需病理切片及免疫组化的结果。典型的GISTs免疫组化表型为CD117和CD34阳性。近30%病例中SMA阳性,少部分病例S-100和Desmin肌间蛋白阳性。但少数病例(<5%)CD117阳性,且存在一些CD117阳性的非GISTs肿瘤。因此,GISTs的免疫组化诊断也并非绝对的,尚需结合临床和一般病理结果,有时需通过免疫组化排除其他肿瘤。
GISTs常需与下列肿瘤鉴别,这些胃肠道肿瘤常有与GISTs类似的临床表现。
1.胃肠道平滑肌瘤/肉瘤 GISTs大多CD117和CD34弥漫性阳性表达,SMA不表达或为局灶性表达,而平滑肌瘤/肉瘤CD117和CD34阴性表达,SMA弥漫性阳性表达。
2.胃肠道神经鞘瘤 GISTs中只有少部分病例中有S-100表达,而胃肠道神经鞘瘤S-100弥漫性阳性表达,CD117和CD34阴性表达。
3.胃肠道自主神经瘤 CD117、CD34、S-100、SMA和Desmin均阴性表达,电镜下可见神经分泌颗粒。
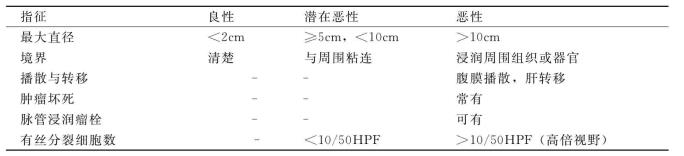
对GISTs的恶性程度判断除了临床上的局部浸润、转移、复发等因素外,肿瘤部位也是一考虑因素,一般说胃、食道及直肠的GISTs恶性程度较低,而小肠和结肠恶性程度较高。肿瘤的大小及核分裂数也是判断GISTs恶性程度的标准之一(见表14-4)。
表14-4 GISTs恶性程度判断
(五)治疗
传统的GISTs治疗以手术治疗为主,虽最近在GISTs病理及基础研究取得很大进展,新的化疗药物研究也取得了一定的进展,但手术治疗仍是目前取得临床治愈的最佳治疗方法。
1.手术治疗及原则 由于GISTs的潜在恶性,对临床怀疑GISTs均应按恶性肿瘤手术原则进行,由于GISTs往往质地脆,血供丰富,且通过血液及腹膜转移,手术时就特别注意避免肿瘤破溃及挤压,对肠道GISTs应先结扎供应和回流血管。术中对可疑病例也不应切取活检,除非肿瘤不能根治。
GISTs一般不宜单纯肿瘤摘除,胃的GISTs直径小于3cm的可行避部切除或行楔形切除,切缘距肿瘤至少3cm;3~5cm宜行楔形切除或胃大部切除术,切缘距肿瘤至少5cm;直径>5cm的应按胃癌D2清扫范围手术。小肠GISTs因报道的淋巴结转移率达7%~14%,故主张常规行淋巴清扫,肠段切除至少距肿瘤10cm。对于直肠GISTs,特别是下段GISTs,有时手术处理十分困难,由于术前难以判断其恶性程度,对于直径<3cm,可考虑尽量保肛;对于直径>5cm或术后复发者,应在术前充分征求患者意愿前提下,在保肛与大手术中作出抉择。对于有局部浸润或远端转移的应在可根治前提下行联合脏器切除术。
2.化疗 传统的化疗GISTs当作平滑肌肉瘤治疗,常用方案为阿霉素+顺铂(AD方案),临床缓解率小于10%,疗效不佳。
伊马替尼(Imatinib)化疗。分子靶向药甲磺酸伊马替尼(Imatinib mesylate),过去称做STI571,美国称为Gleevec,欧洲叫做Glivec,注册商名格列卫,是一种2-苯胺嘧啶的衍生物。伊马替尼是c-kit激酶活性抑制剂,已于2000年第一次应用于临床,主要用于不能根治手术的病人,也有用于高危GISTs的报道。Imatinib治疗进展转移的GIST总有效率在50%左右,比传统化疗有效率高10倍以上,肿瘤生长控制率达到80%以上,起效最快在服药后24h之内,出现症状改善如疼痛缓解、出血停止,客观检查如CT、MRI及PET发现在治疗后1~3个月肿瘤缩小,平均起效时间为13周(即3个月)。患者体力状况改善是又一突出结果。应用方法为400/d,一次与早餐一起服下,同时饮一大杯水,以减少对胃肠道刺激。连续12~24个月,至少连服4个月,如治疗疾病进展或出现严重不良反应时终止治疗,如服至3个月无效剂量可加至1日600mg若仍无效不再增量应停止治疗。据Ⅱ期临床研究PR达63%,SD达20%;Ⅲ期临床研究尚缺乏远期随访报道,但据报道6月的PFS超过70%。伊马替尼用于GISTs新辅助化疗也有小样本成功的报道。
Imatinib的安全性:不良反应多数轻至中度,主要有水肿(体液潴留)、消化道症状、肌肉、骨骼疼痛、头痛、皮疹、潮红等。Ⅲ~Ⅳ度不良的反应鸡21.1%,发生在较大肿瘤坏死出血(胃肠道或腹腔内)约5%,水肿多出现在眼眶周围,严重者(<5%)出现胸腔、腹腔、心包积液及肺水肿,停药并用利尿剂可缓解。消化道反应有恶心、呕吐、腹痛、腹泻等,均不严重。血液学毒性血小板减少与中性粒细胞减少常见。有1%~3%肝功能异常、ALT升高、胆红素升高,减量或停药可恢复正常。
Imatinib治疗GIST的热点问题:
(1)有<10% Imatinib治疗后进展,则PCR检测突变可以预测,这部分患者治疗对策,加大剂量能否获效尚难确定。
(2)Imatinib治疗GIST的推荐规范方案400mg/d/顿服,连用至少3个月,如无进展(PD)或未出现不良反应3~4级者应维持原剂量至少24个月。减量巩固疗效成败待定。
(3)400mg/d无效者可加至600mg/d。联合传统化疗能否增效没有报告,联合抗血管生成药是否增效尚未试验。
(4)部分患者服药12个月以上出现病性进展,耐药机理与治疗处理是一个重要课题。
(5)Imatinib治疗GIST新辅助化疗及辅助化疗试验已有初步报告,还有待大数量随机对照试验。
(6)对良性与潜在恶性GIST的自然发展过程中,病情转化,恶变的随访以及Imatinib是否可干预阻断恶变,尚待研究。
(六)预后
GISTs总的5年生存率为35%,肿瘤完全切除5年生存率50%~65%,不能切除者生存期小于12个月。肿瘤位置、大小、核分裂数和年龄均与预后有关。食管GISTs预后最佳,而小肠GISTs预后最差。
(张应天 彭开勤)
参 考 文 献
1.Sidney J,Winawer,Robert C,Kurtz.eds.Gastrointestinal cancer.New York,Gower Medical Publishing,1992;231—234
2.Yoshida I,Otani Y,Ohgani I,etal.Surgical management of gastric leiomyosar coma:Evaluation of the propriety of laparoscopic wedge resection.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







