第十三章 胃十二指肠外科良性疾病
第一节 胃十二指肠外科的应用解剖及生理概要
一、胃十二指肠外科的应用解剖概要
(一)胃的应用解剖概要
胃是一个囊状肌性器官,与食管相连的近侧端较膨大,而向十二指肠移行的远侧端则逐渐缩窄。胃可分为入、出二口(贲门、幽门),前后二壁,大小二弯。胃小弯全长约15cm,其近幽门处向右弯曲致成角状,称角切迹。胃大弯长度约为小弯的3~4倍。食管与大弯之间所夹的锐角叫贲门切迹,其内面有与切迹相对应的黏膜皱襞(贲门皱襞),该皱襞有掩盖贲门的作用。幽门管长约2~3cm,终止于幽门。在幽门的表面,有一缩窄的环行沟,为幽门括约肌所在之处。幽门前静脉垂直横过幽门前面,活体上清晰可见,为手术时确定幽门的标志。
胃位于上腹部的腹上区、脐区和左季肋区。贲门约相当于第十一胸椎水平正中平面的左侧,与左侧第七肋软骨相对应,距切牙约40cm。幽门约相当于第一腰椎下缘水平(即幽门平面)正中平面之右侧1~2.5cm,和右侧第八肋软骨相对应。胃小弯是食管右缘的延续,起于膈右脚交叉纤维的前面,逐渐转向前方绕经胰腺网膜结节的下面连于幽门。胃小弯借小网膜连于肝脏。胃底的最高点与左膈顶一致,约相当于第五肋间隙水平。胃底的左边借脾胃韧带连于脾门,而胃大弯的其余部分则为胃结肠韧带所附着,胃脾韧带与大网膜是直接延续的。
胃前壁的右侧与肝左叶和方叶相邻,前壁的左侧为左肋缘所遮盖,并与膈相邻。因此,前壁左侧隔着膈与左侧胸膜、左肺底、心包和左侧第六、第七、第八、第九肋骨及其肋间隙相邻。胃前壁并没有被肝及膈完全遮蔽,在剑突下的肋弓角内,部分胃前壁可直接与前腹壁相贴。整个胃均被有腹膜。腹膜于胃小弯续为小网膜,而沿胃大弯则与大网膜及胃脾韧带相延续。胃后壁与膈、左肾前上部、左肾上腺、胰、脾动脉、结肠脾曲、脾的胃面以及横结肠系膜邻接。以上各器官在腹后壁构成胃床。被覆于胃后壁的腹膜,由胃大弯经胃结肠韧带移行于横结肠,构成横结肠系膜的后叶,进而覆盖于胃床各脏器的表面。胃后壁腹膜并沿胃小弯连于小网膜,并经肝的下面及后面与膈下腹膜相移行,进而续于胃床。胃后壁与胃床之间被网膜囊分隔,横结肠系膜及大网膜又将胃与十二指肠空肠曲及小肠分隔开。
胃的供血血管主要来自腹腔动脉的分支(图13-1,图13-2),均沿胃大小弯分布,沿途发出分支进入胃浆膜,在穿经肌层的同时发出肌支,其主干则深达黏膜下层,形成黏膜下动脉丛。自该丛再发出分支穿过黏膜肌层入黏膜层。胃的静脉与同名动脉伴行(与胃左动脉伴行者称冠状静脉),最后注入门静脉。
胃的迷走神经:左、右迷走神经形成食管丛后,继续沿着食管长轴向下,行于食管的前后面。在膈肌食管裂孔上方,食管丛的神经纤维重新汇合成为前后迷走神经干,一前一后贴在食管右半侧的表面下降至腹腔。迷走神经前干分为胃支、肝支、幽门支(Latarjet神经)和腹腔支,而迷走神经后干分为胃支和腹腔支(图13-3)。迷走神经主要支配平滑肌和黏膜腺体的分泌活动。
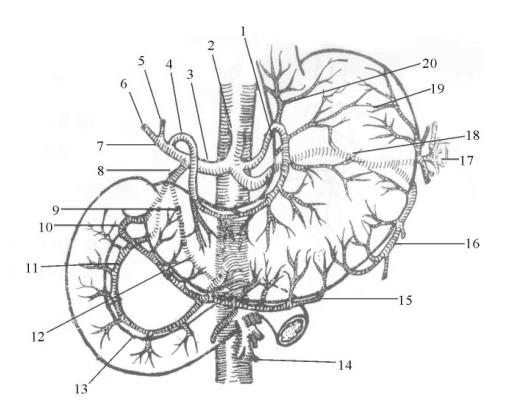
图13-1 胃十二指肠的血管(前面)
1.胃左动脉 2.腹腔动脉 3.肝总动脉 4.胃右动脉 5.左支 6.右支 7.肝固有动脉 8.胃十二指肠动脉 9.胰十二指肠上动脉(后支) 10.胃网膜右动脉 11.胰十二指肠上动脉(前支) 12.胰十二指肠下动脉(后支) 13.胰十二指肠下动脉(前支) 14.肠系膜上动脉 15.胃网膜右动脉 16.胃网膜左动脉 17.脾动脉分支 18.脾动脉 19.胃短动脉 20.食管升支
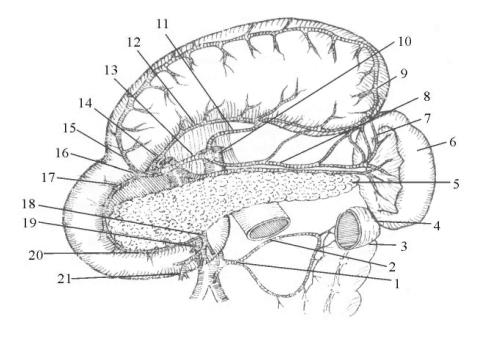
图13-2 胃十二指肠的血管(后面)
1.肠系膜下动脉 2.结肠左动脉 3.降结肠 4.横结肠 5.胰 6.脾 7.胃短动脉 8.脾动脉 9.胃网膜左动脉 10.腹腔动脉 11.胃左动脉 12.胃右动脉 13.肝动脉 14.门静脉15.胃网膜右动脉 16.胃十二指肠动脉 17.胰十二指肠上动脉 18.肠系膜上动脉 19.肠系膜上静脉 20.胰十二指肠下动脉 21.结肠右动脉
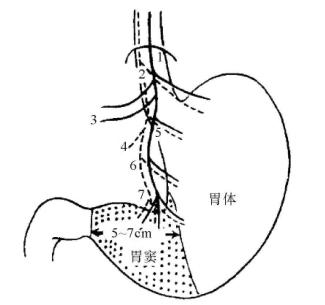
图13-3 胃的迷走神经
1.左迷走神经 2.右迷走神经 3.肝支 4.腹腔支 5.胃前支(Latarjet前神经) 6.胃后支(Latarjet后神经) 7.“鸦爪”
(二)胃与食管下段解剖概要
下段食管包括胸段食管之下段及腹段食管两部分,相当于第七胸椎至第十一胸椎的高度,共长约9cm,其上端自肺根后穿出后,再次向左偏斜,并斜跨于胸主动脉的前面至其左前方穿过食管裂孔而成腹段,此段的关系是(图13-4,图13-5):前面是心包和膈,后面是食管与脊柱之间的食管后间隙。此间隙内充满疏松结缔组织。其内有右肋间动脉、胸导管、奇静脉、半奇静脉和副半奇静脉的末段等。下段食管左侧与胸主动脉和左胸膜相邻接,右侧胸膜除被覆于食管侧壁之外,并于食管和脊柱之间形成隐窝,有时隐窝可深达正中平面。食管在穿出膈肌之前由于向左偏斜,主动脉在其后方与之交叉。胸导管在后纵隔的下部位于食管的右后侧,向上渐左偏,行于食管的后方。食管自食管裂孔穿出后,走行于肝左叶后缘的食管沟内,向左弯曲横过右膈脚、左膈脚、左肺下动脉后末端与胃贲门相接。相接处的前面是肝左三角韧带和肝左叶,后面是膈脚。食管的右缘连续于胃小弯,左缘则以贲门切迹为界与胃底延续。食管腹段的右面包于小网膜内,前及左面则完全由腹膜遮盖,而且腹膜在食管的后面返折到膈下面,形成胃膈韧带的一部分。
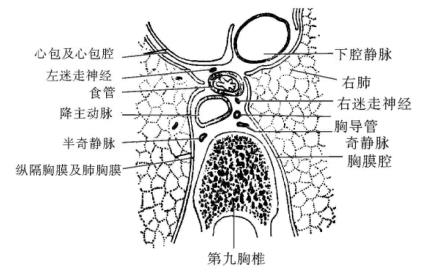
图13-4 食管贲门部的毗邻(平第九胸椎)
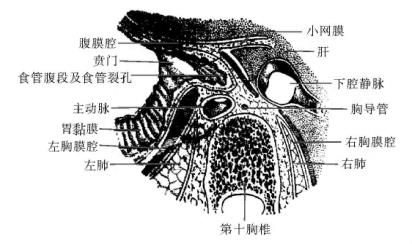
图13-5 食管贲门部的毗邻(平第十胸椎)
食管裂孔及膈:食管裂孔由从第二、第三腰椎和其椎间盘起始的膈脚所围成。左右膈脚形成主动脉裂孔后,右侧膈脚的肌纤维在向腹侧上升的过程中,分为深浅两层肌束。浅层肌束绕食管右侧而过,而深层肌束绕食管的右侧形成食管裂孔的左缘,两肌束的肌腱移行于膈的中心腱。因此食管裂孔全由右侧膈脚的肌束围成。其前方的膈中心腱为膈肌三部分汇合处,无重要血管、神经分布。顺食管裂孔向前上切开膈中心膜,不会损及重要血管神经,亦不致切开胸膜进入胸腔。
膈食管膜(Laimer膜):亦称横膈食道韧带,起于膈下筋膜,分上下两叶(图13-6)。下叶在食管裂孔之下,环包食管末端,其下缘与胃外膜相续。膈食管膜与贲门间有一个相当坚固的脂肪组织环,对食管起固定作用。
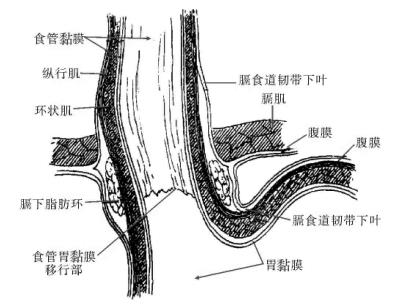
图13-6 膈食管膜
(三)十二指肠的解剖概要
十二指肠始自胃幽门(第一腰椎水平的右侧),止于十二指肠空肠曲(第二腰椎之左侧),全长约23~25cm,呈一“C”弯曲,包绕胰头。十二指肠贴于脊柱,较为固定。按它的走向及十二指肠外科特点,可分为四部。
1.上部(或称第一部、球部) 长约5cm,其后内侧与胆总管、门静脉和胃十二指肠动脉的关系非常密切,并与下腔静脉只隔着一层由蜂窝组织融合而成的结构。
2.降部,又称第二部 长7~10cm。其前面中1/3处有横结肠跨过,后面为右肾的动静脉与下腔静脉,前面及右外侧缘被后腹膜覆盖,而内侧缘与胰头紧贴。胰胆管形成的共同通道开口于降部内后侧的十二指肠乳头,其位置约相当于降部的中点,距幽门8~12cm。胃十二指肠动脉的胰十二指肠上支位于十二指肠降部与胰头形成的前沟中。
3.横部(或称第三部) 长10~12cm,水平方向横过右输尿管、下腔静脉、脊柱和腹主动脉,止于第三腰椎之左侧。横部前面有从胰腺下缘穿出的肠系膜上血管,排列次序自右向左为肠系膜上静脉、肠系膜上动脉、十二指肠空肠曲。胰腺紧附于横部的上缘,其间只相隔一沟,胰十二指肠下动脉位于此处。横部之前面大部分为空肠所覆盖。
4.上行部(或称第四部) 仅长2~3cm,沿着脊柱在主动脉左侧向上并略向左走行,止于第二腰椎的水平,然后急转向左前下方,形成十二指肠空肠曲。十二指肠空肠曲由起自于膈之右脚的一束肌纤维(Treitz韧带)所固定,此处即是空肠的起点。十二指肠上升部与十二指肠空肠曲所占有的间隙称为十二指肠空肠裂孔,其走向由右下朝向左上,解剖关系像拱门样(图13-7),腹主动脉与下腔静脉构成其后柱,肠系膜上动、静脉构成其前柱,上界为胰腺钩状突,下界为部分小肠系膜附着。
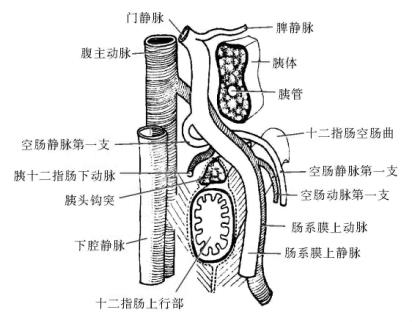
图13-7 十二指肠空肠裂孔的解剖关系示意图
二、胃十二指肠生理概要
(一)胃酸的分泌与调节
胃液是胃黏膜上皮多种细胞所分泌的消化液的总称,其主要活性成分包括胃酸(盐酸)、胃蛋白酶、黏液及多种电解质离子,水约占胃液的91%~97%,另外,胃液中还含有内因子、血型物质等。正常空腹胃液量为20~30m L,无色透明,pH值为0.5~1.9。胃液的酸度决定于胃液中壁细胞成分与非壁细胞成分的比例,并与分泌速度及胃黏膜血流量有关。
胃酸的生理功能包括:①促进胃蛋白酶原转化为胃蛋白酶。胃蛋白酶原需酸的作用而使肽链裂解成为具有生理活性的胃蛋白酶,其最适pH值为2。胃液pH值大于5时,胃蛋白酶原的活力可消失。②杀灭胃内细菌。③促进肠道对铁和钙的吸收。④是某些胃肠激素释放的反馈机制中的作用因素,如能促进促胰液素自小肠的释放、抑制胃泌素的释放等。
胃酸由壁细胞分泌。壁细胞呈球形或三角形,直径约25μm,其尖形顶端朝向腺腔,其胞浆嗜伊红着色。壁细胞存在的腺体称胃底腺,分布于胃底和胃体的大部,其面积约占胃黏膜总面积的3/5;壁细胞分布于胃底腺的峡部、颈部和底部。成年男性胃黏膜内的壁细胞数量约为1.18×106,女性约为0.84×106。
胃酸分泌的生理刺激物主要有3种,即乙酰胆碱、胃泌素和组织胺。它们均有其各自的受体,这些受体位于壁细胞的底膜和侧膜的表面。乙酰胆碱是由迷走神经节后纤维所释放的神经递质,弥散到壁细胞膜表面后,即与膜上的毒蕈碱能M1型受体结合,并经细胞内钙的介导引起泌酸效应。胃泌素主要由胃窦G细胞分泌,经血液循环到达靶细胞(壁细胞),与受体结合后,也是借助于钙充当第二信使引起泌酸效应。组胺系由胃黏膜固有层中的肥大细胞所释放,经局部扩散作用于壁细胞,与组胺的腺苷酸受体结合后,经c AMP介导引起泌酸效应。以上这三种主要受体是特异性的,也是各自独立的。但在生理情况下,不同类型介导机制的刺激物共同作用时具有加强效应。例如,经c AMP介导的组胺和经Ca2+介导的乙酰胆碱,或组胺和胃泌素(均经Ca2+介导)两种刺激物共同作用于壁细胞时,两种刺激物共同作用所引起的分泌反应,要比作用于各自的受体单独引起的分泌反应相加的结果为大。反之,当应用一种组胺受体拮抗剂时,不仅封闭了壁细胞上的组胺受体,也消除了其他刺激物共同作用所引起的泌酸加强效应,使胃酸分泌显著减少。
胃液中氢离子浓度为160mmo1/L,而胃黏膜血流中的氢离子浓度为5×10-5 mmo1/L,两者之间的浓度差高达300万倍。不言而喻,为保持这一巨大的浓度梯度,必然需要消耗能量。研究也已证明,壁细胞分泌盐酸为一主动性、能量依赖性的过程。其能量来源于三磷酸腺苷(ATP)的分解。
综上所述,壁细胞的泌酸过程始自于位于壁细胞基底膜或侧膜上的组织胺、乙酰胆碱或胃泌素受体受到相应的介质刺激后,经第二信使环腺苷酸(c AMP)或钙离子的介导,启动质子泵(H+-K+-ATP酶),将H+从胞浆泵向(耗能过程)胃腔。同时,壁细胞膜受到刺激时通透性增加,K+、Cl-一并经壁细胞顶端膜运转至胃腔,随后K+与H+交换生成盐酸。
基础胃酸分泌:基础胃酸分泌一般即指胃排空6~8小时后的不存在任何刺激下的自然分泌。基础分泌量变异较大,而且表现有昼夜节律,早上分泌率低,晚上分泌率高。正常人的基础分泌量约为最大分泌量的10%,男性高于女性。临床上常测定自然分泌1小时的胃酸量来代表基础胃酸分泌量(basal acid output,BAO),国人的正常值一般男性为6mmol/h,女性为4mmol/h。
影响基础分泌的因素较多,但迷走神经的兴奋性似乎是主要的调节因素。切断迷走神经后,十二指肠溃疡病人的基础胃酸显著降低或接近于零。给予H 2受体拮抗剂每天1~2次可明显减低基础胃酸,说明壁细胞上H 2受体的活性也影响基础胃酸。
调节壁细胞分泌胃酸的神经体液机制见图13-8。
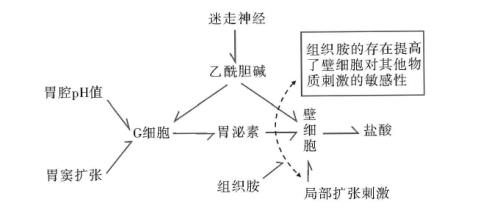
图13-8 调节壁细胞分泌胃酸的神经体液机制
(二)胃黏膜屏障
胃黏膜何以抵御其自身分泌的盐酸和蛋白酶而不被消化,必定有某种起保护作用的“胃黏膜屏障”的存在。早期的研究结果曾将胃黏膜屏障定义为“胃黏膜阻止H+自胃腔向黏膜内扩散和阻止Na+从黏膜细胞间液向胃腔内扩散的一种特性”;现已阐明,胃黏膜屏障包含解剖屏障和黏液屏障两大部分。前者以具有快速整复能力的表面上皮结构为基础,后者则主要体现在黏液的凝胶作用及碳酸氢盐缓冲作用上。
解剖屏障:胃黏膜屏障在解剖结构上是由胃黏膜表面上皮细胞的顶部细胞膜和连接邻近细胞的致密结缔组织所构成的紧密连接,其在生物化学上为一个脂蛋白层。表面上皮细胞的完整性是构成黏膜屏障的最为重要的因素,表面上皮细胞层损伤后,其连续性可非常快地恢复。表面上皮层连续性的修复过程,一般在损伤后数分钟即开始,数小时内即可完成,这是一种特殊的快速修复过程。通过对黏膜修复过程中的形态学改变进行细致的动态观察,证明胃黏膜表面上皮层表浅的破坏,即使损伤的范围很广泛,缺损区域也可在短时间内被上皮重新覆盖而恢复上皮层的连续性。这种快速修复过程特称之为整复(restitution)或重建(reconstitution)。它不同于再生或愈合,因没有细胞增殖(以有丝分裂为标志)和炎症反应的参与。整复可能是上皮细胞本身的一种固有特性,但它要求基底膜必须完整。如果胃黏膜损伤涉及基底膜,则需要通过愈合过程才能修复。事实上,胃黏膜上皮(胃腺)持续处于动态的损伤与修复的平衡过程。胃内经常存在损伤性因素,表面上皮一旦受损而脱落,通过快速的整复过程便可及时地将缺损部位覆盖起来,随后再由增殖带干细胞的再生产生新的细胞得以完全修复。胃黏膜的再生能力很强,在一般情况下,全胃上皮的更新只需4~6天。
黏液碳酸氢盐屏障:黏液层除起滑润作用以防止黏膜受机械损伤外,还有保护胃黏膜抵御胃酸损伤的作用。黏液的主要成分为糖蛋白。随着浓度的增加,糖蛋白分子互相重叠而形成黏稠的不溶于水的凝胶,贴附于胃黏膜表面。暴露于低pH环境中的凝胶,在胃蛋白酶的作用下可降解,从而由凝胶状态变为溶胶状态而剥落于胃液中。附着于胃黏膜表面的黏液层的厚度取决于黏液合成与降解间的动态平衡,人胃黏液层厚166~500μm。胃各部黏液层薄厚十分不均,可差至400μm之多。另有证据表明,黏液与上皮细胞分泌的[HCO3-]形成一道黏液—碳酸氢盐屏障,可阻挡H+与胃黏膜的接触,这是由于黏液凝胶在黏膜表面形成不流动液层,H+在其中的扩散速度仅为水中的1/3~1/4,从而使上皮细胞分泌的[HCO3-]通过黏液层向胃腔扩散时来得及将H+中和。
(三)胃肠激素
表13-1列出了与胃酸分泌有关的主要消化道激素的分泌细胞、作用机制及其靶细胞。
表13-1 与胃酸分泌有关的主要消化道激素

第二节 胃十二指肠溃疡病
胃十二指肠溃疡病(gastroduodenal ulcer)是极为常见的疾病,因其发病机制中与胃酸及胃蛋白酶的消化作用有关,故又称本病为消化性溃疡。临床也常简称为溃疡病。
顾名思义,胃十二指肠溃疡病发生于胃和十二指肠,前者为胃溃疡,后者为十二指肠溃疡。然而,临床上观察到此类溃疡可发生于任何与酸性胃液接触的部位,包括食管下段,胃空肠吻合口及其附近空肠袢,以及含有异位胃黏膜的Meckel憩室中。
一、概述
胃十二指肠溃疡病患病率为2%~5%。综合五大城市(北京、上海、重庆、武汉、广州)16万余例胃镜检查资料,胃十二指肠溃疡的检出率为16%~32%。欧美资料显示,20世纪70年代以来,溃疡病发病率出现下降趋势,并特别以十二指肠溃疡为明显。但我国部分地区的资料并不与此相同。
胃十二指肠溃疡病中以十二指肠溃疡为多见,一般报告的比例为(4~5)∶1。
胃十二指肠溃疡病多发于男性,多数报告的男女性别发病的比例为4∶1。
胃十二指肠溃疡病可发生于任何年龄。十二指肠溃疡发病年龄多在30岁左右,而胃溃疡发病年龄略偏大,在40~50岁之间。
胃十二指肠溃疡病的病因与发病机制尚未确定,但总的来说,溃疡病的发生可视为胃十二指肠黏膜自身保护机制与损害因素之间的平衡被破坏的结果。
胃十二指肠黏膜自身保护机制主要为:①黏膜屏障。②黏液-碳酸氢盐屏障。③黏膜上皮细胞的快速更新。④前列腺素。⑤表皮生长因子。
可能的发病因素包括:①胃酸。“没有胃酸就没有溃疡”。胃液酸度过高,激活胃蛋白酶,致胃十二指肠黏膜“自家消化”可能是溃疡发生的重要原因。②胃黏膜屏障受损。药物(阿司匹林、皮质类固醇等)、缺血、反流的胆汁等可损伤胃黏膜的解剖屏障及黏液屏障。③神经精神因素、内分泌腺肿瘤等。④幽门螺杆菌(helicobacter pylori,HP)。近年来发现HP在溃疡病患者的胃液中的检出率达80%,不少实验及临床研究亦证明HP与溃疡病的发病特别是复发有关。
胃十二指肠溃疡病的局部病理表现是胃十二指肠壁的局限性圆形或椭圆形缺损。以十二指肠球部、胃窦及胃小弯为好发部位。
胃十二指肠溃疡病临床表现以节律性上腹疼痛为特征,除上腹深压痛外常无其他阳性体征。十二指肠溃疡的疼痛特点是节律性较明显,与饮食关系密切,表现为餐后延迟痛(餐后3~4h发作)、饥饿痛和夜间痛,疼痛多为烧灼痛、钝痛、锐痛,也可为剧痛。胃溃疡的疼痛则多无明显节律性,多在餐后1~2h内发作,疼痛性质多为胀痛。十二指肠溃疡的疼痛还具有周期性发作特点,一般秋至早春为好发季节,疼痛持续数周后好转,间歇1~2个月而再发。
胃镜检查可确认溃疡病变。除罕见的胃底大弯侧溃疡及球后溃疡外,大多数的溃疡均在现代纤维胃镜的良好视角范围内。窥视下溃疡呈圆形或椭圆形;周边规则光整;基底平坦,覆盖白色或灰黄色苔膜;周围黏膜有不同程度的水肿、充血;可见黏膜皱襞向溃疡的纠集。为避免漏诊胃癌,应常规活检。
上消化道X线钡餐诊断溃疡的直接征象包括龛影、残存钡点、球部变形,间接征象为球部激惹征。精细的气钡双重对比造影可发现小而浅表的溃疡。
胃十二指肠溃疡病应注意与胆石症、慢性胰腺炎等上腹其他脏器的慢性疾病鉴别。
胃十二指肠溃疡病的现代治疗以内科治疗为主,外科治疗集中于处理溃疡病并发症。
一般内科治疗包括:调整生活规律,饮食宜易消化,避免过甜、过酸及辛辣食物,忌烟酒,避免应用易诱发溃疡的药物等。
药物治疗主要着手于抑酸、保护胃十二指肠黏膜、清除幽门螺杆菌(HP)和调整胃排空功能等。
1.抑酸治疗 ①制酸药:即碱性药物,如胃舒平、胃得乐和乐得胃等,每日3~4次口服。②组胺H 2受体阻断剂:可选用下列一种药物如泰胃美800mg、雷尼替丁300mg、法莫替丁400mg,上述药物剂量分2次服用或夜间1次服下。③质子泵抑制剂:奥美拉唑20~40mg,兰索拉唑30mg,每晚睡前服。一般胃溃疡需治疗6~8周,十二指肠溃疡约4~6周,吸烟及老年患者可延长至8~12周;疗程结束后,维持治疗可防止溃疡复发,维持量可取上述治疗量的半量。也可采用间歇全程治疗,即出现症状时再用4~6周全程治疗。
2.黏膜保护剂 硫糖铝每日4g,分4次服;铋剂(De-nol,迪乐,得乐,果胶铋等),每日3~4次,每次120mg。
3.清除幽门螺杆菌 ①阿莫西林0.5~1.0,每日3~4次。②甲硝唑0.2~0.4g,每日3~4次;③呋喃唑酮0.1g,每日3~4次;④克拉霉素0.25g,每日2次。所有HP阳性的胃和十二指肠溃疡均应进行HP根除疗法,根除HP的方案很多,一般在用质子泵抑制剂或铋剂基础上酌情选用二联、三联或四联疗法,疗程一般为7~14d。
4.调整胃排空功能或对症药 如多潘立酮(吗丁啉)10mg,每日3次;或西沙比利5~10mg,每日3次。
外科治疗及处理:①溃疡急性穿孔。②溃疡急性大出血。③瘢痕性幽门梗阻。④胃溃疡恶变等并发症外,对所谓内科治疗无效的顽固性溃疡仍还有一定的手术率。一般将下列情况列为适应证:①有多年溃疡病史,发作频繁,病情渐加重,影响生活及全身营养状况者。②至少经一次严格的内科治疗,未能控制发作或短期内又复发者。③过去有过穿孔和多次大出血的病史,而溃疡仍为活动性者。④钡餐或胃镜检查发现溃疡很大、很深,或有穿透征象者。⑤复合性溃疡、球后溃疡、胼胝性溃疡。另外,胃溃疡的手术适应证可适当放宽。在确定手术指征时尚应考虑社会因素,如病人的工作性质、生活环境、经济状况、就医条件等。
手术方式选择目前仍以胃大部切除术为常规手术。经典的胃大部切除术的切除范围包括胃体的大部分、整个胃窦部、幽门及十二指肠球部。由于降酸效果确切,复发率低(5年内复发率1%~3%),该术式一直稳居胃十二指肠溃疡手术之首位。
胃迷走神经切断术治疗溃疡病的机理在于:①切断了迷走神经,消除了神经性胃酸分泌。②消除了由迷走神经引起的胃泌素分泌。胃迷走神经切断术几经进展,现多采用高选择性迷走神经切断术(又称壁细胞迷走神经切断术)。该术式仅切断胃近端支配胃体、胃底部壁细胞的迷走神经,而保留胃窦部的迷走神经。从而在消除神经性胃酸分泌的同时,不会引起胃潴留,不需附加引流性手术。但不论迷走神经切断如何彻底,其再生或早或晚势必发生,因而临床溃疡复发率高(5年内复发率可达10%)。在我国大多数医院,目前胃迷走神经切断术一般仅试用于无并发症的十二指肠溃疡。
二、胃十二指肠溃疡病的并发症
(一)胃十二指肠溃疡急性穿孔
胃十二指肠溃疡急性穿孔多发生在慢性溃疡的活动期,但急性溃疡穿孔也可占20%以上。穿孔多位于幽门附近的胃十二指肠前壁,尤以十二指肠球部前壁偏小弯侧为最多见。绝大多数为单个穿孔。
恶变的胃溃疡及胃癌发生急性游离穿孔的比率约占穿孔病例的1%~5%。
溃疡穿孔后,立即表现为急性弥漫性腹膜炎,初期为化学性的,数小时后发展为化脓性的。临床症状及体征的严重程度与外漏入腹腔的胃肠内容量有关。
临床表现:①80%~90%的病人有溃疡病史。近期有溃疡病症状加重史。②突发上腹剧烈疼痛,很快扩散到全腹。常伴有恶心、呕吐。③常有面色苍白、出冷汗、肢端发冷等休克症状。④全腹压痛及反跳痛,以上腹最为明显。腹肌强直(板状腹)。⑤腹式呼吸消失,肝浊音界缩小或消失,肠鸣音减弱或消失。渗液达500m L以上时可有移动性浊音。
辅助检查:①白细胞计数总数增多,中性粒细胞比例升高。血淀粉酶可轻度升高。②站立位腹部透视或平片约80%病人可见单侧或双侧膈下线状、新月状游离气体影。③腹部B超可发现腹腔积液。④腹腔穿刺可获胆汁着色液或脓性液体。
溃疡病急性穿孔应注意与急性胰腺炎、急性阑尾炎等鉴别。
溃疡急性穿孔的处理原则如下。
1.非手术治疗
(1)适应证:①症状较轻,一般情况较好的单纯性空腹小穿孔。②穿孔已超过48h,症状较轻,腹膜炎较局限,估计穿孔已自行粘堵者。
(2)治疗措施:①禁食、胃肠减压。②输液及抗生素。③可配合以针刺等中医药疗法。④密切观察,若治疗6~8h后,症状体征不见好转反而加重者,应立即改用手术治疗。
2.手术治疗
(1)单纯穿孔缝合术:适用于穿孔时间较长,腹腔污染重,继发感染重及一般情况差不能耐受复杂手术者。
(2)胃大部切除术:适用于穿孔时间在12h之内,腹腔内炎症及胃十二指肠壁水肿较轻,一般情况较好,且溃疡本身有较强的根除指征者(如幽门梗阻、出血、恶变可能、胼胝性溃疡、顽固性溃疡等)。
(3)迷走神经切断加胃窦切除、穿孔缝合加高选择性迷走神经切断术等术式可视术者经验选用。
术中将腹腔积液尽量清除干净,并用生理盐水作腹腔冲洗(积液较局限时可不冲洗)。一般不需放置引流,但腹腔感染严重或穿孔修补不满意时应放置引流。术后应视腹腔感染程度适当延长禁食及胃肠减压时间。
(二)瘢痕性幽门梗阻
十二指肠球部溃疡和胃幽门管溃疡的反复发作及修复所形成的瘢痕的收缩可致胃出口梗阻。本症为胃十二指肠手术治疗的绝对适应证,约占溃疡病手术的10%。
梗阻的发生包括3种病理机制。①幽门痉挛:溃疡活动期幽门括约肌的反射性痉挛。②幽门水肿:溃疡活动期溃疡周围炎性充血水肿。③瘢痕收缩:溃疡修复过程中瘢痕的形成及其收缩;并也可因前2种因素的同时存在而加重。因十二指肠溃疡所致的瘢痕性幽门梗阻远较胃溃疡为多见。瘢痕性幽门梗阻的病理结果为胃壁的代偿性肥厚及胃腔的扩大,主要的病理生理后果为低氯低钾性碱中毒。
临床表现:①突出的症状为呕吐,呕吐的特点为朝食暮吐、呕吐宿食。呕吐量大,1次可达1~2L;呕吐物有酸臭味;吐后自觉舒适,常有病人自行诱吐以缓解上腹胀满之苦。②体征:胃潴留的体征为上腹膨隆,可见胃型及胃蠕动波,可引出胃振水音。长期梗阻者可有消瘦、乏力,皮肤干燥、弹性消失,便秘、尿少等营养不良及失水体征。③合并碱中毒、低钙时,耳前叩指试验(Chvostek征)和上臂压迫试验(Trousseau征)可为阳性。
辅助检查:①胃镜检查:胃腔空腹潴留液增多,甚至可见残存宿食;幽门变形及变狭,镜管不能通过;②X线钡餐检查:胃高度扩大,胃张力减低,钡剂入胃后即下沉。若数小时后胃内仍有25%以上的残留钡剂,诊断即可成立。
鉴别诊断:①胃癌所致胃出口梗阻:病程较短,胃扩张程度较轻,胃型、胃蠕动波少见;多可触及肿块;胃镜及钡餐检查可资鉴别。②十二指肠球部以下梗阻性病变:十二指肠肿瘤、十二指肠瘀滞症等所致的十二指肠梗阻,呕吐物中多含有胆汁。X线钡餐可确立梗阻部位。③胃黏膜脱垂症、胃石症等均应在鉴别诊断时考虑。
溃疡病并幽门梗阻的处理原则如下。
1.非手术疗法 适应于因活动性溃疡并发幽门水肿及痉挛所致的幽门梗阻或为手术治疗作准备:①禁食,胃肠减压,必要时温生理盐水洗胃3~7天;②抗酸、解痉及胃动力药物;③纠正水、电解质失衡;④全肠外营养支持及适量输血。
2.手术疗法
(1)胃大部切除术:适应于胃酸高、溃疡疼痛症状较重的年轻病人。
(2)胃窦切除加迷走神经切断术及幽门成形加迷走神经切断术:可按术者经验选用。
(3)胃空肠吻合术:适用于年老体弱、全身情况差者。
(三)胃十二指肠溃疡大出血
胃十二指肠溃疡大出血为上消化道大出血最常见的原因。5%~10%的胃十二指肠溃疡大出血需要手术干预。
发生大出血的溃疡多位于胃小弯或十二指肠后壁,并以十二指肠后壁溃疡为多见。出血是因溃疡的侵蚀导致基底部血管破裂,大多数为中等动脉出血。胃小弯溃疡出血常来自胃右、左动脉的分支,而十二指肠后壁溃疡的出血,则多来自胰十二指肠上动脉或胃十二指肠动脉及其分支。血管的侧壁破裂较之断端出血不易自止。有时由于大出血后血容量减少,血压降低,血管破裂处凝血块形成,出血能自行停止,但约有30%病例可出现第二次大出血。
临床表现:①急性大呕血和/或柏油样便是胃十二指肠溃疡大出血的主要症状,多数病人可仅有柏油便;大量迅猛的十二指肠溃疡出血,黑便的色泽可较鲜红。可伴有乏力、心慌,甚至晕厥等失血症状。②休克:当失血量超过800m L时,可出现明显休克现象,如出冷汗、脉搏细速、呼吸浅促、血压降低等。腹部常无明显体征,可能有轻度腹胀,上腹部相当于溃疡所在部位有轻度压痛,肠鸣音增多。
实验室检查:持续检测血红蛋白、红细胞计数和血细胞比容均呈进行性的下降趋势。
鉴别诊断:无典型溃疡病史者,应与食管曲张静脉破裂所致的大出血、胃癌出血、应激性溃疡出血及急性胆道出血等鉴别。鉴别有困难时应尽力争取作急诊胃镜检查。
溃疡病大出血的处理原则如下。
1.非手术治疗
(1)保证胃管引流的通畅,以便于准确估测出血量及向胃腔内给药。为此,有必要用多达1 000 m L的10℃的生理盐水反复冲洗胃腔,直至抽出的液体不含凝血块为止,并将胃管调节至最佳引流位置。
(2)可供胃腔内局部给予的止血药物的单一剂量为去甲肾上腺素8~10mg、凝血酶2 000~5 000 U、云南白药3g。视情况可在3~4h后重复给予。
(3)全身性用药除常规性止血药外,还可选用立止血、弥凝。
(4)常规给予H 2受体阻滞剂,必要时可应用善得定以减少内脏血流量及胃腺的分泌。
(5)有条件及病人情况允许时,可考虑急诊胃镜止血。
2.手术治疗
(1)手术指征:①出血甚剧,短期内即出现休克。②经短期(6~8小时)输血(600~900m L)后,血压、脉搏及一般情况未好转;或虽一度好转,但停止输血或输血速度减慢后,症状又迅速恶化;或在24h内需要输血量超过1 000m L才能维持血压和血细胞比容者,均说明出血仍在继续,应迅速手术。③不久以前,曾发生过类似的大出血。④正在进行胃十二指肠溃疡药物治疗的病人,发生了大出血。⑤病人年龄在60岁以上或伴有动脉硬化症的胃十二指肠溃疡的大出血。⑥同时存在瘢痕性幽门梗阻或并发急性穿孔。
(2)手术方式:尽量采用包括溃疡在内的胃大部切除术。不能切除的出血性溃疡需作腔内旷置式手术时,对出血灶本身是否应作确切的止血处理尚有不同意见。一般而言,对溃疡底部明显喷射性出血必须处理;而对出血已停止者并不一定非要作操作困难、有损伤可能且又并非真正确切的缝扎处理。
所谓确切的止血措施,是指对溃疡基底部进行缝扎。一般选用中圆针和1号丝线,在显露良好条件下,自溃疡灶的周边对称性地作交叉“8”字形缝合。若溃疡过大,则在溃疡底部围绕出血血管缝扎(参见本节五球后溃疡)。
迷走神经切断加引流术(幽门成形或胃空肠吻合术)或迷走神经切断加胃窦切除术可按术者的经验选用,同样应注意对出血灶的贯穿缝扎。
三、胃大部切除术及其近期并发症
胃大部切除术(gastrectomy)是指切除远侧胃的体积在1/2以上的胃部分切除术。其治疗溃疡病的机理在于:①切除了胃窦黏膜,消除了由胃泌素所引起的胃酸分泌。②切除了大部分胃体,使神经性胃酸分泌也有所减少。③切除了溃疡的好发部位。④切除了溃疡本身。
【适应证】
胃大部切除术用于治疗胃十二指肠溃疡病及其他需切除部分远侧胃的疾病。
【手术类型】
按胃远侧大部分切除后胃肠道再建的方式,分为BillrothⅠ式和BillrothⅡ式两大类,BillrothⅡ式则包括有8种不同的重建方式。
BillrothⅠ式:残胃与十二指肠吻合。
BillrothⅡ式:残胃与空肠吻合。
结肠前-顺蠕动-半口
结肠前-顺蠕动-全口(Monihan法)
结肠前-逆蠕动-半口(Eiseberg法)
结肠前-逆蠕动-全口
结肠后-顺蠕动-半口
结肠后-顺蠕动-全口
结肠后-逆蠕动-半口(Hoffmeister法)
结肠后-逆蠕动-全口(Polya法)
注:顺蠕动为空肠输入袢近端对胃残端大弯侧,即近大远小;逆蠕动为空肠输入袢近端对胃残端小弯侧,即近小远大。全口系指整个胃残端与空肠吻合;半口则为残胃大弯侧部分残端与空肠吻合。
胃大部切除术的消化道再建,应以胃十二指肠吻合(BillrothⅠ式)为首选,若受限于局部解剖条件必须作BillrothⅡ式胃空肠吻合时,应尽量选用结肠后逆蠕动半口吻合(Hoffmeister法,图13-9)。输入袢的长度在无张力的条件下应尽量短些。结肠后吻合一般距Treitz韧带6~8cm。
【操作要点】
1.远侧胃的游离 胃结肠韧带的切断有在胃网膜右动脉弓内或弓外进行2种方法,可视术者经验及胃结肠韧带脂肪沉积程度选择。胃结肠韧带脂肪沉积过多者宜在弓外切断。靠近幽门时应注意胃十二指肠与横结肠系膜和胰腺之间的粘连,以免误伤结肠中动脉。十二指肠后壁与胰腺之间应细心轻巧地分离胰十二指肠上前动脉的细小分支。胃右血管宜紧贴十二指肠壁于幽门下1cm处离断。分离胃网膜左动脉及胃短动脉时应注意腹壁牵开器的正确使用,避免造成脾下极的撕裂。胃左动脉的分离多在十二指肠切断之后进行。尽量不作胃小弯组织的大块结扎,宜将胃左动脉前、后支分别切断结扎。此处应裸露出胃壁2cm,以便吻合或缝闭。
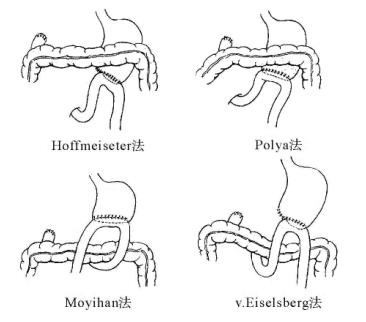
图13-9 胃大部切除术4种常用胃肠吻合方式
2.胃切除量的界定 为治疗胃十二指肠溃疡病所作的胃大部切除术的胃切除量视溃疡部位及病人年龄、胃酸的高低等因素而有所不同。对年龄较大的(45岁以上)胃溃疡患者可能半胃切除就已足够,而对年龄较轻的十二指肠溃疡病例则最少应切除胃的2/3。胃切除量的估算:①半胃切除:自胃小弯中点(约角切迹之上2~3cm处)向大弯胃网膜右、左动脉分界处(所谓无血管区);②2/3~3/4胃切除:胃小弯切至胃左动脉食管升支发出之处,大弯切至第2~3支胃短动脉处;③4/5胃切除(次全胃切除):小弯高切至贲门下,大弯侧的胃脾韧带最少应分离至脾下极以上。精确的切除量的计算是以大小弯长度的测量为佳。正常胃的小弯长度为15cm,大弯为40cm。大小弯各相应比例点连接则为各种不同切除量的切除线。
3.十二指肠残端处理方法 ①完全切除溃疡组织后残端尚有1cm游离缘者,分层连续缝合黏膜、浆肌层,再作浆肌层间断缝合。这样就能做到第二层浆肌层的对合严密,基本上无黏膜组织夹杂其中,有利于残端的愈合。②残端残留部分溃疡组织时,宜采用间断全层缝合法关闭残端,再加浆肌层间断缝合。全层缝合务求针距及做结恰到好处,既保证组织的严密对合,又不失之于过密和过紧。必要时还可用大网膜组织片覆盖残端。③溃疡瘢痕组织多,周围炎症水肿重而不能切除时,作溃疡旷置式(Bancroft)胃大部切除术。④十二指肠已切断,残端因瘢痕组织或严重的炎症水肿关闭困难时,不要勉强缝闭,应作十二指肠置管造瘘术。
4.Bancroft溃疡旷置法 分离胃窦部时注意保留幽门部的血供。距幽门环3cm处切开胃浆肌层,在黏膜下层剥离直至幽门。环形缝扎黏膜后切除胃窦黏膜。浆肌层组织瓣作1~2排肌层内对应缝合,注意缝线不要穿透浆膜。最后浆肌层瓣边缘连续缝合。
5.胃十二指肠吻合 胃溃疡应首选此重建方式,十二指肠溃疡在保证足够的胃切除量及吻合能在无明显张力的条件下进行,也可选用。
幽门再造式胃大部切除术:著者设计的“再造幽门”包括4项内容:①相当于正常幽门口径的小吻合口;②胃黏膜瓣;③胃十二指肠一层套入式吻口;④用取自胃窦体交界部的胃浆肌瓣包绕吻合口全周。该方法能较满意地替代幽门功能的解剖学基础是带蒂胃浆肌瓣包绕吻合口所形成的胃十二指肠间狭紧段。这一狭紧段能有效地延缓残胃的食物重力性排空及防止十二指肠逆蠕动的通过。此外,浆肌瓣对吻合口有良好的保护作用。浆肌瓣一方面可承受较大的张力,另一方面它尚有较强的抗消化液腐蚀的能力。约80%的十二指肠溃疡能完成幽门再造式的胃十二指肠吻合。
6.胃空肠吻合 胃良性疾病的胃大部切除术的胃空肠吻合,应常规采用Hoffmeister法,即结肠后半口逆蠕动吻合,吻合口宽约5cm,输入袢长约5cm。具体操作步骤为:①横结肠系膜戳孔,并将其后唇缝固于残胃后壁,缝合线距吻合口2cm左右。②作空肠与残胃后壁的浆肌层间断结节缝合,吻合口两端各留一针缝线不剪去用作标示。③距前缝合线0.8cm切开胃后壁浆肌层,作黏膜下血管缝扎,接着切开空肠及胃腔。④用细肠线自大弯侧开始作吻合口后壁全层的连续(一般不需作缝线扣锁)缝合,直至小弯侧标示线处作一缝线扣锁,并从此处开始作残胃小弯侧前后壁黏膜的连续缝合直至小弯;再转作胃浆肌层连续缝合,至前述小弯侧标示线处则又改作吻合口前壁的胃空肠黏膜连续缝合直至大弯。再由此作胃空肠浆肌层连续缝合至吻合口的小弯标示线处结束做结。⑤在前壁浆肌层连续缝线外再加一排细丝线的浆肌层缝合,特别注意吻合口小弯侧的“危险三角”的掩埋。⑥将吻合口拉至横结肠系膜戳孔下,缝闭该戳孔与残胃间的空隙。
【术后处理】
禁食、胃肠减压至肠道恢复功能为止;输液及营养支持;抗生素的应用视病情而定。
【并发症】
本节只述及术后近期并发症。
1.上消化道出血 胃大部切除术后上消化道出血的80%来自吻合口部,其他较少见的原因包括术中胃黏膜的忽略性损伤、缝线结的继发性脱落、遗漏性病灶以及术后应激性急性胃黏膜病变等。出血量的估计不能只看胃管引流量,因大部分的失血可能下泄至肠道。还应注意有的病例胃腔内全被凝血块充满,而胃管几乎引流不出血液。
胃大部切除术后的上消化道出血多数均可以经保守治疗而自行停止。保守疗法最重要的是保证胃管引流的通畅,以便于准确估测出血量及向胃腔内给药。为此,有必要用多达1 000m L的10℃的生理盐水反复冲洗胃腔,直至抽出的液体不含凝血块为止,并将胃管调节至最佳引流位置。可供胃腔内局部给予的止血药物的单一剂量为去甲肾上腺素8~10mg、凝血酶2 000-5 000U、云南白药3g,全身性用药除常规性止血药外,还可选用立止血、弥凝。H 2受体阻滞剂应常规给予,必要时可应用善得定(0.1mg,皮下注射,每8h1次)以减少内脏血流量及胃腺的分泌。对于凶猛的大出血以及常规输血速度不能控制血压、脉搏稳定者,可考虑再次手术止血。急诊胃镜检查常因血凝块的堆积或活跃的出血而不能达到查明出血部位及原因的目的。同样的理由,欲经内窥镜作激光或电灼止血亦多不易成功。
2.吻合口漏及十二指肠残端漏 多见于术后4~5天。缓慢发生的渗漏多以局部感染状为主,如发热、局部压痛、引流液增多等。突然发生的急性破裂则以弥漫性腹膜炎为主要表现。术后恢复不顺利,体温爬升,肠麻痹,腹胀,腹部压痛,引流液性状及引流量的改变等均可能是吻合口漏的征象,应注意排除之。必要时可经胃管注入或口服美蓝液,观察能否自引流管流出或经腹腔穿刺发现美蓝着色液体。
吻合口漏的处理原则视临床表现的不同而有所不同。已局限或有局限趋势的应保守治疗:①禁食。②胃肠减压。③肠外营养治疗,其作用除补充热量和氨基酸外,尚可抑制消化液的分泌。有条件时可配合应用施他林、善得定等生长抑素制剂。④保持引流通畅,最好先用持续负压吸引5~7天,一俟窦道形成即改为重力引流。⑤维持水、电解质、酸碱平衡。⑥加强护理,保护好瘘口周围皮肤,密切观察病情变化。
对术后短期内发生的急性破裂并严重的弥漫性腹膜炎及腹腔积液多者,应予再次剖腹。手术原则在于清除腹腔积液,建立确切有效的引流、营养性胃或空肠造口。不要企图在炎性水肿严重的胃肠组织上作修补或吻合性缝合,否则结果适得其反,瘘口或许越补越大。术后所有保守治疗的措施均应注重,特别是引流管的管理尤要加强。
3.梗阻性并发症
(1)吻合口梗阻:吻合口梗阻在术后并发症中所占的比例较大,胃-肠吻合口梗阻较为多见,但除BillrothⅠ式再建后发生者有小部分可能有器质性狭窄外,BillrothⅡ式再建后的吻合口排空障碍多是吻合口炎症、水肿、血肿等因素所致的功能性梗阻。
吻合口梗阻应针对病因处理,病因的鉴别过程也是保守治疗的过程。保守疗法主要是调整饮食的恢复程序,再次按禁食-流质-半流质饮食的进程边治疗边观察,并对食物的质与量及更改的速度加以控制,适当使用胃动力药。对症状持续3周以上,经钡餐或内窥镜检查确认为器质性狭窄者须作侵入性治疗。采用Bollon导管或自制的橡皮气(水)囊进行扩张是简便有效而又损伤最小的方法。经内窥镜作吻合口狭窄段切开适用于狭窄段较短的胃肠吻合口梗阻,但对切开深度的控制技术上较难掌握,切开太浅无效,太深则有出血、穿通等并发症的可能。剖腹作吻合口成形或吻合口部切除再次重建仅在其他治疗无效或无条件时考虑。
(2)输入袢梗阻:为BillrothⅡ式再建的多见并发症之一。原因包括输入袢过长或过短、内疝、粘连、吻合部成角、输入袢扭转,以及结肠前吻合时的横结肠压迫,结肠后吻合时的横结肠系膜孔压迫等。本症在临床上有急性及慢性两种类型,急性输入袢梗阻多系内疝所致,临床上少见。慢性输入袢梗阻又称输入袢综合征,症状多在术后1周饮食量近乎正常时开始出现,以间歇性呕吐大量含胆汁的液体为临床特征,吐出物基本不含食物。钡餐示钡剂不能或很少进输入袢。若症状持续3~4周仍不能消失或渐减轻,应再次手术纠正发病原因。若有足够长的输入袢可供利用,以输入袢与输出袢间的侧侧吻合(Brown吻合)最为简便有效。
(3)输出袢梗阻:输出袢梗阻发生的原因大致与输入袢梗阻发生的原因类似。其中最应注意避免的是因输出入袢位置的错误(不管是顺蠕动还是逆蠕动吻合,输出袢均应置于输入袢之前)而致的内疝。输出袢的内疝多见于术后2~3周,多呈急性发作,表现为高位空肠梗阻,且为闭袢型肠梗阻,腹痛为剧烈的绞痛伴阵发性加剧,呕吐频繁,吐出物多为胆汁性液体,吐后症状并不缓解,需与急性胰腺炎、腹膜炎、肠梗阻鉴别。短暂观察基本明确诊断后应立即剖腹探查,针对发病因素进行处理。发作较缓、症状较轻的不全性输出袢梗阻多因粘连等原因牵拉、压迫所致,反复呕吐含有食物及胆汁的胃内容为其临床特征。保守治疗症状不能逐渐减轻者应手术治疗。
(4)残胃无张力症:症状多在术后5~8天时出现,多与饮食的突然变换有关。表现为上腹部饱胀,恶心呕吐,吐出物主要为食物,含有胆汁,并多有酸腐气味。吐后即觉舒适。口服稀钡造影见残胃的蠕动近乎消失。本症与机械性梗阻所致的胃排空障碍鉴别的一个重要症状是基本无疼痛发作。另外,呕吐也不甚频繁,放置胃管减压的引流量也不足证明有完全性的胃出口梗阻。残胃无张力症的保守观察是需要有耐心的,往往需反复作禁食-流质-半流饮食的饮食调整多次。有的病例可持续5~6周。胃张力一旦恢复,症状立即消失。保守治疗期间,肠外营养、胃动力药及精神安慰治疗均应注重。
四、迷走神经切断术
该术式的适应证为:①无并发症的十二指肠溃疡;②十二指肠溃疡有穿孔、出血、梗阻等并发症,但可用较简单的方法(如穿孔修补、出血灶缝扎、幽门成形等)处理时,也可慎重考虑;③胃溃疡多不倾向选此术式。
(一)迷走神经干切断术
本术式为在食管裂孔水平将迷走神经前、后干切断。
胸段迷走神经食管丛向下汇集成左、右两主干穿过膈肌。如图13-10所示,迷走神经前干有较大的比例分为2支或更多,而迷走神经后干则常为单支。解剖迷走神经的手法为将胃贲门部向下牵拉,绷紧食管下段,以示指沿食管周围边作钝性分离边识别性状有如琴弦样强硬而有弹性的条索状迷走神经分支。注意其前干多紧贴于食管前壁肌层之上,而后干多靠右外侧并略远离食管1~2cm。将游离出的迷走神经一一切断,主要干支应切除一小段(可送病理检查证实)。特别要注意各细小分支的切断。
本术式多需辅以胃窦切除或半胃切除以加强降酸效果。否则应附加胃十二指肠吻合、胃空肠吻合、幽门成形等引流性手术。

图13-10 迷走神经入腹时前、后干变异
(二)选择性胃迷走神经切断术
将迷走神经前干在分出肝支后、迷走神经后干在分出腹腔支后予以切断(图13-11,图13-12)。本术式保留了肝胆、胰、小肠等脏器的迷走神经支配,但胃的运动功能仍受损,需附加引流性手术。
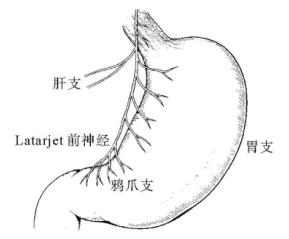
图13-11 迷走神经前干的分支

图13-12 迷走神经后干的分支
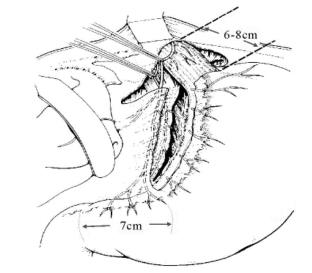
图13-13 高选择性迷走神经切断术
(三)高选择性胃迷走神经切断术
保留支配胃窦部的迷走神经分支(即“鸦爪”支),仅切断支配近端胃体、胃底部的迷走神经,从而保留了胃窦及幽门的正常生理功能,不需附加引流性手术。
手术要点如图13-13所示,自贲门部开始,向下一一切断Latarjet前神经向胃小弯的分支,直至鸦爪支为止。此点距幽门(幽门Mayo静脉)一般定为7cm。再于前迷走神经切断平面,向后进入小网膜囊。将胃小弯的小网膜组织一一分离切断,注意勿损伤胃壁。食管下段应“骨骼化”,即食管下段6~8cm范围内的所有神经纤维应仔细一一加以离断,并应延及食管胃连接部的左侧。否则易致切断不完全。
五、几种特殊类型的胃十二指肠溃疡
(一)应激性溃疡(急性胃黏膜病变)
应激性溃疡指位于胃十二指肠的急性表浅性黏膜糜烂和溃疡。由于其定义一直存在着争议,故有多种不同的名称:如应激性溃疡综合征、急性消化性溃疡、糜烂性胃炎、出血性胃炎、Curling溃疡(继发于烧伤)、Cushing溃疡(继发于脑外伤)等。纤维胃镜广泛应用以来,发现急性胃黏膜病变并不少见,可占上消化道出血临床病例的20%~25%。由于该症病理上包含了从胃黏膜的充血水肿、糜烂、出血、溃疡等一系列病变,多数学者认为以急性胃黏膜病变命名为宜。
【病因病理】
急性胃黏膜病变好发于严重创伤、大面积烧伤、全身性化脓性感染、持续性低血压、休克、慢性肺功能衰竭、多器官衰竭等危重病症,也常见于服用非类固醇性抗炎药如阿司匹林、消炎痛,以及酒精或大量、长期应用肾上腺皮质激素的病人。
急性胃黏膜病变的典型病理改变包括两类:病变未侵及黏膜肌层的黏膜缺损(糜烂)和病变深度超过黏膜肌层的急性溃疡。
继发于严重外伤、有并发症的大手术后、慢性严重疾病者,多发生在胃体和胃底部,呈多数黏膜糜烂或表浅溃疡;继发于脑外伤者,好发部位可从食管、胃到十二指肠;大面积烧伤者则多出现单个或多个的胃十二指肠急性溃疡;在服用非类固醇性抗炎药如阿司匹林、消炎痛等之后的病变多位于胃小弯。溃疡一般较小,多在1.0cm以下。
发病机制与胃黏膜缺血、胃酸分泌过多、胆汁反流、药物等因素所致的胃黏膜屏障损害有关,多种神经、体液因素参与发病;不同诱因所致的发病及病变也不尽一致。
【诊断】
突出的临床表现为在严重外伤、烧伤、大手术或严重疾病过程中,突然发生上消化道大出血或出现急性腹痛和腹膜炎症状。大出血较穿孔远为多见,此类出血常不伴有腹痛,且多呈间歇性。
由于溃疡表浅,胃十二指肠钡餐检查阳性率仅为5%~10%。纤维胃镜可明确病变性质及范围,并可确定出血的部位。在纤维胃镜不能确诊情况下,可考虑作选择性胃左动脉造影。
【治疗】
1.非手术治疗
(1)积极治疗原发疾病,预防急性胃黏膜病变的发生:纠正缺水,纠正凝血机制紊乱,输新鲜血,常规应用H 2受体阻断剂,抽空胃液和反流的胆汁,必要时应用抗酸药物以中和胃酸,慎用可以诱发急性胃黏膜病变的药物如阿司匹林、肾上腺皮质激素等,以及应用大量的维生素A、生长抑制素和全肠外营养治疗等。
(2)已经发生胃肠道出血时的治疗措施:①输血。②持续胃肠吸引。③给抗酸药物、H 2受体阻断剂。④止血药。⑤用冰盐水洗胃有较好的止血作用。⑥有条件时,可采用选择性动脉插管(胃左动脉、肠系膜上动脉)行垂体后叶加压素灌注疗法。
2.手术治疗 如经过积极非手术治疗出血仍不能止住和/或并有消化道穿孔时,应迅速采用手术疗法。如溃疡位于胃近侧或十二指肠,可选用缝合止血后作迷走神经切断加胃空肠吻合术;如溃疡位于胃远侧,可选用迷走神经切断加胃窦切除术,也可作胃大部切除术。全胃切除术仅限于大片黏膜的广泛出血,而第一次手术又未能止血者。穿孔可采用单纯缝合手术。
(二)球后溃疡
球后溃疡就字面意义来说,包含十二指肠球部后壁的溃疡和十二指肠球部以下(后)即降段后壁的溃疡。但在临床上,这两种溃疡并不易于区分。因为球部后壁溃疡因炎症及瘢痕增生而多与其后的胰腺被膜黏着,且因瘢痕的挛缩,球部与降段之间也不能以正常的解剖长度或位置来区分。因此,作者认为,凡十二指肠后壁Vater壶腹(十二指肠乳头)以上的溃疡均可视之为球后溃疡。球后溃疡约占十二指肠溃疡的5%~19%,因此类患者大多球部正常,故内镜检查时应通过球部仔细窥视,不然常易漏诊。患者夜间痛及背部疼痛较十二指肠球部溃疡更为明显而持久,也较易发生出血和梗阻,少数患者可因瘢痕围绕总胆管而致阻塞性黄疸。
十二指肠的血液供应极为丰富。胰十二指肠前、后血管吻合弓分别在胰头、十二指肠的前面及后面向十二指肠发出许多分支,而这两个血管弓又是胃十二指肠动脉和肠系膜上动脉之间重要的侧副循环通路。
上消化道急性大出血的一半以上为胃十二指肠溃疡所并发的出血,而胃十二指肠溃疡的出血中的80%为十二指肠溃疡出血。因解剖结构及血液供给的原因,十二指肠溃疡出血的大多数来自球后溃疡。不仅如此,在溃疡旷置式胃大部切除术(Bancroft术式)后的上消化道出血中,旷置的球后溃疡出血亦占相当的比例。因此,球后溃疡出血是溃疡病外科治疗中的一个难点问题。
球后溃疡的术中处理难点集中在两个方面,一是溃疡能否安全切除,二是不能切除的出血性溃疡应作何处理。
溃疡能否安全切除出于两方面考虑:局部解剖条件是否允许将溃疡在不损伤邻近脏器的前提下切除;再者,溃疡切除后,十二指肠残端能否妥善缝闭。
球后溃疡易于发生向胰腺的穿透,位置稍低者即易与胆总管胰腺段粘连甚至黏着在一起。著者经验,溃疡面超过0.8cm的球后溃疡往往即有切除上的困难。
能否切除的决断应基于仔细的探查,然而,手术经验的因素又是不可否认的。探查的重点在于溃疡与胰腺之间有否进行分离的间隙,溃疡瘢痕是否已波及胆总管。有必要时,应经胃窦前壁切开,对溃疡进行直视观察。对溃疡部位低、瘢痕组织多、周围炎症水肿重者,应注意切勿勉强分离切除溃疡,以免致成骑虎之势,甚至导致不应有的副损伤。明智的选择为溃疡旷置式(Bancroft)胃大部切除术。
十二指肠残端漏是B-Ⅱ式胃大部切除术后最严重的并发症,也是术后死亡的主要原因之一。根据溃疡的病理特点及周边组织情况选择既有效又安全的十二指肠残端处理方法是胃大部切除术的关键步骤之一。
(1)对于溃疡能完全切除者,传统的方法是全层缝合后再行浆肌层间断缝合包埋。著者常规采用连续分层缝合黏膜、浆肌层,再作浆肌层间断缝合,这样就能做到第二层浆肌层的对合非常严密,基本上无黏膜组织夹杂其中,有利于残端的愈合。
(2)对残端残留有部分溃疡组织者,可间断全层缝合关闭残端,再加浆肌层间断缝合,并覆盖大网膜片而完成残端的处理。此种情况下,不过分强调黏膜、浆肌层组织的分层对合,可直接作残端组织的全层间断缝合。全层缝合务求针距及做结恰到好处,既保证组织的严密对合,又不失之于过密和过紧。另外,注意将胃管深深置入输入袢甚至引入十二指肠以充分引流减压,有助于减少残端并发症的发生。
(3)对周围瘢痕组织多,炎症水肿严重,又已失去旷置溃疡机会者,只能切除大部分溃疡组织,作十二指肠置管造瘘术。
无法切除的溃疡的旷置手术有两种方法,即所谓的腔外旷置与腔内旷置法。
腔内旷置法的经典方法为Bancroft法,即在距幽门约5cm处切开胃浆肌层,将胃窦黏膜一直剥离到幽门环后予以缝扎切断,再将浆肌层组织对缝2~3排掩盖黏膜断端。手术的原理在于胃内容物改道下行后,旷置于十二指肠腔中的溃疡因不再受到酸性食糜的侵蚀而可渐趋愈合。
所谓腔外旷置法实际上是一种十二指肠残端的处理方法。对后壁无足够的组织供十二指肠内翻缝合,而前壁无瘢痕组织者,可采用Graham法或Nissen法处理,且以Nissen法更为安全适用。操作方法为:离断十二指肠时多保留一些十二指肠前壁的组织,后壁则沿溃疡近侧边缘切断;溃疡面的黏膜组织予以刮除;然后用3排缝线闭合十二指肠残端。
不能切除的球后出血性溃疡的术中处理必须注意三个方面的问题。
1.确认出血来自该溃疡 对急性上消化道出血作剖腹探查,不论术前是否已明确出血原因,均应对胃和十二指肠进行全面探查。切勿满足于发现一处可能的出血性病灶即轻易认定为此次急性出血之原因。就球后溃疡而言,经胃窦前壁切开,直视探查十二指肠球部及降段是十分必要的。对术中仍在继续活动性出血,或出血虽已停止,但溃疡面有新鲜血痂覆盖者,不存在确认的困难。然而有部分病例,术时既无活动性出血,溃疡又无血痂,甚至因出血已停止较长时间,胃及十二指肠腔中已无血凝块及血液存留。对这类病例亦不应轻易将偶然或意外发现的球后小而浅表的溃疡归咎于出血原因。
2.术中对溃疡出血的确切措施 不能切除的出血性的球后溃疡需作腔内旷置式手术时,对出血灶本身是否应作确切的止血处理尚有不同意见。一般而言,对溃疡底部明显喷射性出血必须处理;而对出血已停止者并不一定非要作操作困难、有副损伤可能且又并非真正确切的缝扎处理。(https://www.daowen.com)
所谓确切的止血措施,是指对溃疡基底部进行缝扎。一般选用中圆针和1号丝线,在显露良好条件下,自溃疡灶的周边对称性地作交叉“8”字形缝合。若溃疡过大,则在溃疡底部围绕出血血管缝扎。缝合要有一定的深度,缝针穿过组织时要有相当的韧实感,否则做结时易于撕裂。缝扎应力求一次成功,反复缝扎不但副损伤机会增多,且止血的牢靠性也大为降低。缝扎溃疡灶之最可能及最严重的副损伤是伤及胆总管,故而术中应仔细探清溃疡与胆总管的关系,手术操作切忌过深过宽的大块缝扎。有撕裂胆总管(有胆汁外渗)或完全阻断胆总管(有的可在术毕探查胆总管时发现其较前明显充盈且有张力感)的怀疑时,应经肝十二指肠韧带段胆总管切开探查并作相应处理。
另一止血措施是所谓阻断溃疡出血血管的血供。如前所述,十二指肠的血液供应是极为丰富的。完全的阻断意味着胃十二指肠动脉和肠系膜上动脉向胰十二指肠分支的完全阻断。对后者而言是无临床实施可能的。胃十二指肠动脉的阻断可用两种方法,一是将其分离后结扎,二是在其横跨胰腺处予以缝扎。因球后溃疡周围的瘢痕组织及炎症水肿,这二者均不易完全保证成功。有人试图缝扎十二指肠一、二段周边的血管以止血,其临床效果很难估测。
3.术后再出血的处理 出血性溃疡十二指肠腔内旷置法术后有一定的再出血率。Sillen甚至认为:任何炎症区域的动脉性出血,采用缝扎止血的效果并不可靠;十二指肠球部溃疡出血即使做了缝扎止血,但因其继续浸泡于碱性肠液中,炎症不能消退,再出血危险仍然存在。
术后即期的再次大出血,若术中未对溃疡作确切性止血处理,则可能需要再次手术干预,否则应以非手术止血疗法为主。其中以超选择性动脉造影并灌注或栓塞止血最为理想。再出血的间期越长,非手术疗法越易成功。
(三)胃高位溃疡
关于胃高位溃疡的具体界定,尚无一致的确定定义。有的学者将它限定为位于贲门附近(距贲门2cm以内)的良性溃疡;但就其临床意义来说,超越远侧60%胃大部切除的断胃线(即胃小弯下2/3,胃大弯下3/5)之上的胃溃疡都应视为高位胃溃疡。本节即以此来讨论高位胃溃疡的一些临床特点及手术处理原则。
1.胃高位溃疡的临床特点
(1)胃高位溃疡临床较为少见,一般认为不超过胃溃疡总数的5%。随年龄的增长,高位胃溃疡的发病增多。
(2)胃高位溃疡大多数位于胃小弯侧,其次为胃底、体部后壁,胃底、体部前壁,极少发生于胃大弯侧。溃疡形状多为圆形或椭圆形,大而不规则形溃疡多见。但有少数可为裂隙状,隐藏于胃黏膜皱襞纵沟内而难于被胃镜及X线检查所发现。
(3)由于胃底、体部黏膜及肌层均较薄,故高位胃溃疡较易发生穿透及出血等并发症。高位溃疡的急诊手术率大大高于其他部位溃疡。
(4)高位胃溃疡多不与高胃酸相伴,加之溃疡并不处于胃蠕动磨擦较频繁的部位,所以其疼痛程度较轻,节律性也不明显。因此临床表现多隐匿,不少病例以上消化道出血为首发表现。溃疡位于贲门附近者,可有吞咽不适甚至吞咽困难。
(5)由于胃高位溃疡无典型的溃疡病症状,亦无特征性体征及实验室检查结果,故其诊断依赖于胃镜或X线钡餐检查。但另一方面,尽管当今胃镜检查已广范围地普及,医患双方对胃疾病的警觉性也已大提高,仍有不少胃高位溃疡为手术中的意外或偶然发现。
(6)胃溃疡的良恶性鉴别历来是一临床难题,近侧胃的溃疡性病变则更是难于排除恶性的可能。虽胃镜所见及X线征均有鉴别诊断上的描述,诸如溃疡的大小、形态、溃疡边缘特征、有否黏膜纠集现象、腔内或腔外龛影、胃壁蠕动及僵硬现象等。但最终的确诊还是要靠胃黏膜活检的结果。然而,尽管有的病例重复数次胃镜取材送检,仍还有一定的假阴性率。
2.胃高位溃疡的手术方式 鉴于胃高位溃疡以上临床特殊情况,又由于胃良恶性溃疡的手术治疗原则是有区别的,因此有必要在决定具体手术方案前,尽可能认定病变的性质。若术前未能明确诊断,或术前虽诊断为良性溃疡,但术中探查所见与之有出入,则应在术中再次对溃疡进行病理组织学检查。小溃疡可以楔形切除送作冰冻切片检查,大的溃疡可在切开胃后从溃疡四周多处取材送检。最后若仍不能排除恶性可能,则以恶性病变处理为妥,保证足够的胃壁切除范围。
用于处理胃高位良性溃疡的手术方式有以下数种。
(1)幽门成形术:因有的高位胃溃疡的发病与慢性不全性幽门梗阻有关,因此有人以幽门成形术来进行病因治疗,也收到了一定的临床效果。具体地说,幽门成形术适用于年高体弱、有多年十二指肠球部或幽门管溃疡病史、临床或多或少有幽门不全梗阻的表现的病例。幽门成形应足够大以防止胃窦部滞留,因此以选Finney法为佳,即在幽门处沿胃大弯到十二指肠作一例“U”字形切开后行胃十二指肠吻合。虽然有些临床经验说明单纯幽门成形术后,高位胃溃疡也可以愈合,但对伴有陈旧性十二指肠溃疡者,应加作迷走神经切断术,以降低溃疡复发率。
(2)高位溃疡旷置、远侧半胃切除术(Kelling-Madlener手术):溃疡远侧胃部分切除,切除范围约50%,胃十二指肠吻合。胃远侧部分切除后,溃疡可以自行愈合。若溃疡小,切除及胃壁修复均比较容易,也可以予以切除。
(3)胃小弯高位溃疡切除并远侧胃大部切除术:适用于胃小弯的高位溃疡。胃小弯可高位切除至贲门下,采用边切边缝方法重建小弯,致使保留的残胃形如“香蕉”。另一类似术式为Pauchet术(大弯侧中等量胃切除,小弯侧舌形切除溃疡)。采用此类手术方式时应特别注意贲门狭窄或小弯缝合处愈合不良的并发症。
(4)远侧胃次全切除术:即作包括溃疡在内的胃广泛切除,对高位胃溃疡的胃广泛切除术需要切除胃的80%以上。术后有可能发生残留胃的血液供应不足、胃壁坏死穿孔并发症。这种并发症多发生在胃左动脉根部结扎和脾同时切除的情况下,因为此时残留胃的血液供应仅来自膈左动脉的回反支和食管下端小动脉。在有动脉解剖异常(膈左动脉起源于胃左动脉)或有动脉硬化时,残留胃的血液供应就会发生障碍。所以,在高位胃溃疡的胃广泛切除时,应保留胃左动脉的上行支,并尽可能保留一部分胃短动脉。另外,极量的胃切除亦易发生胃容量不足——小胃综合征的远期并发症。对此,术中可采用适当的代胃性重建方式予以预防。
(5)近端胃大部切除术:对胃底大弯侧或紧靠贲门的高位溃疡,特别是不能确切排除恶性溃疡者,应积极考虑本术式。近代外科治疗技术水平的提高,特别是营养治疗和新型机械吻合器的进展,使得近端胃大部切除术在技术难度、手术时间、术后并发症及术后营养状况等方面与远侧胃大部切除相差不远。著者经验,本术式并不需要附加幽门成形术。
(6)全胃切除术:对溃疡巨大,按一定的安全边缘切除后近端及远端均无法保留足以完成胃肠再建的胃壁量者,可考虑全胃切除。对高度怀疑溃疡为恶性,且有幽门上、下淋巴结和贲门左、右淋巴结肿大者,应积极考虑根治性全胃切除术。
六、胃十二指肠溃疡术后远期并发症
胃十二指肠溃疡术后并发症有多种类型,每一种都有各自独立的发病机制,亦各有其特征性的症候群。通常一个病人以一种综合征为主,但一个病人表现几种胃术后综合征者亦不罕见。充分认识这些并发症的适时而合理的再次手术矫治有着重要的临床意义。
(一)倾倒综合征
倾倒综合征(Dumping Syndrome)是胃大部切除术和各式迷走神经切断术附加引流性手术后常见的并发症。由于判断倾倒综合征的标准的不一,因而各家所报告的发生率亦相距甚远,5%~75%不等。
【发病机理】
倾倒综合征的发病机理至今尚未能完全阐明,比较一致的看法是多种因素的综合作用。其中幽门功能的失却是发病的根本原因,至于有哪些物理的化学的因素(诸如血容量、渗透压、酸碱度、肠管膨胀等)和胃肠道激素及生理活性物质(诸如5-羟色胺、激肽、血管活性肠肽、胰岛素、肠高血糖素、神经降压素、抑胃肽、胃动素、P物质等)参与了发病则众说纷纭。血容量减少和高渗食物倾入空肠是被广泛接受的两大因素,但也有学者观察到:虽然血糖和血容量下降很显著,但其症状可以很轻,甚至完全无症状;并非高渗的食物(如牛奶)也可诱发倾倒综合征;在给患者进食高渗食物的同时静脉输液(包括胶体液)以维持其血容量正常并不能防止倾倒综合征全身症状的发生。
值得注意的是,近年关于幽门结构和功能的认识已有所更新。幽门不再被认为是一消化系括约肌,而主要是作为胃十二指肠之间的一个狭紧段而存在。胃窦-十二指肠通道即幽门前胃窦、幽门和十二指肠球部,被认为是一个统一的功能单位。幽门的宽窄改变亦即舒缩活动是这三者相互协调的结果。胃排空的调节是相当复杂的。食物的稀稠、粗细、成分(含糖、蛋白质、脂肪的比例),胃内容的体积、渗透压、酸碱度及成分比例等均是影响胃排空速度的因素。食物在胃内消化时所引起的胃运动是产生胃内压亦即胃排空原动力的根本因素,而十二指肠接受排出的食糜后所引起的对胃运动的抑制是实现胃排空调节的主要方面,它具有自动控制(包括神经及体液两条途径的反馈调节)的性质。
丧失幽门功能之后,几乎所有的病人都或多或少、或早或晚出现过倾倒的症状。但仅其中的5%需就医,而就医者中亦仅有1/5的病例需要治疗。即便是症状较重者,亦会在一般的对症处理下逐渐缓解。因此,倾倒综合征可以认为是机体在丧失幽门功能后,生理上适应新的胃肠通道的过程中所出现的反映在神经系统和消化系统上的一组症候群。这种适应反应发生的强度和适应过程的快慢的个体差异是相当大的,这两者之间的不同组合即构成临床倾倒综合征症状或轻或重、病程或长或短等各种不同的多变的病象。因之是否也可以推断,倾倒综合征的防治根本在于尽量保留或恢复幽门的功能。至于发病机理中涉及的物理的化学的因素和胃肠道激素及生理活性物质可能远不止目前所揭示的那些,就现今的资料而言,还无法对这类因素进行有效的调控。
【诊断】
根据餐后出现典型的倾倒症状多可明确诊断。症状可分为消化道症状和全身症状两大类,前者有腹部不适、恶心、呕吐、腹胀、腹痛、腹泻等,后者如乏力、头晕、头痛、心慌、虚汗、气短,甚至虚脱等。对症状不典型者是否有必要作倾倒综合征激惹试验(Dumping Provocation Test)加以证实,意见并不一致。空腹口服50%葡萄糖液200m L是一种非生理性的强刺激,其所诱发的较强反应并不能反映患者的一般发病情况。
【治疗】
1.非手术治疗
(1)一般治疗:
1)体位:餐后适当平卧休息,减少活动,避免因重力作用食物过快从残胃进入小肠。
2)饮食:注意饮食的调节,逐渐增加食量,给予多次少量的高脂、低糖、含水分少的半固体食物,以增加食物的黏滞度,避免流质及含糖、含盐较多的饮食。同时养成餐后半小时方可饮水的习惯。每餐给予10~15g果糖可防止出现低血糖症状,果糖的凝胶特性可增加肠内容的黏滞度而延缓糖的吸收。
(2)支持疗法:对病情严重者应加强支持疗法。根据血生化结果,维持患者水、电解质平衡和酸碱平衡,必要时酌情应用复方氨基酸、脂肪乳剂、血浆制品等,以利于患者机体的康复。
(3)心理治疗:神经精神因素对倾倒综合征的发生是很重要的,倾倒综合征患者术前精神状态多属于兴奋型或紧张型。有必要对患者进行耐心的病情解释工作,使患者能正确认识自己所患的疾病,树立信心与医生配合治疗。适当的心理暗示治疗或许亦有意想不到的效果。应当注意,对此类情感不稳定型的溃疡病患者选择手术治疗时应从严掌握。
(4)药物治疗:对减轻发作的症状有辅助治疗作用。X线钡餐检查证明输出段肠蠕动特别亢进者,可辅用解痉药物,如颠茄类;有时应用抗组胺药或5-羟色胺拮抗剂赛庚定、利血平等亦可有缓解症状的效果。干扰糖代谢的药物(甲糖宁、α-糖苷水解酶等)及有延缓胃排空作用的甲氧果胶也有试用于临床者。另有人报告应用生长抑素(Somatostatin)治疗倾倒综合征患者取得满意的效果,可明显改善患者的全身症状及消化道症状,其作用机理可能是与抑制了血管活性肠肽等多种消化道激素的分泌有关。
2.手术治疗 倾倒综合征是极有可能随着时间的推移而自愈的疾病,因此手术适应证的掌握必须十分慎重,仅宜用于极少数经较长时间非手术治疗而症状仍较严重的患者。目前临床上所用的改变原消化道重建方式的手术机理主要是使新的胃肠通道更趋于人体正常生理(如将BillrothⅡ式吻合改为BillrothⅠ吻合)和延长残胃排空时间(各式空肠袢间置术及Roux-en-Y吻合术等)。常用的手术方式如下。
(1)将BillrothⅡ式吻合改为BillrothⅠ式吻合:改为BillrothⅠ术式后,食物经过十二指肠与胆汁及胰液充分混合,并使食物在十二指肠有一段滞留时间,倾倒综合征的发生率可显著降低。
(2)空肠间置、倒置手术(图13-14):采用顺蠕动或逆蠕动空肠袢间置于胃十二指肠之间,使食物在残胃滞留时间延长,防止倾倒综合征的效果是较为确切的。选用顺蠕动空肠袢(Henley空肠袢)的优点是肠段长度限制不太严格,有时甚至可直接利用原输出袢转接至十二指肠残端上以简化手术操作。而在胃十二指肠间间置一段逆蠕动空肠袢,则长度必须严格控制在10cm,过短无效,过长则有引起胃潴留之虑。另有一法为在输出袢40cm以远处倒置一段肠管,效果不及前二者,这段肠管亦应仅取10cm。
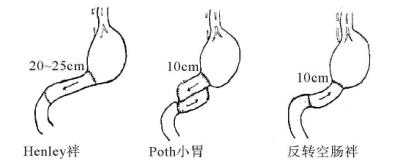
图13-14 空肠间置、倒置手术方式
(3)Roux-en-y吻合(图13-15):对于严重倾倒综合征患者,可试用残胃空肠Roux-en-y吻合,疗效尚可,操作也方便。其作用机制尚未完全明了,除Roux-en-y式胃空肠吻合可延缓胃的排空外,还有人认为十二指肠和上段空肠是糖分解的主要场所,胃空肠y型吻合将使食物直接进入中段空肠,避免了糖的过分吸收而防止倾倒综合征的发生。
(二)复发性溃疡
溃疡复发是胃部分切除术的重要并发症。因其多见于吻合口之空肠侧,故多称为吻合口空肠溃疡或吻合口溃疡,也有称之为边缘性溃疡者。
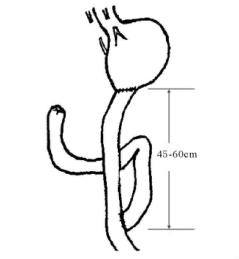
图13-15 Roux-en-y式胃空肠吻合
复发溃疡可早于术后即期(1个月之内),亦可迟至术后10余年后,然而多于术后2年之内出现。溃疡多为圆形或椭圆形,最多见于吻合口对侧的空肠壁,其次为吻合口边缘空肠侧,胃壁上的复发少见。复发溃疡易并发出血、穿孔。尤其是慢性穿透多见,由此并发胃-空肠-结肠瘘,甚或外瘘。
1.胃酸过多仍是溃疡复发的基本因素 其原因可为:
(1)手术方法或技术上的欠缺:①单纯胃空肠吻合术。②胃切除量不足。③Bancrof溃疡旷置法残留胃窦黏膜。④空肠输入袢过长,输入输出袢间的侧侧吻合(Brauwn吻合),胃空肠Y式吻合。⑤迷走神经切断术加胃空肠吻合或半胃切除术时迷走神经切断不完全。
(2)患者的强溃疡素质。
(3)胃泌素瘤(Zollinger-Ellison综合征)、多发性内分泌腺瘤病等。
复发性溃疡的诊断依赖于临床表现及胃镜、X线钡餐检查。血清胃泌素测定有助于排除胰源性溃疡,空腹血清胃泌素>1 000pg/m L可确诊为胃泌素瘤;可疑病例还可进一步作胰泌素刺激试验。胃放射性核素扫描有助于鉴别胃窦黏膜残留症。胃黏膜有浓集99m锝的特性,若原十二指肠残端部位有99m锝积聚,提示有胃窦黏膜的残留。
2.手术治疗的指征
(1)原术式或操作方法有缺陷。
(2)有出血、穿孔、内瘘等严重并发症。
(3)有其他致溃疡因素存在。
3.手术方式 取决于前次手术方法、复发溃疡的范围及部位、有无致溃疡损害及病人的状况等。
(1)原单纯胃空肠吻合术:可加作胃迷走神经切断术或改作胃大部切除术。
(2)切除范围不足:再次胃部分切除术或胃肠吻合口切除加迷走神经切断术。
(3)胃窦黏膜残留:十二指肠残端胃窦黏膜切除。
(4)原迷走神经切断术:改作胃大部切除术或再次彻底的迷走神经切断术。
(5)胃泌素瘤:全胃切除术。
(三)碱性反流性胃炎、返流性食管炎
因幽门功能不全或幽门缺失以致胆汁反流入胃而引起的胃炎称反流性胃炎(reflux gastritis),因反流液为碱性,故又称碱性反流性胃炎(alkaline reflux gastritis)。胃切除术后的慢性浅表性或萎缩性胃炎大多与胆汁反流有关,从而成为一个日愈令人关注的临床问题。
主要致病因素为反流入胃的胆汁中的胆酸,它可溶解胃黏膜屏障结构的重要组成成分——脂蛋白层,致使氢离子易于进入胃黏膜而造成损伤。另外,反流液中的胰液成分与胆酸的损害有协同作用。
反流性胃炎的黏膜损害多表现为充血、水肿、糜烂、点片状出血等。
反流性胃炎的诊断主要依靠典型的“三联征”:中上腹或胸骨后烧灼样疼痛,餐后疼痛加重,服制酸剂无效;胆汁性呕吐,吐后症状并无缓解;明显消瘦,并有贫血。胃镜检查所见的胆汁反流程度并不与临床表现及胃黏膜病理改变相平行;与碱性反流性胃炎相应的胃镜下征象是慢性萎缩性胃炎的表现。
手术治疗的适应证为典型的临床表现加内窥镜下严重的黏膜病变,且症状持续、不为内科疗法(饮食疗法、解痉抗酸剂、H 2受体阻滞剂、消胆胺酯等)所减轻者。手术的原则是将十二指肠内容完全转流,使其不进入残胃。
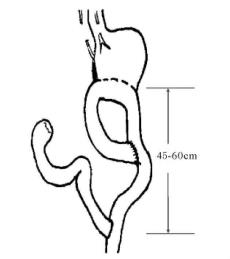
图13-16 Tanner-19式胃空肠吻合
可供选择的术式如下。
1.输入袢与输出袢间吻合 手术简便但效果较差,对肠袢粘连严重者有一定的实用价值。
2.BillrothⅡ式吻合改为BillrothⅠ式吻合 部分病例效果并不理想。
3.顺蠕动Henley肠袢间置 取一长20~25cm的空肠袢间置于胃与十二指肠之间。
4.Roux-en-y式转流 效果较为确切。对于原为BillrothⅡ吻合且输入袢较长者,Tanner-19式转流更为简便(图13-16)。
各种转流性手术的同时应加迷走神经切断术,以防止胃肠吻合口及移植肠袢发生溃疡。
(四)迷走神经切断术后腹泻
迷走神经切断术后腹泻发生率较高。迷走神经干切断术后多达70%的病例有腹泻或大便习惯改变;选择性迷走神经切断术后腹泻发生率有所下降;而高选择性迷走神经切断术后则尚无严重腹泻的报告。多数此类腹泻病例可望由控制饮食和内科药物治疗得以好转,仅约1%因腹泻严重、体重下降过多而需手术治疗。
有效的术式是在Treitz韧带下100cm处反转10cm左右的肠段。制作反转肠段,既可直接切取10cm肠段逆时钟方向旋转180°(图13-17),也可如Rygick所介绍的不需旋转肠系膜,四断端两两交叉吻合(图13-18)。

图13-17 反转肠袢
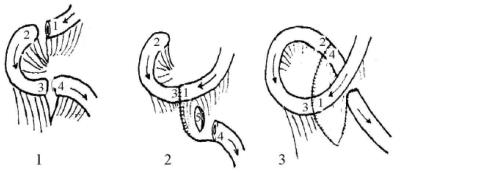
图13-18 Rygick反转肠袢法
(五)小胃综合征
由于胃切除量过多(高位溃疡、再次胃切除等),残胃容积太小,以致术后发生早饱、餐后饱胀、食后加重的上腹不适以及体重下降等,一般称之为小胃综合征。饮食疗法对多数病例有体重增加、贫血改善的效果,但若长期不能恢复正常饮食或不能坚持饮食疗法者可考虑手术矫治。
各式设计于扩大残胃容量的代胃性手术均可选用于治疗小胃综合征(图13-19)。

图13-19 代胃性手术
(六)几种并发症复合存在时的处理
文献中很早即有一个病人有2种甚至几种胃术后综合征的表现的报告。Herrington 6例倾倒综合征与迷走神经切断术后腹泻的经验表明:反转肠段置于残胃与十二指肠之间对控制倾倒综合征有效,而对迷走神经切断术后腹泻无益;而置于Treitz韧带下100cm处的反转肠段虽能控制迷走神经切断术后腹泻,却对倾倒综合征无能为力。因此,他对这6例病人作了两个不同部位的肠段倒置手术而获得成功。这也就意味着,一种矫正性手术只能治疗一种并发症。
以下是几种文献中多见的复合综合征的处理术式。
1.迷走神经切断术后腹泻并倾倒综合征 作前述的双重肠段倒置。
2.倾倒综合征并反流性胃炎 Roux-en-y式转流加胃肠吻合口与Roux臂间的短段空肠袢倒置。
3.迷走神经切断术后腹泻并反流性胃炎 Roux-en-y式转流加胃肠吻合口下100cm处的肠段反转。
第三节 胃扭转
胃扭转偶见于X线钡餐报告,多数不需要手术处理,临床上应对此有所认识。
【病因病理】
胃扭转按发病的急缓分为急性和慢性两类。
急性胃扭转与固定胃的解剖结构异常有关,如较大的食管裂孔疝、膈疝、膈膨出、内脏下垂、胃大小弯的韧带过长、十二指肠外侧腹膜过松等。而剧烈呕吐、急性胃扩张、胃巨大肿块、胸腔负压的急剧改变等则是急性胃扭转的诱因。
慢性胃扭转多继发于膈、胃本身及上腹邻近器官病变,如穿透性溃疡、肝脓肿、膈创伤等造成的粘连可将部分胃壁固定于异常位置而形成扭转的形态。
按扭转方向的不同,胃扭转可分为系膜轴及器官轴两型。前者较常见,胃以从小弯中点至大弯的连线为轴心(横轴)发生扭转,造成胃前后壁对折,使胃形成两个小腔。器官轴型则胃以从贲门至幽门的连线为轴心(纵轴)扭转。两种类型的扭转程度一般在180°以下。
【诊断】
(一)临床表现
胃扭转的症状和体征决定于发作为急性还是慢性,扭转程度为完全性还是部分性。急性胃扭转三联征(Borcherol三联征)为上腹局限膨胀性疼痛、重复性干呕和不能将胃管插入胃内。腹部体征包括上腹可见胀大的胃型,压痛明显,可引出振水音。病情进展急剧,脉搏快速,呼吸急促,可很快陷入休克甚至死亡(有文献报告急性胃扭转的死亡率可高达30%)。慢性胃扭转则可无任何症状,或有类似于胃十二指肠溃疡或慢性胆囊炎的症状,往往有多次反复的急性发作史。
(二)X线检查
急性胃扭转时的X线片常可见宽大气液平面的胃泡阴影,有时可见左膈升高(膈膨出、膈疝等),吞钡检查见钡剂停留于食管下段而不能通过贲门。慢性胃扭转可在钡餐检查时偶然发现。系膜扭转型的X线特征是两个有液平面的胃腔以及幽门和贲门在相近平面。器官轴扭转型则见胃大小弯倒置,胃底液平面不与胃体相连,胃体变形,幽门向下。有时尚可发现与扭转有关的相应病变。
【治疗】
偶然发现的无症状或症状很轻的慢性胃扭转一般不需手术治疗。
急性胃扭转或慢性胃扭转急性发作时应先试行放置胃管。若能置入胃内,则将胃内大量的气、液体吸出,急性症状缓解后再进一步检查确定治疗方案。若不能插入胃内,则应及早手术。
手术方式:若能肯定引发胃扭转的病因,则针对病因处理。如胃病变的胃部分切除术、粘连索带的松解分离术、膈疝的修补术等。胃固定术适用于非此类病变所致者,视术中情况将胃分别固定于前腹壁、肝圆韧带或横结肠系膜等处。最简单的前腹壁固定法为胃前壁置管造口术。
第四节 急性胃扩张
急性胃扩张(acute gastrectasis)系指胃因强烈的刺激而发生反射性麻痹,张力消失,大量液体和气体潴留而排空障碍,引致胃和十二指肠上段极度急性膨胀的一种综合征。大都发生于饱餐和腹部手术后,也可发生于慢性消耗性疾病长期卧床的患者。
【病因病理】
胃肠壁原发性麻痹:如手术过度牵拉;腹膜后血肿或引流物、炎症的刺激;暴饮暴食后胃壁过度扩张;腹腔内炎症或损伤;剧烈疼痛;情绪波动;毒血症以及缺钾为主的电解质紊乱等都可反射性引起胃壁平滑肌麻痹。
十二指肠受压梗阻:十二指肠横部被小肠系膜及肠系膜上动脉压迫于脊柱及腹主动脉之间。如消瘦(腹膜后脂肪少)、长期卧床病人易于受压。
实际上,临床常见的发病是这两种机制的并存。扩张的胃向下压迫增加了机械性梗阻的因素,胃十二指肠内容物的积聚又刺激黏膜分泌更多的液体,进一步加重了胃十二指肠的麻痹和扩张,如此恶性循环。
胃扩张后,胃壁变薄、水肿、胃张力下降,胃黏膜糜烂、坏死、出血,甚至发生溃疡、大出血以及胃穿孔。同时,大量液体丧失导致水、电解质及酸碱平衡紊乱,甚至周围循环衰竭。
【诊断】
(一)临床表现
典型症状为上腹膨胀和溢出性呕吐。呕吐物为含胆汁的液体,可多达3~4L,呕吐后腹胀不减。体检可见腹部膨胀,以左上腹为明显;有压痛和轻度肌紧张,胃区有振水音,肠鸣音减弱或正常。可因水电解质丢失而出现全身表现甚至休克昏迷。若并发胃穿孔或急性胃黏膜撕裂,则可出现腹膜炎或上消化道大出血。
(二)辅助检查
1.实验室检查 血红蛋白升高,有低钠、低钾血症及高氮血症。二氧化碳结合力及非蛋白氮上升,白细胞一般无明显增高。
2.X线检查 腹部平片可见膨大的胃泡及胃区宽大的液平面,侧位片上可见充气扩张的十二指肠。
3.B超 显示胃扩张,胃腔充满液体。
(三)鉴别诊断
1.急性腹膜炎 有腹膜刺激征,无极度胃扩张表现。
2.肠梗阻 X线立位片可见多个液平,有肠梗阻的阵发性腹部绞痛症状。
3.良性幽门梗阻 可有溃疡病史和症状,一般不会出现血流动力学改变;呕吐物多不含胆汁。
4.急性胃炎 腹胀不显著,呕吐后腹痛减轻。
5.急性胃扭转 根据特征性干呕,X线检查的特殊表现可资鉴别。
【治疗】
1.一般治疗 ①立即放置鼻胃管吸出全部胃内液体,用温等渗盐水洗胃。并禁食,持续胃肠减压。②纠正血容量不足、水电解质和酸碱平衡紊乱。③病情好转24h后,可于胃管内注入少量液体,如无潴留,方可开始少量进食。
2.手术治疗 指征:①饱餐后胃内容物无法吸出。手术后发生者一般禁忌手术。②合并胃穿孔或大量胃出血者。③胃功能长期不能恢复,稍进食即扩张潴留,静脉长期营养不能维持者。手术以选用简单有效的方法为原则。如胃腔冲洗,暂时性胃造口术;胃有需切除病灶时可选用不同范围的胃切除术。
第五节 胃嗜酸性肉芽肿
胃嗜酸性肉芽肿(eosinophilic granuloma)于2026年由Kaizsen首次报告,临床上并不罕见,约占所有送检胃病理标本的1%。
【病因】
有关胃嗜酸性肉芽肿的发病因素如下。
1.过敏反应 病变中有大量嗜酸性粒细胞浸润;约50%的患者有过敏史(荨麻疹、枯草热、支气管哮喘等);部分病例末梢血中嗜酸性粒细胞增多,病变切除后又可恢复正常;肾上腺皮质类固醇药物治疗有效。
2.异物反应 本病常合并溃疡,并有异物肉芽肿病理改变;将食物或药物注入胃黏膜下,曾引起与本病相似的病变。
3.炎症 在组织学上肉芽肿组织区有急性和慢性炎性细胞浸润。
4.遗传因素 曾有报告同胞兄妹均患胃嗜酸性肉芽肿。
5.与霉菌感染有关 不少文献报告胃嗜酸性肉芽肿病例近80%病理证实合并有霉菌感染。也有人认为本病系胃溃疡合并霉菌感染所致。
【病理】
病变早期肉芽肿内充满细胞成分,并有大量嗜酸性粒细胞浸润,后期嗜酸性粒细胞减少,但呈弥漫性分布,且纤维组织增多。淋巴细胞、浆细胞浸润并有淋巴滤泡形成;组织内血管壁增厚,小动脉内皮细胞增生,甚至出现血浆渗出和纤维素样变性;病变易于形成包块及合并深大的溃疡。
【诊断】
(一)临床表现
(1)本病无特殊症状。多数病程较长。早期可有类似于胃十二指肠溃疡的上腹疼痛、黑便,后期则因上腹包块、柏油便甚至呕血而与胃癌混淆。
(2)部分病例可有过敏病史及过敏性疾病史。
(3)尽管病程冗长,但无明显消瘦等恶病质表现。
(二)辅助检查
(1)末梢血嗜酸性粒细胞计数可有明显升高。
(2)胃镜检查可直接窥视到胃内肿块、溃疡,但活检阳性率低。
(3)X线钡餐对本病的诊断率较高。深大的腔外龛影、肿块虽大但周边胃壁无受侵僵硬征象等有助于与胃癌鉴别。
【并发症】
(1)溃疡形成。绝大多数胃嗜酸性肉芽肿合并有溃疡形成。发病因素包括胃排空障碍、病变表面黏膜缺血坏死、肿块中心坏死感染等。
(2)溃疡出血。有文献报告其出血率远较消化性溃疡为高。
(3)穿孔。较少见。
(4)恶性变可能。
【治疗】
本病常因上消化道出血、上腹肿块而接受外科治疗。由于术前误诊率很高,因而术中准确判断病变的性质、确立正确的手术原则至关重要。一方面是要避免无谓地扩大切除范围,另一方面也要避免因肿块巨大及向胰腺、肝脏穿透而放弃切除。结合病灶及腹腔探查的发现和术前病史体征及胃镜、X线检查结果综合分析,多数病例可获正确的治疗。
第六节 胃的良性肿瘤
胃良性肿瘤并不多见,约占胃肿瘤的3%。发生临床症状的胃良性肿瘤则更为少见,大半是在X线钡餐或胃镜检查时无意中发现的。
【病理】
按其组织发生可分为两大类:一类为源自胃黏膜上皮组织的腺瘤或息肉样腺瘤,另一类为来自胃壁间叶组织的平滑肌瘤、纤维瘤、血管瘤、脂肪瘤、神经纤维瘤和神经鞘膜瘤等。
胃腺瘤或息肉样腺瘤常称为胃息肉。但应注意胃息肉可分为真性和假性两种。只有源自胃黏膜上皮组织的腺瘤或息肉样腺瘤才是属于肿瘤性增生的有恶变倾向的真性息肉;而那些炎性增生所形成的息肉样病变称为假性息肉。Peutz-Jeghers综合征在胃内见到的息肉属错构瘤。
胃良性肿瘤可发生在胃的任何部位,但多见于胃窦。多数为单发,但多发者亦不少见;胃息肉症则为大小不等的息肉充斥全部胃黏膜。
胃良性肿瘤的继发性病理改变有出血、溃疡、癌变(大于2cm的肿块尤其危险性大)等。
【诊断】
(一)临床表现
胃良性肿瘤临床上常无症状。症状的有无及轻重决定于并发症的严重程度,而并发症的发生又决定于肿瘤的大小、部位及表面状况。除一般的上腹部不适、疼痛外,较多见的症状为出血,虽多为慢性小量出血,但也可发生急性大出血。位于贲门或幽门附近且体积较大者可出现梗阻症状;若为长蒂息肉则可因息肉滑入及退出胃幽门管而表现为发作性的幽门痉挛或梗阻症状。巨大的平滑肌瘤等可在体检时触及上腹肿块。
(二)辅助检查
1.X线钡餐 胃内可发现圆形或卵圆形充盈缺损,外形整齐,边缘清楚;若合并溃疡形成则可见龛影;如为带蒂则阴影可以移动。
2.胃镜检查 可直接观察到肿瘤的形态;多点活检有助于确定有无早期恶变。
【治疗】
小的无症状的息肉需定期随诊,如息肉引起症状或大于2cm时应予以切除。
手术方式视肿瘤的性质及部位而定。可供选择的术式包括胃切开将息肉连同基底黏膜的广泛切除、胃楔形切除、远侧或近侧的胃部分或大部分切除甚至全胃切除。
第七节 十二指肠憩室
十二指肠憩室的发生率并不低,尸检统计可高达22%。由于它很少引起症状,因此,在临床上绝大多数的十二指肠憩室仅是在作X线钡餐检查时偶然发现的。
【病理】
十二指肠憩室是部分肠壁向外扩张所形成的袋状突起,多为单发,绝大多数的憩室位于十二指肠降部的内侧,特别好发于十二指肠乳头的附近;有的深入于胰腺组织之中,在手术时也难以寻找。少数发生在十二指肠横部或升部。
憩室好发于肠壁局限性软弱处,壁由黏膜、黏膜下肌层和浆膜层组成,没有或几乎没有肌层。
上述原发性憩室不同于由于十二指肠溃疡瘢痕收缩或慢性胆囊炎粘连牵拉所致的继发性憩室。后者属于十二指肠溃疡或胆囊炎的并发症,多见于球部,它的壁是含有肌层的。
十二指肠憩室可大可小。如与肠腔连接的入口部(憩室颈)较狭窄时,则食物进入后不易排出,可导致潴留,引发炎症、溃疡、出血、穿孔等并发症。
【诊断】
(一)临床表现
绝大多数十二指肠憩室没有任何症状,憩室本身也没有特殊体征。十二指肠憩室引起症状者不超过5%,症状都继发于有并发症时。如因憩室内食物潴留引起炎症、溃疡时,出现上腹不适、脐周隐痛、进食后饱胀,并可发生恶心、呕吐、嗳气等症状,此时憩室相应部位可有明显压痛;当憩室压迫胆总管和胰管时,可以出现黄疸、胆道感染和胰腺炎症状;憩室合并的出血可以是慢性小量出血导致贫血,也可以是急性大出血引起呕血及便血;十二指肠降段憩室的穿孔常波及腹膜后引发严重的腹膜后感染。
(二)X线钡餐检查
十二指肠憩室的诊断依赖X线钡餐检查,小的十二指肠憩室甚至在X线钡餐检查时也常难发现。憩室的X线表现为与十二指肠腔相连的圆形或分叶状充钡阴影,轮廓整齐,外形可随时改变,阴影内可有气液平面。肠道钡剂排空后憩室内常仍有钡剂残留。
(三)鉴别诊断
鉴别诊断的难点在于认定患者的症状是否为憩室所致,这关系到手术治疗的指征。“上腹症状”是常见的,十二指肠憩室在常规X线钡餐检查中也是常见的,而有症状的十二指肠憩室却是十分少见的,单纯潴留也很少引起症状。鉴于这“二常二少”,不应把“上腹症状”轻率归罪于十二指肠憩室。只有在经过详细深入的检查后,的确没有发现其他上腹器官疾病,而憩室甚大,外观不整齐,钡剂潴留6h以上不能排出,压痛明显者,始可下“有症状的十二指肠憩室”的诊断。
【治疗】
1.无症状的十二指肠憩室不需治疗。
2.非手术治疗 包括调节饮食,给予抗酸、解痉、抗炎药物,体位引流等,若症状可得以减轻或缓解则不需手术治疗。
3.手术治疗
(1)手术指征:①症状确因憩室所致,且内科治疗无效;②十二指肠乳头旁憩室与胆道、胰腺疾病同时存在者;③憩室发生出血、穿孔、十二指肠梗阻等并发症。
(2)手术方式:
1)憩室内翻缝合术 适用于十二指肠降部外侧和横部、升部的小的单纯憩室。憩室经肠腔翻入后,于颈部结扎或缝合。
2)憩室切除术 较大的憩室以及有炎症、溃疡、结石的憩室以切除为宜。
3)憩室旷置术 对显露困难或切除危险性过大的憩室,可考虑胃部分切除胃空肠吻合术,以转流食物。空肠输入、输出袢间应加侧侧吻合甚或采用胃空肠Y式吻合以保证转流完全。
手术中困难的是寻找憩室。手术前服少量钡剂,手术中注射空气入十二指肠肠腔,可能有助于定位。
(3)手术并发症:主要并发症为十二指肠瘘和胰腺炎。手术时要避免损伤胆总管和胰管,术后十二指肠的引流减压要确切有效。
第八节 良性十二指肠淤滞症
本症又称肠系膜上动脉压迫综合征、十二指肠血管压迫综合征等,系指十二指肠第三或第四段受肠系膜上动脉(或其分支结肠中动脉)压迫所致的慢性梗阻。有些急性胃扩张也可能是本症的急性梗阻型。该疾病较为少见,多发于瘦长体型的青、中年女性。
【病因病理】
肠系膜上动脉从主动脉分出时与第一腰椎的夹角平均为30~42°,该角的顶点到十二指肠中点的距离平均为10cm。造成十二指肠梗阻与这两者有关,夹角越小,距离越短,梗阻发生的可能性越大。另外,肠系膜上动脉分出后向右下斜行,所以只有肠系膜上动脉最近端部分才是直接跨过主动脉及椎体的。因此,梗阻发生的因素是综合性的,即肠系膜上动脉起始处呈一窄角伴有异常高位且固定的十二指肠(Treitz韧带过短),或在十二指肠横跨椎体处和主动脉远端有此动脉的异常走行的跨越。
引起慢性十二指肠淤滞症的原因尚有环状胰腺、内脏下垂及腹腔内粘连对肠系膜的牵拉等。
【诊断】
(一)临床表现
突出的症状是:长期反复发作的餐后上腹慢性绞痛,有时也有急性发作。伴有上腹饱胀,杂有隐痛、钝痛的感觉,以及嗳气、恶心和呕吐。呕吐物中含有胆汁和隔餐食物;呕吐常发生于餐后2~3h或夜间,吐后症状暂缓解。病人进食后站立或坐位易诱发呕吐;病人常能发现发作时采取某种体位可减轻症状,如俯卧位或左侧卧位、胸膝位、前倾坐位将双膝放在颌下等。发作时上腹部可偶见胃蠕动波及震水音。病程迁延者,可出现营养不良、消瘦、贫血等症状。
(二)X线钡餐检查
可确定诊断。胃十二指肠明显扩张但幽门通畅。可见十二指肠有频繁的蠕动和逆蠕动,钡剂在十二指肠横部末端突然遇阻,不易进入空肠,采取某种体位(如头低足高位、左侧卧位、俯卧位等)则钡剂顺利通过。
(三)鉴别诊断
注意鉴别引起十二指肠横段或上升段排空障碍的其他病变,如环状胰腺,十二指肠癌肿、结核、克隆病等。这些病变的X线征象与肠系膜上动脉压迫明显不同,易于识别。另需鉴别者尚有先天性巨十二指肠症及硬皮症伴有的十二指肠扩张,此类疾病的排空障碍是动力性的,不难区别。
【治疗】
(一)内科治疗
发作时予以禁食、鼻胃管减压或洗胃、解痉药物、静脉补液及营养治疗。症状缓解后进稀软易消化食物,少食多餐,餐后采俯卧位或左侧卧位。下床活动时可用腹带以防止内脏下垂。
(二)手术治疗
1.十二指肠悬韧带松解术 适用于十二指肠悬韧带过短者。
2.十二指肠空肠吻合术 在横结肠系膜下将空肠与十二指肠二、三段交界处作侧侧或端侧吻合。效果确切。
3.胃空肠吻合术 仅在病人全身情况极差时考虑,一般不宜采用。
(胡元龙)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






