第七章 全身性炎性反应综合征(SIRS)、脓毒症和多器官功能不全综合征(MODS)
第一节 概 述
严重创伤、长时间广泛切除的复杂手术和有各种慢性器质性并存病的手术病例,其手术死亡率和合并症发生率较高。而感染又是死亡和合并症的最重要原因。腹腔感染可引起远处原先正常的器官发生功能衰竭,这是临床外科医师都曾经历的问题。2026年Burk等首先发现重症腹膜炎病例可发生过度通气和低氧血症,且最终大多数又死于肾衰。2026年Skillman报告腹腔感染引起远处器官衰竭,包括呼衰、低血压、黄疸和急性胃黏膜出血。20世纪70年代后正式提出多器官衰竭(MOF)概念,并总结其特征为序贯性、进行性多个器官功能衰竭。比喻为多米诺牌块,当第一块骨牌倒下,随之序贯性骨牌连续倒下。而腹腔感染是其中最为常见和重要的原因,Polk等甚至认为隐匿性腹腔内感染的一个体征就是远处器官衰竭,至今已有大量临床证据证实腹腔内感染与多器官衰竭之间的密切关系。
20多年来临床上MOF发生率不断上升,其死亡率也随之上扬,直至最近数年才稳定下来。显然是因为重危病例在循环复苏、机械通气、营养支持和血液净化等生命支持系统发展和改进下,危重病例生命得以维持,也有了康复的希望,而以前这些病人尚未到MOF出现之前早已死亡。为此1992 年8月美国危重病监护医学会(society of critical care medicine,SCCM)和美国胸科医师学会(american college of chest ohysician,ACCP)对脓毒症及其相关的MOF等进行讨论统一定义,并公布他们的建议。他们认为此类危重病人死亡的原因已不再是原发病而是远处器官序贯性发生的多个系统或器官功能不全,其发生不是突然恶化,不是全部功能丧失或无功能的“全或无”现象,而是逐步发生进行性的生理功能不全和恶化,但也有逆转可能。因而提出:弃用MOF一词,改用多器官功能不全综合征(MODS)。它指器官功能不能维持内环境稳定,在器官功能受损早期应积极治疗或支持其功能。MODS一词比MOF为优,因为器官功能不全在各组病例间有程度上差别,不宜以衰竭一词蔽之。此外,器官功能变化随病程进展而有不同,且有的为直接对一个器官的损害,如胃液吸入性肺炎、胸廓外伤发生ARDS等,由此引起的MODS可认为是原发性(primary);无直接对某一器官损害而引起的远处器官MODS,可称为继发性(secondary)。
ACCP和SCCM公布的会议意见得到普遍的认可,脓毒症发病率和死亡率由于有统一的标准和诊断可以比较治疗措施上的效果。过去,sepsis一词的确切定义不一致,有的泛指重症感染,有的认作全身性感染。John等提出sepsis的临床表现是发热、白细胞增加、神志变化、血循环和代谢改变的内环境失衡,然后可有远处器官功能不全出现。其起因是全身性的炎性反应而非局部的炎性反应,并且是由感染所引起。Sepsis以前的中译名“脓毒症”尚待商讨。因为实验和临床皆证明此种全身性临床综合征主要由宿主产生的递质的作用而发生,并非微生物或其毒素所直接的作用。
sepsis一词传统上是“播散性感染”的同义词。而播散性感染时微生物或其毒素是发热、心率快、呼吸急促的先决条件。最早曾专指全身性(播散性)革兰氏阴性杆菌感染时出现临床表现,以后又认识到革兰氏阳性菌、病毒、霉菌等也可能同样引起。直至近年来才明白正常人给予无菌的肾上腺素也可以发生相同的临床表现。此外过去认为sepsis syndrome半数以上能证实有细菌感染或入侵的存在,故认为细菌感染是先决条件。但实际上可有30%病例证实并无感染的存在。另一方面细胞素和细菌产物的测定结果差异很大,难以得到与临床表现相匹配的浓度值。sepsis定义长期以来都不确切且实际上缺如,其原因很多,主要因为过去此种严重感染的创伤病例未到MODS时已死亡;早期研究着重革兰氏阴性菌血症,而现在已明确sepsis可以并无菌血症存在;早期研究多限于外科。此外,对感染(infection)、sepsis、sepsis syndrome、septic shock也无精确定义,表现在各家说法标准不一,结果是各家报道病例难以彼此比较,因此死亡率相距甚远。
ACCP和SCCM讨论统一意见认为sepsis是一组高度异质性病例;临床医师都能认识sepsis,但并无人能作出一个完全确切的定义。而全身性炎性反应综合征(SIRS)一词比sepsis为优,无论是感染、胰腺炎、缺血(全身性或区域性缺血、缺氧)、复合创伤(主要指躯干区创伤)、出血性休克、免疫介导器官损害等都可以用SIRS而无偏义。基于此,ACCP和SCCM建议:①Sepsis一词用于因感染引起临床上SIRS,而SIRS一词用于不论何种原因引起者。SIRS临床诊断标准为:a.体温>38℃或<36℃;b.心率>90次/min;c.呼吸>20次/min或PaCO2<32mm Hg;d.白细胞>12 000/mm3或<400/mm3(指无其他原因如化疗、放疗等),或未成熟中性白细胞(杆核)>10%。此4项出现≥2项即可诊断SIRS。外源性给予肿瘤坏死因子(TNF)或细胞素也可出现SIRS,SIRS是一种临床表现而MODS是其可能的终末结果。②SIRS若确定由感染所致,则仍用Sepsis一词,以此与其他原因SIRS区别,有利于治疗。③感染的定义为正常无菌组织中,有微生物存在且引起炎性反应或正常宿主组织被微生物侵入,菌血症指血循环中有活的细菌出现,有病毒时为病毒血症,有霉菌时为霉菌血症,有寄生虫时为寄生虫血症。败血症(septicemia)一词应废弃。重症Sepsis(Severe Sepsis)即指Sepsis出现一个或以上器官功能不全时,或低血流灌注(指乳酸酸中毒、少尿和急性神志变化)或低血压(收缩压<90mm Hg或下降幅度≥40mm Hg)。感染性休克(Septic Shock)指重症Sepsis,其低血压即使经充分液体复苏仍有灌注不足存在,即使用正性心肌收缩药或加压药后低血压纠正,则认为Septic Shock仍存在,不因血压回复而否定。故Septic Shock一词仅用于液体复苏无效的低血流灌注重症Sepsis,加压药应用即使血压回复,实际上休克并未逆转,仍有乳酸中毒、少尿或急性神志改变。
由上可见:MODS是SIRS持续性进行性加重的结果,而SIRS是导致MODS的共同通道。而腹腔感染则是腹部外科最重要Sepsis原因。感染、Sepsis和SIRS的关系见图7-1。
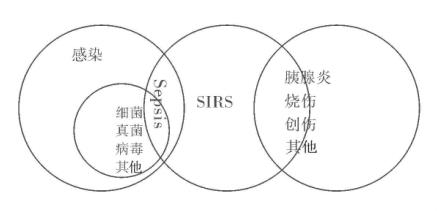
图7-1 感染、Sepsis和SIRS的关系
第二节 腹腔感染程度的评分
临床上对腹腔内感染出现MODS有要求作一客观的统一的危险性评估,这对治疗选择和疗效都很重要。20世纪80年代先后出现多种评分系统,如Teichmann的腹膜炎指数、Wacha的Mannheim腹膜炎评分和Hannover重症评分系统。这些都见于德国文献。在英文文献中有感染程度评分(SSS)和感染评分(SS)。但是迄今用于腹腔内感染上最受推崇的是急性生理学和以往健康评估Ⅱ系统(acute physiology and chronic health evaluateonⅡ,APACHEⅡ)。此种评分源自13个医院重症监护病房连续5030例的医院死亡率资料分析。此评分包括12个生理学指标,加上病人的年龄和以往健康状态两个因素。评分最高为71分。一般生存者的评分为9~15分,而死亡者则为19~25分。Bohnen认为此系统较适用于腹腔内感染手术病人,其评分可反映死亡率。对重症复合性创伤、各种危重急症、甚至择期大手术术前评价评估,则宜用APACHEⅢ评分。腹腔内感染和急性重症胰腺炎合并器官功能不全时应用APACHEⅡ最多且对其价值的认识亦已统一。笔者在临床中发现,评分因治疗过程不同而有不同,以手术治疗前评分最重要。如评分前24h内一些指标有几次测定值,则取最严重的一次计分。对重症感染,如重症胰腺炎病例,动态评分更为重要,因为术后纠正液体和电解质失衡和手术若能满意解决腹腔内感染,评分应该下降,如评分短暂下降后陡升,则说明手术并未有效控制感染,是再次手术时机的信号。
Bosscha等对感染性SIRS提出联合应用APACHEⅡ评分和Mannheim腹膜炎指数更可提高判断腹腔内感染性SIRS病人死亡的正确性。笔者临床多年应用APACHEⅡ评分和改良后Mannheim腹膜炎评分指导治疗腹膜炎的经验也证实此方法简单可行。
术前评估腹腔内感染的严重度的目的是指导治疗和判断治疗效果,手术是否及时和成功是最重要的预后因素。有时评分低者反而死亡,而评分高者得以痊愈,说明治疗不及时或不能解决腹腔内感染之故。
第三节 sepsis的诊断
SIRS是以全身炎症反应和广泛组织损伤为特征。其发病率呈现上升势头,在北美每年约有500 000病人受累,粗略估计死亡率为35%。sepsis发病率增高反映出一些重要的人口统计学和科学趋势。首先,sepsis多见于老年人,美国老年人口正在增长,到2026年,65岁以上人群将达到总人口的17%,其中以85岁以上人群增长比例最大。除了发生感染性SIRS的危险性较大以外,死于sepsis并发症的危险性也较大。第二,多见于对严重免疫疾病和恶性疾病的治疗产生了较多的免疫抑制人群。化疗和放疗使中性白细胞减少,环孢霉素或皮质类固醇治疗使T细胞功能不全,均使发生严重sepsis的可能性大大增加。毫无疑问,过去10年中AIDS成为另一个sepsis的易感高危群体。第三,医疗活动本身亦与我们面对的增高的感染发病率有关。过去25年人们对侵入性监测和治疗的依赖性增加,包括动脉导管、肺动脉导管、中心静脉导管、Foley导管等,多数均穿越解剖屏障,使病原菌能通过天然防线。抗生素的广泛使用使微生物增强耐药性,改变宿主的内源性菌群,有利于致病菌的繁殖和生长。
认识发生sepsis及其并发症的高危因素也很重要,有利于早期采取预防和治疗措施。本节讨论sepsis的诊断方法,包括最新定义和主要临床表现的病原学。
一、定义
sepsis是病人在不同程度感染时所表现的临床和实验室表现的症候群。sepsis、septic shock是感染性SIRS过程中的不同阶段。
二、诊断方法
1.病史 诊断的第一步是采集病史和物理学检查。此类病人的病史特征是具有增加感染的因素、抑制感染反应的因素和增加感染发病率和死亡率的因素。
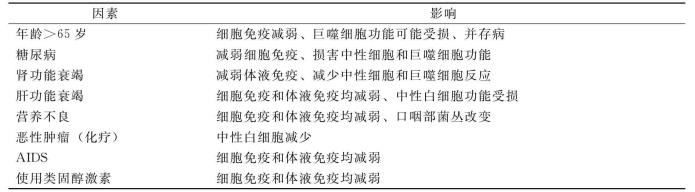
为防止病原微生物在人体内形成病灶,机体防御系统起着至关紧要的作用,许多因素可以影响宿主的主要防御屏障(表7-1)。皮肤黏膜完整性破坏、支气管纤毛功能不全、异物植入、尿道或胆道梗阻均可导致一定部位的感染灶形成。此时,宿主的第二道防线努力局限感染、清除进入血流的病原菌。许多因素不利于机体的第二道防线(表7-2),使宿主对可能导致脓毒症及其并发症的严重感染的易感性增加。某些免疫缺陷使宿主易感特异性感染,这方面病史有助于预先判断特异细菌感染,早期选择合适的抗菌药物。
表7-1 影响宿主第一防御感染屏障的因素

表7-2 影响宿主第二免疫防御机能的因素
2.体检 sepsis导致人体几乎所有器官系统的功能改变,有些因全身炎症反应中炎性介质的体液作用,有的因更广泛的血液动力学功能和代谢改变。sepsis的各种临床表现,包括后面描述的体征和实验检测异常发生频度不等,取决于宿主免疫机能、年龄、并存病、病原菌(表7-3)。
表7-3 Sepsis的临床表现

(1)发热或体温不升:是SIRS的定义特征,很清楚,感染引发全身炎症反应,巨噬细胞释放IL -1和TNF导致发热。部分病人体温不升原因不清,据认为与过度通气和周围血管扩张引起的呼吸道和体表散热有关,尤其是老年病人或已有产热障碍者(肌肉贫乏、神经肌肉疾病、使用抑制寒战的药物)发热或体温不升的确定最好使用肛温或其他体腔测温装置,因为口温在过度通气时可能产生误差。Le Gall等的一项研究对1130例重症脓毒症患者进行了分析,55%病例发热(>38℃),15%体温不升,30%体温正常。
(2)神志改变:sepsis患者可有不同程度意识混乱,从轻度精神混乱到谵妄、反射迟钝、昏迷。神志改变可继发于低血压或低氧血症,若这些指标正常而脑功能不全仍然存在且无其他原因者称为sepsis相关性脑病(sepsis-associated encephalopafhy)。后一种情形中,大脑半球功能紊乱在意识内容和程度方面的紊乱是明显标志,如有灶性神经异常则提示病原变化。sepsis相关脑病通常是完全可以逆转的。
(3)心血管系统:sepsis早期时由于动脉和静脉扩张、血浆漏到血管外间隙,发病时常合并低血容量症。SIRS最早时病人常有心动过速,脉压增大,皮肤温暖;常常对血容量扩充和血管活性药物有反应。静脉内积极输液纠正低血容量症,此时可导致全身血管张力下降、心排血量正常或升高、心动过速、肺动脉氧分压升高。这种高动力型休克综合征见于90%以上的严重sepsis病例中。此后可转为低排高阻性septic shock,是由于扩容不够,大量渗出至组织间隙、细胞外导致低血容量性休克。
(4)呼吸系统:呼吸急促几乎见于所有早期SIRS患者,常在低氧血症之前发生,与此相联的是过度通气和呼吸性碱中毒。过度通气的原因尚不清楚,据认为可能的机制为直接刺激呼吸中枢或肺感受器。SIRS时体温升高和分解代谢使二氧化碳增多,在肺储备减少的病例中可引起高碳酸性呼吸衰竭。sepsis早期动脉氧分压即降低,即引起过度通气。重症sepsis者较易发生急性肺损伤,常在24~72h内发生急性呼吸窘迫综合征(ARDS),出现难治性低氧血症、双肺弥漫性浸润改变,并可能出现低氧性呼吸衰竭。严重sepsis时ARDS发病率为6%~42%。
(5)肾:sepsis时少尿,尿量<0.5mL/(kg/h)很常见,其原因是有效血容量减少导致肾灌注下降。这种状况可经扩充血容量而得到纠正。若事先未用利尿剂或无潜在的肾脏疾病,肾前性少尿者尿钠浓度低,尿钠<20mEq/L、尿渗透压高(>450mOsm/kg)。重症sepsis不断加重、恶化,可发生肾功能衰竭,肌酐和血尿素氮升高、尿少且呈等渗、尿钠浓度升高,尽管血压、心肌灌注压和心排出量尚正常。应当放置导尿管、行肾超声或CT检查以排除尿路梗阻。非少尿型肾衰较少尿型容易处理、预后较好。
(6)胃肠道:sepsis时最常见的胃肠道问题是动力异常,包括胃张力缺乏、胃排空障碍或更广泛的小肠麻痹性梗阻。腹部手术、创伤后及有腹膜炎存在时这些表现更常见,可见于任何原因引起的脓毒症,特别是septic shock及继发的小肠缺血。血管通透性增加和低蛋白血症引起肠壁水肿,也可因麻醉性镇痛引起。
sepsis病人另一个潜在问题是继发于应激相关性黏膜病变(stress-related mucosal disease,SRMD)的出血,尤其是在MODS中更为常见,包括呼吸衰竭,肾衰、肝衰、心衰。大面积烧伤、中枢神经系统创伤、长时间机械通气、凝血机制异常均为危险因素。衰竭的器官越多,危险性越大。预防SRMD最重要的因素是维持胃黏膜血流。复苏迟缓或难治性休克引起黏膜缺血时间较长者胃肠道出血更常见。重症sepsis时低氧血症和酸中毒可导致更严重的组织缺血和胃黏膜屏障破坏。sepsis时胃腔常呈高酸状态,应及早采取治疗以降低胃内酸度,维持pH4.0以上。
(7)肝功能异常:常见于各种原因引起的严重SIRS,多表现为转氨酶轻到中度升高,高胆红素血症。这些异常继发于局灶性肝坏死和肝性胆汁淤积。大多数情形中肝功能相对得到保护,但在重症和难治性sepsis的病人可能发生不可逆的肝功能不全、低凝血酶原血症、黄疸、乳酸酸中毒、低血糖。后一种情况少有存活者。
(8)血液学:SIRS时白细胞增多是由于内源性儿茶酚胺诱导中性白细胞着边作用消失,加之细胞因子引起骨髓幼稚中性白细胞释放。IL-8在驱使白细胞到炎症局部方面具有重要的决定作用。sepsis引起粒细胞减少者大多预后不良,因为它意味着sepsis无法控制,骨髓失去了产生中性粒细胞的能力,而后者具有快速杀死细菌作用。
sepsis较晚时贫血相当多见,原因有多种。初起病时由于液体复苏治疗低血压引起血液稀释和血红蛋白浓度下降;稍后其他一些因素引起贫血,包括sepsis使红细胞生存期缩短、抽血检验、严重全身炎症导致造血功能受损。
重症sepsis时常有血小板减少,原因有骨髓产生血小板减少、循环中血小板寿命缩短、脾脏过多地摄取血小板。细菌引起的脓毒症中,血小板减少常因为血小板破坏增多、黏附于受伤的微血管内皮处和聚集在组织的毛细血管床中引起亚临床DIC。也可以发生弥漫性血管内凝血(DIC)是指血小板减少同时血栓形成和组织缺血、穿刺部位或伤口异常出血。DIC还以D-二聚体增加血纤维蛋白原、纤维蛋白降解产物增多为特征。sepsis时常有凝血酶原时间轻至中度延长,部分凝血活酶时间延长。单纯血小板减少较多见于sepsis,且在sepsis得到控制后多能迅速逆转。
(9)代谢和电解质紊乱:腹腔感染所致sepsis患者常相当快地发生低白蛋白血症,这是由于腹腔渗液中丧失和白蛋白重新分布进入到血管外间隙所致,肝脏蛋白合成白蛋白转向合成急性期C-反应蛋白。IL-1刺激骨骼肌蛋白质分解代谢以便为伤口愈合提供氨基酸的直接来源,同时也作为摄入不足时的能量来源。蛋白质分解代谢引起负氮平衡和机体肌肉组织的快速丢失。
内源性儿茶酚胺、糖皮质激素、胰高糖素增多使葡萄糖利用障碍,故sepsis时血糖增高很常见,特别是使用含糖液体时。相比之下低血糖症少得多,一旦发生表明肝功能不全的存在。sepsis中可见的电解质紊乱中最常见的急性电解质异常是低钾血症,钾排出增加和摄入不足。低钠血症也较常见,原因是抗利尿激素分泌异常,尤其是在因肺炎或中枢神经系统感染引起的sepsis中更是如此。20% sepsis病人出现低钙血症,常伴有低血压和死亡率升高如同其他重症一样,sepsis中可有低镁、低磷血症。
(10)其他:当病人出现全部或大部分症状和体征——发热、寒战、呼吸急促、心动过速、白细胞增多、低血压时,sepsis的诊断是很明显的。酒精中毒、糖尿病、老年、婴儿、尿毒症、肝硬化、淋巴瘤、白血病、白细胞减少、营养不良、糖皮质激素治疗等情形中,临床表现可以不典型,因而诊断很困难。这些病人可能不发热,有的甚至体温不升。过度通气和精神状态改变可能是此类患者SIRS仅有的早期表现,特别是在老年病人中,此时血气分析、Sp O2和少尿常最早提示病情严重性。检查处于免疫抑制状态患者或具有感染危险因素者时,医生应警觉任何临床变化,如过度通气、恶心、呕吐、神志改变、食欲减退、昏睡,以及预示sepsis发病的发热。
详细询问病史和体格检查常可获得感染灶的线索。腹痛和腹肌紧张提示腹膜炎可能,腰痛和频尿提示肾盂肾炎,脓痰及胸痛提示肺炎。运用这些有关感染来源的线索有助于确定感染源,提高疗效。
3.实验室检查 疑诊sepsis时应急查某些项目,若诊断不明,尚需进行其他检查(表7-4)。
表7-4 Sepsis的实验室检查及特检

4.鉴别诊断 SIRS可发生在许多非感染性疾病中,另外,感染既可引起组织损伤也可因组织损伤而发生,因而在一些病人中诊断sepsis有一定困难。
肺栓塞可以出现低血压、过度通气、低氧血症,偶有发热,可能与sepsis混淆。病史(栓塞危险性)、肺动脉高压和右心室超负荷的临床证据、外周血中无不成熟中性白细胞等有助于鉴别。某些时候需作通气灌注扫描、血管造影、双下肢超声波检查以助诊。
急性肾上腺功能不全可出现发热、低血压、高血液动力状态,需与sepsis鉴别。对接受过类固醇治疗或难治的低血压患者应检查其垂体-肾上腺轴功能,应行ACTH刺激可的松试验判断相对性肾上腺功能。若血清皮质醇上升幅度<9μg/dl,则宜及早使用低剂量皮质醇。
其他与sepsis表现相似的情况包括药物相关性发热,如恶性肿瘤发热,抗胆碱药或拟交感神经药引起的发热,过敏反应,变态反应等。由于缺血性损伤坏死、创伤、急性胰腺炎、烧伤所致的重症SIRS也可能有感染发生而与sepsis混淆。几种全身性血管炎包括系统性红斑狼疮的初起表现有时难以与sepsis鉴别,因为二者都表现为多器官损害。由于sepsis是上述多种疾病的常见并发症,在这种情况下可以经验给予抗生素预防和治疗直到排除感染。
三、诊断标准
1.全身性炎症反应综合征(SIRS) 全身性炎症反应综合征是各种重症感染性或非感染性炎症(如外伤、重症胰腺炎、烧伤等)所致的全身反应,诊断标准见表7-5。四项指标中具备≥2项即可诊断SIRS。
表7-5 SIRS的诊断标准

2.sepsis SIRS+感染=sepsis
3.重症sepsis(severe sepsis) 伴有器官功能障碍的sepsis,即重症sepsis,诊断标准包括:①心血管系统,收缩压<90mm Hg或下降幅度≥40mm Hg;②呼吸系统,PaO2<70mm Hg或PaO2/FiO2<300;③泌尿系统,每小时尿量<0.5m L/kg;④中枢神经系统,急性脑病或Glasgow昏迷评分下降≥2分。
4.sepsis syndrome sepsis syndrome指伴有器官灌注改变的sepsis,具有以下特征①低氧血症,PaO2/FiO2<300;②血乳酸增加;③少尿,尿量<0.5m L/kg至少1h;④精神改变。它包括来源不明的sepsis,金黄色葡萄球菌毒性休克综合征、链球菌毒性休克综合征和导管(血管)相关性sepsis4种。(https://www.daowen.com)
5.sepsis休克(septic shock) sepsis休克是severy sepsis的特殊形式,表现为顽固性低血压、器官灌注异常减少和MODS。足够的液体复苏难以纠正低血压,加压药虽可使血压回复,但休克仍存在。
四、sepsis的治疗
sepsis的治疗包括以下方面:①病源控制、去除感染灶如脓肿引流。②抗生素。③液体复苏。④给氧和呼吸支持。⑤肾替代治疗。⑥镇静止痛治疗。⑦营养支持治疗。⑧抗凝治疗。⑨小剂量激素替代疗法。〇10预防应激性溃疡及预防深静脉栓塞治疗等,现就目前治疗最新进展简单介绍:
1.早期达标治疗(early goal-directed therapy,EGDT) EGDT指一发现severe sepsis后6h内积极的复苏治疗。在severe sepsis或septic shock病例中EGDT是支持治疗的一个重要部分,对于维持细胞灌注和避免器官功能不全有重要作用。早期达标治疗的标准是指在入院早期(6h内)通过大量钠盐液体复苏(5 000m L)、多巴酚丁胺和血管加压素Vasopressin和输注RBC维持CVP 8~12mm Hg,MAP 65~90mm Hg,尿量>0.5m L/(kg·h)和中心静脉血氧饱和度ScvO2>70%。如果CVP<8mm Hg,可通过输注晶体或胶体液扩容;如果MAP<65或>90mm Hg,和ScvO2<70%时,则输红细胞并维持HCT≥30%,并给予多巴酚丁胺2.5μg/(kg·min),可增加多巴酚丁胺达20μg/(kg·min)直至ScvO2≥70%。这就意味着在急诊室中就必须进行,不能等待进入ICU后才开始。
2.活化蛋白C(drotrecogin alfa) 大量的研究已经发现在sepsis病例有血清活化蛋白C降低,而活化蛋白C低水平又与高死亡率相关。人体重组活化蛋白C,既是一种抗凝剂,又是一种具有抗炎作用的药物已被证明在治疗sepsis上有重要作用,它可减少19.4%的相对死亡率和6.1%的绝对死亡率,其机制是抗炎作用和促使纤维蛋白元活化和微循环毛细血管中凝血复溶而使灌注通畅。有出血倾向的患者应慎用。
推荐在severe sepsis或septic shock成人病例和有高危死亡风险病例中使用。其用法为:活化蛋白C 24μg/(kg·h)连续输注96h,但应在术前1h前停止,如术后没有出血并发症,可在12h后继续。
3.严格控制血糖 高糖血症在ICU病人常可见到,是一种正常的机体反应,目的是为了保持脑组织、红细胞、伤口愈合有充足的葡萄糖供应,但当血糖过高,则影响患者恢复,甚至有较高的死亡率。目前重症sepsis应采用胰岛素注射严格控制血糖水平来降低危重病例的死亡率,通常的方法为,当血糖≥110mg/d L(≥6.1mmol/L),输注胰岛素维持正常血糖水平(80~110mg/d L,4.4~6.1mmol/L)。但胰岛素量不超过50IU/d。
胰岛素剂量应动态调整,依据每1~4h1次测定的动脉血糖,并按血糖改变调整用量(如血糖降低50%,则下1h胰岛素剂量减少50%)。具体方法见表7-6。
表7-6 调整胰岛素用量方法

第四节 多器官功能不全综合征(MODS)
一、MODS的病因
人们初识MOF时,发现MOF总是与重症腹腔内感染相关联。当时多见的是重症腹膜炎、急性呼衰和肾衰,被称为“死亡三联征”。此后人们逐渐认识到,严重创伤、大面积烧伤、急性胰腺炎等虽无感染,却同样可以发生MOF。
MODS往往是多种因素综合作用的结果(表7-7),这些因素是导致MODS的根本原因。
表7-7 MODS的病因

1.复苏不足
(1)原发性MODS:重症暴发性胰腺炎和严重腹部损伤、剧痛和巨大创伤发生深度休克,如病人就诊太迟、液体复苏不及时或复苏不足就可以发生原发性MODS。反之,及时、足够的复苏可有效预防原发性MODS的发生。
(2)继发性MODS:腹部严重创伤经复苏手术后或腹部严重感染手术后未能清除病灶,则病人必然导致Severe Sepsis,最终发生继发性MODS。
2.持续性感染 感染是导致持续性SIRS的最常见原因,也是继发性MODS的最常见原因。腹部外科急症手术后的持续性感染主要包括腹腔内残余感染和医院获得性感染。
(1)腹腔内感染:腹部外科急诊手术后发热或不明原因的感染,应首先考虑腹腔内感染可能。如能用B超或CT检查确定腹腔内局限性感染灶,不要心存侥幸,寄希望于用大剂量广谱抗生素,而应该及时穿刺抽吸或手术引流。因为,腹腔局限性感染灶内往往存在未被发现感染灶或感染辅助物如缝线异物、血液、胆汁和坏死组织等,外科治疗不仅可消除感染灶,还可清除这些感染辅助物。只有这样,才能恢复宿主的局部免疫力,抗生素才可发挥作用。抗生素不能代替外科治疗。
(2)医院获得性感染(表7-8):最常见的院内感染是肺炎,危险因素包括误吸、非显性误吸、鼻胃管引流、机械通气大于3d(呼吸机相关性肺炎)、伴随有慢性阻塞性肺病、糖尿病、营养不良和用肾上腺皮质激素。除了消除上述危险因素以外,营养支持也可减少医院获得性感染的发生,但以空肠内营养支持为首选,其次是添加谷氨酰胺的胃肠外营养支持。
表7-8 常见院内感染

二、MODS的诊断标准
过去,关于MOF的判断标准各家报告不同。随着MODS概念的提出,ACCP和SCCM认为根据目前资料仍不能统一其诊断标准。不仅如此,MODS包括哪些器官和系统各家报告也不相同。
此外,MODS是逐个器官发生的、进行性的器官功能不全,器官功能可能恶化,但也有逆转可能。因此,连续动态监测各器官功能的变化及其对治疗的反应比单次测定更为必要(表7-9和表7-10)。胃肠道功能不全包括出血性胃炎、肠梗阻、胰腺炎、急性无结石性胆囊炎和肠道黏膜萎缩致细菌移位,目前尚无分级诊断标准。
表7-9 MODS的诊断标准
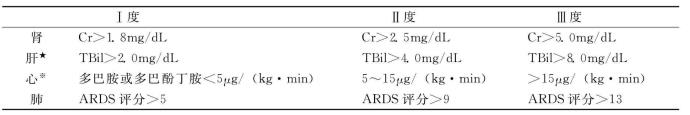
★肝功能:指非阻塞性黄疸;※心功能:指CI<2.2L/(min·m2)时需用正性心力药物支持。
表7-10 ARDS评分标准
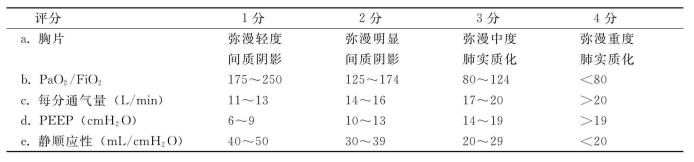
注:ARDS评分=a+b+c+d+e.
三、MODS的治疗
积极预防和积极治疗各种可以引起MODS的病因,如严重持续性感染、内脏灌注不足、低氧血症、组织缺氧等,是治疗MODS的关键。如何阻断细胞因子连锁反应和宿主过度的炎性反应,是今后有希望的研究方向。下面仅对急性肾功能不全和ARDS处理中现在施行的方法进行简单介绍。
1.急性肾功衰的每日透析治疗 当出现容量超负荷引起左心衰、代酸、高钾血症和少尿时需立即透析治疗。血液透析效率高,尤其在severe sepsis病例。血液透析在肾功能部分恢复后就可停止,肾功能部分恢复指尿量的恢复、左心衰和容量超负荷、代酸和高钾血症恢复。
肾替代法用于治疗重症急性肾功能衰竭仍有较高的死亡率,其原因是此类患者除有导致肾功能衰竭的基础病外,往往伴有MODS和Severe Sepsis,且肾功衰也使严重肾外并发症危险加重。虽然对血液透析的剂量与并发症发生率和死亡率呈负相关的结论已达成共识,但对于急性肾功衰采用间断透析或每日透析意见不一。近年Ronco等的前瞻性大规模研究发现每日透析可降低急性肾功衰死亡率并减少尿毒症的发生。同样Helmut的研究证实每日透析除能降低急性肾功衰的致命性肾外并发症的危险外,对促进肾功能恢复、减少血液透析中低血压等并发症也较间断透析为优。故目前对某些术后出现急性肾功衰或尿毒症症状者推荐每日透析,并以将BUN维持在100mg/d L以下为理想水平。
2.保护性通气——ARDS治疗的进步 ARDS时使用PEEP通气模式的主要原因是肺泡的张开和闭合是造成肺泡通气障碍和肺泡损伤的主要原因。2026年欧洲和美国ARDS会议将ARDS定义简化为四点:①急性发病。②无论是否使用PEEP,PaO2/FiO2≤200mm Hg。③胸片显示两侧浸润影和肺水肿。④临床上无左房高压体征或肺动脉楔压≤18mm Hg。
ARDS有缺氧都需机械通气辅助气体交换,30年来ARDS应用呼吸机PEEP模式支持治疗死亡率持久不减,直至最近两年才使死亡率下降25%。近15年来更认识到ARDS时肺总通气容量减少,可以减少>50%总量。传统的ARDS使用机械通气时潮气量通常为10~15m L/kg,是平均潮气量的2倍,目的是需要增加通气率,维持肺泡通气量,以保持正常PaCO2值。但通气率上升至25~30/min时,已无足够时间使呼气完全排出,可造成自发性PEEP(auto-PEEP)。其结果是使气道压力升高,使能通气的肺泡过度扩张引起损伤,即容量伤(volutrauma)。因此美ARDS network trial开始一项多中心临床RCT研究ARDS呼吸支持,最终解决了近10年来争论的用小潮气量的PEEP通气问题。现在,对ARDS患者,用小潮气量通气(保护性通气),即将潮气量限制在6m L/kg(理想体重)。保护性通气并不能治疗ARDS,仅仅是减少传统通气支持中人为的因素对肺实质的损伤。保护性通气方案应该成为ARDS应用PEEP时现行规范方案。
保护性通气的内容主要包括:小潮气量(V T)和允许高碳酸血症、限压通气、吸/呼比率调整、最佳PEEP 5~10cm H 2 O、俯卧通气(prone ventilation)(见表7-11)。
其中小潮气量(V T)是指将潮气量限制在6m L/kg,首先根据理想体重,推算潮气量(VT),如果平台压大于30cm H 2 O,降低V T至5m L/kg或4m L/kg,允许提高V T至7m L/kg或8m L/kg,只要维持平台压小于30cm H 2 O而以16cm H 2 O为理想。而允许高碳酸血症指无代酸或颅内高压情况下,肺泡通气量不足,使PaCO2上升达55cm H 2 O,必需限制频率,以不产生Auto-PEEP为度。大量报告证明一定条件下PaCO2升高能耐受,仍能改善生存率。但闭合性颅脑损伤或颅内压增高病例和代谢性酸中毒时不能允许应用。前者可使颅内压进一步升高。pH值以7.2为限,否则仍需提高VT和输注Na HCO3。
表7-11 保护性通气方案

ARDS都用容量循环呼吸机支持通气,可以提供通气量保证和限压通气,需床边观察并调整呼吸机和监测每分通气量。有研究比较压力循环和容量循环呼吸机治疗低氧血症,限压组72h后肺顺应性改善,而容量循环呼吸机组肺顺应性下降;限压组拔管较早,死亡率低于容量控制组,因此提倡限压通气。
为了减少气道压力,另一方法是吸/呼比率反转通气。自然呼吸有正常通气道时,吸/呼比率(I/E率)为1∶2;机械通气时I/E率由预定VT流速控制吸气时间后得I/E率,气流速慢则在定量V T下吸入时间长,吸入时间长则呼气时间短。故吸/呼时间比率变化在一定V T时与呼吸频率有关。I/E反转可能有两种益处:①潮气量吸入慢则气道压力较低,吸入峰压(PIP)下降;②吸入时间长可能改善氧合。但是造成气压伤是平均气道压力而非PIP,I/E为2∶1通气使平均气道压力上升,可引起气压伤。有报告ARDS时,当I/E为2∶1时平均气道压力为27cm H 2 O,3∶1时为31cm H 2 O,1∶2时为22cm H 2 O,而I/E反转时氧合并无改善。I/E≥1.5∶1时是有害的。也应该注意用IMV时当通气率快大于25/min时就可能出现I/E反转通气和Auto-PEEP可能。因此I/E比率仍以1∶1为好。I/E反转时不良反应有:①病人耐受差,当I/E为>1.5∶1时必需应用肌松剂和镇静剂;②吸入时间长,呼出时间缩短,在通气率高时就产生Auto-PEEP。实际上I/E达2∶1时不可避免产生Auto-PEEP。
30年来PEEP一直是ARDS机械通气中主要措施。PEEP能改善氧合,由于可减少肺内分流和死腔气通气,故常能使FiO2下降。近年来提出最佳PEEP是为了防止气道剪力伤,主要是在应用小潮气量通气时。最佳PEEP目的是既兼顾氧合和肺通气工作,又防止肺通气引起损伤。
近年来用胸部CT扫描研究ARDS病例重新重视体位改变对通气效果的影响。CT扫描研究显示ARDS病人仰卧位时肺存在重力相关肺容量丧失,即V/Q失衡,俯卧位使肺通气区V/Q比率改善,表现氧合好转可占2/3病例。而俯卧位时颜脸部水肿多有发生,清醒病人应该用镇静药和肌松剂,俯卧位后30min到2h内PaO2/FiO2值即有上升。Jolliet报告用12h俯卧位,然后30min仰卧位,交替进行。但实验室资料证明不需如此频繁更改体位,故以12~24h俯卧位后再仰卧30~60min为实用。
(张应天)
参 考 文 献
1 Angela S,Frederick A,Moore EE,et al.Early risk factors for postinjury multiple organ failure.World J Surg,1996,20∶392
2 Avery BN,John CM.Sepsis,SIRS,and MODS:What's in a name?World J Surg,1996,20:
3 Goris R J A.MODS/SIRS:Results of an overwhelming inflammatory response?World J Surg,1996,20:418
4 Roger C B,William J S,Charles L S.The ACCP-SCCM consensus conference on sepsis and organ failure.Chest,1992,101:1481386
5 Roger C B,Robert A B,Frank B C,et al.Definition for sepsis and organ failure and guidline for the use of innovative therapies in sepsis.Chest,1992,101:1644
6 Bosscha K,Reijnders K,Hulstaert P F,et al.Prognostic scoring system to predict outcome in peritonitiss and intra-abdominall sepsis.Br J Surg,1997,213:130-6
7 Zimmerman J E,Kraus W A.Sun XL,et al.Severity sbatification and outcome prediction for multisystem organ failure.World J Surg,1996,20:401
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







