第四章 腹部外科营养支持
第一节 营养支持的过去与未来
一、营养支持的过去
营养支持是基础与临床医学近30多年来重要的进展之一。
通过静脉途径提供病人所需的全部营养物质(氨基酸、脂肪、碳水化合物、电解质、维生素和微量元素),称全胃肠外营养或全静脉内营养(total parenteral nutrition,TPN;total intravenous nutrition,TVN);将病人所需全部营养物质经胃肠道途径提供者,称全胃肠内营养(total enteral nutrition,TEN)。经胃肠外或胃肠内补充病人所需的部分营养物质,则称部分胃肠外营养(partial parenteral nutrition,PPN)或部分胃肠内营养(partial enteral nutrition,PEN)。
营养支持基础理论与应用技术的日趋完善,很多学者作出了贡献:Robert Elman(2026年)首次静脉输入酪蛋白水解物。Alfred Shohl(2026年)应用结晶氨基酸静脉注射。Robert Aubaniat(2026年)报告应用穿刺锁骨下静脉置管的经验。Francis Moore(2026年)提出非蛋白热卡(Kcal)与氮(克)的比为150∶1。Arvid Wretlind(2026年)用大豆油制成脂肪乳剂。Stanley Dudrick和Donglas Wilmore(2026年)提出“静脉高营养”(intravenous hyperalimantation)概念。Randall(2026年)将为太空人所设计的要素饮食(elemental diet)用于临床肠内营养。Belding H.Scribner等(2026年)倡导人工胃肠(artificial gut),即家庭肠外营养。David H.Elwyn等(2026年)探讨机体应激状态时燃料的需要量。Cerra(2026年)根据应激状态特点,提出了“代谢支持”(metabolic support)概念,为危重病人营养支持奠定了重要理论基础。
随着对饥饿状态和应激状态代谢特征和营养治疗临床应用的广泛研究,当今已从Dudrick所提出的“静脉高营养”概念转变为“营养支持”和“代谢支持”的概念,并认识到营养过度和营养不足对病人同样是有害的。
不少学者已注意到,根据“代谢支持”概念提供营养,虽能改善负氮平衡,但不能改变应激的高代谢、高分解代谢状态,不能阻止自身蛋白丢失,进而提出了代谢调理(metabolic intervention)理论,即设想应用药物或生物制剂,改变机体对应激的神经、内分泌反应,调理体内代谢反应,降低分解代谢,与营养支持协同作用,进一步降低体内蛋白分解。
二、营养支持的未来
对于“饥饿状态”病理生理的认识及其营养支持的应用原则已趋成熟,且效果肯定。对“应激状态”病人的营养支持,随着其临床的广泛应用(主要是肠外营养支持),以及实验与临床研究的不断深入,对于一些问题的认识取得了新的进展。归纳起来,“应激状态”的营养支持,未来主要有下列发展倾向。
(一)只要胃肠道有功能,就应首选肠内营养
自20世纪80年代以后,施行肠外营养的病人几乎呈指数增长,随着其临床广泛应用,长期肠外营养所带来的问题已引起极大关注,如导管败血症,代谢并发症,肠屏障功能受损、细菌移位、肠源性感染率增高,以及费用昂贵等。一些大宗、随机、前赡性研究表明,危重病人施行肠外营养并未能减少并发症发生率与病死率,这促使我们冷静思考及对其重新作出评价。基于肠内营养的优越性,从临床治疗角度,根据肠道功能状况,依次或联合应用肠外和肠内营养,即所谓“胃肠外、胃肠内阶段性营养支持”,将是今后主要的营养支持方式,其基本原则是在肠道衰竭或因基础疾病肠道需要“休息”时,施行肠外营养,一旦肠道恢复功能或允许解除“休息”状态,则逐渐由肠外营养过渡为肠内营养。
强调肠内营养主要基于:①肠内营养利于胃肠黏膜接受食物(或肠内营养制剂)的刺激,预防黏膜萎缩;②肠内营养利于价廉地提供谷氨酰胺,谷氨酰胺是肠黏膜重要的能源;③通过肠内营养,可补充外源性益生菌(如国产的双歧杆菌活菌制剂)及益生源(如含膳食纤维的肠内营养制剂)。然而,施行肠内营养的核心是胃肠道必须有功能,过分依赖肠外营养,固然是不完善的,而忽视肠道功能,片面地强调所谓“早期”肠内营养也是不可取的。
(二)应激病人施行营养支持,倾向于低热卡供能
创伤、外科手术后或其他应激状态的危重病人,其代谢特征是高代谢、高分解代谢,能量消耗大。按传统原则,能量消耗多少,就应供能多少,即“按耗供能”。具体作法是,据Harris-Benedict公式计算出基础能量消耗再乘以校正系数(或称应激系数),或按30~35kcal/(kg·d)提供能量。然而:①由于应激病人神经、内分泌反应所引起的代谢紊乱,尽管能量消耗大,但即使提供高能量并不能被机体充分利用。②为改变应激病人神经、内分泌反应及代谢紊乱所提出的“代谢调理”,理论上是合理的,但临床疗效甚微。③肠外营养的许多代谢并发症,均与提供高能量有关,如高血糖等。④随着肠内营养日趋受到重视,对多数病人来说,肠外营养实为整个营养支持过程的过渡阶段,机体所储备的脂肪在短期内可满足部分(约25%~30%)能量消耗。有学者以循证医学的方法进行研究,证实应激状态病人按低热卡供能,有利于控制血糖,减少感染并发症,缩短住院时间。
(三)免疫增强型营养物质的应用将受到重视
过去,营养支持着重于三大营养基质(糖、脂肪、蛋白质)、电解质、维生素及微量元素的补充,然而,对于应激状态的危重病人来说,维护免疫功能,减少感染并发症,对于提高生存率至关重要。谷氨酰胺、精氨酸、膳食纤维及ω-3多不饱和脂肪酸等特殊营养物质,有助于维护机体的免疫功能,称之为“免疫增强型营养物质”。谷氨酰胺是其中研究最多、最受到重视的物质,完全肠外营养超过5~7d就应给予补充,其静脉滴注制剂是“力太”(Dipeptiven),系丙氨酰-谷氨酰胺二肽,在溶液中稳定;国内亦有供口服的谷氨酰胺制剂,如谷参肠胺。含ω-3多不饱和脂肪酸的脂肪乳剂是Omegaven,ω-3多不饱和脂肪酸是由深海鱼油提炼制成,目前应用尚不广泛。国内已有含一种或多种免疫增强型营养物质的肠内营养制剂,如能全力等。
(四)合理联合应用生长激素和生长抑素
生长激素(GH)具有促进机体合成代谢,促进蛋白合成,刺激多种组织细胞分化、增殖的功能。GH可直接作用于GH受体发挥生物效应,或刺激某种组织合成胰岛素样生长因子I(IGF-I)而发挥生物效应。胃肠道黏膜富含IGF-I受体。应激及危重病人,外周血GH及IGF-I水平下降,补充外源性GH有助于减轻分解代谢,矫正负氮平衡,促进肠黏膜细胞再生及肠相关淋巴结增殖,改善免疫功能,减少肠道细菌和毒素移位,降低感染并发症发生率。目前临床应用的是重组人生长激素(rhGH),是由遗传工程哺乳动物细胞产生的生物制剂,价格较贵,仅供重症应激病人进行营养支持时联合应用。
生长抑素具有抑制内、外分泌,抑制消化液分泌,以及减少腹腔内脏血流等作用,腹部外科应用广泛。最典型的例子是重症胰腺炎、小肠瘘及短肠综合征,在对这些疾病进行营养支持时,联合应用生长抑素有助于胰腺炎症消退及减少消化液丢失(肠瘘及短肠综合征),一旦这些疾病基本稳定,则应逐渐减少生长抑素用量,改用生长激素,促进胰腺炎症损伤后的修复,肠瘘闭合及短肠综合征的残肠代偿。生长抑素的人工合成制剂有奥曲肽(octreotide,八肽)及思他宁(stilamin,14肽)。
第二节 能量、营养基质及其代谢
一、能量
能量是维持人体生命活动最基本的条件。
进食和营养支持所提供的能量,是用于:①维持基础代谢的能量消耗,此称基础能量消耗(basal energy expenditure,BEE),50%基础能量消耗用于离子泵工作,30%用于蛋白质的合成,20%用于氨基酸、乳酸、葡萄糖及丙酮酸盐等中间代谢产物的再循环。②进食(和肠外营养)后引起代谢率增高所额外消耗的能量——特殊动力作用(specific dynamic action,SDA)。所谓静息能量消耗(resting energy expenditure,REE),是指BEE与SDA的总和。③体力活动的能量消耗,如肌肉活动。④应激因素所增加的能量消耗。
机体的总能量消耗(total energy expenditure,TEE),是指BEE、SDA、体力活动以及由于创伤、手术、脓毒症等所引起应激因素消耗能量的总和。
TPN时供能的基质是葡萄糖和脂肪乳剂。仅由葡萄糖供能者称“单能源系统”,由二者共同供能的称“双重能源系统”,其供能热卡的总和称“非蛋白热卡”。
营养支持所提供的能量与氮平衡关系密切。供能不足,能量负平衡,则不可能获得氮平衡,因为此时营养支持所提供的氨基酸将被作为能源消耗。理想的是应提供“合适的能量”,即所提供的能量既能保存机体蛋白,又要防止因供能过多而导致代谢并发症。应激状态的“合适的能量”,是指所提供的能量使机体负氮平衡值达到最低限度。
二、营养基质(substances)及其代谢
这里主要介绍葡萄糖、脂肪及氨基酸三大营养基质及其基本代谢。
(一)葡萄糖
葡萄糖是重要而必需的供能基质。
1.葡萄糖的氧化与供能 葡萄糖在体内以有氧氧化及无氧分解2种方式供能。前者在供氧充足时进行,释放大量能量,是葡萄糖供能的主要方式;后者在缺氧情况下进行,又称糖酵解,仅释放少量能量。
具体地说,静脉输注(或消化吸收)的葡萄糖,进入细胞后,在细胞质进行一系列的酶促反应,产生丙酮酸,在氧供应充足时,丙酮酸进入线粒体,氧化脱羧生成乙酰辅酶A(乙酰COA),后者进入三羧循环,氧化生成CO2和H 2 O,同时释放大量能量;在缺氧情况下,丙酮酸还原成乳酸,释放少量能量。
葡萄糖→丙酮酸
1mol葡萄糖经糖酵解(无氧分解)仅生成2mol ATP,而经有氧氧化,1mol葡萄糖则生成38mol ATP。从这一角度,也说明TPN为什么要在病人呼吸、循环功能等全身状况稳定后才开始施行的理由。
2.糖异生 是糖酵解的中间产物或其他能转变为此中间产物的物质(如丙氨酸、乳酸,甘油),转变为葡萄糖的过程。糖异生是糖酵解的逆反应。鉴于只有肝脏存在催化糖酵解逆反应的全部酶类,故糖异生只在肝脏进行。
3.葡萄糖乳酸循环(Cori循环) 是糖酵解产生的乳酸经血循运至肝脏,合成葡萄糖,新合成的葡萄糖经血循运至全身供组织利用的过程。
4.糖原 是葡萄糖在肝细胞与肌细胞内的储存形式。肝糖原的合成分解对血糖水平有调节作用。
(二)脂肪
脂肪(即甘油三酯)是另一重要的供能基质,又是细胞结构主要成分之一,特别是细胞的膜结构的重要成分。提供脂肪的营养制剂是脂肪乳剂(简称脂乳)。
1.脂乳在体内的运转 静脉输注的脂乳与肠道所吸收的乳糜微粒的运转过程相同:①脂乳微粒流经各组织时,毛细血管内皮细胞释放的脂蛋白脂酶(LPL),将其中的甘油三酯(TG)水解成甘油和脂肪酸供组织利用,或进入脂肪组织再合成甘油三酯而储存。②流经肝脏的脂乳微粒,通过分解、转化、合成,最后形成极低密度脂蛋白(VLDL),释放入血后至各组织,经LPL作用释放出脂肪酸,供组织利用,或再合成甘油三酯储存脂库。(图4-1)
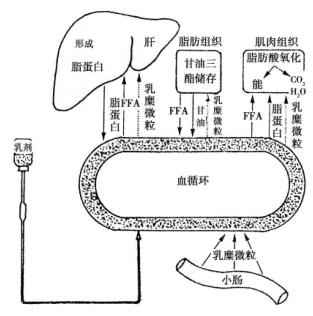
图4-1 体内脂肪的运送与利用
2.脂肪酸的氧化 甘油三酯被LPL分解所形成的游离脂肪酸(FFA),由血浆进入细胞内,先在细胞质活化成脂酰辅酶A(脂酰-SCo A)。中、短链脂肪酸活化所形成的脂酰——SCo A可自由进入线粒体进行β氧化,而长链脂肪酸活化所形成的脂酰——SCo A则需依赖肉毒碱载运至线粒体内再进行β氧化。经β氧化生成的乙酰辅酶A,进入三羧循环,彻底氧化成CO2和H 2 O,同时释放出能量。极少量的乙酰辅酶A可转变为酮体。
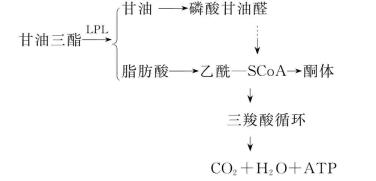
3.脂动员 当血糖浓度降低及糖利用障碍时,机体由以葡萄糖供能转变为以脂肪供能,储存在脂肪组织的甘油三酯分解为甘油与脂肪酸,供组织氧化利用,称脂动员。
4.酮体的生成与利用 脂肪酸在肝脏氧化,产生乙酰乙酸及β-羧丁酸,后者经脱羟又生成丙酮,此3种物质总称为酮体。因肝脏富含合成酮体的全套酶系,且活性很强,故血内酮体几乎全部来自肝脏,但肝脏氧化酮体的酶活性很弱;相反,肝外组织(如心肌、脑组织、骨骼肌等)合成酮体的酶活性很弱,不能合成酮体,而氧化酮体的酶活性很强,可分解利用酮体。
脂肪动员时,肝脏生成酮体量增多,从而在葡萄糖供能不足的情况下,心、脑、肌肉等组织由酮体的氧化可获得能量。但如酮体产生过多,超过了肝外组织的利用限度,则会发生酮血症,导致酸中毒。
5.脂肪乳剂 脂肪由脂肪酸与甘油构成。脂肪酸按其分子中碳链的长短分为:长链脂肪酸(LCFA,C14-24);中链脂肪酸(MCFA,C6-12);短链脂肪酸(SCFA,C2-4)。按脂肪酸分子中碳原子连接的方式分为:饱和脂肪酸,碳原子之间由单链连接;单不饱和脂肪酸,碳原子之间存在一个双链连接;多不饱和脂肪酸(PUFA),碳原子之间存在多个双链连接,最重要的多不饱和脂肪酸是必需脂肪酸(EFA)。
目前临床肠外营养支持所用的脂乳,主要有两种:由长链脂肪酸构成的长链甘油三酯(LCT)及由中链脂肪酸构成的中链甘油三酯(MCT)。
(1)长链甘油三酯(LCT):其常用制剂是10%、20%及30%三种浓度的Intralipid。10% Intralipid500 m L可提供能量550kcaI。
LCT具有下列特点:①含人体不能合成的必需脂肪酸(EFA)、亚油酸和亚麻酸,亚油酸在体内又进一步衍生为花生四烯酸,它们对维持生物膜结构与功能的完整性以及合成十二烷类(eicosanoids)物质至关重要,每周应用2次10% Intralipid 500m L,可避免EFA缺乏。②其水解生成物LCFA进入线粒体氧化需肉毒碱作辅助因子,应激状态肉毒碱内源性合成不足,故中-重度肝功能受损、重度应激状态,LCT的应用需减量[≤1~2g/(kg·d)]。③LCT对免疫功能的影响尚有争议。体外实验发现,LCT可抑制嗜中性白细胞的趋向和游走,封闭网状内皮系统的功能及损害补体的合成,但有关损害机体免疫功能的临床报告甚少。相反,随着机体营养状况的改善,原来较低的免疫功能逐渐改善。④正常成人最大的清除率为4.0g/(kg·d)。
(2)中链甘油三酯(MCT):含MCT的常用制剂是10%、20% Lipofundin MCT/LCT和力能MCT(Lipovenoes MCT)均是中、长链混合脂乳制剂。
MCT的特点是:①不含必需脂肪酸。②能较快地从血液中清除,脂蛋白脂酶(LPL)和肝脂酶(HL)水解MCT的最大速率分别是水解LCT的2.2倍和1.2倍。③水解生成的MCFA进入线粒体无需肉毒碱的参与,能较快地被氧化供能,因此更适用于应激及肝功能不良的病人。④对机体免疫功能影响较少。⑤MCT的生酮作用限制了其在糖尿病和酸中毒患者的应用。
6.双重能源系统的优点 葡萄糖与脂肪构成的双重能源系统的优点:①含LCT的脂乳可提供必需脂肪酸(亚油酸、亚麻酸)。②脂乳单位容量能提供较多热卡,避免输液容量负荷过重。③脂乳可作为脂溶性维生素载体。④较葡萄糖单一能源系统具有更佳节氮效应。⑤能避免单一能源系统所引起的高血糖、高糖高渗性非酮性昏迷、CO2产生过多(加重呼吸负担,甚至诱发ARDS)及肝脂肪浸润等缺点。
(三)氨基酸
1.氨基酸的分类
(1)根据转运特征分为:中性氨基酸(12种),包括甘氨酸、丙氨酸、羧基氨基酸(丝氨酸、苏氨酸)、支链氨基酸(缬氨酸、亮氨基、异亮氨酸)、含硫氨基酸(蛋氨酸、半胱氨基酸)和芳香族氨基酸(苯丙氨酸、酪氨酸、色氨酸)。碱性氨基酸(3种),即精氨酸、赖氨酸、组氨酸。酸性氨基酸(2种),包括天门冬氨酸、谷氨酸。
(2)必需、半必需及非必需氨基酸:人体蛋白由20种氨基酸组成,包括:①8种必需氨基酸(EAA):异亮氨酸、亮氨酸、赖氨酸、蛋氨酸、苏氨酸、色氨酸、缬氨酸、苯丙氨酸等,人体不能合成,必需外界供应。②2种半必需氨基酸:即精氨酸和组氨酸,人体虽能合成,但合成量不能满足需要。③10种非必需氨基酸(NEAA):酪氨酸、丙氨酸、甘氨酸、脯氨酸、谷氨酸、天门冬氨酸、丝氨酸等。
所谓必需与非必需氨基酸,是指机体内能否合成而言,而不是指营养的价值而言。就体内代谢而言,所有氨基酸都是必需的。非必需氨基酸对机体的重要性并不亚于必需氨基酸。摄入或提供外源性非必需氨基酸,机体则可不必通过必需氨基酸的转化而获得,可减轻必需氨基酸的需要量。此外,某些非必需氨基酸具有特殊生理功能。
2.氨基酸的代谢 胃肠道摄入蛋白被分解吸收的氨基酸,或肠外输注的氨基酸,在体内有3个去向:①合成自身蛋白质。②合成具有生理活性的物质(如激素、酶、抗体)及非蛋白含氮物质(如嘌呤、嘧啶、胆碱……等)。③分解、氧化释放能量为机体供能。营养支持所提供的氨基酸,其目的主要是用于合成自身蛋白,满足组织、细胞更新及合成生理活性物质的需要,但当能量(非蛋白热卡)提供不足,所提供的氨基酸则不能用于合成蛋白,而作为分解、氧化供能,从而导致负氮平衡。
不同氨基酸的分解、代谢各有其自身规律,但总的说来,主要有3个通路:①氨基酸的氨基通过转氨基或脱氨基作用,脱下的氨基通过鸟氨酸循环生成尿素排出体外。②氨基酸碳链的氧化:一部分氧化形成乙酰辅酶A,进入三羧循环,一部分形成三羧循环内的中间产物,然后进入三羧循环,最终氧化分解;③氨基酸通过脱羧基作用而释放出CO2。
3.骨骼肌的氨基酸代谢 骨骼肌是机体内体积最大的组织,骨骼肌的氨基酸代谢对整个机体的蛋白质代谢具有重要意义。
大部分必需氨基酸在肝内分解,而支链氨基酸(branched chain amino acid,BCAA)则主要在骨骼肌分解、氧化、供能;在骨骼肌,BCAA的氨基团与丙酮酸及谷氨酸盐结合成丙氨酸及谷氨酰胺,它们分别被运送至肝(糖异生的原料)及肠(谷氨酰胺是肠道的主要能源);BCAA中的亮氨酸具有抑制肌蛋白的降解、促进肌蛋白合成的作用。
3-甲组氨酸(3-MH)是肌蛋白的分解产物,测定血清3-MH含量可作为肌蛋白分解程度的指标。
4.肠外营养的氨基酸制剂
(1)营养型氨基酸制剂:营养型氨基酸的模式,应符合下列要求:①含8种EAA、2种半必需氨基酸及若干种(6种以上)NEAA,即其模式近于人体蛋白组成(平衡氨基酸液),NEAA的补充有助于EAA的利用。②EAA/NEAA=1∶1~1∶3,EAA/TAA=1∶3~1∶4.7(TAA:总氨基酸量);③含氮浓度较高,以免输液容量过大;④含有一定浓度的支链氨基酸(BCAA):异亮氨酸、亮氨酸和缬氨酸。
7% Vamin(华瑞公司)、10%氨复命18-F(天津氨基酸公司)、8.5% 14-氨基酸823(上海长征药厂)和8.5%氨复命14S(天津和平药厂)等均属营养型氨基酸制剂。7% Vamin 1 000m L含9.4g氮。
(2)特殊氨基酸制剂:用于特殊疾病的营养支持,如严重应激状态用的高支链氨基酸制剂,肝病用的氨基酸制剂,肾病用的氨基酸制剂等(参阅本章以下各节)。
三、糖、脂肪及蛋白质代谢之间的联系
三种营养基质在体内的代谢并不是孤立的,而是相互关联的。①3种营养基质在代谢过程中可以互相转变:如糖代谢和脂肪代谢的中间产物可转变为某些氨基酸,氨基酸也可转变为糖和脂肪,糖和脂肪可相互转变。②3种基质在代谢上相互影响:如糖、脂肪供不足,影响蛋白合成,脂肪代谢发生障碍,亦影响蛋白与糖代谢。③三羧循环是三者氧化供能的必经之路,也是三者互相转化的中心环节。
机体的物质代谢是受神经、内分泌调节下进行的。
第三节 特殊营养物质
谷氨酰胺、精氨酸、膳食纤维、ω-3多不饱和脂肪酸以及核苷酸等,不但有助于逆转应激时的代谢,改善氮平衡,且利于提高机体的免疫功能。含有这类物质的营养支持称之为“免疫型营养支持”。
一、谷氨酰胺
(一)谷氨酰胺的代谢及生理功能
谷氨酰胺(glutamin,Gln)是人体含量最丰富的氨基酸,占人体总游离氨基酸的50%。正常血浆GIn浓度为600~900μmol/L,占血浆游离氨基酸的20%,而细胞内Gln的浓度是血浆的30倍。体内所有细胞都有Gln合成酶,具有合成Gln的能力,由于骨骼肌是人体含量最大的组织,因此,骨骼肌是人体合成、贮存和提供内源性Gln的主要场所,75%的Gln贮存在骨骼肌中。
糖皮质激素是体内合成、释放Gln的调节激素。应激状态,糖皮质激素分泌增多,骨骼肌合成与释放Gln的速率亦增加。Fong及Loder等研究证实,应激时由骨骼肌释放的Gln及丙氨酸占从骨骼肌释放氨基酸总量的50%以上。
由骨骼肌释放的Gln,经血流输送至内脏器官和免疫组织,特异性地被肠、肝、肾和淋巴组织摄取,发挥下列生理功能:
1.是肠黏膜上皮的主要能源及其增殖、更新的底物
(1)Gln是肠黏膜的主要能源:肠黏膜细胞数量大,代谢活跃,能量需要大,Gln酶活性高,Gln是其主要能源。离体及整体大鼠空肠血流灌流模型研究证实,流经肠道的Gln 64%被氧化为CO2,Gln在肠道的消耗率达60μmol/(kg·h)。
(2)Gln是肠黏膜上皮增殖、分化、更新的必要底物:Gln是DNA、RNA的前体嘌呤和嘧啶合成的重要氮源。小肠黏膜上皮每2~4d更新一次,提供足量的Gln,对于肠黏膜上皮细胞的增殖、更新甚为重要。
(3)应激时肠黏膜对Gln的需求增加:肠腔内的Gln借助黏膜刷状缘转运装置进行吸收;而血循中的Gln则通过肠上皮细胞的基底侧方膜转运。生理状态,食物中含有足量的Gln,不会导致体内Gln不足。(图4-2)
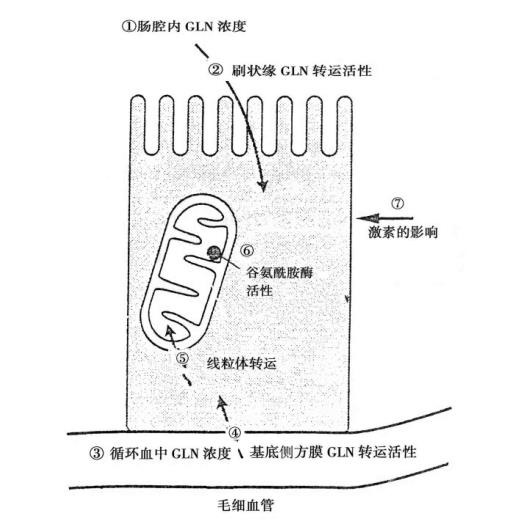
图4-2 影响小肠上皮细胞吸收和释出谷氨酰胺的因素,这些因素包括酶解物的传递、膜转运和细胞内代谢
应激状态,肠道对Gln的消耗增加70%以上。肠道虽能摄取与利用葡萄糖,但其氧化产生的CO2仅占肠道产生CO2总量的5%,因为此时肠道主要依赖Gln供能。应激时,骨骼肌Gln合成酶活性增加20%~40%,Gln合成增加,转运至小肠的Gln增多,即便如此,仍不能满足小肠对Gln的需求。因此,应激状态施行TPN时,如不经静脉补充Gln,必然导致小肠黏膜代谢障碍。
(4)Gln与肠屏障功能:肠屏障功能(gut barrier function)包括机械屏障、免疫屏障、生物屏障和化学屏障。机械屏障是由肠黏膜上皮细胞、上皮间紧密连接和菌膜三者组成。实验研究表明,不含Gln的标准TPN(standad total parenteral nutrition,STPN)应用1周后会产生肠黏膜萎缩,绒毛高度、面积和黏膜厚度降低,机械屏障受损,导致细菌移位,肠源性感染并发症发生率增高。
2.Gln是合成抗氧化剂谷胱甘肽的重要前体 谷胱甘肽(GSH)是由半胱氨酸、甘氨酸及谷氨酸组成的三肽化合物,其分子中的谷氨酸来自Gln。Hong等实验显示,给予Gln强化的TPN,可保持组织中GSH贮备,利于保护组织免受氧自由基的损伤。
3.是淋巴细胞、吞噬细胞等免疫细胞增殖和发挥功能所必需 淋巴细胞增殖迅速,Gln是淋巴细胞代谢的重要燃料并为其增殖合成嘌呤、嘧啶的主要氮源。一些研究表明,Gln是T细胞和自然杀伤细胞(NK)生长和功能的发挥所必需。体内和体外研究发现,IL-2可促进NK细胞的活化与增殖,然而IL-2的这种作用依赖于Gln和GSH的存在。肠道免疫屏障由肠相关淋巴组织(gut associated lymphoid tissues,GALT)及其分泌的分泌型免疫球蛋白SIg A组成,SIg A的作用是阻止肠内细菌对肠上皮的黏附,与补体溶菌酶协同发挥杀菌作用,Gln缺乏或不足,将导致SIg A分泌减少,削弱肠道免疫功能,利于细菌移位发生。
4.参与体内酸碱平衡的调节 肾脏摄取、利用Gln并生成NH 3,NH 3与H+结合形成NH 4+随尿排出,机体每日酸负荷的30%~50%均由此途径排出以维持内环境稳定。肾小管每排出一分子NH 4,就有一分子Na HCO3重新吸收入血。危重病人机体每日酸的生成增加,用于肾脏排H+所需求的Gln亦相应增加。尽管此时骨骼肌释放Gln量增多,因首先满足了肠道的需求,而能用于肾脏排H+的Gln则显著不足。
(二)TPN时补充谷氨酰胺的制剂
力肽(Dipeptiven),是谷氨酰-谷氨酰胺二肽。
二、精氨酸
精氨酸(arginine,Arg)是半必需氨基酸。应激状态,内源性Arg不足,需补充外源性Arg。在体内,Arg在一氧化氮合成酶(NOS)作用下,生成具有广泛生物活性的一氧化氮(NO)。
Arg的主要作用是:
(一)改善机体免疫功能
Arg是分裂、增殖迅速的淋巴细胞合成DNA、RNA及蛋白质所必需。研究表明:①补充外源性Arg,有助于增加胸腺体积和淋巴细胞数;促进淋巴细胞对促分裂素的反应;增加淋巴细胞、自然杀伤细胞l L及l L-2R的活性及其表达;促进胸腺外T细胞的成熟,促进T细胞介导的免疫反应。②Arg是巨噬细胞发挥细胞毒作用所必需,促进巨噬细胞游走、吞噬和杀伤微生物作用。③Arg生成物NO可直接引起病原菌中半胱氨酸的亚硝基化,干扰DNA双链,抑制其转录、翻译,杀灭微生物。
(二)减轻全身炎症反应及其所引起的病理损害
此作用主要是通过Arg的体内生成物NO得以实现。
(1)扩张内脏微血管:NO通过多种途径参与内脏微血管舒缩调节的信息传递,松弛微血管平滑肌,改善内脏血流灌注。
(2)抑制血小板黏聚:补充外源性Arg导致血管内皮所产生的NO增加,更有效地抑制血小板相互集聚及血小板与血管内皮细胞的黏附。
(3)减轻氧自由基的损伤:NO具有灭活靶细胞的还原型辅酶Ⅱ(NADPH)氧化酶活性,减少氧自由基生成。其次,NO与氧自由基反应,生成无活性的硝酸盐。此外,NO具有抑制嗜中性粒细胞活化及超氧离子产生等作用,继而减轻氧自由基对组织的损伤。
(4)抑制细胞因子生成。
(5)抑制白细胞-内皮细胞相互作用:“白细胞-内皮细胞相互作用”是指在细胞因子等诱导下的中性粒细胞在血管内皮细胞表面滚动、黏附及中性粒细胞变形,并经内皮细胞间隙向血管外的游走过程,这是机体的防御机制。但此反应一旦过度,则导致大量白细胞黏聚、活化,产生大量氧自由基及蛋白水解酶,损伤微血管及周围组织。毛细血管后静脉是“白细胞-内皮细胞相互作用”的主要场所,此作用加剧则加重毛细血管后静脉血流淤滞、血栓形成,导致微循环障碍。
Arg抑制“白细胞-内皮细胞相互作用”与Arg体内生成物NO的下列作用有关:①抑制细胞因子生成。②抑制中性粒细胞活化及其表面CD11/CD18黏附分子的表达。③灭活氧自由基,已证实氧自由基可促进“白细胞-内皮细胞相互作用”。④血管内皮细胞生成的NO在血管内皮细胞表面形成保护层,利于降低血管阻力,阻止中性粒细胞在血管内皮表面黏附。
(三)Arg对肿瘤细胞增殖的影响
平衡氨基酸的营养支持,在改善肿瘤病人营养状况的同时,亦会促进肿瘤的生长。已有学者研究表明,大剂量精氨酸强化的不平衡氨基酸,可抑制免疫原性肿瘤细胞的分裂、增殖,降低肿瘤复发率与转移率,改善宿主生存率。
Arg抑制肿瘤生长的机制是:①肿瘤组织多胺代谢活跃,多胺与肿瘤增殖密切相关,Arg能抑制肿瘤细胞多胺生成。②增强机体免疫细胞对肿瘤细胞的杀伤作用。③Arg体内生成物NO直接抑制肿瘤细胞线粒体呼吸、三羧酸循环和核酸合成。
三、膳食纤维
膳食纤维是指来源于植物的不被小肠中消化酶水解的多糖及少量木质素的总和。膳食纤维可分为可溶性膳食纤维和不可溶性膳食纤维两类,前者具有减缓葡萄糖在小肠的吸收、降低血清胆固醇及延缓胃排空的生理作用,后者可刺激肠蠕动,增加粪便重量和减少粪便在肠道平均通过时间的作用。
短链脂肪酸(SCFA)是结肠黏膜的基本能源。膳食纤维经结肠细菌分解产生短链脂肪酸,有助于维护结肠黏膜的结构与功能,对于短肠综合征者,更利于结肠黏膜的代偿性增生。
含膳食纤维的肠内营养制剂,能维护肠绒毛形态结构的完整,增加空肠和回肠的绒毛高度、隐窝深度及隐窝细胞增殖率,对肠黏膜屏障有保护作用。
“能全力”是含膳食纤维的肠内营养制剂。
四、ω-3多不饱和脂肪酸
ω-3多不饱和脂肪酸(ω-3PUFA)可改善细胞膜结构,影响细胞膜的流动性、细胞膜信使传递和膜受体动能,减少炎性介质的产生,降低IL-1、TNF等促炎细胞因子的产生。
深海鱼的鱼油中ω-3PUFA含量高。Omegaven是ω-3PUFA的商品制剂。
第四节 外科病人营养状况的评定
在确定是否需进行营养治疗之前,应对病人的营养状况进行评定。施行营养治疗后,亦需通过营养评定以衡量营养治疗的效果。
一、营养状况的评定
从营养学角度出发,人体是由脂肪、肌肉和内脏蛋白三类成分构成,目前用于评定营养状况的指标,多属于反映此三类成分的状况。常用评定营养状况的指标介绍如下:
(一)体重
体重测量简单、易行。如不伴有水代谢异常(水潴留或脱水),体重可直接反映营养状态。
1.理想体重百分数(IBW%)∶IBW=![]()
理想体重按Broca改良方法进行计算,即:理想体重[kg]=[身长(cm)-100]×0.9身长在165cm以下的男性,其理想体重则为:理想体重[kg]=[身长(cm)-105]×0.9 IBW%的正常值为90%~120%。
2.占平时(病前)体重百分数 鉴于正常人个体体重的差异,病人体重与得病前体重的对比,更能反映营养状况的变化。
占平时(病前)体重的百分数=![]()
(二)脂肪储存量测量——三头肌皮褶厚度(TSF)测定
用卡尺测量三头肌皮褶厚度(TSF),可间接反映人体脂肪的储存。临床上常用三头肌皮褶厚度百分数(TSF%)来反映脂肪储存程度,即:
TSF%=![]()
不同年龄TSF理想值厚度有所差别,我国尚无群体调查的数据,鉴于东方人有相似之处,目前可借助日本报告的平衡理想值厚度(男性:8.3mm;女性15.3mm)作为参考。
TSF的具体测量,教科书已有介绍。
(三)骨骼肌量
1.上臂肌肉周径(AMC)
AMC(cm)=MAC(cm)-[TSF(cm)×3.14]
式中:MAC——上臂周径。
先用软尺及卡尺分别测量出MAC及TSF,再按上式求出AMC(MAC的测量教科书已有介绍)。
成人AMC的理想值男性为25.3cm,女性为23.2cm,临床上用AMC理想值百分数(AMC%)反映营养状态。
AMC%=![]()
2.肌酐-身高指数(CHI%)
肌酐-身高指数可较客观地反映人体肌肉总量。肌酐由肌肉代谢产生,由尿排泄。肾功能正常时,正常人24h尿肌酐排出量是恒定的。营养不良者,尿肌酐排出的减少量与自身肌肉的丢失量呈正相关。
CHI%=![]()
健康人尿肌酐值的计算:以Broca改良法计算出与病人同等身长健康人的理想体重,再乘以肌酐相关系数。肌酐相关系数男性为27mg/kg,女性为18mg/kg。故CHI%可改为下列公式:
CHI%=![]()
(四)内脏蛋白量
目前多借助测定血清中某些蛋白质的浓度和某些免疫功能来判断内脏蛋白状态。
1.血清白蛋白及转铁蛋白 白蛋白是肝脏合成的主要蛋白质。白蛋白降低是营养不良的征象。但由于白蛋白的半衰期长,约20d,只有较严重蛋白质不足或营养不良持续较长才显著下降。转铁蛋白是一种β球蛋白,亦由肝脏制造,具有运送铁的功能,因半衰期短(8d),其测定值能较早地反映内脏蛋白质储备量,小于2.0/L说明已存在营养不良。由于缺铁亦影响转铁蛋白值,可靠性不如白蛋白。
2.前白蛋白(pre-albumin,PA)和视黄醇结合蛋白(retinoid-binding protein,RBP)都是由肝细胞合成的血浆蛋白质,体库较小,半寿期较短。PA的半寿期为2~3d,RBP的半寿期为10~12h,故其浓度的变化能够早期而敏感的反映肝脏蛋白质合成功能。当蛋白质和热量均摄入不足时,两者均可于短期内即示降低;若仅热量摄入不足,则RBP水平也会下降。因此这两个参数可作为短期营养治疗效果监测的指标,特别是迅速反映蛋白质营养不良的敏感指标。其正常值因检测的方法而有一定的差异。一般较为通用的参考值见表4-1。在分析检验结果时尚应注意,各类肝病时,PA、RBP均可减少。肾脏疾患时两者均可升高,尤其是RBP升高更为显著。
表4-1 前白蛋白、视黄醇结合蛋白测定的正常参考值

3.免疫功能测定
(1)总淋巴细胞计数(TLC):系指周围血液中每立方毫米的淋巴细胞总数,可据血液分析报告的淋巴细胞百分比乘以白细胞总数来计算。低于1 500/mm3为异常。TLC不是营养不良的特异指标,心衰、尿毒症、何杰金氏病以及使用免疫抑制剂均可使淋巴细胞减少,分析时应注意。
(2)迟发性皮肤超敏反应(delayed skin hypersensitive test,DSH):可用下列其中的某二种抗原,如结核菌素、腮腺炎病毒、链球菌激酶-链球菌脱氧核糖核酸酶、植物血凝素等,各0.1m L分别同时作皮内注射,对该抗原敏感又能产生反应的病人则发生皮肤硬结和红斑。注射后24~48h观察,硬结、红斑<5mm者示反应低下,>5mm者为阳性,两项呈阳性反应者表示细胞免疫有反应性。
(五)氮平衡试验
氮及热量摄入不足均可造成氮负平衡,因此,氮平衡试验可动态反映蛋白质和能量平衡情况。
氮平衡=24h氮摄入量-(24h尿尿素氮量+4g)(注:4g代表每日经粪便、皮肤丢失的氮及氨等未测定的蛋白质分解产物)。
施行TPN时,24h氮摄入量可从所输入氨基酸制剂的含氮量及输注容量求得;搜集24h尿液,计量,并测定该标本的尿素氮量,再计算24h尿尿素氮量(g),即24h尿尿素氮量(g)=尿素氮(g/L)×24h尿量(L)。
例如:输入7% Vamin 1 500m L(Vamin的含氮量9.4g/L),24h尿量1 500m L,尿尿素氮测定为4.2g/L。求其氮平衡:
氮平衡(g/d)=(9.4×1.5)-[(4.2×1.5)+4]=14.1-(6.3+4)=3.8g
肠瘘、短肠等病人,因腹泻及消化液丢失,蛋白质丢失过多,氮平衡测定不易准确。
(六)其他
纤维连接蛋白(fibronectin)是一种具调理因子功能的糖蛋白,半寿期为12~24h,为营养支持的敏感指标,也是与患病率和死亡率有关的预后指标。营养不良伴防御功能低下时,纤维连接蛋白水平下降,营养再充实(nutritional repletion)1周后的病人,该指标的意义有所减轻。
生长调节素C(somatomedin,C,也称促生长因子)是一类在肝脏形成见于血浆中的肽(分子量约8 000),主要参与脂肪、肌肉和软骨合成代谢的物质。氮平衡与生长调节素之间呈正相关。饥饿时生长调节素C水平下降,进食后水平上升。生长调节素的半寿期很短,为2~8h。
常用营养评定指标的正常值及营养不良的数值见表4-2。
表4-2中各指标对营养的评定都有一定的局限性,精确性受限,故应同时检测多项指标并进行综合分析。目前最常用的指标仍为体重(与病前体重相比)、血浆白蛋白及氮平衡。前已述及,体重的正确判断要排除水潴留及脱水的因素。白蛋白半衰期长,要2周以上才有明显变化,难以反映短期内营养效应,如同时测定血清转铁蛋白,可达互相补充、综合评价的作用。血清前白蛋白半衰期更短(2d),是一更可用于反映短期内营养效应的指标。氮平衡不失为动态评定营养状况的指标,应注意的是,在分析氮平衡时,其前提是病人的肾功能良好,在测定氮平衡时要同时测定BUN,以除外体内氮潴留。此外,在施行营养支持时,每日大于或等于2~3g的正氮平衡持续6~7d以上,才能说明机体处于合成代谢,2~3d之正氮平衡并无多大临床意义。
表4-2 营养指标的正常值及营养不良的分级
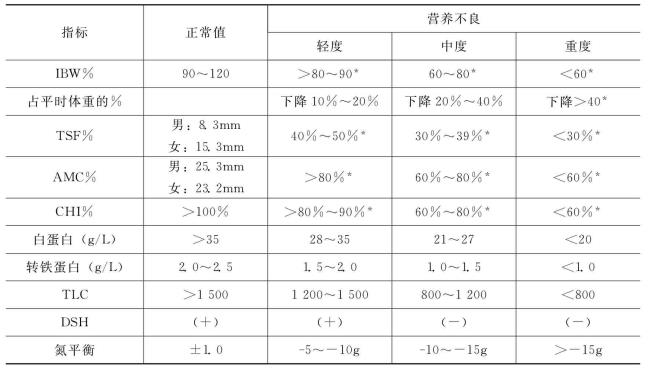
*相当于实测值与理想的百分率。
为了综合判断营养状况,并预测与并发症发生率及病死率的关系,Mullen等提出“预后性营养指数”(prognostic nutritional index,PNI)概念,用白蛋白(ALB)、三头肌皮褶厚度(TSF)、转铁蛋白(TFN)、DSH四项指标按下列公式进行计算:
PNI(%)=156-16.6×ALB(g)-0.78×TSF(mm)-0.2×TFN(mg)-5.8×DSH
DSH的数值规定如下:皮肤无反应者=0,红肿区<5mm=1,红肿区>5mm=2
PNI值愈高,可能发生并发症及死亡的可能性越大。PNI≤30%,并发症率、病死率低;相反,≥60%者,则发生率高。预测正确性可达80%~90%。
二、营养不良的类型
营养不良大致分为下列3种类型:
1.蛋白质-热卡营养不良(protein-caloric malnutrition,PCM) 是因蛋白质、热卡供应不足,导致皮下脂肪与肌肉组织消耗所致,是外科最多见的类型。临床主要表现为消瘦(marasmus)、体重下降、TSF%、AMC%及CHI%均低,早期血清白蛋白可正常。
2.蛋白质营养不良(恶性营养不良病) 又称kwashiorkor病,kwashiorkor是非洲黄金海岸的一个地名,该病最早在该地被发现。系由于严重蛋白质缺乏引起,其特征是发育迟缓,皮肤毛发色素沉着,水肿及肝脏病理改变(脂肪浸润、坏死和纤维变性)。因该病表皮脱落后留下粉红色,又有“红孩病”之称。此类营养不良,血清白蛋白、转铁蛋白及总淋巴计数均下降,但人体测量数值可能正常,临床上易于忽视。
3.混合型营养不良 由于长期营养不良而表现为上述两种营养不良的某些特征,是一种非常严重、危及生命的营养不良。
第五节 饥饿与应激状态的胃肠外营养支持
外科需进行营养治疗的疾病大致见于两类状况:饥饿状态所造成的营养不良,以及应激状态所引起的营养障碍。
一、饥饿状态机体的代谢特点
人体摄入的营养物质(主要是热量和蛋白质)不能满足维持机体各种代谢的最低需要量者,称为饥饿。
外科病人许多原因(或疾病)使机体处于饥饿状态,例如因治疗需要长期禁食和胃肠减压,恶性肿瘤引起的食欲下降、摄食不足,胃肠道梗阻(幽门梗阻、慢性不全肠梗阻),慢性肠瘘,短肠综合征以及肠道炎性疾病等所引起的吸收功能障碍。
在饥饿状态下,由于血糖下降,胰岛素分泌减少,儿茶酚胺、胰高血糖素及生长激素等分泌增加导致机体代谢发生下列变化:
(1)体内贮备的糖原迅速耗竭:脑组织、红细胞及肾髓质必需依赖葡萄糖供能,每日约消耗葡萄糖140~160g,而体内糖原贮存有限,肝糖原200g,可转化为葡萄糖被利用,肌糖原300g,不能转变为葡萄糖。饥饿状态,24h肝糖原几乎迅速消耗殆尽。
(2)糖异生作用增强:为满足依赖葡萄糖供能组织的代谢需要,蛋白质与脂肪的糖异生作用增强。每100g糖异生将消耗200g脂肪和150g蛋白质。参与糖异生蛋白质的先后顺序大致是:消化食物的蛋白质(酶),肌肉蛋白质,内脏蛋白质。随着糖异生增强,自身蛋白消耗增多,尿素氮排出增加。
(3)脂肪动员加强:脂肪是机体最大的能源贮备场所,占体内能量贮备的85%。饥饿状态持续3d后,脂肪动员加强,体内由葡萄糖供能逐渐转变为由脂肪供能。随着体内酮体增多,脑组织亦逐渐适应于氧化酮体供能。酮体供能有利于保存自身蛋白,使机体蛋白分解减少,尿素氮排出降低。
(4)长期饥饿状态,将造成机体重要器官功能与结构受损,体重下降,肌力减弱,胃肠道萎缩,肝、肾功能损害,心力减弱、心排出量减少以及循环功能减退。长期饥饿导致免疫功能障碍,极易招致严重感染。
二、应激状态机体代谢的特点
创伤、手术、严重感染所引起的应激反应及代谢改变,是危重病人进行营养治疗的重要理论基础。
许多外科疾病均可引起应激反应,如严重创伤、严重胆道感染、急性腹膜炎和其他急腹症,全胃切除、肝切除、全结肠切除、直肠癌根治术、胰十二指肠切除术等大、中手术。
外科医生不但应识别是否存在应激反应,还应根据创伤或感染的程度,判断应激反应的程度,为制定营养治疗方案提供依据。
(一)应激所引起的神经、内分泌反应
应激所引起的神经、内分泌反应很广泛,其中与营养治疗关系密切的是:
(1)交感神经兴奋性增高:由于交感神经-肾上腺髓质反应增强,儿茶酚胺(肾上腺素、去甲基肾上腺素和多巴胺)分泌增多,进而刺激胰岛α细胞分泌胰高血糖素增多,而相对抑制β细胞的胰岛素分泌,其结局是胰高血糖素/胰岛素比率增大。
(2)下丘脑-垂体轴活动性增高:继而导致生长激素及促肾上腺皮质激素分泌增多,后者进而使糖皮质激素分泌增多。
(二)应激状态机体代谢的特点
(1)高代谢(hypermetabolism)和高分解代谢(hypercatabolism):应激状态,基础能量消耗较正常人增高,其增高程度与应激程度呈正相关;体内蛋白合成减少,分解加速,出现自身相食(autocannibalism),负氮平衡;脂肪动员,组织对脂肪酸的利用增强,严重应激时,机体所消耗的能量75%来自脂肪氧化。
(2)高血糖(hyperglycemia):儿茶酚胺、胰高血糖素、生长激素和肾上腺皮质激素等,均促进糖原分解和糖异生,是升糖激素,而促使葡萄糖转变为糖元的胰岛素分泌却相对受到抑制,其结局是引起高血糖——“应激性高血糖”(Stress hyperglycemia)。
(3)胰岛素阻抗(insulin resistance):所谓胰岛素阻抗,是指不管血浆胰岛素水平如何,本来对胰岛素敏感的组织变为不敏感了,致细胞对葡萄糖的通透性降性,组织对葡萄糖利用减少。胰岛素阻抗的产生与儿茶酚胺直接抑制胰岛素受体有关。
应激所引起的神经、内分泌反应及对代谢的影响可简单用图4-3表示:
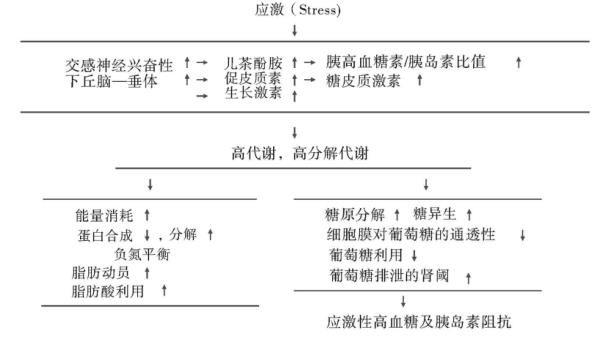
图4-3 应激反应及对代谢的影响
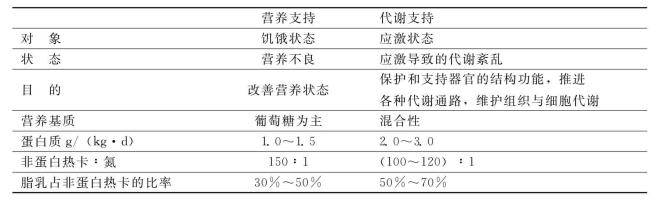
(三)营养支持与代谢支持
从代谢观点出发,现已有倾向将营养治疗区分为“营养支持”与“代谢支持”。
营养支持的研究与应用是以饥饿病人为基础,目的是对饥饿性营养不良提供理想的治疗效果。其要点是:①由于机体对输注葡萄糖耐受性强,葡萄糖是供应热源的主要基质。②每日供应的氮量相当于蛋白质1.0~1.5/kg体重。③非蛋白热卡:氮=150(kcal)∶1(g)。④在代谢率增高、能量需求增多的情况下,着重注意总能量的供应。
代谢支持的研究与应用是以应激病人为基础。在研究中发现,将“营养支持”的原则用于应激病人,负氮平衡不但得不到纠正,还会引起更严重的代谢紊乱,进一步加重应激。代谢支持的主要目的是保护和支持器官的结构与功能,推动各种代谢通路,维护组织与细胞代谢。其要点是:①供应非蛋白热量不宜过高[<30kcal/(kg·d)]。②减少葡萄糖负荷,避免高血糖,40%以上的非蛋白热卡由脂肪乳剂供应。③提高蛋白质供应量(2.0~3.0g/kg体重)。④非蛋白热卡与氮之比100~120 (kcal)∶1(g)。
营养支持与代谢支持的区别见表4-3。
表4-3 营养支持与代谢支持的区别
三、TPN的指征
TPN的指征是:①病人已存在营养不良,因肠道功能或/和基础疾病,不能或不容许经口进食及肠道喂饲者。②病人目前营养状况虽良好,但预计5~7d内仍不能经口进食或肠道喂饲者。③病人处于应激状态,且伴肠功能衰竭者。举例如下:
1.短肠综合征 TPN的应用,将为残肠结构与功能适应性改变提供机会。在广泛小肠切除后的腹泻期及适应代偿早期,需依赖TPN提供病人所需全部营养,一旦腹泻症状减轻,即逐渐过渡为EN。残肠过短或不能完全代偿者,需长期依赖PPN。
2.重症胰腺炎 见本章第八节。
3.高排出量胰瘘及胰性腹水 TPN可使胰液分泌减少,促进胰外瘘闭合及胰性腹水消退。TPN与生长抑素联合应用,胰液分泌量可减少60%~80%,只要主胰管的流出道不存在梗阻,80%的胰外瘘可自然闭合。
4.肠外瘘 肠外瘘施行TPN的目的是提供营养、减少消化液分泌、使胃肠休息,进而促进瘘闭合。TPN与生长抑素及H 2受体阻滞剂联合应用,可使肠瘘排出量减少70%以上。以TPN为核心的非手术综合治疗,70%~80%的肠瘘可自然闭合。
5.炎症性肠道疾病(Inflamatary bowel disease,IBD) 约30%~50%的Crohn病和50%~70%的溃疡性结肠炎存在营养不良。症状极严重的IBD病人应停止经口进食,使炎性肠道绝对休息,并可减少抗原通过炎性肠壁所引起的局部免疫反应。
6.围手术期 围手术期应用TPN的具体指征是①术前已存在营养不良者:术前体重3个月内下降10%以上,或6个月内下降15%以上,或血清白蛋白在35g/L以下,均示存在营养不良。术前如已存在营养不良,又不允许或不可能借助EN改善营养状况者,是术前施行TPN的适应证。术前TPN有助于提高病人对手术的耐受性,改善止血功能,提高免疫能力,降低并发症的发生。②手术创伤大、术后代谢及胃肠道紊乱严重者,如全胃切除、胰十二指肠切除、肝叶切除、复杂的胆-肠吻合术等,这些手术病人,即使术前无营养不良,但为保证吻合口愈合,减少并发症的发生,在恢复正常进食前,仍需施行TPN(或PPN)。③术后合并严重并发症者:如术后合并胃肠吻合口瘘、十二指肠残端瘘、肠梗阻等严重并发症,应及时施行TPN。
7.恶性肿瘤病人 见本章第七节。
8.肝功能减退病人 见本章第九节。
9.急性肾功能衰竭病人 见本章第十节。
四、营养液
涉及每日由TPN营养液应提供的能量及各种营养基质的量。
1.能量 能量单位用千卡(kcal)或千焦尔(kJ)表示,lkcal=4.18kJ。
(1)简单估计法:饥饿状态病人,供能25~30kcal/(kg·d)。应激状态病人,能量消耗大,如果依照“按耗供能”的原则,应供能30~35kcal/(kg·d)。但基于应激反应引起的代谢紊乱,高能量供能不但不能被利用,反会增加代谢并发症,故应激状态供能目前认为以20~25kcal/(kg·d)为当。
(2)Harris-Benedict公式(H-B公式):原先传统的作法是,先按H-B公式计算出基础能量消耗(Basal energy expenditure,BEE),再乘以校正系数(又称应激系数),即为实际能量消耗,亦即为每日从营养液应提供的热卡。
BEE(男)=66.5+13.7W+5 H-6.8A
BEE(女)=655.1+9.56W+1.85 H-4.65A式中:W——体重(kg);
H——身高(cm);
A——年龄(岁)。
实际能量消耗=BEE×校正系数
常见的校正系数见表4-4
表4-4 常用的校正系数

一位体重65kg、身高170cm、年龄30岁的男性,及一位体重60kg、身高165cm、年龄30岁的女性,按H-B公式计算,其BEE值分别为1 603kcal及1 394kcal。南京军区南京总医院以间接测热法测定我国健康人群静息能量消耗(REE)男性平均为1 452kcal,女性平均为1 108kcal,说明按H-B公式计算的BEE值较实际的基础能量消耗约高出10%~15%。
因此,为防止高能量供能的弊端,应激病人的供能,如按H-B公式计算,只提供基础能量消耗即可,不必乘以校正系数。
2.营养基质(substances)
(1)葡萄糖:每克葡萄糖供能4.0kcal。饥饿状态,机体葡萄糖利用率高,对输注葡萄糖负荷能力强;应激状态,由于存在“应激性高血糖”及“胰岛素阻抗”,对输注葡萄糖负荷能力差,如输注葡萄糖的量超过机体负荷能力,将导致血糖进一步升高,加重应激,形成恶性循环。但为满足依赖葡萄糖供能组织(脑、红细胞及肾髓质)的代谢需要,每日由营养液输注的葡萄糖量不得少于140~160g。
(2)脂肪乳剂(简称脂乳):每克脂肪供能9.0kcal。脂乳的提供量以脂乳供能占非蛋白热卡的百分比表示,即以“糖脂(热卡)比”表示。
糖脂(热卡)比:葡萄糖与脂乳供能所提供的总热卡,称“非蛋白热卡”,葡萄糖与脂乳所提供热卡的比值,称“糖脂(热卡)比”。饥饿状态,非蛋白热卡的50%~70%应由葡萄糖提供,30%~50%由脂乳提供,即糖脂(热卡)比可分别为7∶3、6∶4或5∶5;应激状态,非蛋白热卡的30%~50%由葡萄糖提供,50%~70%由脂乳提供,即糖脂(热卡)比可分为3∶7、4∶6、5∶5。应激愈严重,脂乳占非蛋白热卡的比率应越大。在实际工作中,应根据血糖、尿糖测定及血脂肪廓清试验调整糖脂(热卡)比。
(3)氨基酸:每日需氮量可从对病人代谢特点的分析或氮平衡试验获得。
非应激状态病人,每日排出尿氮37mg/kg,粪氮12mg/kg,皮肤丧失氮7~8mg/kg,共56~57mg/kg,60kg体重者每日约丢失氮3~5g。因此,一般禁食病人,如无氮的额外丢失(如腹泻),在能量供给足够的前提下,为避免负氮平衡,每日供氮量不得少于4.0~5.0g。
应激状态,蛋白分解加速,尿氮排出增多,呈负氮平衡,负氮平衡值的大小与应激程度呈正相关。然而,负氮平衡并不会因提供较多的氮而中止。Francois和Larsson等研究表明,当能量摄入等于能量消耗时,如每日提供14g氮,可使负氮平衡值下降至-8g——最低负氮平衡值;如每日供氮量少于14g,氮供量越少,负氮值越大。因此,对应激状态分解期的病人,在能量供应足够的情况下,如无氮的额外丢失,每日供氮量以14g为当(相当于7% Vamin 1 500m L)。随着应激反应消退,机体进入合成代谢期,供氮量则应渐增多,以助正氮平衡(见图4-4)。
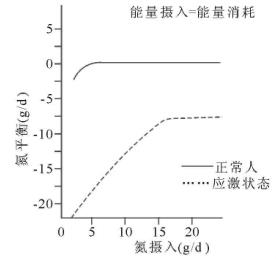
图4-4 正常人及应激状态氮摄入量与氮平衡的关系
非蛋白热卡与氮之比:TPN所提供的氨基酸能否真正用于合成蛋白,既决定于所提供的能量是否足够,也决定于非蛋白热卡与氮的比值是否合理。
非蛋白热卡/氮的比值过大(热卡过多,或供氮不足),会导致代谢并发症;非蛋白热卡/氮的比值过小(热卡不足),所输注的氨基酸将会用于糖异生,转作供能,而不能用于合成蛋白。
饥饿状态病人的非蛋白热卡(kcal):氮(g)应为150∶1左右;应激状态病人则应为100∶1~120∶1左右。
(4)维生素:复合水溶性维生素制剂“水乐维他”、“九维他”及多种脂溶性维生素复合乳剂——维他利匹特可供TPN用。
(5)电解质:TPN时,应根据临床与生化检测,维持水、电解质与酸碱平衡,其中应特别注意:①钾的补充:分解代谢时,K+从细胞内外移,经尿丢失多,如不及时补充钾,会造成低钾血症;于合成代谢阶段,K+又移至细胞内,对钾的需求亦增多。因此,施行TPN的病人需补钾量较大,一般要求40mEq/1 000 kcal;②注意补磷:磷是细胞核蛋白及多种酶的组成部分,磷参与糖、脂肪及蛋白代谢,合成代谢时需磷增加,体内不足时,于开始进食后可发生再进食综合征(Refeedings syndrome)。每日补充有机磷制剂甘油磷酸钠(Glycophos)10~20m L,可满足人体对磷的需要。
(6)微量元素:人体必需13种微量元素,其中有6种尚未用于输液营养,安达美(Addamel)是含有7种微量元素的复方制剂。在各种输液制剂中,有各种微量元素的痕迹量同时被输入体内,因此,只有长期TPN(1个月以上)才考虑微量元素的补充。
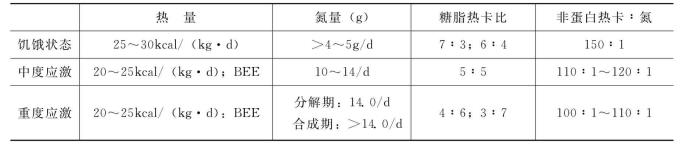
成人每日应供能量、氮量及糖脂热卡比归纳于表4-5。
表4-5 能量及各主要营养物质的需要量(成人)
确定营养液的组成是TPN的核心,应“个体化”。临床工作中可遵循下列程序实施:①先确定应供总热卡及氮量;②据氮量及选用氨基酸制剂的含氮浓度换算成输注该氨基酸制剂的容量;③据病人代谢状况确定糖脂热卡比,然后据此计算出葡萄糖与脂乳的输入量;④验证经上述程序计算出的配方是否符合“非蛋白热卡∶氮”的要求,必要时作局部调整;⑤最后考虑水、电解质平衡及维生素和微量元素的补充。举例如下:
男性,体重60kg,身高175cm,年龄50岁。全胃切除手术后。
据H-B公式计算,BEE=1 423.0kcal
应供能量=1 423.0kcal[23.7kcal/(kg·d)](不必乘校正系数)
营养液基本配方: 热卡:1 423kcal
7% Vamin1 500m L 氮:14.1g
葡萄糖150g(600kcal) 非蛋白热卡∶氮=100.9∶1
10% Intralipid750m L(825kcal) 糖脂热卡比=4.2∶5.8
水乐维他1支
维他利匹特1支
电解质(酌情)
五、全营养混合液(TNA)的配制
施行TPN时,所给予的营养物质应同时输注(双静脉通道或经Y型管)或混合后输液。将葡萄糖、氨基酸、脂乳混合一起,称为“三合一”(Three in one),将所有营养物质混合在一起,称“全合一”(All in one,AIO),2026年美国肠外与肠内营养协会称之为全营养混合液(Total nutrient admixture,TNA)。
TNA是将患者所需的全部营养物质,按一定顺序混合于醋酸乙烯或聚氯乙烯袋中,其程序是:①将电解质(磷酸盐除外)、微量元素、水溶性维生素、胰岛素加入氨基酸液中;②磷盐加入另一瓶氨基酸溶液中;③脂溶性维生素加入脂肪乳剂中;④将含有添加物的氨基酸先后加入含有15%~20%葡萄糖液(1 000m L以上)的3L聚氯乙烯袋中;⑤最后加入含有脂溶性维生素的脂肪乳剂。混合过程应不间断地一次完成,并不断地晃动以保持均匀混合。
注意事项:①如上所述钙剂和磷盐应分别加在不同溶液内稀释,以免产生Ca HPO4沉淀。②TNA中不要加入其他药物。③加入液体总量应等于或大于1.5L,混合液中葡萄糖的浓度不要>23%,以利于混合液的稳定。④混合后4℃冰箱保存;4~25℃环境下24h输完。⑤阳离子可中和脂肪颗粒上磷脂的负电荷,使脂肪颗粒相互靠近,发生聚集和融合,最终导致水油分层。因此,一般控制一价阳离子总浓度小于150mmol/L,Mg2+浓度<3.4mmol/L,Ca2+<1.7mmol/L。⑥氨基酸、葡萄糖、脂肪乳剂的容量比为2∶1∶1,1∶1∶1或2∶1∶0.5。⑦全过程应严格无菌操作。
TNA的优点:①简化了营养的输注程序。②减少了营养液的污染机会。③避免空气栓塞。④营养成分同时输入,有利于代谢,增加氮的利用。
六、营养液输注的途径
不超过2周的TPN,可采用周围静脉;长期TPN,一般需上腔静脉插管,24h连续输注。
第六节 胃肠内营养及“胃肠外、胃肠内阶段性营养支持”
随着肠外营养支持的临床应用,其某些弊端已逐渐被人们认识,其中主要是长期TPN所导致的代谢并发症和肠屏障功能受损。胃肠内营养符合生理,因此,“只要胃肠道有功能,就应首选肠内营养,”已成为当今营养支持的趋势。
一、胃肠内营养的途径与优点
(一)胃肠内营养的途径
1.经口 指进食“口感”较好的肠内营养制剂,适用于胃肠道消化、吸收功能较差而对传统饮食难以耐受的病人。经口进食保存了胃液及胰液分泌的头相(cephalic phase)、胃相(gastric phase)和肠相(intestinal phase)。
2.胃饲(gastric feeding) 指经鼻胃管或营养性胃造瘘灌注肠内营养制剂,适用于昏迷及食道梗阻、食道瘘病人。胃饲消除了胃液及胰液分泌的头相,但仍保留了胃相与肠相。
3.空肠喂饲(jejunal feeding) 鼻-肠管插入上段空肠或在腹部手术时在空肠上段施行营养性空肠造瘘,灌注肠内营养制剂,空肠喂饲消除了胃液及胰液分泌的头相、胃相及大部分肠相。
“肠外、肠内阶段性营养支持”(stage nutritional support of PN、EN)是据疾病的不同阶段、胃肠功能状况及/或代谢特征,依次阶段性地施行肠外、肠内营养支持,其中主要指由TPN逐渐过渡为空肠喂饲的营养支持,这种营养支持方式在外科(主要是腹部外科)具有广泛而重要的应用价值。其过程简单表示为:全肠外营养(TPN)→部分肠外营养(PPN)+部分肠内营养(PEN)→全肠内营养(TEN)→完全经口进食。
(二)胃肠内营养的优点
肠内营养(及“肠外、肠内阶段性营养支持”)的优点在于:①能避免或减少长期TPN所引起的导管感染及代谢并发症。②能避免或降低长期TPN所引起的肠道屏障受损、细菌易位及肠源性感染的发生。③胃肠减压液及胆道引流的消化液,可经营养性造瘘管再滴注入肠内,减少消化液丢失,有助于维持水电解质和酸碱平衡。④肠内营养符合生理,营养物质吸收后经门静脉输送至肝,有利于营养物质代谢。⑤简单、安全、方便、价廉,并发症少。
二、适应证
(一)下列情况,可选择“TPN、空肠喂饲阶段性营养支持”
1.重症胰腺炎 重症胰腺炎机体呈高代谢、高分解代谢,病程长,并发症发生率高,营养支持是其综合治疗的重要组成部分。
胰外分泌的头相、胃肠、肠相中,肠相占胰外分泌量的70%~80%。肠相涉及两种消化道激素:胰液素(secretin),其分泌细胞S细胞全部分布在十二指肠黏膜;缩胆囊素(CCK),其分泌细胞I细胞主要分布在十二脂肠及上段空肠黏膜。空肠喂饲旷置了十二指肠及上段空肠。临床研究证明,适时而及早地由TPN过渡为空肠喂饲,不会刺激胰外分泌增加,仍能使胰腺处于“休息”,对胰腺炎症的稳定与消退不构成负性影响(详见本章第八节)。
2.胰、十二指肠损伤 在胰、十二指肠损伤手术时,同时施行营养性空肠造瘘,术后进行“阶段性营养支持”。空肠喂饲有助于维持病人营养状况,不刺激胰外分泌增加,有利于创伤的修复。
3.高位胃肠瘘 包括胃切除术后吻合口瘘、十二指肠残端瘘及高位小肠瘘等。高位小肠瘘,只要肠瘘的远侧具有120cm以上的正常小肠,仍适宜空肠喂饲。营养性造瘘部位应选择在肠瘘远侧20cm处。
4.胃切除术后梗阻并发症 指吻合口梗阻、输入或输出襻梗阻经非手术治疗无效而需手术者,手术的同时在胃-肠吻合远侧20cm处施行营养性空肠造瘘。梗阻所致呕吐的病人多已存在严重的电解质与酸碱失衡,术后适时而及早地由TPN过渡为空肠喂饲有利于矫正内环境紊乱及负氮平衡。
5.全胃切除及胰十二指肠切除术 此类病人术前多已存在营养不良,手术创伤大,上消化道已失去正常解剖位置,并发症发生率高(胰瘘、胆瘘、胃肠吻合口瘘等)。“阶段性营养支持”有助于预防与治疗手术并发症。营养性造瘘部位应在胃空肠吻合口远侧20cm处。
6.复杂胆道外科病施行胆肠内引流术者 如果机体状况差,术后应施行TPN、空肠喂饲阶段性营养支持。空肠营养造口之部位,据胆肠吻合的方式,分别选于空肠上段(胆总管十二指肠吻合,或胆总管十二指肠短襻空肠间置术时)或Roux-en-y吻合之远侧20cm处。
(二)下列情况可选用胃饲
昏迷病人但胃肠功能尚好者(插入鼻-胃管灌注肠内营养制剂);食道梗阻(食道癌,食道瘢痕性狭窄)及食道瘘(如食道胸膜腔瘘、食道支气管瘘),通过营养性胃造瘘途径施行胃饲。
(三)下列情况,可选择“TPN、经口进食阶段性营养支持”
1.短肠综合征 过渡为经口进食的时机是腹泻症状减轻,腹泻容量<2.5L/d。(https://www.daowen.com)
2.低位小肠瘘 只要有100~150cm以上有功能的小肠,通过一段时间TPN,待腹腔内感染基本控制,全身状况稳定,肠功能恢复,就可过渡至经口进食。
3.炎症性肠道疾病 症状严重或急性发作期,施行TPN,症状减轻后则过渡至经口进食。
(四)其他
恶性肿瘤、烧伤与创伤、慢性胰腺炎,以及其他疾病导致胃肠道消化吸收功能较差者,可口服某种肠内营养制剂。
三、肠内营养制剂
(一)肠内营养制剂
目前已有多种供临床应用的商品制剂,表4-6列出几种常用肠内营养制剂的营养成分。
表4-6 几种常用EN营养制剂成分
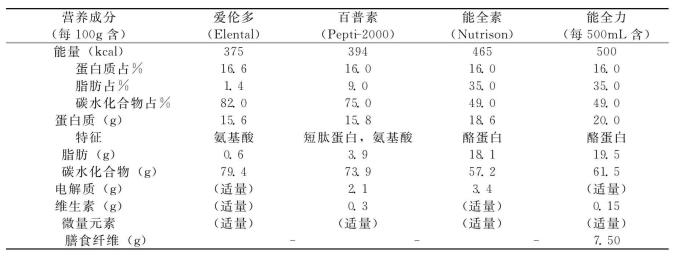
上述肠内营养制剂各有特征:爱伦多以氨基酸为氮源,低脂(脂肪仅占能量1.4%)。百普素以短肽蛋白、氨基酸为氮源,低脂(脂肪占能量9.0%)。能全素的氮源为酪蛋白,是常用的肠内均衡营养制剂。能全力各营养基质的比率与能全素类同,其特点是含膳食纤维,膳食纤维在结肠被细菌分解为短链脂肪酸,短链脂肪酸是结肠黏膜的重要能源,有助于维护结肠黏膜的结构与功能。
(二)肠内营养制剂的选择
肠内营养制剂的选择,取决于胃肠道的功能状况及原发病。例如:重症胰腺炎而胃肠功能处于恢复阶段者,选用爱伦多、百普素。胃肠功能尚可者,选用能全素。能全力最适用于短肠综合征,有利于“结肠代偿”。
表4-7 EN各阶段营养制剂的选择
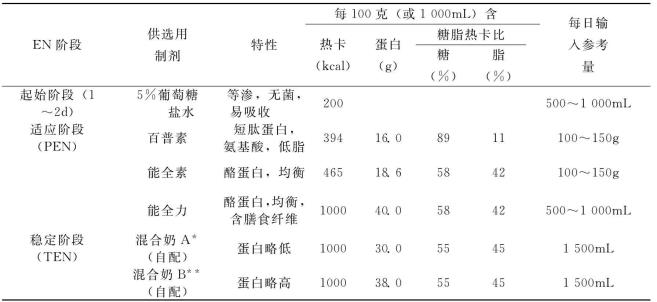
注:*基本配方:鲜牛奶400m L、豆浆400m L、米汤200m L、白糖100g、食盐2.0g
**基本配方:鲜牛奶600m L、豆浆200m L、米汤200m L、白糖100g、食盐2.0g
各种维生素、微量元素口服制剂均可酌量加入混合奶。
“TPN、空肠喂饲阶段性营养支持”时,空肠喂饲制剂的选择,应遵循下列原则:①空肠喂饲起始阶段:选用等渗、易于吸收的5%葡萄糖盐水,每日由营养造口导管缓慢滴注500~1 000m L,持续2~3d,使“废用”较久的肠道开始适应喂饲。②空肠喂饲适应阶段:此阶段空肠喂饲量逐渐增加,静脉输注营养液逐渐减少,肠外、肠内营养共存,营养成分互补,总热卡及营养基质是二者的相加。选用上述各种肠内营养制剂。③空肠喂饲稳定阶段:此阶段疾病已稳定,进入合成代谢与修复,停用肠外营养,以肠内营养供给所需全部热卡与营养物质,选用混合奶。见表4-7。
四、胃肠内营养的时机
施行胃肠内营养的时机,是当前争论的焦点。对于需进行营养支持的危重病人,Naked McClave等及国内部分学者主张在起病或手术后48~72h内,通过插入“鼻-胃-空肠管”(NGJT)或通过营养性空肠造瘘进行空肠喂饲(JF),此即当今备受关注的“早期肠内营养”(Early enteral nutrition)。
主张“早期肠内营养”的主要依据是:胃肠道停止喂食36~72h,由于肠道缺乏食物刺激,肠黏膜将发生萎缩,功能降低,肠黏膜机械屏障与免疫屏障受损,利于肠内细菌与内毒素移位及肠源性感染的发生;其次,Burth及Shatney等学者认为,腹部外科手术后,空肠蠕动恢复最早,因而不必等肠鸣音正常及肛门排气就可于术后及早地施行空肠喂饲。
笔者认为,胃肠道具有一定程度功能以及机体存在一定水平的物质代谢能力,是肠内营养的先决条件。然而:①肠道是应激作用的中心器官,在严重创伤、烧伤、大手术以及其他重症病人,由于应激反应,为保证心、脑等重要器官的血供,肠壁血供减少,肠黏膜灌注降低,导致黏膜缺血、绒毛顶端细胞坏死、脱落,黏膜通透性增强,其机械屏障和免疫屏障功能下降。在此阶段进行肠内营养,不但不能消化吸收,反而会加重肠道损害,增加细菌和内毒素移位。②其次,尽管腹部外科手术后,空肠蠕动恢复较早,但只有当回肠、结肠蠕动功能均恢复,才能使肠内营养物质向下输送,并被消化吸收。③再次,只有病人全身状况基本稳定,才能使肠道吸收的营养物质在体内得以代谢。
基此,对于胃肠内营养的时机,笔者认为应据病人具体情况而定。凡具有营养支持指征的重症病人,全身状况基本稳定后仍先施行肠外营养(PE),全身状况进一步稳定且肠蠕动恢复,方逐渐过渡为肠内营养(EN)。因为病人原发疾病不同,遭受手术方式、手术大小各异,机体应激反应大小、持续时间以及代谢紊乱程度亦有差别,这些因素均极大地影响肠内营养的时机。应该认识到,无论是长期PE,还是不适当而过早地施行EN,均会给病人带来不利影响。正如Douglas W.Wilmore所述,肠外与肠内营养(依次地)联合应用是今后营养支持的主要方式。
五、“TPN、空肠喂饲阶段性营养支持”应注意的问题
(一)空肠喂饲的浓度与容量必须遵循“循序渐进”的原则
总的原则是浓度由低至高,量由少至多,循序渐进,使病人感到舒适和不引起腹泻为度。在肠外、肠内营养支持交替阶段,二者热卡、营养物质与容量的总和要满足机体对能量、营养基质、维生素、电解质及水平衡的需求,使尿量达1 200~1 500m L/d,且无口渴症状。
(二)空肠喂饲的营养液要新鲜配置
据全日总量多少,分2~5次滴入,滴速以100~120m L/h为宜。营养液的温度以35~39℃为好,温度过低亦可导致腹泻。
(三)拟回收经空肠营养性造瘘再输入的消化液(胃肠减压液、胆管引液等)
要求分次收集、煮沸、过滤。消化液再回收输入对预防与矫正水电与酸碱失衡极为有利。
第七节 恶性肿瘤病人的营养支持
恶性肿瘤病人(即荷瘤宿主)蛋白质-热量营养不良发生率高。导致恶性肿瘤病人营养不良的原因,除由于食欲下降、营养物质摄入不足,以及肿瘤与宿主竞相争夺营养物质以满足自身不断增殖的需要外,还与荷瘤宿主本身存在物质代谢紊乱有关。
一、酶学变化是荷瘤宿主物质代谢紊乱的基础
造成荷瘤宿主代谢紊乱,主要与肿瘤细胞代谢失调有关。而肿瘤细胞的代谢失调,又与肿瘤细胞关键酶活性的变化直接相关。关于肿瘤细胞关键酶活性变化对其代谢的影响,Weber提出了“分子相关概念”(molecular correlation concept),即认为在正常细胞的同一代谢物两个方向相反的代谢途径中,关键酶的活性处于稳定状态;当细胞恶变时,由于基因表达异常,使方向相反的代谢途径的关键酶活性发生改变,因而造成癌细胞代谢失调。关键酶活性改变的程度与肿瘤细胞恶变程度有关,即分化程度低、生长速度快、恶性程度大的癌细胞,关键酶活性改变大,相反,关键酶活性变化小,代谢失调程度也不明显。
肿瘤细胞糖代谢关键酶的改变就是一典型例子。糖酵解和糖异生是糖分解代谢与合成代谢两个方面相反的代谢途径。糖酵解有3个关键酶:己糖激酶、磷酸果糖激酶和丙酮酸激酶。糖异生有4个关键酶:葡萄糖-6-磷酸酶,果糖二磷酸酶,磷酸烯醇式丙酮酸羧激酶和丙酮酸羧化酶。实验研究显示,肿瘤生长速度愈快者,其糖异生的关键酶活性愈低,而糖酵解的关键酶活性愈高,从而导致癌细胞糖酵解增强,产生的ATP增多,以供癌细胞能量消耗。这是各种癌细胞糖代谢的共同特征。
除了癌细胞的关键酶外,癌细胞的同工酶以及宿主体液中的酶学,亦有改变,它们亦是导致宿主物质代谢紊乱的基础。
二、肿瘤病人代谢系乱的特征
肿瘤病人存在能量、蛋白、糖及脂肪代谢异常。
(一)能量消耗
能量代谢研究显示:饥饿病人,随着饥饿持续时间延长,能量消耗逐渐减少,而荷瘤状态,机体呈高代谢,能量消耗增多,且能量消耗增高并不因营养物质摄入的减少而降低。
(二)蛋白代谢
肿瘤是靠与宿主竞相消耗营养物质来满足其本身不断增生的需要,由于宿主蛋白消耗,导致宿主负氮平衡,此负氮平衡并不因摄食增加或营养支持而得到完全逆转。
研究表明,肿瘤病人肌蛋白合成减少,但肝脏蛋白合成增加。然而由于肿瘤对氮的不断消耗,无论肌蛋白或肝蛋白(主要是白蛋白)的分解速率均增强,最终导致肌群(muscle mass)大量丢失,血浆总蛋白和白蛋白降低。
(三)糖代谢
肿瘤病人的糖代谢存在特殊的改变。
1.葡萄糖耐受性下降 荷瘤状态机体对糖的代谢能力降低,且在厌食症状出现前就已存在。无论是口服糖或静脉输注葡萄糖均可引起高血糖。糖清除能力下降的主要原因是荷瘤机体存在胰岛素阻抗,组织对糖利用下降。胰岛素阻抗与血浆乳酸水平升高有关。切除肿瘤后胰岛素阻抗好转。
2.肝脏糖异生增强 由于糖异生,肝脏产糖约增加20%~40%。糖异生增强是由于:
(1)糖异生酶活性增强。
(2)供糖异生的原料如丙氨酸、乳酸、甘油等的血浆水平增加。
3.肿瘤对糖的利用增加 肿瘤代谢活跃,对糖的利用、消耗增多。Nolop研究证实,肿瘤组织消耗葡萄糖的量为正常组织的7倍。肿瘤的糖代谢主要是无氧代谢,一些研究证实,肿瘤病人血浆糖无氧代谢产物乳酸水平增高。Richtsmeier测定肿瘤供血动脉与引流静脉血中葡萄糖及乳酸浓度,证明肿瘤摄取与利用葡萄糖增加,乳酸产生增多。
肿瘤糖代谢所产生的乳酸,经血循环运至肝脏,供肝脏糖异生合成新的葡萄糖,这一过程,称为“萄萄糖乳酸循环”,又称Cori循环。Cori循环导致能量额外丢失,因为每1分子葡萄糖无氧分解仅产生2mol ATP,而由乳酸再合成萄萄糖却要消耗6mol ATP。估计荷瘤病人通过Cori循环每天要额外丧失1 046~1 464kJ(250~350kcal)能量。
肝脏糖异生产生的新葡萄糖,再供给宿主及肿瘤利用。这样,宿主通过两个渠道额外丧失能量:①Cori循环造成的能量丢失;②肿瘤本身对葡萄糖利用增加所丧失的能量。
(四)脂肪代谢
荷瘤鼠的血清注入正常鼠血管内后,可见血浆游离脂肪酸水平升高,说明荷瘤鼠血清内含有促进脂肪动员的物质。输注葡萄糖不能抑制脂肪动员,说明荷瘤状态脂肪动员并不是由于外源性能量供给不足。切除肿瘤后脂肪动员可以终止。
荷瘤状态可见高甘油三酯血症,脂肪清除力下降与毛细血管内皮细胞所释放的脂蛋白脂酶(LPL)活性下降有关,但导致LPL活性下降的机制却尚不清楚。Vas-sara等报告,已存在体重减轻的肿瘤病人,LPL活性降低35%,且与体重减轻程度呈正相关。
荷瘤状态脂肪酸氧化增强。脂肪酸氧化增强的程度与肿瘤的分期呈正相关,晚期肿瘤、有转移者较之早期肿瘤脂肪酸氧化增强程度高。
恶性肿瘤病人的代谢特征归纳为表4-8。
表4-8 恶性肿瘤对宿主代谢的影响

荷瘤状态主要营养物质代谢的相互关系以图4-5表示。
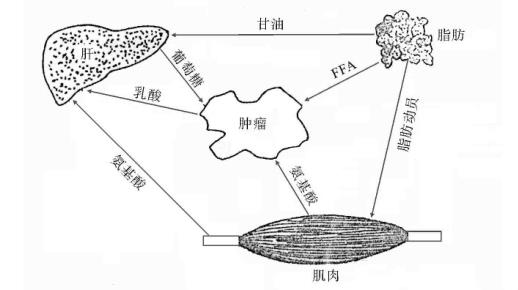
图4-5 荷瘤状态营养物质代谢的相互关系
三、营养支持对宿主及肿瘤生长的影响
(一)营养支持对宿主的影响
荷瘤状态对营养支持的代谢反应,研究较多的是蛋白代谢,脂肪和糖代谢研究较少。综合这些研究:营养支持有利于改善氮平衡,经尿排出3-甲基组氨酸(3-methylhistidine,3-MH)减少,说明肌蛋白分解代谢受到抑制。血浆葡萄糖的清除率好转,糖异生减少。游离脂肪酸氧化增加(表4-9)。
表4-9 肠外营养支持对宿主代谢的影响
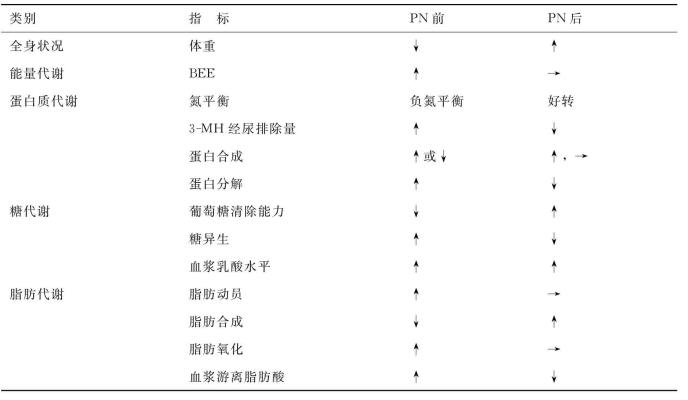
注:3MH;3-甲基组氨酸;↑:增强或升高;↓:减弱或下降;→:不变
然而,与饥饿状态相比,恶性肿瘤病人的营养支持远不令人满意,这是因为它们之间有两点重要区别:①饥饿状态,虽存在代谢紊乱,但随着营养的补充,此紊乱可中止;而荷瘤状态,肿瘤与宿主竞相摄取营养物质及宿主的代谢紊乱是营养不良的主要原因,且并不因补充外源性营养中止。②饥饿状态,营养支持的目的是改善营养状况,最终可恢复至正常营养水平;恶性肿瘤病人,营养支持的主要目的是使病人能经受肿瘤的特殊治疗(手术、化疗、放疗等),降低治疗后的并发症,但营养状况难以恢复至正常水平,只能改善生活质量,延长生命。
(二)营养支持对肿瘤生长的影响
实验研究发现,营养支持能加速肿瘤生长,肿瘤细胞进入生长周期的比率增加。尽管实验研究所显示的加速肿瘤生长的作用在人体并未得到肯定证实,但营养支持刺激肿瘤生长的作用已受到广泛关注,因而寻求一种既能改善病人营养状况,又有助于抑制肿瘤生长的营养制剂是当今研究的热点。
四、恶性肿瘤病人肠外营养支持的要点
(一)能量与基质
肿瘤耗能增多,且Cori循环额外丢失能量,机体呈高代谢状态,需供“非蛋白热卡”126~146kJ(30~35kcal)/(kg·d),即成人每天供氮量为12~15g,“非蛋白热卡(kcal)∶氮(g)”约为120∶1。
(二)特殊氨基酸制剂
1.不平衡氮基酸制剂 众多学者研究证实,平衡氨基酸的营养支持在改善荷瘤宿主营养状况的同时,亦促进了肿瘤生长。基于某些氨基酸在肿瘤生长中具有特殊作用,根据肿瘤细胞氨基酸代谢的特点,人为地改变所提供的氨基酸制剂谱,造成体内某种或某几种氨基酸含量过剩或减少,以达既能抑制肿瘤生长,又能改善宿主营养状况的目的,这就是肿瘤病人的不平衡氨基酸营养支持。目前研究较多的有以下几种:
(1)精氨酸增量的不平衡氨基酸:精氨酸对强免疫原性或肿瘤相关抗原阳性的肿瘤具有抑制生长作用,而对弱免疫原性肿瘤却有刺激生长作用。“大剂量”精氨酸具有抑制肿瘤生长作用,“小剂量”则具有促进肿瘤生长作用,然而剂量值与肿瘤生长的相关性,仍待进一步研究。此种不平衡氨基酸用于荷瘤宿主的营养支持,尚处于实验研究阶段。
(2)去蛋氨酸不平衡氨基酸:蛋氨酸是含硫必需氨基酸,为肿瘤细胞增殖所进行的甲基化提供活性甲基,因而肿瘤生长对蛋氨酸有极大的依赖性。去蛋氨酸不平衡氨基酸的营养支持,降低荷瘤宿主体内的蛋氨酸水平,可使肿瘤细胞生长停滞于S后期和G2期,阻扰肿瘤细胞周期循环。日本学者已将去蛋氨酸不平衡氨基酸制剂——AO-90用于临床。
(3)其他不平衡氨基酸:例如去缬氨酸不平衡氨基酸、去苯丙氨酸/酪氨酸不平衡氨基酸等,均尚处于实验或临床试用阶段。
2.右旋氨基酸 按过去的认识,右旋氨基酸不能为机体直接利用,目前用于营养支持的氨基酸均为左旋氨基酸。但近些年有研究表明,某些右旋氨基酸仍能在体内转化为左旋氨基酸而被机体利用,其关键酶是右旋氨基酸氧化酶。肿瘤细胞不存在这种酶,故这种右旋氨基酸不能被肿瘤组织所利用。Sagarmuna的研究显示4种右旋氨基酸(D-Phe,D-Val,D-Met,D-Leu)具有抑制肿瘤生长且能改善宿主营养状况的作用。
(三)其他
1.谷氨酰胺抑制剂 早期研究认为,谷氨酰胺强化的TPN可改善肿瘤病人的氮平衡,促进蛋白合成,不刺激肿瘤生长。但晚近报告,谷氨酰胺是肿瘤生长所必需的氨基酸,并优先为肿瘤所摄取。在PN营养液中加入谷氨酰胺代谢抑制剂异恶唑醋酸(acvicin),能减缓肿瘤生长。
2.胰岛素及生长激素 均为合成激素。胰岛素能改善糖代谢,促进正氮平衡;生长激素有助于改善蛋白质代谢,增进宿主免疫功能。这2种激素的应用均应配合肿瘤的特异性治疗(如手术、放疗与化疗等)。
(四)配合针对肿瘤的特异性治疗
营养支持是恶性肿瘤病人综合治疗的组成部分。尽管目前众多学者正致力于肿瘤病人营养支持氨基酸制剂的研究,但临床效果尚待进一步观察。只有及早切除肿瘤,配合放疗、化疗,尤其是选用对S期有特异性作用的化疗药物(如甲氨蝶呤、6-巯基嘌呤、5-Fu或阿糖胞苷等),使机体荷瘤状态向无瘤状态转化,削弱病人的代谢紊乱,才能使营养支持起到既治疗肿瘤又改善病人营养状况的双重作用。
第八节 重症胰腺炎病人的营养支持
一、营养支持在重症胰腺炎治疗中的地位
(1)重症胰腺炎病情凶险,机体处于应激状态,分解代谢增加,能量消耗高于正常人20%~50%。如无合理的营养支持,将加重负氮平衡,导致营养障碍,甚至衰竭死亡。
(2)重症胰腺炎病程长,如未能采取措施维持适当营养,终将导致免疫功能低下,延长病程,增加感染性并发症的发生率,使病情进一步恶性,病死率增加。
(3)重症胰腺炎可能经受多次手术,如分期清创、胰周脓肿引流等,如营养状况恶化,将使病人降低或丧失对手术的耐受力,增加手术危险性。
营养支持当今已构成胰腺炎治疗的重要组成部分,合理的营养支持,对于减少并发症、缩短病程、提高治愈率,均具有重要意义。
二、重症胰腺炎病人对输注脂肪乳剂的耐受性
重症胰腺炎机体处于应激状态,应激性高血糖(stress hyperglycemia)、胰岛素阻抗(insulin resistance)以及胰腺炎症所引起的胰内分泌功能障碍,均可致血糖升高,转而依赖增加输注脂乳的比率才能满足机体对能量的需求。然而,胰腺炎病人可能存在脂质代谢障碍,高甘油三酯血症是诱发胰腺炎的病因之一。因此,胰腺炎病人输注脂乳能否耐受,是否会加重胰腺炎或使已消退的炎症“反跳”(rebound),是需要作出明确回答的问题。
(一)高甘油三酯血症与胰腺炎
早在2026年,Klatskin就注意到,原发性高脂血症与胰腺炎复发有一定的相关性。之后,国外众多学者研究表明,急性胰腺炎病人高甘油三酯血症(简称“高TG血症”)并存率高达12%~38%。
尽管胰腺炎与所伴行的高TG血症的因果关系尚不完全清楚,但不少学者研究发现:①伴高TG血症的胰腺炎病人,大多数在胰腺炎发生前就存在TG代谢障碍。②当高TG血症一旦被控制,有利于胰腺炎消退,相反,高TG血症未能控制甚至加重,则会使胰腺症炎走向反面。③Cameron及Farmer等研究表明,血TG值≥11.3mmol/L,或血TG值虽为5.65~11.3mmol/L,但血清呈乳状者,此种程度的高TG血症可能成为诱发胰腺炎的病因,伴此种程度的胰腺炎称之为高脂血症胰腺炎(hyperlipemic pancreatitis)或称为高甘油三酯性胰腺炎(hypertriglyceridemic pancreatitis)。而血TG值虽增高,但仅在1.70~5.65mmol/L者,因未构成胰腺炎的病因,则应称之为“伴高甘油三酯血症胰腺炎”。作者的实验研究亦表明,高TG血症动物的胰组织内,存在能引起胰腺炎的PLA2(磷脂酶A 2)活性升高及MDA(丙二醛)含量升高。用同一方法诱发实验性胰腺炎,具有高TG血症的动物较之无高TG血症的动物,胰腺炎症程度更为严重。因此,胰腺炎病人输注脂乳后,如不能及时代谢清除,确有加重胰腺炎或导致炎症“反跳”之虞。
(二)重症胰胰炎病人对静脉输注脂肪乳剂的耐受性
鉴于胰腺炎病人高TG血症并存率高,对每例胰腺炎病人进行肠外营养前,应常规测定空腹血清TG值(基础血清TG值)。
1.基础血清TG值正常病人对输注脂乳的耐受性 基础血清TG值正常,表明不存在TG代谢障碍。作者临床研究证实,基础血清TG值正常者,每日输注含脂肪65.0~80.0g的脂肪乳剂(占非蛋白热卡40%~50%)均能耐受,脂乳廓清试验阴性,无胰腺炎症反跳发生。Sitzman报告64例,输注占非蛋白热卡22%~55%的脂乳,耐受良好。尽管各学者报告每日输注脂乳的量差别较大,但输注占非蛋白热卡50%的脂乳应是安全的。
2.伴高TG血症胰腺炎的脂乳应用 据Cameron等学者报告及作者的临床研究,伴高TG血症胰腺炎应用脂乳,应遵循下列原则:①基础血清TG值在1.7~3.4mmol/L者,可输注脂乳。②基础血清TG值在3.4~4.5mmol/L且空腹血清呈乳状者,禁用脂乳,但空腹血清不呈乳状者,仍可慎用。③基础血清TG值>4.5mmol/L者,不用脂乳。④应用脂乳过程中,定期复查脂乳廓清试验,阳性者及时停用。
三、重症胰腺炎PN、EN阶段性营养支持
自2026年Feller报告TPN用于重症胰腺炎的营养支持以来,重症胰腺炎的预后有了改善。但由于重症胰腺炎病程长,长期TPN可能带来一些不容忽视的问题,如导管感染,肠道屏障受损,细菌移位及代谢并发症等,基此,对重症胰腺炎的营养支持,应采用“TPN、空肠喂饲阶段性营养支持”,尽量缩短肠外营养(PN)持续时间,及早过渡为肠内营养(EN)。
(一)“阶段性营养支持”的实施
1.开始施行TPN的指征 病人术后待全身状况稳定,开始施行TPN。具体指征是:①P≤100次/min,收缩压≥13.3kPa,脉压≥3.5k Pa。②尿量≥1 200m L/d。③水电解质及酸碱失衡矫正。通常为术后或急性起病后48~72h。
2.开始过渡为EN的指征 病人TPN后,如全身状况进一步稳定,且符合下列指征者,开始过渡为EN。①无腹胀,肠功能恢复且肛门排气。②施行营养性空肠造瘘者,应经空肠造瘘导管注入美蓝液证实空肠造瘘处无外渗。在施行EN后如出现胰腺炎“反跳”,或严重胰腺及胰周脓毒性感染且有消化道功能障碍,或应激性溃疡合并大出血等,则暂停转为PN,待病情稳定后重新继续EN。EN直至病人能经口进食为止。
3.EN的营养制剂 见本章第六节。
(二)“阶段性营养支持”的评价
胰腺和胰周继发感染是导致胰腺炎死亡的主要原因。要改善重症胰腺炎的预后,维持病人营养状况是基础,预防与控制感染是关键。临床研究显示:“阶段性营养支持”仍能较好的维持病人营养状况,缩短病程,胰腺及胰周感染发生率低。及早过渡为EN的营养与治疗效应,除其合乎生理外,可能通过下列机制实现:①消化道及早接受喂养刺激,有助于防止肠黏膜萎缩及机械屏障受损;EN营养液所含营养物质全面,包括含有肠道特殊营养物质谷氨酰胺(GLN)。②较之PN,EN利于增强腹腔及肠系膜淋巴结中巨噬细胞的吞噬和杀菌能力,巨噬细胞在预防细菌移位中起着重要作用。③EN的营养物质通过对肠道内分泌细胞的刺激,对营养物质代谢产生正前馈型调节(positive foodforward requlation)作用,有利于营养物质的进一步代谢与同化。
及早过渡为EN是否会引起胰腺炎症“反跳”,是值得重视的问题。众所周知,刺激胰外分泌的头相、胃相、肠相中,肠相占胰外分泌量的70%~80%。肠相涉及两种消化道激素:促胰液素(secretin),其分泌细胞S细胞全部分布于十二指肠黏膜;缩胆囊素(CCK),其分泌细胞I细胞主要分布在十二指肠及上段空肠黏膜。空肠喂养旷置了胃、十二指肠及上段空肠。空肠喂养对胰外分泌的非正性影响,已被实验及在人体的研究证实。
EN简便、安全、并发症少。及早过渡为EN,有利于减少长期TPN的导管感染及代谢并发症。
四、结语
营养支持在重症胰腺炎外科综合治疗中占重要地位,也是营养支持临床应用的典型范例。
重症胰腺炎具有神经内分泌应激反应的特征,营养支持时应提供足够的能量(成人每日约2 000~2 500kcal);由于应激性高血糖发生率高,应常规测定空腹血糖,每日输注葡萄糖量200g左右,并给予外源性胰岛素,定期作血糖监测;基础血清TG值正常者,每日输注占非蛋白热卡50%的脂乳是安全的,伴高TG血症胰腺炎的病人,应据基础血清TG值增高的程度及是否存在空腹乳状血清,判断是应用、慎用或不用脂乳。重症胰腺病程长,采用“PN、EN阶段性营养支持”有利于降低长期TPN的并发症,及早过渡为EN不会刺激胰外分泌,仍能使胰腺“休息”。
脂乳不能耐受又同时存在应激性高血糖者,PN的营养基质选择困难,供能不足,营养状况难以维持,应设法及早过渡为EN。
第九节 肝功能减退病人的营养支持
慢性肝病存在程度不等的肝功能受损,严重者导致凝血功能障碍、肝性脑病、肝肾综合征、门脉高压及上消化道出血。
慢性肝病常伴有营养不良,其原因:①食欲下降,营养物质摄入减少。②胃肠道消化、吸收功能降低。③肝脏对营养物质的转化、代谢能力下降。
肝功能受损与营养不良,是密切相关的一个问题的两个方面:肝功能受损可引起营养不良;营养不良又进一步造成肝细胞损害及肝功能恶化,形成恶性循环。合理营养支持,对促进肝细胞结构的恢复与再生,维护与改善肝功能,均具重要意义。
普外科治疗的病人中,常见到肝功能减退,如门脉高压症,合并肝硬变的肝癌,慢性胆道疾病,以及其他并存慢性肝病的病人。这些病人均需在围手术期进行包括营养支持在内的综合治疗,否则将降低病人对麻醉与手术的耐受性,增加肝衰及其他并发症的危险性。
一、慢性肝病病人代谢紊乱的特征
(一)糖代谢
1.糖代谢相关激素水平的改变 与糖代谢相关的激素主要是胰岛素和胰高血糖素。肝功能减退时,这两种激素体内水平均升高,但由于胰高血糖素升高幅度大于胰岛素升高幅度,最终导致胰岛素/胰高血糖素比率降低。
导致胰岛素与胰高血糖素体内水平升高是由于:①肝脏对其灭活能力下降:此二激素均在肝脏降解、灭活。动物实验发现,随着肝衰的发展,胰高血糖素急剧升高,胰岛素与胰高血糖素的比率越来越低。②门-体分流:由于肝硬化多存在门-体分流,使此二激素的一部分不流经肝脏灭活。临床研究发现,门-体分流术后此二激素的血浆水平迅即升高;③氨及芳香族氨基酸刺激胰高血糖素分泌增加。
胰岛素/胰高血糖素比率下降,其对糖代谢的影响是糖原分解加速,肝脏糖异生增强以及对口服或输注葡萄糖耐受性下降。
2.空腹低血糖罕见 硬化的肝脏贮存葡萄糖的能力极低,由于其有限的糖元迅速耗竭,按理说肝功能受损病人易出现空腹低血糖,但实际上空腹低血糖却罕见。这是由于:①在激素的影响下,肝脏糖异生活跃;在肝脏贮存葡萄糖、产生葡萄糖(糖异生)和维持血糖浓度稳定等功能方面,以第一项功能受损最早,只有肝功极度衰竭,才出现糖异生功能受损。此外,长期饥饿状态,肾脏亦参与糖异生。②供能尚有其他来源:如脂肪动员,蛋白分解,骨骼肌蛋白分解所释放的BCAA等。
3.对输注或口服葡萄糖耐受性下降 葡萄糖经门-体分流是一原因,但主要原因是胰岛素与胰高血糖素比率降低。
(二)脂肪代谢
对外源性脂乳清除能力降低,输注大量脂乳不能耐受。其原因与糖代谢障碍(高血糖)导致毛细血管内皮细胞脂蛋白脂酶的合成减少及活性降低有关。
(三)蛋白质代谢
1.蛋白合成减少 人体蛋白40%在肝脏合成。肝功能减退时,蛋白合成减少,由于糖、脂代谢与利用能力下降,自身蛋白分解加速,出现低蛋白血症。
2.血浆氨基酸谱改变 血浆氨基酸谱改变是严重肝功能减退的重要特征,即芳香族氨基酸(AAA,包括苯丙氨酸、酪氨酸、色氨酸升高,支链氨基酸BCAA,包括亮氨酸、异亮氨酸和缬氨酸)降低,导致BCAA/AAA比值下降。
生理状态:蛋白质消化吸收进入门静脉的氨基酸,AAA进入肝脏时被肝细胞所摄取,合成蛋白质或被代谢;BCAA通过肝脏时不被肝脏摄取,重新进入血液循环,运至骨骼肌,部分合成骨骼肌蛋白,部分被分解、氧化。
肝功能减退时,肝脏利用AAA合成蛋白质能力及代谢能力降低,同时由于门-体分流,造成AAA血浆浓度升高。骨骼肌对BCAA利用加速是导致BCAA水平下降的原因。
(四)血浆氨基酸改变与肝性脑病
血浆BCAA/AAA比值下降,当今认为是肝性脑病发病的基础。2026年Fischer对肝性脑病的发病学提出了“假性神经传递介质学说”(false neurotransmitter hypothesis),按照该学说,AAA与BCAA可竞相通过血脑屏障,严重肝功能减退时,血浆AAA浓度大于BCAA浓度,AAA通过得多,并在脑中积聚。AAA是生理神经传递介质(如正肾上腺素、多巴胺、五羟色胺)的前体,过多的AAA,脱羟基后形成苯乙醇胺和羟苯乙醇胺,其结构很像生理性神经传递介质,但其活性却等于零,Fischer称之为假性神经传递介质,假性介质与真性介质竞争受体,受体被假性介质占有,使生理介质不能起作用,而出现脑功能失常。
慢性肝病的代谢紊乱归纳于表4-10。
表4-10 慢性肝病代谢紊乱特征

二、肝功能减退病人肠外营养支持的基本原则
肠外营养支持是肝功能减退病人营养支持的主要方式。其基本原则是:根据代谢紊乱特征,提供合理的能量与基质,维护肝细胞结构与功能,改善营养状况,促进肝细胞再生,预防或减轻肝性脑病。
(一)限制葡萄糖的输入量
葡萄糖的输入量以满足依赖葡萄糖供能的脑组织、红细胞及肾髓质的代谢需要为度,即150~200g/d,并以葡萄糖(g)与胰岛素(IU)4∶1~6∶1的比率加入胰岛素,使血糖控制在11~12mmol/L(200mg/d L)以下。
(二)适量输注脂乳
临床研究证实,轻至中度以内的肝功能异常,静脉输注脂乳1.72g/(kg·d)完全可以耐受,对肝功不但无害反而有利,配合矫正水与电解质失衡、间断输注鲜血、白蛋白等措施,有利于消除或改善腹水,促进蛋白的合成与再生。肝功能减退病人,以选择MCT/LCT制剂(如10%及20% Lipofundin,德国,Braun公司)为好,并据脂乳廓清试验调整输注量。
肝功能减退应用脂乳的营养与治疗效应,除众所周知的双能源供能的优点外,还与下列因素有关:①脂乳不易渗漏至毛细血管外,不易引起水潴留;②脂乳可由肝外器官与组织微血管内皮细胞的脂蛋白脂酶代谢,不会加重肝脏负担;③有利于减少骨骼肌BCAA的消耗,改善血浆氨基酸谱BCAA/AAA比值的失衡。
(三)输注支链氨基酸
中-重度的肝功能减退,输注支链氨基酸是营养支持中最为重要的措施,其必要性与理由见表4-11。
表4-11 中-重度肝功受损输注BCAA的理由

支链氨基酸的输注量为10.0~12.0g/d。FO80(d)、4.25%支链氨基酸注射液均为BCAA制剂。4.25%支链氨基酸注射液250m L,含BCAA 10.65g。在输注BCAA制剂的同时,应输注适当剂量的营养型氨基酸制剂。
(四)其他治疗
在肠外营养支持中,应同时补充维生素及微量元素。肠外营养支持是慢性肝病综合治疗的组成部分,间断输鲜血、白蛋白、矫正水与电解质失衡等亦不可少。
第十节 急性肾功能衰竭病人的营养支持
急性肾功能衰竭(Acute renal failure,ARF) 是不同病因所造成的急性肾功能减退综合征,临床特点为少尿、水潴留、氮质血症、高血钾、高血磷、高血镁、低血钙、高尿酸血症及代谢性酸中毒。
普外科导致ARF常见的病因是严重创伤(包括手术)、严重感染(如绞窄性肠梗阻、腹膜炎、胰腺炎)、失血及有效血容量下降。
ARF病人机体呈高代谢、高分解代谢状态,能量消耗及含氮代谢废物增多,钾、磷等电解质从组织释放增加,使氮质血症、电解质及酸碱失衡更为严重。在对ARF综合治疗的同时,根据其代谢特征进行营养支持,有助于减轻氮质血症与电解质、酸碱失衡,促进肾脏结构与功能的恢复。
一、ARF的代谢特征
高代谢及高分解代谢状态,导致机体耗能增加,蛋白合成减少,分解增强,糖利用下降,糖异生增加以及对外源性脂乳的清除能力降低。
间接测热法测定显示,术后并发的ARF机体能量消耗为正常人的130%~190%。但能量消耗个体差异较大,有学者研究认为,能量消耗升高主要与引起ARF的原发病有关。如:存在ARF的MODS与无ARF的MODS能量消耗无显著差异;不伴有脓毒症的ARF,能量消耗在正常范围。
实验研究证实,ARF时骨骼肌分解增加,蛋白合成减少20%。成人ARF时每日蛋白丢失量达2~30g,尿素氮生成(Urea nitrogen appearance,UNA)增多。Mitch及Wilmore提出用UNA值反映分解代谢的程度及与死亡率的相关性(表4-12)。
表4-12 尿素氮生成与临床过程

注:UNA=尿中尿素氮定量(g)+血清BUN改变(g)
血清BUN改变=(本日血BUN值-前日血清BUN值g/L)(体重kg)(0.6)
ARF分解代谢增强,与下列原因有关:①血浆分解代谢激素水平升高:高血糖素水平升高及组织对其敏感性增强,以及胰岛素阻抗。造成激素水平的改变与引起ARF的病因如创伤、感染等有关。②尿毒症时体内积聚的代谢产物具有促分解代谢作用。③ARF病人血清中,存在促进蛋白分解的物质:Houl等观察到,其血清中蛋白酶含量增加,抑制物减少。
ARF含氮废物、水、电解质及酸的清除受损,其升高程度取决于尿量及代谢状态。非少尿者,水、电解质及酸碱紊乱较轻。高分解代谢的少尿病人,每天平均血BUN及肌酐升高分别为3.57~7.14mmol/L和38~76μmol/L,发热及存在脓毒性感染者,血BUN及肌酐每天平均升高值还会成倍的增加。血钾、血磷及血镁亦呈类似速率升高。
二、ARF的肠外营养支持
能进食的病人,调整膳食结构,进行肠内营养支持或部分肠外营养支持。完全肠外营养支持用于完全不能进食的ARF病人。
ARF病人肠外营养支持主要有下述特点:
(一)提供足够热卡
只有提供足够的热卡,才能减轻蛋白质分解,减少尿素氮生成。每日需供热卡量,各学者报告不一,差别很大。作者认为,以30~35kcal/(kg·d)为宜。热卡不足,不利于抑制蛋白分解;供能过多,非但不能利用,还会加重应激,引起代谢并发症。
早期应用葡萄糖单能供能虽也获得一定临床效果,但鉴于ARF病人需限制水的输入,有限的容量输入高热卡的能量,葡萄糖浓度太大,渗透压太高,高血糖也难以控制。Lee(1976)提出由葡萄糖与脂肪乳剂各提供50%热量后,已用于临床,其优点是总液量少,能量密度大,渗透克分子浓度低,并可提供必需脂肪酸。
(二)必需氨基酸的输注
早在2026年,Levenson用14 C标记的尿素喂养大鼠,发现25%~40%的尿素存在于体蛋白中。尿素在肠道经尿素酶分解为氨和CO2,氨进入肠肝循环,在肝中经转氨基反应形成非必需氨基酸,作为合成自身蛋白质的原料。根据这一发现,在提供足够热卡的前提下,提供必需氨基酸,使内源性尿素氮用于非必需氨基酸的合成,将会起到为机体提供合成蛋白质原料及减轻氮质血症的双重作用。
必需氨基酸在ARF营养支持的“双重作用”已被研究证实:Giovannetti及Maggiore(1964)采用鸡蛋蛋白或纯必需氨基酸组成的膳食,每日供热量2 000~3 000kcal和氮1~1.5g,尿毒症临床症状减轻,血尿素氮浓度下降或不再升高。Berlyne(1967)用含有必需氨基酸的膳食和单纯糖类膳食分别给ARF病人作肠内营养支持,结果发现前一种膳食的病人每天平均血BUN升高值为4.25mmol/L,而后一种膳食的病人每天平均血BUN升高值为12.14mmol/L,说明前者已利用内源性尿素氮供自身蛋白合成之用。Wilmore(1969)及Abel(1973)亦证明,必需氨基酸与高糖输注较之葡萄糖单能源有助于稳定或降低血尿素氮水平。
在提供必需氨基酸的同时,是否需要同时提供非必需氨基酸,是值得研究的另一问题。应该认识到:①用于合成蛋白质,非必需氨基酸所占比率远大于必需氨基酸,如果肠外营养所需输注的氨基酸剂量较大,仅输入必需氨基酸,单靠内源性尿素氮再利用提供蛋白质合成所需之非必需氨基酸,仍会导致非必需氨基酸相对不足;②各种氨基酸可竞相进入细胞内,仅输入必需氨基酸,其细胞外浓度过高,将影响非必需氨基酸向细胞内转移。因此,对输注氨基酸剂量较大的ARF病人,应同时输注一定剂量的非必需氨基酸。
每日输注氨基酸量,取决于分解代谢程度或/和尿素氮生成量(UNA)。无高分解代谢的病人,可用营养型平衡氨基酸供氮(如7% Vamin),该制剂必需与非必需氨基酸含量比约为0.8∶1;轻度高分解代谢或/和UNA值<4~5g/d者,每日静脉输注必需氨基酸0.3~0.4g/kg(成人每日输注量含氮2.4~3.2g);高分解代谢或/和UNA>4~5g/d者,则按2∶1之比率同时输入必需和非必需氨基酸,二者之总供氮量较UNA值多1~2g/d,每日供氮量往往超过10g。
ARF少尿期,需限制液体量输入,鉴于目前TPN所用氨基酸制剂的浓度,每日要输入10g以上氮量的氨基酸制剂,其输液总量将会超过应限制的液体输入量。实际上,随着必需氨基酸的输入及内源性尿素转化为非必需氨基酸的再利用,将会弥补外源性供氮量的不足。因此,对少尿期病人,不必追求按UNA值计算的大剂量氨基酸输入。
(三)ARF病人TPN营养液配方举例(表4-13、表4-14、表4-15)
目前可用于急性肾衰的氨基酸制剂有肾必安,肾衰氨基酸(津),肾安氨基酸(广州),复方氨基酸9R,Nephramin(美),Ami-U(6.25%)(日)等。
表4-13 ARF肠外营养液配方(1)(用于非高分解代谢)
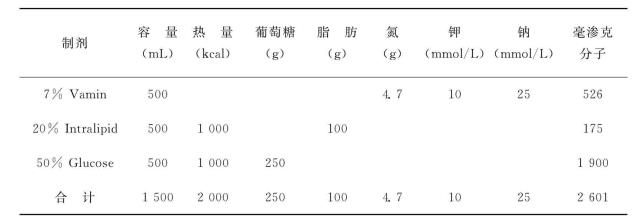
注:每日加入水乐维他(Soluvit)、维他利匹特(Vitalipid)各1支。
表4-14 ARF肠外营养液配方(2)(适用于轻度高分解代谢及少尿病人)
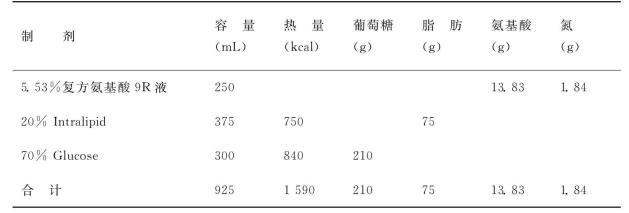
注:(1)每日加入水乐维他、维他利匹特各1支。(2)随着病人尿量增加,输入容量可相应增加。(3)5.53%复方氨基酸9R 含8种必需氨基酸及组氨酸。
表4-15 ARF肠外营养液配方(3)(适用于高分解代谢及少尿病人)
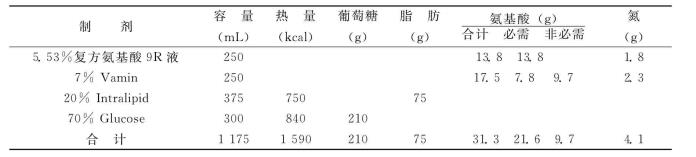
注:(1)每日加入水乐维他、维他利匹特各1支。(2)本配方必需氨基酸与非必需氨基酸之比为2.2∶1。(3)输入容量决定于尿量。
输注含有高渗葡萄糖的营养液,易引起高渗性非酮性昏迷,输注开始时,输注速率应慢,每小时30m L,每6h监测血糖1次,据血糖值给予外源性胰岛素,以后每日或隔日测血糖1次。耐受稳定后,输注速率渐增,当日之营养液24h输完。含有Intralipid之营养液应进行脂肪廓清试验监测。
TPN施行期间,亦应定期监测血BUN、电解质及酸碱平衡。
三、ARF肠外营养支持的疗效
随着ARF病人肠外营养支持的施行,血尿素氮、钾、磷、镁的浓度逐渐下降,可避免或减少透析次数,肾功能逐渐恢复,存活率增加。
ARF病理生理紊乱严重,内环境改变复杂,必须认识到,营养支持仅是其综合治疗的组成部分。更为重要的是,及早去除ARF病因,矫正水、电解质和酸碱失衡,并应据临床与实验室监测,不断调整营养液的组成和输注量。
第十一节 老年病人的营养支持
随着物质生活水平的提高及社会人口结构的老龄化,老年人占人口的比率较前增加。
中年以后,伴随年龄的增长,细胞与组织结构逐渐老化,器官功能及其贮备功能降低,外科手术并发症率与死亡率增加。
自然人群的老年人有5%~12%存在营养不良。老年病人营养不良的发生率国内尚无确切数据,但据国外文献报告,患慢性疾病需家庭护理的老年人,营养不良的发生率高达52%~85%,37%者有低蛋白血症。
具有营养不良的老年人,更增加了手术及术后并发症的危险性,组织修复延缓,术后康复时间延长。围手术期营养支持能使上述情况得到改善。
本节简介老年病人的营养状况评定及肠外营养支持的特点。
一、老年病人营养状况的评定
(一)人体测量数据不能客观反映老年人营养状况
老年人身高、体重及机体结构发生改变。中年以后,随着年龄增长,身高每20年降低4.2cm;皮下脂肪和内脏器官间脂肪组织增加;瘦肉组织群(LBM)减少。这些改变,导致皮下脂肪与总体重比、肌肉总重量与体重比以及身高体重比均发生变化,故常用于评定营养状况的人体测量数据,如理想体重、三头肌皮褶厚度百分数(TSF%)、上臂肌肉周径及肌酐——身高指数(CHI%)等均不能客观反映老年人营养状况。
(二)老年人内脏蛋白测定值偏低
老年人内脏蛋白测定值如血清白蛋白及转铁蛋白,较中、青年偏低,临床中在分析这些数据时要考虑到年龄的影响因素。老年人反映内脏蛋白状态的免疫功能测定也有变化,如总淋巴计数(TLC)较中、青年低,迟发性皮肤超敏反应(Delayed skin hypersensitive test,DSH)正常老年人可为阴性。
(三)老年人营养不良的判定
鉴于人体测量及内脏蛋白测定均不能较客观地反映老年人的营养状况,致使老年人营养不良的判定有一定困难,较为可靠的是对病人进行动态比较或根据多个指标综合判定。美国(2026年)所公布的“老年人营养不良筛选指标”可作为临床判定的参考:①近期体重明显减轻(作者注:3个月内下降10%以上)。②与同等身高者相比,体重减少或增加20%。③血清白蛋白<35g/L。④(某一或某几个器官)功能明显改变。⑤食量过少或过多。⑥实验室检查证实存在导致营养不良的其他相关性疾病。显然,在这些筛选指标中,“营养不良”的概念包括了“营养过度”。
二、老年病人肠外营养支持的特点
(一)输液容量
正常成人水分占体重60%。进入老年期后,体内之水分逐渐降至体重的55%。水分减少是由于细胞内液减少及细胞总数减少,其次与脂肪占总体之比率增加有关。老年人水分减少,使其对水平衡调节能力下降,输液不足易引起脱水,输液过多易导致超载。
基于老年人总水量及其分布的改变,肠外营养支持时输液的“日需量”(即不包括“已缺失量”及“额外丧失量”),应较同等体重的中、青年减少20%~30%。尿量是衡量输液量是否适当的最简便指标;在全身状况稳定时,老年人每h的尿毫升数应等于体重千克数。例如体重50千克老年人,每小时理想尿量为50m L。
(二)供热量
老年人基础代谢率低,基础能量消耗较成人少10%~20%。超标准体重按标准体重计算。应激状态仍以其基础能量消耗供能。
(三)糖
进入老年期后,对输注葡萄糖的耐受性逐渐降低,这与老年人组织对胰岛素敏感性下降,或胰岛功能早期反应减弱有关,使胰岛素分泌减少,分泌高峰后移。
老年人肠外营养时涉及葡萄糖供能方面应注意以下几点:①常规测定空腹血糖,以防遗漏糖代谢紊乱疾病。②空腹血糖即使正常者,亦应适当控制葡萄糖输注量。③营养液中葡萄糖浓度开始不要超过10%,待其适应后浓度可逐渐增加。④定期监测血糖。
(四)脂肪
老年人脂蛋白酶活性降低,对输注脂乳的清除能力下降,因此即使无脂质代谢障碍疾病,输注脂肪量不超过1.0~2.0g/(kg·d)。老年人高脂血症发生率高,应常规测定空腹血脂。
(五)蛋白质
老年人血中必需氨基酸水平低,创伤后血中精氨酸、蛋氨酸明显减少,表明老年人对蛋白质需要量增加。以营养支持为目的的供氮量应为0.13~0.16g/(kg·d)。对已存在低蛋白血症者,应适当补充白蛋白与血浆,但白蛋白输注量一次不能过多,以免组织间的水分过多地进入血管内而引起超载。
(六)其他
钾、镁、磷在细胞内液含量高,由于老年人细胞内液总量减少,因而对这些电解质的调节能力下降。Touitu测381例住院老年病人血清电解质,发现普遍存在低钾、低镁,营养支持时应注意发现与矫正这些电解质的失衡。
老年人常存在维生素缺乏症。
第十二节 胃肠外营养的全身并发症
胃肠外营养的全身并发症包括导管败血症及代谢并发症。随着TPN配方及输注技术的日益完善,这些并发症已很少发生,但仍应引起注意。
由穿刺、置导管等所引起的技术并发症本节不拟介绍,可参阅其他专业书。
一、导管败血症
胃肠外营养时,迄今仍约有3%~5%的病人发生与导管相关的败血症。导管败血症按其感染来源分原发性与继发性两种:原发性导管败血症的感染源来自导管本身,体内无其他感染源,拔除中心静脉导管后病情即可缓解;继发性导管败血症指细菌是由体内其他感染源传播至导管上,移除导管后不能缓解败血症病情,但如果导管未能拔除,仅对体内原发感染源进行治疗亦会无效。
导管败血症的发生,与下列因素有关:
(1)穿刺与置管过程无菌技术不严:如所使用的器械及局部皮肤的消毒及操作过程的无菌技术不严。
(2)营养液配置过程的污染。采用3L“全合一”营养袋有助于减少污染机会。
(3)利用TPN输液系统作输血、取血、加药及测静脉压等多种用途。
(4)导管无菌护理技术不严格,细菌经皮肤穿刺口及导管穿过体内的组织间隙进入静脉。
(5)细菌移位:长期TPN由于缺乏谷氨酰胺,导致肠屏障功能受损及细菌移位,可引起继发性导管败血症。
(6)体内存在其他感染灶。
在进行TPN期间,出现无其他原因可解释的寒战、发热,应想到导管败血症的可能,血培养阳性者可确诊。此时应拔除导管,并将导管尖端剪下一段作细菌培养,拔除导管后配合抗生素治疗可迅速好转。TPN暂时改为经周围静脉输注。拔除导管后败血症仍不好转,应想到继发性导管败血症的可能。
二、代谢并发症
(一)葡萄糖输入的并发症
1.高血糖症 如果机体不存在糖耐受性下降的原因,成人对输注葡萄糖的耐受量达0.5g/(kg· h),每日可耐受500g(20g/h)而不需给予外源性胰岛素。但如在应用TPN开始时,葡萄糖输注太快或浓度过高,由于内源性胰岛素未来得及适应性分泌增加,将产生高血糖。应激状态,由于胰高血糖素/胰岛素比率增加及胰岛素阻抗,对输注葡萄糖耐受量亦下降。
血糖值达15~20mmol/L,则引起渗透性利尿。血糖值达33mmol/L,将导致非酮症高血糖-高渗性昏迷(nonkecogenic hyperglycemia-hyperosmotic coma,NKHHC)。NKHHC是严重的并发症,其临床表现与处理见第三章第四节。
2.低血糖症 输入葡萄糖后,血中胰岛素水平随之渐升,并维持在较高水平,停输葡萄糖后6~24h内,血中胰岛素水平逐渐下降。若突然停止输注葡萄糖,此时胰岛素水平尚未明显下降,则会出现低血糖。因此,撤除TPN时,应逐渐减少糖量。
(二)与输入氨基酸有关的并发症
随着全蛋白模式L-结晶氨基酸的应用,此类并发症明显减少,但仍应注意以下并发症的产生。
1.氮质血症 输注氨基酸的目的是合成自身蛋白,当非蛋白热卡供应不足,或/和氨基酸输入相对过多,氨基酸则会作为供能基质而产生氮质血症。高渗性脱水或已存在肾功能障碍,亦是促进产生氮质血症的原因。
2.代谢性酸中毒 结晶氨基酸多用盐酸盐,加以临床上常用氯化钠、氯化钾等含氯制剂,如同时存在肾功能障碍,应警惕高氯性酸中毒的发生。当[CI-]高于116mmol/L,有酸中毒症状,即可建立诊断,根据血化结果,给予碳酸氢钠或乳酸钠。此外,过多输入阳离子氨基酸(如精氨酸、赖氨酸及组氨酸等),它们在同化为蛋白之前先释放H+,这些H+被体内HCO3-所缓冲,造成HCO-3减少,导致代谢性酸中毒。通过改用含醋酸盐的氨基酸及增加阴离子氨基酸(如天门冬酸、谷氨酸盐等)可消除之。
3.高血氨 当输注氨基酸过多或/及肝功能不良时,可有轻度血氨增高。纠正方法是给予0.5~1.0mmol/(kg·d)精氨酸。
4.谷氨酰胺缺乏 迄今所使用的氨基酸制剂均不含谷氨酰胺,长期TPN可引起谷胺酰胺缺乏,而致肠黏膜萎缩,肠屏障功能受损。
(三)脂肪代谢障碍
对禁饮食的病人,每周输注相当于10%脂肪乳剂500m L 2~3次,可防止必需脂肪酸缺乏。
血清脂肪廓清正常的病人,输注脂肪1.0~2.0g/(kg·d),10%脂肪乳剂500m L在4~6h输完是安全的。脂肪乳剂输注过多、过快则可发生高甘油三酯血症,已存在脂质代谢障碍的病人更易发生。临床表现为发热、急性胃肠道溃疡、微循环内泥状物形成,严重者发生血小板聚积、溶血或自身免疫性贫血,此称“脂肪超载综合征”。
文献报告,输注脂肪乳剂还可引起:①急性反应,如发热、寒战及背痛等,少见;②肺功能障碍,较轻微;③引起免疫抑制。
(四)肝脏和胆道并发症
1.肝脏异常 进行TPN 1~2周后,部分病人可有转氨酶、胆红质和碱性磷酸酶升高,肝活检显示肝细胞脂肪沉着,当停止TPN后逐渐恢复正常。当今认为,其发生机制与下列原因有关:①用葡萄糖单能源供能或供能过多;Jeejeehoy等观察表明,进行长期肠外营养的病人,由使用脂乳供能改用葡萄糖供能后,发生肝脂肪浸润,当重新使用脂乳后,肝组织结构恢复正常。有学者研究,若按213.4KJ(51kcal)/(kg·d)供能或非蛋白热卡(kcal):氮(g)超过150∶1,易发生肝功能障碍及肝细胞脂肪沉着。②必需脂肪酸(EFA)缺乏:长期输注不含EFA的营养液可促进肝脏中性脂肪沉积,国内有实验研究发现,TPN大鼠以300kcal/(kg·d)供应总能量,其中以LCT或MCT/LCT提供占非蛋白热卡30%的能量,不出现肝脂肪变性,而以葡萄糖单能源供应100%的能量,则出现脂肪变性。EFA使肝脏内脂肪合成减少,脂肪自肝脏运回血流增加,从而避免了肝脂肪变性。
2.胆囊结石 Roslyn、Pitt等报告,无论成人或儿童,长期TPN治疗,胆囊结石、胆泥及胆囊炎性病变发生机会增加,TPN持续3个月者,发生率在20%~30%以上。其发生与TPN引起胆囊长期处于松弛状态及胆汁滞留有关。回肠弥漫性病变(如回肠炎症性肠道疾病)或回肠大部分切除者施行TPN时,由胆汁酸肠肝循环破坏,胆囊结石发生率增加。
3.胆汁淤滞 长期TPN亦可导致胆汁淤滞,且常伴有肝细胞炎症反应。在TPN 3周内很少发生,随着TPN持续时间延长其发生的危险性增加,且婴幼儿特别易发病。肝活检显示非特异性的胆汁淤滞和炎症的混合表现,有时出现进行性肝纤维化。如果停止TPN,病情可好转;否则,将导致进行性肝损害。
虽然对长期TPN所引起的胆汁淤滞进行大量研究,但发病机制尚未明了。总的说来,与TPN营养液的组成所引起的肝脏代谢异常、胆汁成分的改变以及其排出有关。目前受到重视的是两种因素:①糖脂热卡比:葡萄糖所占比率过高易引起胆汁淤滞,双能源供能有助于预防胆汁淤滞。糖脂热卡比最大不要超过3∶1。②外源性氨基酸不合理使体内氨基酸谱失常:如所输氨基酸制剂中赖、苏氨基酸不足,因为赖、苏氨基酸是合成肉毒碱所必需,而肉毒碱在脂肪分解代谢中起重要作用:有人研究发现,静脉注射精氨酸,可使胆汁酸依赖型胆汁分泌减少32%,胆酸排量下降26%;若营养液中含防腐剂重硫酸钠时,色氨酸很不稳定,其转化产物对肝脏有毒性。
(五)电解质失衡及微量元素缺乏
实施TPN时,机体对某些电解质需要量相应增加,若补充不足,则可发生缺乏症,尤其要警惕低钾、低磷、低钙和低镁血症的发生。钾和磷与蛋白质合成和能量代谢密切相关,应注意补充。禁食超过1个月者,每天应补充微量元素制剂(Addamel)1支,以防微量元素缺乏症。
(周亚魁)
参 考 文 献
1 Beale RJ,Bryg DJ,Bihari DJ.Immunonutrition in the critically ill∶A systematic review of clinical outcome.Crit Care Med,1999,27∶2799
2 Compher C,Mullen JL,Barker CF.Nutritional support in renal failure.Surg Clin N Am,1991,71(3)∶597
3 Daly JM,Redmond HP,Lieberman MD,et al.Nutritional support of patients with cancer of the gastrointestinal tract.Surg Clin N Am,1991,71(3)∶523
4 Daly JM,Redmond HP,Gallagper H,et al.Perioperative nutrition in cancer patients,JPEN,1992,16(Suppl)∶100
5 Douglas W.Wilmore.21世纪的营养和代谢支持.中国临床营养杂志,2001,9(1)∶4
6 Harrison LE,Brennan MF.The role of total parenteral nutrition in the patient with cancer.Current Prob Surg,1995,10∶837
7 Ikuta K,Mishina Y,Nimura Y,et al.Effect of lipid emulsions for total parenteral nutrition on regeneration of the liver after partial hepatectomy in rats.Nutrition,1995,11∶365
8 Klimberg VS,McClellan JL,Rock L.Glutamin,cancer,and its therapy.Am J Surg,1996,171∶418
9 Latifi R,Killan RW.Dudrick SJ.Nutritional support in liver failure.Surg Clin N Am,1991,71(3)∶567
10 Mainous MR,Deitch EA.Nutrition and infection.Surg Clin N Am,1994,74(3)∶659
11 Moriwaki H,Tajika M,Miwa Y,et al.Nutritional pharmacotherapy of chronic liver disease∶from support of liver failure to prevention of liver cancer.JGastrenterol,2000,35(Suppl 12)∶13
12 Marchesini G,Bianchi G,Rossi B,et al.Nutritional treatment with branched-chain amino acids in advanced liver cirrhosis,J Gastroenterol,2000,35(Suppl 12)∶7
13 Patino JF,Pmiento SE,Vergara A,et al.Hypocaloric support in the critical ill[J].World J Surg.1999,23∶553
14 Senkal M,Zumtobel V,Bauer KH,et al.Outcome and cost-effectiveness of perioperative enteral immunonutrition in patients undergoing elective upper gastrointestinal tract surgery.Arch Surg,1999,134∶1309
15 Sabiston DC.Textbook of surgery∶The biological basis of modem surgical practice.fifteeth edition.W.B.Saunders Company,1999,137
16 Torosian MH.Stimulation of tumor growth by nutrition spport.JPEN,1992,16(Suppl)∶72
17 刘权焰,周亚魁,贺银成,等.不平衡氨基酸对肿瘤生长的影响.肠外与肠内营养,2001,8 (2)∶83
18 刘权焰,贺银成.周亚魁审校.氨基酸与肿瘤生长(文献综述).国外医学外科分册,2000,27 (3)∶158
19 刘铮,刘青,金学源.生态免疫营养剂应用于危重病人营养支持的理论.中国临床营养杂志,2001,9(4)∶251
20 李幼生.全肠外营养与肿瘤生长(文献综述).国外医学外科分册,1993,20(1)∶8
21 何桂珍,霍红梅.谷氨酰胺在肿瘤的代谢及应用.中国临床营养杂志,2000,8(4)∶274
22 周亚魁,曹军,陈纪伟,等.重症胰腺炎病人空肠营养支持的应用.腹部外科,2000,13(4)∶209
23 周亚魁,史海安,何跃明,等.重症胰腺炎肠外营养、肠内营养阶段性营养支持的研究.中华实验外科杂志,1999,16(1)∶50
24 周亚魁,史海安,何跃明,等.重症胰腺炎病人对静脉输注脂肪乳剂耐受性的临床研究.中华消化杂志,1999,19(1)∶35
25 周亚魁.肠外、肠内阶段性营养支持在腹部外科的应用.临床外科杂志,1998,6(2)∶65
26 周亚魁,史海安,何跃明.重症胰腺炎病人肠外、肠内阶段性营养支持的合理性.肠外与肠内营养,1998,5(2)∶86
27 吴国豪.免疫增强型肠内营养支持.中国临床营养杂志,2001,9(1)∶46
28 张忠涛,王宇.谷氨酰胺抗感染及氧化损伤作用机理研究进展.中国临床营养杂志,1994,2 (3)∶127
29 张栋林,王文治.脂肪在恶性肿瘤治疗中的作用.中国临床营养杂志,1995,3(2)∶69
30 郑扶民.肠内肠外营养治疗的并发症的发生及处理.中国临床营养杂志,1994,2(4)∶175
31 夏穗生.疑难普外科学.武汉∶湖北科学技术出版社,2001,147
32 顾倬云.肠内肠外营养的并发症.中国临床营养杂志,1994,2(1)∶28
33 顾倬云.多不饱和脂肪酸对机体免疫功能的影响.中国临床营养杂志,2000,8(4)∶251
34 蔡斌,江华,王秀荣,等.低热卡及低氮肠外营养对术后患者影响的随机对照研究的系统评价.中国临床营养杂志,2003,11(1)∶19
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。








