猪肉及其制品中弓形虫RT-LAMP快速检测技术的研究
陶斯悦 池 娜 章欢军 戚文烨 曲道峰 韩剑众
(浙江工商大学 食品与生物工程学院,浙江杭州310012)
[摘 要] 为提高猪肉及其制品中弓形虫(T.gondii)检出率,研究采用逆转录环介导等温扩增技术(RT-LAMP)建立一种快速、灵敏、特异的弓形虫检测方法。根据GenBank中弓形虫18S r RNA序列,设计6条RT-LAMP引物,优化反应体系条件,在Bst DNA聚合酶的作用下,65°C反应60min,加入SYBRgreen I后,肉眼观察及凝胶电泳分析。结果表明,该RT-LAMP检测体系特异性强,与隐孢子虫RNA等不发生交叉反应;敏感性高,为一般RTPCR方法的10倍。该方法具有简单、快速、低成本的特点,可用于猪肉及其制品弓形虫的快速检测。
[关键词] 弓形虫;RT-LAMP;18S r RNA;检测;猪肉及其制品
Development of Reverse Transcription Loop-mediated Isothermal Amplification(RT-LAMP)as a Diagnostic Tool of Toxoplasmagondii in Pork and its Products
Tao Siyue Chi Na Zhang Huanjun Qi Wenye Qu Daofeng Han Jianzhong
(College of Food Science and Biotechnology,Zhejianggongshang University,Hangzhou Zhejiang 310012,China)
Abstract:A fast,sensitive and specific reverse transcription loop-mediated isothermal amplification(RT-LAMP)method for the detection of Toxoplasmagondii(T.gondii)in pork and its products was developed.In this study,a conserved sequence of 18S r RNA of Toxoplasmagondii to design primers for RT-LAMP test was stndied.The amplication was able to finish in 60 min under isothermal condition at 65°C by employing a set of six primers.The assay showed higher sensitivity than RT-PCR using T.gondii RNA as template.The RT-LAMP assay was also assessed for specificity and was found to precisely discriminate between positive and negative test samples.Furthermore,the assay correctly detected T.gondii from contaminated pork and its products.This is the first report of a study which applied the RT-LAMP method to detect T.gondii from pork and its products.As RT-LAMP requires very basic instruments and the results can be obtained by visual observation,this technique provides a simple and reliable tool for inspecting food which are T.gondiicontaminated.
Key words:T.gondii;RT-LAMP;18S r RNA;detection;pork and its products
弓形虫病(Toxoplasmosis)是由刚地弓形虫(Toxoplasmagondii)引起的一种人畜共患病,它不仅给养猪业造成巨大损失,还严重威胁着食品卫生安全和人类健康。猪肉是人们生活中最主要的动物性食品来源,人群可通过食用携带弓形虫的猪肉、肝脏等而感染弓形虫病其高发严重威胁着人类健康,对公共食品安全造成极大危害。
环介导等温扩增(1oop-mediated isothermal amplification,LAMP)是由Notomi T等建立的一种新型核酸扩增技术,其原理是针对靶基因的8个区域设计6条特异性引物,利用链置换DNA聚合酶,在等温条件下进行自动循环的链置换核酸扩增反应,其产物鉴定可直接通过白色沉淀或荧光来进行判断。该技术具有特异性高、操作简便、反应迅速、成本低廉等优点,目前在一些病原微生物的检测中开始被广泛应用,但逆转录环介导等温扩增(RT-LAMP)应用于弓形虫检测尚未见报道。本研究基于弓形虫18S r RNA的特异性,结合RT-LAMP的快速、简便等优点,建立了简单、实用、方便的弓形虫RT-LAMP快速检测方法,从而为肉制品的安全检测提供有效的手段和研究工具,为动物源性食品安全的监控及政府决策提供系统、科学的资料与依据。
1. 材料和方法
1.1 材料
1.1.1 弓形虫RH株速殖子。
弓形虫RH株由朱兴权教授惠赠,经Vero细胞传代培养。
1.1.2 主要试剂及酶类。
Bst DNA Polymerase购自纽英伦生物技术(北京)有限公司;甜菜碱购自Sigma公司;DNA Marker、d NTP和限制性内切酶均购自TaKaRa公司;荧光染料SYBRgreen I购自Invitrogen公司;RNA酶抑制剂、反转录酶、TRNZol购自北京全式金生物科技公司。
1.2 方法
1.2.1 弓形虫RNA的提取。
取弓形虫悬液250μL,TRNZol 750μL加入到DEPC处理过的EP管内,混匀,冰上放置5min。4℃,12000 rpm离心15min,吸取上清液至新的EP管内,向上清液加入150μL的氯仿,剧烈震荡15s,冰上静置10min。4℃,12000 rpm离心15min,上层液转移至新的离心管中,加入等体积的异丙醇,混匀,-20℃放置1-2 h。4℃,12000 rpm离心15min,弃上清液,加入400μL 75%乙醇,颠倒清洗5min,4℃,5000 rpm离心5min,弃上清液,加入350μL 75%乙醇,颠倒数次,离心弃上清液,室温放置晾干。加入20μL的Rnase-free dd H 2 O,反复吹打,混匀,充分溶解RNA,-80℃保存备用。
1.2.2 弓形虫RT-LAMP引物的设计。
参照GenBank中登录的弓形虫18S r RNA基因序列,应用生物软件分析,并利用在线Primer Explorer 4.0软件在18S r RNA基因的特异区域筛选6条引物(外引物:F3/B3,内引物:B1P/FIP和环引物:LF/LB)。对设计的引物进行在线BLAST分析,确定其特异性,引物由上海生工生物工程服务有限公司合成。
1.2.3 反应体系的建立及条件优化。
应用设计的弓形虫18S r RNA RT-LAMP引物对提取的弓形虫RNA进行RT-LAMP扩增,并以弓形虫RNA为模版对反应体系进行优化,分别对Mg2+浓度、d NTPs浓度、反应温度、BST DNA聚合酶和反应时间进行优化,建立RTLAMP反应体系。将反应体系置于65℃水浴锅中作用1 h,80℃2min灭活Bst DNA聚合酶。向反应体系中直接加入SYBRgreenⅠ染料1μL,混匀后将反应管置于桌面上拍照并肉眼观察结果。取产物2μL加入0.2μL 10× Loading Buffer于1.0%琼脂糖凝胶上进行电泳,观察结果。
1.2.4 RT-LAMP扩增产物的酶切鉴定。
利用限制性内切酶HinfⅠ对RT-LAMP扩增产物进行酶切,15μL反应体系中加入各种试剂量如下:10×H buffer 1.5μL,HinfⅠ1.0μL,DNA 4.0μL,灭菌双蒸水8.5μL,混匀,置于37℃水浴锅中作用24 h,取产物5μL加入0.5 μL 10×Loading Buffer于1.0%琼脂糖凝胶上进行电泳,观察结果。
1.2.5 弓形虫18S r RNA RT-PCR检测方法的建立。
25μL RT-PCR反应体系为:10×PCR Bufer 2.5μL,d NTP 1.6μL,F3 0.4μL,B3 0.4μL,模板1μL,r Taq 0.15μL,剩余用dd H 2 O补平。RT-PCR程序:94℃3 min;94℃45 s、60℃90 s、72℃70 s,30个循环;72℃10 min。RTPCR产物琼脂糖凝胶电泳检测。
1.2.6 RT-LAMP检测方法的特异性检测。
为了鉴定RT-LAMP反应方法的特异性,采用弓形虫(T.gondii)、大肠杆菌(E.coli)、犬新孢子虫(Neospora caninum)、布氏锥虫(Trypanosoma brucei)、隐孢子虫(Cryptosporidium parvum)、犬弓首蛔虫(Toxocara canis)六种病原体的RNA作为待检样品,同时将DEPC水作为阴性对照。进行RT-LAMP的扩增,反应结束后分别取其2μL反应产物上样于1.0%琼脂糖凝胶电泳,观察结果。
1.2.7 RT-LAMP检测方法的灵敏性检测。
将获得的弓形虫RNA模板进行10倍梯度稀释(10-1-10-8),用所建立的RT-LAMP检测方法分别对其进行扩增,同时用RT-PCR方法进行比较。反应结束后取2μL反应产物上样于1.0%琼脂糖凝胶电泳,观察结果。
1.2.8 RT-LAMP检测方法的重复性和稳定性检测。
将连续传代F1、F2、F3的弓形虫细胞培养液提取的RNA分成两份,每份RNA进行2次重复RT-LAMP扩增检测,确定批内重复性和稳定性;将F1、F2、F3的弓形虫细胞培养液在不同时间2批次重复提取RNA,进行RT-LAMP扩增检测,确定批间重复性和稳定性。反应结束后取2μL反应产物上样于1.0%琼脂糖凝胶电泳,观察结果。
1.2.9 临床样品检测。
人工混入弓形虫悬液的猪肉、火腿、肉丸各1份;待检猪肉及其制品90份,由本实验室人员到菜市场、屠宰场以及养殖场采集。提取样品RNA,用建立的RT-LAMP方法进行扩增,同时采用RT-PCR方法进行比对,反应结束后取2 μL反应产物上样于1.0%琼脂糖凝胶电泳,对检测结果进行分析。
2. 结 果
2.1 RT-LAMP引物设计
选取的6条RT-LAMP特异性引物见表14-1,引物由上海生工生物工程有限公司合成,dd H2O溶解后分装,-20℃冰箱保存备用。
表14-1 RT-LAMP的引物序列
2.2 RT-LAMP反应体系的优化及建立
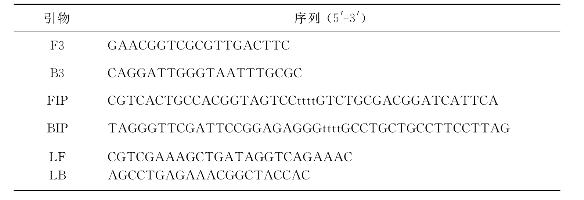
通过对Mg2+浓度、d NTPs浓度、反应温度、Bst DNA聚合酶和反应时间进行优化,确定最佳反应体系为:10×Bst DNA buffer 2.5μL,MgCl2(25 m M)2.0μL,d NTPs 6.0μL,RNA酶抑制剂0.5μL,B3引物0.5μL,F3引物0.5 μL,FIP引物2.5μL,BIP引物2.5μL,LF引物1.0μL,LB引物1.0μL,甜菜碱2.0μL,反转录酶1.0μL,Bst DNA聚合酶1.0μL,RNA提取物2.0μL,混匀,置于65℃水浴锅中作用1 h,80℃2min终止反应。SYBRgreenⅠ染料加入后,颜色变为绿色为阳性,橙色则为阴性(图14-1);经凝胶电泳后,有梯形条带为阳性,无条带则为阴性(图14-2)。

图14-1 RT-LAMP反应结束后加入SYBRgreenⅠ染料后结果
1:颜色呈绿色为阳性 2:颜色呈橙色为阴性
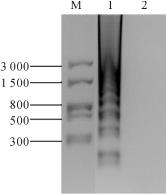
图14-2 RT-LAMP产物琼脂糖凝胶电泳图谱
M:Marker;1:阳性呈现梯形条带;2:阴性无条带
2.3 RT-LAMP扩增产物的酶切鉴定
用限制性内切酶HinfⅠ对RT-LAMP扩增产物进行酶切鉴定,取产物5 μL加入0.5μL 10×Loading Buffer于1.0%琼脂糖凝胶上进行电泳,出现约150 bp,300 bp的条带,与预计结果相同,如图14-3。
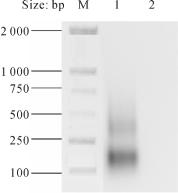
图14-3 RT-LAMP产物酶切鉴定(https://www.daowen.com)
M:DL2000DNA Marker:1:RT-LAMP酶切产物;2:阴性对照
2.4 RT-LAMP检测方法的特异性检测
以弓形虫、大肠杆菌、犬新孢子虫、布氏锥虫、隐孢子虫、犬弓首蛔虫进行RTLAMP扩增,从而实现该方法的特异性检测。从图14-4可见:泳道2—7未见任何条带,泳道1可见梯形条带。结果表明:我们建立的RT-LAMP方法只与弓形虫RNA发生特异性反应,而与其他病原体无反应,说明该方法具有良好的特异性。
图14-4 RT-LAMP检测方法的特异性
M:DNA Marker;1:弓形虫;2:大肠杆菌;3:犬新孢子虫;4:布氏锥虫;5:隐孢子虫;6:犬弓首蛔虫;7:阴性对照
2.5 RT-LAMP检测方法的灵敏性检测
将提取的弓形虫RNA进行连续10倍稀释(10-1—10-8),分别利用RT-PCR 和RT-LAMP进行检测。随着RNA浓度的降低,目的条带亮度逐渐变淡。RTPCR结果如图14-5所示,1—5泳道可见清晰的目的条带,6—9泳道未见到目的条带;RT-LAMP结果如图14-5所示,1—6泳道可见清晰的梯形条带,7—9泳道未出现清晰的梯形条带。试验结果表明:RT-LAMP比RT-PCR的灵敏度高10倍。

图14-5 RT-LAMP灵敏性检测
M:DNA Marker;1-8:弓形虫RNA10倍稀释;9:阳性对照
2.6 RT-LAMP检测方法重复性和稳定性的检测
不论批内还是批间所做的RT-LAMP检测结果无明显差异。说明本研究建立的RT-LAMP检测方法相对稳定,具有好的重复性与稳定性。
2.7 RT-LAMP用于临床样品检测
采用RT-LAMP检测试剂盒对人工混入弓形虫悬液的猪肉、火腿、肉丸进行检测,检测结果均呈阳性(图14-6),阴性对照未检出;使用RT-LAMP及RT-PCR对90临床份样品提取的RNA进行检测,结果表明两种方法阳性检出率的结果一致(表14-2),表明本实验建立的RT-LAMP检测试剂盒可以用于临床样品的检测。
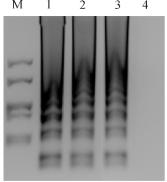
图14-6 RT-LAMP检测弓形虫猪肉及其制品
M:DNA Marker:1:混入弓形虫的猪肉;2:混入弓形虫的火腿;3:混入弓形虫的肉丸;4:阴性对照
表14-2 RT-LAMP与RT-PCR对临床采集的猪肉样品检测

3. 讨 论
猪肉是人们生活中最主要的动物性食物来源,因此弓形虫感染的猪及猪肉制品对公共卫生和公共食品安全构成极大的威胁。在美国,所有肉制品中猪肉被认为是人类弓形虫病的最大肉食性来源。弓形虫感染的猪通常没有明显症状,但其组织中可能含有弓形虫包囊,如果烹饪加工不当或者食用了未熟透的猪肉,就有可能引起人的感染。目前,弓形虫的检测主要依靠血清学、病原形态鉴定、分子生物学检测等方法。然而,这些检测方法都有不足之处,如:检测时间长,检测程序繁琐,工作量大,很难适应现代化食品安全快速检测的需要,严格的病原体检测是保障食品安全的重要环节,因此亟须建立一种操作简便、快速准确、灵敏度和特异性都较高的现代化检测弓形虫方法。
逆转录环介导等温扩增技术(Reverse Transcription Loop-Mediated Isothermal Amplification,RT-LAMP)是在LAMP技术基础上改进的一种新颖的RNA扩增方法。特点是针对靶基因的8个区域设计6种特异性引物,利用链置换DNA聚合酶和反转录酶在大约65℃恒温条件下保温1小时左右即可完成对RNA进行同步反转录及等温扩增,具有高特异性、高效性、快速、简便、成本低等特点,目前已被国内外学者应用到多种病原体的检测中,如马轮状病毒(ERV)、丙型肝炎病毒(HCV)、禽流感病毒(AIV)等,但尚未见到使用该技术检测弓形虫的报道。本研究所建立的RT-LAMP方法检测临床样品中弓形虫的结果表明,该方法具有灵敏度高,特异性强,检测程序简单快捷,不需要特殊仪器等优点,有望成为适合临床应用的新方法。
弓形虫核糖体RNA(18S r RNA)具有很好的种属特异性,而且其r RNA占细胞RNA总数的80%以上,以弓形虫18S r RNA为目的基金诊断肉制品中弓形虫可以提高检测方法的特异性及敏感性,本研究选取弓形虫18S r RNA的保守序列,应用在线软件Primer explorer V4设计了针对该序列保守区域的外引物、内引物及环引物,通过对反应体系、反应时间、灵敏度、特异性的优化,建立了一种针对弓形虫的RT-LAMP快速检测方法。该方法能特异地检测弓形虫,并且具有很高的灵敏度,是常规RT-PCR的10倍,且整个反应只需在水浴锅中60分钟即可完成,真正实现了无需贵重仪器的检测。并且,通过加入荧光染料SYBRgreenⅠ,实现了RT-LAMP技术的可视性。本研究过程还表明,RTLAMP检测技术无需单独的逆转录,只需一步即可完成对靶序列的扩增,没有核酸的变性复性过程;在等温条件下进行扩增,不仅节省时间和成本,更重要的是减少了RNA酶和扩增核酸的污染机会。
4. 结 论
本实验结果显示,针对弓形虫18S r RNA基因的特异区域设计引物,能够准确识别弓形虫的特异性片段,提高了该检测方法特异性。敏感性实验进一步证实该RT-LAMP方法效果良好,敏感性高于一般RT-PCR检测方法,能够准确鉴定弓形虫污染的猪肉及其制品。该方法成本低廉,仪器要求简单,耗时短,结果判定简单,特异性和灵敏度高,可满足临床检测的需要,从而为肉制品的安全检测提供有效的手段和研究工具,具有较好的应用前景。
[参考文献]
[1]崔君兆.弓形虫病研究九十年[J].实用寄生虫病杂志,2000,8(2):75-78.
[2]孔繁瑶.家畜寄生虫病学(第二版)[M].北京:中国农业大学出版社,1997.
[3]Furtado J M,Smith.Toxoplasmosis:aglobal threat[J].Jglob Infect Dis,2011,3(3):281-284.
[4]El-Nawawi F A,Tawfik.Methods for inactivation of Toxoplasmagondii cysts in meat and tissues of experimentally infected sheep[J].Foodborne Pathog Dis,2008,5(5):687-690.
[5]Lunden A,Uggla A.Infectivity of Toxoplasmagondii in mutton following curing,smoking,freezing or microwave cooking[J].Int J Food Microbiol,1992,15(3-4):357 -363.
[6]Qu DF,Yu HJ,Liu Z,et al.Ginsenoside Rg1 enhances immune response induced by recombinant Toxoplasmagondii SAG1 antigen[J].Vet Parasitol,2011,179(1-3):28 -34.
[7]Notomi T,Okayama H,Masubuchi H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Res,2000,28(12):E63.
[8]Nagamine K,Hase T,Notomi T.Accelerated reaction by loop-mediated isothermal amplification using loop primers[J].Mol Cell Probes,2002,16(3):223-229.
[9]Thekisoe,O.M.,Inoue,N.Evaluation of loop-mediated isothermal amplification (LAMP),PCR and parasitological tests for detection of Trypanosoma evansi in experimentally infected pigs[J].Vet Parasitol,2005,130(3-4):327-330.
[10]Curtis KA,Rudolph DL,Owen SM.Sequence-specific detection method for reverse transcription,loop-mediated isothermal amplification of HIV-1[J].J Med Virol.2009,81(6):966-72.
[11]Zhang XJ,Sun Y,Liu L,et al.Validation of a loop-mediated isothermal amplification assay for visualised detection of wild-type classical swine fever virus[J].J Virol Methods,2010,167(1):74-8.
[12]Iwamoto T,Sonobe T,Havashi K.Loop-mediated isothermal amplification for direct detection of mycobacterium tuberculosis complex M.avium and M.intracellulare in sputum samples[J].Clin Mierobiol,2003,41(6):2616-2622.
[13]Dubey J P,Thyer D W.Killing of different strains of Toxoplasmagondii tissue cysts by irradiation under difined conditions[J].J Parasitol,1994,80(5):764-767.
[14]Gamble H R.Parasites associated with pork and pork products[J].Rev Sci Tech,1997,16(2):496-506.
[15]Jitender P,Dubey J P.The History of Toxoplasmagondii—The First 100 Years[J].J Eukaryot Microbiol,2008,55(6):467-475.
[16]Vostalova E,Literak I,Pavlasek I,et al.Prevalence of Toxoplasmagondii in finishing pigs in a large-scale farm in the Czech Republic[J].Acta Vet Brno,2000,69(3):209-212.
[17]Dubey JP,Hill DE,Jones JL,et al.Prevalence of viable Toxoplasmagondii in beef,chicken,and pork from retail meat stores in the United States:risk assessment to consumers[J].J Parasitol,2005,91(5):1082-1093.
[18]Gutierrez J,O’Donovan J,Proctor A,et al.Application of quantitative real-time polymerase chain reaction for the diagnosis of toxoplasmosis and enzootic abortion of ewes[J].J Vet Diagn Invest,2012,24(5):846-54.
[19]Rengifo-Herrera C,Ortega-Mora LM,Alvarez-Garcíag,et al.Detection of Toxoplasmagondii antibodies in Antarctic pinnipeds.Vet Parasitol[J].2012,190(1-2):259-62.
[20]李巍,李宁,袁万哲,等.牛轮状病毒RT-LAMP检测方法的建立[J].动物医学进展.2012,33(5):39-43.
[21]汪一帆,郭潮潭.环介导等温扩增技术及在感染病诊断中的应用[J].中国卫生检验杂志,2008,18(9):1933-1935.
[22]Manabu N,Hiroshi I,Koji T,et al.Detection of equine rotavirus by reverse transcription loop-mediated isotherm al am plification(RT-LAMP)[J].Virology,2010,72(6):823-826.
[23]Hong TC,Mai QL,Cuong DV,et al.Development and evaluation of a novel Loopmediated isothermal amplification method for rapid detection of severe acute respiratory syndrome Coronavirus[J].J Clin Microbiol,2004,42(5):1956-1961.
[24]Horibe D,Ochiai T,Shimada H,et al.Rapid detection of metastasis ofgastric cancer using reverse transcription loop-mediated isothermal amplification[J].Int J Cancer,2007,120(5):1063-1069.
[25]píndola S,Vilches-Flores A,Hernández-Echeagaray E.3-Nitropropionic acid modifies neurotrophin mRNA expression in the mouse striatum:18S-rRNA is a reliable controlgene for studies of the striatum[J].Neurosci Bull,2012,28(5):517-31.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




