苦荞麦皮中提取抗氧化活性肽的研究
刘柯岑 黄惠灵 许 钢
(浙江工商大学 食品与生物工程学院,浙江杭州310012)
[摘 要] 以苦荞麦皮为原料提取苦荞麦皮中的活性肽,采用正交实验研究了影响苦荞麦皮蛋白酶解的主要因素及适宜酶解条件。通过方差分析和显著性检验结果表明:碱性水解蛋白酶提取苦荞麦皮活性肽以羟自由基清除率为检验量时的最佳提取条件为:温度60℃>时间2h>酶量0.5g,在此条件下羟自由基清除率可达81.1%;碱性水解蛋白酶提取苦荞麦皮活性肽以超氧自由基清除率为检验量时的最佳提取条件为:温度60℃>酶量0.6g>时间2h,在此条件下超氧自由基清除率可达96.14%。碱性水解蛋白酶提取苦荞麦皮中活性肽的最佳提取条件为:酶量0.4g>时间2.5h>温度55℃,在此条件下活性肽提取的量最大。
[关键词] 苦荞麦皮;活性肽;生理功能;抗氧化;酶解
Research on Antioxidant Bioactive Peptides draw from Tartary buckwheat skin
Liu Kecen Huang Huiling Xugang
(College of Food Science and Biotechnology,Zhejianggongshang University,Hangzhou Zhejiang 310012,China)
Abstract:Through the analysis of variance and significance test results show that,The best extraction conditions when alkaline hydrolysis protease extracting buckwheat skin Bioactive Peptides with hydroxyl radical clearance for inspection was temperature 60℃>time 2h>enzyme quantity 0.5g.On this condition,rate at hydroxyl radical elimination can reach 81.1%;The best extraction conditions when alkaline hydrolysis protease extracting buckwheat skin Bioactive Peptides with superoxide radical clearance for inspection was temperature 60℃>enzyme quantity 0.6g>time 2h. On this condition,rate at superoxide radical elimination can reach 96.14%;The best extraction conditions when alkaline hydrolysis protease extracting buckwheat skin Bioactive Peptides with flavone was enzyme quantity 0.4g>time 2.5h>temperature 55℃.On this condition,Bioactive Peptides extract the largest amount.
Key words:Buckwheat skin;Activity peptides;Physiological functions;Antioxidation;Enzymolysis
1. 引 言
苦荞麦又称为三角麦、乌麦、花荞,是蓼科荞麦属作物。苦荞麦皮粉经蛋白酶水解后生成的多肽和氨基酸的混合物,更易被人体消化吸收。近年国内外科研人员不断发现由苦荞麦粉水解制得的水解产物具有降低血液胆固醇、降血压、抑制有害物的吸收、抑制乳腺癌和大肠癌的发生、抑制脂肪蓄积、抑制胆结石的形成、抗氧化以及抗衰老等功能。
多肽是由蛋白质中天然氨基酸以不同组成和排列方式构成的,从二肽到复杂的线性或环性结构的不同肽类的总称。其中可调节生物体生理功能的多肽称为功能肽或生物活性肽(bioactive peptidess)。它是蛋白质经过特征酶或生物降解后产生的具有显著生物学活性,且由数个至数十个氨基酸组成的肽类混合物,即蛋白水解产物(protein hydrolysates)。生物活性肽是源于蛋白质的多功能化合物,多样化且来源充足,具有多种人体代谢和生理调节功能,如易消化吸收、促进免疫、激素调节、抗菌、抗病毒、降血压、降血脂等功能。迄今为止,人们已从人体、动物和植物等生物体中提取和合成了各种生理活性的多肽。
本试验旨在尽可能从水溶性蛋白中得到高含量的生物活性肽,找到最适合的水解条件,为苦荞麦的进一步研究提供试验方法与基础。
2. 材料与方法
2.1 实验材料、化学试剂与仪器
2.1.1 实验材料。
苦荞麦皮粉:由浙江工商大学食品实验室提供,经凯氏定氮测定其蛋白质含量为2.39%。
碱性水解蛋白酶(Alcalase):购自诺维信中国生物技术有限公司。
2.1.2 主要仪器。
表7-1 主要仪器

2.1.3 主要试剂。
碳酸钠、氢氧化钠、柠檬酸、L-酪氨酸、磷酸氢二钠、磷酸二氢钠缓冲溶液、硫酸铜溶液、细胞色素C、双氧水、无水乙醇、三氯乙酸、芦丁溶液、亚硝酸钠、硝酸铝(以上所用试剂均为分析纯)。
维生素B2、甲硫氨酸、氮蓝四唑(NBT)、Folin-酚试剂、茚三酮显示剂、考马斯亮蓝G-250、甘氨酸、牛血清蛋白(以上均为生化试剂)。
2.2 苦荞麦皮活性肽提取
2.2.1 苦荞麦皮活性肽提取途径。
苦荞麦皮粉→溶解→热变性处理(80℃,30min)→调pH至碱性(11左右)→酶解→灭酶(沸水浴10min)→调pH至4.5→离心(3000rpm,25min)→取上清液(提取液)。
2.2.2 苦荞麦皮酶解反应的正交实验设计。
在探索试验结果的基础上得到适合碱性水解蛋白酶酶解反应的相关参数,然后在此基础上对苦荞麦皮粉酶解反应的正交实验进行设计。实验因素分别是水解温度℃(A)、酶量g(B)和反应时间h(C)为条件,进行荞麦活性肽的羟自由基清除率、氧自由基清除率以及活性肽含量的三因素三水平的正交实验,如表7-2所示。
表7-2 碱性蛋白酶酶解反应正交实验因素水平表L9(33)

2.3 苦荞麦皮酶解液的活性肽提取含量测定方法(以蛋白质含量计)
2.3.1 活性肽含量的测定(半微量凯氏定氮法)。
2.3.1.1 实验原理。
样品与浓硫酸共热时,有机物被破坏,其中的碳和氢被氧化成二氧化碳和水逸出,而氮转变为氨再与硫酸结合成硫酸铵留在消化液中。硫酸铵用氢氧化钠中和生成氢氧化铵,加热又分解成氨,经硼酸吸收后用标准酸液滴定,根据标准酸液的消耗量计算总氮量,再乘以换算系数,即蛋白质含量。
2.3.1.2 结果计算。
蛋白质含量的计算公式:
![]()
式中:X—样品中蛋白质的含量,%;
V 1—样品中消耗盐酸标准液的体积,%;
V 2—试剂空白消耗盐酸标准液的体积,%;
C—盐酸标准液的浓度,mol/L;
0.014—1mol/L盐酸标准液1mL相当于氮的克数;
F—荞麦皮为5.83;
m—样品的质量,g或mL。
2.3.1.3 苦荞麦皮总蛋白质的含量测定:凯氏定氮法。
2.3.2 羟自由基清除率的测定。
在生理浓度Cu2+存在下,用维生素C作为还原剂,能与中间生成的H 2 O2反应,使Cu2+还原为Cu+,生成·OH反应机理见图7-1。

图7-1
首先,
![]()
接着,Cu+与维生素C中间产生的H 2 O2反应(https://www.daowen.com)
![]()
根据基自由基能使还原型细胞色素C[cyt C(Ⅱ)]氧化的原理
![]()
推测·OH自由基同样能使cyt·C(Ⅱ)转化为氧化型(Ⅲ)
![]()
还原型细胞色素C(Ⅱ)呈浅红色,而氧化型呈浅黄色。前者在550nm处有尖锐吸收峰,而后者不明显,因此,可用此比色分析。通过测定还原细胞色素C(Ⅱ)含量变化了解·OH的生成。
在维生素C Cu2+-H2O2体系中,Vc(Ⅱ)可能与O2缓慢反应生成H2O2,H2 O2在与被维生素C还原了的Cu+反应生成·OH,一般这一系列的反应需在25℃下90min才进行完毕。经过多次试验和大胆改进,本实验在反应液中加入H 2 O2后马上测定,使Vc与O2缓慢生成H 2 O2这一反应提前完成,这样就大大缩短了反应的时间,而且并不影响试验结果。
将细胞色素C,维生素C,pH7.4的PBS按一定比例配成6mL反应液。用紫外分光度计在550nm处测得吸光度值为A,不改变反应液中细胞色素C的维生素C的浓度,再在反应液中加入H2O2和CuSO4,宏观可见反应体系从浅红色转变为浅黄色,在550nm处测得吸光值为A1,A-A1表示·OH生成的量,在反应液中加入麦叶提取物后消除自由基,在550nm测得吸光度值为A2,A-A2表示反应体系中最后剩余·OH自由基的含量,则清除率可计算为:
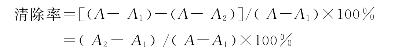
2.3.2.1 苦荞麦皮酶解液羟自由基清除率的测定。
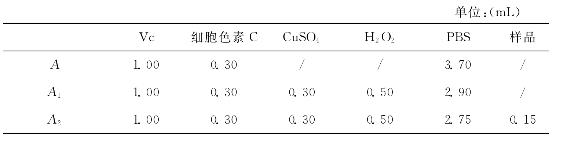
如表7-3所示添加各试剂于10mL离心管中,以pH=7.4的PBS为空白,于550nm波长处测定吸光值。
表7-3 自由基清除率测定试剂用量表
2.3.2.2 结果计算。
按下列公式计算羟自由基清除率:
![]()
将实验重复三次,求得清除率的平均值。
2.3.3 超氧自由基O2-·清除率的测定。
实验原理是当甲硫氨酸作用于维生素B2时可产生超氧离子自由基O2-·,O2-·可还原氮蓝四唑(NBT),使之转化为CN4 H 4,而黄酮及活性多糖类化合物可以抑制该反应,故可依据抑制率的高低来研究苦荞麦皮提取物对O2-·的清除效果。
2.3.3.1 苦荞麦皮酶解液超氧自由基清除率的测定。
如表7-4所示配制5mL试样,反应在装有一支30W的节能日光灯,四周衬有铝箔的暗箱中进行,调节反应物离灯的距离。其中,维生素B2的浓度为1.5× 10-5 mol/L,甲硫氨酸浓度为2×10-2 mol/L,NBT浓度为5.1×10-3 mol/L,磷酸缓冲液(PBS)浓度为5×10-2 mol/L,pH=7.5。在560nm波长下测得其吸光度为A,可表示O2-·的含量;加入样品后能清除O2-·来抑制NBT的还原,测得此时的吸光度为A 1;A-A 1表示O2-·的减少量。
表7-4 超氧自由基清除率测定试剂用量表

2.3.3.2 结果计算。
按下列公式计算超氧自由基清除率:
超氧自由基清除率(%)=(A-A 1)/A×100%
将实验重复三次,求得清除率的平均值。
3. 结果与讨论
3.1 苦荞麦皮酶解反应的正交实验结果
按2.2.2荞麦粉酶解反应的正交试验表进行正交试验,分别对其羟自由基清除率(%)、超氧自由基清除率(%)以及活性肽含量进行测定,实验结果如表7-5所示。
表7-5 苦荞麦皮酶解反应的正交试验结果

3.2 苦荞麦皮酶解反应的正交实验结果与方差分析
为了确定显著性因子,我们对表7-5实验结果做方差分析及显著性检验,结果如表7-6所示。
表7-6 方差分析及显著性检验
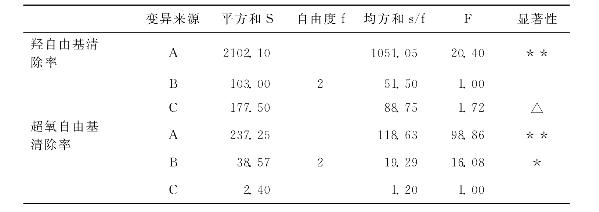
注:F0.01(2,2)=99,F0.05(2,2)=19,F0.1(2,2)=9,F0.2(2,2)=4,F0.25(2,2)=3。表中**和*分别表示0.05<p<0.1和p<0.05即有极显著性和显著性统计学意义;△则表示没有显著性统计学意义。
从表7-6可知,羟自由基清除率测定的实验中3种因素对实验结果影响的大小依次为A>C>B,其中A有极显著影响,C的影响较显著,而B的影响不显著。
超氧自由基清除率测定实验中3种因素对实验结果的影响大小依次为A>B>C,其中因素A温度具有极显著性影响,因素B酶量有显著性影响,而因素C时间则影响不显著。
4. 结 论
通过以反应时的水解温度(℃)、酶量(g)和反应时间(h)为条件的三因素三水平正交实验,本次实验可以得到以下结论:
碱性蛋白酶提取苦荞麦皮活性肽使其活性肽含量最高的条件为:A3B3C3,即温度60℃、酶量0.6g、时间3h,在此条件下的活性肽含量高达(1.66±0.07)×103μg/mL。
碱性水解蛋白酶提取苦荞麦皮活性肽使其羟自由基清除率最高的条件为:A 3 B2 C1,即温度60℃、酶量0.5g、时间2h,极差值反映出影响苦荞麦皮活性肽羟自由基清除率的各因素的排列顺序为温度>时间>酶量,在此条件下的羟自由基清除率高达81.1%。
碱性水解蛋白酶提取苦荞麦皮活性肽使其超氧自由基清除率最高的条件为:A 3 B3 C1,即温度60℃、酶量0.6g、时间2h,极差值反映出影响苦荞麦皮活性肽超氧自由基清除率的各因素的排列顺序为温度>酶量>时间,在此条件下的羟自由基清除率高达96.14%。
[参考文献]
[1]刘领渭.中国荞麦深加工的探索[J].西北农林科技大学学报:自然科学版,2000(9):30.
[2]Kayashita.Consumption of buckwheat protein lowers plasma cholesterol and raises fecal neutral sterols in cholesterol of its low digestibility[J].The Journal of Nutrition,1997 (127):1395-1400.
[3]冯怀蓉,张慧涛.多肽简介及应用[J].新疆农业科学,2002,39(1):38-39.
[4]陈新.酶解玉米蛋白生产生物活性多肽的研究现状及开发趋势[J].食品科学,2004,25 (7):202-205.
[5]扬永翔.食品中抗高血压多肽的发展现状[J].食品工业,1999(1):9-17.
[6]郑用熙编著.分析化学中的数理统计方法[M].北京:科学出版社,1986.
[7]Clemente A.Enzymatic Protein Hydrolysates in Human Nutrition[J].Trends Food Sci Technol,2000(11):254-262.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






