一、实验目的
①学习原子吸收光谱法的基本原理;
②了解原子吸收分光光度计的基本结构及其使用方法;
③掌握应用标准曲线法测定自来水中钙、镁的含量。
二、实验原理
在使用锐线光源条件下,基态原子蒸气对共振线的吸收符合朗伯-比尔定律。 在试样原子化时,火焰温度低于3 000 K 时,对大多数元素来说,原子蒸气中基态原子的数目实际上接近原子总数。 在固定的实验条件下,待测元素的原子总数与该元素在试样中的浓度c 成正比,可以表示为
A = K′c
就是进行原子吸收定量分析的依据。
原子吸收定量分析常用的方法有标准曲线法、标准加入法、稀释法和内标法。 对组成简单的试样,用标准曲线法进行定量分析较方便。
三、仪器与试剂
1)仪器
原子吸收分光光度计(AA800,美国PE 公司);钙、镁空心阴极灯;无油空气压缩机或空气钢瓶。
2)试剂与材料
乙炔瓶;基准碳酸钙、氧化镁、盐酸均为分析纯;超纯水。
3)样品
自来水。
四、实验步骤
1)系列标准溶液的配制
钙标准溶液:准确称取2.498 0 g 于110 ℃干燥的基准CaCO3,加入100 mL 去离子水,滴加少量(1 +1)HCl 使其溶解。 低温电炉上加热至沸,赶尽CO2,用去离子水定容至1 000 mL,即为1 000 μg/mL 的钙储备液。 吸取10 mL 钙的储备液于100 mL 容量瓶中,用去离子水稀至刻度,即为100 μg/mL 钙标准使用液。(https://www.daowen.com)
镁标准溶液:准确称取0.250 0 g 于100 mL 烧杯中,盖上表面皿,滴加5 mL 1 mol/L HCl溶液溶解,然后把溶液转移到250 mL 容量瓶中,用水稀释至刻度,摇匀备用,即为1 000 μg/mL的镁储备液。 准确吸取5 mL 标准储备液于100 mL 容量瓶中,用水稀释至刻度,摇匀备用,即为50 μg/mL 镁标准使用液。
用5 mL 移液管分别吸取0,1.00,2.00,3.00,4.00,5.00 mL 0.100 mg/mL 钙标准溶液于6个50 mL 容量瓶中,再用5 mL 移液管分别吸取0,1.00,2.00,3.00,4.00,5.00 mL 0.005 mg/mL镁标准溶液于上述6 个50 mL 容量瓶中,分别加入2.5 mL(1 +1) HCl,用蒸馏水稀释至刻度,摇匀。 系列标准溶液分别含钙0,2.00,4.00,6.00,8.00,10.00 μg/mL,含镁0,0.10,0.20,0.30,0.40,0.50 μg/mL。
选择上述工作参数调整仪器,测量并记录标准系列的吸光度。
2)实验条件设置
实验条件设置如表3-3 所示。
表3-3 实验条件
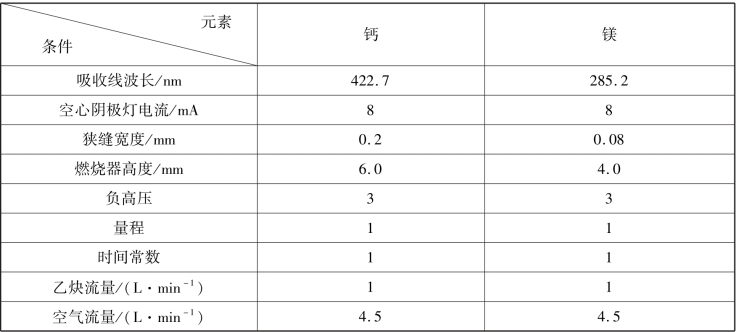
实验条件应根据仪器具体情况而定,上述条件仅供参考。
3)水样的测定
用5 mL 移液管吸取自来水样5.00 mL 于50 mL 容量瓶中,加入2.5 mL (1 +1) HCl,用蒸馏水稀释至刻度,摇匀。 安装钙空心阴极灯,参照上述测量条件测定钙的吸光度。 安装镁空心阴极灯,参照上述测量条件测定镁的吸光度。
五、注意事项
试样的吸光度应在标准曲线的线性范围之内并尽量靠近中部,否则须改变取样的体积以满足上述条件。
六、数据处理
用Origin 作图程序绘制钙和镁的标准曲线,由未知试剂的吸光度求出自来水中钙、镁的含量(μg/mL)。
七、思考题
①试述标准曲线的特点及适用范围。
②如果试样成分比较复杂,应该怎样进行测定?
③比较原子吸收光谱法和原子发射光谱法在样品分析过程中各有哪些优缺点。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。








