6.4.3.1 实验过程
这里,选用取自位于黄河中上游某水电站坝址“红层”岩样作为进行室内实验模拟的固相物质。其中,1 号岩样为粘土质砂岩及页岩互层,具有区内典型的软弱夹层的岩性特征,而2号岩样则为薄层砂岩;试验前,这2个岩样的主要化学成分及其相对含量见表6.4.8。考虑到坝前库水是蓄水条件下区内地下水的主要补给源,故选用该水电站坝前库水作为进行该实验模拟的液相物质,其主要水质特征如表6.4.9 所示。
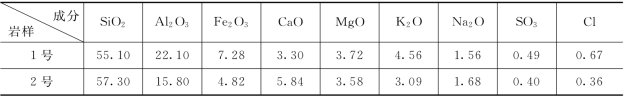
表6.4.9 坝前库水的主要水质特征
注 表中TDS 值的单位为“g/L”,余除pH值外为“mg/L”。
上述实验是在开放环境下,固相与液相间以M∶V=60.0g∶900ml比例在反应玻璃器皿中进行。实验过程持续时间20d,一定间隔时段从反应体系中抽取25ml水溶液进行常规离子浓度、pH值以及TDS 值等指标的测定,同时往反应体系中加入等体积的蒸馏水进行总体积补偿,以保持实验过程中水溶液体积恒定,对各项指标的测量值则采用质量平衡法进行修正。
由表6.4.8及表6.4.9 可见,在采集的固—液相试样间存在着化学不平衡,标志着之间一经接触则非平衡、非对称的地球化学过程可自发进行。显然,随着上述实验过程的持续进行,岩样中的化学成分将以不同形式(或以离子态或以化合物态)不断迁移到水溶液中,从而导致水溶液质量随反应时间的动态变化,而岩样本身也由于不断失去组分而在结构和性态上发生变化。
6.4.3.2 模拟结果分析
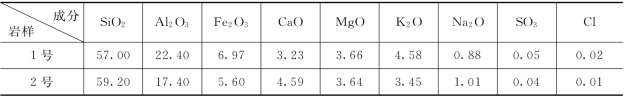
随着水—岩作用实验的进行,岩样形态发生了很大的变化;其化学成分(见表6.4.10)同实验前(表6.4.8)相比较,也发生了一些变化。前者反映为由实验前的块体崩解为相对松散的比表面积较大的若干个矿物集合体;后者反映在:①Si/Al的摩尔比值的变化;②CaO、Na2O、SO3、Cl等组分含量的变化,即比实验前均有所减少,其中后2种组分含量的减小幅度最大,此与这2种组分的较大溶解度有关。另外,需要指出的是,在上述实验过程中,发现了水溶液中出现了絮状物质,并最终沉淀在固相介质表面。此现象在1 号岩样反应体系中反映更甚。
表6.4.10 实验后岩样化学成分统计 单位:%
在实验过程中,伴随着岩样组分的变化,水溶液的组分及其含量也发生了相应的变化。
图6.4.7为上述实验过程水溶液中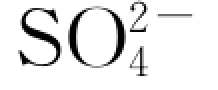 随时间的变化曲线。反映,该c—t 曲线呈抛物线型,表明岩样中相应物质(硫酸盐)的溶解速率在最初一段时间内较大,即呈指数增大,之后逐渐趋于平稳。其中,1 号岩样反应体系中,
随时间的变化曲线。反映,该c—t 曲线呈抛物线型,表明岩样中相应物质(硫酸盐)的溶解速率在最初一段时间内较大,即呈指数增大,之后逐渐趋于平稳。其中,1 号岩样反应体系中,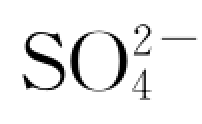 浓度上升速率仅
浓度上升速率仅
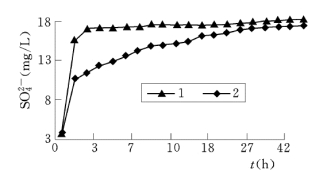
图6.4.7 实验中水溶液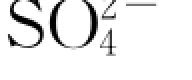 离子浓度随反应时间的演化
离子浓度随反应时间的演化
在实验第1d内比2号岩样反应体系大,并且溶解的绝对量也要多;而在随后的时段中,2号岩样反应体系中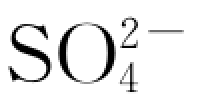 浓度上升速率要大于1 号岩样反应体系。对此,可分别用如下非线性方程进行拟合(R 为相关系数)。
浓度上升速率要大于1 号岩样反应体系。对此,可分别用如下非线性方程进行拟合(R 为相关系数)。
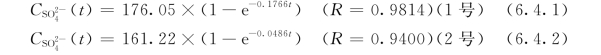
根据图6.4.7可知,岩样中硫酸盐类矿物(如石膏)的溶解具有非线性溶解行为(non linerdissolutionbehavior)。事实上,这种现象在矿物的室内溶解实验中具有普遍性。对于它的形成可能有以下原因:①实验样品在制样过程中因机械破碎产生并覆盖于矿物表面的盐类亚微米粒子(submicron particles)、应变位、裂隙及其他结构性变形位置的溶解;②矿物开始溶解后不久,其次生相(secondaryphase)开始生成并发生沉淀(岳梅等,2004)。当溶解与沉淀达到平衡时,溶解趋于稳定。另外,复杂的硫酸盐成分也可能导致其溶解呈非线性行为。岩样中的硫酸盐类虽然大多为石膏(CaSO4·2H2O),但也不排除包括芒硝(NaSO4·10H2O)等其他硫酸盐杂质成分。相同条件下,由于芒硝的溶解性大于石膏,这样即使岩样中所含的芒硝的相对含量很低,也可能导致实验初期液相中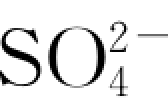 浓度的急剧增长。
浓度的急剧增长。
尽管岩样中所含的硫酸盐类可能不是均相物质,但其溶解时有一个共同的特点,即固相中每溶解1mol的硫酸盐类物质,液相中相应地增加1mol的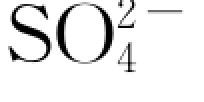 。这样,就可以建立硫酸盐类溶解的动力学方程,并以液相中
。这样,就可以建立硫酸盐类溶解的动力学方程,并以液相中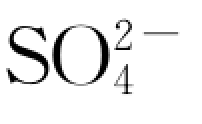 浓度增长的速率作为其表观反应速率。即(https://www.daowen.com)
浓度增长的速率作为其表观反应速率。即(https://www.daowen.com)
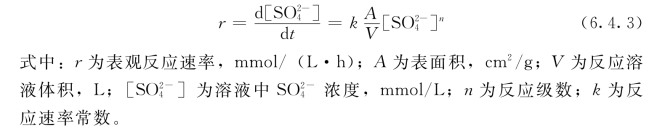
实验中保持参与反应的水溶液体积V 不变,这样可将A/V 与k 合并为k′,后者称为表观速率常数。则式(6.4.3)具有如下形式:
![]()
显然,由于岩样中参与反应的矿物(石膏)因粒径的变化以致其表面积A亦发生了相应的变化,因此上述k′仅具有平均意义。
关于确定速率方程的常用方法有积分法、微分法以及半衰期法等(江棂等,2006)。这些方法都必须使用一组或多组反应物浓度随反应时间变化的实验数据。这里,采用积分法中的作图尝试法来求解。经用此方法对实验数据进行分析,发现ln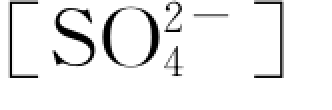 与反应时间t 之间存在良好的线性关系,见图6.4.8。
与反应时间t 之间存在良好的线性关系,见图6.4.8。
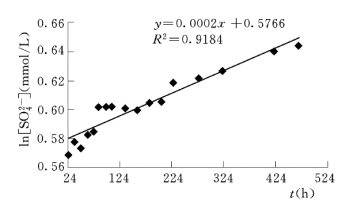
图6.4.8 1 号岩样反应体系水溶液中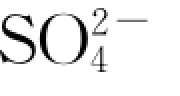
浓度与时间t之拟合曲线
根据该图建立的ln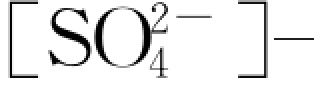 —t之回归方程,得其斜率为0.0002,即为表观速率常数k′值,相应的反应级数n为1。这样,可得到1 号岩样中硫酸盐矿物—水间反应的化学动力学速率方程
—t之回归方程,得其斜率为0.0002,即为表观速率常数k′值,相应的反应级数n为1。这样,可得到1 号岩样中硫酸盐矿物—水间反应的化学动力学速率方程
![]()
根据图6.4.7和图6.4.8,认为上述岩样中硫酸盐类矿物在水溶液中的溶解作用受到如下两个方面的控制:①表面化学反应;②扩散迁移。即反应体系中,与水相接触的硫酸盐矿物表面的浓度大于相对远离矿物处溶液的浓度,但小于矿物的溶解度。显然,参与反应的水溶液处于非饱和状态。

图6.4.10为上述实验过程中水溶液的pH—t 变化曲线。该图反映,实验初期,液相体系的pH值发生了相对明显的下降,但很快转为上升,之后趋于相对的平稳。此反映了该实验模拟过程中,有关水—岩系列间作用过程具有非线性变化。在该实验初期,有关酸化作用强度大于碱化作用,此源于硫酸盐类矿物的溶解作用;之后,有关酸化作用强度弱于碱化作用,此源于相应时段内岩样中铝硅酸盐类矿物的不全等溶解作用;而在后一较长的实验时段内,有关酸化作用在其强度方面大致与碱化作用相当。
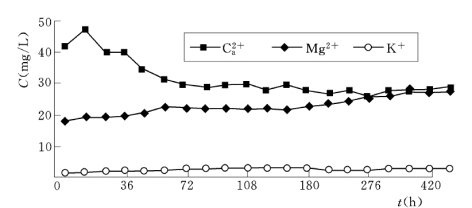
图6.4.9 1 号岩样反应体系水溶液中其他部分离子浓度随时间的变化
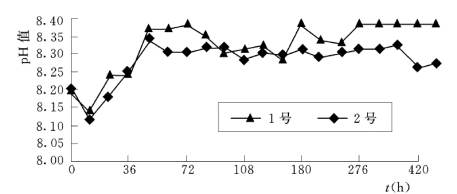
图6.4.10 水—岩反应体系中水溶液pH值的变化
图6.4.11 为上述实验过程中水溶液的TDS—t 变化曲线。该图反映,TDS 值随时间t 的变化呈明显的指数上升关系。按其增幅的大小,至少可分为如下两个时段:在第一时段即实验初期,固相中有较多的物质进入水溶液中,而以硫酸盐类等可溶性物质为主;而在第二时段即实验后期,固相中进入水溶液中的物质相对减少,而以相对难溶的铝硅酸盐类物质为主。
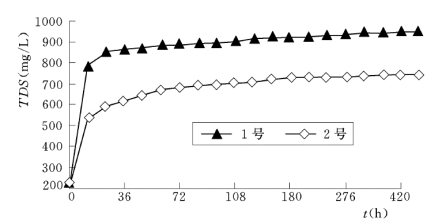
图6.4.11 水—岩反应体系中水溶液的TDS 值的变化
另外,需要指出的是:上述两个岩样中1 号岩样(黏土质砂岩及页岩互层)具有区内典型的软弱夹层的岩性特征,在上述水—岩作用实验模拟过程中发现遇水后,很快发生崩解作用并向松散性转化;还发现,伴随着长石类矿物的不全等溶解作用,水溶液中出现絮状无定形物质,并沉淀于固相介质的表面,此为形成次生矿物的雏形;而一定条件下次生矿物的形成则标志着该夹层岩样发生了泥化。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







