实验目的
1.理解基因过表达技术的原理。
2.掌握基因过表达技术的实验方法。
实验原理
基因过表达的基本原理是通过人工构建的方式在目的基因上游加入调控元件,使基因可以在人为控制的条件下实现大量转录和翻译,从而实现基因产物的过表达。本实验选用的是pRT100与pBAR-A双元载体系统。选择35S启动子在烟草中大量表达目的基因,其中35S启动子结合目的基因的完整编码框是通过pRT100载体引入的,随后连入pBAR-A过表达载体用于过表达转基因实验,并引入相应的抗性苗筛选标记PPT(草铵膦)。构建好的载体转入农杆菌LBA4404用于烟草转化。
实验用品
1.材料:本氏烟草种子。
2.器材:培养箱,摇床,PCR仪,电泳仪,电泳槽,凝胶成像系统,超净工作台。三角瓶,离心管,枪头,烧杯,三角瓶,培养皿,镊子,剪刀,酒精灯。
3.试剂:农杆菌LBA4404,pRT100载体,pBAR-A载体,MS培养基,50 μg/mL kanamycin(卡那霉素),100 μg/mL rifampicin(利福平),100 μg/mL Amp(氨苄青霉素),300 mg/L Cef(头孢霉素),YEB培养基,10 mmol/L MES(2-(N-吗啉代)乙磺酸),0.2 mmol/L acetosyringone(乙酰丁香酮),10 mmol/L MgCl2,500 mmol/L IPTG(异丙基-β-D-硫代半乳糖苷),20 mg/mL X-gal(5-溴-4-氯-3-吲哚-β-D-半乳糖苷),5 mg/L PPT(草铵膦),Xho I和BamH I限制性内切酶。
实验程序
1.相关载体的构建
(1)pRT100载体的构建
①NbGLO1的完整读码框的获取
PCR扩增出NbGLO1的完整读码框。根据载体pRT100(见图41-1)多克隆位点,在插入片段的5’端引入酶切位点XhoI,3’端引入酶切位点BamH I。
反应体系(50μL):
5 μL 10×Ex buffer
1 μL dNTP(10 mmol/L)
1 μL FPrimer(10 pmol/L)(Xho I)
1 μL RPrimer(10 pmol/L)(BamH I)
1 μL cDNA
0.5 μL ExTaq DNA聚合酶
40.5 μL ddH2O
PCR反应程序:
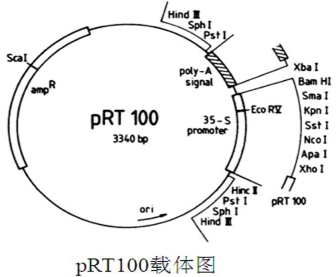
图41-1 pRT100载体图
Step 1 94 °C 3 min
Step 2 94 °C 30 s
Step 3 56 °C 30 s
Step 4 72 °C 1 min
From step 2 to step 4×35 cycles
Step 5 72 °C 10 min
取PCR产物5μL进行电泳检测。TianGEN回收试剂盒纯化回收(universal DNA Purification Kit DNA纯化回收试剂盒,N2924)PCR产物。用30 μL的无菌去离子水,洗脱试剂盒中的吸附柱,回收目的cDNA片段,-20 °C保存。
②pRT100载体质粒与NbGLO1完整读码框的酶切反应
酶切反应体系为(50 μL):
5 μL 10×K buffer
2.5 μL Xho I
2.5 μL BamH I
8 μL cDNA
32 μL ddH2O
37°C,过夜酶切。TianGEN PCR产物纯化试剂盒纯化酶切产物。
③NbGLO1的完整读码框和质粒pRT100的链接反应为(10 μL)
1 μL 10×T4 ligation buffer(https://www.daowen.com)
1 μL T4 DNA ligase(Takara)
6 μL insert DNA
2 μL pRT100
16 °C,过夜链接。
连接产物的转化、阳性克隆筛选与鉴定、载体质粒的提取相关操作同实验四十。阳性克隆的鉴定用目的基因的特异引物。
(2)pBAR-A载体的构建
将上述构建好的pRT100载体质粒和pBAR-A载体质粒用HindⅢ酶切,把从构建好的pRT100载体质粒上切下的片段正向插入到pBAR-A载体中,完成过表达载体的构建。具体的酶切反应、与pBAR-A载体质粒的连接、转化、阳性克隆的筛选同以上的实验方法。阳性克隆的鉴定用目的基因的特异引物。用冷冻法将质粒转化到农杆菌LBA4404中(将10 μL的阳性克隆质粒加入50 μL的感受态农杆菌(LBA4404)中,放入液氮中将其快速冷冻,然后再放入37℃的水浴锅中使其溶解,反复2次)。
2.无菌苗的准备
(1)蒸馏水震荡清洗本氏烟草种子3 min。
(2)倒出蒸馏水后,用10%次氯酸钠震荡清洗种子15 min。
(3)倒出液体后,用无菌的双蒸水冲洗种子3~5次。
(4)75%乙醇清洗种子1 min。
(5)倒出75%乙醇后,再用无菌的双蒸水冲洗种子3~5次。
(6)将种子平铺于MS培养基平板上。25 °C,16 h光照培养30 d左右,待子叶长出时即可用于后续转化实验。
3.本氏烟草转化体系
(1)取构建成功的阳性农杆菌接种于5 mL的YEB液体培养基,28 °C,200~250 r/min,振荡培养2 d。
(2)将上述培养好的菌液按1∶100比例接种于100mL的YEB液体培养基中,28 °C,200~250 r/min,振荡培养至OD=0.4~0.6。
(3)4000 r/min,离心5 min收集菌体。
(4)用50 mL的MS液体培养基重悬菌体。
(5)剪取本氏烟草无菌苗的子叶与幼茎部分作为用于侵染的外植体,将其浸入菌体中黑暗培养1~20 min。
(6)将侵染好的外植体用MS液体培养基清洗去多余的菌液,用灭菌的干净滤纸吸干外植体上的残余液体,将外植体放于MS平板上(含15 mg/L AS),黑暗培养1~2 d。
(7)待农杆菌长出后,用双蒸水(含Cef 300 mg/L)清洗外植体上多余的菌体,此过程进行3~6次,直至洗完双蒸水为清亮透彻为止。然后用灭菌的干净滤纸吸干外植体上的残余液体,将外植体放于1/2 MS分化平板上(含Cef 300 mg/L,1 mg/L 2,4-D+0.5 mg/L 6-BA)。25 °C,16 h光照培养。
(8)每2周继代1次。继代2次后,转入筛选平板(含Cef 300 mg/L,1 mg/L 2,4-D+0.5 mg/L 6-BA和PPT 5 mg/L)。
(9)每2周继代1次,筛选愈伤组织,诱导至再生芽产生,诱导再生芽的培养基含1/2 MS+0.5 mg/L 6-BA+0.5 mg/L NAA,PPT 5 mg/L和Cef 300 mg/L。
(10)当抗性芽长到2 cm时,将其切下换到1/2 MS培养基(含Cef 300 mg/L,0.5 mg/L 6-BA+0.2 mg/L NAA和PPT 5 mg/L)上面生根,待根生长好后炼苗,即可移栽温室。
4.转基因植株的基因型分析
对转基因株系在转录水平进行阳性鉴定,利用半定量RT-PCR方法检测目的基因在花芽中的表达情况,方法同实验三十八。
5.转基因植株的表型分析
转基因植株当代(T0代)收种,把种子种下去,得到T1代转基因植株,经鉴定后挑选3棵然后土培,以同时期的野生型本氏烟草作为对照,对T1代转基因植株早期的花进行测量、统计、分析。对早期相同位置上的5朵花,测量花的长度。
实验注意事项
1.在种植无菌苗时,一定要将种子彻底清洗与消毒,以避免污染。
2.侵染农杆菌的子叶与茎段一定得用双蒸水(内含Cef 300 mg/L)清洗干净,否则在愈伤组织诱导过程中污染太厉害。
3.培养的农杆菌浓度应达到一定范围的OD值,浓度过低过高都不利于植物组织菌液的侵染。
4.继代2次后,应转入相应的筛选平板(含PPT 5 mg/L)中。
思考题与作业
1.比较RNAi技术与基因过表达技术在验证基因功能时有什么区别?
2.转基因植株培养时,为什么要用筛选培养基?
参考文献
Li Z C,He CY.Physalis floridana cell number regulator1 encodes a cell membrane-anchored modulator of cell cycle and negatively controls fruit size[J].The Journal of Experimental Botany,2015,66(1):257-270.
Zhang J S,Li Z C,Zhao J,et al.Deciphering the Physalis floridanadouble-layered-lantern1 mutant provides insights into functional divergence of the GLOBOSA duplicates within the Solanaceae[J].Plant Physiology,2014,164(2):748-764.
(李巧峡)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






