
实验目的
1.理解植物病毒诱导的基因沉默的原理。
2.掌握植物病毒诱导的基因沉默的实验方法。
实验原理
病毒诱导的基因沉默(Virus-induced gene silencing,VIGS)是利用RNA干扰诱导植物中目标基因沉默的技术。VIGS利用植物内源RNA介导的防御体系使得目标基因RNA与病毒RNA序列形成二聚体而得到特异性降解。携带靶基因片段的病毒载体在被感染的植物体中大量复制并且转移,病毒载体中的靶基因片段在RNA介导的RNA聚合酶(RNA-directed RNA polymerase,RdRP)作用下合成大量的双链RNA(double-stranded RNA,dsRNA)。dsRNA在Dicer酶作用下产生21~25个核苷酸的短干扰RNA(short interfering RNA,siRNA)片段。然后,siRNA的反义链与RNA诱导基因沉默复合物(RNA-induced silencing complex,RISC)结合,特异性识别细胞质中靶基因的单链mRNA,造成内源靶基因mRNA特异性降解。研究表明,在成功的植物VIGS体系中,沉默诱导子300~500 bp的双链RNA(dsRNA)片段中,至少有21~23个核苷酸序列与目标序列具有100%的同源性。VIGS在分析植物基因功能时,具有方便、快速的优点,并避开了植物遗传转化的复杂性。近年来,VIGS体系在多种双子叶与单子叶植物中已成功建立。
实验用品
1.材料:本氏烟草植株。
2.器材:培养箱,摇床,PCR仪,电泳仪,电泳槽,凝胶成像系统。三角瓶,离心管,枪头,1mL无针注射器。
3.试剂:农杆菌GV3101,pTRV1载体,pTRV2载体,50 μg/mL kanamycin(卡那霉素),100 μg/mL rifampicin(利福平),100 μg/mL Amp(氨苄青霉素),YEB培养基,LB培养基,10 mmol/L MES(2-(N-吗啉代)乙磺酸),0.2 mmol/L acetosyringone(乙酰丁香酮),10 mmol/L MgCl2,500 mmol/L IPTG(异丙基-β-D-硫代半乳糖苷),20 mg/mL Xgal(5-溴-4-氯-3-吲哚-β-D-半乳糖苷),Xho I与BamH I限制性内切酶,TIANprep mini plasmid kit,universal DNA Purification Kit,PrimeScript™RT Master Mix,SYBR Premix EX Taq II。
(1)YEB培养基配方:
牛肉膏 5 g
酵母提取物 1 g
胰蛋白胨 5 g
蔗糖 5 g
硫酸镁 0.4 g
琼脂粉 15 g(YEB液体培养基不需要,固体平板培养基用到)
蒸馏水 至1 L,pH=7.4。
(2)LB培养基配方:
酵母提取物 5 g
胰蛋白胨 10 g
NaCl 10 g
琼脂粉 15 g(LB液体培养基不需要,固体平板培养基用到)
蒸馏水 至1 L,pH=7.4。
实验程序
1.探针cDNA序列的PCR扩增
用Trizol法提取本氏烟草花芽的总RNA,并合成第一链cDNA。如用探针NbGLO1(来源于本氏烟草)的开放阅读框(3’端400 bp左右),根据载体pTRV2的(见图40-1)多克隆位点,在插入片段的5’端引入酶切位点Xho I,3’端引入酶切位点BamH I。用特异性引物对其序列进行特异性扩增。
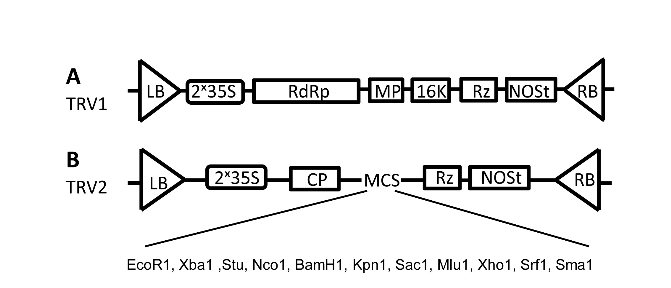
图40-1 pTRV1与pTRV2载体图
PCR反应体系为(25 μL):
0.2 μL ExTaq聚合酶(Takara)
2.5 μL 10×ExTaq缓冲液
2 μL 2.5 mmol/L dNTP
1 μL cDNA
1 μL F Primer(10 pmol/L,Xho I)
1 μL F Primer(10 pmol/L,BamH I)
17.3 μL ddH2O
PCR扩增程序如下:
Step 1 94 °C 5 min
Step 2 94 °C 30 s
Step 3 55 °C 30 s
Step 4 72 °C 30 s
From step 2 to step 4×35 cycles
Step 5 72 °C 10 min
2.探针cDNA片段的回收
将特异扩增的PCR产物在1%的凝胶上进行电泳。取PCR产物进行琼脂糖凝胶电泳检测。电泳仪电压150 V,电流120 mA,电泳30 min,将凝胶置于EB中染色20 min,然后用凝胶成像系统拍照。如扩增出cDNA片段,且大小在预期的范围内,则进行片段的回收。将合适大小的条带在紫外灯下切下,放入干净的离心管中,称取重量,用TianGEN回收试剂盒纯化回收(universal DNA Purification Kit DNA纯化回收试剂盒,N2924)。用30 μL的无菌水,洗脱试剂盒中的吸附柱,回收目的cDNA片段,-20℃保存。
3.探针cDNA片段的链接、转化
探针cDNA片段4 μL与pEASY-T1克隆载体(TransGen)1 μL轻轻混合,在室温下反应5~10 min,反应结束后将离心管置于冰上。加链接产物于50 μL刚刚解冻的Trans-T1感受态细胞中(TransGen),轻弹混匀,放于冰盒中冰浴30 min。42℃水浴锅中热激45 s,立即置于冰上2 min。然后加500 μL室温的LB液体培养基,200 r/min 37℃下孵育1 h。在孵育期间,取8 μL,500 mmol/L IPTG和40 μL,20 mg/mL X-gal,避光条件下均匀涂于100 μg/mL Amp的LB培养基平板上,室温放置30 min。孵育好的菌液4000 r/min离心2 min,弃去部分上清,保留200 μL,用枪轻轻吹弹悬浮菌体,取100 μL菌液涂板,37℃倒置培养12~16 h。
4.阳性单克隆的鉴定
挑选白色克隆,置于有100 μg/mL Amp的LB液体培养基中,200 r/min 37℃摇菌4 h。取0.5 μL菌液用作PCR反应的模板。用M13F,M13R(引物序列见表40-1)正反向引物鉴定重组子。
阳性单克隆鉴定的PCR反应体系为(10 μL):
5 μL Premix ExTaq聚合酶
0.5 μL M13F(www.daowen.com)
0.5 μL M13R
0.5 μL 菌液
3.5 μL ddH2O
PCR反应程序为:
Step 1 94 °C 5 min
Step 2 94 °C 30 s
Step 3 60 °C 30 s
Step 4 72 °C 30 s
From step 2 to step 4×30 cycles
Step 5 72 °C 10 min
然后将PCR产物电泳检测,用凝胶成像系统拍照。
表40-1 实验中所用到的引物序列

5.测序及序列分析
所得阳性克隆由华大基因完成测序工作。将所测得的序列在NCBI数据库进行BLAST,确定该序列是否为目的基因的家族成员。
6.VIGS载体构建
本研究中VIGS载体为pTRV1和pTRV2。探针NbGLO1序列与pTRV2同时进行酶切,并将探针序列连接到pTRV2载体中。
酶切反应体系为(50 μL):
5 μL 10×K buffer
2.5 μL Xho I
2.5 μL BamH I
8 μL cDNA
32 μL ddH2O
37°C,过夜酶切。TianGEN PCR产物纯化试剂盒纯化酶切产物。
和质粒的链接反应为(10 μL):
1 μL 10×T4 ligation buffer
1 μL T4 DNA ligase(Takara)
6 μL insert DNA
2 μL pTRV2
16 °C,过夜链接。
接下来的感受态细胞转化与阳性克隆的鉴定同3和4的方法。阳性克隆用156引物进行检测(引物序列见表40-1),并由华大进行测序,合适的阳性克隆用TIANprep mini plasmid kit(TIANGEN,Beijing,China)试剂盒提取质粒。
7.植株培养与农杆菌渗入法
用冷冻法将质粒转化到农杆菌GV3101中,将10 μL的阳性克隆质粒加入到50 μL的感受态农杆菌(GV3101)中,倒入液氮中将其快速冷冻,然后再放入37℃的水浴锅中使其溶解,反复2次。然后将含有pTRV1和pTRV2::NbGLO1质粒的农杆菌GV3101分别涂到YEB(含50 μg/mL kanamycin和100 μg/mL rifampicin)平板上,28℃培养。2 d后,挑选单个克隆于5 mL的YEB液体培养基(含50 μg/mL kanamycin和100 μg/mL rifampicin)中,28℃,250 r/min小摇过夜。随后将小摇过夜的菌液混合于250 mL的YEB液体培养基(含50 μg/mL kanamycin 100 μg/mL,rifampicin,10 mmol/L MES和0.2 mmol/L acetosyringone)中,28℃,250 r/min大摇。待菌液在600 nm处OD值达到2.0左右时,收集菌液。菌液进一步用渗透缓冲液(10 mmol/L MgCl2,10 mmol/L MES,and 200 mmol/L acetosyringone)重悬,并在室温下孵育3h,之后将含有pTRV1和pTRV2::NbGLO1质粒的农杆菌GV3101的渗透液按照1∶1的比例进行混合。然后用1 mL无针的注射器将混合液注射到4真叶本氏烟草所有叶子的下表皮中。暗培养2 d,随后置于光照培养箱,22~25℃、光照强度120 umol·m-2·s-1、空气湿度为48%、16h光照条件下培养。
8.qRT-PCR分析
VIGS实验后,为了检验本氏烟草中NbGLO1的表达量,取本氏烟草花芽为材料,TRIZOL法提取总RNA,PrimeScript™RT Master Mix(TAKARA,047A)试剂盒将其反转录成cDNA,SYBR Premix EX Taq II进行qRT-PCR分析。用DNAman软件设计Nb-GLO1的特异引物,以Nbactin为内参基因(特异引物序列见表40-1)。扩增程序为95℃变性30 s,接着95 °C变性5 s,60℃退火30 s,共40个循环。实验过程中3次独立的生物实验样本。采用2-△△Ct法相对定量分析数据。
9.形态观察
将本氏烟草花芽置于OLYMPUS(DP2-BSW-V2.2,Olympus公司,Tokyo,Japan)体视显微镜下解剖,并拍照,得到花芽与雄蕊的形态结构。
实验注意事项
1.探针cDNA序列一定要引入正确的限制性内切酶位点。
3.cDNA片段回收时,用刀片切取合适大小的条带,尽量除去多余的凝胶。
4.cDNA片段转化时,注意感受态细胞解冻时间不易太长。
5.实验过程中,应设一个阴性对照,即将没有链接探针序列的pTRV1和pTRV2注射到植物叶片中,观察植株有无明显的表型变化。
思考题与作业
1.选取限制性内切酶时,应该注意什么?
2.VIGS实验后,为什么需检验本氏烟草中NbGLO1的表达量?
Zhang S H,Zhang J S,Zhao J,et al.Distinct subfunctionalization and neofunctionalization of the Bclass MADS-box genes in Physalis floridana[J].Planta,2015,241:387-402.
Gong P C,Li J,He C Y.Exon junction complex(EJC)core genes play multiple developmental roles in Physalis floridana[J].Plant Molecular Biology,2018,98:545-563.
Li Q X,Wang J,Zheng S,et al.Virus-induced gene silencing in Nicotiana benthamiana trigged by the heterologous gene sequence from Viola philippica[J].Biologia Plantarum,2019,63(1):153-163.
(李巧峡)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。





