实验目的
1.通过实验操作,掌握斑马鱼的视神经损伤技术。
2.掌握Western blot技术的实验原理和实验步骤。
3.了解RT-97识别的神经丝蛋白在斑马鱼视觉组织轴突损伤再生过程中的作用。
实验原理
鱼类和两栖类的视神经是由视网膜神经节细胞的轴突形成的,它们作为中枢神经的一部分,具有完全的再生能力。许多实验证据表明低分子量的神经丝蛋白在视觉组织早期的正常发育和轴突损伤再生过程中起了重要的作用。有大量资料显示许多低分子量神经丝蛋白都在视觉轴突中有表达,它们的表达与轴突生长发育有密切的关系。在鱼类中研究证实,低分子量神经丝蛋白Plasticin和Gefiltin在金鱼和斑马鱼视神经损伤后节细胞中有表达,说明它们与视神经损伤后轴突的阶段性生长有关。Zhao等在爪蟾视觉轴突的研究中发现,低分子量神经丝蛋白Xefiltin在视觉轴突到达视顶盖之前,主要在正常发育和损伤再生的视觉轴突中表达。当将爪蟾视神经损伤后,神经丝蛋白的表达高于正常水平,说明在创伤刺激及其他因素的影响下,神经元会大量合成相关的蛋白,以适应轴突再生。
Western Blot中文一般称为蛋白质印迹,它是分子生物学、生物化学和免疫遗传学中常用的一种实验方法,其基本原理是通过特异性抗体对凝胶电泳处理过的细胞或生物组织样品进行着色,通过分析着色的位置和着色深度获得特定蛋白质在所分析的细胞或组织中的表达情况的信息。与Southern或Northern杂交方法类似,但Western Blot采用的是聚丙烯酰胺凝胶电泳,被检测物是蛋白质,“探针”是抗体,“显色”用标记的二抗。经过SDS-PAGE分离的蛋白质样品,转移到固相载体(例如硝酸纤维素薄膜)上,固相载体以非共价键形式吸附蛋白质,且能保持电泳分离的多肽类型及其生物学活性不变。以固相载体上的蛋白质或多肽作为抗原,与对应的抗体起免疫反应,再与酶或同位素标记的第二抗体起反应,经过底物显色或放射自显影以检测电泳分离的特异性目的基因表达的蛋白成分。该技术也广泛应用于检测蛋白水平的表达。
实验材料
1.材料
成体斑马鱼。
2.器材
体视显微镜、解剖盘、眼科镊子、研磨器、垂直电泳槽、电泳仪、离心机。
3.试剂
丙烯酰胺,甲叉双丙烯酰胺,四甲基乙二胺,过硫酸铵,Tris,甘氨酸,蔗糖,溴酚蓝,SDS,甲醇,H2O2,鼠抗RT-97,生物素标记的马抗鼠IgG,辣根过氧化物酶标记的亲和素(亲和素-HRP),脱脂奶粉,牛血清白蛋白,HCl,NaCl,TritonX-100,二氨基联苯胺(DAB),Leupeptin(亮抑酶肽),Pepstatin(胃胰蛋白酶肽),EDTA,PMSF,冰块(冰浴),标准蛋白(53~220 kDa)。
溶液配制如下:
(1)电极缓冲液:Tris 3 g,Gly 14.4 g,SDS 1 g,pH=8.3,定容至1000 mL。
(2)转移缓冲液:Tris 5.8 g,Gly 2.9 g,SDS 0.37 g,200 ml甲醇,pH=8.3,定容至1000 mL。4℃保存。
(3)5×TBS缓冲液:Tris 0.6075 g,NaCl 20.0157 g,pH=7.6,定容至1000 mL。4℃保存。
(4)TTBS:取200 mL 5×TBS,加500 μL Tween-20,定容至1000 mL。4℃保存。
(5)封闭液(5%脱脂奶粉-TBS):0.5 g脱脂奶粉+2 mL 5×TBS+8 mL蒸馏水。
(6)显色液:3 mg DAB+9 mL TBS+10 μL 10% H2O2,临用前配。
(7)30%丙烯酰胺储备液:Acr 29.2 g,Bis 0.8 g,加蒸馏水至100 mL。4℃保存。
(8)浓缩胶缓冲液:Tris 6.0 g,加50 mL蒸馏水,pH=6.8,定容至100 mL。4℃保存。
(9)分离胶缓冲液:Tris 18.15 g,加50 mL蒸馏水,pH=8.8,定容至100 mL。4℃保存。
(10)上样缓冲液:浓缩胶缓冲液2 mL,甘油2 mL,10% SDS 4 mL,0.1%溴酚蓝1 mL,2-巯基乙醇1 mL。
(11)10%过硫酸铵(W/V):0.1 g Ap+1 mL蒸馏水,临用前用蒸馏水配制或4℃保存(一周内可用)。
(12)10% SDS(W/V):SDS 1 g,蒸馏水10 mL,4℃保存。
(13)考马斯亮蓝R-250染色液:考马斯亮蓝R-250 0.31 g,CH3OH 125 mL,CH3COOH 25 mL,H2O 100 mL,总体积250 mL。
(14)脱色液:CH3OH 250 mL,CH3COOH 50 mL,蒸馏水200 mL,总体积500 mL。
(15)Leupeptin(亮抑酶肽):5 mg溶于50 mL蒸馏水,分装到5个离心管,即0.1 mg/mL。待用时稀释10倍,即0.1 μg/μL,每毫升匀浆液加50 μL,-20℃保存。
(16)Pepstatin(胃胰蛋白酶肽):5 mg溶于20 mL C2H5OH,分装到2个离心管,即0.25 mg/mL。待用时稀释10倍,即0.25 μg/μL,每毫升匀浆液加28 μL,-20℃保存。
(17)EDTA:300 mg溶于30 mL蒸馏水中,加入少量的NaOH,定容至50 mL,即6 μg/μL,每毫升匀浆液加50 μL,4℃保存。
(18)PMSF:0.87 g溶于异丙醇中,定容至100 mL,即8.7 mg/mL,分装,待用时用异丙醇稀释10倍,每毫升匀浆液加23 μL,-20℃保存(PMSF易在水溶液中失活,需临用前加入)。
(19)0.5 mol/L Tris-HCl:Tris 3.025 g,pH=6.8,定容至50 mL。4℃保存。
(20)0.1%溴酚蓝:0.01 g溶于10 mL蒸馏水,室温保存。
(21)蛋白提取液:
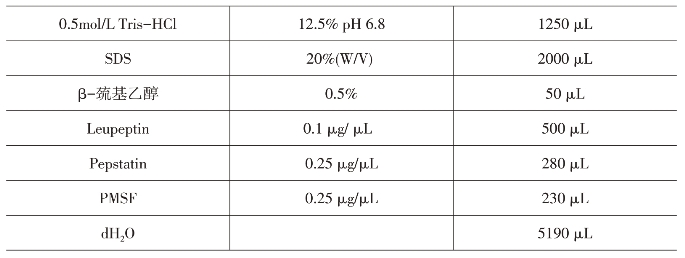
实验程序
1.视神经损伤手术:将斑马鱼以0.05%的Finquel(Tricaine methansulfonate,Sigma)溶液麻醉后,用湿纱布包裹住鱼体,露出头部,使鱼侧卧,置于体视解剖镜下,用光滑的眼科镊子将左右眼球表面的黏膜去除,小心地将眼球从眼眶中向外拨出,可看到眼球后的大动脉与白色的视神经伴行。避开大动脉,用眼科镊子在视神经一固定的位点夹断视神经(被夹断处成半透明状态,可以看见髓鞘里的神经纤维有明显的断痕),此过程中严防损伤大动脉和视神经髓鞘,否则该鱼弃去不用。手术后将鱼眼复位,用清水从口内灌流冲洗,直至苏醒,再放回水中(水温26~28℃,每日换水1次,饲喂水蚯蚓,控制光源调节昼夜节律L14/D10)饲养备用。
2.取材:取视神经损伤后不同时期(14 d和28 d)的斑马鱼的视网膜、视神经和视顶盖。每一时期取15条斑马鱼。在取材之前,暗适应0.5~1 h,将鱼以0.05%的Finquel的溶液麻醉,置于体视解剖镜下。然后,在4℃的解剖盘上滴加适量生理盐水,用眼科镊子迅速剥离视网膜、视神经、视顶盖及中脑,置于-20℃保存备用。
3.提取蛋白
以1∶4的比例混合待测组织和蛋白提取液,冰上研磨;4℃13 000 r/min离心15 min,离心后取上清液,再加入等体积的样品缓冲液,煮沸,冷却至室温后放入4℃冰箱备用。保存时间较长需在-20℃冰箱贮存。
4.SDS-聚丙烯酰胺电泳
(1)灌胶前的准备
将两块玻璃板洗净晾干,嵌入橡胶带的凹槽中,一块略长一点的玻璃板下沿与橡胶带框底部之间留有2~3 mm空隙,以便凝胶的一侧与电极槽电极液相通;另一块短玻璃板的下沿嵌入橡胶框底槽内,两块玻璃板之间形成一个“橡胶夹芯”,然后将嵌有玻璃的橡胶凹槽装入电泳槽之间,用固定螺丝固定,在长玻璃板一侧的底部用2.5%的琼脂(用电极缓冲液配制)密封。
(2)凝胶的配制(www.daowen.com)
本实验中蛋白质相对分子质量为50~200 kDa,因此选择的凝胶浓度为T=7.5%,C=2.6%。(见表19-1)
表19-1 凝胶的配制
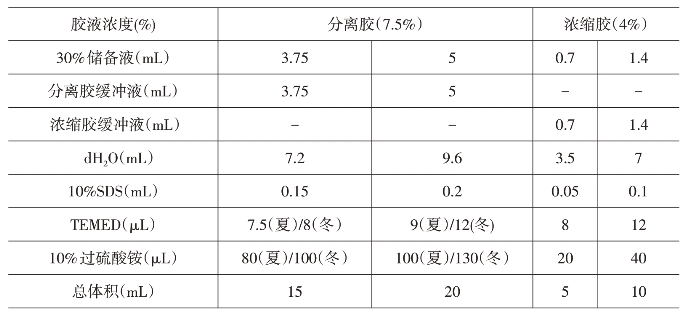
(3)灌胶
将配制的分离胶液加入到橡胶框的“玻璃腔”内,待胶液加至距短玻璃板顶端约3 cm处时停止灌胶,然后在胶液表面上小心加入水层,以保持分离胶面平整。待凝胶和水之间界面清晰时,说明胶已聚合。30~40 min聚合完毕。
聚合好的分离胶,倾去上层水,插上梳子,将配制好的浓缩胶液加到分离胶上,直至短玻璃的顶端。放置30~40 min待其聚合。
(4)加样
样品上清液以1∶1与上样缓冲液吸入Eppendorf管中混合后沸水浴加热8 min,冷却至室温,离心(4000 r/min,30 s),取上清液使用。
拔出梳子,用滤纸将样品槽中的水分和气泡吸干。上样,每槽加样液20~30 μL。
(5)电泳
稳压120 V,约30 min跑完浓缩胶,再将电压调至180 V,电泳总用时3~4 h,当溴酚蓝前沿到达距底部0.5 cm左右时,停止电泳。取出胶,将胶切成两半,一条用考马斯亮蓝R-250染色液染色,7~8 h后换成脱色液脱色,中间换1~2次脱色液至蛋白质条带清晰,用玻璃纸将其制成干板保存;另一半胶用于转移和酶联免疫染色。
5.转移蛋白质到PVDF膜上
转移电压:40 V;转移时间:2 h。
(1)切割与胶尺寸相符的PVDF膜,先用100%的甲醇将膜浸泡30 s,然用转移缓冲液浸泡胶与膜15 min,使没有气泡。
(2)剪两张滤纸与胶尺寸大小相符,将其与海绵一起浸泡在转移缓冲液中10 min。
(3)打开转移槽的胶板,从负极(黑孔板)到正极(白孔板)依次放入:黑孔板,凝胶纤维支持垫,滤纸(3张),凝胶,PVDF膜,滤纸(3张),凝胶纤维支持垫,白孔板。在装的过程中,要不时地用玻璃棒将气泡赶出。
(4)小心地合上胶板,并立即放入转移电泳槽中。加转移缓冲液至满。
(5)因为蛋白质带负电荷,所以胶侧为负,PVDF膜侧为正。打开电泳仪开关调至稳压40 V,电泳2 h,转移结束后打开胶板取出PVDF膜。防止膜的背景较高而影响实验结果,所以本实验不采用丽春红预染,可将转印后的PVDF膜放入含20%甲醇溶液中,在白透射光照下依稀可以看到透明的蛋白条带后,可进行后续实验。
6.转移膜的酶联免疫染色
(1)冲洗:用TTBS冲洗膜15 s。
(2)孵育:用含5%脱脂奶粉-TBS溶液室温孵育1 h。
(3)一抗:鼠抗RT-97(取6 μL抗体用TBS稀释,比例为1∶1700),4℃孵育过夜,然后用TTBS冲洗5次,每次3 min。(最好在摇床上操作,一抗回收)
(4)二抗:生物素化的二抗(取24 μL生物素标记的马抗鼠IgG用TBS稀释,比例为1∶300),室温孵育2 h,然后用TTBS冲洗5次,每次3 min。(二抗回收)
(5)三抗:辣根过氧化物酶标记的亲和素(取24 μL,用TBS稀释,比例为1∶200)室温孵育2 h,然后用TTBS冲洗5次,每次3 min。(三抗回收)
(6)DAB染色2~3 min,水洗2 min。
(7)观察显色程度,用双蒸水洗膜终止显色反应,每次30 min,共3次。
(8)用吸水纸吸干膜上的水分,避光干燥保存于4℃(可放于塑料袋内夹在本中)。
7.实验观察
比较正常斑马鱼视觉组织与损伤斑马鱼的视觉组织中神经丝蛋白表达与含量的变化。
实验注意事项
1.在取材之前,将鱼暗适应0.5~1 h,然后以0.05%的Finquel的溶液麻醉。
2.制胶时,在胶面上加入蒸馏水,可保持胶面平整和防止空气进入,待凝胶和水之间界面清晰时,说明胶已聚合。
3.拔出梳子后,应用滤纸将样品槽中的水分和气泡尽量吸干。
思考题与作业
1.免疫印迹时,为什么准备两块胶,一块用考马斯亮蓝R-250染色液染色,另一块胶用于转移和酶联免疫染色,其目的是什么?
2.第一抗体与第二抗体是如何识别的?
佟向军,陈建国,翟中和.神经丝的结构和功能[J].细胞生物学杂志,1998,20:63-68.
黄瑛,柳达,石玉秀.神经丝的完整性对线状溶酶体形状与分布的影响[J].解剖学报,2004,35(2):198-201.
周国民,谷华运.人胚胎视网膜内神经丝蛋白的出现和分布[J].解剖学报,1995,26(2):190-193.
Velasco A,Bragado M J,Jimeno D,et al.Growing and regenerating axons in the visual system of teleosts are recognized with the antibody RT97[J].Brain research,2000,883:98-106.
Zhao Y G,Szaro B G.Xefiltin,a xenopus laevis neuronal intermediate filament protein,is Expressed in actively growing optic axons during development and regeneration[J].Journal of neurobiology,1997,33(6):811-824.
Gervasi C,Thyagarajan A,Szaro B G.Increased expression of multiple neurofilament mRNAs during regeneration of vertebrate central nervous system axons[J].The Journal of Comparative Neurology,2003,461:262-275.
Leake D,William S,Asch A.Gefiltin in zebrafish embryos:sequential gene expression of two neurofilament proteins in retinal ganglion cells[J].Differentiation,1999,65:181-189.
(王芳春,李巧峡)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







