实验目的
掌握胚胎显微注射技术。
实验原理
显微注射技术是利用显微操作系统和显微注射技术,将外源基因直接注入受精卵、胚胎细胞或体外培养的细胞中,使外源基因整合到受体细胞的基因组内,以研究外源基因的功能或获得转基因动物的技术。研究斑马鱼最大的优点之一就是可以迅速和便捷的研究基因功能。如Morpholinos,一个人工合成的寡核苷酸链,序列和目的基因的RNA互补,通过显微注射到胚胎后,可特异性地降低目的基因的表达量。相反,体外转录的mRNA也可通过显微注射到胚胎中,以提高目的基因在体内的表达量。显微注射高效而快速,可在1 h内注射几百枚胚胎。
实验用品
1.材料
斑马鱼。
2.器材
体视显微镜,显微注射仪,氮气罐,1 cm OD玻璃毛细管,照相机,1 mL塑料吸管,微量移液枪。
3.试剂
胚胎培养液,GFP质粒DNA。
实验程序
1.显微用针的准备、上样和准备工作
(1)利用显微拉针仪,将1 mm OD玻璃拉成2根注射用针,妥善进行保存。
(2)用微量上样器或微量上样枪头,从显微用针的底部将要注射的物质缓慢移入针内。向针头的方向晃动数次直到液体中无气泡。
(3)打开氮气罐和显微注射仪,将装有注射物质的针头插入显微注射仪的金属管中,要确保针头插紧。检查显微手动操作装置的位置,以保证注射的方便。将插好的针头放在显微镜下,调整好视野后,用尖镊子小心地修整玻璃针的头部,以使针头更锋利,更容易穿过胚胎的胶膜。
(4)利用3 cm定量毛细管测定每次注射的溶液量,将显微注射仪上的注射时间调整至秒级别,将注射针头小心地放在毛细管关口处,踩踏开关,液体将注射入毛细管中,之后用毫米级别的尺量取注射入毛细管的液体的长度,进行换算。3 cm的定量毛细管的容量为1 μL。如5 s内注射入毛细管的液体为6 mm,那么注射总量为0.2 μL,其后将显微注射仪上的注射时间调整至毫秒级别,5 ms注射量为2 nL。
2.胚胎的准备和收集
(1)在注射的前一天晚上,准备好实验用鱼。
(2)实验当天早晨,收集胚胎。
(3)将足够量的胚胎置于培养皿中准备注射,用吸管吸去多余的水分,并尽量使胚胎不要超过1细胞期。(www.daowen.com)
3.注射
(1)确保胚胎时期没有超过4细胞期,最好在1细胞期。
(2)将针头放低,用另外一只手压住装有胚胎的培养皿。
(3)将针头穿过胶膜的表面,轻轻地穿入卵黄,注意不要挑起卵黄或者使胚胎受损严重。将注射的物质注入卵黄中(附图14-1)。
(4)注射一批胚胎后,轻轻加入少量胚胎培养液,并将这些注射后的胚胎转移至干净的培养皿中。保留一部分未注射的胚胎为对照。在注射后的当晚,弃去死亡的胚胎,并对注射过的胚胎进行计数。定期更换胚胎培养液以减少因感染而引起的胚胎死亡。
(5)结果观察。
24 hpf后,于荧光显微镜下,观察注射GFP质粒DNA后胚胎所发出的绿色荧光。
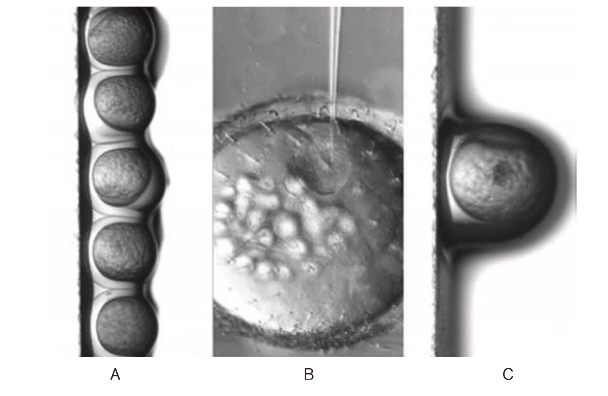
附图14-1 斑马鱼显微注射
A.将斑马鱼按顺序在显微镜下摆好;B.针头插入胚胎中的显微附图示;C.注射后的胚胎
实验注意事项
1.注射时应尽量避免气泡或拉伸卵黄,这些操作都会使胚胎死亡。
2.用塑料吸管弃去未受精或在注射过程中受损的胚胎。
思考题与作业
1.统计注射后的死亡率。
2.统计发出绿色荧光的胚胎比例。
Jochen W.Microinjection of DNA,RNA and tracer dyes into early fish embryos[J].Applications,2011,112.
(李建真)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







