实验目的
1.掌握精巢与卵巢的切片制作过程。
2.通过切片及活体观察,理解精子和卵子的发生过程,加深对成熟精子形态的认识。
实验原理
卵子发生是在卵巢内进行的,以哺乳动物为例:在性成熟以前,卵巢内有相当数量的卵原细胞,经增殖分裂后数量更多。随着动物性成熟的过程,卵原细胞开始进入生长期即初级卵母细胞。最初,卵母细胞较大,周围为一层扁平的滤泡细胞包围,称为初级滤泡;随着滤泡细胞层数的增多,称为生长滤泡;随着滤泡细胞之间的小腔逐渐汇成一个大腔(滤泡腔),与此同时,初级卵母细胞日趋成熟,积累了各种营养物质,并渐向滤泡腔(充满蛋白质、激素、cAMP和其他分子的混合物)突出,形成卵丘,此即称为次级滤泡或成熟滤泡。然后初级卵母细胞在激素或神经的诱导下从卵巢中排除,并在体腔中完成第一次减数分裂,成为次级卵母细胞。遗留的滤泡细胞发育为黄体(后由卵泡迅速转变成的富有血管的腺体样结构),如卵子不能受精,黄体仅维持2周即萎缩,被结缔组织结疤所代替,形成白体。若卵子受精成功并开始妊娠,黄体继续增长,至妊娠2~3月后慢慢萎缩。
精子形成于精巢,哺乳动物成熟的精子储存于附睾中,取其活体状态下附睾内精液,借助显微镜,即可观察到活体的精子形态。精巢是一结构复杂的器官,在脊椎动物中主要由曲细精管和小的导管所构成,曲细精管是由各个时期的生殖细胞和支持细胞所组成。在高等动物雄性动物性成熟时,由精原细胞产生精子,但精巢内的精原细胞并不是在同一时间突然发育成精子,而是每隔一段时间有周期地有一部分精原细胞发育成为成熟的精子。因此,在同一时间内,在曲细精管的不同部位,即由基膜向管腔排列依次为不同发育时期的精原细胞、初级精母细胞、次级精母细胞、精子细胞和分化中的精子。
实验用品
1.材料:小鼠或家兔的精巢、附睾及家兔卵巢。
2.器材:解剖器具,载玻片,盖玻片,吸水纸,酒精灯,染缸,包埋纸盒,手摇切片机,组织包埋机,普通光学显微镜。
3.试剂:乙醇,二甲苯,石蜡。
(1)卡诺氏固定液:95%乙醇∶冰醋酸=3∶1。
(2)1 mol/L盐酸溶液:取82.5 mL密度1.19 g/mL的浓盐酸加蒸馏水至1000 mL。
(3)希夫试剂(Schiff试剂):称1 g碱性品红于200 mL煮沸的重蒸馏水中,5 min后使其冷却至55~50℃,过滤到一个棕色的试剂瓶中,加入1 mol/L HCl 20 mL,继续冷却至25℃,加入1 g偏亚硫酸氢钠,摇动瓶子使其溶解。密闭瓶口,置黑暗低温处或冰箱内(4℃左右),18~24 h后检查,试剂如透明无色或呈浅黄色时即可使用,这就是Schiff试剂溶液。如有不同程度的红色未褪,可加入1 g活性炭,强烈震荡1 min,仍在低温下静置过夜,然后用滤纸过滤后使用。密封瓶口,包以黑纸,在5℃以下冰箱内可以保存半年。如有白色沉淀,就不能再使用,如颜色变红,可加入少许偏重亚硫酸钠,使之再转为无色,仍可继续使用。
(4)亚硫酸水溶液:取200 mL蒸馏水,加入10 mL 10%偏重亚硫酸钠水溶液和10 mL 1 mol/L HCl,三者使用前混匀。
(5)0.5%固绿乙醇染液:称取0.5 g固绿溶于100 mL 95%乙醇中。
(6)0.9%生理盐水。
(7)Bouin氏固定液:饱和苦味酸50 mL,40%甲醛250 mL,冰醋酸50 mL。饱和苦味酸过滤,甲醛和冰醋酸最好在临用前加入。
(8)1%氨水乙醇溶液:99 mL 70%乙醇中加1 mL氨水。
(9)1%盐酸乙醇溶液:99 mL 70%乙醇中加1 mL盐酸。
(10)1%伊红水溶液:1 g伊红溶于95%乙醇100 mL,充分搅拌完全溶解,用前加2滴冰醋酸。
(11)埃里希氏苏木精:苏木精:1 g;无水乙醇:50 mL;硫酸铝钾:5 g;蒸馏水:50 mL;碘酸钠:0.2 g;冰醋酸:5 mL;甘油:50 mL。
配制方法:将苏木精溶于无水乙醇,再将硫酸铝钾溶于蒸馏水,溶解后将甘油倾入一起混合,最后加入冰醋酸和碘酸钠。
实验程序
1.精子的发生过程
(1)精巢制片——Feulgen染色法
①取材:处死小鼠,取其精巢,用解剖针在精巢上刺几个小孔。
②固定:卡诺氏固定液固定0.5~2 h。
③脱水:85%、95%、100%乙醇各1 h。
④透明:先在100%乙醇与二甲苯混合液中0.5 h,然后在二甲苯中0.5 h,中间换1次二甲苯。
⑤浸蜡:二甲苯与石蜡等量混合液0.5 h,纯石蜡中换2次,每次0.5 h。
⑥包埋:将精巢包埋于石蜡中。第5、6步在组织包埋机中进行,包埋机温度为56℃。
⑦切片:切片厚度为7 μm。
⑧Feulgen染色:石蜡切片溶蜡:溶蜡二甲苯Ⅰ(3~5 min),溶蜡二甲苯Ⅱ(3~5 min),1/2纯乙醇+1/2二甲苯(3~5 min);复水:无水乙醇Ⅰ(2~3 min),无水乙醇Ⅱ(2~3 min),95%乙醇(2~3 min),85%乙醇(2~3 min),70%乙醇(2~3 min),蒸馏水;水解:1 mol/L HCl,过一下,1 mol/L HCl,60℃,8~10 min(水浴或温箱中);染色:Schiff试剂染色(60 min);漂白:亚硫酸水Ⅰ(2 min),亚硫酸水Ⅱ(2 min),亚硫酸水Ⅲ(2 min),自来水清洗(5~10 min),蒸馏水,过一下;对染:0.5%固绿乙醇溶液(10 s),蒸馏水,过一下;脱水:95%乙醇(2 min),无水乙醇Ⅰ(2 min),无水乙醇Ⅱ(2 min);透明:透明二甲苯Ⅰ(2 min),透明二甲苯Ⅱ(2 min);封片:中性树胶封片。
(2)小鼠精巢切片观察(附图1-1)
先用低倍镜观察曲精小管不同切面的全貌,然后转换高倍镜,找一个较清楚的曲精小管切面,从管壁到管腔依次认出:
精原细胞:靠基膜的一层或两层细胞,细胞核大而圆,染色深。
初级精母细胞:比精原细胞大得多,往往在分裂期间,染色质正在形成染色体。
次级精母细胞:比初级精母细胞小,胞核圆,染色淡,接近管腔。
精子细胞:体积小,最近管腔。染色最深,多呈梭形和细杆状。(https://www.daowen.com)
精子:成簇聚集于管腔或支持细胞上。
支持细胞:夹杂分布于生殖细胞间,锥形或不规则形,细胞核靠近基部。形状不定,染色淡,细胞轮廓不易认出。
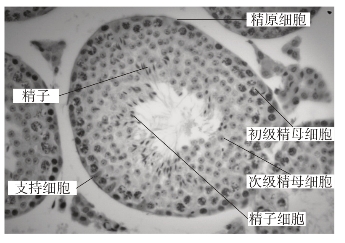
附图1-1 小鼠曲精小管中精子的发生过程
2.成熟精子的形态观察(活体)
剪开刚处死的家兔附睾的一端,轻微将其断面在清洁过的载玻片上涂一下,然后加0.9%生理盐水一滴于涂片上,盖上盖玻片在高倍镜下观察。可看见家兔高级分化型的,有头尾结构的精子作活泼的运动。
再加上一滴苏木精染液于盖玻片一侧,用吸水纸在盖片的另一侧吸水,将染液引至材料上,约1 min后,即可在显微镜下观察,则头尾较为明显(似人类精子)。
3.卵子的发生过程
(1)卵巢的切片制作——HE染色法
①取材:处死家兔,取其卵巢。
②固定:卵巢于生理盐水中清洗后,用Bouin氏固定液固定24 h。
③脱水:取出卵巢,用刀片分割成5~8 mm小块,用70%乙醇清洗3次后于70%乙醇中保存(过夜)。取出组织进行逐级脱水,80%乙醇(2~3 h);90%乙醇(2~3 h);95%乙醇I(2 h);95%乙醇Ⅱ(2 h);无水乙醇Ⅰ(2 h);无水乙醇Ⅱ(2 h)。
④透明:1/2二甲苯+1/2乙醇(过夜),然后在二甲苯中0.5~1 h,中间换一次二甲苯。
⑤浸蜡:二甲苯与石蜡等量混合液0.5 h,纯石蜡中换2次,每次0.5 h。
⑥包埋:将卵巢在包埋台上进行石蜡包埋。
⑦切片:切片厚度为7~8 μm。
⑧HE染色:脱蜡:二甲苯Ⅰ(15 min),二甲苯Ⅱ(15 min),1/2乙醇+1/2二甲苯(5 min);复水:无水乙醇Ⅰ(5 min),无水乙醇Ⅱ(5 min),95%乙醇(5 min),90%乙醇(5 min),80%乙醇(5 min),70%乙醇(5 min),蒸馏水Ⅰ(5 min),蒸馏水Ⅱ(5 min);染色:埃里希氏苏木精(15~30 min),自来水冲洗(5 min);分化:1%盐酸乙醇(20 s),自来水冲洗(稍洗),1%氨水乙醇(4 s),蒸馏水Ⅰ(3 min),蒸馏水Ⅱ(3 min);复染:1%伊红(3 min);脱水:70%乙醇(30 s),80%乙醇(30 s),90%乙醇(5 min),95%乙醇(5 min),无水乙醇Ⅰ(5 min),无水乙醇Ⅱ(5 min);透明:1/2二甲苯+1/2乙醇(5 min),二甲苯Ⅰ(10 min),二甲苯Ⅱ(10 min);封片:将染色完成的切片取出,确保二甲苯未干燥,迅速用移液枪吸取树胶滴在组织上,盖上盖玻片,待凝固后观察结果。
(2)家兔卵巢切片观察
取切片置低倍镜下,观察滤泡在卵巢中分布情况(附图1-2)。依次高倍镜观察初级滤泡的生长过程和次级滤泡的形态(附图1-3、4)。
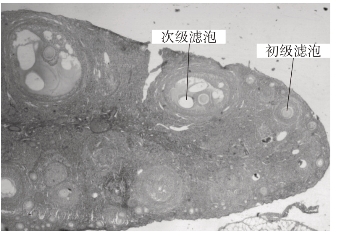
附图1-2 家兔卵巢切面

附图1-3 初级滤泡
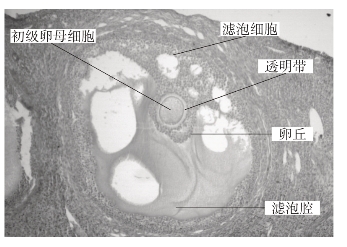
附图1-4 次级滤泡
实验注意事项
1.为了让固定液能渗入到精巢中,用解剖针在精巢上刺一些小孔。
2.用固绿乙醇溶液复染时,为避免过染,这一步一定要快。
3.将染色完成的切片取出,确保树胶能很好地扩散,在二甲苯未干燥时迅速在组织上滴加树胶。
思考题与作业
1.简述哺乳动物精子与卵子的发生过程。
2.卵子与精子在发育上有何异同。
3.简述HE染色的过程。
参考文献
丁汉波,仝允栩,黄浙.发育生物学[M].北京:高等教育出版社,1987.
曲漱惠,李嘉泳,黄浙,等.动物胚胎学[M].北京:人民教育出版社,1980.
杨轩.家兔卵巢石蜡切片HE染色影响因素的研究[J].安徽农学通报,2009,15(1):40-41.
(李巧峡,梁桂霞)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






