一、污染物的结构、毒性与微生物降解性之间的关系
生物降解(biodegradation)是指由于生物的作用将污染物大分子转化为小分子,实现污染物的分解或降解。而生物中由微生物所起的降解作用最大,所以又可称为微生物降解。完全的生物降解或矿化是将化合物氧化成CO2和水,为细胞生长和繁殖提供所需要的碳源和能量。微生物的代谢活性与污染物的结构及其物理化学性质密切相关,主要包括以下几个方面因素。
1.遗传潜能
遗传潜能即土著微生物群落的合适降解基因的存在与表达。通常在开始对污染物进行生物降解之前,土著微生物要经历一段适应或驯化期。通过适应过程,野生微生物难以降解的人工合成化合物能诱导必需的降解酶的表达;或微生物发生基因突变建立起新的酶系;或者微生物在不改变基因型的情况下,显著改变表型,进行自我代谢调节,来降解转化污染物。微生物群体适应的最常见情况是诱导出生物降解所需要的酶,接着降解生物群体的数量就会增加。通常适应期的长短取决于污染物结构。缺乏合适的生物降解酶往往是导致有机污染物持久性的一个常见原因,尤其是那些具备不常见结构的化合物,其结构是现存酶所不能识别的。因此,在正常条件下,与自然基质结构相似的污染化合物容易被降解;反之结构差异较大的通常降解缓慢,或者根本不能被降解。这时需要遗传改变的适应及适应群落的选择和发展。所需时间可能是数月或数年。
2.生物可利用性
影响有机化合物生物可利用性的第一因素是其水溶性。生物降解的第一步是细胞对底物的吸收,第二步才是对底物的代谢和降解。虽然有合适的降解途径,但如果污染物的存在状态影响到细胞对其的吸收,则降解难以快速进行。通常当污染物的水溶性有限,又被土壤和沉积物强烈吸附时,其降解会由于低生物可利用性而受到限制。例如,多氯联苯(PCBs)是一类高疏水性物质,水溶性很低,因此生物可利用性很差。
微生物可以直接利用溶解的有机化合物,或者细胞直接与有机化合物接触,还可以直接与分散在水相中的污染物(微米或亚微米的液滴)接触吸收液态有机物。通常在水溶性降低时微生物细胞直接与有机物接触的模式可以起到更重要的作用。微生物可产生糖脂、磷脂和脂肪酸、脂肽、脂蛋白质、聚合物等生物表面活性剂或乳化剂。表面活性剂可增加疏水性物质(如石油)的生物可利用率,从而提高污染物吸收和生物降解的速率。
另一个影响有机化合物生物可利用性的因素是土壤和沉积物对其的吸附作用。当污染物扩散到土壤基质的微孔后,由于孔径阻碍细菌无法进入,其生物可利用性会降低。最后,某些污染物在土壤基质中各种氧化酶的催化作用下可以掺入土壤有机质中去,这个过程称为腐殖化。作为土壤腐殖质物质正常转换的一部分,这些被固定或腐殖化的污染物残余仅能缓慢释放并被降解。
3.污染物结构
可以从以下几个方面分析化合物结构对微生物代谢活性的影响。
(1)空间效应 反应位点是降解酶与污染物底物接触并使转化步骤发生的部位。当反应位点被分支或功能基团阻塞后,污染物与酶在反应位点的接触就会受阻,这称为空间效应。在烃类化合物中,支链烷基越多越难降解就是此原因。
(2)电子效应 功能基团可以通过影响污染物与酶的相互作用而产生阻碍降解的电子效应。功能基团可划分为吸电子基团(如—Cl、硝基等)或供电子基团(如—CH3、羟基等),它们能改变反应位点的电子云密度。通常增大反应位点电子云密度的功能基团能提高生物降解速率,而减少反应位点电子云密度的功能基团能降低生物降解速率。由于氯原子强烈吸引电子云,使苯环上的电子云密度降低,氯原子数越多,苯环上的电子云密度越低,氧化越困难。
(3)毒性 石油烃或有机溶剂等非离子有机污染物能够破坏细胞膜的完整性,从而具有对微生物种群的毒性,这将影响到微生物对其的降解过程。
将污染物生物浓缩、毒性等环境性质与有机污染物的结构属性关联起来研究,可以发现这些性质与污染物结构的定量关系,即定量结构-活性关系(quantitative structure-activity relationship,QSAR)。QSAR模型能通过物理化学特征来预测大量非离子型有机物的毒性和对微生物的抑制作用。例如,用辛醇-水分配系数(Ko w)表征分子疏水性,发现随着苯酚氯代化程度的提高,化合物会更亲脂(更大的Ko w),对细菌生长具有更大的毒性。
二、影响污染物微生物降解的环境因素
污染物本身的状态与环境因素有关,环境中微生物的存在和丰富度也与环境因素有关。因此,环境因素对污染物的微生物降解存在重要影响。这些因素包括氧气、营养物可利用性、温度、pH、盐度和水活度等。
1.氧气
微生物降解转化污染物的过程可能是好氧的,也可能是厌氧的。污染物的微生物降解过程大部分是氧化还原过程,所以氧对污染物微生物降解的速率和程度影响非常重要。一般来说,好氧微生物降解要比厌氧过程快得多。例如,进入淡水湖泊和河流好氧区的石油类烃一般可较快地被微生物降解,但积累在厌氧沉积物中的石油降解一定是相当持久的。氧气对链烃如十六烷的降解特别重要,它只能在有氧的条件下被生物降解。苯、氧化芳香烃(苯甲酸盐和苯酚)和烷化芳香烃如甲苯在厌氧条件下能被生物降解,这时硝酸盐、铁离子和硫酸盐成为电子受体;但在厌氧条件下这些化合物生物降解比在好氧条件下要慢得多。
2.营养物可利用性
污染物降解取决于微生物种群生长繁殖及其活性大小,这些受微生物可利用的营养物所控制。因此,营养物可利用性对污染物的微生物降解有着重要影响。土壤中随着深度的增加,微生物数量会大量减少,这是营养物含量随深度递减造成的。微生物的生长除碳源外,还需氮、磷、硫、镁等元素。微生物在利用有机污染物特别是主要由碳和氢组成的烃时,也消耗像氮和磷这样的主要营养物。通常微生物依种类不同,生物量平均碳氮比为5∶1~10∶1。海水中N、P常是微生物增殖的限制因素。在漏油事故中常常因为氮磷含量不足限制了微生物对石油的降解,故适当添加氮磷可以促进油解。为避免营养盐的流失,有研究采用油溶性营养物如石蜡化尿素、磷酸三辛酯供石油降解菌利用,以增加降解效果。例如,美国路易安纳州原油泄漏后,在无补肥情况下几乎无石油降解,而加入氮磷后,水中油污3d内降解近73%。
3.温度
生物降解途径的每一步都是由细胞产生的特定酶所催化的,而温度正是酶反应动力学的重要影响因子。同时,微生物的生长速率以及化合物的溶解度等也受温度直接影响,因而温度对控制污染物的降解转化起着重要作用。烃类的环境降解与温度呈正相关,在0~40℃范围内每升高10℃,其生化反应速率增加2~3倍。一般情况下,温带和热带的石油经2~6个月得到降解,寒带则要几年,而极地更难以分解。温度还可以影响水分的供应、烃类的物理状态。这些都影响微生物的降解过程。例如,在河流沉积物中十六烷和萘的降解速率在冬季(0~4℃)相比夏季(8~21℃)分别下降至1/4.5和1/40。
4.pH
对于不同的微生物,其生长和繁殖的最佳pH范围不同。因此,环境酸碱度对生物降解有着很大的影响。通常在pH4~9范围内微生物生长最佳。在酸性土壤中,真菌在烃降解中发挥更重要的作用;细菌和放线菌更适应在中性到碱性的环境中发挥作用。氧化亚铁硫杆菌(Thiobacillus ferrooxidans)等嗜酸细菌在强酸性条件下代谢活性更高;芽孢杆菌属等细菌则可在强碱性环境中发挥其降解转化作用。pH还对污染物状态、溶解度有着重要影响。在碱性条件下,羧基、巯基、羟基等的电离会增加污染物的溶解度;而酸性条件下,氨基转化为铵离子将增加污染物的溶解度。又如,碱性条件下,污染物的羟基、巯基的电离会加速污染物的氧化;而在酸性条件下,污染物的氨基会转化为铵离子,这时供电子基团转化为吸电子基团,从而降低污染物被降解的可能性。
5.盐度和水活度
不同微生物对环境盐度的适应性是不同的。淡水沉积物加盐培养后显示,嗜盐菌和耐盐菌对烃的降解速率降低;相反,港湾沉积物增加盐度的培养对烃降解的影响很小。
对好氧土壤微生物的活动来说,38%~81%的土壤孔隙空间(也称为百分饱和度)是最适条件。因为在这种水含量范围内,水和氧气的可利用性达到最大化。在更高含水量时,氧气在水中的慢速扩散限制了氧气的补充,从而制约了微生物的好氧活性;而较低的含量则限制了水的可利用性。
三、有机污染物的微生物降解途径
人类的工业活动产生了数量巨大的化学物质。这些化合物通过正常处理途径或泄露不可避免地进入了环境。大多数进入环境的有机污染物分子结构的基础是以下3种结构中的一种:脂肪烃、环烷烃和芳香烃。它们的降解途径分别介绍如下。
1.脂肪烃的生物降解
石油烃中的直链烃、支链烃、线性烷基苯硫酸盐都属于脂肪烃类污染物。
(1)烷烃 从环境样品中很容易分离出直链烷烃的降解微生物,因此,烷烃通常被认为是最容易被降解的烃类型。其降解最常见的途径是通过单加氧酶把一个氧原子掺入烷烃末端碳中的一个,生成伯醇;另一种途径是通过双加氧酶将两个氧原子掺入烷烃,生成过氧化物。这两种途径的最终结果都是生成伯脂肪酸。脂肪酸是存在于所有细胞中的一般代谢物。分解脂肪酸的一般途径是通过β-氧化连续切下二碳片段,每个二碳片段被辅酶A以乙酰CoA的形式脱下,接着进入三羧酸循环并被彻底矿化为CO2和水。通常中等大小的直链脂肪烃化合物(链长10~18碳)比更短或更长的烷烃更容易被微生物利用。长链烷烃由于水溶性极低,因而被微生物降解的速率很慢;短链的直链烷烃具有稍高的水溶性,可以增加细胞对烃的吸收,但随后短链烷烃会溶解在细胞膜中,这些短链烷烃的存在能改变细胞膜的流动性和完整性,从而对细胞具有毒性。
(2)烯烃 烯烃和烷烃具有相当的生物降解速率。单烯开始降解的步骤包括对末端或亚末端甲基的氧化攻击;另外的开始步骤是攻击双键,产生醇类和环氧化物。而这些最初的降解产物都会被进一步氧化生成伯脂肪酸,如烷烃一样经β-氧化被降解。
(3)卤代脂肪烃 卤代脂肪烃比没有卤代的脂肪烃生物降解要慢得多。卤代脂肪烃的生物降解有3种基本类型:①亲核的取代反应(反应物带来一对电子),一卤化合物或二卤化合物的卤原子被羟基取代。②由单加氧酶和双加氧酶催化的选择基团的氧化反应,这些酶能氧化高度氯代的C1和C2化合物。这些酶由能够氧化甲烷、甲苯各种非氯代化合物的细菌产生,没有严格的底物专一性,故参与对氯代脂肪烃的共代谢降解。③还原脱卤,这是由还原性转换金属配合物控制的,一般发生在厌氧环境。在还原脱卤的第一步,电子由还原性金属转移到卤代脂肪烃上,产生一个烷基和一个游离卤原子,而烷基基团能吸引一个氢原子或失去第一个卤原子形成一个烯烃。通常好氧条件有利于较少卤代取代基的化合物的生物降解;而厌氧条件有利于较多卤代取代基的化合物的生物降解。然而在厌氧条件下,高度卤代脂肪烃的降解不完全。故有研究提出,采用交替厌氧和好氧处理这些卤代物,开始厌氧条件下处理降低其卤代程度,然后充氧创造好氧条件使卤代物完全降解。
2.环烷烃的生物降解
环烷烃是原油的主要成分,在自然界主要存在于植物油、石蜡、微生物的脂质以及杀虫剂中。环烷烃化合物生物降解的研究相对较少。目前,利用富集技术分离能降解环烷烃的微生物纯培养物比较困难。环烷烃的降解过程被认为主要是一个共生和共代谢反应。例如,已知有两种假单胞菌能通过共代谢作用降解环己烷,它们利用庚烷作为碳源与能源,把环己烷氧化为环己醇,环己醇接着被球形诺卡菌(Nocardia globerula)以及其他微生物所降解。
环烷烃类的生物降解中环烷烃被氧化为一元醇。大多数细菌对环烷醇和环烷酮的代谢是通过内脂中间体断裂而实现的。大多数利用环己醇的微生物菌株,也能在一些脂环化合物中生长,包括环己酮、顺(反)-环己烷-1,2-二醇和2-羟基环己酮。环己烷分解代谢的可能途径如图11-5所示。
图11-5 环己烷的生物降解途径
含有一个或两个羟基、羧基、羰基的环戊烷和环己烷的衍生物易于被代谢,它们的降解菌也易于从环境样品中分离得到。相反,那些含有一个或几个甲基的脂环烃衍生物阻碍降解。环己醇烷基派生物生物降解速率递减的顺序为:环己醇>甲基环己醇>二甲基环己醇。
3.芳香烃的生物降解
芳香烃化合物含有至少一个不饱和苯环结构,通常是C6R6,R可以是任何基团。苯(C6H6)是这个不饱和环状化合物家族的基础。含有两个或更多苯环合在一起的芳香环化合物被称为多环芳烃(PAHs)。芳香烃是天然产物。矿石燃料的开采利用、木材和煤的燃烧,使进入环境的芳香烃化合物明显增多。
大量细菌和真菌能够在各种环境条件下部分或完全转化芳香烃化合物。光合作用微生物,特别是蓝细菌在烃类降解中发挥重要的直接和间接作用,如Anabaena cylindrica、Phormidium faveolarum和Agmenellum quadruplicatum等蓝细菌能降解芳香烃化合物。在海洋水体中,丰富的蓝细菌在泄露石油的降解中可能发挥更重要的作用。在藻丛中,蓝细菌与降解原油的细菌缠结在一起,防止其被冲走。蓝细菌生长繁殖产生氧,其固氮作用产生生物可利用的氮。这些间接作用都有利于其中细菌的生长繁殖和降解原油。在好氧条件下,最普遍的转化是把分子氧掺入芳香烃的羟化作用。催化最初反应的酶是单加氧酶和双加氧酶,接着是邻位或间位开环直至完全降解。
(1)苯 单环芳香烃如苯,首先在双加氧酶催化下转化为顺-1,2-二羟-1,2-二氢苯。该化合物进一步转化为儿茶酚。然后儿茶酚以两种途径进一步代谢:邻位裂解产生顺,顺-黏康酸;间位裂解产生2-羟黏康酸半醛。这两个途径产生的化合物都能进入三羧酸循环而进一步代谢。苯降解的开始两个步骤与多数其他单环和多环芳香烃的降解是一样的(图11-6)。
图11-6 苯的生物降解途径(邻位、间位)
(2)甲苯 甲基化的芳香烃衍生物如甲苯(toluene)的降解步骤如下:首先侧链的烷基被攻击,侧链经氧化生成相应的苯甲酸,然后是苯环的羟基化和开环。Burkholderia sp.JS 150具有宽底物范围的甲苯双加氧酶,同时具有用以降解甲苯的邻-单加氧酶和对-单加氧酶。在JS150菌株,还存在另外一组单加氧酶,这使得此细菌能进行多种烷基和氯取代单环芳香烃的降解。它们由tbc1和tbc2基因族编码,与邻-单加氧酶和对-单加氧酶具有一定程度的同源性。实验证明这些tb c基因具有新的独特功能。这些多种不同功能氧化酶的存在,是JS 150菌株能降解较大范围芳香烃底物的原因。tb c2在非活化的烷基和氯芳香烃初始降解中发挥作用,而tbc1在随后的降解步骤中发挥作用。
(3)苯酚 苯酚经微生物单加氧酶氧化转变为邻苯二酚,邻苯二酚沿邻位裂解途径生成β-酮己二酸,然后生成乙酰-CoA和琥珀酸,最后进一步氧化成CO2和H2O。苯酚的降解途径如图11-7所示。
图11-7 苯酚的降解途径
(4)苯乙烯 土壤中存在多种能降解苯乙烯的微生物,如Pseudomonas、Rhodococcus、Nocardia、Xanthobacter和Enterobacter等细菌。苯乙烯的好氧降解主要有两个途径:一是以乙烯基侧链的氧化开始,另一个是芳香环的直接氧化。在侧链氧化中乙烯基环氧化,然后异构化而生成苯乙醛,随后氧化成苯乙酸。在芳香环直接氧化中,由2,3-双加氧酶催化生成3-乙烯基儿茶酚,然后转化为乙醛和丙酮酸盐(图11-8)。
芳香烃化合物的厌氧矿化通常需要一个混合的微生物群落共同作用。例如,苯酸盐的矿化就是通过厌氧生长的苯酸盐降解菌和甲烷、硫酸盐还原菌的共培养实现的。在这样的系统中,最初的转化是发酵过程,产生芳香酸,接着转化为乙酸盐、CO2和甲酸盐,这些小分子物质能被产甲烷菌利用。这种混合群落称为共生菌群。
(5)多环芳烃微生物对PAHs的降解一般通过两种方式:①以PAHs作为唯一碳源和能源生活而将其降解;②把PAHs与其他有机质共代谢(或共氧化)而降解。
通常含1~3个聚合环的芳香烃化合物转化较快且经常被完全矿化;4个或更多聚合环的芳香烃化合物转化要慢得多,且常是共代谢过程。这是由于其较低的生物可利用性决定的。这些物质的水溶性很有限,而且经常被土壤和沉积物强烈吸附。共代谢作用可以提高微生物降解PAHs的效率,改变微生物碳源与能源的底物结构,增大微生物对碳源和能源的选择范围,从而达到难降解PAHs最终被微生物利用并降解的目的。
图11-8 细菌降解苯乙烯的主要途径
图中的数字标明了能进行此代谢步骤的微生物:1—P. putida CA-3 2—Xanthobacter strain 124X
3—Xanthobacter strain S5 4—P.fluorescens ST 5—Pseudomonas sp.strain Y2
6—Corynebacterium strain ST-10 7—Rhodococcus rhodochrous NCIMB 13259
PAHs降解过程实际上是一系列酶促反应过程,微生物降解PAHs依赖于酶的活性。真菌产生单加氧酶,细菌产生双加氧酶。在目前已知的代谢途径中,芳香环通过羟基化后经过环的开裂再进一步代谢,已成为最为显著的共性。在细菌对多环芳烃的代谢过程中有两个关键酶,即第一步反应的起始双加氧酶,在它的作用下完成氧对芳香烃的攻击;另一个是芳香环开环裂解,即邻苯二酚双加氧酶,在它的作用下使PAHs彻底开环裂解,生成TCA循环中间物(图11-9)。
目前已知的能催化氧化芳香烃类化合物的双加氧酶大约有40余种。编码降解PAHs关键酶的基因有的位于染色体上,有的位于质粒上。萘是最简单的PAHs。土壤中假单胞菌的萘代谢通常被位于大质粒上的基因所调控,其中研究最透彻的是恶臭假单胞菌G7的83kb NAH7质粒。NAH7质粒含有能降解萘的一组基因,能够编码萘开始氧化11步所需要的酶。这种质粒及相关质粒在被PAHs污染的地带经常被发现。
在一些假单胞菌的菌株中,相继报道了编码萘上游代谢途径酶的基因的核苷酸序列:Pseudomonas putida NCIB9816的ndo基因、Pseudomonas putida G7和NCIB9816-4的nah基因、Pseudomonas sp.Strain C18的dox基因、Pseudomonas putida OUS82和Pseudomonas aeruginosa PaK1的pah基因以及Pseudomonas stutzeri AN10的nah基因等。在这些菌株的上游代谢途径基因中,基因的组织和序列的相似性(大约90%)均与Pseudomonas putids G7的NAH质粒的nah基因非常相似,它们通常被称为“经典nah-like基因”。对于AN10,降解基因位于染色体上而非质粒上。AN10的降解基因完整序列已被确定,上游序列为nahAaAbAcAdBFCED,下游序列为nahRGTHINLOMKJ。
图11-9 多环芳烃的生物降解途径
萘与蒽可以看作致癌多环芳烃如苯并芘等的前体。萘与蒽能被微生物的双加氧酶催化,引入氧分子的两个氧原子而生成顺二氢二醇衍生物(cis-dihydrodiols)。分枝杆菌(Mycobacterium)类细菌能通过双加氧酶和单加氧酶催化蒽的降解,在多个芳香环上加氧而启动生物降解。Mycobacterium sp.AP1降解PAHs的亚甲基氧化途径见图11-10,环氧化与邻位断裂途径见图11-11。
图11-10 Mycobacterium sp.AP1降解PAHs的亚甲基氧化途径
Mycobacteriumsp.AP1能以芘作为唯一碳源和能源,通过单加氧酶或双加氧酶催化进攻芘的C4、C5位而分别生成反或顺-4,5-二羟基-4,5-二氢芘。此顺二氢二醇衍生物邻位断裂生成4,5-菲二羧酸,4,5-菲二甲酸脱羧生成菲4-甲酸,然后通过邻苯二甲酸而降解。另一个途径是芘中间两个环的断裂,形成6,6′-二羟基-2,2′-二苯基二甲酸。除此之外,AP1还能利用十六烷(hexadecane)、菲和荧蒽(fluoranthene)。Mycobaterium sp.AP1还可氧化芴(fluorene)和二氢苊(acenaphthene)亚甲基,实现环的二羟基化和邻位断裂,从而分别生成2-carboxycinnamic和diphenic acids(图11-12)。
图11-11 Mycobaterium sp.AP1降解PAHs的环氧化与邻位断裂途径
图11-12 Mycobacterium sp.AP1降解芘的途径
(6)含取代基的芳香烃化合物 微生物降解含取代基的芳香烃化合物特别是氯代芳香烃化合物很困难。这是因为氯原子是吸电子基团,它降低了芳香烃的电子云密度;取代基氯原子越多,此效应越强,使得芳香环变得越难降解。卤代化合物通常并不来自于自然界,而是人为合成的。有机氯因为它们的疏水性,允许其通过或进入细胞膜,能阻止氧化磷酸化,以此破坏细胞活性。所以有些有机氯是杀生物剂。微生物降解这些有机氯必须克服它们增加的毒性和在水中的低溶解度。当有机氯化合物为许多异构体的混合物时,则更进一步降低了它们被降解的速率,如多氯联苯。所以它们是持久性有机污染物。
已经确定有些氯化芳香烃降解的需氧途径和厌氧途径。这些氯化芳香烃通常与多环芳烃(PAHs)降解途径相似,通过单加氧酶和双加氧酶加氧后裂解。而卤化物降解中额外的步骤是脱卤化过程,存在4种可能的脱卤方式。①氧化脱卤:卤原子被移去,代之为两个羟基;②消除脱卤:以消除反应同时脱去卤原子和氢原子;③水解(取代)脱卤:一个卤原子被一个羟基取代;④还原脱卤:卤原子被氢原子取代。
①五氯酚的生物降解:五氯酚是除草剂和用作木材防腐的杀真菌剂,是一个危险污染物。因为它毒性大,已停止生产应用。已分离出许多微生物可在需氧条件和厌氧条件下降解五氯酚,如黄杆菌属(Flavobacterium)、节杆菌属(Arthrobacter)、红球菌(Rhodococcus)和白腐真菌黄孢原毛平革菌(Phanerochaete chrysosporium)等。(https://www.daowen.com)
氯酚裂解的多数途径是脱氯、芳香环羟基化,然后裂解。这里的羟基化和芳香环裂解与多环芳烃降解情形相似,由加氧酶催化(图11-13)。
图11-13 五氯酚的好氧降解和厌氧降解
②1,2,4-三氯苯的生物降解:1,2,4-三氯苯(1,2,4-trichlorobenzene,1,2,4-TCB)是应用最广的氯苯之一,可用作染料溶剂、杀虫剂中间体、传热介质、变压器的介电液体、除油剂和润滑剂等,因而成为普遍存在的环境污染物。高氯苯只能被还原脱氯(reductive dechlorination)开始降解,而低氯苯能在好氧条件下矿化。已观测到一氯苯、二氯苯、三氯苯甚至四氯苯的好氧矿化(aerobicmineralisation)。有些菌株能以氯苯作为唯一碳源和能源。在好氧条件下,1,2,4-TCB在足够营养存在下能被土著细菌少许降解。在土壤淤泥和活性淤泥中,1,2,4-TCB不被降解,但是在接种了能降解一氯苯和1,4-二氯苯的绿脓杆菌后,1,2,4-TCB被共降解。当一氯苯和二氯苯消耗完后,此共降解将停止。莱茵河河底的土著细菌不能降解1,2,4-TCB,但接种了Pseudomonas sp.菌株P51后,导致快速降解。
③2,4-二硝基甲苯的生物降解:在相关工业生产中,已经有不少2,4-二硝基甲苯(2,4-dinitrotoluene,2,4-DNT)释放进入环境。由于2,4-DNT具有毒性和致癌性,因而对环境危害较大。伯克霍尔德菌(Burkholderia sp.)DNT菌株能好氧降解2,4-DNT。其降解途径第一步为2,4-DNT双加氧反应,形成4-甲基-5-硝基儿茶酚(4M5NC),然后4M5NC经过单加氧反应形成2-羟基-5-甲基醌(2H5MQ),并释放出亚硝酸盐,2H5MQ被还原为2,4,5-三羟基甲苯(2,4,5-THT),接着2,4,5-THT开环断裂。相应的dntA、dntB和dntD基因分别编码2,4-DNT双加氧酶、4M5NC单加氧酶和2,4,5-THT加氧酶(图11-14)。
图11-14 Burkholderia sp.DNT菌株降解2,4-DNT的途径
DntA—2,4-DNT双加氧酶 DntB—4M5NC单加氧酶 DntC—2H5MQ还原酶 DntD—THT加氧酶
④多氯联苯的生物降解途径:多氯联苯(polychlorinated biphenyls,PCBs)虽然因为其毒性已被永久禁用了,但由于过去PCBs应用广泛,难降解,某些污染地和沉淀物中还存在PCBs。PCBs能被好氧降解。第一步类似于单环芳香烃的降解,由双加氧酶催化。该双加氧酶的性质与氧化萘和甲苯的双加氧酶相似。联苯的降解途径见图11-15。
微生物具有代谢PCBs的能力,并以两种方式降解PCBs:一种是无机化,即在好氧或厌氧条件下以PCBs为碳源或能源,降解的同时满足自身生长和繁殖的需要;另一种是共代谢,即微生物生长代谢过程中以另外一种基质作为碳源或能源,同时转化目标污染物。
图11-15 联苯的降解途径
PCBs的降解包括厌氧降解和好氧降解。一般来说,高氯(≥5个氯)PCBs因其稳定性更高,疏水性更强,最初作为电子受体被微生物厌氧降解。在此过程中循序渐进地脱氯,把高氯转化为低氯,其疏水性也随氯原子的减少而降低。而低氯PCBs很少发生厌氧脱氯,而是倾向作为电子供体成为好氧降解的理想基质。
参与厌氧脱氯的微生物种类较多。它们通过催化还原反应把脂肪族和芳香族的氯代化合物从高氯转化为低氯或无氯的物质。目前已经分离到的有蒂氏脱硫念珠菌(Desulfomonile tiedjei)、脱亚硫酸菌属(Desulfitobacterium)、脱卤素杆菌(Dehalobacter restrictus)、四氯乙烯还原脱氯细菌(Dehalospirillum multivorans)、Desulforomonas chloroethenica、辛乙烯脱卤拟球菌(Dehalococcoides ethenogenes)、肠杆菌(Entherobacter)MS21和成团肠杆菌(Enterobacter agglomerans)。其中一些以共代谢的方式脱氯,而另一些则在能量代谢中把氯代化合物作为电子受体。
尽管低氯的PCBs化学性质相当稳定,但在有氧条件下,它们还是能被微生物降解或转化的。这些微生物包括伯克霍尔德菌(Burkholderia spp.)、假单胞菌(Pseudomonas spp.)、鞘氨醇单胞菌(Sphingomonas spp.)、红球菌(Rhodococcus spp.)、微球菌(Microccus spp.)、诺卡氏菌(Norcardia spp.)、节杆菌(Arthrobacter spp.)、不动杆菌(Acinetobacter spp.)、两面神菌(Janibacter spp.)、芽孢杆菌(Bacillus spp.)以及棒状杆菌(Corynebacterium spp.)的一些菌株。
PCBs的好氧代谢需两组基因,一组可以将PCBs降解为氯代苯甲酸,该基因命名为bph基因;另一组负责氯代苯甲酸的降解。除了联苯和单氯联苯可作为微生物的生长基质外,1个氯原子以上的PCBs的好氧化均为共代谢过程。即微生物在利用联苯作为生长基质时,所产生的氧化酶专一性不高,也能同时将其结构相似物PCBs氧化为氯代苯甲酸。
4.化学农药的生物降解
微生物对农药的降解机理主要为矿化作用和共代谢。有些微生物可以农药为唯一碳源、能源,直接利用或通过产生诱导酶进行降解(有脱卤、脱烃、水解、氧化、还原、裂解等生化反应);许多微生物通过共代谢作用使农药降解,特别是结构复杂的农药多靠此种方法得以转化消失。如芽草平和2,4,5-T都可以通过共代谢作用转化成为3,5-二氯邻苯二酚;后者也是某种节杆菌(Arthrobacter sp.)代谢2,4-D的中间产物,进而可被一种无色杆菌属(Achromobacter sp.)细菌所共代谢。
农药的降解与降解性质粒有密切的关系,许多降解基因均位于降解性质粒中。正是这些降解质粒表达产生的各种酶类,使得复杂的农药分子逐步矿化(表11-2)。产碱杆菌中存在对除草剂2,4-D降解起决定性作用的PJP1质粒,该质粒可以表达降解2,4-D的一系列酶类。
表11-2 目前部分已明确的农药降解基因及其合成的酶类
有机磷农药是一类高效、高毒的农药品种,比有机氯农药容易降解。微生物降解这些杀虫剂的最常见反应机制是脂酶水解过程。对硫磷(parathion)在对硫磷水解酶的作用下形成二乙基硫代磷酸和对硝基苯酚(图11-16)。对硝基苯酚可在土壤中被其他微生物降解。已发现黄杆菌属、假单胞菌属的一些菌株均可诱导生成对硫磷水解酶。
图11-16 对硫磷的主要降解途径
四、微生物对金属的作用
金属(主要是指重金属)不能被微生物降解,并且对生物体有毒害作用,但微生物对金属又有一定的抗性和解毒作用,可以吸附和转化金属。两者间相互作用的研究可为湿法冶金、环境污染评价及生物净化提供理论依据。近年来,正是基于微生物对金属的积累和解毒作用,以净化有毒金属或回收有经济价值的金属为目的的生物处理技术日益成熟,形成了与常规的物理、化学处理技术并存,相互补充、共同完善、协调发展的新格局。微生物巨大的环境保护功能(生态毒理评价和生物修复)显得越来越重要。研究和运用微生物与重金属间的相互作用将具有明显的生态效益、社会效益和经济效益。
1.环境中金属的微生物可利用性
(1)环境中金属的存在形态 沉积物或土壤中金属的形态可分为:可交换态、碳酸盐结合态、铁锰氧化物结合态、有机物结合态和残渣5种形态;也可以划分为7种形态:水溶态、易交换态、无机化合物沉淀态、大分子腐殖质结合态、氢氧化物沉淀吸收态或吸附态、硫化物沉淀态和残渣态;或者8种形态:水溶态、交换态、碳酸盐结合态、无定形氧化锰结合态、无定形氧化铁结合态、晶体型氧化铁结合态、有机物结合态和残渣态。
①可交换态:是指吸附在黏土、腐殖质及其他成分上的金属,可用一价或二价的盐浸提。它们是引起土壤金属污染和生物体危害的主要根源。此外,由于水溶态金属的含量较低,又不易与交换态区分,人们常将水溶态合并到可交换态中。
②碳酸盐结合态:是指金属元素在碳酸盐矿物上形成的沉淀或共沉淀结合态。该形态金属对土壤pH最敏感:当pH下降时,易重新释放出来而进入环境中;相反,pH升高则有利于碳酸盐的生成。
③铁锰氧化物结合态:是指与铁、锰氧化物反应生成结合体或包裹于沉积物颗粒表面的部分金属。该形态金属的最大特点是在还原条件下的稳定性较差。当环境的氧化还原电位(Eh)下降时,这部分形态的金属可能会被释放,具有潜在危害性。铁锰氧化物结合态还可进一步划分为无定形氧化锰结合态、无定形氧化铁结合态和晶体形氧化铁结合态等3种形态。
④有机物结合态:是指土壤中各种有机物如动植物残体、腐殖质及矿物颗粒的包裹层等与土壤中的金属螯合或生成硫化物。在碱性或氧化环境下,该形态金属可转化至活性态,从而导致土壤污染和生物体危害。有机物结合态也可分为有机物疏松结合态和有机物紧密结合态。
⑤残渣态:是土壤金属最重要的组成部分。它们一般存在于硅酸盐、原生和次生矿物等土壤晶格中,是自然地质风化过程的结果,在自然界正常条件下不易释放,能长期稳定在沉积物中,不易为植物吸收。一般情况下,残渣态金属的含量可以代表金属元素在土壤或沉积物中的背景值。
(2)影响金属生物可利用性的因素 根据生物对金属不同形态的吸收难易程度,将金属形态分为3类:可利用态(溶解的、不被吸附的、可移动的)、潜在可利用态和不可利用态(沉淀的、被配合的、被吸附的和不可移动的)。可被生物利用的金属能被生物吸收富集并对生物系统产生毒性作用。
金属的生物可利用性受螯合剂、阳离子交换能力、pH、氧化还原电位(Eh)等环境因素的影响。当这些环境因素变化时,金属的形态含量及其分布发生一定的变化,金属的生物可利用性也随之变化。
①螯合剂:随着EDTA浓度的增加,土壤中Cu、Zn、Cd、Pb、Ni可溶态金属的含量占总含量的比例增加。向土壤中加入柠檬酸和苹果酸后,土壤中水溶态Cu的含量有所提高,但对交换态Cu没有影响。不同螯合剂对土壤中不同金属的活化能力不同,如EDTA对Pb的活化能力最强,而EGTA对Cd的活化能力最强。不同螯合剂对同一金属元素的活化能力也不相同,如对Pb的活化能力大小是EDTA>HEDTA>DTPA>EGTA>EDDHA。
②阳离子交换能力:土壤阳离子交换能力(cation exchange capacity,CEC)是影响金属生物可利用性的最重要因素之一,它反映了土壤吸附金属的能力。在CEC较高的土壤中(富含有机质和黏质的土壤)金属的毒性常常较低,甚至总金属浓度很高时也是如此。相反,CEC较低的沙质土,由于对金属的低结合力,在金属浓度相对较低的情况下也能降低微生物活性。土壤有机质中的非腐殖质物质如碳水化合物、蛋白质和核酸通常易于被降解,在土壤中的存留时间相对比较短,因此它们对金属的影响较小。然而在短期内,有机酸易于降解而形成的羧酸盐阴离子能和金属离子形成复合物,降低了金属的生物可利用性。
③氧化还原电位:金属的生物可利用性随氧化还原电位的改变而改变。在氧化性或好氧条件下(0~800mV),金属大多以溶解的阳离子形态出现,如Cu2+、Cd2+、Pb2+和Ca2+。相反,还原性或厌氧条件(-400~0mV)常导致金属沉淀。这种情况常见于沉积物或饱和土壤中。例如,在那些富含硫和硫酸盐还原菌的地带,产生的硫化物可用于生成不溶性的、无毒硫化物,如CuS和PbS。另外,在富含碳酸盐的土壤中会形成金属碳酸盐沉淀,如CdCO3,金属由易于被微生物利用的溶解态转化为难以被利用的碳酸盐结合态。
④pH:对金属离子而言,一个系统的pH对金属的溶解性有显著影响,因而也影响金属的生物可利用性。在高pH时,金属主要以不溶解的金属无机磷酸盐和碳酸盐形式存在;而低pH时主要以游离金属离子或溶解的有机金属态出现。系统的pH还对土壤表面对金属的吸附产生影响,该影响主要是土壤和有机颗粒的静电荷变化的结果。当pH上升时,依赖pH的阳离子交换能力会增加,因此加强了金属与土壤成分的静电吸引。如前所述,随着pH的上升,金属的溶解性下降。因此,土壤pH上升的净效应是减小了金属的生物可利用性。相反,土壤pH下降时,金属溶解性提高,依赖pH的交换能力减弱,提高了金属的生物可利用性。对低pH土壤中的阴离子金属(如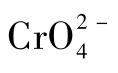 ),随着土壤颗粒所带正电荷的增加会增强与其的吸附作用。随着pH的增加,阴离子的归宿会高度依赖于如氧化还原电位在内的其他环境因子。
),随着土壤颗粒所带正电荷的增加会增强与其的吸附作用。随着pH的增加,阴离子的归宿会高度依赖于如氧化还原电位在内的其他环境因子。
2.金属和类金属的生物甲基化
有一些特性介于金属与非金属之间的元素,称为类金属,如硼、硅、锗、砷、锑、碲和钋等7种元素一般被视为类金属。自从Challenger证明生长于含砷(As)壁纸上的霉菌能将砷的三氯化物转化为三甲基砷,而硒(Se)、碲(Te)的氧化物也存在类似的生化过程后,引起了人们对金属、类金属元素生物甲基化行为研究的极大兴趣。甲基化是许多金属、类金属元素参与生物地球化学循环的重要迁移转化过程。该过程对某些元素能起到降低其毒性的作用,例如,As5 +甲基化产物的毒性要小于砷酸盐;而对另外一些元素则可以加强其毒性,如甲基汞的毒性比相应的无机态大得多,它是一种强有力的神经毒素,也是日本水俣病事件中的致病化合物。能发生生物甲基化反应的金属和类金属元素主要有汞、砷、铅、锡和硒等。
(1)汞 环境中存在着金属汞、有机汞化合物和无机汞化合物3种形态的汞(图11-17)。不论是何种形态的汞均具有毒性,但毒性大小不同。以无机汞化合物毒性最小,烷基汞的毒性较大,甲基汞的毒性比无机汞高50~100倍。
图11-17 汞循环
许多微生物可以使无机汞甲基化,得到甲基汞(一甲基汞或二甲基汞)。
能进行汞甲基化的细菌有匙形梭菌(Clostridium cochlearium)、荧光假单胞菌、草分枝杆菌(Mycobacterium phlei)、产气肠杆菌(Enterobacter aerogenes)、巨大芽孢杆菌(Bacillus megaterium)等;真菌中有粗糙脉孢霉(Neurospora crassa)、黑曲霉(Aspergills niger)、短柄帚霉(Scopulariopsis brevicaulis)及酿酒酵母等。
在自然界,硫细菌也是甲基汞的重要制造者。受到酸雨影响的水域具有较低的酸度,底泥中硫细菌十分活跃,可以促进甲基汞的生成。厌氧条件下甲基汞的产率优于有氧条件下的反应。因此,甲基汞多富集在缺氧的底泥中。此外,一些哺乳动物消化系统中共生的微生物群落,如从小鼠盲肠中取得的细菌,也能够使Hg2Cl2发生甲基化反应。
在代谢过程中,汞的生物甲基化往往与甲基钴氨素有关。甲基钴氨素中的甲基活性基团,易被亲电子的汞离子夺取而形成甲基汞。甲基钴氨素(或者还有其他产甲基的媒介物)把甲基转移给重金属离子后,本身成为还原态。汞的生物甲基化被认为是微生物自身的解毒机制。带一个甲基基团的甲基汞离子,既具有水溶性又具有脂溶性,易于随代谢产物排出细胞外。二甲基汞在常温下为气体,不溶于水,生成后便扩散到周围的环境中了。因此,这两种形式均有利于单细胞生物排除汞。
(2)砷 砷分布于自然界,广泛用于合金、农药、木材保存及医药制品中。砷具毒性,含三价砷的亚砷酸盐的毒性比含五价砷的砷酸盐更大。在自然界中,细菌如甲烷菌(Methanobacterium)和脱硫弧菌(Desulfovibrio),酵母菌如假丝酵母(Candida),霉菌如镰刀霉、曲霉、帚霉(Scopulariopsis)和拟青霉(Paecilomyces)等均能使砷发生生物甲基化反应。
砷存在两个系列的甲基化产物。一个系列为As(V)甲基化,可得到一甲基砷酸CH3 As(OH)2或其盐类、二甲基砷酸(CH3)2AsOOH或其盐类,以及三甲基砷氧化物(CH3)3AsO(图11-18)。甲基化砷(V)的毒性较相应的无机砷盐低。随着甲基基团的增加,三甲基砷(V)的毒性致死量比无机砷降低3个数量级。另一个系列为As(Ⅲ)的甲基化产物,即一甲基砷CH3AsH2、二甲基砷(CH3)2AsH和三甲基砷(CH3)3As,都是剧毒化合物。与前者相反的是随着甲基基团数目的增加,As(Ⅲ)化合物的毒性也逐步加强。
图11-18 砷的微生物甲基化过程
在流动水体中,发生甲基化的砷少于1%;而湖水中发生甲基化的砷超过50%。砷的甲基化与温度具有相关性,因此水体中甲基化砷的含量存在季节性的变化。甲基砷化合物可以通过食物链富集,并逐步增加甲基基团,因此处在食物链末端,遭到砷毒害的动物体内一般含有较高含量的三甲基砷化合物。
(3)铅 铅在地球上的分布很广,用途亦非常广泛。四甲基铅是无机铅盐的甲基化产物,常温下为气体,可以吸附于肺部,并轻易进入血液循环系统,对人体的危害比其他铅化合物更强。在实验室内,将适当的碳、氮养料加至几个大湖的底泥样品中,经过培养,可见有挥发性的四甲基铅产生。
关于铅发生的甲基化反应还有一些争议:有人认为铅可以由微生物通过生物途径甲基化;但也有资料称在实验中找不到铅能发生生物甲基化反应的证据,其甲基化过程只能通过纯化学过程进行。纯培养的假单胞菌属、产碱杆菌属、黄色杆菌属及气单胞菌属中的某些种,能将乙酸三甲基铅转化生成四甲基铅,但不能使无机铅化合物进行转化。
(4)锡自然水体中的甲基锡浓度很低。由于甲基锡化合物广泛应用于PVC稳定剂、杀菌剂和杀螨剂,因此人为源释放是自然界存在的甲基锡的重要来源。研究发现,无机锡如SnCl4·5H2O也存在甲基化过程,一甲基锡、二甲基锡、三甲基锡、四甲基锡化合物均可在该过程中形成。甲基锡和甲基汞常相随而生。在这种情况下,甲基汞不是由于生物甲基化作用,而系非生物学原因产生,是由于生物形成的甲基锡经烷基转移作用,使汞转化为甲基汞所致。
(5)硒硒发生甲基化反应的产物为二甲基硒CH3SeCH3、二甲基二硒CH3Se2CH3以及二甲基硒氧化物(CH3)2SeO2,前两种化合物是硒参与地球化学循环的重要形式。对硒而言,其甲基化是部分的解毒机制,因为二甲基硒的毒性不强,是生物体排除剧毒的硒氢化物的途径之一。
3.微生物对金属的抗性和解毒机制
(1)微生物对金属的抗性 含有金属的外界环境会引起微生物产生对金属的抗性。微生物可以通过自身染色体、转座因子、质粒等产生抵抗机制来适应金属的毒性。
已经鉴定了几种对某些金属具有抗性的菌株。这些菌大多是好氧的,如大肠杆菌、绿脓杆菌、芽孢杆菌(Bacillus spp.)等。也发现一些专性厌氧细菌对无机汞[Hg(Ⅱ)]和有机汞具有抗性,如类杆菌(Bacteroides)和梭菌。微生物对金属的抗性系统可能开始形成于原核生物,几乎所有的细菌都具有这种抗性。在生物机体中,抗性的产生一般通过共轭结合和转移两种作用。有些情况下,微生物对抗生素和金属的抗性是由同一质粒介导产生的。
必需金属是微生物营养的一部分,高浓度的金属会对微生物产生毒害作用。有些必需金属只有在一定的价态下才能被生物利用,如铁[Fe(Ⅱ)]、铜[Cu(Ⅱ)]和锰[Mn(Ⅱ)],表明微生物可以通过氧化还原系统利用体内的金属。通过氧化还原系统改变金属的价态,对于微生物体内抗性的产生也是非常重要的,这主要是由细胞表面的电子转移和具有解毒作用的酶系统来完成的。如微生物对铬[Cr(Ⅵ)]的排出,细菌在好氧和厌氧条件下都可以通过电子转移系统排出体内的铬[Cr(Ⅵ)],这一抗性可由质粒介导或者染色体编码产生。
微生物调节细胞内金属浓度的过程主要靠细胞膜转移机制。正常情况下,非必需金属和必需金属通过特异性吸收进入生物体内。而当金属离子含量较高时,微生物体内的特异性金属离子外排系统就会将非必需金属排出体外,比如微生物在吸收体内必需的磷酸盐时对有毒物质砷[As(Ⅴ)]的外排。
金属离子的存在可以加速金属抗性基因的转移。例如,微生物体内Hg(Ⅱ)的抗性基因。Hg(Ⅱ)因为可以和巯基很好地结合而具有巨毒性,它可以使酶和蛋白质失活。微生物为适应环境中的汞,激活一系列的基因从而形成抗性。这一系列基因不仅可以解除汞的毒性,而且参与汞的转移与自身细胞调节过程。
(2)微生物对金属的解毒机制 微生物对金属产生抗性可以通过通透性选择系统对金属的排除、金属在细胞/机体内的主动运输、细胞内金属的蛋白螯合作用、细胞外金属的隔离作用、金属的酶脱毒和金属作用靶位敏感性的降低等6种机制。自然的抗性机制是细胞发生基因突变,阻止与金属发生作用或者改变细胞膜组成。一种微生物可以拥有一种或几种混合的抗性和解毒机制。
①通透性选择系统对金属的排除:微生物的细胞壁、细胞膜及外包被可作为通透性选择系统阻挡金属的进入,以保护敏感的细胞组成成分免受损伤。例如,大肠杆菌通过基因突变导致膜孔蛋白改变从而阻止Cu(Ⅱ)的进入。
另外,微生物细胞上有许多结构组分具有结合重金属的能力,可以进行胞外积累从而阻止金属的进入。大量研究证实,构成细菌荚膜的胞外多聚糖带有负电荷,可以作为重金属的有效生物吸附剂,阻止重金属离子进入细胞。例如,具有荚膜的产气克雷伯菌(Klebsiella aerogenes)可以胞外积累Cd(Ⅱ)高达1mol/L。当培养基中含有2.5mg/L Cd(Ⅱ)时,恶臭假单胞菌荚膜多糖可以100%吸附Cd(Ⅱ)。当培养基中含有100mg/L Cd(Ⅱ)时,黏结杆菌(Arthrobacter viscosus)的荚膜可以累积30mg/g Cd(Ⅱ)。
②金属在细胞/机体内的主动运输:主动运输或外排为微生物对金属的主要抗性机制。微生物利用主动运输机制从细胞内排出有毒金属。非必需金属通过正常蛋白转移系统进入细胞内,但很快又被排出。这些外排过程需要ATP,而且对于外排离子具有高度选择性。解偶联剂试验表明,解偶联剂可以造成某些阴离子或阳离子外排性降低,说明主动运输需要ATP。
③细胞内金属与蛋白质的螯合作用:细胞内金属螯合是通过蛋白质结合将金属积聚在细胞质内以避免其对细胞成分造成毒害,一般隔离的金属有Cd(Ⅱ)、Cu(Ⅱ)和Zn(Ⅱ)。微生物对金属的结合蛋白有两种:聚球藻(Synechococcus spp.)产生的金属硫蛋白和假单胞菌(Pseudomonas spp.)体内的半胱氨酸蛋白。聚球藻的金属抗性系统含有两种基因:smtA和smtB。smtA编码金属硫蛋白,结合Cd(Ⅱ)和Zn(Ⅱ),其表达受高浓度的Cd(Ⅱ)、Cu(Ⅱ)和Zn(Ⅱ)诱导,并受smtB产物——SmtB蛋白的抑制。SmtA金属硫蛋白中的半胱氨酸可与过量的有毒金属离子——Cd(Ⅱ)和Zn(Ⅱ)结合。从污泥中分离的恶臭假单胞菌也能在细胞内发生Cd(Ⅱ)的积聚。它能产生3种富含半胱氨酸的小分子蛋白,结合金属Cd(Ⅱ)。
④细胞外金属的隔离作用:以前人们认为只有细菌才具有细胞外金属的隔离作用,但是后来发现一些酵母菌和真菌也能通过这种方式对金属产生抗性。例如,酿酒酵母可以通过分泌大量谷胱甘肽,以减少Ni(Ⅱ)的吸收。由于谷胱甘肽与重金属有很强的亲和力,从而形成胞外金属-谷胱甘肽复合物,阻止重金属进入细胞。真菌对Cu(Ⅱ)的抗性机制与此类似。真菌分泌的草酸可以与金属形成复合物。其他的微生物如柠檬酸杆菌(Citrobacter spp.)可以通过形成不溶性的镉-磷酸盐的复合物来获得对金属的抗性。克雷伯产气杆菌(Klebsiella aerogenes)可以分泌硫,硫与Cu(Ⅱ)在体外形成沉淀进而限制Cu(Ⅱ)进入体内。这些机制使得微生物具有从外界环境中移除Cu(Ⅱ)的能力。
⑤金属的酶脱毒:对汞具有抗性的微生物可以分为窄谱和广谱两类。窄谱抗性微生物缺少控制有机汞裂解酶合成的基因,因此对大多数有机汞不具有抗性;广谱抗性微生物体内则含有控制这种酶合成的基因,并能对大多含汞化合物产生抗性。对一些微生物质粒上的汞操纵子的研究发现,汞操纵子由5~7种基因组成(表11-3)。
表11-3 组成微生物金属Hg抗性系统的基因及其作用
有机汞裂解酶(MerB)催化甲基汞转变为离子汞,汞离子还原酶(MerA)催化离子汞还原为金属汞。汞转运基因包括merC、merT和merP,编码在细菌体内转移Hg的蛋白,最后重金属汞通过细胞膜被释放到外界环境中。
⑥金属作用靶位敏感性的降低:有些微生物可以通过降低细胞成分对金属的敏感性获得对金属的抗性,这是微生物的一种自我保护功能。这种保护作用通过基因突变降低微生物对金属的敏感性,但是并不改变突变部位的基本生化功能。微生物也可以改变离子通道以避免敏感组分与金属的接触,从而对金属产生抗性。DNA修复功能也可以为DNA基因片段提供一定的保护作用。例如,当将不具有适应性的大肠杆菌暴露于Cd(Ⅱ)中时,菌体中的DNA发生大量的损伤;然而经过一定时间的转接培养后,这种微生物对Cd(Ⅱ)表现出了抗性。微生物暴露在Cd(Ⅱ)中的时间越长,它的生长滞后期就会越短。开始滞后期比较长可能是由于DNA的自我修复引起的。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






