微生物的代谢途径调控(regulation of metabolism)是发生在细胞水平和分子水平上对代谢途径中酶的调节控制,主要有两种类型:酶活力的调节(激活或抑制)和酶合成的调节(诱导或阻遏)。
一、酶活力的调节
某一代谢途径的反应速率和方向是由该途径的一个或几个具有调节作用的关键酶的活性决定的。关键酶一般具有以下特点:①关键酶催化的反应速率最慢,决定整个代谢途径的总反应速率,又称限速酶;②关键酶催化单向反应或非平衡反应,决定整个代谢途径的反应方向;③关键酶一般处于代谢途径的起始或分支部位;④关键酶的活性除了受底物影响外,还受到多种代谢物或效应剂的调节。因此对关键酶的活力进行调节是代谢途径调控的一种重要方式。这种调节方式较为快速,主要包括变构调节和共价修饰调节。
1.变构调节
代谢途径的关键酶能够和某些化合物结合而使酶分子发生构象改变,从而改变酶活力以控制代谢反应的速率,这种调节作用称为变构调节(allosteric regulation)。能发生变构调节的酶称为变构酶(allosteric enzyme)。能使酶分子发生变构效应的化合物称为变构剂,其中能使酶活力增加的变构剂称为变构激活剂,而使酶活力降低的变构剂称为变构抑制剂。变构酶一般具有两个亚基,即与催化底物结合的活性亚基和与变构剂结合的变构亚基。当变构酶的变构亚基与变构剂非共价结合后,会使酶的空间构象发生改变,从而导致其活性亚基的构象也发生变化,使酶的催化活性降低或提高。这一过程并不涉及能量消耗。EMP途径和TCA循环中的一些变构调节控制位点如图5-11所示。
图5-11 葡萄糖分解代谢中的变构调节控制位点
缩写:G6P—6-磷酸葡萄糖F6P—6-磷酸果糖F1,6BP—1,6-二磷酸果糖PEP—磷酸烯醇式丙酮酸G1P—1-磷酸葡萄糖AcCoA—乙酰辅酶A CitA—柠檬酸IsoCit—异柠檬酸α-KG—α-酮戊二酸OAA—草酰乙酸MalA—苹果酸FumA—延胡索酸SucA—琥珀酸Suc-CoA琥珀酰辅酶A
变构调节的生理意义在于:①代谢途径的某种产物作为变构抑制剂反馈抑制该途径的关键酶,从而使代谢产物的生成量得到控制,避免原料的浪费;②通过变构调节,使能量得以有效储存;③通过变构调节,可维持代谢物的动态平衡;④通过变构调节,使不同代谢途径相互协调。
2.共价修饰调节
一些酶分子上的某些基团可以在另外一种酶的催化下发生共价修饰,如磷酸化或去磷酸化,从而导致酶活力的激活或抑制,这种调节作用称为共价修饰调节;这类酶称为共价调节酶。目前已知的多种共价修饰有磷酸化/去磷酸化、乙酰化/去乙酰化、甲基化/去甲基化和腺苷化/去腺苷化等。与变构调节的酶构象变化不同,共价调节酶被共价修饰后,酶的一级结构发生了改变,形成两种互变形式,即有催化活性的形式和无催化活性的形式,如糖原磷酸化酶的去磷酸化形式无活性,而其磷酸化形式有活性(图5-12)。这两种形式的转换是由酶催化的,因此可以在很短的时间内经信号启动,生成大量有活性的酶,其催化效率比变构调节更高。此外,发生共价修饰反应时一般需要消耗少量能量。
图5-12 磷酸化与去磷酸化
二、酶合成的调节
微生物代谢途径的调节除了酶活力的调节以外,还可以通过改变酶合成(或降解)的速率以控制酶的浓度来进行调节。酶活力的调节实际是对现有的可用酶在极短时间内进行的活性调节,而酶合成的调节则是在转录和翻译水平上进行的浓度调节。
1.底物诱导
培养基中某种酶的底物,可以促进细胞中该酶的合成速率,这种现象称为底物诱导;这些酶称为诱导酶(induced enzyme)。能诱导酶合成的底物称为诱导物(inducer),它可以是酶催化的底物或者其衍生物,以及其结构类似物。诱导酶合成的关键还是取决于细胞是否有编码该酶的基因,否则即使有诱导物存在也无法合成这种酶。底物诱导这种调节方式可以避免合成暂时无用的酶所造成的浪费,只有细胞在遇到诱导物时,才会迅速合成诱导酶。如果某种酶的合成速率受其底物浓度变化的影响非常小,那么这种酶称为组成酶(constitutive enzyme)。组成酶是细胞固有的酶类,无需底物诱导便能自动合成,如EMP途径的酶系。
大多数原核生物对酶合成的调节,主要是在转录水平上调控mRNA的浓度,以避免合成不必要的mRNA造成浪费。在结构基因附近起调节基因转录作用的控制区域,称为调节区。当RNA聚合酶与调节区中的启动子结合时,结构基因即开始转录。通过控制RNA聚合酶与启动子结合的速率,可以调节mRNA合成的速率,从而决定合成酶的表达水平。在调节区中除了包含启动子外,还包含一段编码调节蛋白的调节基因,以及一个能与调节蛋白结合的操纵基因。调节蛋白的功能如果是阻止基因转录的,称为负调控;反之称为正调控。例如,大肠杆菌的乳糖操纵子(lactose operon),是研究得最早最充分的底物诱导调控系统(图5-13)。乳糖操纵子的启动子和操纵基因分别是lacP和lacO,调节基因lacI编码阻遏蛋白。当缺乏乳糖时,阻遏蛋白与操纵基因结合,阻碍RNA聚合酶对操纵子的转录,因此乳糖操纵子的底物诱导系统是一个负调控系统。当存在乳糖时,乳糖与阻遏蛋白的特定位点结合,引起阻遏蛋白的构象变化,使其与操纵基因的亲和力降低,从而使RNA聚合酶能够向前移动转录出多顺反子mRNA,它编码了利用乳糖作为碳源时所必需的结构基因:β-半乳糖苷酶(lacZ)、乳糖通透酶(lacY)和β-半乳糖苷转乙酰基酶(lacA)。
图5-13 乳糖操纵子的转录控制
(1)乳糖缺乏时,阻遏蛋白与操纵基因结合,阻碍RNA聚合酶基因的转录(2)乳糖存在时,阻遏蛋白与乳糖结合后失活,RNA聚合酶与启动子区结合,转录编码乳糖操纵子3个酶的结构基因lacZ、lacY和lacA
2.代谢物阻遏
乳糖操纵子还有一个正调控系统。由于大肠杆菌利用葡萄糖的酶是组成型的,当葡萄糖和乳糖同时存在时,细胞会优先利用葡萄糖,此时表达乳糖代谢酶是对胞内资源的浪费。当葡萄糖被细胞利用浓度变得很低时,乳糖代谢酶才能高效表达。正调控系统的调节蛋白是环腺苷酸受体蛋白(cyclic AMP receptor protein,CRP)。当大肠杆菌利用葡萄糖生长时,胞内cAMP浓度低,而细胞利用其他碳源时,cAMP浓度增高。当cAMP浓度高时(葡萄糖浓度很低),cAMP与CRP蛋白结合形成CRP-cAMP复合物,进而结合在乳糖操纵子的CRP位点上,促进RNA聚合酶和启动子的结合,并在乳糖的底物诱导作用下使乳糖代谢酶高效表达。而当cAMP浓度低时,无法形成CRP-cAMP,此时RNA聚合酶和启动子的结合力较弱,即使存在乳糖的底物诱导作用,乳糖操纵子也不能高效表达。在这种代谢调控过程中,由于底物葡萄糖的存在而阻遏了乳糖代谢酶的合成,称为葡萄糖效应。除了葡萄糖效应以外,这种容易利用的碳源阻遏其他碳源分解酶的合成的现象普遍存在,被称为分解代谢物阻遏。同样,某些分解含氮代谢物的酶也会受到容易利用的氮源(如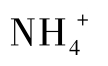 或谷氨酰胺)的阻遏。大多数受阻遏的酶是诱导酶,实际上有些高效诱导物也可逆转分解代谢物的阻遏作用。表5-2中列出了一些受分解代谢物阻遏的酶系。(https://www.daowen.com)
或谷氨酰胺)的阻遏。大多数受阻遏的酶是诱导酶,实际上有些高效诱导物也可逆转分解代谢物的阻遏作用。表5-2中列出了一些受分解代谢物阻遏的酶系。(https://www.daowen.com)
表5-2 受分解代谢物阻遏的酶系
还有一种代谢物阻遏是终产物阻遏。代谢途径的终产物除了可以通过变构调节直接影响途径中第一个酶或关键酶的活性外,有时还可以阻遏这一系列酶的合成,这种调节机制称为终产物阻遏。终产物阻遏和底物诱导的机制类似,都是阻遏蛋白与操纵基因结合阻遏RNA聚合酶的转录,是一种负调控系统。两者的不同之处是,在终产物阻遏系统中,阻遏蛋白不能单独与操纵基因结合,只有阻遏蛋白和终产物结合后才能与操纵基因结合,阻遏基因的表达。例如,大肠杆菌中的色氨酸阻遏[图5-14(1)],当色氨酸浓度高时,阻遏蛋白TrpR与色氨酸结合后改变构象,从而可结合在操纵基因上,阻遏色氨酸操纵子的转录;当色氨酸浓度低时,阻遏蛋白TrpR不与色氨酸结合,无法结合在操纵基因上,色氨酸操纵子的转录开启。
3.弱化机制
除终产物阻遏以外,大肠杆菌的色氨酸操纵子还存在一种称为弱化作用(attenuation)的调控转录终止机制。弱化作用是通过trpE基因前的一段前导RNA链在转录过程中形成终止子或抗终止子结构进行的[图5-14(2)]。前导RNA链有以下几个特点:①5′端有核糖体结合位点(RBS)以及一个起始密码子,距5′端70个碱基处有一个终止密码子,这段序列可翻译为由14个氨基酸残基组成的短肽,称为前导肽。②前导肽编码基因有两个连续的色氨酸密码子。③前导RNA链有4段能互相配对的区域。如果区域2和区域3配对则形成抗终止子结构,如果区域3和区域4配对则形成终止子结构。
图5-14 色氨酸操纵子的终产物阻遏和弱化机制
(1)色氨酸阻遏(2)前导RNA链(3)终止子结构(4)抗终止子结构
前导RNA链被转录后,核糖体就会结合在RBS上启动前导肽的翻译。当色氨酸浓度高时,胞内的色氨酸-tRNA供应水平较高,核糖体可以快速通过两个连续的色氨酸密码子,并占据区域1和区域2,因此区域3和区域4会配对形成终止子结构,中止色氨酸操纵子的转录[图5-14(3)]。当色氨酸浓度低时,胞内的色氨酸-tRNA供应水平较低,核糖体无法快速通过两个连续的色氨酸密码子,只占据区域1,因此区域2和区域3可配对形成抗终止子结构,防止了区域3和区域4配对形成终止子结构,使色氨酸-mRNA被完全转录[图5-14(4)]。
4.核糖开关
位于大肠杆菌维生素B12胞外转运蛋白btuB mRNA的5′-UTR(untranslated region)存在某些结构元件。当维生素B12的辅酶腺苷钴胺素浓度高时,该元件能结合腺苷钴胺素,导致mRNA构象发生变化,进而抑制 btuB蛋白的翻译。这类mRNA结构元件,能够直接感受环境中特定代谢物浓度的变化,并通过与代谢物结合发生mRNA构象变化,来实现对基因表达的调控,被称为核糖开关(riboswitch)。目前在细菌和真菌中发现了多种核糖开关,参与多种物质基础代谢途径的控制。细菌的核糖开关位于mRNA的5′-UTR,而真核生物的核糖开关可位于3′-U TR或内含子区域。大多数核糖开关都由两个结构域组成,沿转录方向,分别是适配子结构域(aptamer domain,AD)和表达平台(expression platform,EP)(图5-15)。AD是一个高度折叠的结构,能选择性地与特定代谢物结合,导致其自身以及EP的构象发生变化。EP构象的变化可以形成抗终止子结构或终止子结构,或者将RBS位点、mRNA酶切位点暴露或掩蔽,从而在基因转录、翻译或mRNA酶切和加工等水平上进行调节。
图5-15 核糖开关结构示意
目前已经发现的核糖开关主要有以下几种。①焦磷酸硫胺素(TPP)核糖开关。普遍存在于细菌、古生菌、真菌和植物中,是自然界分布最广的核糖开关。大肠杆菌中thiC基因的5′-UTR存在此开关,它通过控制维生素B1的合成来调节细胞内TPP的浓度。②黄素单核苷酸(FMN)核糖开关。存在于许多细菌中,调节维生素B2和FMN的合成及运输等相关基因的表达。③腺苷钴胺素(辅酶B12)核糖开关。存在于多种细菌中,根据辅酶B12的浓度在转录和翻译水平上调节维生素B12的合成和运输相关基因的表达。④S-腺苷甲硫氨酸(SAM)核糖开关。多存在于革兰阳性细菌中,在转录水平上调节与半胱氨酸、甲硫氨酸和SAM合成相关基因的表达。⑤赖氨酸核糖开关。枯草芽孢杆菌lysC基因的5′-U TR含有一个赖氨酸核糖开关,能够专一性地感应胞内L-赖氨酸的浓度并调节其合成。⑥甘氨酸核糖开关。枯草芽孢杆菌gcvT操纵子的5′-UTR含有甘氨酸开关,当甘氨酸浓度过高时,启动甘氨酸降解。它具有两个相距很近的适配子结构域,并存在协调效应,即第一个适配子结构域与甘氨酸结合后会增强第二个适配子结构域与甘氨酸的亲和力。⑦嘌呤核糖开关。主要控制嘌呤合成和运输相关基因的表达。⑧6-磷酸葡萄糖胺(GlcN6P)核糖开关。存在于革兰阳性细菌glmS基因的5′-UTR,它与GlcN6P结合,可导致mRNA的5′端发生自剪切,从而下调glmS基因的表达。⑨SAM-辅酶B12核糖开关。在克劳芽孢杆菌(Bacillus clausii) metE基因的5′-UTR中存在的一种两个核糖开关串联的结构,其适配子结构域可分别与SAM和辅酶B12结合,任何一种浓度过高都能结束 metE基因的转录。
5.翻译的控制
某些酶的调控也能够发生在翻译水平,称为转录后调控。这种调控机制控制一个完整mRNA被翻译的次数。一般情况下,翻译调控的方式主要有以下几种:①控制mRNA的稳定性;②控制翻译起始概率;③控制蛋白质合成速率。
许多编码核糖体蛋白的操纵子都可在翻译水平上进行调控。因为核糖体翻译蛋白的速率有限,每个核糖体每秒约翻译15个氨基酸。当细胞加速生长时,蛋白质合成速率也加快,因此细胞会合成更多的核糖体。细胞可以通过两种机制调控,使核糖体蛋白的合成与核糖体的合成相偶联:①少许过量合成的核糖体抑制rRNA的合成(核糖体反馈调节);②某些核糖体蛋白结合在其自身mRNA的RBS位点附近,从而抑制核糖体蛋白的翻译(翻译抑制)。
还有一种重要的rRNA调控系统是严紧反应。细胞在培养过程中某种氨基酸被耗尽,细胞处于“饥饿”状态,导致tRNA空载,此时会引发relA基因的诱导,relA基因表达严紧反应的调控因子(p)ppGpp。(p)ppGpp的产生发出停止蛋白质合成的信号,触发rRNA合成的终止。
在原核生物中,可通过前述的核糖开关对基因的表达进行翻译控制。例如,核糖开关通过感受某种代谢物的浓度,发生mRNA构象变化后,通过掩蔽或暴露RBS位点来实现翻译的终止和启动。此外,还可以通过小RNA来进行翻译控制。这些小RNA在低温或低铁水平等环境下表达,通过与特定mRNA的翻译起始区配对结合而抑制翻译,或者诱导特定mRNA构象发生变化暴露出翻译起始位点而启动翻译。在某些噬菌体和原核生物中还有一类mRNA特异性阻遏蛋白,这些蛋白可以结合在特定mRNA的RBS位点附近,从而抑制翻译。
三、细胞水平的总体调控
作为一种基因水平调控的机制,乳糖操纵子的阐明激起了人们对其他操纵子研究的强烈兴趣。随着更多新操纵子的发现和对它们的研究分析得出共识:这些操纵子不是独立发挥作用,而是作为一个更高水平的调控网络的成员发挥作用。这个更高水平的调控称为总体调控。在细胞水平上,总体调控利用调控信号控制细胞的多种生理状态,为生物体提供了适应环境变化的能力。例如,培养基成分发生变化、好氧和厌氧环境的切换、发生各类应激反应等。总体调控网络包括功能明显无关而且在染色体图上物理位置也不连续的多套操纵子和多套调节子。尽管这些操纵子各自分布在基因组的位置不同,有时表现出完全不同的功能,但它们都在一个总体调控网络中,被统一协调控制。一个总体调节网络中处于一个共同调节蛋白控制下的一个操纵子网络,称为总体调节子。即使环境简单的变化通常也会诱导几个调节子。相应于单一环境刺激的全部调节子,称为刺激子。通过共享一个多效调节蛋白处于不同的特定控制之下的一组操纵子和(或)调节子,称为调控代谢子(modulon)。
Stephanopoulos等提出存在这种总体调控网络有两点理由。第一,某些细胞过程所涉及的基因多于单个操纵子所能容纳的基因。例如,细菌的翻译过程,涉及至少150个基因产物的一组基因,包括rRNA,核糖体蛋白,起始、延长以及终止因子,氨酰基合成酶和tRNA。如此众多的相互关联组分的高效协调控制,显然不是一个操纵子基因所能包含的。第二,尽管有些基因需要被独立调控,但有更高级的协调控制系统也是至关重要的。这些情况的例子常见于编码分解代谢酶的基因中。这些酶参与碳源和能源的利用。葡萄糖是大多数细菌的优质底物,当存在于生长培养基时,它总是抑制第二种或冗余底物的代谢所需酶的表达(分解代谢物阻遏)。然而当缺乏优质底物时,每个操纵子都必须有在其同源底物存在时独立诱导的能力。这些例子表明需要一个调控组织机构替代单个操纵子的独立调控。据估计,细菌细胞已经演化形成了几百个多基因调节系统。只有极少数系统被深入研究。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







