古生菌(Archaea)又称古菌,属于原核生物。古生菌在细胞结构、生理、遗传和生态等方面具有独特的性质,是不同于细菌和真核生物的独特生命形式(表2-3)。基于16S rRNA基因序列的差异,沃斯于1977年将原核生物分为两大类,称为真细菌(Eubacteria)和古细菌(Archaebacteria);并认为这两组生物和真核生物是从一个具有原始遗传机制的共同祖先分别进化而来,因此将三者各划为一类,作为比“界”高的分类系统,称作“域”(domain)或“总界”(superkingdom)。1990年,沃斯为避免将古细菌看作是细菌的一类,将三域系统修改为细菌(Bacteria)、古生菌(Archaea)和真核生物(Eukarya)(图2-10)。
表2-3 古生菌、细菌和真核生物主要特征的比较
续表
图2-10 生命系统发育树
一、古生菌的分类
《伯杰氏系统细菌学手册》第2版第1卷将古生菌域分为了2门、8纲,包括了可人工培养和研究较为深入的主要古生菌种类。泉古生菌门(Crenarchaeota)包括热变形菌纲(Thermoprotei),比较重要的属有硫化叶菌属(Sulfolobus)、热网菌属(Pyrodictium)、热变形菌属(Thermoproteus)等,大部分为嗜热和极端嗜热古生菌,很多还兼具嗜酸性。广古生菌门(Euryarchaeota)因其生存的生态环境广,并有各种不同的代谢类型而得名,包括7纲,其中甲烷杆菌纲(Methanobacteria)的甲烷杆菌属(Methanobacterium)、甲烷球菌纲(Methanococci)的甲烷球菌属(Methanococcus)、盐杆菌纲(Halobacteria)的盐杆菌属(Halobacterium)和盐球菌属(Halococcus)、热原体纲(Thermoplasmata)的热原体属(Thermoplasma)和嗜酸菌属(Picrophilus)、热球菌纲(Thermococci)的热球菌属(Pyrococcus)和嗜热球菌属(Thermococcus)、古生球菌纲(Archaeoglobi)的古生球菌属(Archaeoglobus)和铁球菌属(Ferroglobus)以及甲烷嗜高热菌纲(Methanopyri)的甲烷嗜高热菌属(Methanopyrus)古生菌研究较多。
近年来,基于免培养的分子生态学技术,包括16S rRNA基因文库、原位荧光杂交技术(FISH)、宏基因组学等研究,发现古生菌在中温环境也有广泛分布,检测到很多实验室难以分离培养的古生菌种类,陆续提出一些新的古生菌门。初古生菌门(Korarchaeota)古生菌只能用FISH检测证实其存在,实验室中尚难以人工培养,仅包括一个属:初古生菌属(Korarchaeum)。2005年德国科学家在北冰洋底发现了一种寄生古生菌中最古老、最简单、最微小的骑火球纳米古生菌(Nanoarchaeum equitans),只有大肠杆菌的1/160(与天花病毒大小相当),拥有50000个碱基,提出建立纳古生菌门(Nanoarchaeota),包含一个属:纳古生菌属(Nanoarchaeum)。2011年Nunoura提出设立曙古生菌门(Aigarchaeota),代表种为Caldiarchaeum subterraneum。然而,该门的设立仍有争议,因为代表种基因组编码一些奇古生菌的特征性表型。
中温环境中分布的古生菌称为中温泉古生菌(nonthermophilic Crenarchaeota)。这些古生菌数量巨大,多样性高,且近年发现其中的氨氧化古生菌能催化氨氧化过程,说明这些中温泉古生菌在自然界重要元素的生物地球化学循环中发挥着重要作用。近来对更多新获得的古生菌小亚基核糖体RNA(SSU rRNA)和大亚基核糖体RNA(LSU rRNA)基因序列进行的分析显示,中温古生菌可能代表了新的系统发育分支。对核糖体蛋白进行的系统发育分析也不支持中温泉古生菌由嗜热泉古生菌进化而来的假设,而暗示中温泉古生菌在起源上早于嗜热泉古生菌和广古生菌门。基因组学分析也显示中温泉古生菌与广古生菌门有更相似的遗传组成特征。因此,Brochier-Armanet等在2008年建议将中温泉古生菌划分为一个新门——奇古生菌门(Thaumarchaeota),目前包括3目、3科和3个属。
利用免培养研究技术在各种不同生态环境中进行系统调查研究,将发现更多类群的新型古生菌。古生菌的分类和系统发育状况将会处于不断发展变化之中。利用全基因组分析获得的古生菌系统发育关系见图2-11。
图2-11 基因组分析揭示的不同古生菌门的系统发育关系示意(引自Nunoura等,2011)
A—曙古生菌门 C—泉古生菌门 E—广古生菌门
K—初古生菌门 N—纳古生菌门 T—奇古生菌门
括号中的数字表示每个门代表种的数量
二、古生菌的形态与结构
1.古生菌的形态与大小
单个古生菌直径从0.1μm到超过15μm。不同古生菌形状不同,通常为球状、杆状、螺旋状或盘状。泉古生菌还表现出其他形态,如硫化叶菌(Sulfolobus)的不规则叶状,热丝菌属(Thermofilum)的丝状(直径小于0.5μm),热变形菌属(Thermoproteus)和火棒菌属(Pyrobaculum)的长方状,Haloquadratum walsbyi为生活于高盐湖的方形超扁平古生菌。古生菌的细胞壁和原核骨架决定了其不寻常的形状。而热原体(Thermoplasma)和铁原体(Ferroplasma)由于缺乏细胞壁,细胞形状不规则,类似于阿米巴原虫(图2-12)。
图2-12 几种古生菌形态
(1)硫化叶菌(2)超嗜热古生菌(Thermofilum uzonense)(3)极端嗜热古生菌(Thermoproteus uzoniensis)
(4)极端嗜盐古生菌(Haloquadratum walsbyi)
一些古生菌能形成细胞聚集体或丝状体,可长达200μm。如深海热液区超嗜热古生菌Thermococcus coalescens人工培养子代细胞会融合在一起,形成单个巨大细胞。极端铁代谢嗜热菌Pyrodictium abyssi人工培养产生精细的多细胞菌落,长、薄、中空的套管从细胞表面伸出来,使得菌落浓密成团(图2-12)。这些套管具有较强的抗热和抗压能力,可能在与邻居细胞的通讯或营养交换中发挥作用。
2.古生菌的细胞结构
古生菌和细菌在细胞结构方面有些类似,但细胞组成和组织不同。同细菌一样,古生菌缺乏膜包裹的细胞器。结构上,古生菌更类似于G +细菌。多数古生菌具有单层质膜和细胞壁,缺乏周质空间。然而,燃球菌属(Ignicoccus)例外。该属古生菌具有特别大的周质空间,并包含膜连接的囊泡。
(1)细胞膜 细胞膜一般由磷脂双分子层和蛋白质构成。细菌细胞膜与真核生物细胞膜相似,但不含胆固醇等甾醇。多数细菌和真核生物细胞膜脂类主要是由脂肪酸通过酯键与甘油连接构成的甘油酯组成,而古生菌细胞膜脂则由异戊二烯侧链代替了脂肪酸与甘油经醚键连接形成的甘油醚构成(图2-13)。醚键比酯键化学抗性更强。该稳定性可帮助古生菌适应极端高温、高酸或高碱性的环境。古生菌细胞膜完整极性膜脂由核心膜脂和极性头基组成,其中核心膜脂主要由以类异戊二烯侧链(有时甚至为环丙烷或环己烷)、甘油为骨架的含4个醚键的甘油二烷基甘油四醚化合物构成,极性头基主要由磷酸盐和糖基构成。古生菌细胞膜脂甘油基团立体构型受甘油-1-磷酸脱氢酶(G1P脱氢酶)催化,形成2,3-2-O-烷基链-sn-甘油构型,与细菌和真核生物的甘油构型为旋光对映体。在一些古生菌,脂质双层为单层代替,融合了2个独立的磷脂分子为单一分子,有2个极性头部(新型双亲分子)(图2-14)。该融合可使其膜更具刚性,能更好地抵抗恶劣环境。例如,铁原体的脂质属于该类型,有助于该古生菌在高酸性基质下生存。极端嗜热菌的膜,如热浆菌属和硫化叶菌属几乎全部都是四乙醚单层膜。
图2-13 细菌与真核生物(1)和古生菌(2)细胞膜脂质结构与组成的比较
图2-14 古生菌两种不同的细胞膜
(1)由内在蛋白与双层 C20二乙醚组成的膜
(2)由内在蛋白与C40四乙醚组成的一种坚硬的单层膜
古生菌核心膜脂结构多样性远低于细菌和真菌,其骨架由类异戊二烯烷烃链与甘油或其他较为复杂的多元醇缩合而成并形成醚键,且碳链长度多为C15、C20、C25或C40。常见的古生菌膜脂骨架组成部分——植烷(C20)也存在于非古生菌类群中(如类胡萝卜素、维生素A和视黄醛),而古生菌是唯一利用该组分构成细胞膜的生命体。古生菌细胞膜脂极性头基多由磷酸盐、糖基、肌醇和氨基衍生物等组成。氨基衍生物头基是产甲烷古生菌特有的生物标记物(如磷酸乙醇胺、磷酸丝氨酸和甘油磷酸乙醇胺)。肌醇作为产甲烷古生菌细胞膜脂头基组分,在广古生菌门的嗜热菌中也有出现,但所占比例较小。磷脂衍生物头基则主要出现在嗜盐古生菌中。泉古生菌极性头基主要由半乳糖、葡萄糖和磷酸肌醇构成,细胞膜脂的差异多由糖苷键的不同空间排列和不同的糖苷键产生。
(2)细胞壁除热原体和铁原体之外,多数古生菌均具有细胞壁。很多古生菌的细胞壁由蛋白装配而成,形成S层。蛋白质分子的刚性排列像锁子甲似地覆盖在细胞外部,为细胞提供了化学和物理保护,可阻止大分子物质接触细胞膜。与细菌不同,古生菌细胞壁缺乏典型的肽聚糖、胞壁酸和D-氨基酸,不受溶菌酶和β-内酰胺抗生素,如青霉素作用。甲烷杆菌目(Methanobacteriales)细胞壁含有假肽聚糖,在形态、功能和物理结构上类似于细菌的肽聚糖;但假肽聚糖化学结构特殊:L-氨基酸取代了D-氨基酸、N-乙酰塔罗糖胺糖醛酸代替N-乙酰胞壁酸、β-(1→3)-糖苷键代替了β-(1→4)-糖苷键。
(3)鞭毛 与细菌鞭毛相似,古生菌也是鞭毛基部马达旋转驱动鞭毛丝旋转而使古生菌菌体运动。这些马达旋转为跨膜的质子梯度所驱动。然而,古生菌鞭毛在组成和发育上与细菌不同。古生菌鞭毛似乎进化自细菌的纤毛。细菌鞭毛合成时,蛋白质亚基沿中央孔移动到鞭毛顶部组装;而古生菌鞭毛则是通过在基部不断添加蛋白质亚基而合成。
3.古生菌的代谢
古生菌的不同类群成员之间代谢性质差异很大。极端嗜盐菌和嗜热菌可用一种修饰的ED途径异化糖类,产生丙酮酸和NADH或NADPH。产甲烷菌不能分解葡萄糖。嗜盐菌和产甲烷菌以EMP途径的逆方向进行葡萄糖异生。多数古生菌可以氧化丙酮酸生成乙酰CoA,嗜盐菌和极端嗜热菌、嗜热浆菌属似乎存在三羧酸循环,产甲烷菌没有完整的三羧酸循环。嗜盐菌和嗜热菌具有呼吸链。
(1)古生菌的糖酵解途径与真核生物和细菌不同,古生菌糖酵解仅存在Embden-Meyerhof途径(EMP)与Entner-Doudoroff(ED)途径,而缺少氧化的磷酸戊糖途径。古生菌EMP与ED途径具有与真核生物及细菌经典途径显著不同的特点。古生菌糖酵解过程中的部分路径及经过的中间代谢物转化过程不同,许多新的酶或酶家族催化糖酵解过程中的同一或不同代谢步骤。
①古生菌的ED途径:存在于超嗜热古生菌嗜酸热原体(Thermoplasma acidophilum)和嗜热好氧硫黄矿硫化叶菌(Sulfolobus solfataricus)的非磷酸化ED途径,不伴随着净ATP的产生。存在于好氧极端嗜盐古生菌(如Haloarcula marismortui)和喜糖嗜盐杆菌(Halobacterium saccharovorum)的半磷酸化ED途径,由于伴随着磷酸化磷酸甘油醛脱氢酶/磷酸甘油酸激酶,产生1分子ATP。在S.solfataricus和T.tenax中存在分支ED途径(合并非磷酸化和半磷酸化ED途径),也没有净ATP产生(图2-15)。在古生菌ED途径中,葡萄糖首先经过脱氢、脱水生成2-酮-3-脱氧葡萄糖酸,后者经过磷酸化(半磷酸化的ED途径)或直接(非磷酸化的ED途径)裂解为3-磷酸甘油醛或甘油醛,随后由3-磷酸甘油醛脱氢酶氧化3-磷酸甘油醛为3-磷酸甘油酸,或者由甘油醛脱氢酶将甘油醛氧化为甘油酸,再由甘油酸激酶催化生成2-磷酸甘油酸。其中,磷酸甘油酸变位酶、烯醇化酶、丙酮酸激酶催化EMP与ED途径中相同的代谢路径。与真核生物和细菌1个葡萄糖分子生成1分子ATP不同,多数古生菌ED糖酵解途径中没有净ATP的产生(图2-15)。
图2-15 古生菌的修饰ED途径
非磷酸化ED途径(酶1~7)不伴随着净ATP产生;半磷酸化ED途径(酶1、2、8、3、9~12、6和7)由于伴随着磷酸化GAPDH/磷酸甘油酸激酶,产生1分子ATP;分支 ED途径(合并非磷酸化和半磷酸化ED途径)也没有净 ATP产生
KDG—2-酮-3-脱氧葡萄糖酸KDPG—2-酮-3-脱氧葡萄糖酸磷酸
Fdox和Fdred—分别为氧化型和还原型铁氧还蛋白
①—葡萄糖脱氢酶 ②—葡萄糖酸脱水酶 ③—KD(P)G醛缩酶
④—甘油醛脱氢酶(嗜酸热原体中发现)⑤—甘油酸激酶
⑥—烯醇化酶 ⑦—丙酮酸激酶 ⑧—KDG激酶 ⑨—3-磷酸甘油醛脱氢酶
⑩—磷酸甘油酸激酶 ⑪—醛脱氢酶家族 ⑫—磷酸甘油酸变位酶
②古生菌的EMP途径:极端嗜热发酵型厌氧古生菌激烈火球菌(Pyrococcus furiosus)、滨海热球菌(Thermococcus litoralis)、超嗜热热球菌(Thermococcus spp.)、溶淀粉硫还原古球菌(Desulfurococcus amylolyticus)、还原硫闪烁古生球菌7324菌株和微需氧喜气火棒菌(Pyrobaculum aerophilum)采用不同修饰的EMP途径。当前,发现的既使用修饰的EMP,又存在ED途径的唯一古生菌是极端嗜热硫依赖厌氧古生菌附着热变形菌(Thermoproteustenax)。死海盐盒菌(Haloarcula marismortui)和河谷盐盒菌(Haloarcula vallismortis)可通过修饰的EMP途径几乎完全代谢果糖。
与传统的EMP途径相比,古生菌中发现的修饰EMP途径中催化葡萄糖磷酸化、磷酸葡萄糖异构化、6-磷酸果糖磷酸化、1,6-二磷酸果糖裂解、3-磷酸甘油醛氧化和磷酸烯醇式丙酮酸转化为丙酮酸的酶显著不同,可能发生了非同源性基因置换。此外,不同古生菌鉴定的相应酶(如糖激酶、磷酸葡萄糖异构酶和氧化3-磷酸甘油醛的酶)的不同酶家族的多样性,反映出古生菌超越细菌和真核生物的代谢多样性。
涉及3-磷酸甘油醛-铁氧还蛋白氧化还原酶或醛脱氢酶家族的修饰EMP途径的净ATP产量为0。在附着热变形菌,如果厌氧形成的焦磷酸(细胞废产物)再被焦磷酸依赖的磷酸果糖激酶所循环利用的话,则将产生小于1分子的ATP。在火球菌,形成ATP的另一个部位是通过铁氧还蛋白依赖的脱氢酶或磷酸烯醇式丙酮酸合成酶逆反应,偶联氢气形成的电子传递磷酸化。
不同糖酵解途径产生的丙酮酸的降解包括氧化为乙酰辅酶A,在所有古生菌均被丙酮酸-铁氧还蛋白氧化还原酶所催化。在厌氧发酵型古生菌,乙酰辅酶A进一步被非寻常原核酶——形成ADP的乙酰辅酶A合成酶(ACD)转化为乙酸,而在O2-、硝酸盐和硫还原古生菌,乙酰辅酶A通过三羧酸循环氧化为2分子的二氧化碳。
③古生菌的糖异生作用:糖异生作用(从丙酮酸形成6-磷酸葡萄糖)主要通过EMP途径的逆反应发生。不同的酶催化古生菌修饰的EMP途径的逆反应,包括果糖-1,6-二磷酸酯酶(FBPase)、传统磷酸甘油醛脱氢酶/磷酸甘油酸激酶和磷酸烯醇式丙酮酸合成酶(PEPS)。产氢嗜热球菌(Thermococcus kodakaraensis)酶学和突变分析发现,FBPase族V为古生菌功能性代表。在附着热变形菌,可逆的焦磷酸依赖的磷酸果糖激酶代替了FBPase。古生菌从3-磷酸甘油酸形成磷酸甘油醛被NADP +依赖的磷酸甘油醛脱氢酶和磷酸甘油酸激酶所催化(如火球菌和附着热变形菌)。在嗜盐古生菌,磷酸甘油醛脱氢酶和磷酸甘油酸激酶在半磷酸化ED途径具有糖酵解的功能。
(2)古生菌的营养类型 基于不同的能源和碳源,古生菌具有多种营养类型。光能营养型古生菌可利用光能,但以有机化合物为碳源。古生菌不发生蓝细菌和绿色植物那样的产氧型光合作用。无机营养型古生菌能从无机化合物如硫化氢、元素硫或氨氧化获得能量,以氧气或金属离子作为电子受体,包括硝化细菌、产甲烷菌和厌氧甲烷氧化菌。在这些反应中,一种化合物传递电子到另一种,并释放能量供给细胞生长繁殖。在该类氧化还原反应中,一个化合物充当电子供体,另一个为电子受体。释放的能量通过氢离子跨膜移动产生ATP。而在真核生物,类似的过程在胞内细胞器线粒体发生。有机营养型古生菌从有机物氧化获得能量,碳源则是有机化合物或二氧化碳(表2-4)。
表2-4 古生菌的营养类型
(3)光能营养古生菌的紫膜光合磷酸化 光能营养古生菌通过紫膜光合磷酸化,利用光能产生ATP形式的化学能。在嗜盐菌,光能活化离子泵如菌紫红质和嗜盐菌紫质,可引起蛋白中心的视黄醛辅助因子的结构改变。它们通过泵出质子到质膜外产生离子梯度。能量储存于这些电化学梯度,然后通过ATP合成酶转化为ATP。该过程是最简单形式的光合磷酸化。(https://www.daowen.com)
(4)古生菌产甲烷代谢产甲烷代谢的本质是产甲烷古生菌利用细胞内一系列特殊的酶和辅酶将CO2或甲基化合物中的甲基通过一系列的生物化学反应还原成甲烷的过程。在这一过程中,产甲烷菌细胞能够形成钠离子或质子跨膜梯度,驱动细胞膜上的ATP合成酶将ADP转化成ATP以获得能量。根据底物类型的不同,可以将该过程分为3类:还原CO2途径、乙酸途径和甲基营养途径,详见第12章相关章节内容。
(5)古生菌的CO2固定自养型古生菌能利用大气CO2作为碳源。CO2固定的途径有修饰的卡尔文循环(图2-16)、厌氧乙酰辅酶A途径、逆向三羧酸循环途径、3-羟基丙酸途径、3-羟基丙酸/4-羟基丁酸循环途径及二羧酸/4-羟基丁酸循环途径(详见第七章第三节)。碳固定的能量来自无机物的氧化。
图2-16 古生菌存在的修饰卡尔文循环
Ru5P—5-磷酸核酮糖 PRPP—5-磷酸核糖-1-焦磷酸 AMP—单磷酸腺苷
R15P—1,5-二磷酸核糖 RuBP—1,5-二磷酸核酮糖 3-PGA—3-磷酸甘油酸
APRT—腺嘌呤磷酸核糖转移酶
4.古生菌的遗传
古生菌具有单条环状染色体,常温产甲烷菌(Methanosarcina acetivorans)的基因组较大,为5.75Mb。骑行纳古生菌(Nanoarchaeum equitans)的基因组较小,仅491kb,为前者的1/10,仅编码537种蛋白质。古生菌中也发现质粒。质粒可通过物理接触传播,类似于细菌接合的形式。
古生菌也发现了病毒。已知的古生菌病毒多为双链DNA病毒,表现出不寻常的桶形、弯曲杆状或泪珠状。嗜热菌病毒研究较多,特别是硫化叶菌目(Sulfolobales)和热变形菌目(Thermoproteales)古生菌病毒(图2-17)。最近分离了两组感染古生菌的单链DNA病毒:感染嗜盐古生菌的Halorubrum pleomorphic virus 1(Pleolipoviridae)和感染超嗜热古生菌的气热菌卷曲形状病毒(Spiraviridae)。后者病毒具有目前最大的ssDNA基因组。可采取针对病毒基因相关的重复DNA序列,采用RNA干扰技术防御这些病毒。
图2-17 硫化叶菌感染DNA病毒(箭头)
与细菌和真核生物相比,古生菌具有遗传独特性。古生菌基因组可编码高达15%域独特的蛋白质。多数独特基因没有任何已知功能。古生菌、细菌和真核生物共同的蛋白质发挥核心的细胞功能,多数与转录、翻译和核苷酸代谢相关。古生菌也存在相关功能基因的组织成操纵子的特征,如催化同一代谢途径不同步骤的酶组织为新的操纵子。古生菌的tRNA基因及其氨酰tRNA合成酶与细菌和真核生物有明显差异。
古生菌的转录系统具有真细菌和真核生物的融合特征:古生菌的基本转录装置包括RNA聚合酶、基本转录因子、启动子元件等与真核生物相似;而古生菌的转录调控机制却更加类似于真细菌,在古生菌中发现并鉴定了许多类似于真细菌的转录调控蛋白。另外,古生菌还具有某些独特的转录调控方式。古生菌具有单一的依赖于DNA的RNA聚合酶(RNAP),它是含有10~14个亚基的多组分酶,其亚基的成分复杂性远远高于真细菌的RNAP(仅有3个不同的亚基)。古生菌RNAP的绝大部分亚基都与真核生物RNAP的亚基高度同源。古生菌的两种基本转录因子是TATA box结合蛋白(TBP)和转录因子B(TFB)。绝大多数古生菌基因的转录需要RNAP、TBP、TFB 3种蛋白质相互作用形成转录起始复合物。古生菌的TBP在结构和功能上类似于真核生物的TATA box结合蛋白(TBP),负责识别和结合古生菌启动子中高度保守的TATA box区域。古生菌的TFB类似于真核生物的转录因子TFIIB,它在转录起始中起多种关键作用。首先TFB能够与TBP-DNA复合物结合,并且特异性地识别和作用于古生菌启动子BRE元件(TFIIB-responsive element)。TFB的C-末端能够与BRE元件特异性结合,决定了古生菌转录起始复合体的方向正确性,即TFB和TBP的N-末端面向转录起始位点。其次,TFB的N-末端结构域存在一个锌带的基序结构(Zinc ribbon motif),和真核生物的TFIIB一样,古生菌TFB的N-末端结构域对于RNAP与启动子的结合是必需的功能区。在建立了稳定的转录起始复合体之后,TFB还能够协助RNAP脱离转录起始复合体和启动子,继续沿着模板DNA延伸,转录mRNA。古生菌的启动子结构与真核生物RNA聚合酶Ⅱ型启动子相似。古生菌基因转录起始位点上游30bp左右和转录起始位点自身附近的核苷酸对转录非常重要,这两个区域和真核生物RNA聚合酶Ⅱ型启动子的TATA box与转录起始元件具有同源性。TATA box是古生菌主要的基本启动子元件,对于编码rRNA和tRNA以及各种蛋白质的基因的转录是重要的功能元件。TATA box上游一段富含嘌呤的序列对于启动子的强度也很重要,该序列能够特异性地被TFB识别和结合,称为TFB识别元件(TFB-responsive element,BRE)。古生菌的转录调控机制却更加类似于真细菌。古生菌基因组编码大量包含螺旋-转角-螺旋(HTH)DNA结合结构域的蛋白质,这些HTH结构域的序列更加类似于真细菌,而且古生菌中HTH结构域的数量和多样性都与真细菌相似,这些含有HTH结构域的DNA结合蛋白质绝大部分参与特异性基因的转录调控,表明在古生菌基因组中存在大量结构类似于真细菌的转录调控蛋白。古生菌存在一些独特的全局性调控机制(global regulatory mechanisms)。古生菌DNA的拓扑结构能够影响转录的强度,利用抗Z-DNA的抗体,已经在嗜盐古生菌盐沼盐杆菌(Halobacterium salinarum)中分离得到了20多个含有Z-DNA结构的基因组DNA片段。假如这些Z-DNA位于启动子区域,就会影响基因的转录。古生菌染色体不同的组装方式也能够影响基因的转录,例如,在盐沼盐杆菌对数生长早期,染色体不与任何蛋白质相结合;而在稳定期染色体组装成为类似核小体的结构。这种随生长时期不同而不同的染色体组装方式必然会对基因的转录产生全局性影响,这可能是古生菌在转录水平上调节不同生长时期不同基因表达的一种方式。古生菌转录后修饰比真核生物更加简单。多数古生菌基因缺乏内含子,少数蛋白编码基因上发现了内含子,古生菌tRNA和rRNA基因上存在很多内含子。
极端嗜盐古生菌沃氏嗜盐富饶菌(Haloferax.volcanii)细胞间形成胞质桥,似乎用于从一个细胞向另一个细胞转移DNA。当超嗜热古生菌硫矿硫化叶菌(S.solfataricus)和酸热硫化叶菌(S.acidocaldarius)暴露于DNA损伤因子紫外辐射、博来霉素或丝裂霉素C时,会诱导种特异性细胞凝聚。紫外线诱导的细胞凝聚介导酸热硫化叶菌高频率的染色体标记交换,重组率超过未诱导培养物3个数量级,暗示细胞凝聚提高了硫化叶菌细胞间的特异DNA转移,以提高通过同源重组的方式进行的DNA损伤修复。该响应可能为有性互作的原始方式,类似于细菌的转化系统;也与种特异性DNA在细胞间转移有关,引起DNA损伤的同源重组修复。
5.古生菌的繁殖
古生菌通过二分裂或多重分裂、片段化或出芽的方式无性繁殖。不发生减数分裂,不存在有性繁殖。古生菌的细胞分裂在细胞循环中受到严谨的控制。染色体复制后,2个子代染色体分离,细胞分裂。在硫化叶菌属,该循环的特征类似于细菌和真核生物。染色体从多个起始位点开始复制,使用类似于真核生物相应的DNA聚合酶。在广古生菌,细胞分裂蛋白FtsZ在细胞周围形成收缩环,在细胞中央构建隔膜组分,类似于真细菌。然而,在泉古生菌和奇古生菌,细胞分裂机器Cdv发挥类似的作用。该机器与真核生物ESCRT-III机器相关,发挥细胞分选和分裂细胞分离的作用。古生菌不像细菌和真核生物那样产生孢子。嗜盐古生菌的一些种类会发生表型转换,以几种不同的细胞类型生长,包括厚壁结构抵抗渗透压胁迫,允许古生菌在低盐浓度下生存。但这些不同类型的细胞都不是繁殖结构。
6.古生菌的生态
(1)古生菌的生态环境 古生菌存在于多种生境,构成地球上的主要生态系统,代表着海洋20%的微生物细胞。首先发现的古生菌均为极端微生物。在间歇喷泉、黑烟和油井中发现的一些古生菌能在高温下生存(通常高于100℃),在其他生境如高盐、高酸或碱水中也有发现。然而,古生菌也有很多中温菌,生长于温和条件下,如沼泽地、污水、海洋、人和动物腔道、牙龈、白酒窖泥和土壤等。
最近发现古生菌在低温下也存在,有时候数量很大。例如,古生菌在诸如极冷的海洋环境很普遍,而且世界各大海洋的非极端生境均发现大量的古生菌,成为超微型浮游生物。虽然这些古生菌可以极度丰富存在(达40%微生物生物量),但是几乎没有人工分离培养过。因此,理解古生菌在海洋生态中的作用是困难的,其对地球生物地理化学循环的影响还有待于深入研究。一些海洋泉古生菌能进行硝化作用,表明这些生物可能影响海洋氮循环。在海底沉积物也发现了大量古生菌,使得这些生物组成了海底达1m深的主要生活细胞。
(2)在化学循环中的作用 古生菌在不同生境中的碳、氮和硫元素循环中发挥着重要作用。在氮循环中,古生菌发挥着从生态系统移除氮的反应(如硝酸盐呼吸和反硝化)及引入氮的过程(如硝酸盐同化和固氮)。古生菌还涉及氨氧化反应,对海洋和土壤具有较大意义。氨氧化产生亚硝酸盐,再被其他微生物氧化为硝酸盐。硝酸盐可被植物和其他生物同化利用。在硫循环,古生菌通过氧化含硫化合物从岩石释放元素硫而生长,进而硫再被其他微生物利用。硫化叶菌能产生硫酸作为废产物。这些古生菌在废弃矿中的生长,会引起酸性废水排放,损害生态环境。在碳循环,产甲烷古生菌可移除氢气,在厌氧生态系统如沉积物、沼泽地和污水处理场充当分解者的角色。产甲烷菌是大气甲烷的主要制造者,是地球主要的甲烷排放者,因而是全球温室气体排放和全球变暖的元凶。
(3)与其他生物的互作 古生菌寄生的研究不够透彻,一些产甲烷菌可能与口腔感染有关,骑行纳古生菌可能是另一种古生菌的寄生菌,因为它仅在泉古生菌Ignicoccus hospitalis胞内生存和繁殖,而且似乎对其宿主没有益处。认识比较清楚的古生菌与其他生物的互作是共生和共栖。反刍动物和白蚁消化道内分解纤维素的原生动物与产甲烷古生菌间的关系为共生。在厌氧环境中,原生动物裂解纤维素获得能量,该过程释放氢气;产甲烷古生菌转化氢气为甲烷,降低了氢气的浓度,使原生动物受益。古生菌栖息在厌氧原生动物如Plagiopyla frontata内部,利用其氢化酶体产生的氢气合成甲烷。古生菌Cenarchaeum symbiosum作为内共生体生活在墨西哥小轴海绵Axinella mexicana内部。古生菌也可共栖,对其伙伴不产生有利或有害影响。例如,产甲烷菌史氏甲烷短杆菌(Methanobrevibacter smithii)是与人类发生联系的最普遍的古生菌,在人类肠道内约占原核生物的1/10。这些产甲烷菌与白蚁和人类的关系为共生,在肠道内与其他微生物互作,帮助白蚁和人类消化食物。在珊瑚表面和根际的土壤古生菌也与很多其他生物发生联系。
7.古生菌研究的主要价值
古生菌是地球重要的生物资源。研究古生菌具有重要的理论意义和开发利用价值。古生菌研究进一步深化了对生物进化的认识。沿北冰洋大洋中脊(Arctic Mid-Ocean Ridge)的沉积物中发现了一组新的古生菌,被命名为Lokiarchaeota,可能构成搭建原核生物和真核生物两者间桥梁的作用。古生菌与真核细胞是姐妹,她们拥有共同的祖先。在进化树上真核生物的起源归到了TACK超门古生菌(包括奇古生菌门、曙古生菌门、泉古生菌门和初古生菌门)分支上。Lokiarchaeota归属于TACK组,是与真核关系最接近的原核生物类群。据研究,在大约20亿年前,Lokiarchaeota与真核生物拥有共同的祖先。这一祖先拥有一个基因的“起始套件”(starter kit),拥有这一特性使其不断增加细胞的复杂性,进化形成今天缤纷的真核生物界。Lokiarchaeota拥有部分编码仅在真核细胞中才出现的蛋白的基因,如支撑细胞形状和细胞运动的骨架蛋白基因。真核细胞进化的一个关键问题是获取线粒体。Lokiarchaeota与其他原核生物一样,也没有线粒体。因此,细胞何时与“能量工厂”的祖先发生了融合还是一个悬而未决的问题。在Loki样古生菌中找到了编码肌动蛋白的一些基因,虽然现在还不清楚它们在Loki中的功能,但是发现的这些基因提供了一些提示。真核生物肌动蛋白具有多种功能,其中一个就是吞噬,有了这种能力细胞才能吃掉其他细胞。可以推断出Loki与真核生物共同的祖先也拥有这类基因。
目前学术界认可沃斯提出的生物三域分类系统,即将地球上的生物分别归为细菌域(Domain Bacteria)、古生菌域(Domain Archaea)和真核生物域(Domain Eukarya)。然而,Lake等于1984年根据核糖体形态的演化分析发现,相对于真细菌和其他古生菌而言,真核生物与原核的泉古生菌具有更近的亲缘关系,二者为姊妹群,并提出了不同于三域假说的泉古生菌假说,即真核生物起源于泉古生菌。Williams等(2013)认为,随着新的生物进化分支的发现,数据的不断积累,以及更好的系统演化模型的应用,越来越多的证据更加支持二域分类系统,即将所有的生物分别归为细菌域和古生菌域,其中真核生物归为古生菌域,并起源于泉古生菌。
在技术与工业应用领域,极端生活古生菌,特别是抗热或抗酸、抗碱的古生菌,是重要的特种酶制剂来源。这些酶有很多用途。聚合酶链式反应(polymerase chain reaction,PCR)中所使用的几种热稳定DNA聚合酶,如vent DNA聚合酶来自超嗜热古生菌滨海热球菌,Pfu DNA聚合酶来自激烈火球菌,Pwo DNA聚合酶来自嗜热古生菌Pyrococcus coesei,使得PCR成为简便快捷的DNA克隆研究技术。在工业上,来自其他火球菌的淀粉酶、半乳糖苷酶和普鲁蓝酶,在超过100℃时仍具有活性,可应用于高温下食品加工,如产生低乳糖牛乳和乳清。来自这些嗜热古生菌的酶在有机溶剂中也稳定,可以应用于环境温和的绿色化学加工业,合成有机化合物。同时,该稳定性使得它们应用于结构生物学研究。
相对于古生菌酶的广泛应用,古生菌在生物技术其他方面的应用发展较为缓慢。产甲烷古生菌是完成厌氧消化和产生生物气体的微生物群落的组成部分,在污水处理中发挥着关键作用。此外在选矿业,嗜酸古生菌在从矿砂包括金矿、钴矿和铜矿中提取金属方面具有利用价值。
古生菌还产生一组具有潜在应用价值的抗生素。这些古生菌素已有少数研究,特别在嗜盐古生菌和硫化叶菌中可能存在上百种。这些古生菌抗生素在结构上与细菌抗生素不同,可能具有新作用机制。此外,还可产生一些新的选择性标记,用于古生菌分子生物学研究。
8.重要的古生菌类群
(1)氨氧化古生菌 氮是生命体核酸与蛋白质必不可少的组成元素。氮素的生物地球化学循环(氮循环)对生命的存在和持续具有关键作用,本质上是微生物驱动的氮素转化、利用及循环的过程,包括氮的固定、硝化作用、反硝化作用和氨化作用。其中硝化作用,即将氨氧化为亚硝态氮,进而氧化为硝态氮的过程,是氮循环的核心环节。氨氧化被认为是硝化作用的第一个限速步骤,主要是由β-变形杆菌亚门或γ-变形杆菌亚门细菌所进行的专性化能自养过程,本质上是由氨单加氧酶催化完成的微生物生化反应。近年来,随着分子生物学技术的快速发展,科学家们通过对海洋、土壤等环境的研究发现,氨氧化古生菌(ammonia-oxidizing archaea,AOA)也具有编码氨单加氧酶的基因,且广泛分布于包括海洋、湖泊和土壤等在内的多种环境中,因此可能也有进行氨氧化的能力,参与环境氮循环的硝化作用环节。
采用传统的平板分离培养和富集培养等技术,已经分离到多种氨氧化细菌(ammonia-oxidizing bacteria,AOB)和AOA。但是由于氨氧化微生物生长缓慢,采用培养技术难以全面分离。目前,对AOA的研究主要依赖分子微生物技术,如荧光原位杂交(fluorescence in situ hybridization,FISH)技术、甘油二烷基甘油四醚脂技术、稳定性同位素技术等,以及基于PCR方法的基因克隆建库、反转录PCR(reverse transcription PCR,RT-PCR)、定量PCR(quantitative PCR)等。基于PCR的分子生物学方法所采用的引物是16S rRNA基因或功能基因amoA的两侧序列。
AOA在全球具有很广的生态位,在陆地环境中的分布非常广泛,在农业土壤、温带森林土壤、半干旱森林土壤、稻田土壤、牧草土壤、淡水植物仙人掌水草(Littorella uniflora)根系土壤以及高原永久冻结带等陆地生态系统中都检测到AOA。在水生生态系统中的各个区域都有AOA的分布,包括海洋透光层和深海缺氧层、深海沉积物、珊瑚和暗礁、江河口、地下河入海口、淡水及沉积物,以及南北两极的海水中。在工程系统中也发现有AOA的存在,如废水生物反应器、污水处理厂的活性污泥、活性污泥生物反应器样品、污水处理厂等。中温泉古生菌(主要包括AOA)主要聚类于奇古生菌Group I.1a分支和奇古生菌Group I.1b分支。其中,奇古生菌Group I.1a分支包括了海洋、大多数水体以及沉积物来源的AOA;奇古生菌Group I.1b分支涵盖了土壤及其他陆地生态系统来源的AOA。
在水生生态系统中AOA类群具有数量优势。土壤环境中AOA的比例也相当高,总体高出AOB2~3个数量级。研究表明,古生菌具有氨氧化功能。AOA的半饱和速率常数Km与海洋原位氨氧化作用的Km非常接近,且A O A对底物铵态氮的亲和力相当高,进行氨氧化作用的最低铵态氮浓度约为AOB最低生长浓度的1/100或更低。因此AOA在与其他微生物竞争底物铵态氮时占有绝对的优势,在氨氮浓度极低的贫营养水体中AOA丰度远高于AOB。可以通过羟基丙酸/羟基丁酸循环更高效地利用能源进行CO2的固定,将无机碳转化为有机碳营自养生活,从而从生物化学的角度解释了AOA能够在寡营养条件下生存和繁荣的机制。AOA不仅丰度显著高于AOB,而且在部分生境中其转录和表达活性也高于AOB,尤其在低浓度铵态氮生态系统和贫营养海域,AOA对硝化作用的贡献远大于AOB。在高氮投入的生态系统,AOB是氨氧化过程的主要驱动者,AOA的生态学功能仍待进一步探索。相对于复杂的土壤环境,已有证据表明硝化古生菌是海洋氨氧化过程的重要驱动者。嗜热AOA更是高温环境氨氧化作用的主要承担者。因此,AOA在自然界氮素生物地球化学循环中可能起着非常重要的作用。
(2)缺氧嗜甲烷古生菌缺氧嗜甲烷古生菌(anaerobic methanotrophs,ANME),也称甲烷氧化古细菌(methane oxidizing archaea,MOA),是负责海底沉积物中甲烷缺氧氧化(anaerobic oxidation of methane,AOM)的古生菌。海底沉积物中发生的AOM在减少甲烷从海洋向大气的释放中起着非常重要的作用,海洋环境中大约90%的甲烷是由这一过程去除的。因此,AOM对于调控大气甲烷的平衡以及缓解甲烷引起的温室效应具有极为重要的意义。另外,AOM研究对寻找海底天然气水合物资源也十分有用,可间接指示天然气的存在。
缺氧嗜甲烷古生菌大多与硫酸盐还原菌(sulfate-reducing bacteria,SRB)联合,共同完成AOM。在缺氧环境中,微生物维持生长的普遍方式是互养共栖,然而这种互养关系大多数不能在实验室重复,一个显著的例子正是ANME与SRB,所以至今未培养出这些菌。与ANME互养的SRB主要属于Δ-变形菌(Deltaproteobacterium)。一般认为在AOM这一过程中,ANME将CH4转化为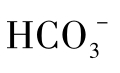 ,S RB再将
,S RB再将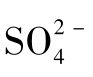 转化为HS -,总反应式为:CH4+SO42-=HCO3-+HS -+H2O。可以看出,甲烷氧化与硫酸还原偶联。ANME至今未获得纯培养,主要原因可能是AOM过程产能低,致使ANME生长缓慢。因此对这种菌的生理生化及形态学知识人们掌握得很少。目前对ANME的研究主要是基于16S rRNA基因文库的构建、荧光原位杂交等分子生物学方法,只能间接地展现ANME的群落结构等特征。
转化为HS -,总反应式为:CH4+SO42-=HCO3-+HS -+H2O。可以看出,甲烷氧化与硫酸还原偶联。ANME至今未获得纯培养,主要原因可能是AOM过程产能低,致使ANME生长缓慢。因此对这种菌的生理生化及形态学知识人们掌握得很少。目前对ANME的研究主要是基于16S rRNA基因文库的构建、荧光原位杂交等分子生物学方法,只能间接地展现ANME的群落结构等特征。
ANME代表着一个新的广古生菌类群,目前至少包含3个簇,即ANME-1、ANME-2和ANME-3。ANME-1(分为a和b两个亚簇)与甲烷微菌目和甲烷八叠球菌目系统进化关系较近,但形成单独的分支。ANME-2(分为a、b、c和d四个亚簇)形成甲烷八叠球菌目中的一个较大分支。ANME-3是最近才鉴定出来的新类群,与甲烷八叠球菌目甲烷类球菌属(Methanococcoides spp.)的基因序列相似性较高。
ANME几乎在有冷泉活动和水合物产出的海底环境中都能找到,硫酸盐-甲烷界面和海底甲烷渗漏区也生长着较多ANME,同时,在海水、陆地湖泊、湖底泥、含水层、土壤、金矿生物膜、采油污水以及废水污泥等环境中也能发现这类古生菌。在已知研究中,ANME大多都是通过16S rRNA、mcrA基因以及类脂生物标志化合物(ANME形成相应的醚类异戊二烯类和类异戊二烯类生物标志物,SRB形成二烃基甘油二醚和脂肪酸生物标志化合物)直接从环境样本中检测出,并辅以荧光原位杂交、变形梯度凝胶电泳和末端限制性片段长度多态性分析等技术进行具体检查分析。AOM大约发生在海底几毫米到200m的区域,甲烷和硫酸盐的存在与否是影响AOM中互养微生物生长的主要因素;氧气也是不容忽视的环境因子,因为ANME和SRB都是缺氧生长的。
近年来,应用FISH和次级离子质谱(secondary ion mass spectroscopy),发现冷泉活动区海底沉积物及水合物样品中,单体的ANME细胞呈球状,直径通常为0.13~0.15μm。黑海渗漏区的单体ANME的细胞呈尾部扁平的圆柱杆状,具有矩形外观,直径为0.16~1.14μm。有些ANME细胞相互连接形成长达70μm的丝状体,三维图像为圆柱杆状。甲烷渗漏区的ANME细胞常聚集成球状集合体,部分或全部被SRB细胞包裹,这种以ANME为核、以SRB为包壳的球状互养集合体直径通常为1~11μm,平均为3.2(±1.5)μm。这种互养集合体通常从小集合体发展为大约100000个细胞的大集合体(直径可达20μm以上),当SRB的生长触及ANME核时,大集合体就均等或非均等地分为许多小集合体。
ANME与产甲烷菌有着许多相似点:①几乎都必须在严格缺氧的环境中生存。②都含有可作为标志基因的甲基辅酶M还原酶的α亚基基因(mcrA)。③都存在多样的代谢途径,ANME在AOM中不仅能以硫酸盐为电子受体,还能将硝酸盐等还原;产甲烷菌代谢途径的多样性表现在以氢气和二氧化碳、乙酸或甲基化合物等作为产甲烷底物。④都有可能逆转自身的代谢途径。痕量甲烷氧化研究证实常温产甲烷古生菌乙酸甲烷八叠球菌(Methanosarcina acetivorans)能进行一定量的缺氧甲烷氧化;也已经证实ANME的逆转产甲烷代谢途径。⑤甲基硫化物很可能是AOM的中间代谢物;同时,乙酸甲烷八叠球菌的一氧化碳产甲烷途径也是以甲基硫化物作为中间代谢产物。⑥部分ANME甚至含有产甲烷菌进行甲烷合成所需的全部基因,并利用这些基因进行AOM。
(3)嗜盐古生菌嗜盐古生菌是一类需要高盐维持生长的古生菌。到目前为止,已发现的嗜盐古生菌都属于古生菌域的广古生菌门,主要包括:嗜盐甲烷古生菌类群(Halophilic methanogenic archaea)、嗜盐古生菌纲(Halobacteria)的全部成员以及尚不能培养的纳米嗜盐古生菌类群(Nanohaloarchaea)。嗜盐甲烷古生菌类群主要包括甲烷八叠球菌科(Methanosarcinaceae)和甲烷卵石形菌科(Methanocalculaceae)的部分物种,这些物种除调查甲烷盐菌(Methanohalobium evestigatum)为极端嗜盐菌(生长盐浓度范围15%~30%,最适生长盐浓度25%)外,其余的都属于中度嗜盐菌或耐盐菌。这些嗜盐甲烷古生菌类群所处的属、科也存在非嗜盐类群,因此嗜盐甲烷古生菌类群并非单系的分类群,因而不属于传统意义上的嗜盐古生菌。传统意义上的嗜盐古生菌是指属于古生菌域、广古生菌门、嗜盐古生菌纲、嗜盐菌目、嗜盐菌科和其下14个属(《伯杰氏系统细菌学手册》第2版第1卷)的全部物种。纳米嗜盐古生菌类群是近年通过“宏基因组”组装技术揭示的“微生物暗物质”类群,可能代表广古生菌门的一个未知的纲,目前尚不能培养。截至2015年12月底,嗜盐古生菌纲已经描述了52个属、213个种。
极端嗜盐古生菌(extremely halophilic archaeon)的生长至少需要1.5mol/L NaCl,在含2.5~5.2mol/L盐的培养基中生长最好,很多能够在饱和NaCl浓度下生长。它们主要分布于天然或人工高盐环境中,如海洋、盐(碱)湖、晒盐场、盐矿、人工腌制品等。极端嗜盐古生菌属于嗜盐菌目(Halobacteriales)下的盐杆菌科(Halobacteriaceae)。该科由1997年的9个属发展到2002年的15个属,到2005年12月增加到21个属,到2008年9月记录了27个属,正式公布名字的种达96个。至今已记录39个属。嗜盐碱古生菌的生活环境不仅需要高浓度的NaCl,而且需要高pH和低浓度的Mg2+。嗜盐碱古生菌主要归于盐杆菌科下的两个属,即嗜盐碱杆菌属(Natronobacterium)和嗜盐碱球菌属(Natronococcus)。
嗜盐古生菌是盐环境的土著类群,驱动着盐环境生态系统的生物地球化学循环。作为极端微生物,嗜盐古生菌在理论研究和应用领域具有重要的研究价值。
(4)海洋古生菌海洋约占地球表面积的71%。海洋生态环境独特,具有盐浓度高、深层海域高压、低温、低营养和光照强度变化大等特点,因此生活在这一复杂环境中的海洋微生物为适应这一独特的环境条件,在物种类型、代谢类型、功能基因组成和生态功能上具有多样性。海洋微生物种类繁多,据统计有1×106~2×108种,迄今只了解其总量不到1%。海洋原核微生物是海洋生物中的主要成分,在海洋生态系统中的物质和能量循环中起到关键作用,在海洋环境下生存的大量微生物为适应复杂的环境,具有其独特的代谢方式,代谢类型具有多样性。
浮游古生菌在海洋中十分丰富,并且广泛存在于各类海洋生态环境中,古生菌的分布、组成及多样性与海水的深度、季节、温度等环境条件的变化有相关性。研究发现,海洋浮游古生菌在海洋水域表层相对广泛存在;而在水域中层,浮游古生菌在原核细胞群体中占优势地位。在不同的海域中古生菌的分布也有变化,在南极海域中古生菌在浮游微生物中可占到10%~30%。北冰洋及南极海域古生菌的研究发现,浮游古生菌在深层海域中要比在表层水域中丰富得多;广古生菌在各个海域中都有一些独特的类型;在北冰洋海域中古生菌的构成分布与海水的深度有关。类型Ⅰ泉古生菌数量为56%,类型Ⅱ广古生菌为43.5%。但是,类型Ⅱ广古生菌的多样性要比类型Ⅰ泉古生菌丰富得多。类型Ⅰ泉古生菌在海域中是优势的浮游原核生物,而类型Ⅱ广古生菌只是在海洋表层水域中为优势类群。
对大西洋和太平洋不同水深的样品系统进化分析发现,随着水深增加古生菌的相对含量增加,可以从表层的占微型浮游生物的约2%,到200m深达到最大值约20%,然后就不再随深度发生变化。但由于在表层与200m水深的微生物总量相差一个数量级,因此古生菌的绝对含量并无多大的变化,并且发现该层的古生菌多为广古生菌门,而在深层则多为泉古生菌门。北大西洋深层海水浮游古生菌的丰富度远比细菌的要高,分别为42%和32%。研究还发现,古生菌的种类数占海洋原核生物种类数目的60%,它构成原核生物34%的生物量。对太平洋海域中层海水中古生菌的丰富度进行了研究,在透光水域下(>150m),浮游的泉古生菌构成海洋浮游生物的主要部分。随着深度的下降,泉古生菌在整个可检测到的浮游生物中占到39%,推断在世界海洋中约有1.3×1028个古生菌细胞体和3.1×1028个细菌细胞体,并且认为浮游的泉古生菌为最为丰富的单一细胞类型之一。深海热水域附近的类群I泉古生菌比例要比在一般海域的更高。
古生菌在海洋中空间分布的主要影响因子有海水的盐浓度、各种养分的含量与分布,以及与海水深度有关的光照强度、压力、氧气的含量、温度等影响因子。在不同的海域,对古生菌的分布有不同的主要影响因子。在极地海域,温度是主要的影响因子,但在热带、亚热带海域,温度对古生菌的分布影响可能就小一些;在深层海域,压力与氧气的含量是主要的影响因子。在海底沉积物中,由于氧气的含量低,在这一环境中分布的古生菌多为厌氧型古生菌,如产甲烷古生菌等。
古生菌是海洋微生物类群中的主要组成部分,尤其是海洋浮游古生菌。古生菌在海洋生态系统中的广泛分布表明,在古生菌域中可能会有新的表型古生菌大量存在。由于古生菌大量存在于各种海洋生态环境中,种类繁多,代谢类型独特多样,所以浮游的海洋古生菌被认为在海洋生态中的物质和能量循环中扮演重要的角色。
(5)土壤古生菌土壤中的古生菌主要分布在广古生菌和泉古生菌两大门,并以中温泉古生菌为主,不仅分布广泛,而且多样性丰富。与细菌相比,绝大多数古生菌的多样性要小得多,而且种群分布在土壤层次间也有一定的专一性。土壤中古生菌的多样性在某种程度上还与细菌的多样性有一定的相关性。比如,一些影响细菌群落的环境因子也改变了那些可被古生菌利用的底物,最终对古生菌的多样性产生影响。中温泉古生菌在陆地环境中分布广泛,在农业土壤、森林土壤、草原,以及退化冰川高山等土壤中均有发现。在外界环境因子作用下,土壤泉古生菌群落组成会发生很大的变化。土壤中的中温泉古生菌含量很高,约占全部原核生物的1%~5%,在酸性森林土壤中达到12%。有趣的是,虽然土壤细菌的数量远远高于古生菌,但在整个原核生物中古生菌的比重随土壤层次加深而趋于增大,比如在酸性森林土壤中从12%增加到38%。在草地生态系统中的研究发现,泉古生菌的数量远远大于广古生菌。土壤是一个复杂的异质体系,土壤中微生物群落的分布和数量受土壤理化性状的影响。土壤泉古生菌分布不仅与土壤养分状况紧密相关,也与土壤pH、土壤层次深度、污染状况、植被和土壤管理方式有很大的关系。土壤剖面上有机碳组成和可利用性的变化可能引起泉古生菌在剖面上的分布差异。随土壤剖面加深,土壤有机质和总氮含量明显降低,同时土壤广古生菌和中温泉古生菌也随之减少,而土壤质地和pH没有表现出显著的变化。采用16S rRNA基因构建克隆文库的方法对森林泥炭土的剖面进行分析,发现表层土壤中(0cm和10cm)未能检测到古生菌序列,而在深层土壤中(20cm和50cm)获得了属于泉古生菌的序列,且在这些土层中未检测到广古生菌序列。根据对长期定位试验站的调查结果,土壤pH影响氨氧化泉古生菌群落和丰度,尤其在酸性土壤影响更为明显。土壤中氨氧化泉古生菌的群落结构在不同pH(4.9~7.5)的长期影响下产生了明显的变化。
沈菊培等(2011)以2个农田剖面土壤和2个长期施肥试验站祁阳(QY)和封丘(FQ)的土壤为对象,以实时定量PCR方法为主要研究手段,对土壤中古生菌(包括泉古生菌)和细菌的16S rRNA基因拷贝数丰度变化进行了研究。结果表明,土壤泉古生菌16S rRNA基因拷贝数要低于古生菌1~2个数量级,两者与细菌相比,16S rRNA基因拷贝数大小顺序为土壤泉古生菌<古生菌<细菌,而古生菌和泉古生菌16S rRNA基因拷贝数与细菌的比值均随土壤深度加深而增大。不同施肥处理对土壤古生菌和泉古生菌的数量有显著影响。QY试验站土壤古生菌和细菌的数量与土壤pH显著相关;FQ古生菌、泉古生菌和细菌与土壤pH相关性不显著,与土壤有机质含量相关性均达显著水平。
秦杰等(2015)借助传统化学分析方法和Illumina Miseq高通量测序技术解析土壤化学性状和细菌与古生菌的群落结构特征,并对细菌和古生菌群落结构与环境因子进行相关性分析。结果发现,不同施肥处理土壤细菌和古生菌群落结构存在显著差异,与不施肥相比,施氮磷肥、施氮钾肥、施磷钾肥、施氮磷钾肥处理均降低了古生菌的丰富度,施氮磷钾肥处理增加了土壤细菌的丰富度、多样性以及古生菌的多样性。pH对土壤细菌和古生菌群落结构的影响最大(解释了66.5%的变化);其他环境因子则共同解释了细菌与古生菌群落33.5%的变化;各因子的贡献率依次为pH>速效钾>有效磷>有机质。细菌和古生菌群落与土壤化学指标间存在密切的相关关系。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。





