填充到容器中的储氢材料不尽相同,是储氢容器开发的重要环节。迄今为止,趋于成熟和具备实用价值的金属氢化物储氢材料主要有钛系、稀土系、镁系、Laves相系和V基bcc固溶体系五大系列。此外,还有部分潜在的金属氢化物如硼氢化物、氢化铝盐、氢化物/氮氢化物复合体系、氨硼烷等,由于具备独特的储氢性能成为目前研究的热点。
1.金属氢化物[7-10]
(1)合金储氢
合金是研究较早且较为成熟的方向,在合金中氢以原子态存储,重新释放出来时,经历扩散、相变、化合等过程,这些过程受到热效应和反应速度的制约,不易爆炸,安全程度高。用于氢存储的金属氢化物,其要求的主要性能有:室温下合适的吸氢压力;组分-压力曲线宽而平坦,且滞后小;氢化物生成热和氢燃烧热比值小;易活化;良好的抗氧化性能;成本低。
1)Ti-Fe系。1969年,美国布鲁克海文国立实验室首先合成具有CsCl结构的FeTi,其储氢量为1.8wt%。生成的氢化物在室温下的解吸压力为105Pa数量级,易于操作,同时FeTi价格较低,但活化温度和活化压力均较高、滞后较大、抗氧化性能差、寿命较短。为改善FeTi的性质,采用Mn、Cr、Co、Ni、V等元素部分取代Fe或Ti,可得一系列三元、四元或五元合金。
2)稀土系(AB5型)。以LaNi5为代表,具有CaCu5型六方结构,吸氢和解吸性能优良,储氢性能极佳(合适的坪压、滞后系数较小,易于活化和较强的抗中毒能力),但成本太高。
为降低成本,使用稀土元素(主要为La、Ce、Pr、Nb)的混合物Mm取代La,制得MmNi5,用Ca、Cu、Mn、Fe、Al等金属部分置换Mm或Ni,形成稀土类储氢合金。通过调整MmNi5中Ni成分的第三和第四种元素,可获得适合不同用途的稀土金属氢化物。
3)镁系储氢合金。该合金也由美国布鲁克海文国立实验室首先研制成功,典型代表为Mg2Ni。这类合金的储氢量可达3.8wt%,重量轻、解吸等温线平坦、滞后小,是移动装置上理想的储氢合金。缺点是脱氢的温度高(解吸压力为105Pa时,解吸温度为287℃),吸氢(解吸)速度较低,热焓增量大。
通过添加Ca、Cu、Al和稀土金属可提高其吸(放)氢的速度,从而形成了适合不同用途的Mg2Cu、Mg2Ca、Mg1.92Al0.08Ni等镁系储氢合金。
4)Laves相系(AB2型)。已有C14(MgZn2型)、C15(MgCu2型)、C36(MgNi2型)3种,均为立方晶体结构。Laves相储氢达1.8wt%~2.4wt%。另有一类是bcc相与Laves相共存的一个体系,其吸氢行为与Laves相相同,此相称为与Laves相有关的bcc固溶相。bcc固溶相能大量吸氢,是很有前途的储氢合金。
5)V基bcc固溶体系。V及V基固溶体合金(V-Ti及V-Ti-Cr等)吸氢时可生成VH及VH2两种类型氢化物。其中,VH2的储氢量高达3.8wt%,在接近室温条件下,尽管VH的平衡氢压太低而使VH→V的放氢反应难以利用。实际上可以利用的VH2→VH反应的放氢量只有1.9wt%左右。此外,由于难于活化及价格昂贵,一直以来,V基合金的发展进展不大。近年来,TiMnCrV等四元合金具有良好的吸放氢性能。该类合金的最大吸氢量可达到4wt%,但是由于稳定的第二相的存在,只有一半能在100℃以下放出。
虽然LaNi5这样的材料已经在镍氢电池领域得到了广泛的应用,然而已经用于实际生产的储氢合金的储氢量还相对比较低,储氢量<2.5wt%,因此开发研究高能储氢材料成为了广大研究者们研究的目标。
储氢合金有着安全可靠的储氢性能及较高的体积氢含量等优点,因此其在氢气存储方面一直有着重要的地位,是诸多国家长期研究的重要领域,所开发的部分合金已应用于车载储氢罐及其他相关领域中,表14-3列举了几种储氢合金储氢罐的应用实例。但其不足也非常明显。首先,储氢合金单位重量的储氢能力有限;再者,存在使储氢合金性能衰减的诸多因素,如吸放氢体积变化引发的储氢合金粉化,由于储氢容器在放氢过程中吸热引起的储氢容器温度降低,杂质气体在合金中的积累,合金会变质等。
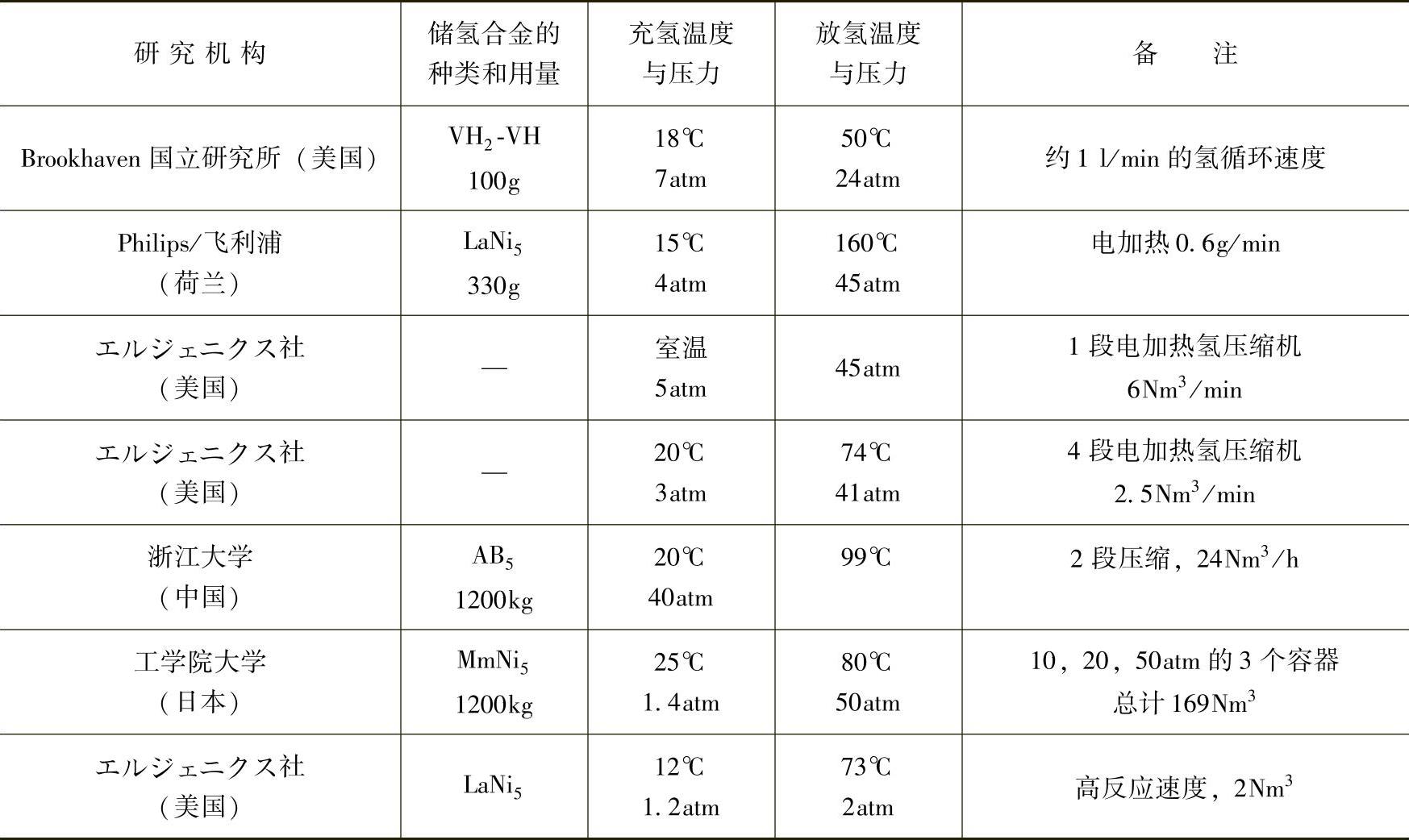
表14-3 储氢合金储氢罐应用实例
(2)金属单质氢化物(https://www.daowen.com)
金属单质氢化物有许多,如LiH、NaH、MgH2、CaH2、AlH3等,对于上述金属原子量较少的化合物,其有效氢含量可以较由过渡金属组成的合金有大幅提高,但对大多数单质氢化物而言,形成化合物的稳定性或较高的吸氢条件成为了这类化合物的普遍不足。尽管单独使用该物质作为储氢材料存在一定困难,不过这类化合物在储氢方面无疑具有潜在的价值。
在这类化合物中,MgH2因较高的氢含量(7.7wt%)、较好地可逆循环性在过去的20多年内受到的关注最多。MgH2自身分解放氢时,要达到一个大气压的平衡压需约300℃的高温,其吸放氢热、动力学的改善是主要的研究方向。研究发现通过与一些氧化物如V2O5、Nb2O5球磨后,MgH2的储氢动力学性能可以明显改善[11,12]。另外,TiF3/MgH2体系也表现出了较高的吸放氢性能,在300℃时其放氢可以在6min内完成,吸氢可以在室温下进行,可逆循环储氢量为4.5%[13]。其他添加剂如Co、Ni等对MgH2的吸放氢也有作用。除添加剂外,纳米化也是改善MgH2储氢性能的一个有效方法,计算表明当MgH2分散至0.9nm时,其在真空中的放氢温度可以降低到200℃[14]。
此外,另一种单质氢化物AlH3,具有更高的存储密度(10.1%),比传统的储氢合金储氢密度高很多。AlH3可以通过LiAlH4+AlCl3在乙醚溶液中反应得到,但这种方法的重复性差,往往得到AlH3的乙醚络合。目前已报道7种AlH3物相,皆在室温下处于亚稳定态。最近研究表明[15,16]:Al引入二甲基乙醇胺(DMEA)或者三乙烯二胺(TEDA)再加上Ti的催化后,在可逆性上有了突破的进展。然而DMEA或TEDA这种不放氢的有机物引入,对于AlH3储氢含量大为不利。通过上述两个例子可知,对于极不稳定的AlH3来说,引入路易斯碱有利于形成一种稳定的络合物,使得AlH3的生成反应得以进行。
基于稳定性,可逆性等多方面考虑,其他金属氢化物本身作为储氢材料的研究不多,不过这些化合物在与其他储氢化合物复合方面却有较多研究。
2.轻金属配位氢化物
研究表明,元素周期表中部分轻金属可以与氢形成某种稳定的配位结构,如BH4-、AlH4-等,图14-12为几种储氢材料储氢密度对照,由该图可以看出由于该类化合物中以轻金属元素为主,所以有较高的理论氢含量,如LiBH4理论氢含量为18.6wt%,LiAlH4的理论氢含量10.6wt%,均高于理想固体储氢材料的标准,具有很高的研究开发价值。但该类化合物在1940年首次报道后较长时间内并未引起关注,主要是因为在没有催化剂作用下,该类化合物通常存在脱氢温度高或加氢反应条件苛刻的不足[17,18]。
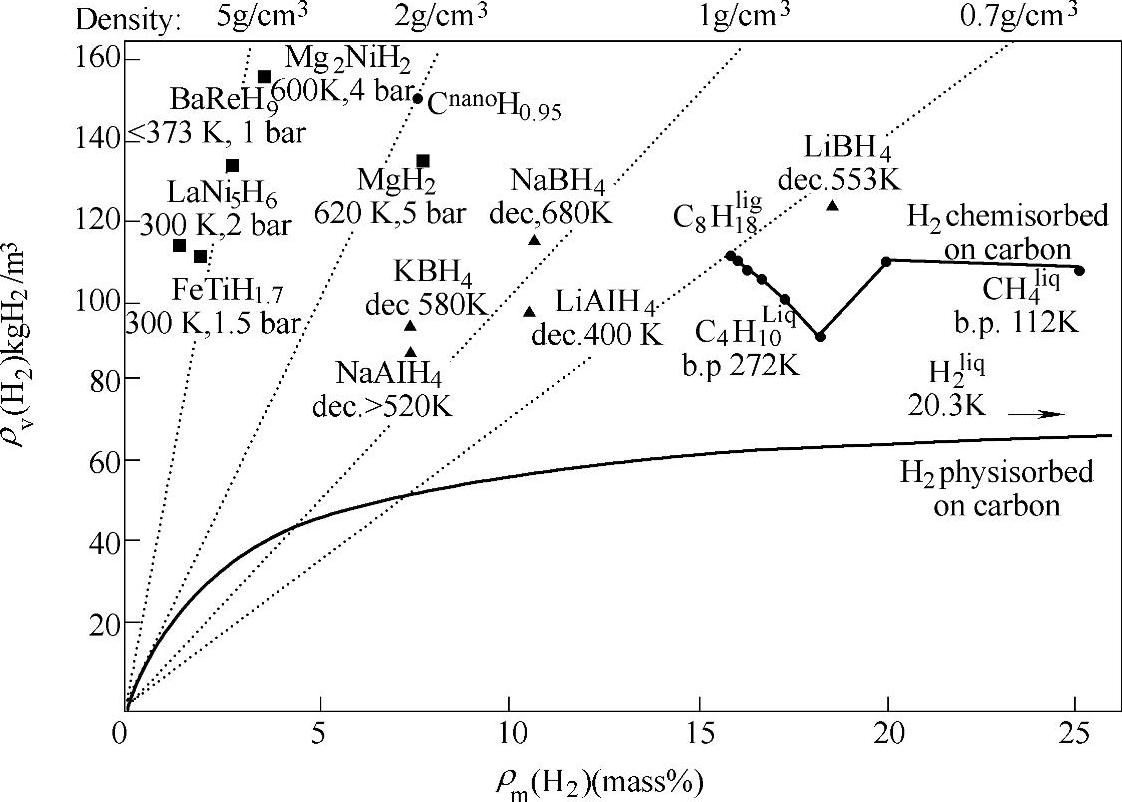
图14-12 各种储氢材料储氢体积及质量密度对比图
对于硼氢化物,LiBH4由于含氢量高,备受关注,出现了大量LiBH4改性方面的研究报道[19-26]。对于LiBH4,研究发现通过与MgH2、CaH2,SiO2、LiNH2、碳等多种化合物复合,LiBH4的放氢性能会发生改变,如LiBH4/MgH2(摩尔比2:1)时,放氢反应的焓变为约25kJ/mol H2,而与LiNH2等混合时反应为放热反应,放氢温度更低。对于其他硼氢化物如(Mg(BH4)2、Ca(BH4)2、Zn(BH4)2目前也有较多研究[27-36]。Nakamori等指出M(BH4)n(M=Li、Na、Ca、Mg、Zn等。)的分解温度与M离子的电负性有关,电负性越高,化合物分解温度越低[37,38]。
在AlH4-化合物中,研究最多的是理论氢含量为7.4wt%的NaAlH4[39]。其首次报道在1961年[40],1997年证实NaAlH4+2%Ti能够在较缓和条件下可逆吸放氢后,出现了大量不同种类钛化合物对NaAlH4吸放氢影响及吸放氢机理的研究[41-45]。最近研究表明,NaAlH4/钛复合体系可以在160℃吸放4wt%氢100次以上[46],尽管NaAlH4体系可能无法达到理想储氢材料的标准,但仍有应用价值,同时其低温可逆吸放氢机理也值得研究。相对于NaAlH4,其他AlH4-化合物如Na2LiAlH6、KAlH4、K3AlH6、K2LiAlH6及K2NaAlH6不仅含氢量低,也更稳定;而LiAlH4、Li3AlH6、Mg(AlH4)2、Ca(AlH4)2、Ti(AlH4)4含氢量稍高,但这些物质可逆性不如NaAlH4[47]。
3.氨硼烷及其衍生物
氨基硼烷(AB)是最近新型的热门储氢材料,其具有较高的含氢量(大约20wt%)以及较好的动力学。AB可以在100℃以下释放1个当量的氢气,但是,要释放所有的氢气,则需要加热到500℃,而且伴有硼吖嗪以及氨气等气体释放,导致氢气纯度严重下降。所以,近来的研究主要集中在对其放氢动力学和氢气纯度的改善上。但是,其可逆性一直没有突破,从而也限制了其市场应用。最近研究表明,通过图14-13所示途径,AB可以有效地再生,这将大大推动该类材料最终走向实际应用。
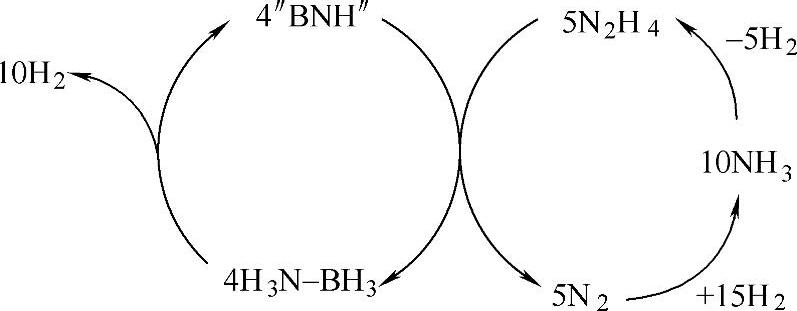
图14-13 NH3BH3的再生途径:PB(BNH)与N2H4反应[48]
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







