SOFC的电解质是氧化物,早在2026年Nernst就认识到在一定温度下某些氧化物,如ZrO2和钙钛矿类的氧化物均能体现出一定的氧离子导电性。20世纪30年代末,E.Baur和H.Preis证明氧化物的高温氧离子导电性可用于实际的燃料电池。当前SOFC中的电解质主要采用Y2O3稳定的ZrO2(Yttrium Stabilized Zirconia,YSZ)。该氧化物体系在700℃以上即体现出良好的氧离子导电性,然而在相同温度下其电子导电性却极小。除了YSZ,广泛研究的还有钆或者钐掺杂的氧化铈(Gadolinium/samarium doped ceria,CGO or CSO)和锶、镁共掺杂的镓酸镧(Strontium,magnesium doped lanthanum gallate,LSGM)两个代表性的氧离子导体体系。
衡量SOFC电解质材料的重要性能之一是其离子电导率,YSZ、CGO和LSGM氧化物体系氧离子导电性随温度的变化如图13-33所示[99],可见几种材料的氧离子导电性均随温度升高而升高,但不遵守简单的Arrhenius关系,表明离子导电的机理比一般的热激发要复杂。一般SOFC电解质的电阻应在0.1Ω/cm2以下,对于10mm厚的电解质层,要求电导率在0.01S/cm以上。从图中可以看出,为达到上述要求,其最低的操作温度为YSZ:~700℃,CGO:~550℃,LSGM:~550℃。铋的氧化物δ-Bi2O3具有很高氧离子导电性,在800℃时能达到1S/cm以上,然而其稳定区间仅为730℃以上到其熔点804℃,掺杂Y2O3或ZrO2等稀土氧化物能使其高温相稳定存在的区间向低温移动,然而Bi2O3在还原气氛中易被还原成金属而限制其应用[99]。
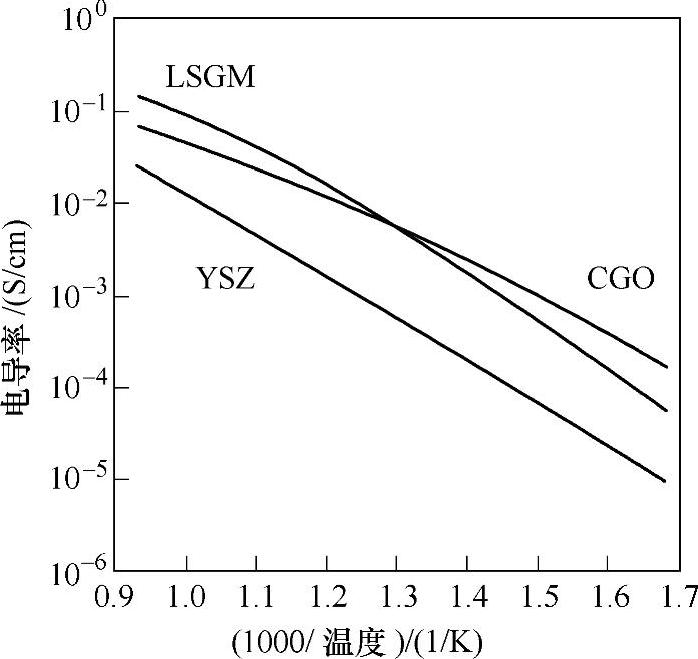
图13-33 YSZ、CGO和LSGM体系的电导率——温度曲线[99]
许多氧化物均存在固固相变,而通常高温相体现出较强的离子导电性,原因是通常高温相氧的亚晶格具有较强的活动性。为了降低SOFC的工作温度,需要使具有较强离子导电性的高温相在较低的温度下也能稳定存在,而掺杂是实现这一目的的有效手段。如图13-34a所示,在纯的氧化物体系中,可以观察到氧离子电导率随着温度的突变,表明在该温度下发生了相变。而掺杂之后突然消失,同时在较低温度下就能达到较高的离子导电性(见图13-34b),表明掺杂有助于稳定高温相。
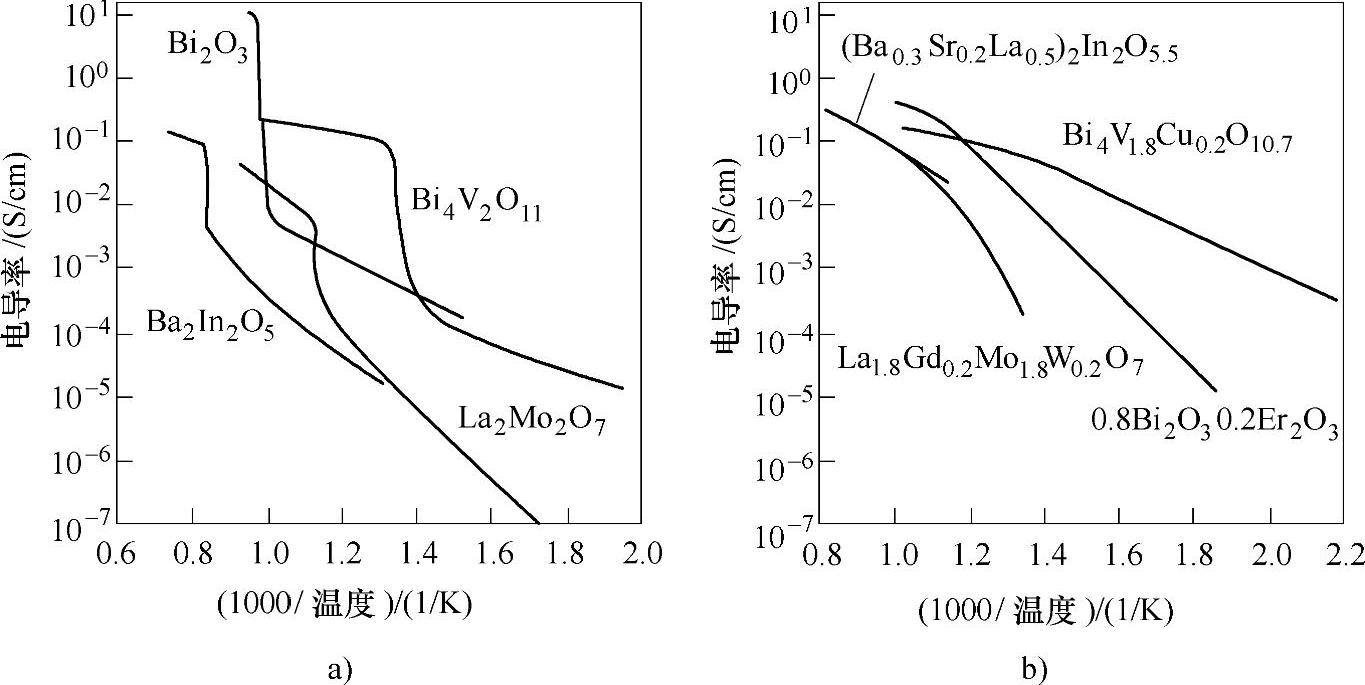
图13-34 一系列氧化物电解质的电导率——温度曲线[99]
具有氧离子导电性的氧化物体系是SOFC开发的关键领域之一,同时也是固体结构化学的研究热点。尽管具有氧离子导电性的氧化物体系很多,但从微观结构上可以分为四大类:第一类为萤石结构,如掺杂的氧化锆、氧化铈和氧化铋;第二类为钙钛矿结构,如掺杂的镓酸镧;第三类为多钼酸镧LaMOX结构;第四类为磷灰石结构。下面分别进行简单的介绍。
1.萤石结构的氧离子导体电解质材料
萤石结构的代表物质为CaF2,其结构如图13-35所示。该结构属于立方晶系,阴离子呈面心立方排列,阳离子占据其中的四面体空隙。这一结构很容易形成氧空穴,从而为O2-的传输提供了通道,是重要的SOFC电解质材料。
具有萤石结构的氧离子导体中最重要的是掺杂的ZrO2体系。ZrO2具有单斜、四方和立方3种晶体结构,具有较强氧离子导电性的是具有萤石结构的立方相,但只能在高温下稳定存在。通过适当的掺杂,可以是萤石结构在较低温度下稳定存在。研究的最广泛的是Y2O3稳定的ZrO2(YSZ)。图13-36为ZrO2-Y2O3体系的相图,对于纯的ZrO2,立方相仅在2370℃以上存在,随着Y2O3掺入量的增加,立方萤石结构稳定存在的最低温度大大降低。
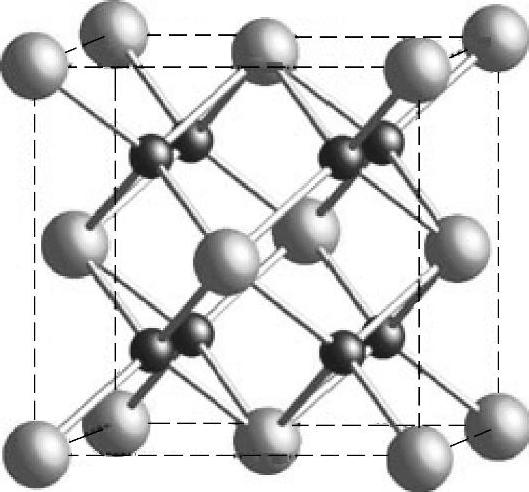
图13-35 萤石结构模型
研究表明,在1000℃当Y2O3的掺入量为8mol%时YSZ体系的氧离子导电性最强,其物相结构为立方和四方的混合物[71],如图13-37所示。当三价的Y替换四价的Zr时,会相应的生成氧空位以平衡电荷,因此Y2O3的掺杂还可以提高氧空穴的浓度,从而提高离子电导率。YSZ在高温下的稳定性以及机械强度均较好,但运行温度仍然偏高。目前的主要研究工作是通过调节YSZ电解质层的微观结构,降低其操作温度至700~800℃。
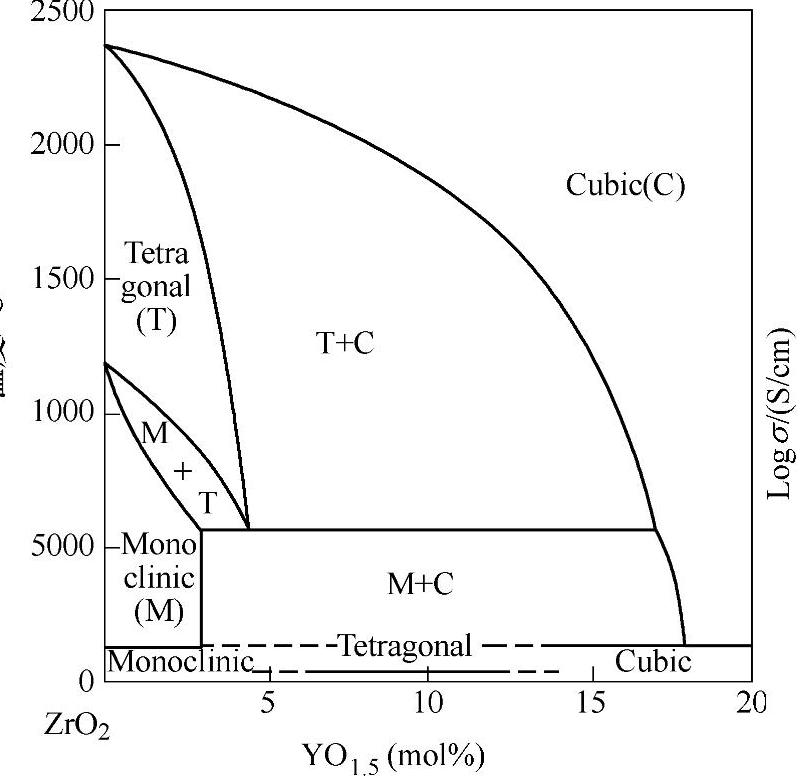
图13-36 ZrO2-Y2O3体系相图[100]
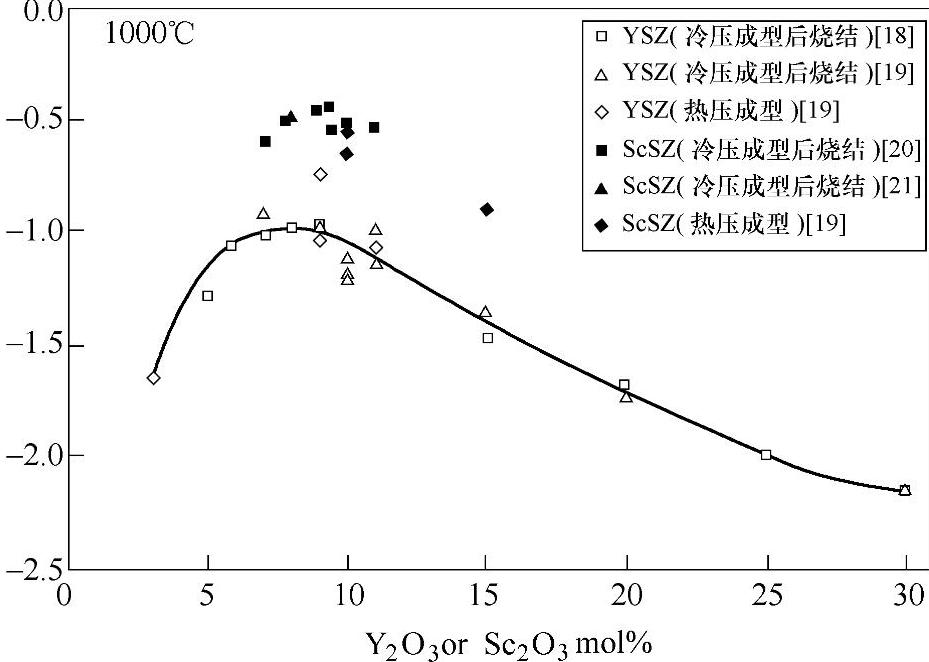
图13-37 YSZ体系O2-电导率随成分的变化[101]
ZrO2体系中另一种常见的掺杂元素为Sc,得到ScSZ复合氧化物,在室温下为正交结构,在600℃以上转化为具有较高离子导电性的萤石结构,Sc2O3掺杂量在10~12mol%时离子导电性最高。一般来说ZrO2-Ln2O3复合氧化物体系的离子导电性随着稀土离子Ln3+的半径的增大而降低,因此半径最小的Sc3+离子有利于离子导电性的提高,主要原因是Sc3+和Zr4+离子半径相近,因此缺陷的结合能较小,有利于氧空位的移动。此外还可以通过共掺杂的方式,向YSZ或ScSZ体系中进一步掺入Al、Nb等元素,以提高复合氧化物体系的离子电导率和机械强度[101]。
另一个具有萤石结构的氧离子导体氧化物体系是掺杂的CeO2,该体系在500~650℃下具有较高的离子导电性,同时与高性能的阴极材料如钴基钙钛矿类化合物相容性好,因此在新型低温SOFC中具有广阔的应用前景。与ZrO2体系一样,CeO2也具有萤石结构,也需要通过掺杂三价稀土离子来提高其离子导电性,并且效果最好的掺杂离子也具有和本体阳离子Ce4+相近的离子半径,常用的掺杂元素是Gd和Sm,形成CGO和CSO复合氧化物体系。在较低温度下(<700℃)CGO体系的离子导电性几乎比YSZ高一个数量级。这一体系的主要问题之一是在较低的氧气分压下不够稳定,Ce4+被还原成Ce3+,导致电子导电性提高,从而使电池性能下降[99,101]。(https://www.daowen.com)
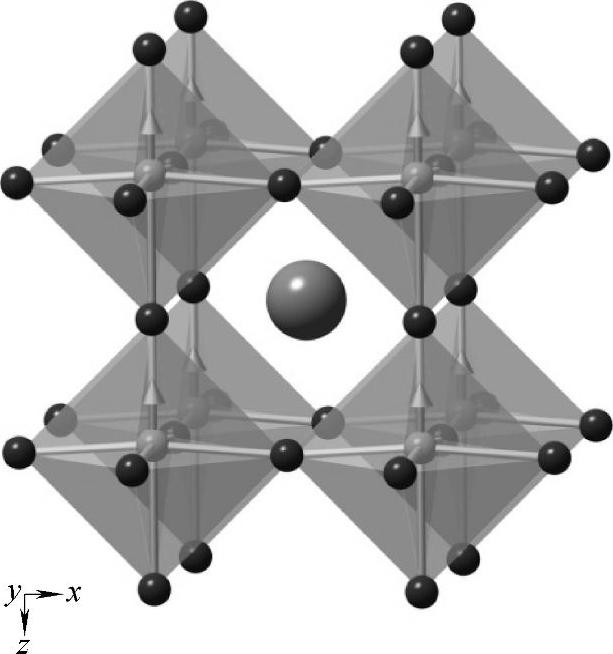
图13-38 钙钛矿结构模型
2.钙钛矿结构的电解质
钙钛矿结构具有ABO3的化学组成,其结构如图13-38所示,属于立方晶系,BO6八面体呈简单立方排布,通过共顶点方式构成三维网络,A离子位于简单立方的体心。这一结构类型的氧化物种类繁多,并且通过掺杂能衍生出丰富的结构和性能的变化,是固体结构化学研究的热点领域。
作为SOFC电解质的钙钛矿类化合物最重要的是Mg、Sr共掺杂的镓酸镧LaGaO3(LSGM),其中Sr取代La,Mg取代Ga,其通式为La1-xSrxGayMg1-yO3。这一体系首先由Ishihara[102]和Goodenough[103]的研究组独立发现。例如Goodenough等人发现La0.8Sr0.2Ga0.8Mg0.2O2.85在800℃下离子电导率可达0.17S/cm,其低温氧离子导电性与CGO相当,明显高于YSZ和ScSZ。但是LSGM中不含有易被还原的离子,因此在低氧分压的条件下比CGO稳定。LSGM的导电性与掺杂浓度密切相关,不同成分的LSGM的氧离子导电性及其温度依赖如图13-39所示。提高其离子导电性的有效方法之一是向其中掺入过渡金属元素,常见的有Fe、Co和Ni,但随着过渡金属的掺杂量的增大,对氧离子导电性的增强会逐渐减弱,同时会导致空穴导电作用的增强,从而导致漏电,因此需要在这两者之间寻找一个平衡点。钙钛矿结构对于因取代离子半径差异以及氧空位导致的晶格畸变有较强的承受能力,因此可以用作取代的元素种类很多,最常用的取代La的元素是Sr,但Gd、Ba取代也具有较好的氧离子导电性。LaAlO3由于其成本较低也受到关注,但是其离子电导率较低。
3.LAMOX类化合物电解质[99]
LAMOX是多钼酸镧,其化学式为LaMo2O9,与Bi2O3类似,在580℃左右发生单斜向立方相的转变,高温下的立方相具有较好的氧离子导电性,在800℃时电导率可以达到0.06S/cm。立方相的LAMOX结构如图13-40所示,每个Mo原子与7个氧原子相邻,可以分为3种类型,图中用O1、O2、O3标出,其中O2和O3两类氧原子的原子位移参数较大。通过用Gd、Y等元素取代La,可以使高温立方相在较低温度下稳定存在,而通过W对Mo的取代,可以提高氧离子导电性。LAMOX的主要问题是与电极材料NiO的兼容性。
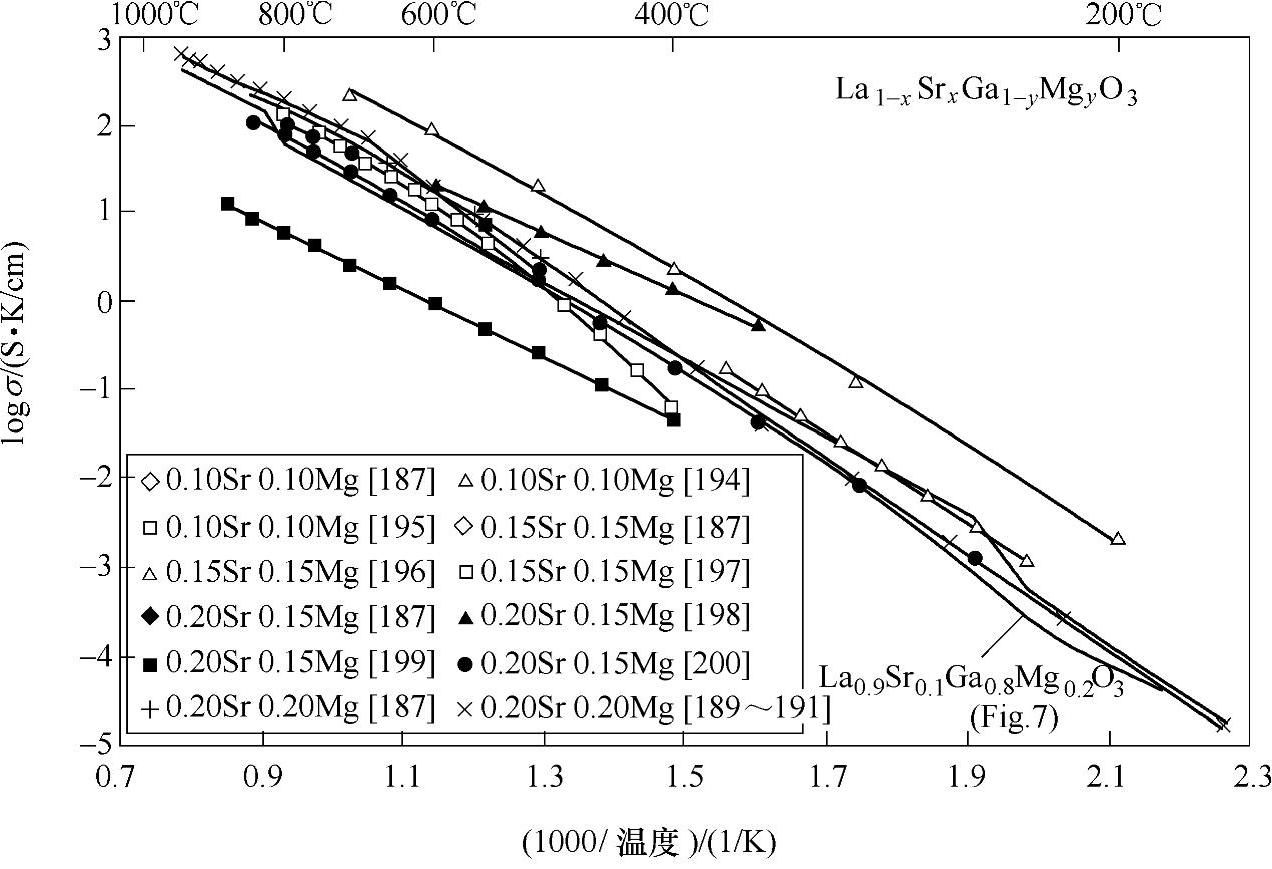
图13-39 LSGM体系的电导率——温度曲线[101]
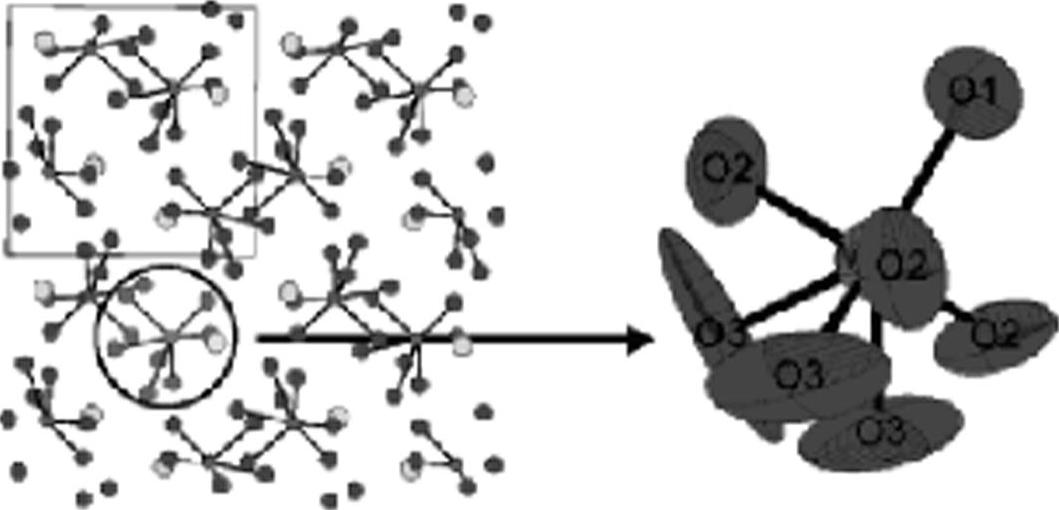
图13-40 LAMOX及其中的Mo原子配位结构[104]
图13-41 磷灰石结构模型[99]沿c轴方向投影图
4.稀土金属磷灰石电解质
稀土金属磷灰石具有通式RE10(XO4)6O2+y,其中RE为稀土元素,X为P、Si或Ge。其结构如图13-41所示,XO4四面体构成沿c(c为投影方向)轴方向的通道,较小的通道中为稀土原子列,较大的通道中为稀土和氧的原子列。该氧化物体系中离子导电性最好的是La的Si磷灰石。该结构对于掺杂也有较强的容忍程度,通常采用Sr对La的取代以提高氧离子导电性。通道中La离子的空位对于氧离子导电有重要作用,化学整比的体系,如La8Sr2(SiO4)6O2的电导率较低。与萤石和钙钛矿结构不同,在稀土磷灰石中,氧离子的传导是以间隙氧离子而非氧空位的形式进行的。该体系的问题在于煅烧成型的温度较高,通常需要1600℃以上。
电解质的离子电导率是限制SOFC工作温度的最重要因素,当前SOFC的开发致力于降低工作温度至500~750℃,即所谓的中温SOFC(IT-SOFC),一些主要的氧化物的离子电导率如图13-42所示。PEFC、PAFC和MCFC的电解质的电导率也列在其中进行对比。
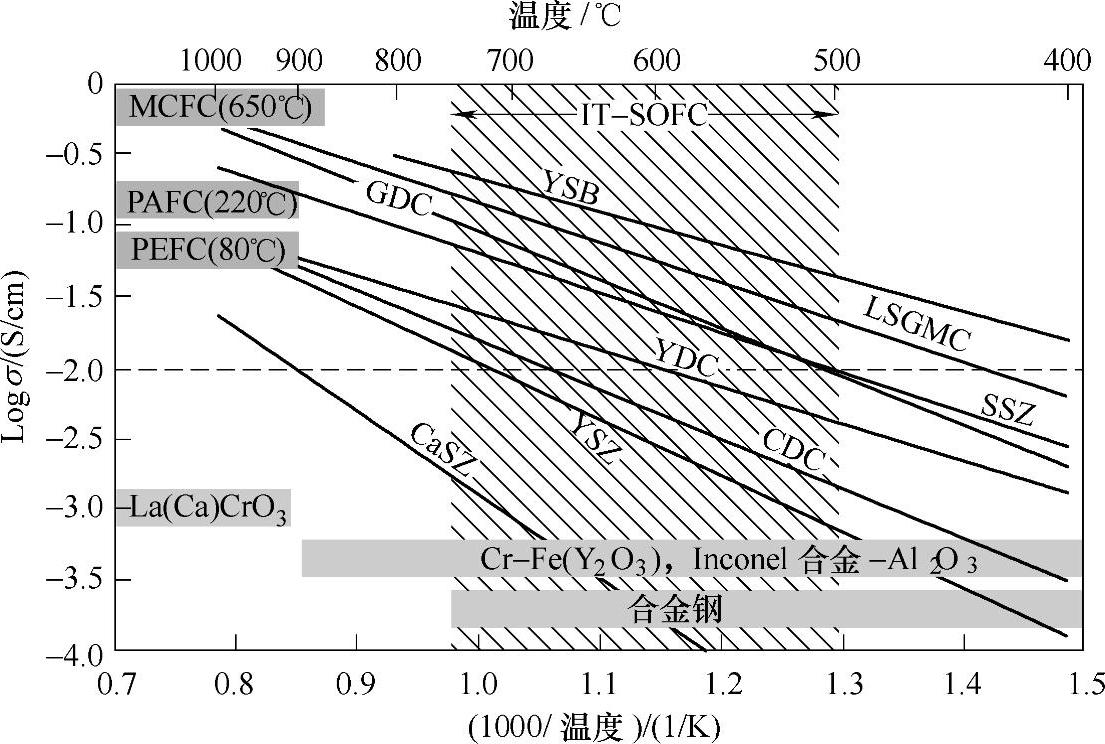
图13-42一些氧化物体系氧离子电导率随温度变化图[105]
注:PEFC、PAFC和MCFC中电解质的电导率也在图中标出作对比。YSB[(Bi2O3)0.75(Y2O3)0.25],LSGMC[LaxSr1-xGayMg1-y-zCozO3,x~0.8,y~0.8,z~0.085],GDC[Ce0.9Gd0.1O1.95],SSZ[(ZrO2)0.8(Sc2O3)0.2];YDC[Ce0.8Y0.2O1.96];CDC[Ce0.9Ca0.1O1.8],YSZ[(ZrO2)0.92(Y2O3)0.08];CaSZ[Zr0.85Ca0.15O1.85]。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。





