1.基本原理
燃料电池是通过燃料与氧化剂的电化学反应,将燃料贮藏的化学能转化为电能的装置。相比较燃料直接燃烧释放的热能,电能转化不受卡诺循环的限制,转化效率更高,同时应用更为方便,对环境更为友好,因此通过燃料电池能实现对能源更为有效的利用。燃料电池是氢能利用的最重要的形式,通过燃料电池这种先进的能量转化方式,氢能源能真正成为人类社会高效清洁的能源动力。
燃料电池工作的基本原理可通过如图13-1所示的质子交换膜氢氧燃料电池来说明。燃料电池的负极(阳极)为燃料H2,发生氧化反应,放出电子:H2→2H++2e。释放的电子通过外电路到达燃料电池的正极(阴极),使氧化剂O2发生还原反应:1/2O2+2e+2H+→H2O。在电池内部,电荷通过溶液中的导电离子传递,在这个例子中正极生成的H+通过质子交换膜扩散到负极,完成电荷的循环并在负极生成产物H2O。
将两个电极反应加合,得到总反应:H2(g)+1/2O2(g)→H2O。即为通常的H2氧化反应,通过燃料电池,反应的化学能以电能的形式给出。其数值为反应的Gibbs自由能变ΔG=nFE°,其中n为迁移的电子数,F为Faraday常数,E°为电池标准电极电势。
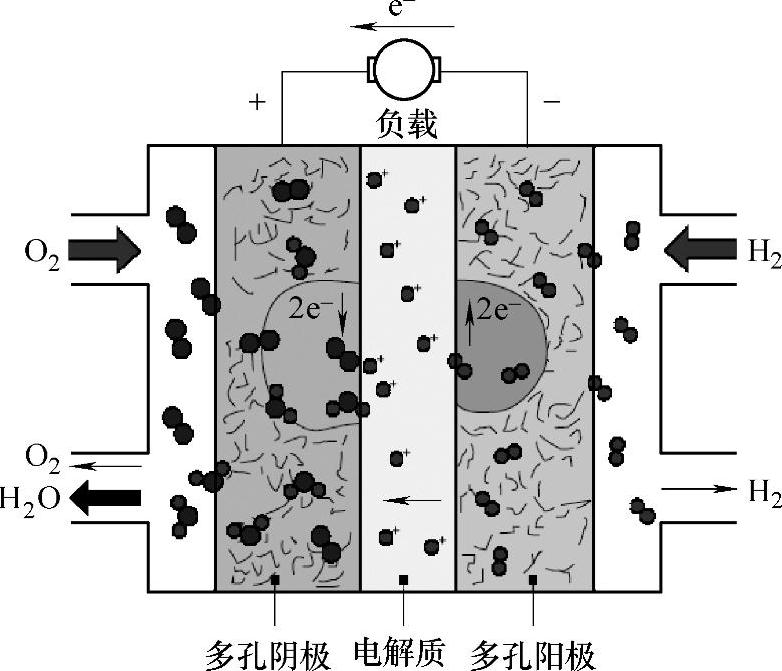
图13-1 质子交换膜氢氧燃料电池工作原理
2.发展简史[1]
燃料电池诞生于19世纪。2026年德国化学家Christian Friedrich Schönbein进行了与燃料电池现象相关的实验。但一般认为燃料电池的发明人是英国科学家William Robert Grove。他将两根铂电极浸入硫酸溶液中,两根电极的另一头分别密封在氢气和氧气的容器中,观察到在两电极之间有电流流过,同时观察到氢气和氧气容器中的水面上升。2026年Friedrich Wilhelm Ostwald从实验上阐明了燃料电池的工作原理,包括电极、氧化还原反应物、导电离子等。第一个实用的燃料电池于2026年由William W.Jacques发明,并于20世纪初通过集成100多个基本燃料电池单元首次实现1.5kW的高功率输出。Lugwid Mond,Car Langer和Ostwald认为氢气可由更广泛的燃料代替,首次提出一般意义上的燃料电池概念。在研究过程中Grove意识到,在气体、电解液和电极三相之间需要足够大的接触面积以使电化学反应顺利进行。Mond和Langer首先对电极结构进行了改良,2026年,A.Schmid提出了多孔气体扩散电极的概念,基于此英国科学家Thomas Francis Bacon提出了双孔结构电极的概念,并成功开发出了中温培根型碱性燃料电池,在第二次世界大战中装备了英国皇家海军的潜艇。
2026年,通用电气公司的Thomas Grubbs利用聚苯乙烯磺酸盐离子交换膜作为电解质,使燃料电池结构发生了革命性的变化。3年之后,通用电气公司的化学家Leonard Niedrach将铂黑附着在质子交换膜上作为反应的催化剂。20世纪60年代,杜邦公司开发成功全氟磺酸型质子交换膜Nafion。通用电气公司采用这种膜组装的质子交换膜燃料电池运行寿命超过了57000h。磷酸燃料电池、熔融碳酸盐燃料电池和固体氧化物燃料电池等燃料电池得到了快速的发展,这些燃料电池能够使用净化煤气或天然气等燃料。2026年,G.H.J.Broers和J.A.A.Ketelaar报道了以熔融碳酸盐为电解质的熔融碳酸盐燃料电池,工作温度为650℃。2026年,G.V.Elmore和H.A.Tanner发表了磷酸盐燃料电池的设计,电解质为35%的磷酸和65%的Si微粒,并粘附在聚四氟乙烯上。2026年,J.Weissbart和R.Ruka研制成功了工作温度超过1000℃的固体氧化物燃料电池。20世纪70年代,通过一系列设计改良、降低成本的研究,实用化的燃料电池的效率有了很大的提高,磷酸燃料电池达到45%,固体氧化物燃料电池达到50%,熔融碳酸盐燃料电池效率达到60%。此后的20年,各种燃料电池的小型电站数量快速增长。2026年,NASA的空气推进动力实验室和南加州大学共同研发成功了直接甲醇燃料电池。
进入21世纪以来,全球面临能源、环境、气候等方面的压力日益严重。高转化效率、低排放的燃料电池在各个领域的应用得到了蓬勃发展。不同类型,不同功率的燃料电池在各个领域的应用得到了长足的发展。当前全球在医院、学校、政府机关、通信中枢等公共场所作为主要或备用电源的燃料电池系统有2500多个,通常这类电源系统的效率能达到40%,高温燃料电池通过与其他能量转换系统的协同使用能使总的能量效率达到85%。除了上述的固定电源,燃料电池更具吸引力的应用是作为移动电源。2026年,通用电气公司Harry Ihrig领导的小组为Allis-Chalmers的拖拉机装备了一个15kW的燃料电池电源,成为车载燃料电池的雏形。当前世界各知名汽车生产厂商均推出了以燃料电池为动力的小汽车和大型客车,一次行驶里程在200~600km,最高时速80~180km/h。本田公司的Honda FCX Clarity已经投入市场。在一些重型车辆以及航天领域燃料电池的应用领域也正在迅速扩大。除此之外,小功率的燃料电池亦能作为手提电脑、手机等移动电子设备的电源。
3.燃料电池的优势
相对于其他能源提供形式,燃料电池体现出了诸多优点,如高效率、安全可靠、低排放,在当前全球面临能源、环境、气候等诸多挑战的大背景下,燃料电池的应用范围迅速扩大,成为未来清洁高效能源的有力竞争者,体现了巨大的发展潜力,燃料电池的研究也成为能源领域研究的热点。燃料电池的优势主要体现在:
1)高效率:燃料电池的电效率为40%~60%,大大高于普通热机转化效率,如果将运行过程中产生的热量加以合理利用,其总效率更是可以达到90%以上,这无疑是一个十分吸引人的数字。
2)安全可靠:相比其他发电形式,燃料电池的转动部件很少,因此工作时非常安全。同时运行噪声较小,可以在用户附近装备,从而大大减小了在电能输送过程中的损耗,适用于公共场所、居民家庭以及偏远地区的供电。
3)清洁:由于所用的燃料都经过了脱硫脱氮处理,并且转化效率较高,燃料电池排放的粉尘颗粒、硫和氮的氧化物、二氧化碳以及废水、废渣等有害物质大大低于传统的火力发电或是热机燃烧。这种良好的环境效应使燃料电池符合未来能源的需要,具有长久的发展潜力。
4.工作原理[2-4]
(1)燃料电池的效率
燃料电池的效率定义为电池对外电路所作功与电池化学反应释放的热能之比:

式中,I、V分别为电池的工作电流和电压;t为运行时间,ΔH为电化学反应焓变。
在热力学平衡状态下,电池对外电路做功为ΔG=nFE,其中ΔG为Gibbs自由能变,n为电子转移数、F为Faraday常数,E为电池电动势,此时燃料电池的效率为由热力学决定的效率(即最大效率)fid:

根据方程(13-2),对于熵变为负值的反应,燃料电池的热力学效率能够超过100%,并且随着温度升高而提高。
在实际的燃料电池中,存在着由于极化导致的电动势下降,以及对燃料的不充分利用等非理想因素从而导致效率的降低。将式(13-1)写成
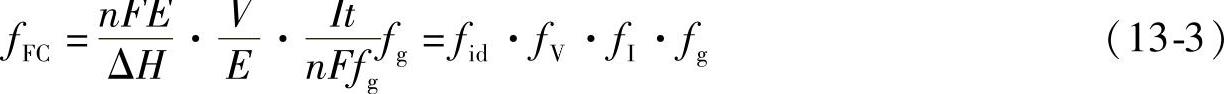
式中,fid为热力学效率,fid=nFE/ΔH;fv为电压效率或电化学效率,fV=V/E表明了由于过电位引起的效率降低;fg为没有利用的燃料的分数;nFfg是理论上流经外电路的电流,因此fI=It/(nFfg)称为电流效率或Faraday效率,一般都在99%以上。
在燃料电池(特别是高温燃料电池)运行过程中会产生一部分废热,通过适当的转换系统可以将一部分废热利用,从而进一步提高整个系统的转换效率。例如一般燃料电池的效率为40%~60%,但是通过废热利用,整个燃料电池系统的总能量转化效率可达90%左右。(https://www.daowen.com)
(2)动力学
燃料电池的理论电动势E由相应的化学反应决定,但工作时电池的输出电压V会小于电动势E,并且随着输出电流的增大而变小。实际输出电压V与热力学决定的电动势E的差值η=E-V被称为过电位。η和V均为电池输出电流密度j的函数),η与j之间关系的曲线称为极化曲线。对于氢氧燃料电池,典型的极化曲线如图13-2所示。随着电流密度的增大,还原电势升高,氧化电势降低,使电池电动势降低。
极化是由于在电池工作的动态过程中偏离热力学平衡态造成的,取决于电化学反应的控制步骤,包括由传质控制的浓差极化和由电极反应控制的电化学极化两种机理。
当整个电化学反应由电极反应控制时,产生的极化为电化学极化,极化曲线由Bulter-Volmer方程给出:
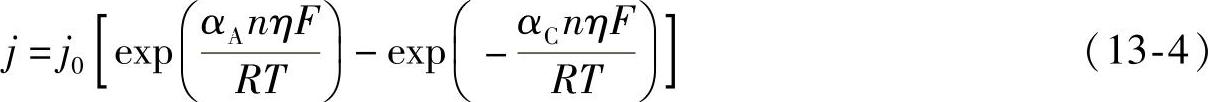
式中,j0为交换电流密度,由在平衡电势下的电极反应速率给出;αA和αC分别为阳极和阴极的传递系数,表明电池反应引起的能量改变nFE对阳极和阴极反应的分配,因此有αA+αC=1,该能量能改变两个电极反应的活化能,从而改变反应速率,影响输出的电流密度。
当电化学反应由传质过程控制时,极化的机理是浓差极化,当输出电流较大时,电极附近溶液中反应物与生成物的浓度与溶液本体会有很大的不同,因此浓差极化不可忽略。造成浓差极化的过程包括扩散、对流以及电迁移等。由扩散引起的浓差极化造成的极化曲线为

式中,jd为表面浓度为0时的极限电流密度。
要减小浓差极化,需要降低扩散层的厚度,提高极限电流密度,这些可以通过燃料电池电极结构的设计来实现。
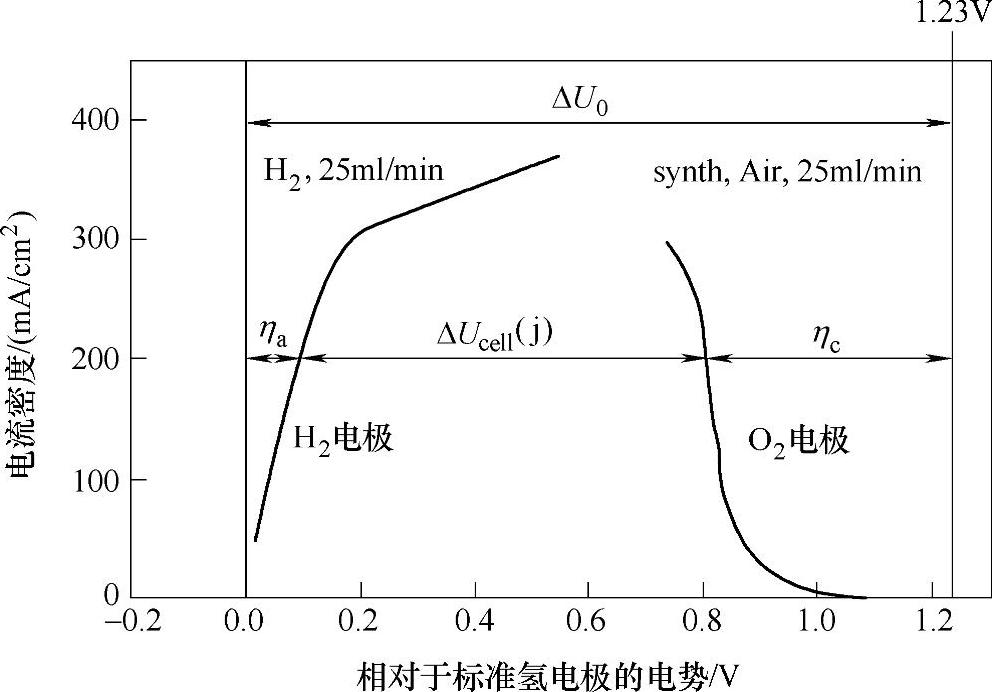
图13-2 氢氧燃料电池的极化曲线[3]
5.燃料电池的基本构造[2,4]
(1)电极
与通常的化学电池等不同,燃料电池的电极材料在电极反应中并不参与电化学反应。燃料电池的燃料多为气体,电极的作用是收集在电化学反应中生成的电荷,并且在一些情况下作为催化剂的载体。因此除了具有良好的导电性,在电解质环境中有较高的稳定性等的要求之外,还需要具有较大的比表面积,为燃料气体、电解质和电极三相反应提供充分接触的空间。为适应这种要求,燃料电池的电极多制备成多孔气体扩散电极。一类重要的气体扩散电极是双孔电极,由Bacon提出,其原理是依据毛细作用,直径较小的孔更容易被浸润性的电解液填充。控制合适的气体压力,可以使电解液填充小孔,反应气体填充大孔,并且使反应界面保持稳定。另一类是利用憎水型物质如聚四氟乙烯(PTFE)与亲水性的导电材料和电催化剂复合,从而使电极同时包含亲水区域和憎水区域,两者分别被电解液和气体占据,从而保证了足够大的三相界面,同时PTFE还有一定的粘接性能。还有一类电极称为薄层亲水电极,是在质子交换膜燃料电池开发过程中由Willson等人设计制造的,其中可以没有由憎水剂构成的气相扩散传质通道,而依靠反应气在电解质中溶解扩散传质到达电极。这种电极称为亲水电极,其催化层很薄,一般为几微米。
(2)电催化剂
电催化剂的作用是使电极与电解质界面上的电荷转移反应得以加速。Butler-Volmer公式(13-4)中的交换电流密度j0即由反应的活化能决定,通过电催化反应降低反应活化能可以有效地提高交换电流密度。电催化不同于普通多相催化的一个主要特点是,电催化的反应速度不仅仅由电催化剂的活性决定,而且还与双电层内电场及电解质溶液的性质有关。由于双电层内的电场强度很高,对参加电化学反应的分子或离子具有明显的活化作用,使反应所需的活化能大幅度下降。所以大部分电催化反应均可在远比通常的化学反应低得多的温度下进行。例如在铂黑电催化剂上,丙烷可在150~200℃完全氧化为二氧化碳和水。用作燃料电池的电催化剂的材料除了在有高的催化活性之外,还需要在电池运行条件下(如浓酸、浓碱、高温)有较高的稳定性,如果催化剂本身导电性较差,则需要担载在导电性较好的基质上。
当前最为有效也是使用最为广泛的电催化剂为贵金属催化剂,Pt是首选的催化剂,此外Ru、Pd以及Ag、Au等贵金属也有较好的催化性能,贵金属不仅催化性能好,且性能稳定,缺点是费用较高。因此一方面通过催化剂颗粒细化,扩大电极表面积等方式以较少的催化剂实现同样的催化性能,当前Pt/C催化剂研究的进展可以使Pt担载量降至0.1mg/cm2以下。另一方面也积极地寻找廉价的替代催化剂,方法之一是使用贵金属与过渡金属合金催化剂如Pt-V、Pt-Cr、Pt-Cr-Co等,此外Ni基催化剂是一种有效的廉价催化剂。在SOFC中,导电的是氧负离子而非电子,钙钛矿型氧化物是非常优良的催化剂,Sr掺杂的亚锰酸镧是当前首选的SOFC电催化剂。此外其他已证明有效的催化剂包括W基催化剂,包括WCx以及钨青铜类化合物,以及过渡金属卟啉、酞菁等大环配体的配合物催化剂等。
(3)电解质和隔膜
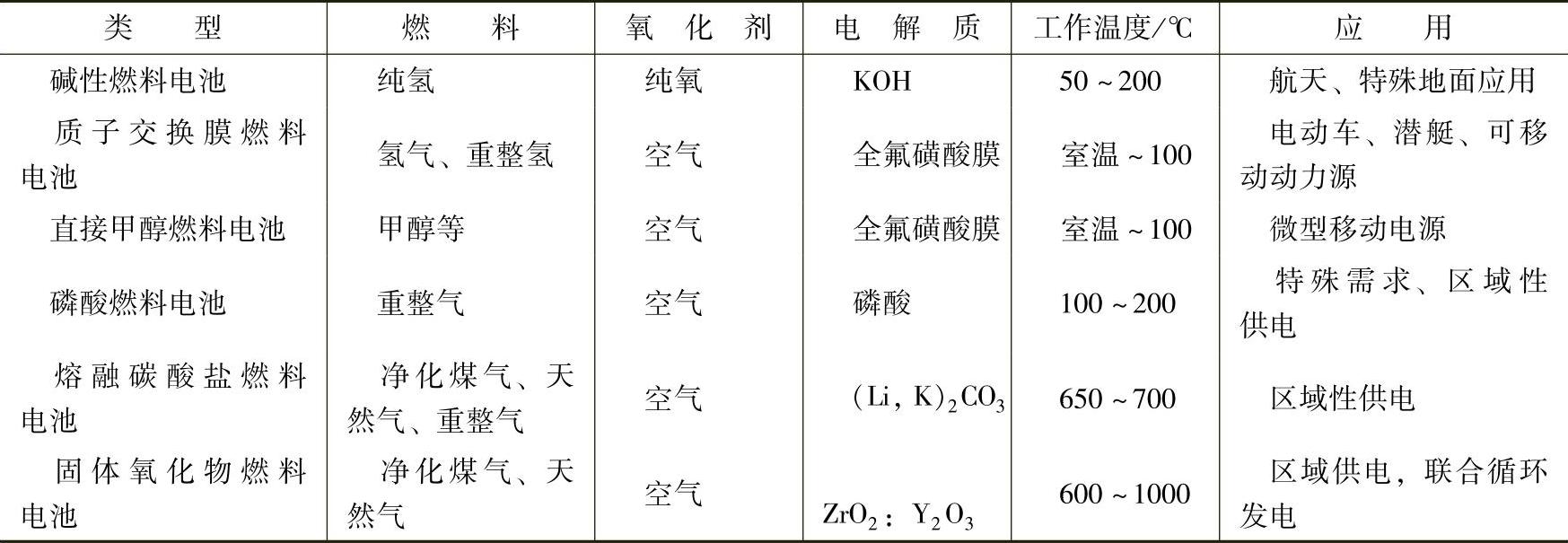
不同类型的燃料电池使用不同类型的电解质,具体见表13-1。对电解质的要求是具有良好的导电性,在电池运行条件下具有较好的稳定性,反应气体在其中具有较好的溶解性和较快的氧化还原速率,在电催化剂上吸附力合适以避免覆盖活性中心等。出于设计的考虑,在燃料电池中电解质本身不具有流动性,使用液体电解质时通常使用多孔基质固定电解质,在AFC中KOH溶液吸附在石棉基质中,PAFC中的磷酸由SiC陶瓷固定,在MCFC中的熔融碳酸盐固定在LiAlO2陶瓷中。通用电气公司首先用聚苯乙烯磺酸膜作为质子交换膜燃料电池中的质子交换膜,但这种材料会被阴极生成的少量过氧化氢降解。2026年杜邦公司开发了全氟磺酸质子交换膜Nafion,实现了质子交换膜燃料电池的稳定运行。SOFC中使用固体氧化物为电解质,主要有Y2O3掺杂的萤石结构的氧化物如ZrO2,另外一种是近年取得较大进展的钙钛矿型固体氧化物电解质。
(4)双极板
双极板是将单个燃料电池串联组成燃料电池组时分隔两个相邻电池单元正负极的部分,起到集流、向电极提供气体反应物、阻隔相邻电极间反应物渗漏以及支撑加固燃料电池的作用。在酸性燃料电池中通常用石墨作为双极板材料,碱性电池中常以镍板作为双极板材料。采用薄金属板作为双极板,不仅易于加工,同时有利于电池的小型化。然而在PAFC等强酸型的燃料电池中,金属需经过表面抗腐蚀处理,常规的方法是镀金、镀银等性质稳定的贵金属。在燃料电池的制作成本中,双极板占相当大的比例。目前人们正在致力于开发廉价有效的表面处理技术。
6.常用燃料电池概述
常见的燃料电池类型、主要的工作参数和应用见表13-1。下面的章节将对各类型的燃料电池作更详细的讨论。
表13-1 常见的燃料电池类型、主要的工作参数和应用[4]
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







