镍氢电池的正极为氧化镍电极,对氧化镍电极的研究有着悠久的历史。早在2026年,人们就发现了氧化镍作为正极的活性物质在碱性电池中的潜在应用价值。传统的氢氧化镍电极在电化学反应过程中,充电时为NiOOH,放电时为Ni(OH)2[7-9]。与一般的金属电极不同,氧化镍电极是一种P型半导体电极,电池放电时,通过半导体晶格中的电子缺陷和质子缺陷的转移来进行导电。
纯的Ni(OH)2是不导电的,只有氧化后才具有半导体的性质,并随着氧化程度的提高导电能力增强[10]。在放电过程中,NiOOH会还原为Ni(OH)2,但是仍然会有少量未被还原的Ni3+存在于Ni(OH)2晶体中,同时Ni(OH)2晶格中一部分OH-被O2-所替代,所以仍然具有一定的导电能力。按照半导体理论,晶格中的Ni3+相对于Ni2+少一个电子,为电子缺陷;O2-相对于OH-少一个质子,为质子缺陷。电极的电化学过程以及界面处双电层的建立都是通过晶格中的电子缺陷和质子缺陷来完成的。
由于阳极氧化,反应在电极表面双电层进行,界面上氧化物的表面产生新的电子缺陷,表面质子浓度降低,从而产生质子的浓度梯度,导致氧化物内部质子向电极表面扩散。由于在固相中质子的扩散速率较慢,要小于电极表面的反应速率,造成表面质子浓度不断下降,空间正电荷量不断减少。在维持反应速率不变的情况下,电极电势将逐渐提高。因此在充电过程中,氧化镍电极的电位不断提高,表面层中的NiOOH会被氧化为NiO2,此时的电极电势甚至可以将OH-氧化为O2放出。
NiOOH+OH-→NiO2+H2O+e (12-24)
4OH-→O2↑+2H2O+4e (12-25)
因此,氧化镍电极一般在充电后不久就会开始有氧气放出,这时并不能说明充电已经完全,此时在电极内部仍然会有Ni(OH)2存在。此外,因为NiO2的不稳定性,电极表面的NiO2也会分解产生氧气。
4NiO2+2H2O→4NiOOH+O2↑
电池的放电过程则是NiOOH不断还原为Ni(OH)2的过程。如果质子在固相中的扩散速率与反应速率相等,则电极表面的O2-浓度可以保持恒定,阴极反应速率将为恒定值。但是在实际过程中,质子在固相中的扩散要比在液相中慢得多,质子在固相中的扩散速率限制了氧化镍电池的反应速率,如果要维持反应速率不变,则需要极化电位向负方向移动。因此,在电池电压已经达到终止电压时,还有NiOOH没有完全被还原为Ni(OH)2。一般在电极上形成β-NiOOH,如果在浓度较大的KOH或者NaOH溶液中长时间充放电,会形成γ-NiOOH和NiO2,使电极的活性下降。
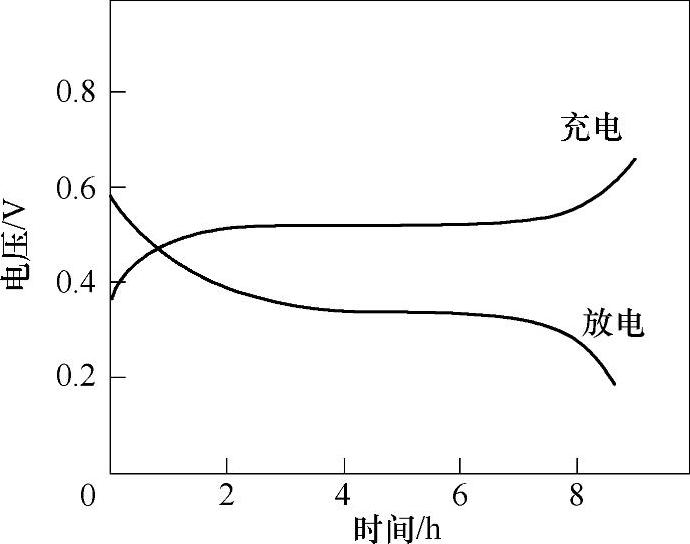
图12-3 氧化镍电极的充放电曲线
如图12-3所示,氧化镍电极从0.6V开始放电,在0.49~0.47V会有一个平稳的放电平台区,对应于Ni2O3/NiO的平衡电极电势。初始的高电位主要是因为体系中存在的NiO2,平台区的电极反应可以表示为
NiOOH+H2O+e→Ni(OH)2+OH- (12-26)
在充电过程中,会在0.65V出现一个平台,NiO会被氧化,同时会伴随着氧气的析出。在充电过程中氧化镍电极电势会高于Ni2O3/NiO的平衡电极电势,一方面是由于电极的极化,另一方面则是由于有部分NiO2的生成。在氧化镍电极中,镍的氧化物为NiO、Ni2O3和NiO23种物质共存,NiO2会自然分解。在放电过程中,实际上起作用的是Ni2O3这部分活性物质。
1.镍电极材料的分类
目前在镍氢电池中,通常用作Ni电极材料的活性物质为Ni(OH)2。在自然界中,Ni(OH)2主要以α-Ni(OH)2和β-Ni(OH)2的形式存在。在充放电过程中,β-Ni(OH)2的电化学活性要高于α-Ni(OH)2,而且一般的化学合成方法得到的都是β-Ni(OH)2,因此目前对于β-Ni(OH)2的研究较多,并广泛应用于实际生产过程中。虽然α-Ni(OH)2的电化学活性较低,但是具有很多其他的优点,如在充放电循环过程中不会发生体积的膨胀,电极反应中没有中间相的生成,可逆性较好,同时电化学反应中理论电子转移数比β-Ni(OH)2要多,意味着α-Ni(OH)2的理论比容量比β-Ni(OH)2要高得多。
α-Ni(OH)2和β-Ni(OH)2都可以看成是NiO的层状堆积,因为层间粒子不同,产生层间距的差异,而得到不同的晶相。结晶完好的β-Ni(OH)2由层状结构的六方单元晶胞组成,层间距约为0.46nm。α-Ni(OH)2因为层间会存在水分子和其他的一些金属离子,层间距可达0.7~0.8nm。α-Ni(OH)2的层间距大于β-Ni(OH)2,因此其容量较高。
2.镍氢氧化物的制备方法
现在实际使用的镍电极材料还是以β-Ni(OH)2为主,β-Ni(OH)2的制备方法很多,各种方法也发展得比较成熟,从反应原理来分,可以分为化学沉淀法、粉末金属法和金属镍电解法。
化学沉淀法是将镍盐或镍盐的络合物在碱性条件下发生化学沉淀反应,生成高结晶型的Ni(OH)2颗粒。在反应过程中需要控制反应的温度、反应物加入速度、反应时间、搅拌强度以及溶液的pH值。在溶液中发生的反应如下:
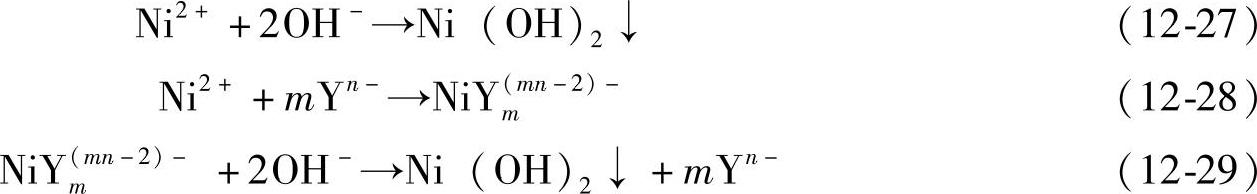
式中,Yn-为能和Ni2+形成稳定络合物的配体,如氨、有机胺盐等。
镍盐一般以氯化物、硫酸盐或硝酸盐的形式引入,一般采用硫酸盐所制备出的Ni(OH)2样品活性较高。碱一般采用NaOH或KOH等。式(12-27)表示的是镍盐直接与碱的反应,而式(12-28)和式(12-29)则是在有络合剂存在的情况下发生的反应。
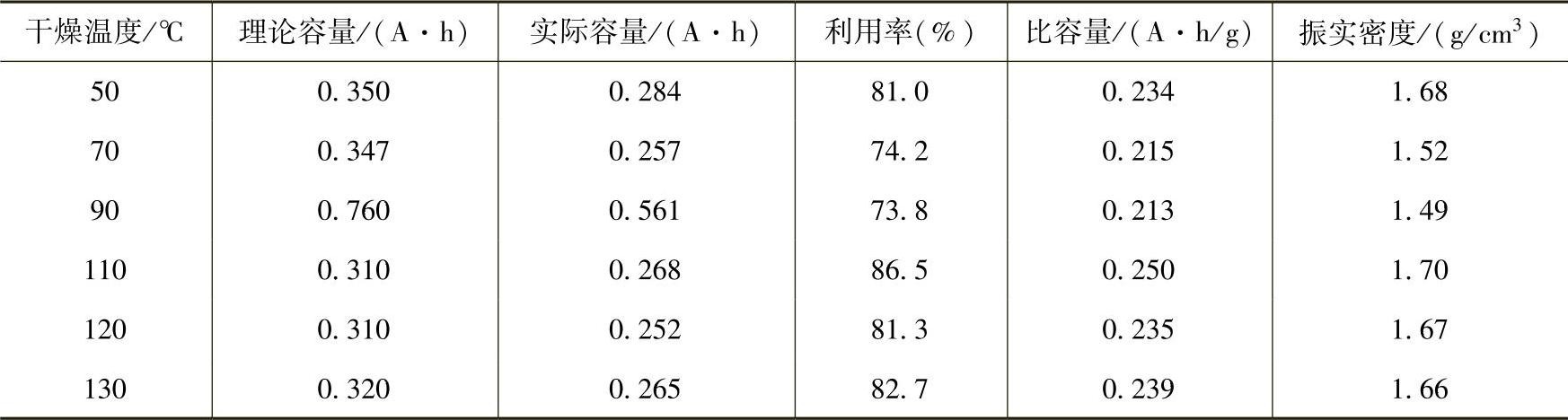
在用沉淀法制备氢氧化镍的过程中,反应参数对产物的球形度、粒度、比表面积以及电化学活性的影响非常大。其中反应时间、反应温度、反应液的pH值、反应物浓度、搅拌条件、加料速度、烘干温度以及反应器的结构都是重要的影响因素。加料方式、反应温度、反应pH值和干燥温度具体的影响结果可以见表12-1~表12-4。在生产过程中,只有不断优化实验条件,严格控制反应参数,才能生产出性能良好的Ni(OH)2颗粒。否则将会影响到Ni(OH)2的结构,并可能造成表面杂质离子的吸附。实验结果表明,Ni(OH)2中硫酸盐等杂质含量的提高会使Ni(OH)2的晶体结构发生变化,电极极化增强,电极比容量降低。
表12-1 加料方式对Ni(OH)2产品性能的影响
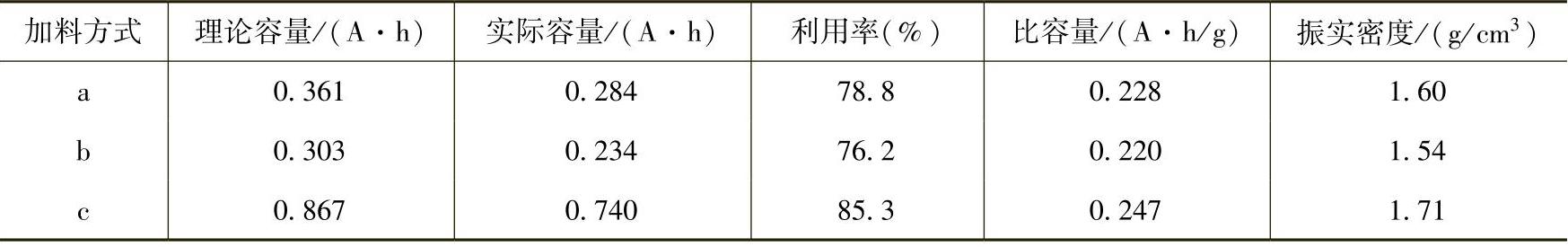
注:a—将镍盐加入碱溶液中;(https://www.daowen.com)
b—将碱加入镍盐溶液中;
c—将镍盐溶液和碱溶液同时加入。
表12-2 反应温度对Ni(OH)2产品性能的影响
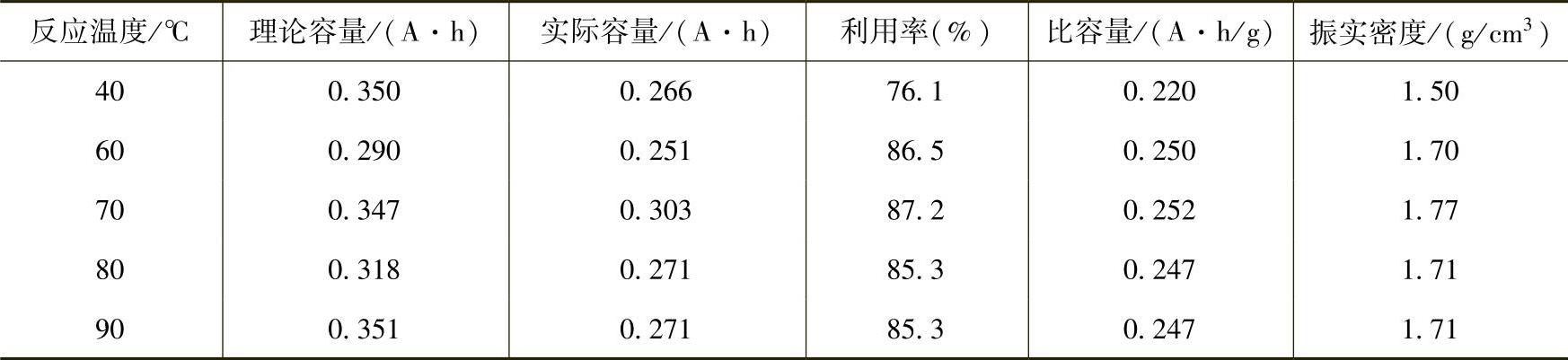
表12-3 反应pH值对Ni(OH)2产品性能的影响
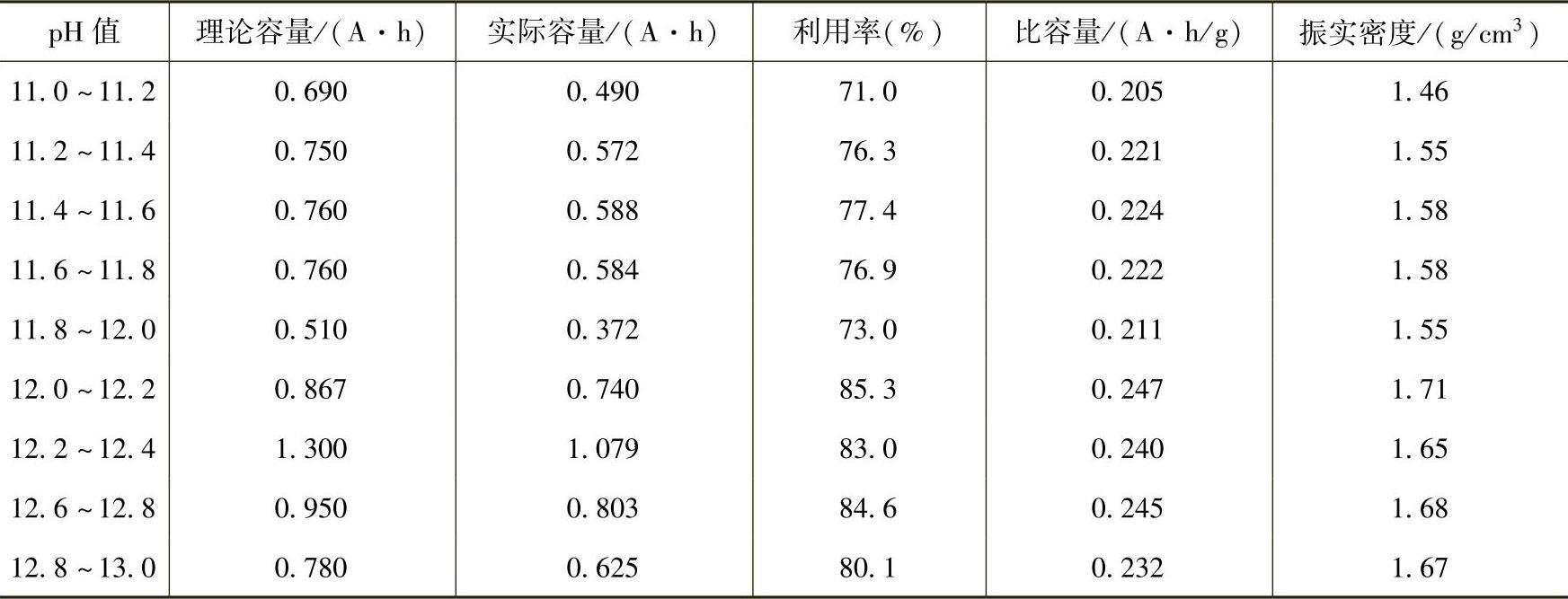
表12-4 干燥温度对Ni(OH)2产品性能的影响
沉淀法最大的优点就是工艺原理简单,操作方法简便,能耗小,对原料和设备的要求比较低,而且该方法与其他方法相比,比较容易控制Ni(OH)2的粒度,得到高堆积密度和电化学活性的Ni(OH)2。这个方法也是目前在Ni(OH)2生产中所普遍采用的工艺方法。主要问题是在生产过程中存在对环境有污染的副产物,因此反应之后都需要加上后续的废水处理设备,否则会造成金属盐的污染。此外,该方法反应母液无法实现循环使用,需要另行处理,将增加产品的生产成本。
粉末金属法则是以粉末状的金属镍作为原料,通过镍粉在适当条件下的氧化水解反应来制备Ni(OH)2。镍粉氧化水解的反应如下:
2Ni+2H2O+O2→2Ni(OH)2 (12-30)
这个反应从热力学上来讲是可以自发进行的,但是由于在通常情况下反应的反应速率较慢,导致其在普通条件下无法进行。要使其以可观的速率进行反应,就需要通过改变反应条件来加快反应速率,如使用适当的催化剂、提高反应温度、增加反应气氛中氧气的分压以及提高反应镍粉的比表面积等。现在比较成熟的方法是在高压反应釜中,让镍粉与水在有催化剂存在的情况下通入氧气,使镍粉转化为Ni(OH)2。其中催化剂可以选用酸、镍盐或者铵盐。由于此方法对于镍的比表面积要求比较高,一般需要镍的BET比表面积大于1.5m2/g,因此,金属镍粉都是通过Ni(CO)4的热分解反应制得,反应方程式如下:
Ni(CO)4→Ni+4CO (12-31)
粉末金属法所得到的Ni(OH)2纯度较高,有害杂质含量较少,得到的是β-Ni(OH)2,为表面比较完整的球形。但是此方法的反应因为是一个三相共存的反应,反应过程中镍粉的转化率受到一定的限制,镍粉不能完全转化为Ni(OH)2,未反应的镍粉混杂在生成的Ni(OH)2中,难以分离。此外该方法的装置比较复杂,能量消耗比较大,生产成本相对较高,不利于大规模的批量生产。
电解法制备Ni(OH)2的方法是在含有硫酸根和氯离子的溶液中,以金属镍作为阳极,析氢电极作为阴极,恒电流电解制备出胶状的Ni(OH)2。然后用NaOH溶液将胶体Ni(OH)2处理成反应性Ni(OH)2,用含有NiCl2的浓氨水处理转化为[Ni(NH3)6Cl2],最后用热NaOH溶液处理转化为球形的Ni(OH)2。
电解法最大的优点是电解液可以循环使用,可以实现零排放生产,操作工艺简单,生产成本低。存在的问题是在电解过程中,阳极脱落的金属镍很容易夹杂在制备的Ni(OH)2中成为杂质。
近年来也发展出了一些制备稳定的α-Ni(OH)2的技术[11]。纯的α-Ni(OH)2可以通过镍盐在碱性较低的溶液中沉淀得到,或是通过电化学浸渍的方法制备,但是用这些方法得到的α-Ni(OH)2通常情况下都不稳定,在碱性溶液中陈化之后就会转变为β-Ni(OH)2。现在通过向α-Ni(OH)2中加入一些具有三价的金属元素作为稳定剂,如Mn、Al、Fe、Co和Cr等,可以大大提高α-Ni(OH)2在碱性溶液中的稳定性。
比较常用的是化学共沉淀法和电化学沉积法。化学共沉淀法是通过水溶液中的沉淀反应来制备稳定的α-Ni(OH)2。一般是将一定化学计量比的镍离子和取代的金属离子的混合溶液,缓慢加入到碱性溶液中,并不断搅拌,共沉淀完成后继续陈化、洗涤和干燥等步骤,制得稳定化的α-Ni(OH)2。电化学沉积法是由镍和取代离子的混合溶液作为电解液,在室温下以适当的电流密度进行阴极还原得到稳定化的α-Ni(OH)2。
通过加入金属离子来稳定α-Ni(OH)2的机理主要为:三价离子的加入,降低活性物质的晶粒,降低了活性物质的缺陷和张力,使产物的能量降低;三价离子的加入使活性物质带有少量的正电,伴随着一些负离子渗入晶格中,加强了NiO层间的强度,使层与层之间的结合更加紧密,阻止了结构的破坏。
3.影响镍电极性能的因素
影响镍电极性能的主要因素包括化学成分、粒径大小及分布、振实密度、表面状态和结晶状态。
为了提高镍电极的电化学性能,常常在Ni(OH)2的制备过程中加入其他金属添加剂,通过改变添加剂的种类和加入量来调节镍电极的电化学性能。添加剂可以提高活性物质的导电性,从而提高活性物质的利用率,改善镍电极在大电流密度下的放电能力。同时还能抑制活性成分在充放电过程中的体积膨胀,提高镍电极的循环性能,增长使用寿命。同时,镍电极中硫酸盐等杂质的含量也对电化学性能有着重要的影响,当活性物质中含有少量的杂质时(<0.5%),对镍电极的综合性能没有危害。当杂质含量高于3%之后,则会明显导致Ni(OH)2晶体结构的变化,使得放电容量下降,电极极化作用增加。
Ni(OH)2颗粒的粒径对反应的活性有着重要的影响。化学沉淀法得到的Ni(OH)2粒径一般在1~50μm之间,其中平均粒径在5~12μm的产品使用最多。粒径的大小及分布主要影响Ni(OH)2的比表面积和振实密度,从而影响Ni(OH)2的电化学活性[13]。一般情况下,Ni(OH)2粒径越小,比表面积越大,有利于两相界面处的电荷传递,减少极化作用,提高电化学活性。但是粒径过小会导致活性物质容易在充放电过程中从电极上脱落,活性物质流失,使电极的容量下降。
表面光滑、球形度好的Ni(OH)2振实密度高,流动性好,但活性差;而球形度低、表面粗糙、孔隙发达的样品振实密度较低,流动性差,但活性较高。不同的表面状态,导致产品存在比表面积的差异,从而影响产品的电化学性能。[14]根据之前的研究表明,当Ni(OH)2的比表面积在7.8~17.5m2/g时,电极的放电比容量相对较高。
Ni(OH)2晶体内部的结晶状态和缺陷不同也会导致Ni(OH)2电极在电化学性能上的差异。对于结晶度差、层错率高、微晶晶粒小、排列无序的产品,活化速率快,放电容量高,循环性能也较好。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






