在20世纪70年代,国际电化学会对电化学做出了明确的定义:电化学是研究第一类导体与第二类导体的界面及界面上所发生的一切变化的科学[1,2]。第一类导体指的是电子导体,包括金属材料和石墨等导电非金属材料。第二类导体指的是离子导体,包括导电溶液、固体电解质和熔融盐等。在电化学反应体系中,电极是第一类导体,而电解质是第二类导体。电化学反应是在电极与电解质的相界面上发生的。当电化学反应发生时,界面上将发生电子转移,界面附近发生的传质作用,以及化学物质在电极表面发生的转化。这些都是电化学所研究的对象。
1.电极电势与电池电动势
当电极插入溶液中时,电极中的金属离子或电子以及溶液中的离子将在两相间自发地转移,或者通过外电路向界面两侧充电,使得界面两侧都出现了剩余电荷。界面两侧的电荷数量相同,符号相反。由于静电力的作用,电荷在电极表面聚集,形成了双电层(见图12-1)。有关的双电层理论认为,溶液一侧的剩余电荷不是完全排列在电极表面,也不是完全均匀地分散在溶液中,而是一部分排在电极表面形成紧密层,其余部分按照Boltzmann分布规律分散于表面附近一定距离的液层中,形成分散层。
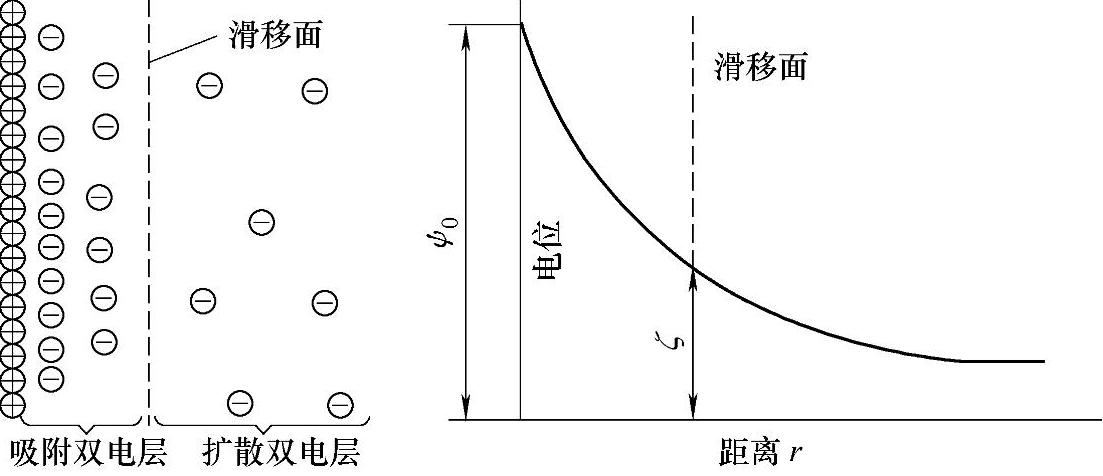
图12-1 双电层模型与电势的形成
正是由于在电极和溶液的界面处形成了一定的电荷分布,而产生了相间电位差,这个电位差被认为是该电极的绝对电极电势。到目前为止,电极两相之间的绝对电势差仍然是无法通过实验的方法来测量的,也不能通过计算的方法得到。因此,人们目前所说的一个特定电极的电极电势都是指该电极体系相对于另外一个电极体系的相对电极电势。[3]
当通过可逆电池的电流为零的时候,电池两端的电势差称为电池的电动势,用E表示。对于一个能够自发进行的化学反应,在电池中等温可逆进行,可做最大有用电功即电池反应的Gibbs自由能变化,有用电功等于电池电压与放电电量的乘积。所以对于可逆电池,其电动势的数值与电池反应的Gibbs自由能的变化是相联系的:
ΔG=-nFE (12-1)
在标准情况下,有
ΔGΘ=-nFEΘ (12-2)式中,ΔG为Gibbs自由能的变化;ΔGΘ为标准状态下的Gibbs自由能变化;n为电子转移数;E为电池电动势;EΘ为标准状态下的电池电动势。
国际上统一规定,用标准氢电极(SHE)作为负极与待测电极作为正极组成电池,所得到的电池电动势为待测电极的相对电极电势,用φ来表示。若待测电极处于标准状态则称为标准电极电势,用φΘ来表示。这里作为电势测量的标准氢电极为一块镀了铂黑的铂片,浸入H+的溶液中。在一定温度下,当氢离子的活度为1mol/L,通入溶液中的氢气压力为标准压力pΘ=101325Pa时,达到平衡状态后,作为标准氢电极进行测量。标准氢电极上发生的电化学反应为

对于一个给定的电极,将其与标准氢电极组成原电池并以标准氢电极作为电池负极,测量所得的电池电动势即为该电极的电极电势。若在溶液中粒子的活度都为1时,则该电池的电动势就是电极的标准电极电势。对于任意一个给定的电极反应,可以表示为如下形式:

其平衡电极电势可以通过计算得到,电极电势的计算式为

式中,φ为电极的平衡电极电势;φΘ为标准电极电势;z为电子转移数;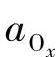 为氧化态粒子的活度;aRed为还原态粒子的活度。
为氧化态粒子的活度;aRed为还原态粒子的活度。
式(12-5)为电化学中的能斯特(Nernst)公式,它给出了电极的平衡电极电势与氧化态和还原态粒子活度以及温度的关系,是电化学领域重要的公式之一。通过该公式,可以计算出电极在任意状态下的平衡电极电势,并通过构成电池的两个电极的电极电势来计算得到电池的电动势。电池的电动势可以理解为两个电极的电极电势之差。
以传统的Daniel电池为例,该电池由铜和锌的可逆电极组成,可以表示为Cu|CuSO4|ZnSO4|Zn。为了消除液接电势,经常用盐桥来连接两个电极。此电池的电极反应如下:
正极:Cu2++2e→Cu (12-6)
负极:Zn→Zn2++2e (12-7)(https://www.daowen.com)
电池反应:Zn+Cu2+→Zn2++Cu (12-8)
电池的电动势可以表示为
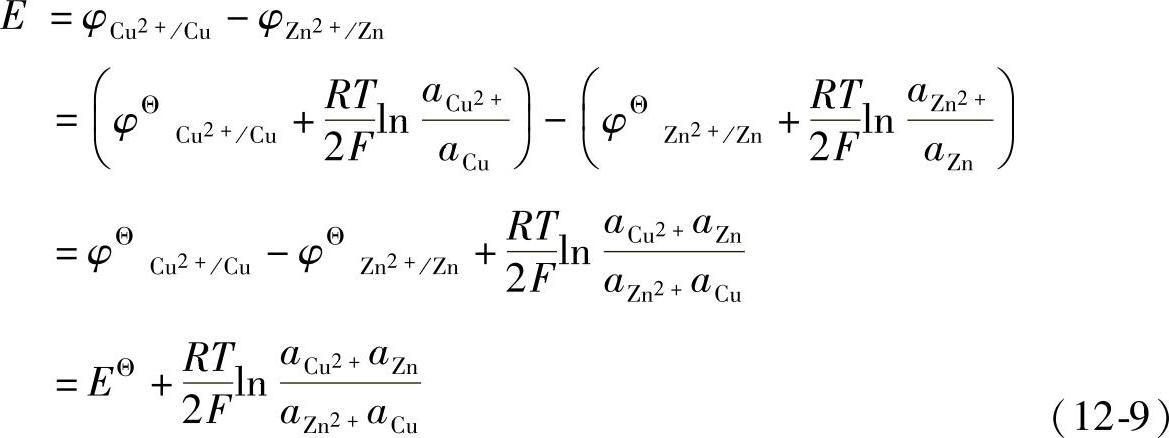
因此,电池的电动势也可以由电池的标准电动势与反应体系中各物种的活度积来直接进行求算。电池的电动势只与参加反应的物质、反应条件和反应物与产物的活度有关,而与电池的外部结构、装配方式无关。
2.电池内阻与电压
电池的内阻是指电池在工作时,电流流过电池内部所受到的阻力。电池的内阻包括欧姆电阻和极化电阻两种。欧姆电阻是电池内部的固有电阻,与电池的内部组成结构有关。而极化电阻是在有电流通过的时候产生的,与通过的电流强度有关。电池的内阻可分为欧姆电阻和极化电阻两部分电阻之和[4]。
电池的欧姆电阻是由电极材料、电解液、隔膜电阻及各部分零件的接触电阻组成。为了降低电池内部的欧姆电阻,一般采用减小电极之间的距离,选用具有高电导率的电解液,在电极材料中添加导电性良好的添加剂如石墨粉、炭黑或金属粉等来降低电池材料的固有电阻。
电池的极化电阻是由于电流的通过所引起的。当有电流通过的时候,电极上会发生如电极反应、气体吸附和离子扩散等一系列的反应过程。而进行这些过程都需要克服一定的阻力,消耗一定的能量,即电极发生极化,从而产生极化电阻。电池极化电阻的产生主要是因为电化学过程本身的动力学因素造成的。因为溶液中离子的扩散速度低于电极反应速率,使得电极表面的离子浓度与溶液本身的离子浓度产生差异而产生浓差极化的电阻。因此,采用海绵状或粉末状的活性物质制成多孔性电极,提高电极的比表面积。在相同的条件下,多孔电极上比表面积大,可以有效地降低通过电极的电流密度。同时也可以选用导电优良的电解液组合体系,来减少极化电阻。
电池两极间的电位差,称为电池的电压。电池两极间与外电路断开时,两电极都没有电流通过。此时电池两极之间的电位差称为开路电压。工作电压又称为放电电压,是指有电流通过外电路时,电池两极之间的电位差。因为在电流通过电池内部时,必须克服欧姆电阻和极化电阻所造成的阻力,所以电池的工作电压总是低于开路电压。电池的工作电压受放电条件的影响,如放电时间、放电电流、环境温度等都能影响电池的工作电压。
3.电池的容量和能量
电池容量是指在一定的放电条件下电池能够提供的电量。电池的容量分为理论容量、实际容量和额定容量。
理论容量是假设所有的活性物质都参加电化学反应形成电流,按照电池中所含的活性物质的质量,根据Faraday定律计算得到的理论值。理论容量只是电池容量的一个理想值,在实际使用过程中,电池放出的容量与理想值还存在一定的差距。
实际容量指的是电池在一定的放电条件下实际放出的电量。可以用式(12-10)来表示:

式中,C为电池容量;I为放电电流;t为放电至终止电压的时间。
在恒流放电条件下,式(12-10)可以简化为
C=IΔt (12-11)
额定容量是指在规定条件下电池应该放出的电量的最低限值。额定容量是在设计和制造电池过程中,电池质量的重要技术指标。
为了考察不同电池的性能,常采用比容量的概念进行比较。电池的比容量通常有体积比容量和质量比容量,分别是指单位体积和单位质量电池的容量。与电池的容量类似,电池的比容量同样也存在理论比容量和实际比容量之分。根据电池比容量的数据结果,可以比较不同类型的电池的性能差异。
电池在一定条件下能对外输出的电能叫做电池的能量。在理论条件下,将电池的电动势作为电池的放电电压,假定活性物质的利用率为100%,在此条件下计算出的电池的输出能量称为电池的理论能量。而在放电过程中电池实际放出的能量称为电池的实际能量。为了比较不同型号和类型的电池的输出能量,引入比能量的概念。与比容量的定义类似,电池的比能量也有体积比能量和质量比能量,分别表示单位体积和单位质量的电池所能给出的能量。电池的比能量也称为电池的能量密度。[5]
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






