氨硼烷化合物(NH3BH3)是具有研究前景和应用潜力的储氢材料,不仅因为它具有高的氢含量密度,而且因为NH3BH3在不同的体系中,表现出丰富多彩的放氢方式。采用水解催化体系的方法,NH3BH3可以在室温附近极快速地放出约3个化学计量比的氢气;但NH3BH3水解产物(NH4+,BO2-)再生为氨硼烷化合物的过程,需要跨越很大的能垒,目前尚无文献报道节省能源、经济适用的放氢产物再生方法。在氨硼烷化合物热分解放氢过程中,不同的体系和不同的反应条件下,NH3BH3放氢的特点各不相同。例如,在均相催化剂(POCOP)Ir(H)2(POCOP=[η3-1,3-(OP-tert-Bu2)2C6H3])作用下,NH3BH3有机溶液体系可以非常快速地放氢,放氢速度已达到实际应用的需求;而在引入Ni(Enders’NHC)2催化剂的NH3BH3体系中,热分解体系可以放出高达2.5个化学计量比的氢气。热分解放氢的产物BNHx,重新再生为氨硼烷化合物所需的能量比水解放氢产物再生耗费的能量要少;故此,以热分解方式将氨硼烷化合物开发为储氢材料,有利于实现体系储氢的循环性。现在对于热分解放氢产物再生过程的研究,正在进行当中;不同的热分解改性体系带来的不同的反应产物如何再生,也是如何实现氨硼烷化合物热分解放氢循环性必须考虑的问题。将所有的BNHx类型产物,转化为相同的反应产物如BBr3、BCl3,随后进行统一转化再生过程,是人们解决氨硼烷化合物热分解放氢产物再生问题的可能解决方法。除了反应产物再生问题之外,对于NH3BH3材料而言,其作为储氢材料的一大优势即是其理论储氢重量密度高达19.4wt%;而在NH3BH3储氢体系中,无论是水、有机溶剂、分子筛担载材料还是离子液体的加入都会明显降低整个体系的储氢密度。如何采用合适的体系,在大幅度提高NH3BH3在合适温度范围内的放氢动力学性能,同时尽可能保持体系具有高的储氢重量百分比,是人们需要进一步研究并探讨的课题。
氨硼烷储氢体系具有制氢/储氢一体化的特征,未来可能的发展趋势是,由大型工厂负责制备氨硼烷化合物以及放氢后产物的再生;在车载等应用性储能体系中,氨硼烷化合物既是氢源,同时又是储氢材料。与常规的先制氢-再氢能输送-然后将氢能存储于储氢体系的系统相比,氨硼烷化合物这一类新型储氢和制氢结合应用方式在车载储氢应用领域中具有显著的便利和经济效益优势。氨硼烷体系,由于其诸多储氢性能优势和新颖的储氢材料设计思路,已成为储氢领域研究的热点,受到美国、日本、德国、中国等多国的科学家的关注。
 (https://www.daowen.com)
(https://www.daowen.com)
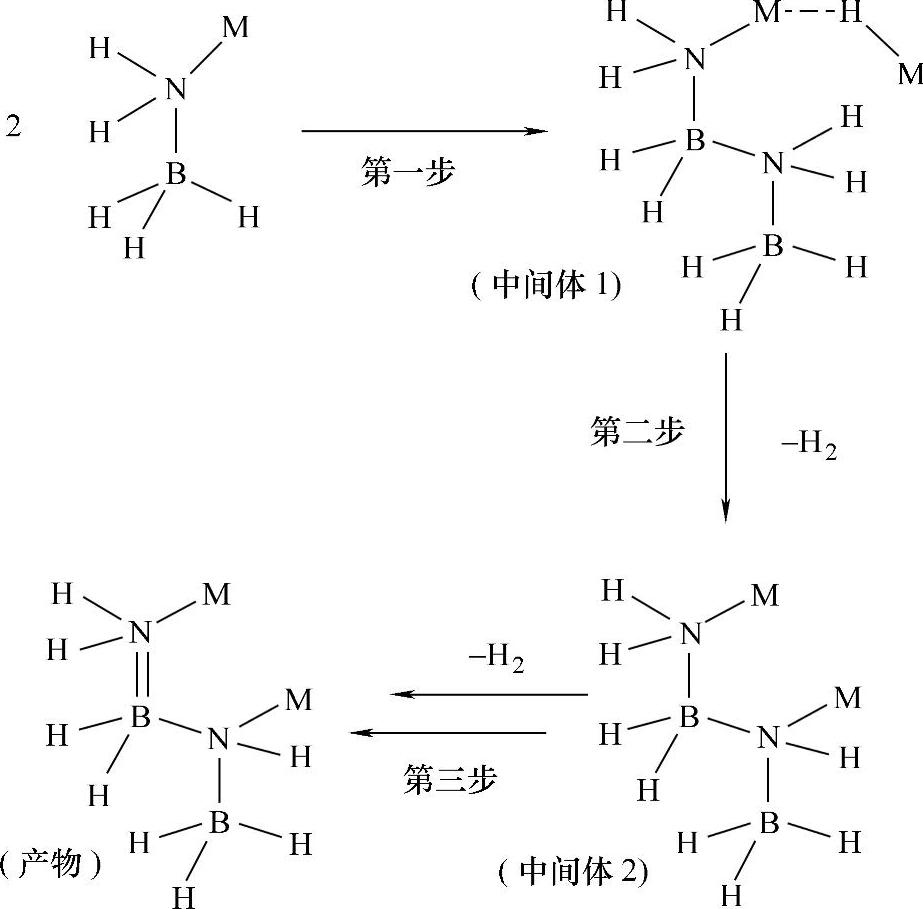
图9-64 MAB(M=Li、Na或K)的放氢过程反应机理示意图
当前的研究中,除了NH3BH3之外,氨硼烷化合物的衍生物([Mn+(NH2BH3)n,MAB)作为储氢材料,也得到了人们的关注,包括Ca(NH2BH3)2体系、LiNH2BH3体系和NaNH2BH3体系等。MAB可以通过在NH3BH3的有机溶液(溶剂THF)中加入过量的LiH、NaH等金属氢化物制备得到。在Ca(NH2BH3)2、LiNH2BH3和NaNH2BH3等化合物体系中,虽然金属离子的引入降低了体系的储氢重量密度,但是金属离子的引入能够大大改变体系的放氢性能。例如,LiNH2BH3在放氢过程中表现出较低的放氢温度和改良的放氢热力学性能,同时金属离子在LiNH2BH3和NaNH2BH3体系中,减少了放氢时挥发性副产物的逸出。研究表明,在MAB(M=Li、Na或K)的放氢过程是双分子反应机理,先通过M-N键和B-H的断裂,形成了M-H键和反应中间体MH3MNH(R)BH2N(R)MBH3(中间体1·MH)(图9-64中第一步),中间体1快速脱氢生成中间体2,中间体2在实验过程中瞬间放氢变成终产物3。其中,通过理论计算证实,B-H键断裂是决速步;而金属离子的加入及其电负性的作用,对B-H键的断裂过程有很大的影响,例如,放氢速度:KNH2BH3>NaNH2BH3>LiNH2BH3。在MNH(R)BH3(M=Li、Na和K)体系中,对于不同的取代基R,放氢速度:H>Me>tBu。现有的研究工作表明,氨硼烷化合物的衍生物体系表现出具有研究和应用潜力的储氢性能。这一类氨硼烷化合物的类似物储氢体系,也是储氢领域人们关注的热点。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






