现在主要研究的氨硼烷储氢材料的放氢方式有:①与溶剂(如水等)反应,放出氢气。以氨硼烷水解放氢体系为例,见式(9-65)。纯的氨硼烷化合物的水溶液在常温常压,空气气氛下稳定,自行放氢的速度极慢。而人们通过选择和添加各种催化剂,进而调控氨硼烷水解体系的动力学性能,使材料在合适的温度、压力、气氛下快速放出氢气。②固体氨硼烷热分解放氢,例如式(9-66)、式(9-67),依式(9-68)分解,放出1.1±0.1化学计量比的氢气;当温度升至约150℃,依式(9-67),反应再次放出一个化学计量比的氢气,两步热分解的放氢量总达约两个化学计量比,式(9-67)的产物[NHBH]x进一步放氢生成NB和氢气的反应,由于所需反应温度过高(>500℃),较少被人们考虑。现在人们的研究目标是,通过对热分解体系的设计与改性,调控氨硼烷热分解放氢的动力学性能和热力学反应途径,使体系适应实际应用的需求。③在有机溶剂中,NH3BH3有机溶液体系在有机金属配位化合物存在的条件下,催化脱氢,放出氢气。
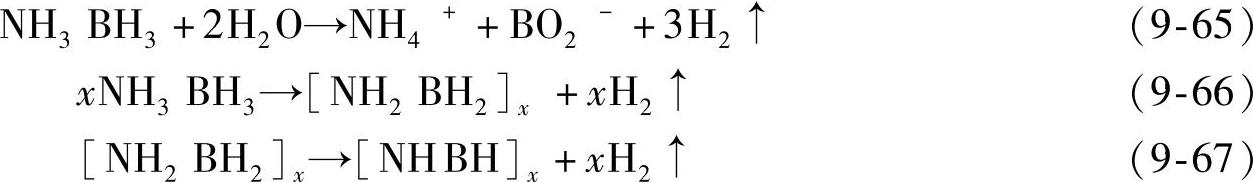
氨硼烷与溶液反应储氢体系,利用的是氨硼烷和溶液之间的反应,在合适的条件下快速放出氢气,采用的溶剂包括甲醇、水等。出于环境保护、成本等考虑,氨硼烷水解放氢为科学界广为关注。在酸性的水溶液中,氨硼烷化合物可以与酸反应,快速放出氢气,氨硼烷和H+之间的反应遵循一级反应规律。溶液中的H+与-NH3反应生成NH4+,解离出的BH3(solv)快速水解放出氢气[见式9-68]。
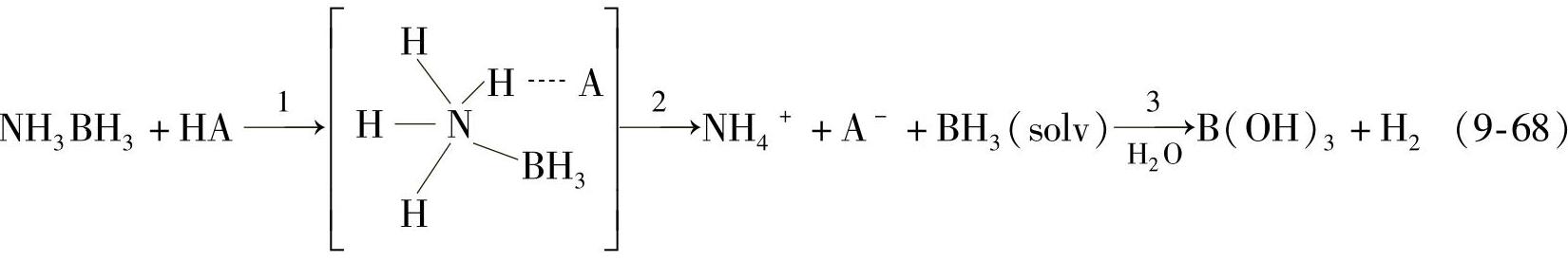
在中性和弱碱性的条件下,氨硼烷化合物的水溶液非常稳定。氨硼烷化合物溶解于水后形成的无色溶液的pH值为9.1(pH与NH3BH3的浓度无关)。通过11B NMR实验证实20,将氨硼烷的水溶液保存在氩气气氛下,80天内氨硼烷化合物的11B NMR谱峰的化学位移没有改变,证明了氨硼烷水溶液体系具有高稳定性。这一稳定特性有利于氨硼烷水解储氢体系的保存和运输。但另一方面,在中性和弱碱性的水溶液中,由于氨硼烷化合物稳定,在不加催化剂的情况下,氨硼烷水溶液在室温条件下放氢动力学性能差,放氢速度缓慢,需要改性以提高实际应用的可能性。
NH3BH3水解放氢,见式(9-65),在常温常压条件下为热力学可以进行反应。在室温298K条件下,式(9-65)的反应标准摩尔焓变为-156kJ/mol(标准生成焓:NH3BH3,-178kJ/mol;2H2O,-572kJ/mol;NH4+,-133kJ/mol;BO2-,-772kJ/mol)。该反应为放热反应。由于纯氨硼烷的水溶液在室温附近温度范围内放出氢气的速度极为缓慢,因此,采用高效催化剂提高水解反应的动力学性能,在氨硼烷水溶液体系中,加快NH3BH3室温水解放氢,促使3个化学计量比的氢气快速放出,是氨硼烷水解体系必须解决的问题。对于贵金属催化剂体系,现有的研究表明现在采用的Pt/C、PtO2、Ru/Al2O3、Rh/Al2O3、Pt/Al2O3等担载型材料在氨硼烷水解放氢体系中具有优异的催化性能,能够明显加快NH3BH3与水反应放氢的反应速率。研究表明,贵金属系列催化剂在氨硼烷化合物体系中的催化性能与采用的贵金属种类密切相关。在现有的文献报道中,Ru、Rh、Pt基的担载型催化剂具有高效的催化性能;Ru、Rh、Pt基担载型贵金属催化剂的加入明显降低了氨硼烷化合物放氢反应的活化能(Ru/γ-Al2O3(2wt%),23kJ/mol;Rh/γ-Al2O3(2wt%),21kJ/mol;Pt/γ-Al2O3(2wt%),21kJ/mol),在这些催化剂作用下,氨硼烷化合物水解体系可以在数分钟内放出3个化学计量比的氢气(见图9-51),这些体系表现出很好的放氢动力学性能。而对同一种贵金属催化剂而言,在氨硼烷水解体系中,贵金属催化剂中金属的颗粒尺寸、分散性、制备时前驱体的选择以及担载多孔材料的选择,均会显著影响其在氨硼烷水解体系中表现出的催化性能。具有小颗粒尺寸和高分散性的催化剂具有较高的催化性能。
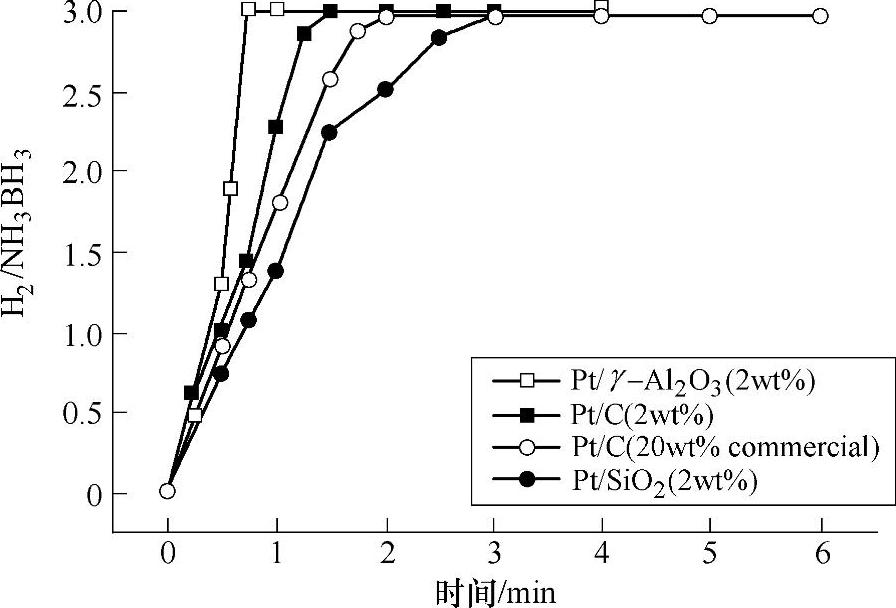
图9-51 氨硼烷在室温条件下水解动力学性能(1wt%NH3BH3,10mL)
但由于贵金属材料的价格昂贵,全球储量匮乏,从实际应用考虑,贵金属催化剂不适宜氢能未来的推广应用。考虑到实际商业化和储氢材料快速放氢的需求,氨硼烷水解体系中,开发具有高效催化性能、优异循环性能同时价格低廉的新型催化剂成为人们关注的目标。过渡金属催化剂的添加也能够改善氨硼烷体系在室温附近水解放氢的动力学性能。文献报道的过渡金属催化剂包括介孔材料(Al2O3、C和SiO2)担载Fe、Co、Ni、Cu催化剂、通过还原法原位制备的无定形的Fe催化剂(见图9-52)、以金属有机框架结构(Ni(4,4’-bipy)[HBTC],其中4,4’-bipy=4,4’-bipyridine,H3BTC=1,3,5-benzenetricarboxylic acid)为前驱体制备的Ni催化剂(见图9-53)和Cu/CuO2核壳结构纳米材料等。通过过渡金属催化剂的加入,氨硼烷化合物在室温下的水解放氢速度得到了一定的提高。现有文献报道中的许多过渡金属催化剂的催化性能尚不及Ru、Rh和Pt担载催化剂,但部分过渡金属基催化剂促使氨硼烷水解体系在数分钟内放出3个化学计量比的氢气的性能,已显著高于现
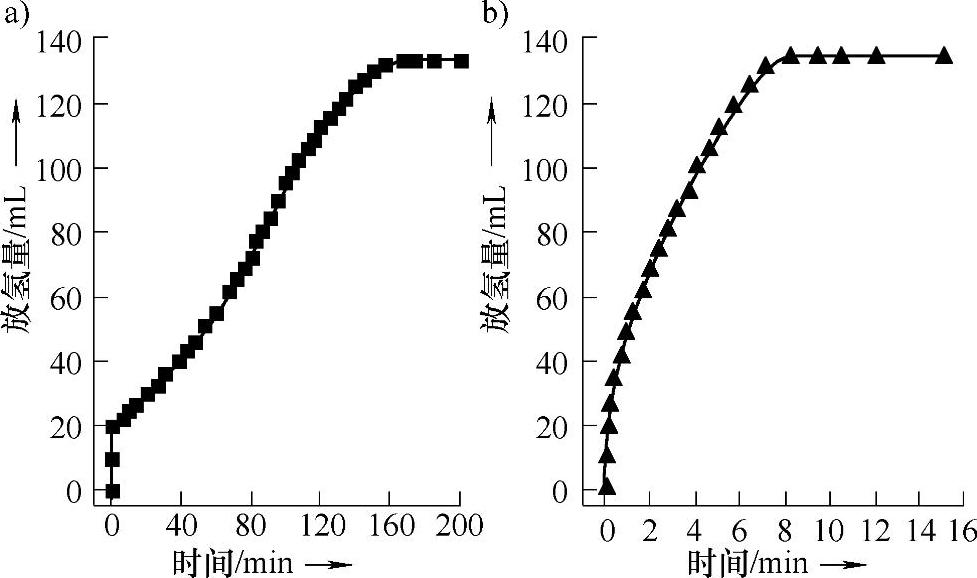
图9-52 氨硼烷在室温,氩气气氛下,水解动力学性能(0.16M NH3BH3,10mL)
a)加入由NaBH4预先还原制备的Fe催化剂 b)加入在催化氨硼烷放氢过程中,由NaBH4原位还原制备的Fe催化剂(Fe/NH3BH3=0.12)
在研究的Pd、Au贵金属催化剂材料的催化活性。如图9-52所示,在氨硼烷化合物水解体系中引入原位制备的无定形的Fe催化剂(Fe/NH3BH3=0.12mol/mol,NH3 BH3水溶液浓度为0.16mol/mol),体系中的NH3BH3在室温,氩气气氛下,8.5min内即可完成水解放氢过程。如图9-53所示,在氨硼烷水解体系中加入以Ni(4,4’-bipy)[HBTC]为前驱体制备的Ni催化剂,使0.32M的NH3BH3水溶液在室温、空气气氛下,能够在5min内完全水解放出3个化学计量比的氢气;该催化剂的加入将NH3BH3水解放氢的活化能将降低至26kJ/mol,显示出良好的催化活性。该催化体系在20个氨硼烷化合物水解循环中没有发生催化活性的明显衰减,催化活性中心具有稳定性;以Ni(4,4’-bipy)[HBTC]为前驱体制备的N催化剂可以在多个放氢过程中重复使用。当前,通过进一步调控制备方法,选择合适前驱体和催化剂制备方法,利用纳米技术和担载效应,研究并提高非贵金属基催化剂材料在氨硼烷水解体系中的催化性能,是具有潜力和应用价值的研究课题。综上所述,氨硼烷水解体系的优势明显,但在研究这一体系的过程中,如何提高反应产物的循环再生性能,如何采用合适的体系和催化剂材料在常温条件下快速放出纯的氢气的问题,包括在催化体系中,催化剂的循环性和再生等问题,值得人们进一步深入研究和探讨。
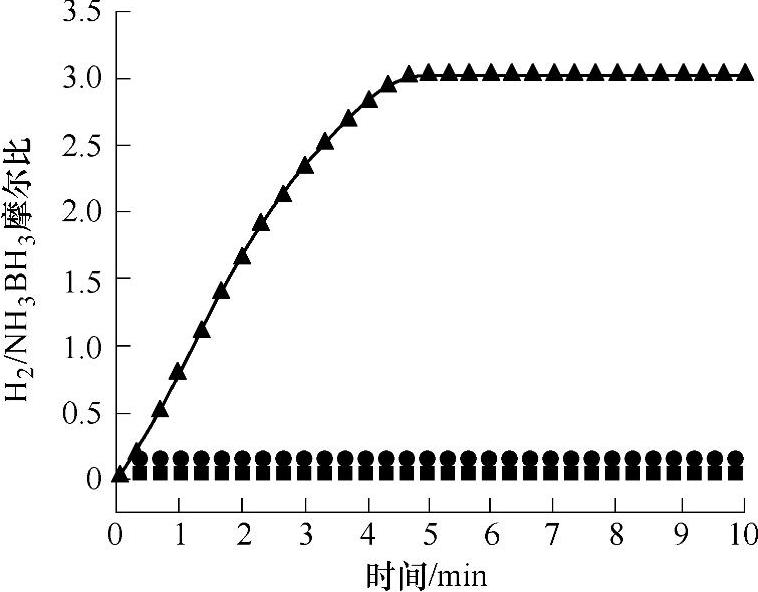
图9-53 氨硼烷在298K,空气气氛下,水解动力学性能(0.32M NH3BH3,1.0mL)
(其中加入以MOF为前驱体制备的催化剂(▲),普通Ni粉和未处理的MOF(●)和无催化剂条件下氨硼烷水溶液(■))
氨硼烷化合物在高温条件下,可以热分解放出氢气;在氨硼烷化合物热分解过程中,放氢的速率和分解产物与加热反应条件密切相关。氨硼烷化合物固体在110℃附近,可以观察到发生融化现象;DSC实验中(见图9-54),曲线显示了氨硼烷熔化的吸热峰和一个尖锐的放氢反应放热峰,在这一步过程中,放出1.1±0.1个化学计量比的氢气,这一过程的主要产物是硼氮多聚物[NH2BH2]n。[NH2BH2]n在110~200℃的温度区间范围内,在缓慢的升温条件下(1℃/min),可以继续放出1个化学计量比的氢气(DSC实验,见图9-54,表现为一个宽峰,△T≈40℃),同时反应生成[NHBH]n。氨硼烷化合物热分解过程的升温速度会影响反应产物。在10℃/min的升温条件下,氨硼烷化合物热分解会生成少量的挥发性c-(NHBH)3(Borazine);同时通过热重分析可以观察到,氨硼烷固体在热分解过程中的失重超过了14.3wt%(对应放出的两个化学计量比的氢气),这也证明了体系中有除H2以外的气态产物逸出。在这一体系中,产生的挥发性产物c-(NHBH)3(Borazine)降低了氨硼烷化合物热分解体系产生氢气的纯度,不利于氢能后续利用(如降低燃料电池性能);在氨硼烷化合物储氢体系的研究中,应当考虑如何避免挥发性产物混杂在氢气中逸出。
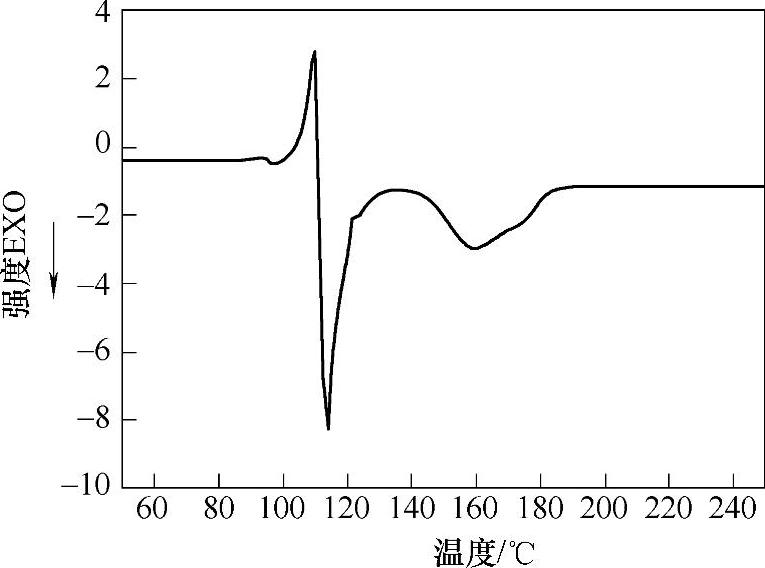
图9-54 氨硼烷化合物氩气气氛下热分解DSC曲线(升温速度5℃/min)
氨硼烷化合物在较低温度条件下(例如,为适应离子交换燃料电池的要求,人们期望的氨硼烷化合物热分解放氢温度为80℃左右),直接热分解放氢的引发过程漫长,而在引发阶段体系几乎不放出氢气,这是NH3BH3作为储氢材料的不利之处。如图9-55所示,氨硼烷化合物在90℃条件下,放氢的引发过程需要数小时才能完成。如图9-56所示,氨硼烷化合物在85℃条件下热分解,前3h几乎不放出氢气,之后在17h后,才放出0.9个化学计量比的氢气,此后保持85℃直至67h,再无观察到明显的放氢;即使提高放氢温度,在95℃时,NH3BH3热分解放氢的引发阶段也需要长达1h。
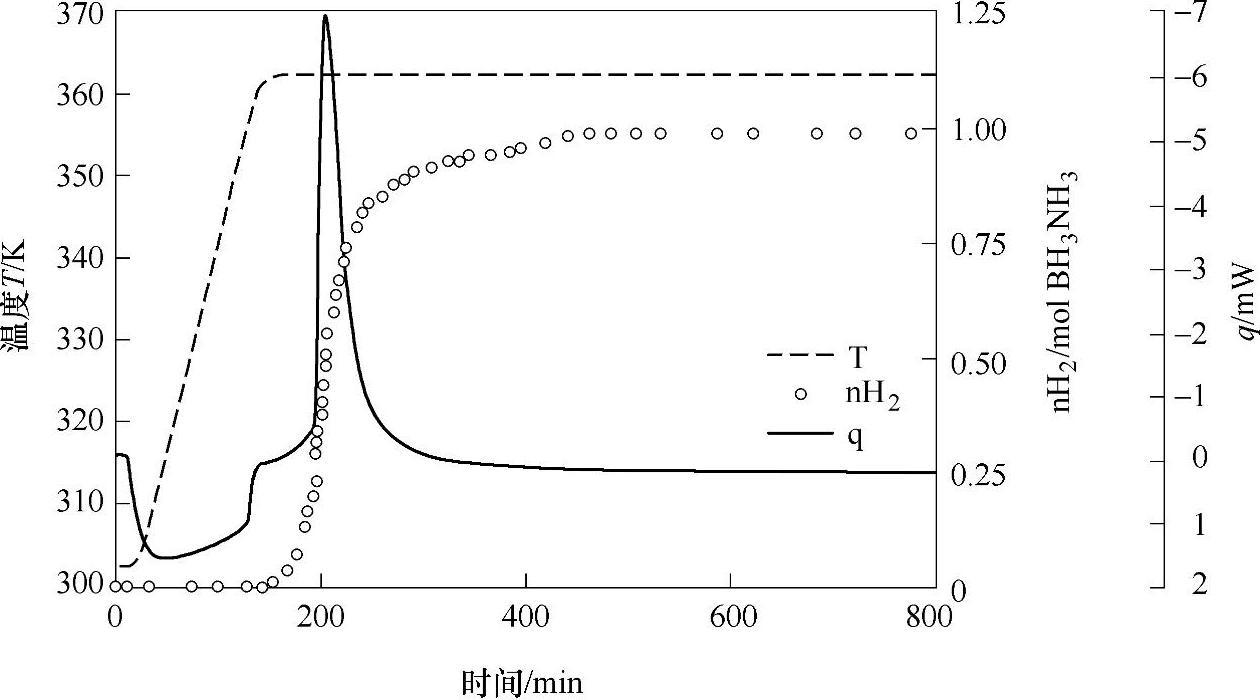
图9-55 氨硼烷化合物在90℃条件下,热分解放氢过程 注:—为热流曲线,---为实验过程温度控制曲线, 为放氢量曲线
为放氢量曲线
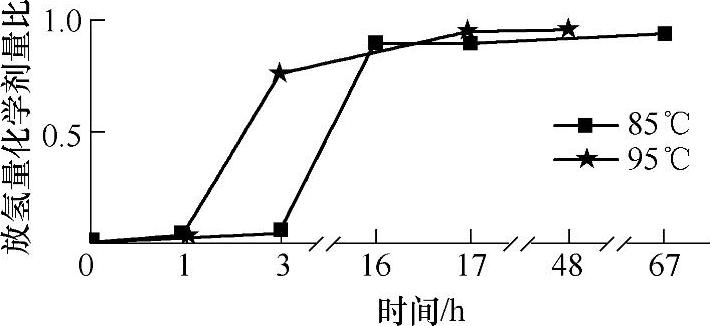
图9-56 氨硼烷化合物在85℃和95℃条件下,热分解放氢放氢量随时间变化图
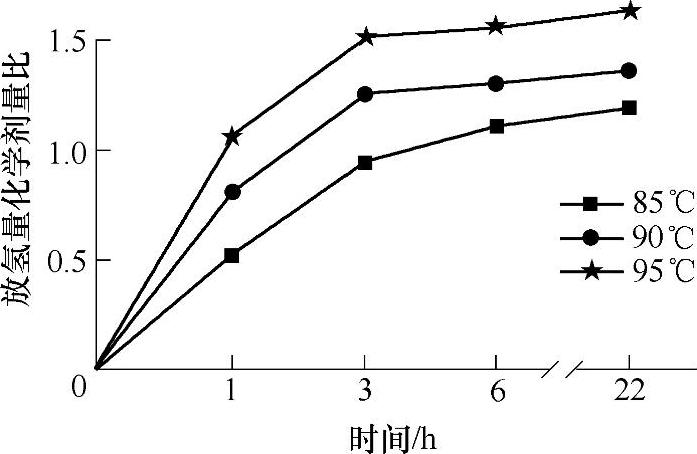
氨硼烷化合物分解放氢体系中漫长的引发阶段和缓慢的动力学放氢过程无疑不利于NH3 BH3储氢材料的实际应用。在已有文献报道中,人们采用了各种方法,以期望提高在80℃左右温度范围内氨硼烷化合物储氢体系的放氢动力学性能。Sneddon L.G.等人通过将氨硼烷化合物引入离子液体体系(采用的离子液体是bmimC1,1-butyl-3-methylimidazolium chlo-ride),提高了氨硼烷化合物的动力学性能,使NH3BH3/bmimC1体系可以在较低的温度放出氢气;如图9-57所示,NH3BH3/bmimC1体系在85℃、90℃和95℃条件下,3h内放出了0.95、1.2及1.5个化学计量比的氢气。在NH3BH3/bmimC1体系中,离子液体的引入促使了热分解反应的活性中间体的生成(如DADB,[(NH3)2BH2]+[BH4]-),从而使氨硼烷化合物能够快速热分解放氢。采用浸渍法,将氨硼烷化合物填充在介孔分子筛SBA-15中(见图9-58,氨硼烷化合物与SBA-15的重量比是1:1),可以提高氨硼烷化合物热分解的动力学性能,降低NH3BH3热分解放氢的活化能(NH3BH3,184±5kJ/mol;NH3BH3/SBA-15体系,67±5kJ/mol);NH3BH3/SBA-15体系的TPD/MS(Temperature-Programmed Desorption Mass Spectrometry)实验结果显示,该体系放氢温度比纯相NH3BH3的热分解放氢温度约降低了15℃。同时,11B NMR实验结果证明,NH3BH3/SBA-15体系热分解反应副产物c-(NH-BH)3(Borazine)的放出量也明显降低。
 (https://www.daowen.com)
(https://www.daowen.com)
图9-57 NH3BH3/bmimC1(1-butyl-3-methylimidazolium chloride)体系在85℃、90℃和95℃时,热分解放氢放氢量随时间变化图
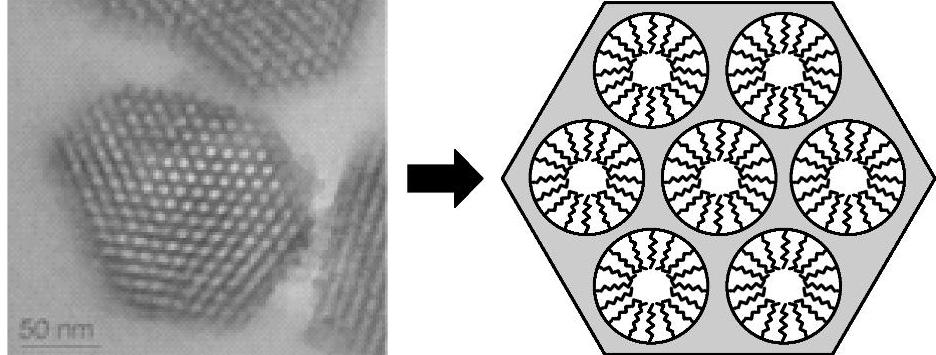
图9-58 (左)介孔分子筛SBA-15的透射电镜照片和(右)氨硼烷化合物在SBA-15分子筛介孔中填充示意图
在氨硼烷化合物热分解储氢体系中,通过加入催化剂对NH3BH3有机溶液体系动力学性能的改进以及对放氢机理影响的研究,也是科学家们重点关注的课题。GoldbergK.I.等报道,在氨硼烷化合物的有机溶液体系(THF溶液,其中氨硼烷化合物的浓度为0.5mol/L)中,采用(POCOP)Ir(H)2(POCOP=[η3-1,3-(OP-tert-Bu2)2C6H3])为均相催化剂;可以在室温条件,氩气气氛下,快速放出氢气(见图9-59)。当催化剂的加入量为0.5mol%时,体系放出1个化学计量比的氢气需要约14min;当催化剂的加入量为1.0mol%时,体系放出1个化学计量比的氢气仅需要约4min;这个体系的放氢速度已经可以满足实际应用的要求。氨硼烷化合物的有机溶液体系以其快速的放氢动力学性能在近年来颇受关注,人们研究了不同的催化剂对NH3BH3/有机溶液体系的降低放氢温度和提高动力学性能的作用。在氨硼烷化合物有机溶剂体系(有机溶剂为C6D6/二甘醇二甲醚,体积比为1∶2)中采用Ni基催化剂(Ni(Enders’NHC)2Enders’NHC=1,3,4-triphenyl-4,5-dihydro-1H-1,2,4-triazol-5-ylidene);该催化剂具有长催化寿命,同时具有高催化活性,能够使氨硼烷化合物/有机溶剂体系,在60℃时,4h中,放出高达2.5个化学计量比的氢气;在该体系中,Ni基催化剂的加入削弱了氨硼烷化合物中的B-H键,促进β-氢消除反应的完成,从而放出氢气。同时,在Ni(Enders’NHC)2的作用下,该体系中不利于氢能后续利用的挥发性副产物c-(NHBH)3(Borazine)进一步脱氢,形成了可溶于有机溶剂的交联产物,减少了挥发性副产物的逸出。
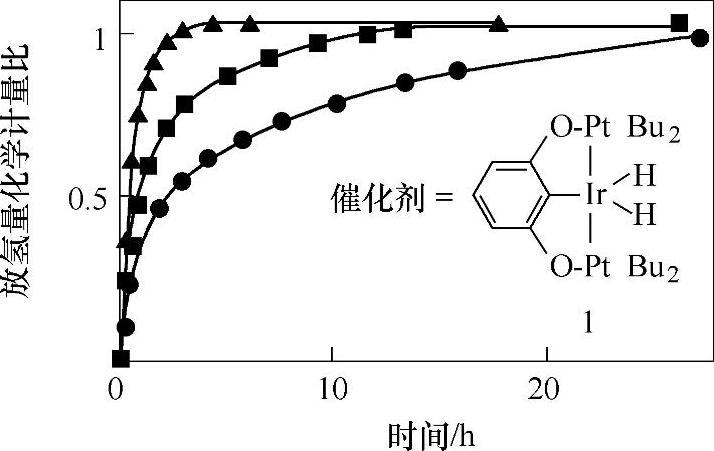
图9-59 氨硼烷化合物(0.5mol/L,THF溶液体系)在室温、氩气气氛下放氢动力学曲线注:
注:●代表体系中加入0.25mol%的催化剂,■代表体系中加入0.5mol%的催化剂,▲代表体系中加入1.0mol%的催化剂(催化剂分子式如图中所示)。
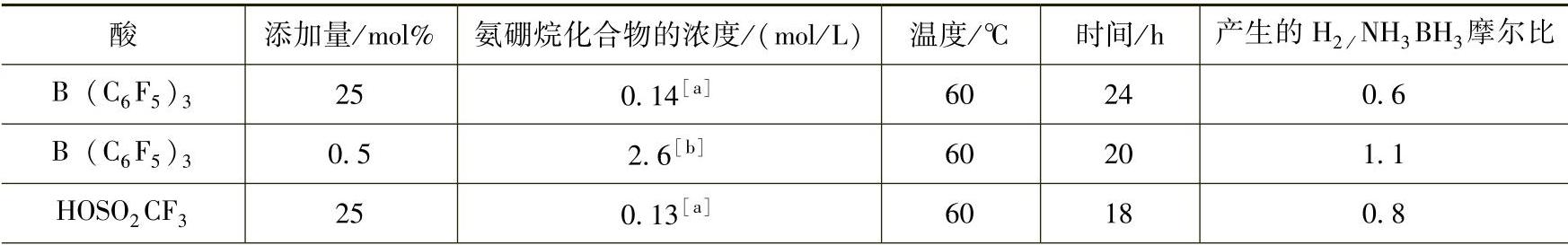
在NH3BH3/有机溶剂体系中,文献也报道了酸催化脱氢机理(见表9-12)。Lewis酸B(C6F5)3可以催化NH3BH3/有机溶液体系在低温下放氢。在60℃条件下,在体系中加入Lewis酸B(C6F5)3或Brønsted酸(如HOSO2CF3),能显著加快氨硼烷化合物放氢速率,在18~24h内能放出约1个化学计量比的氢气。酸催化氨硼烷化合物有机溶液体系的反应机理是,Lewis酸或Brønsted酸的加入使NH3BH3中B-H键发生脱氢反应,生成[BH2(NH3)(溶剂分子)]+正离子中间体(见图9-60)。这个正离子与前文所述的[(NH3)2BH2]+[BH4]-(DADB)相类似,[BH2(NH3)(溶剂分子)]+也和一个氨硼烷分子反应,生成新的B-N化学键,从而同时放出一个化学计量比的氢气;在该反应体系中,脱氢产物是BN低聚物。
表9-12 氨硼烷化合物在酸催化作用下放氢数据列表(溶剂为[a]乙二醇二甲醚厂[b]双二乙氧基甲醚[c]二甘醇二甲醚)
(续)

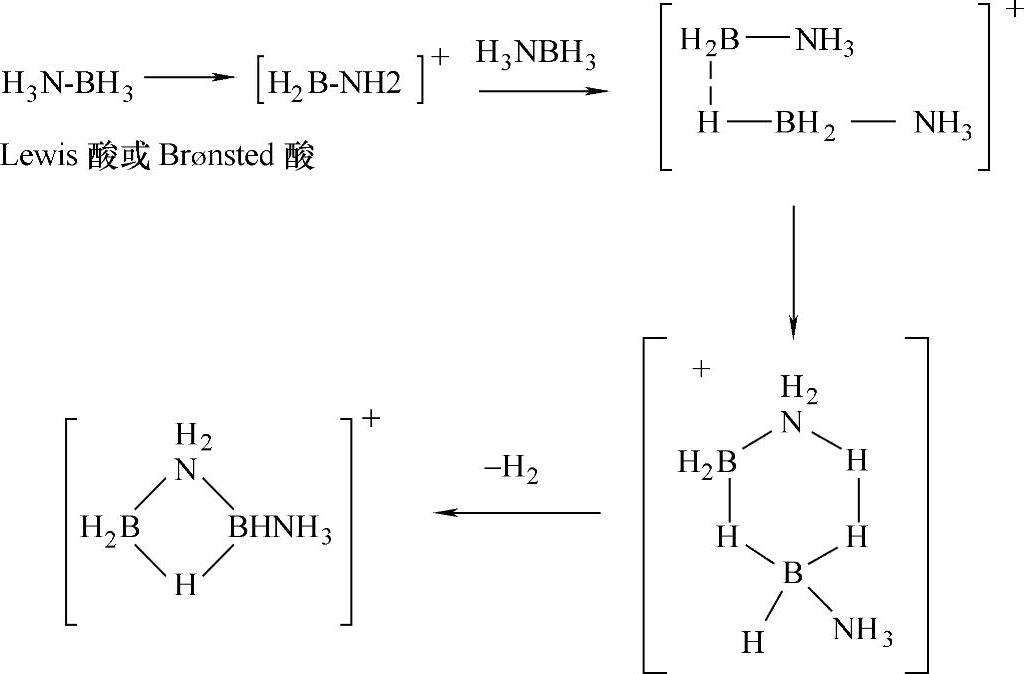
图9-60 氨硼烷化合物被酸催化放氢机理(为简明起见,图中省略了溶剂分子和阴离子)
如上所述,在NH3BH3/离子液体、NH3BH3/分子筛担载体系和NH3BH3/有机溶液体系中,人们利用模板效应、缺陷和催化剂,改进了氨硼烷化合物在低温下放氢缓慢的动力学性能。但是,在上述体系中,无论是离子液体、有机溶剂还是分子筛的加入,都使整个储氢体系的氢能重量百分比下降;这一点不利于氨硼烷化合物热分解放氢的未来应用。除了以上NH3BH3放氢体系之外,人们也着重研究了固体氨硼烷化合物直接加入催化剂后热分解放氢的性能;通过研究开发高效的催化剂,期望通过在氨硼烷化合物中仅添加少量的催化剂(体系中不添加离子液体、有机溶剂和担载介孔材料等),提高NH3BH3在80℃附近温度范围内的放氢动力学性能,从而获得具有高的储能密度和快速放氢特性的氨硼烷化合物热分解放氢体系。如图9-61所示,通过热重(TG)实验和微商热重曲线证实,在加入Ni0.88Pt0.12(Pt,1.8wt%)亚微米空心球之后,NH3BH3的热分解放氢第一阶段峰值温度降低了约9℃(相同实验条件下,NH3BH3,109℃;NH3BH3/Ni0.88Pt0.12,100℃);在NH3BH3/Ni0.88Pt0.12体系中,升温到100℃时,固体失重达到24.8wt%,这说明在Ni0.88Pt0.12催化剂作用下,NH3 BH3不仅放出了氢气,同时也产生了其他挥发性产物。以金属有机框架结构为前驱体制备的Ni催化剂(包括以Ni(4,4’-bipy)[HBTC],其中4,4’-bipy=4,4’-bipyridine,H3BTC=1,3,5-benzenetricarboxylic acid为前驱体制备的MOF1cat和以Ni(pyz)][Ni(CN)4],其中pyz=pyrazine为前驱体制备的MOF2cat),能够提高氨硼烷化合物在80℃的热分解放氢动力学性能。如图9-62所示,加入以Ni(4,4’-bipy)[HBTC]为前驱体制备的MOF1cat,NH3BH3的热分解放氢第一阶段峰值温度降低至80℃;同时,引入MOF1cat和MOF2cat的NH3BH3体系,由于体系的热分解放氢活化能降低,在80℃温度条件下,这两个体系热分解放氢动力学性能比纯氨硼烷体系有了明显的提高,在1~2h内,放出一个化学计量比的氢气(见图9-63)。
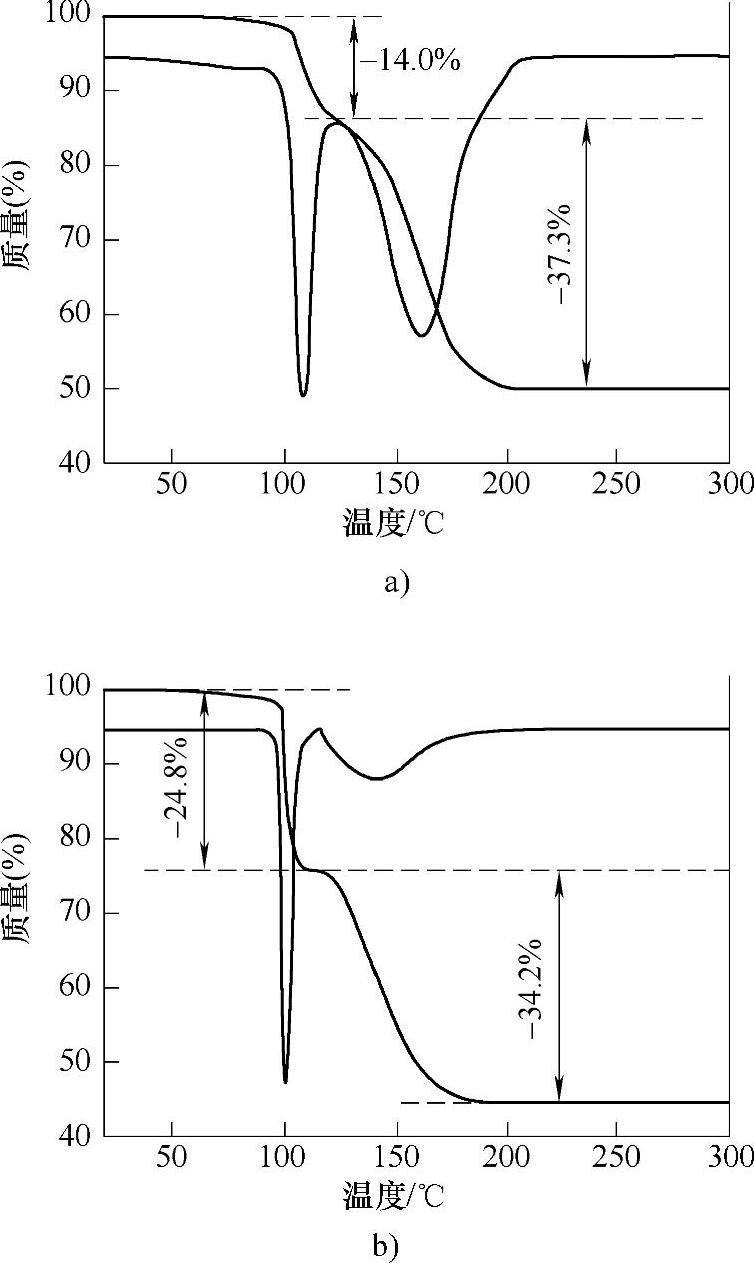
图9-61 N2气氛,升温速度5℃/min条件下,热分解放氢的热重曲线和微商热重曲线
a)为NH3BH3体系 b)为NH3BH3/Ni0.88Pt0.12体系
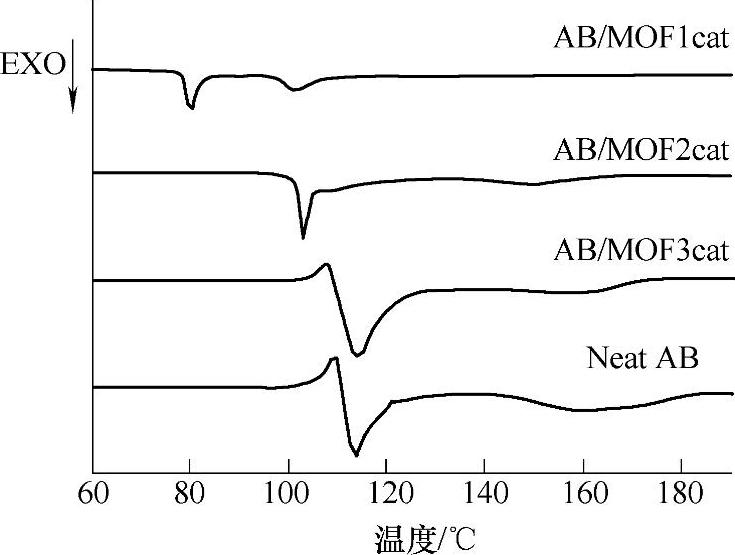
图9-62 Ar气氛,升温速度5℃/min条件下,热分解放氢的DSC实验结果
注:AB/MOF1cat为添加了MOF1cat的NH3BH3体系,AB/MOF2cat为添加了MOF2cat的NH3BH3体系AB/MOF3cat为添加了以Ni3[Fe(CN)6]2为前驱体制备的催化剂的NH3BH3体系,Neat AB为没有加入催化剂的NH3BH3。

图9-63 在80℃条件下,氨硼烷化合物/金属有机框架结构催化体系热分解放氢动力学曲线
注:a)曲线为NH3BH3/MOF1cat体系,b)曲线为NH3BH3/MOF2cat体系,c)曲线为没有加入催化剂的NH3BH3。
如上所述,纯的氨硼烷化合物自身热分解放氢过程中,放氢速度学缓慢,所需放氢温度较高,同时在放氢过程中可能产生挥发性硼氮副产物,混杂在产生的氢气中。近年来,人们采用各种不同的体系,如离子液体体系,有机溶液催化体系,直接添加催化剂体系等,期望提高氨硼烷化合物在80℃附近的放氢动力学性能和减少反应挥发性副产物的产生。为了使氨硼烷化合物热分解放氢体系满足未来氢能应用的要求,对NH3BH3体系新的改性策略和进一步的研究工作是人们关注的热点。另一方面,对NH3BH3热分解放氢体系而言,分解放氢后的反应产物再生,从而实现氨硼烷化合物储氢体系循环性的课题,也是人们关注的问题。值得注意的是,在不同的NH3BH3改性体系中,氨硼烷热分解放氢的产物千差万别,例如在NH3BH3/离子液体体系中,放氢产物为链状的[NH2BH2]n37;在Ni(Enders’NHC)2催化剂作用下,NH3BH3热分解后生成交联产物(polyborazylene)。对应不同体系的氨硼烷化合物热分解产物,采用经济实用的方法,实现储氢体系的产物再生和循环性,是NH3BH3体系付诸于实际应用前必须解决的挑战,也正是人们当前视图解决的问题。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。








