碱金属硼氢化物MBH4(M=Li、Na、K)的分解反应可以由式(9-50)来表示。MBH4的放氢温度高于熔点,因此融化后才开始放氢。在MBH4中,放氢温度顺序依次为Li<Na<K,其中LiBH4的储氢容量最高,高达18.5wt%。因此,以下将重点介绍LiBH4的吸放氢性能及反应机理。
MBH4→MH+B+3/2H2 (9-50)
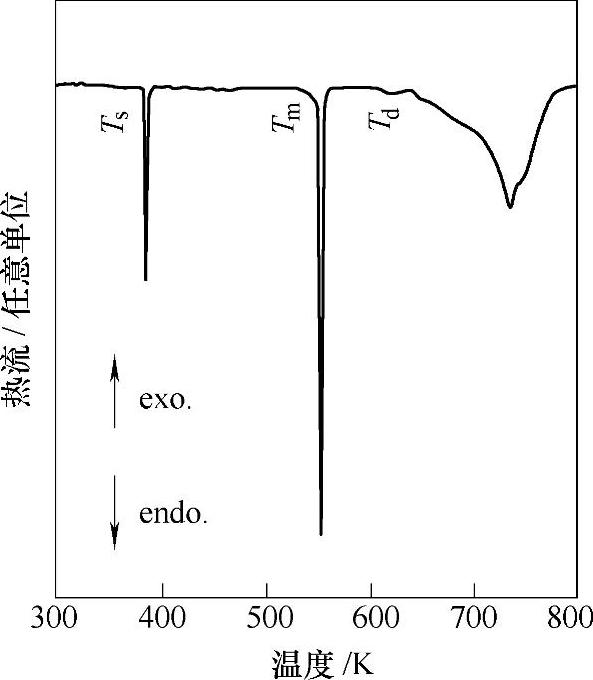
图9-38 LiBH4的DSC曲线[4](升温速度为:10K/min;气氛为:0.1MPa H2)
在加热过程中(见图9-38),LiBH4将首先经历相变(110℃左右)和融化(280℃左右),在320~400℃下开始放氢,至600℃可放出4个氢原子的3个,生成LiH和B,放氢量约为13.8wt%[1,4]。LiH在680℃以上才会分解。通过流量法测定了LiBH4在410~520℃下的放氢PCT曲线,如图9-39所示;利用van't Hoff方程,得到LiBH4放氢反应(LiBH4→LiH+B+3/2H2)的焓变为ΔH=74kJ/mol H2,熵变为ΔS=115J/Kmol H2[123];这些数值与第一性原理计算的结果(ΔH=56~76.1kJ/mol H2[6,124-126])吻合。根据所测的ΔH和ΔS值进行预测:当平衡氢压为0.1MPa H2时,LiBH4的分解温度为370℃。LiBH4的放氢反应在一定条件下是可逆的。其分解产物LiH和B,在600℃和15.5~35MPa H2下保持200min~12h后,可生成LiBH4[4,123]。LiBH4苛刻的可逆吸氢条件及缓慢的可逆吸氢动力学,可能是由于单质硼(α-B,二十面体结构)晶格中B-B键的断裂以及Li和B原子的扩散所引起的。将硼原子与Li原子直接进行纳米尺度的混合,可以有效减弱B-B键的强度,从而提高吸氢性能。比如LiBx合金(Li7B6、LiB3、LiB)等,可在350℃、15MPa H2下生成LiBH4[127]。
LiBH4在放氢反应中将生成中间相Li2B12H12[10,11]。Li2B12H12具有立方结构,空间群为Pa-3[128]。有研究者认为,Li2B12H12可能是由于LiBH4分解过程中释放的B2H6或高硼烷与残余的LiBH4反应生成[129]。
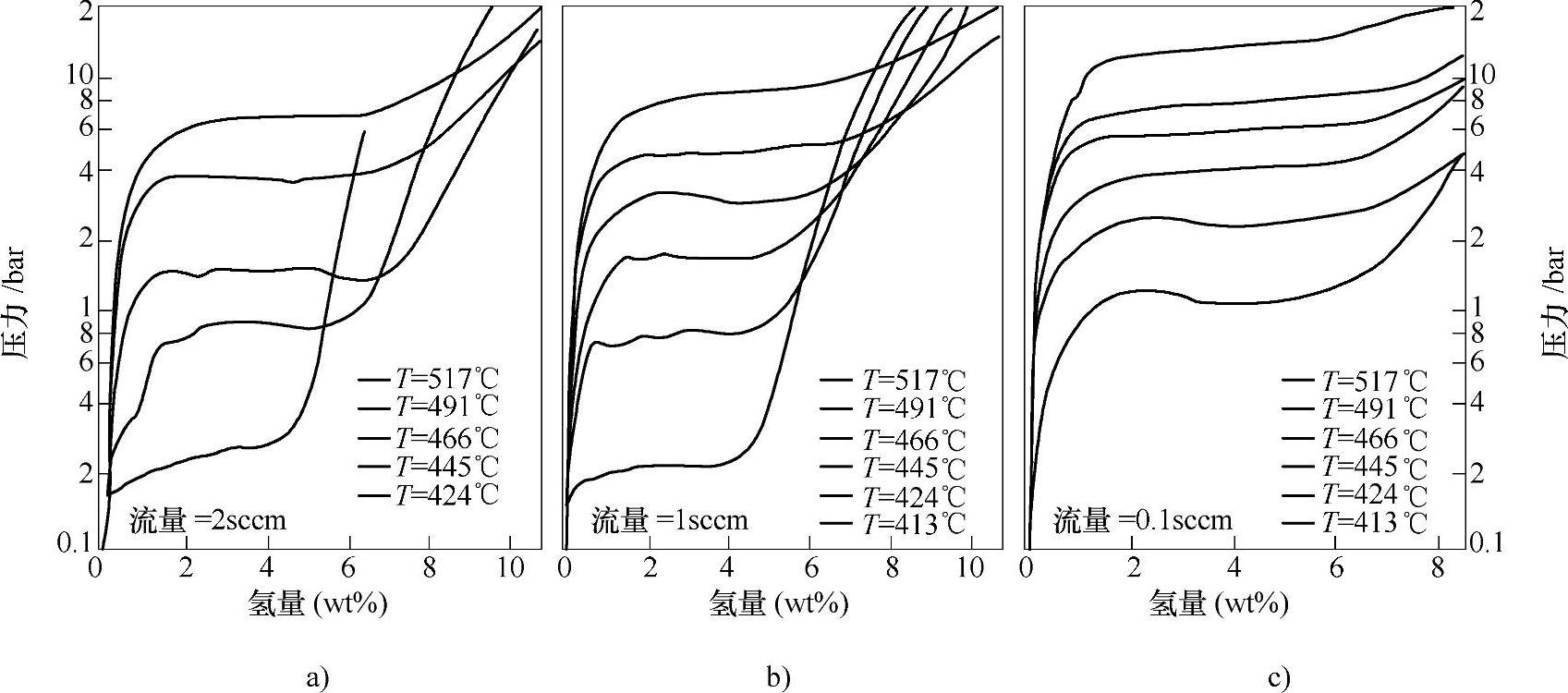
图9-39 不同流量下LiBH4的放氢PCT曲线[123]
a)2cm3/min b)1cm3/min c)0.1cm3/min
Mg(BH4)2的储氢密度为14.9wt%,其放氢反应(Mg(BH4)2→MgH2+B+3H2或Mg(BH4)2→MgB2+4H2)的焓变为39kJ/mol H2左右[130,131],这意味着Mg(BH4)2的理论放氢温度(Peq=0.1MPa时)在室温附近,可以达到质子交换膜燃料电池的使用要求。Mg(BH4)2的开始放氢温度在250℃左右,加热至500℃左右可放出全部14.9wt%的氢,如图9-40a所示;质谱分析表明,在Mg(BH4)2的分解过程中,没有释放出B2H6等有毒气体[132]。该分解过程伴随着中间相的生成,按多步反应进行,在DTA(见图9-40a)和质谱(见图9-40b)上分别观察到多个放氢峰。目前已证实MgB12H12是Mg(BH4)2分解过程中的中间相之一,如图9-41所示[133];第一性原理计算的结果表明,MgB12H12的最低能量结构具有C2/m(No.12)空间对称性[134]。
对Mg(BH4)2的可逆吸氢性能研究发现,在270~390℃和40~90MPa H2下吸氢48~72h后,Mg(BH4)2的再生率达到40%~66%,并且吸氢后产物中存在大量的Mg2B12H12;因此,Mg(BH4)2的可逆吸氢反应可能与MgB12H12中间相密切相关[135,136]。Mg(BH4)2可逆吸氢反应过程中焓变(ΔH)及活化能(EA)的示意图如图9-42所示,从热力学角度看,放氢产物(Mg或MgH2+B)的可逆吸氢反应,更易生成Mg(BH4)2;反应生成Mg(BH4)2和MgB12H12的焓变分别为39kJ/mol H2[130,131]和18~29.5kJ/mol H2[130,134]。从动力学角度看,Mg(BH4)2的生成必然伴随着硼(由B12二十面体团簇构成)中B-B键的断裂和B原子的移动;而MgB12H12中[B12H12]2-离子与B12具有相似的晶体结构,因此MgB12H12的生成不需要克服B-B键断裂及B原子移动所引起的动力学阻力,因而可逆吸氢反应中更倾向于生成MgB12H12。另一研究发现,将MgB2在400℃和90MPa H2下保持数天后可直接生成Mg(BH4)2[137];对MgB2进行机械球磨后,可以缩小晶粒尺寸和导入晶界等缺陷,有助于提高MgB2的吸氢能力[138]。
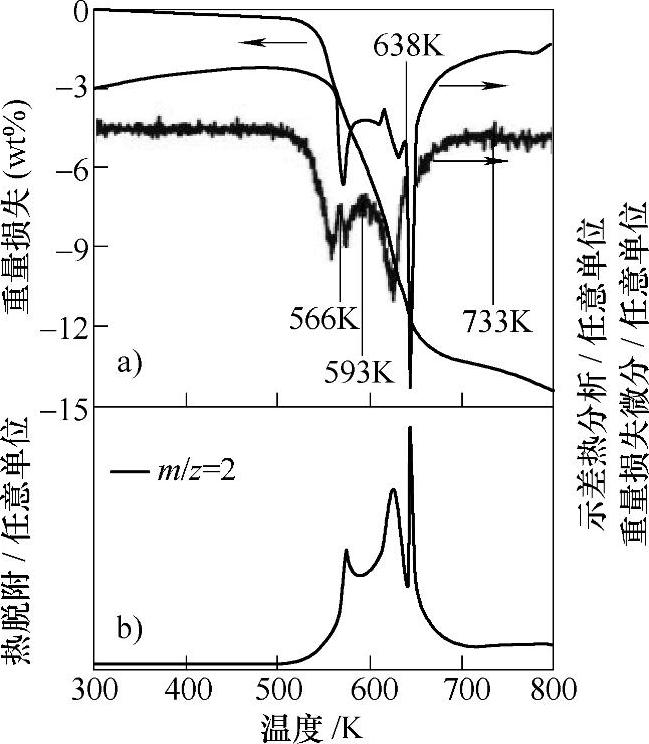
图9-40 Mg(BH4)2的分解反应[132]
a)热重(TG)和差热分析(DTA) b)质谱分析
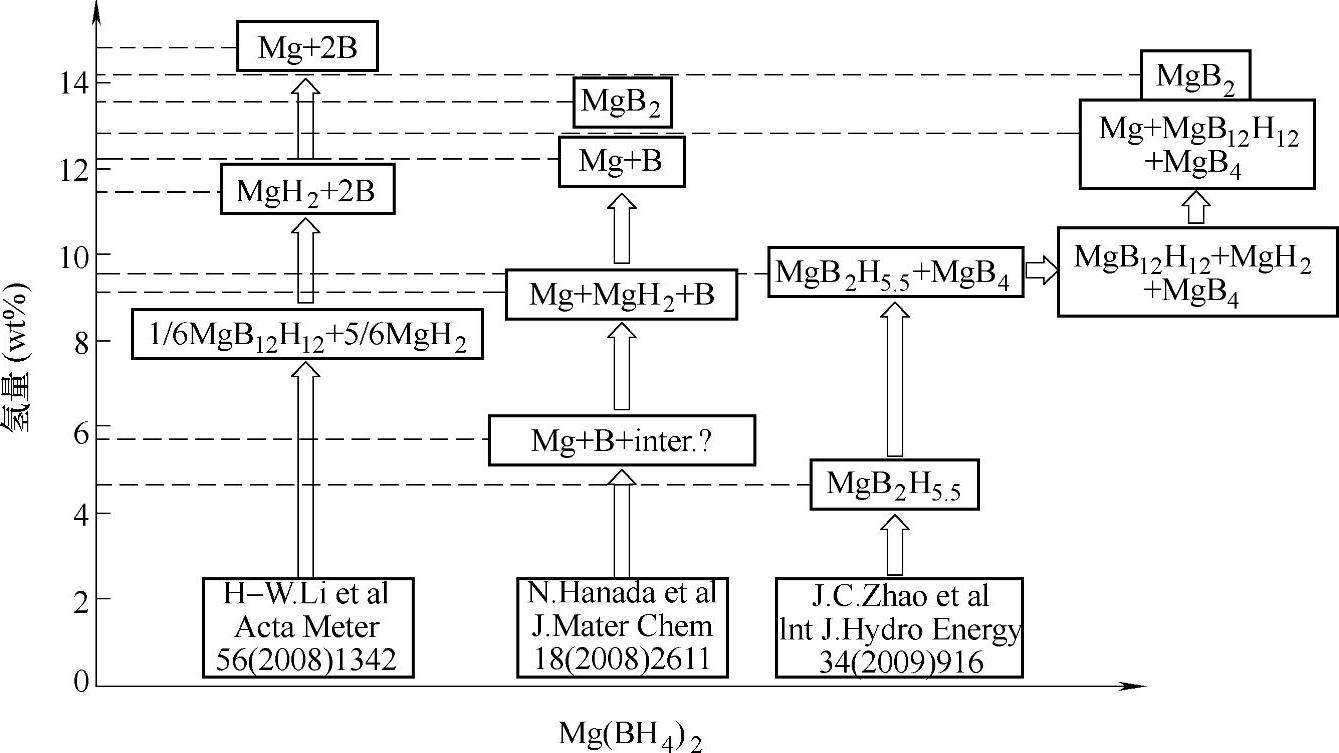
图9-41 Mg(BH4)2的分解过程示意图(www.daowen.com)
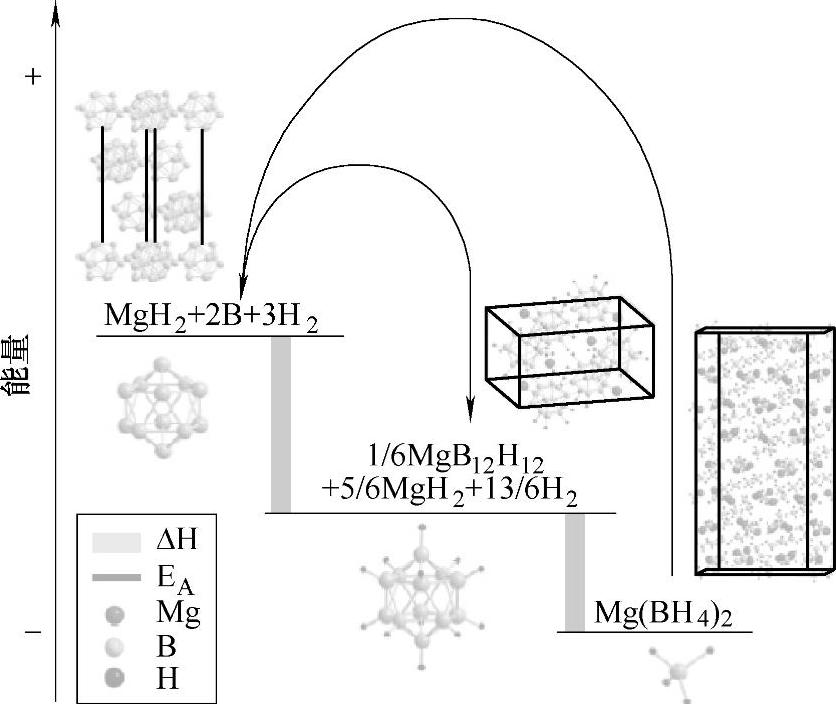
图9-42 Mg(BH4)2可逆吸氢反应过程中焓变(ΔH)及活化能(EA)的示意图[135]
Ca(BH4)2的储氢密度为11.5wt%,理论上预测其分解反应按式(9-51)进行[139],可放出9.6wt%的氢。实验上发现,Ca(BH4)2在330℃左右开始放氢,至520℃可放出9.0wt%的氢[140],这与式(9-61)的放氢量接近。在Ca(BH4)2的放氢过程中,出现了两个吸热峰,如图9-43所示,这意味着Ca(BH4)2的放氢通过多步反应进行,反应过程中伴随中间相的形成。一种中间相可能为CaB2Hx,高分辨同步辐射X射线衍射分析表明,它具有HgCl2型结构和Pnma空间对称性[141]。而平面波密度泛函理论计算结果表明,CaB2Hx的结构非常不稳定,且生成CaB2Hx的焓变过高(176kJ/mol H2)[196]。另一方面,实验和理论计算的结果均表明,CaB12H12更有可能是Ca(BH4)2分解过程中的一种中间相[134,142]。CaB12H12具有单斜结构,空间群为C2/c[143]。
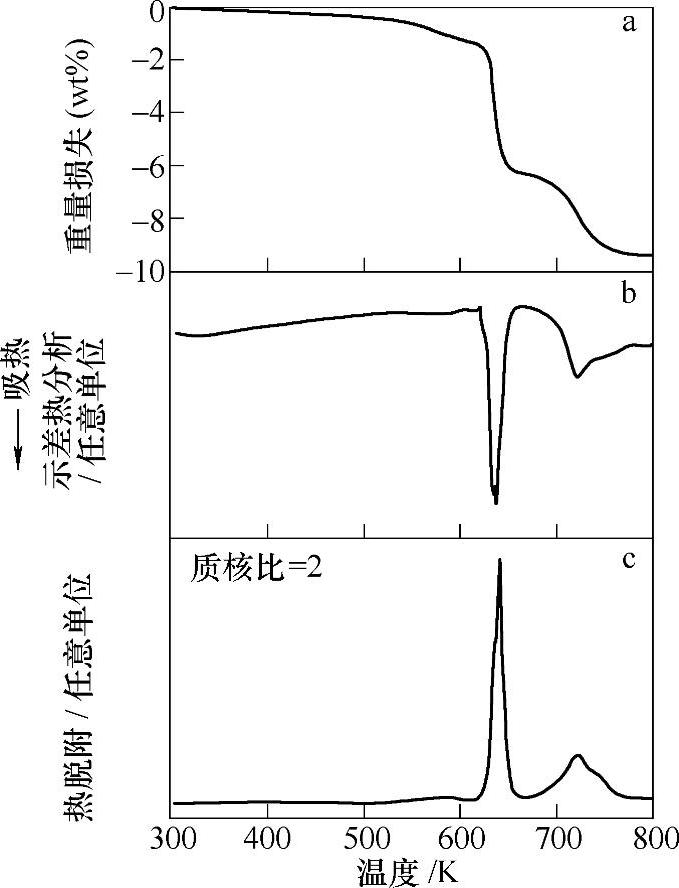
图9-43 Ca(BH4)2加热过程的热重(TG)(见a)、差热分析(DTA)(见b)和质谱(见c)[140]
Ca(BH4)2→2/3CaH2+1/3CaB6+10/3H2 (9-51)
在Ca(BH4)2的可逆吸氢性能方面还没有系统的报道。可逆吸氢过程中生成的稳定CaB12H12中间相,不利于Ca(BH4)2的生成[144]。CaB12H12和CaH2的混合物,经过机械球磨后,在100MPa H2和400℃下不能反应生成Ca(BH4)2[145]。通过添加催化剂,57%的Ca(BH4)2可在350℃和10MPa H2下经过可逆吸氢反应生成[146]。
Y(BH4)3的理论储氢密度为9.1wt%,在190℃左右开始分解放氢,加热至500℃,可放出约7.8wt%的氢,该值与式(9-52)的理论放氢量接近[147]。分解过程是一个多步反应,伴随中间相得生成。Y(BH4)3分解后,在300℃和35MPa H2下吸氢24h,可逆吸氢容量为1.1wt%~1.3wt%。
Y(BH4)3→YH2+3B+5H2 (9-52)
其他金属硼氢化物M(BH4)n(M=Zn、Al、Ti、Zr等)[148,151],熔点较低,分解过程中通常生成B2H6,如式(9-53)~式(9-55)所示;它们的放氢反应一般不可逆。
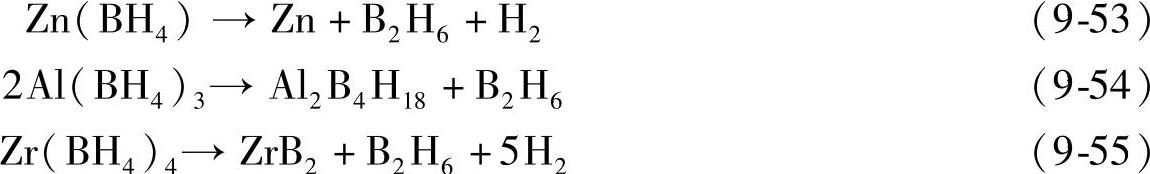
以上对单金属元素M(BH4)n吸放氢性能进行了介绍,并归纳在表9-7中。M(BH4)n可归纳为两类:碱金属、碱土金属及稀土金属硼氢化物,它们具有较高的热力学稳定性,放氢通过多步分解反应进行,作为可逆储氢材料具有较高的潜力,但是高的可逆吸放氢温度和缓慢的动力学性能使它们的应用受到了极大的限制;Zn、Al、Ti和Zr等金属硼氢化物,它们具有较低的熔点,放氢反应中易生成B2H6等有毒气体,因此不适合作为可逆储氢材料。
表9-7 M(BH4)n的基本吸放氢性能
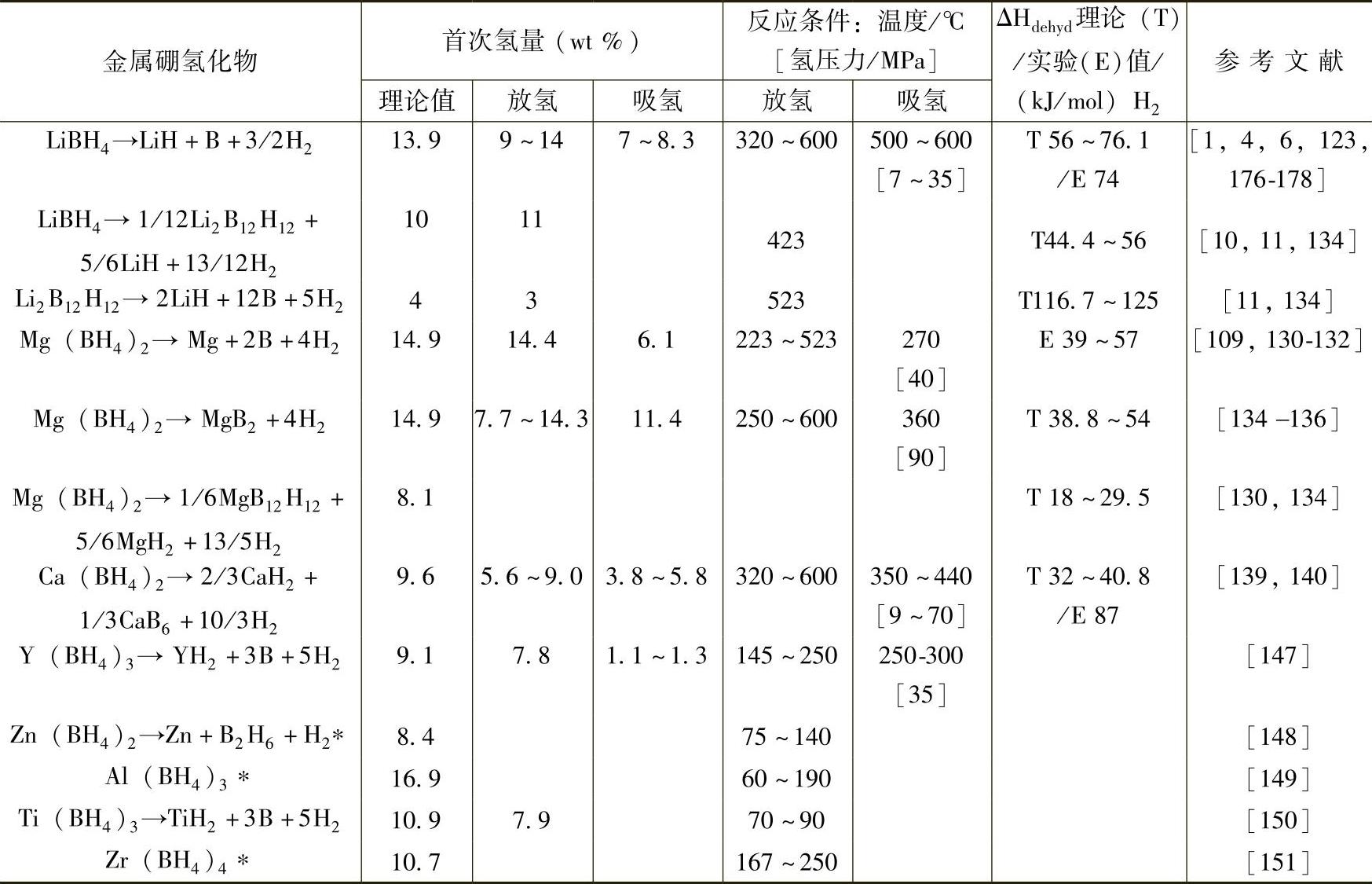
注:*表示分解过程中释放B2H6。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







