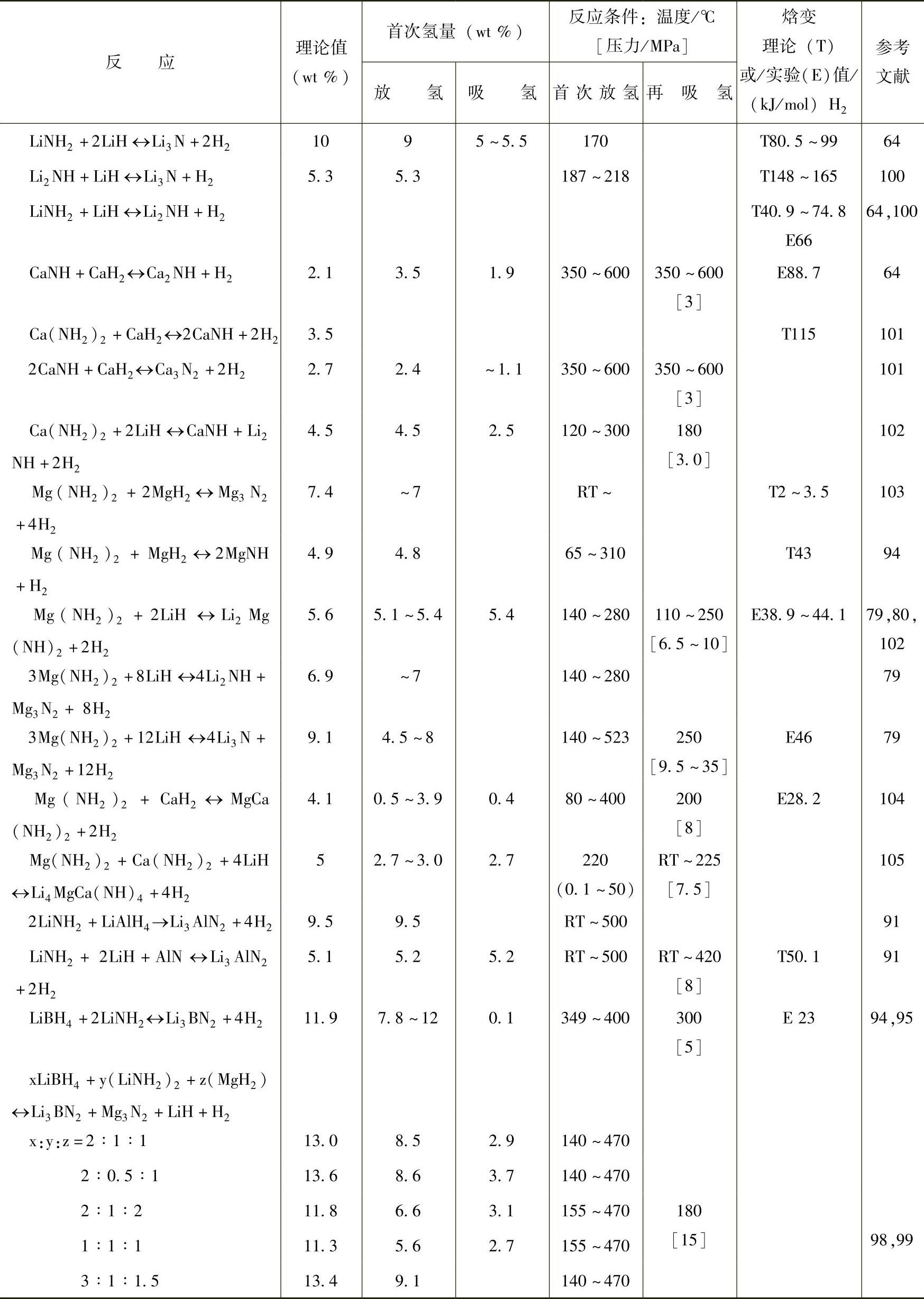
一些主要金属氮氢化合物的可逆吸放氢性能及生成焓等参数已归纳于表9-5中。
LiNH2的吸放氢反应按式(9-32)进行[64]。反应①和②的放氢量分别为5.5wt%和5.2wt%,反应①焓变为66kJ/mol H2,整个反应(①+②)的生成焓为80.5kJ/mol H2。在真空气氛下,反应①在150℃以上开始进行。
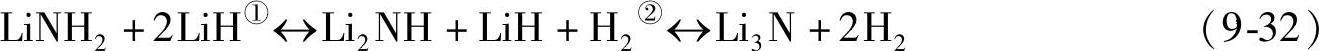
LiNH2/LiH体系的放氢机制,主要有以下两种学说:LiNH2-LiH间的协同作用机制[76]。这种机制反应机制认为,LiNH2中的H呈电正性(Hδ+),LiH中的H呈电负性(Hδ-),Hδ+与Hδ-氧化还原生成H2,与此同时LiH中的Liδ+与Nδ-结合形成Li2NH;氨气媒介机制[77]。根据这种机制,LiNH2首先分解生成Li2NH,并放出NH3;NH3与LiH快速反应生成LiNH2和H2,如式(9-33)和式(9-34)。

与LiNH2相比,Mg(NH2)2可在更低的温度下分解放出NH3;根据NH3媒介反应机制,Mg(NH2)2/LiH复合体系可能具有更低的放氢温度。将Mg3N2和Li3N按1∶4(摩尔比)混合后,在250℃、35MPa H2下吸氢,可生成Mg(NH2)2/4LiH复合体系[78],其放氢反应按式(9-35)进行,理论放氢量为9.1wt%;200℃下,可放出4.4wt%的氢,反应温度明显低于LiNH2/LiH,如图9-23所示;通过PCT测试,得到式(9-35)的焓变为46kJ/mol H2,低于LiNH2/LiH体系的反应焓(66kJ/mol H2)。
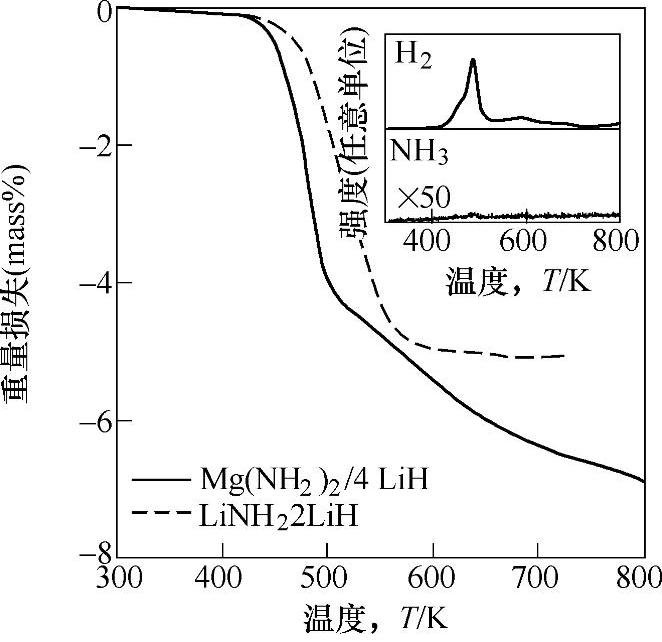
图9-23 Mg(NH2)2/4LiH复合体系放氢反应的热重分析曲线;插图是反应过程中的质谱分析结果[79]
注:图中虚线表示LiNH2/LiH体系的放氢反应。升温速度为5K/min,气氛为He。
通过调节Mg(NH2)2与LiH的组成比,可以改变体系的反应过程,如图9-24所示。3Mg(NH2)2/8LiH和Mg(NH2)2/2LiH复合体系,理论放氢量分别为6.9wt%和5.6wt%,总反应如式(9-36)和式(9-37)。Mg(NH2)2/2LiH复合体系可在120~250℃之间放氢(见图9-25);其可逆吸放氢反应可在9MPa H2、100~200℃下进行;基于PCT测试,反应式(9-37)的焓变可估算为38.9kJ/mol H2,由此可推算出该反应在0.1MPa H2下的理论放氢温度可达90℃[80]。
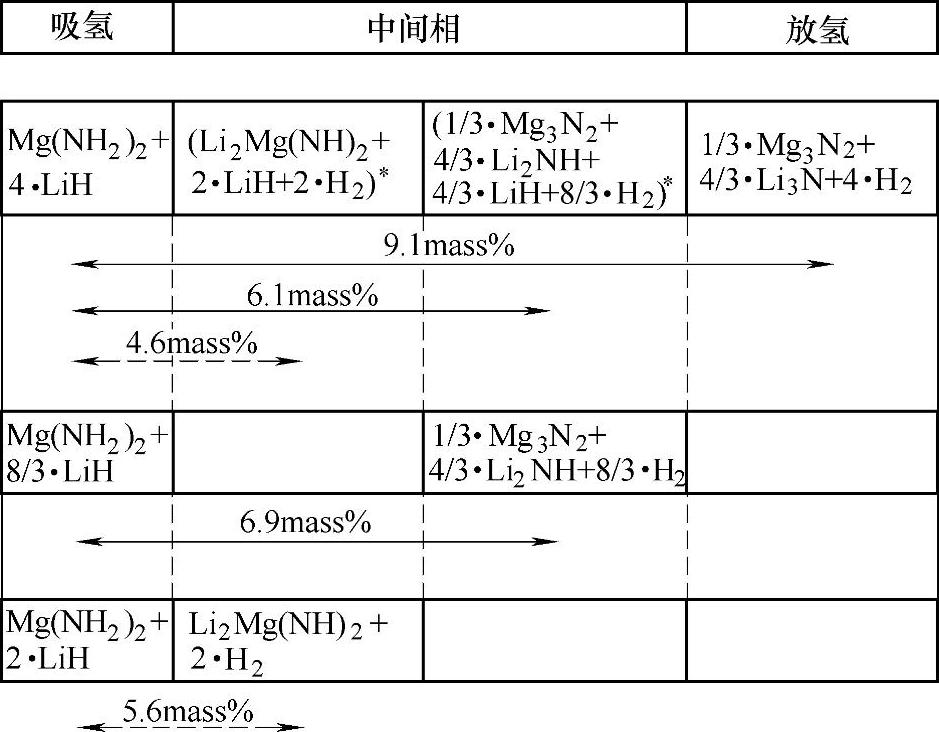
图9-24 不同组成比Mg(NH2)2与LiH的可逆吸放氢反应过程[79](表示可能出现的中间相)
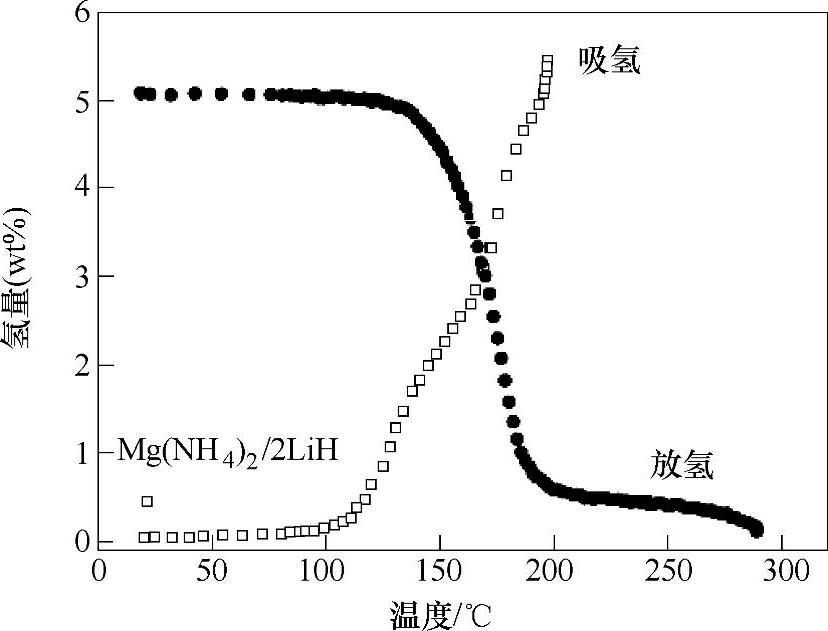
图9-25 Mg(NH2)2/2LiH复合体系的吸放氢曲线[80]
注:放氢条件为真空,2℃/min;吸氢条件为9MPa H2,25~200℃。
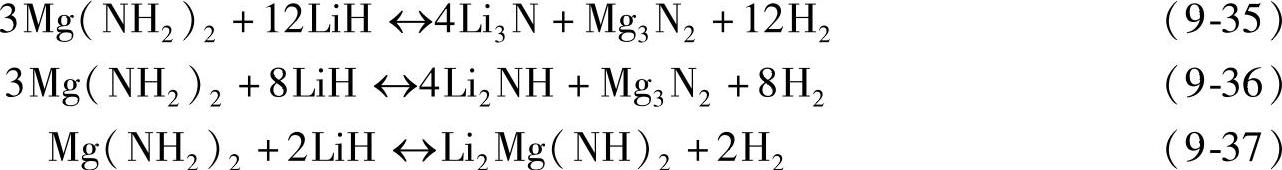
实际上,Mg(NH2)2/2LiH体系的放氢反应至少在120℃以上才开始发生[80],其原因主要归属于较高的活化能(88kJ/mol)。通过研究反应物颗粒尺寸对吸放氢动力学的影响发现,Mg(NH2)2/2LiH体系的反应受扩散机制控制,Li+、H+、H-等离子的迁移可能是反应的控制步骤[81,82]。中间相的生成也可能是导致动力学缓慢的另一个重要因素。例如,Li2Mg(NH)2在吸氢过程中可能先生成Li2Mg2(NH)3中间相和LiNH2,然后再生成LiH和Mg(NH2)2,反应如式(9-38)和式(9-39)所示;中间相生成过程中伴随的原子迁移和结构重构,可能成为吸放氢反应的动力学障碍。另有研究发现,Mg(NH2)2/2LiH体系的反应与Li+的扩散有很大的关联,反应机制如图9-26所示[83]。Li+首先从LiH中扩散到Mg(NH2)2晶体中,使[NH2]-分解为[NH]2-和H+;生成的H+离子与LiH中的H-离子结合生成H2。再吸氢反应过程则与之相反。
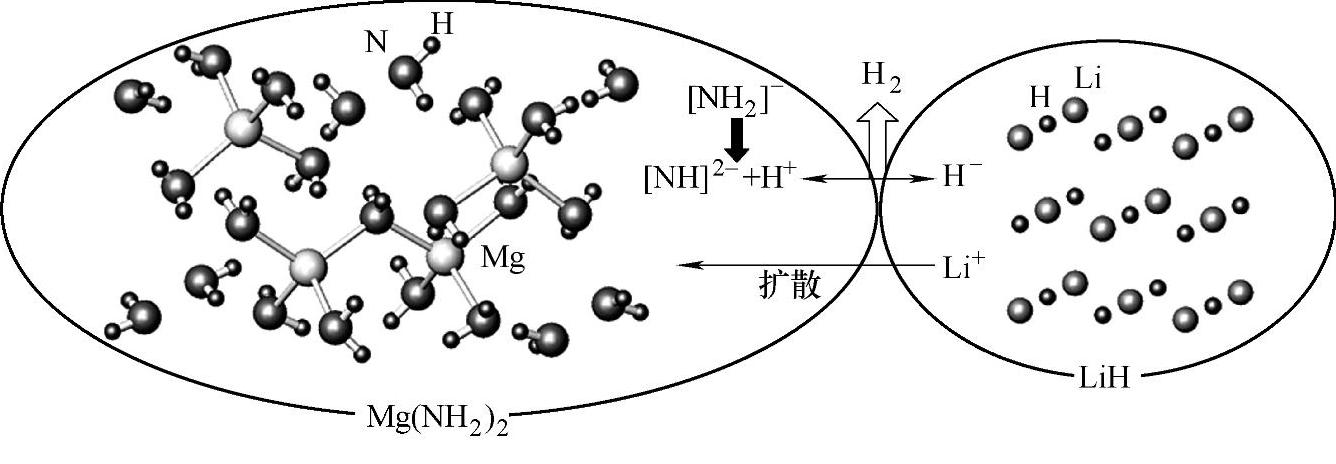
图9-26 Mg(NH2)2+LiH体系放氢过程示意图[83]
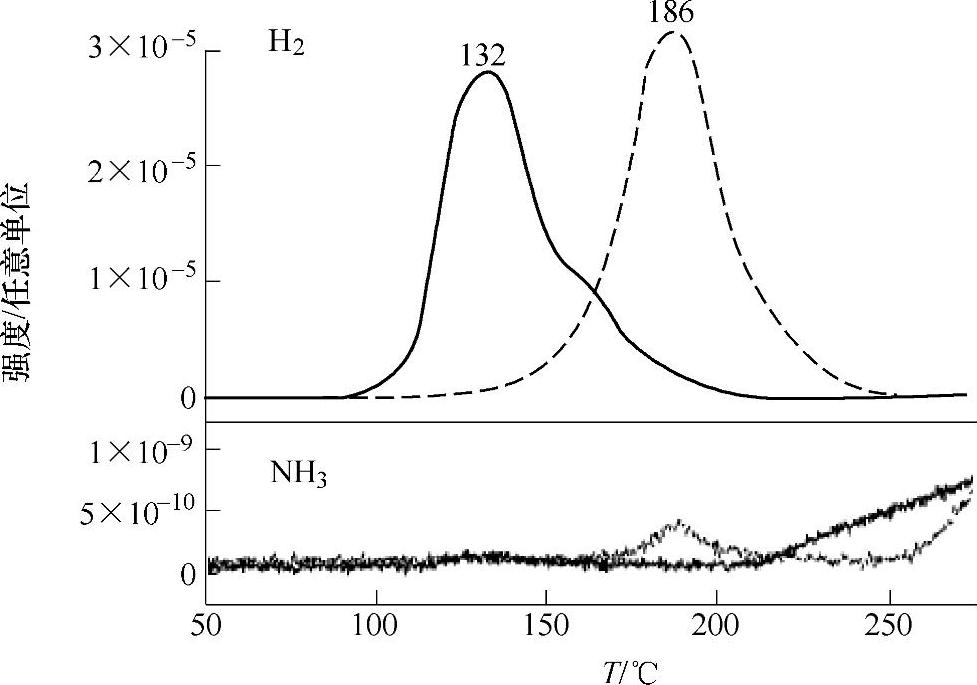
图9-27 添加3mol%KH的Mg(NH2)2/2LiH(实线)和未添加的Mg(NH2)2/2LiH(虚线)的放氢质谱分析[87]
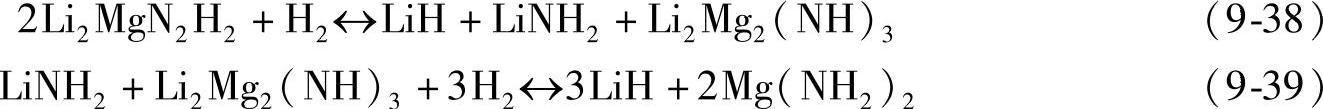
通过添加催化剂[84-87],可以降低Mg(NH2)2/2LiH体系的活化性能,从而提高反应动力学性能,降低放氢温度。在Mg(NH2)2/2LiH中添加10wt%的Li2Mg(NH)2后[84],反应温度降低了40℃;分析认为,Li2Mg(NH)2起到了形核剂的作用,从而促进了界面反应,降低了活化性能(从88.0降至76.2kJ/mol)。以石墨为载体的纳米金属铑(Ru/C)是一种良好的催化剂,能够促进Mg(NH2)2/2LiH的界面反应和N-H键的再生成,因而可同时提高放氢和可逆吸氢性能[85]。添加少量的LiBH4(0.02~0.1mol%)[86],也能有效降低Mg(NH2)2/2LiH的活化能,提高反应动力学。最近,陈萍等[87]发现,在Mg(NH2)2/2LiH中添加3mol%的KH,使得反应开始温度降低了约50℃,即在80℃左右可开始放氢;有毒气体NH3的生成也得到很大的抑制(见图9-27)。同时,Mg(NH2)2/2LiH的再吸氢反应动力学也得到很大的提高,在3MPa H2、143℃下,12min的吸氢量可达到总量的75%;在相同条件下,未添加KH的试样需要20h以上才能达到相同的吸氢量。分析认为,添加KH后,有助于减弱Mg(NH2)2中的N-H键的结合强度,促进原子的迁移,从而提高了动力学性能。
通过缩小反应物的尺寸,可有效提高Mg(NH2)2/2LiH体系的反应动力学性能[88]。不同粒径(100nm、600nm和2μm)的Mg(NH2)2如图9-28(左)所示。随着Mg(NH2)粒径的减小,Mg(NH2)2/2LiH的放氢动力学性能明显提高。反应的活化能随着Mg(NH2)粒径的减小而明显降低,且与Mg(NH2)2粒径之间呈现很好的线性关系,如图9-28(右)所示。反应物尺寸越小,表面积越大,原子的扩散距离越短,因而有助于提高反应速度。(https://www.daowen.com)
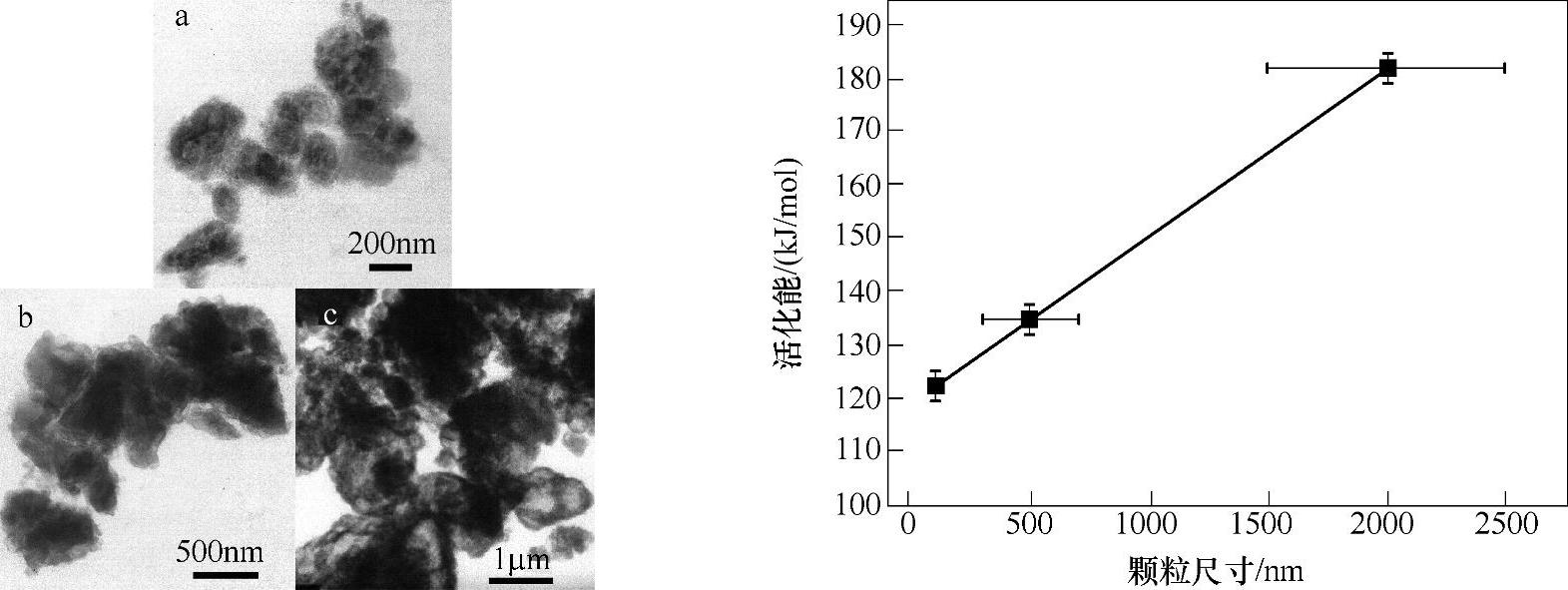
图9-28 左图为不同Mg(NH2)2粒径的TEM照片,其中试样a、b、c的平均粒径分别为100nm、600nm和2μm;右图为Mg(NH2)2/2LiH体系放氢反应中,活化能与Mg(NH2)2颗粒尺寸之间的关系[88];不同Mg(NH2)2粒径的复合体系中,LiH的平均粒径相同
图9-29表示Mg(NH2)2/2LiH体系在200℃下的循环放氢性能。270次循环后,放氢量衰减了25%;其中,由于NH3的释放引起的容量衰减为7%,其余的容量衰减原因尚不清楚。在Mg(NH2)2/LiH体系中,放氨反应的开始温度要高于放氢反应,随着温度升高,NH3浓度会逐渐增加[89,90],180℃下NH3浓度为180ppm,240℃下升高至720ppm。
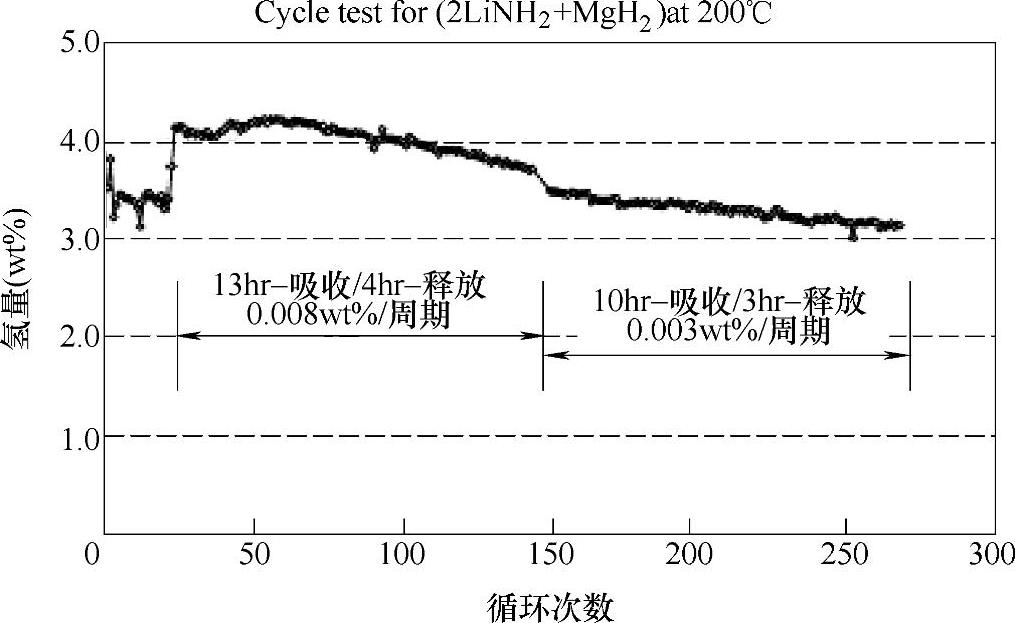
图9-29 200℃下,Mg(NH2)2/2LiH的循环放氢性能[89,90]
LiNH2/LiAlH4(摩尔比1:1和2:1)混合物在球磨过程中就可直接放氢[91]。2LiNH2/LiAlH4的放氢反应分两步进行,总的放氢量为9.5wt%,如式(9-40)所示。分解产物Li3 AlN2吸氢后不能生成LiNH2和LiAlH4,而是生成AlN、LiH和LiNH2,吸氢量为5.1wt%左右(见图9-30)。NaNH2/LiAlH4体系(摩尔比1:1)[92],在球磨过程中也可快速放氢,10min内放出2mol H2(每摩尔混合物);然而,该系统的放氢反应是个放热过程,热力学上是不可逆的。
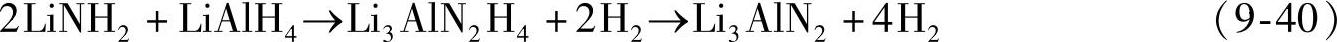
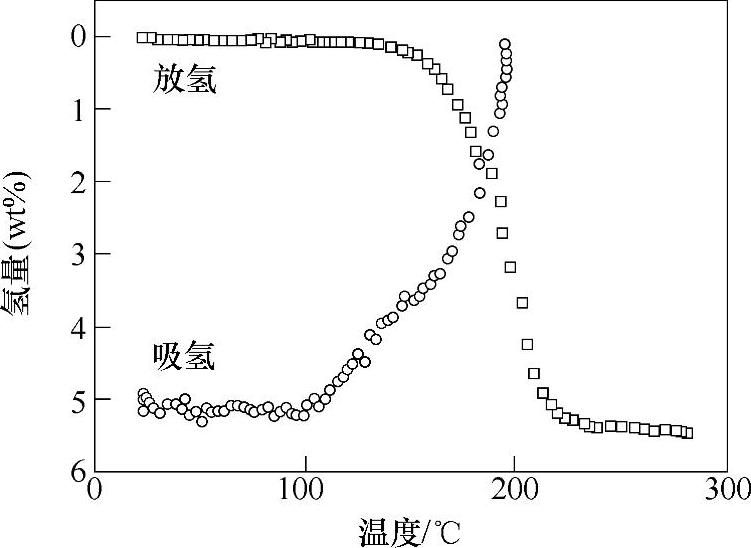
图9-30 Li3AlN2的吸放氢曲线[91]
对不同组成比LiNH2/LiBH4体系的研究表明,当LiNH2与LiBH4摩尔比为2∶1时,可以得到最大的放氢量和最小的放氨量[93]。2LiNH2/LiBH4体系(即Li3BN2H8)的理论放氢量为11.9wt%,在250℃开始分解放氢,反应后生成Li3BN2[94,95],如式(9-41);放氢过程中会释放少量的氨气;放氢产物在300℃、5MPa H2下吸氢,吸氢量仅为0.1wt%。通过添加催化剂,能有效的降低2LiNH2/LiBH4体系的放氢温度,减少有毒气体NH3的生成。例如添加5wt%的CoCl2或NiCl2等[96],可使反应温度降低约100℃,如图9-31所示。将2LiNH2/LiBH4填充到纳米孔(孔径为13nm的碳凝胶),体系的可逆吸氢量(300℃、5MPa H2)可提高至3.8wt%[97]。
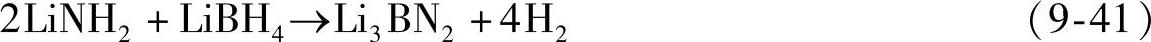
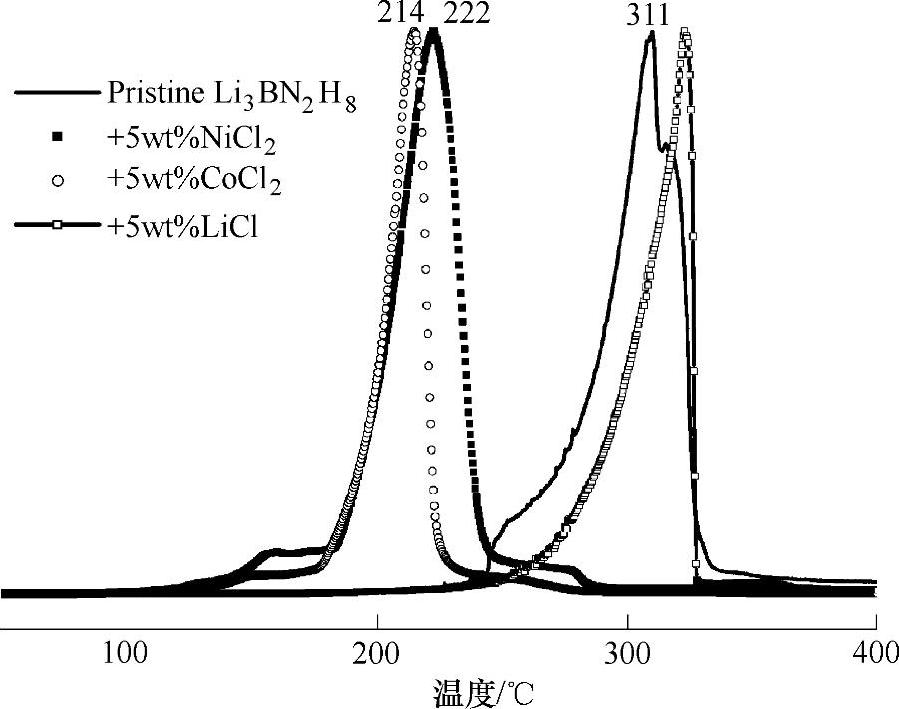
图9-31 添加5wt%的CoCl2、NiCl2、LiCl对Li3BN2H8的TPD(程序升温放氢)曲线[96]
2LiNH2/LiBH4/MgH2(摩尔比2∶1∶1)的多元复合体系,在加热过程发生级联反应如图9-32所示。3LiNH2与LiBH4在球磨过程中首先生成Li4 BN3 H10,Li4 BN3 H10在加热初始阶段(~100℃)与MgH2反应生成Li2Mg(NH2)2,并放出少量的氢,如式(9-42)。生成的Li2Mg(NH2)2可作为后续Mg(NH2)2与2LiH之间反应的形核剂,从而使反应式(9-43)的反应温度降低至110℃;反应式(9-43)也是2LiNH2/LiBH4/MgH2复合体系的主要可逆吸放氢反应。通过这种级联反应模式,2LiNH2/LiBH4/MgH2在180℃下10min内放氢量可达3wt%左右(见图9-33),180℃下、15MPa H2下吸氢量为2.5wt%。通过成分优化,发现组成比为2∶0.5∶1时,180℃下的放氢量增加至3.7wt%,可逆吸氢量达到3.5wt%(见图9-33)。表9-5为金属氮(N)氢化物的吸放氢性能。
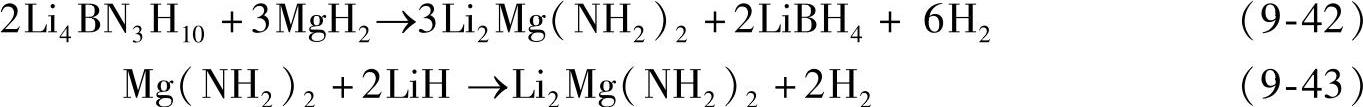
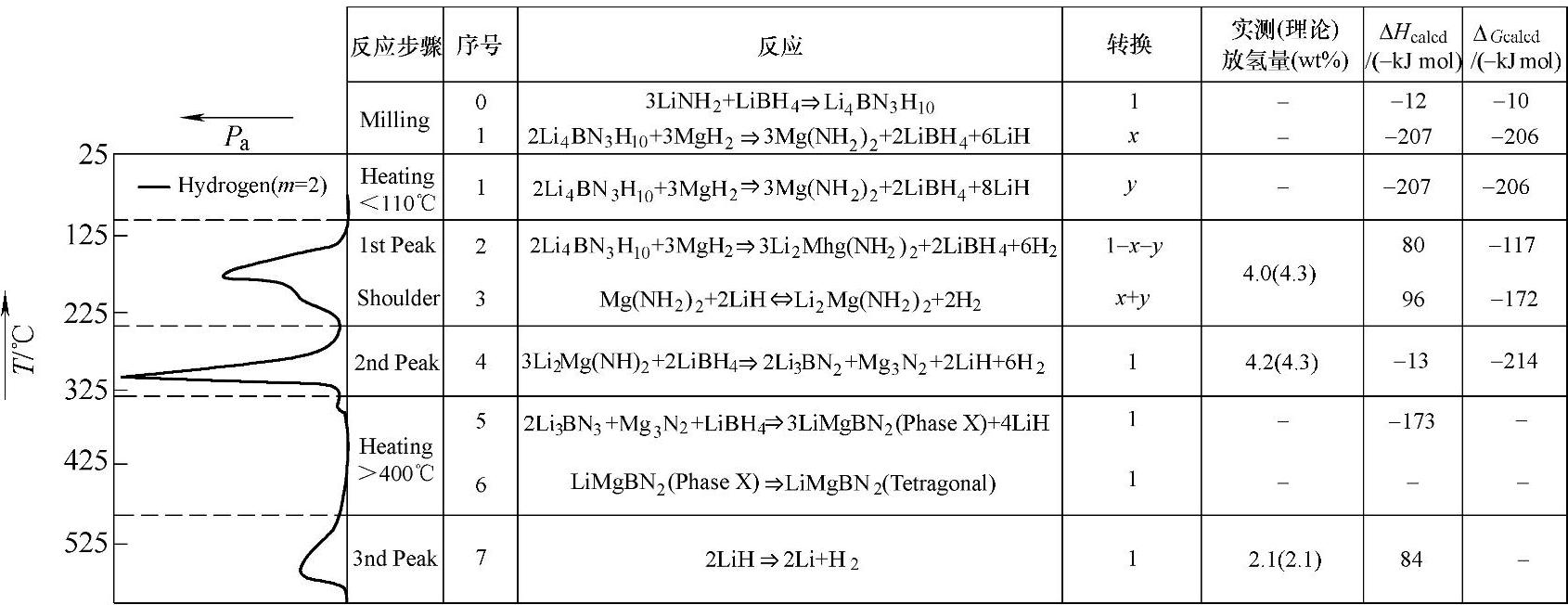
图9-32 2LiNH2/LiBH4/MgH2的级联反应过程[98]
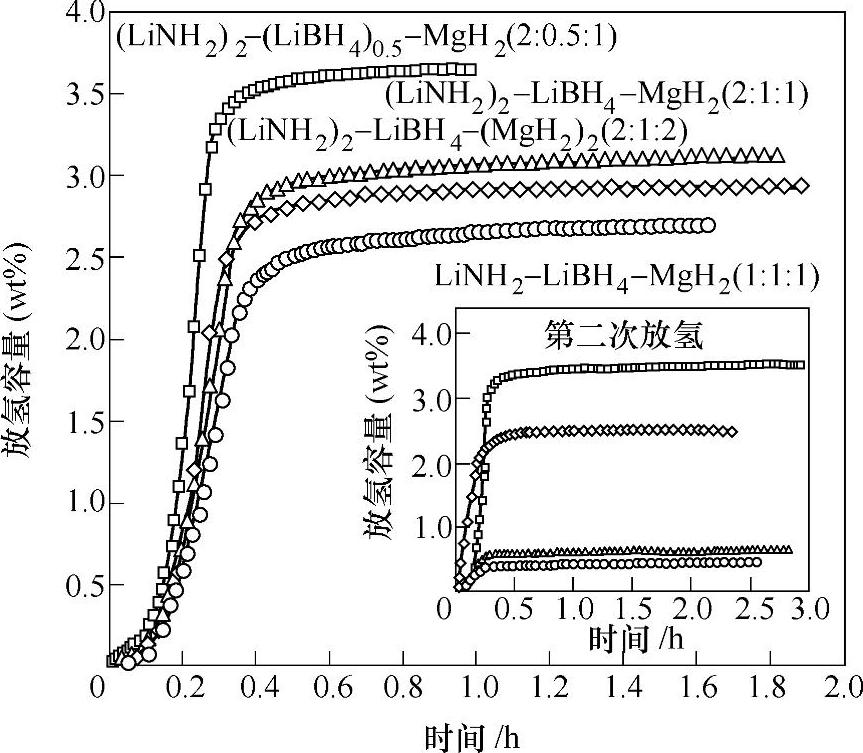
图9-33 LiNH2/LiBH4/MgH2复合体系在180℃下的等温吸放氢性能[99]
注:放氢:0.1MPa H2为背压;吸氢:15MPa H2。
表9-5 金属氮(N)氢化物的吸放氢性能
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






