催化剂的掺杂方法主要有两种。湿法掺杂。在NaAlH4二乙醚溶液中添加Ti基化合物,如Ti(Obutyl)4、β-TiCl3等,在二乙醚蒸发后即可得到掺杂的NaAlH4。干法掺杂。利用机械球磨的方法添加催化剂[47]。催化剂在球磨过程中均匀分散到试样表面。相比湿法掺杂,干法掺杂得到的试样粒径更小,有利于可逆吸放氢反应的进行,因而试样可能具有更低的开始放氢温度,如图9-14所示。
纳米Ti颗粒(如Ti·THF)[48]具有非常优异的催化性能。添加纳米Ti的NaAlH4,其放氢产物在10MPa H2、115~140℃下进行可快速吸氢(见图9-15),第3次循环,反应产物在15min内的吸氢量达到4.6wt%。然而这种纳米催化剂的合成工艺非常复杂,成本很高;随着循环次数的增加,可逆吸放氢容量会逐渐衰减。
近来研究表明ScCl3、CeCl3和PrCl3可能具有比TiCl3更优越的催化性能[49,50]。例如,掺杂2mol%ScCl3的NaAlH4放氢后[49],能在9MPa H2下快速吸氢,20min内吸氢达到90%;掺杂CeCl3的NaAlH4放氢后,在120℃、11MPa H2下,20min内可基本达到吸氢饱和(见图9-16),
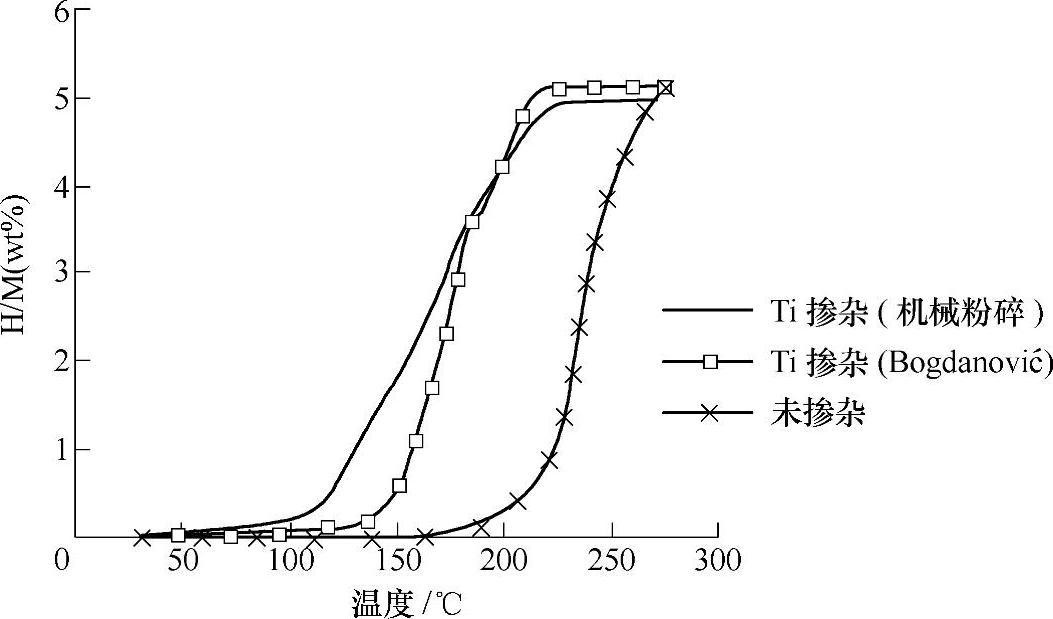
图9-14 Ti掺杂与不掺杂的NaAlH4的热分解曲线(2℃/min)[47]
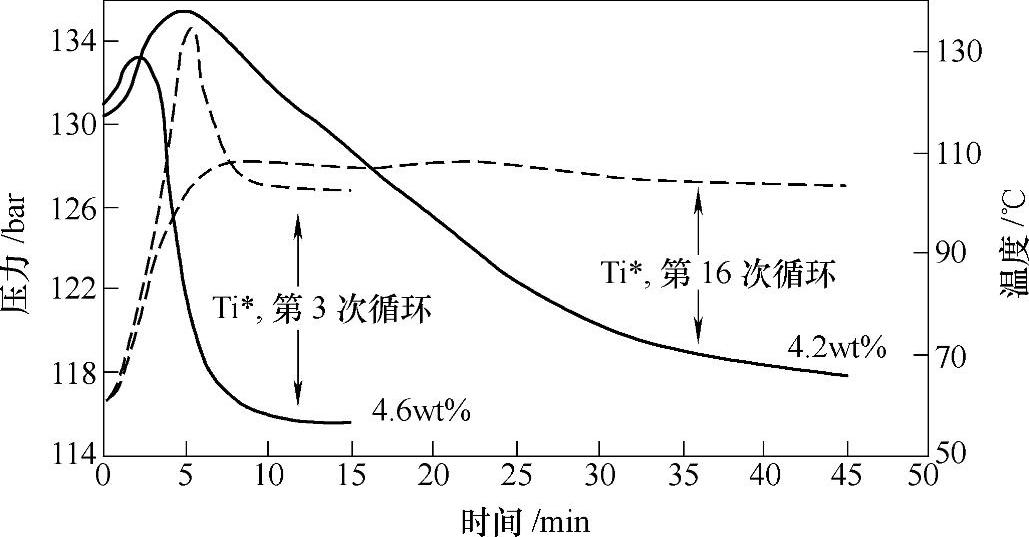
图9-15 Ti掺杂与不掺杂的NaAlH4的热分解曲线(2℃/min)[48]
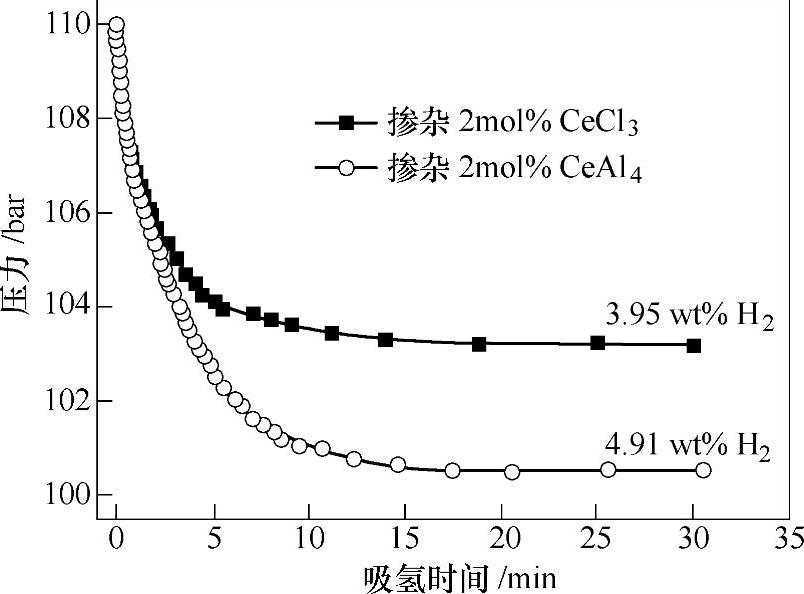
图9-16 Ti掺杂与不掺杂的NaAlH4的热分解曲线(2℃/min)[78]
在16次循环内,容量基本未见衰减[50]。其他过渡金属(如V、Zr、Fe、Ni等)的化合物对NaAlH4可逆吸放氢性能的催化效果不如Ti基化合物。不同种类的Ti基催化剂,如TiCl2、TiF3、TiBr4和TiH2,对NaAlH4的催化效果相似。Ti基化合物对其他配位Al氢化物(如Na2 LiAlH4、LiAlH4和Mg(AlH4)2等),也有良好的催化作用[3,18,43,44],如降低初始放氢温度、提高放氢速率和循环性能等。
含金属Ti粉的Na和Al混合物,在0.8MPa H2下球磨10h后,在120℃下可以快速吸氢生成NaAlH4[51]。通过这种方式合成的NaAlH4具有很好的循环稳定性,在10次循环内,其放氢容量基本没有衰减(见图9-17左);相比之下,直接掺杂金属Ti粉的NaAlH4,放氢容量衰减很快(见图9-17右)所示。将NaH+Al+4mol%TiCl3的混合物在8MPa H2下球磨,混合物在50℃下就开始吸氢,1.5h后吸氢达到饱和;通过这种方法,只需一步反应即可合成NaAlH4,如式(9-24),并且反应温度低(50~70℃)、时间短[52]。(https://www.daowen.com)
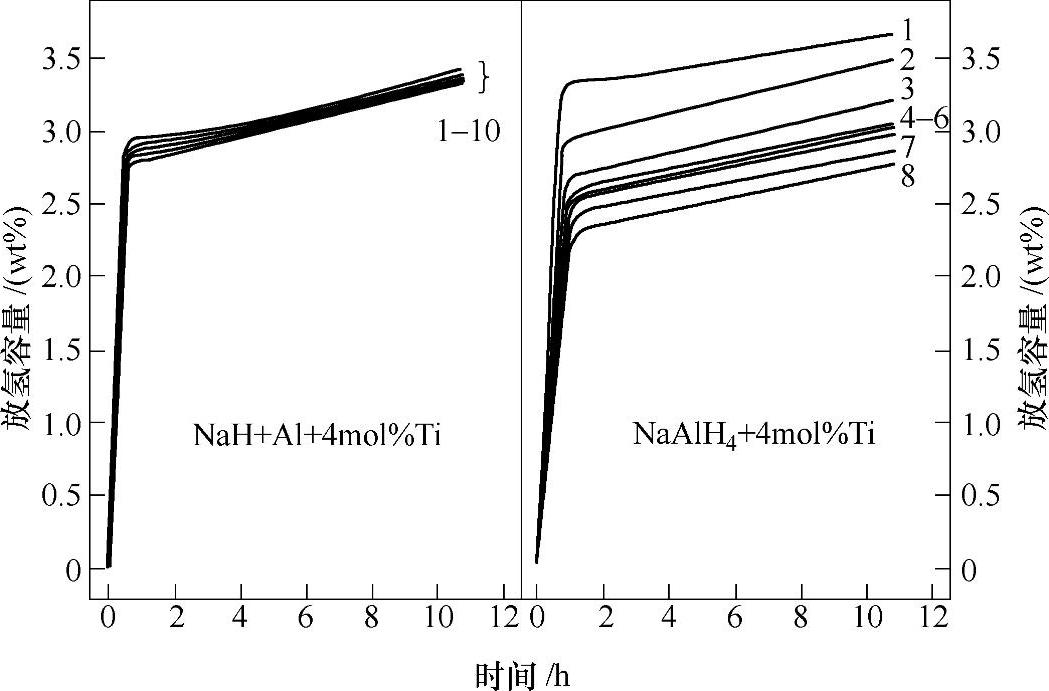
图9-17 150℃下,NaH+Al+4mol%Ti和NaAlH4+4mol%Ti的循环放氢性能对比[51]
注:这两种试样均在0.8MPa H2气氛下球磨10h。

Ti基催化剂的作用机制一直是一个热门研究话题。目前,普遍认为,Ti基化合物在反应过程中会被还原成金属态的Ti或TiAlx[55-59],如式(9-25);并且,这种转变与Ti基化合物的初始状态无关[57]。通过X射线衍射[55,56],在4LiAlH4/TiCl4和3NaAlH4/TiCl3的球磨产物中观察到了TiAl3的生成;但是催化剂含量较低时(如10mol%或更低)[56],X射线衍射并没有观察到TiAl3的生成,此时Ti可能以非晶态存在,分散于金属Al的表面。采用X射线吸收对Ti掺杂的NaAlH4的研究进一步证实[58],在反应过程中Ti的价态是零价,并且在吸放氢循环过程中一直保持不变;在微区结构上,Ti以非晶体TiAl3存在[57],分散于NaAlH4表面,从而对其可逆吸放氢起催化作用。
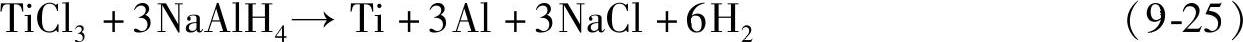
虽然Ti基化合物在吸放氢过程中的存在方式已经比较清楚,但是其催化机制目前仍然存在争议。一种观点认为,Ti基催化剂有利于H2的脱附和金属原子的迁移[59],然而金属钯(Pd)这类对氢的脱附具有高催化活性的催化剂,对NaAlH4的可逆吸放氢的催化性却能远低于Ti基催化剂[60]。TiCl3的添加不仅改善了NaAlH4的吸放氢动力学性能,而且改变了热力学性质[61];不同TiCl3添加量的PCT曲线,如图9-18所示,随着TiCl3量的增加,氢的分解压力逐渐升高,这表明添加TiCl3后NaAlH4的可逆吸放氢焓变发现了变化。这一发现暗示,催化剂可能影响的是Al基析出物(如AlH3)的热力学性质及分解压。在前文(9.3.3节)中已经提到,NaAlH4的分解及合成通过AlH3(或AlH3空位)的生成和扩散来完成的。因此,Ti基催化剂可能是通过促进NaAlH4表面AlH3的分解和AlH3空位的形成,来实现对NaAlH4可逆吸放氢反应的催化作用[37]。
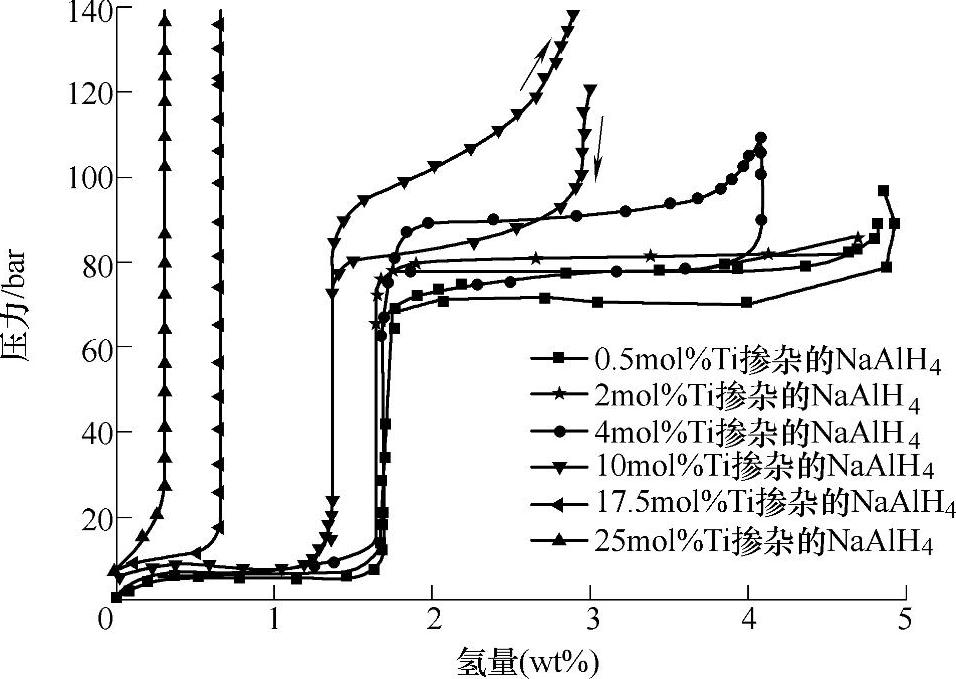
图9-18 添加不同TiCl3量(0.5mol%、2mol%、4mol%、10mol%、17.5mol%、25mol%)的NaAlH4的PCT曲线[91]
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






