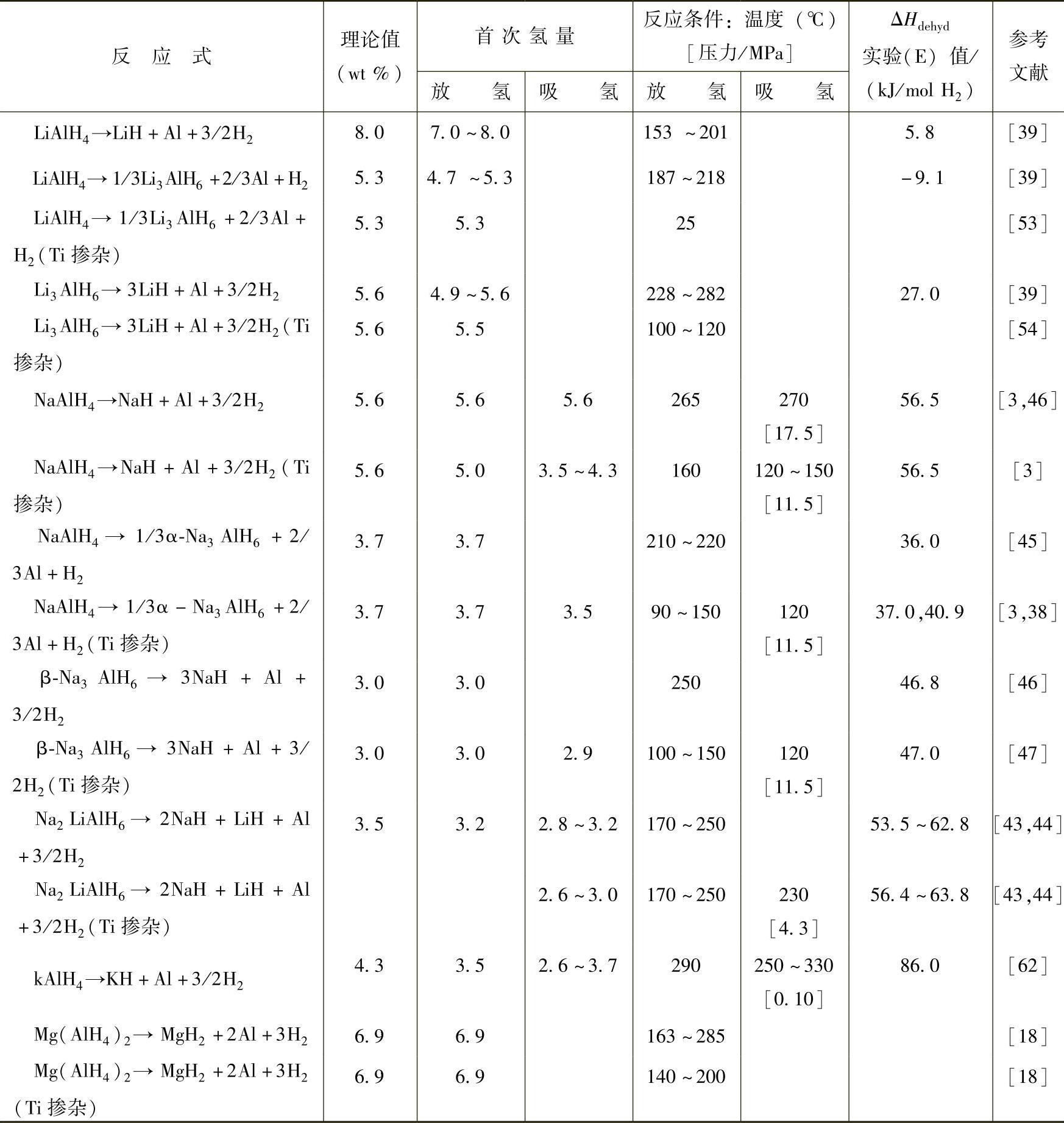
一些主要配位铝氢化物的可逆吸放氢性能及反应焓变等参数已归纳于表9-4中。以下分别介绍其可逆吸放氢性能及反应机理。
NaAlH4的放氢过程通过以下3步放热反应进行[3]:
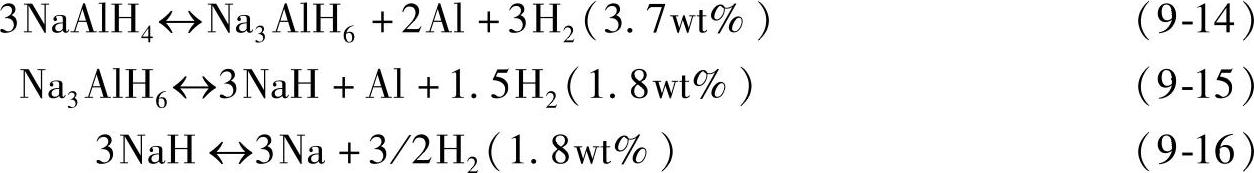
反应式(9-14)和式(9-15)分别在210℃和250℃下进行,合计放氢量为5.5wt%;NaH的分解温度在400℃以上,因此其有效放氢量为5.5wt%。在图9-9所示的放氢PCT曲线中(150~199℃),可清楚观察到NaAlH4的多步反应过程:图中高压区平台(右侧)对应于反应式(9-14),低压区平台(左侧)对应于反应式(9-15);在150~199℃范围内,NaH不分解。
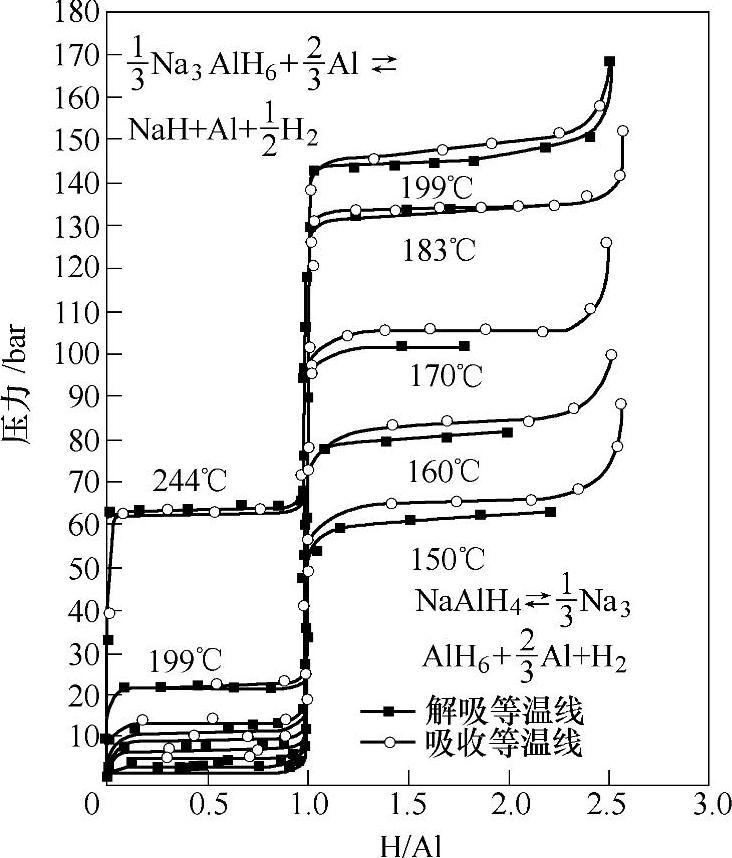
图9-9 NaAlH4的压力-成分-温度(PCT)曲线[31]
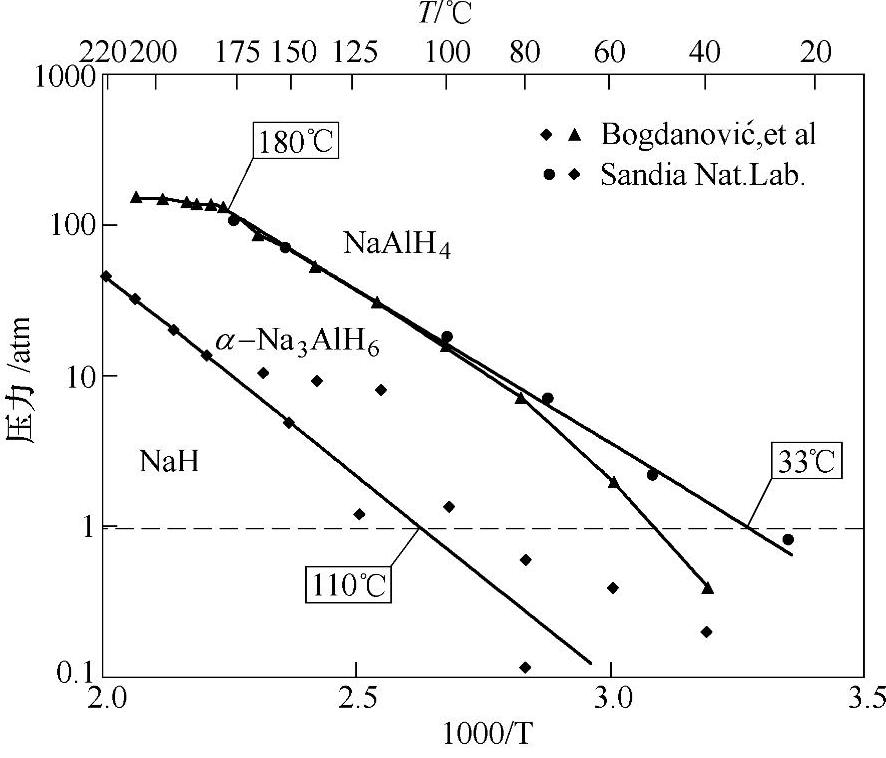
图9-10 NaAlH4↔1/3(α-Na3AlH6)+2/3Al+H2和α-Na3AlH6↔3NaH+Al+3/2H2反应的范特霍夫曲线(试样为2mol%Ti(OBun)4和2mol%Zr(OPri)4同时掺杂的NaAlH4)[32]。
图9-9中反应式(9-14)和式(9-15)对应的放氢平台压力均随着温度的升高而升高,由此可以导出NaAlH4放氢反应的van't Hoff曲线,如图9-10所示。反应式(9-14)和式(9-15)的焓变ΔH分别为37kJ/mol和47kJ/mol H2。若ΔS=130.5J/mol H2·K,通过ΔH可预测:当平衡压力为0.1MPa时,NaAlH4的分解温度为33℃;60℃和80℃下对应的平衡压力可以达到0.2MPa和0.7MPa,这非常适合质子交换膜燃料电池使用。当平衡压力为0.1MPa时,Na3AlH6分解温度为110℃。然而,由于动力学的原因,NaAlH4和Na3AlH6分别在210~220℃和250℃下才分解放氢。NaAlH4的可逆吸氢条件为17.5MPa和270℃。1997年 等通过添加少量Ti催化剂,显著降低了NaAlH4的可逆吸放氢温度,例如,放氢反应温度降至150℃,可逆吸氢反应可在15.2MPa和170℃下进行[3]。催化剂的作用机理将在后文中(9.3.4节)详细论述。
等通过添加少量Ti催化剂,显著降低了NaAlH4的可逆吸放氢温度,例如,放氢反应温度降至150℃,可逆吸氢反应可在15.2MPa和170℃下进行[3]。催化剂的作用机理将在后文中(9.3.4节)详细论述。
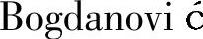 等提出的多步反应机制,即NaAlH4的放氢反应通过式(9-14)~式(9-16)进行,且已被实验所证实。在NaAlH4分解过程中,四面体[AlH4]-转变为八面体[AlH6]3-,必然经历复杂的原子结构重排,这可能是导致NaAlH4动力学性能差的原因之一。但也有人认为Na3AlH6等分解产物的出现只是一种宏观表现,并不能解释反应的真实过程。因此,提出了另外一种反应机理,即NaAlH4的分解过程通过AlH3中间体的形成和分解来完成[33-39],反应过程如式(9-17)~式(9-20)所示。
等提出的多步反应机制,即NaAlH4的放氢反应通过式(9-14)~式(9-16)进行,且已被实验所证实。在NaAlH4分解过程中,四面体[AlH4]-转变为八面体[AlH6]3-,必然经历复杂的原子结构重排,这可能是导致NaAlH4动力学性能差的原因之一。但也有人认为Na3AlH6等分解产物的出现只是一种宏观表现,并不能解释反应的真实过程。因此,提出了另外一种反应机理,即NaAlH4的分解过程通过AlH3中间体的形成和分解来完成[33-39],反应过程如式(9-17)~式(9-20)所示。
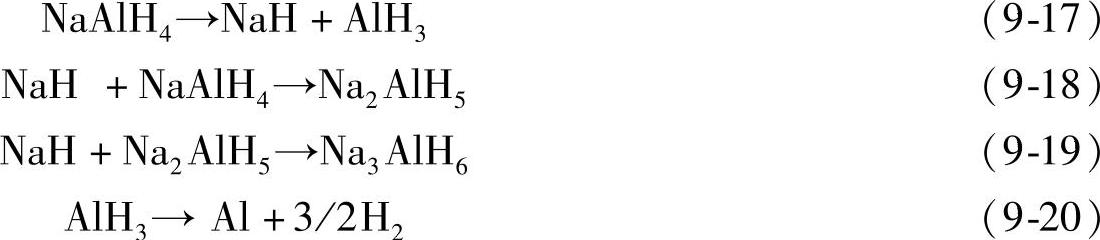
NaAlH4首先分解生成NaH和AlH3,NaH与NaAlH4反应生成Na2AlH5,Na2AlH5与NaH反应继而生成Na3AlH6;AlH3向界面扩散并最终分解生成Al和H2。
通过对H2和D2气氛下的活化能等动力学参数进行对比,发现NaAlH4分解反应的控制步骤不是氢的扩散,更可能是较重的组分如AlxHy等[35]。第一性原理计算也发现Al相关组分(如AlH3)的扩散最有可能是NaAlH4分解反应的控制步骤[36];这一观点后来被实验所证实[37]。AlH3空位扩散分解反应机制(见图9-11)指出,在NaAlH4的分解过程中,AlH3向NaAlH4和Al的界面扩散,在界面上分解生成Al和H2,与此同时,AlH3空位向NaAlH4和Na3AlH6界面扩散。另一方面,如果体系中存在AlH3,Na3AlH6和NaH将容易与之发生合成反应,即可逆吸氢反应生成NaAlH4比较容易进行。借助非弹性中子散射,在NaAlH4的吸放氢过程中观察到了(AlH3)n分子的出现[38]。
 (https://www.daowen.com)
(https://www.daowen.com)
图9-11 NaAlH4的分解反应经由空位扩散[35]
注:可能的空位有:电中性AlH3和NaH空位。空位形成于反应界面,随后被从内部扩散过来的原子所填充,这样在内部将形成一个相同的空位;通过这种方式,空位将在整个晶体内部移动。
与NaAlH4相似,LiAlH4的分解过程也是一个多步反应[39]。在加热过程中,LiAlH4首先从低温相转变为高温相(160~177℃);然后在187~218℃附近通过放热反应分解生成Li3AlH6,如式(9-21),同时伴随着5.3wt%的放氢量。继续加热至228~282℃,Li3AlH6分解生成LiH和Al,同时释放出5.6wt%的氢,如式(9-22)。该步反应是吸热反应,焓变为25kJ/molH2。LiH本身非常稳定,在680℃以上才能分解。在图9-12和图9-13中,热重分析曲线清楚显示了LiAlH4的两步分解过程。
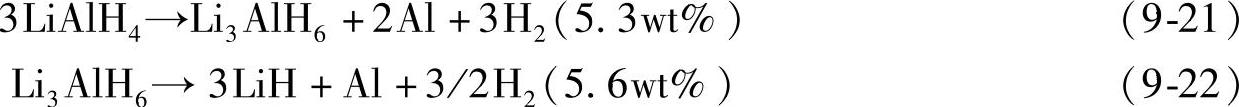
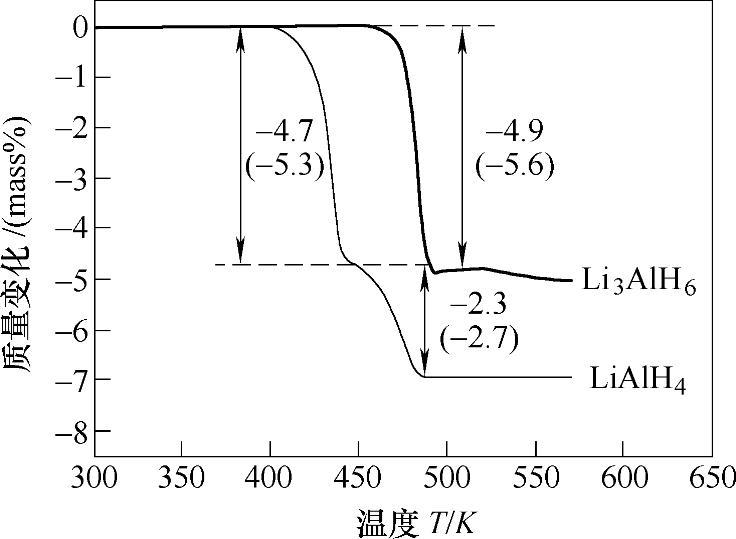
图9-12 LiAlH4和Li3AlH6的热重分析曲线[20](数值表示加热过程中的放氢量,括号内数值表示理论放氢量)
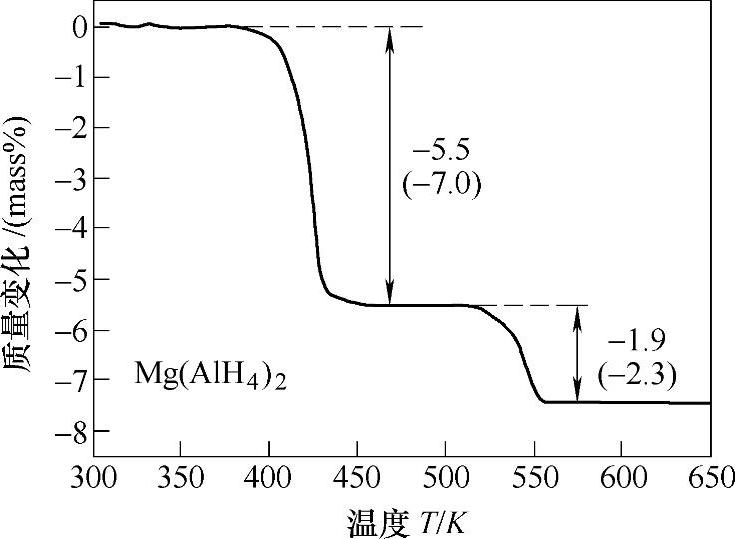
图9-13 Mg(AlH4)2的热重分析曲线(数值表示加热过程中的放氢量,括号内数值表示理论放氢量)
由于从Li3AlH6到LiAlH4的吸氢反应[见式(9-21)的逆反应]是吸热反应,所以该反应很难实现。理论计算结果显示,室温下该反应在100MPa H2下才能进行[40]。近来发现,在反应产物即LiH和Al的混合物中注入THF溶剂,将所得的固液混合物在9.75MPa H2下球磨,可生成LiAlH4·THF,LiAlH4·THF脱附后即可得到LiAlH4[41];通过这种间接可逆方式,LiAlH4在80~110℃下的可逆放氢量为4wt%。另一种实现LiAlH4可逆吸放氢反应的方法如下:首先制得Ti/Al(含2mol%催化剂Ti)的THF浆体;浆体与LiH的混合物在4.2MPa H2、25℃下反应,生成LiAlH4·THF;LiAlH4·THF在60℃下脱附后即得到LiAlH4晶体[42]。表9-4为配位铝氢化物的吸放氢性能。
Mg(AlH4)2在163℃可分解放氢,但分解过程中不生成[AlH6]3-中间体,如式(9-23)所示,这与碱金属配位铝氢化物不同[18]。继续加热至287℃,MgH2将分解生成Mg。Mg(AlH4)2的两步分解反应见图9-13。Mg和Al在400℃左右反应生成AlMg3。反应式(9-23)是一个明显的放热过程,因此在热力学的角度上,其放氢反应是不可逆的。
Mg(AIH4)2→MgH2+Al+3H2 (9-23)
表9-4 配位铝氢化物的吸放氢性能
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







