与金属氢化物相比,无机类非金属氢化物具有不同的电子结构与成键特性,这决定了它们不同的吸放氢性能与反应机制,如图9-3所示。
在金属氢化物中,氢原子占据金属晶格的间隙,氢原子与金属原子之间主要以金属键结合。金属氢化物的吸放氢过程通常伴随着晶格的膨胀和收缩,其反应主要取决于氢气分子在金属或者合金表面的解离或者氢原子结合形成氢气分子,以及氢原子在晶格内的扩散与迁移,如式(9-1)所示,其中M代表金属或者合金。

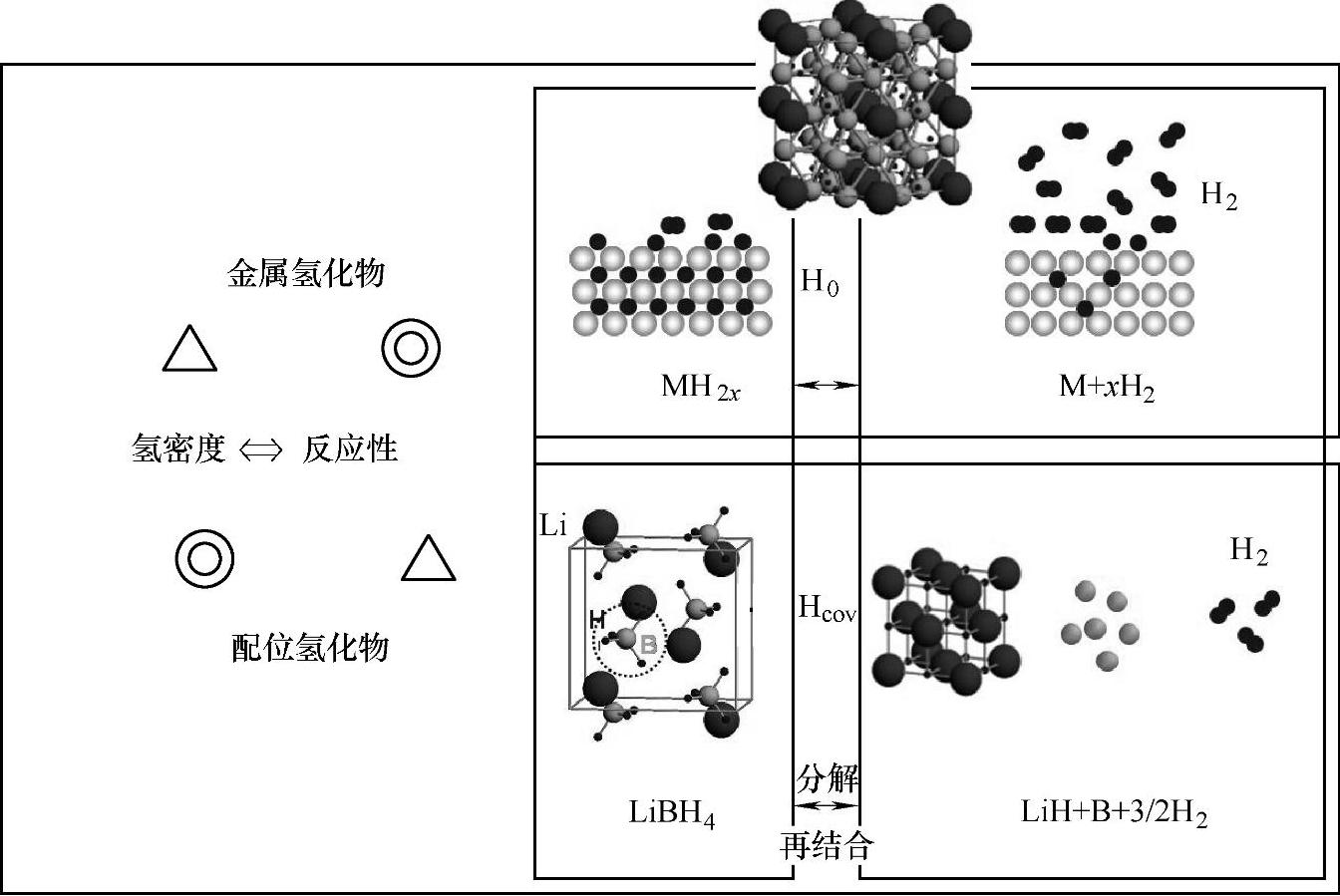
图9-3 金属氢化物MH2x与配位氢化物(以LiBH4为例)的可逆吸放氢反应模式图
在配位氢化物中,氢原子通过与中心原子(如Al、B、N等)形成共价键。因此,配位氢化物的放氢和吸氢过程分别伴随着氢化物自身结构的分解和重构,需要组成原子(包括金属原子M、配位中心原子及H原子)的扩散与迁移,从而导致较弱的吸放氢反应性。以LiBH4为例,其可逆吸放氢反应可由式(9-2)来表示。该反应过程大概包含下面几步:Mn+与[BH4]-之间离子键和B-H共价键的断裂,LiBH4自身结构分解;产物(LiH和B)的成核及长大;氢原子结合形成氢气分子。(www.daowen.com)

最近的研究还发现,LiBH4的分解过程中还出现了中间相Li2B12H12[10,11];[B12H12]2-具有二十面体结构,与非晶体硼中的B12二十面体单元结构相似;Li2B12H12的生成意味着LiBH4的分解过程中伴随复杂的原子结构重排。
硼氨(AB)的分解过程比较复杂,目前已证实,它的反应分多步来进行[12-16],如式(9-5)~式(9-8)所示。在低于150℃下,1mol NH3BH3能放出2mol H2,生成聚硼氨(PAB);PAB随后分解生成,聚氨基甲硼烷(NHBH)n(PIB),至此总共可放出12wt%的氢。继续升高温度,分子间形成交联,释放出剩余的氢,最终产物为BN。TG/FTIR和TG/MS分析发现,在硼氨的分解过程中(特别是第二步反应)中,会释放出单体NH2BH2、环硼氮烷(NHBH)3、二硼烷B2H6等有害气体[12-16];当降低升温速度的时候,生成的有害气体会减少。由于硼氨的分解反应是放热的,因此在热力学上是不可逆的,它的分解过程受动力学控制[12]。
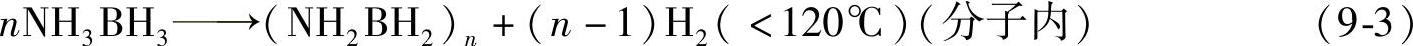
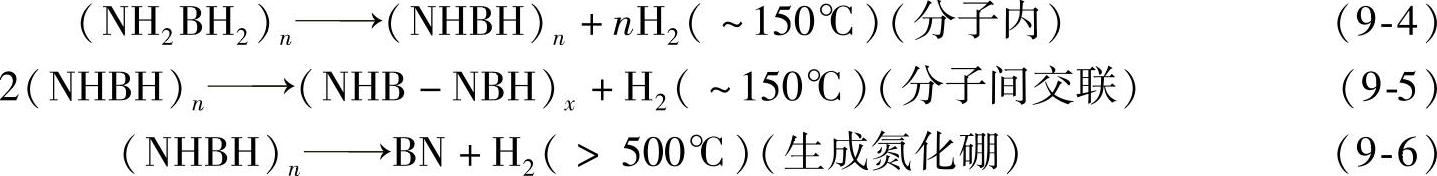
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






