配位氢化物中,配位阴离子由氢原子与中心原子(如Al、B、N等)以共价键形式构成,氢原子位于配位多面体的角上(见图9-1)。配位阴离子与带正电的金属原子(通常为碱金属或碱土金属,如Li+、Na+、Mg2+等)结合,阴离子的电荷由金属阳离子Mn+补偿,形成相对稳定、结构复杂的配位化合物。对MAH4(M=Li、Na、K;A=B、Al、Ga)热力学稳定性的系统研究发现[5],在A相同情况下,KAH4>NaAH4>LiAH4,因为M的金属性越强,M与AH4的离子键越强;在M相同情况下,MAH4中热力学稳定性从高到低依次为是MBH4>MAlH4>MGaH4,这是因为中心原子的非金属性越强,则A-H的共价键越强。
电负性小的金属原子(如碱金属Li、Na、K等),与配位阴离子形成较强的离子键,因此得到的配位氢化物的热力学稳定性比较高,如NaAlH4、LiNH2、LiBH4等;反之,由电负性大的金属原子(如过渡族金属)所构成的配位氢化物热力学稳定性较低,如Ti(BH4)3等。
为了更好地理解配位氢化物的成键特性,下面以LiBH4为例介绍配位氢化物的电子结构[6]。LiBH4是一个禁带宽度为6.8eV(见图9-2左)的绝缘体。Li的电子态对占有态(满态)的贡献很小,因此Li以Li+的形式存在。占有态由两个峰构成,低能量态由B-2s和H-1s轨道组成,高能量态由B-2p和H-1s轨道组成。这些键合特性与CH4分子相似。硼原子发生sp3杂化轨道,与周围4个H原子形成4个共价键;形成共价键缺少的电子由Li+补偿。从LiBH4的价电子等高线图(见图9-2右)可以看出,价电荷主要分布在B和H原子周围,B和H的电子云有明显的重叠;Li原子周围的电荷密度很低;[BH4]-配位离子之间电子云没有发生重叠,说明[BH4]-配位离子之间的作用力比较弱,这也与图9-2左图中窄的占有态能带宽度等现象吻合。其他的配位氢化物,如M(AlH4)n、M(NH2)n、M(BH4)n(M=Cu、Na、K、Zr、Hf、Mg、Zn、Sc等)等,与LiBH4的电子结构相似,均为绝缘体,占有态主要由H和配位中心原子(Al、N、B等)的电子态贡献,金属原子对占有态的贡献很小而以金属阳离子的形式存在。
NH3BH3是一种分子晶体,它与乙烷(C2H6)是等电子体。由于B原子的电负性(2.0)与N原子(3.0)不同,导致NH3BH3具有一定的分子极性。在NH3BH3分子中,NH3存在孤立电子对,BH3有2p空轨道,NH3与BH3组成一对典型的电子供体和电子受体,它们组成之间的B-N配位键键能为130kJ/mol,介于与范德瓦尔斯力与典型的共价键的键能之间[7]。另外,在NH3BH3分子内部,存在N-Hδ+…Hδ--B二氢键,H-H的最短距离为2.02Å,小于范德瓦尔斯距离(2.4Å)[8]。较强的二氢键(约25~29kJ/mol)和分子极性[9],造成NH3BH3特殊的物理性质,如较高的熔点(110~114℃),相比之下于C2H6的熔点只有-181℃。(https://www.daowen.com)
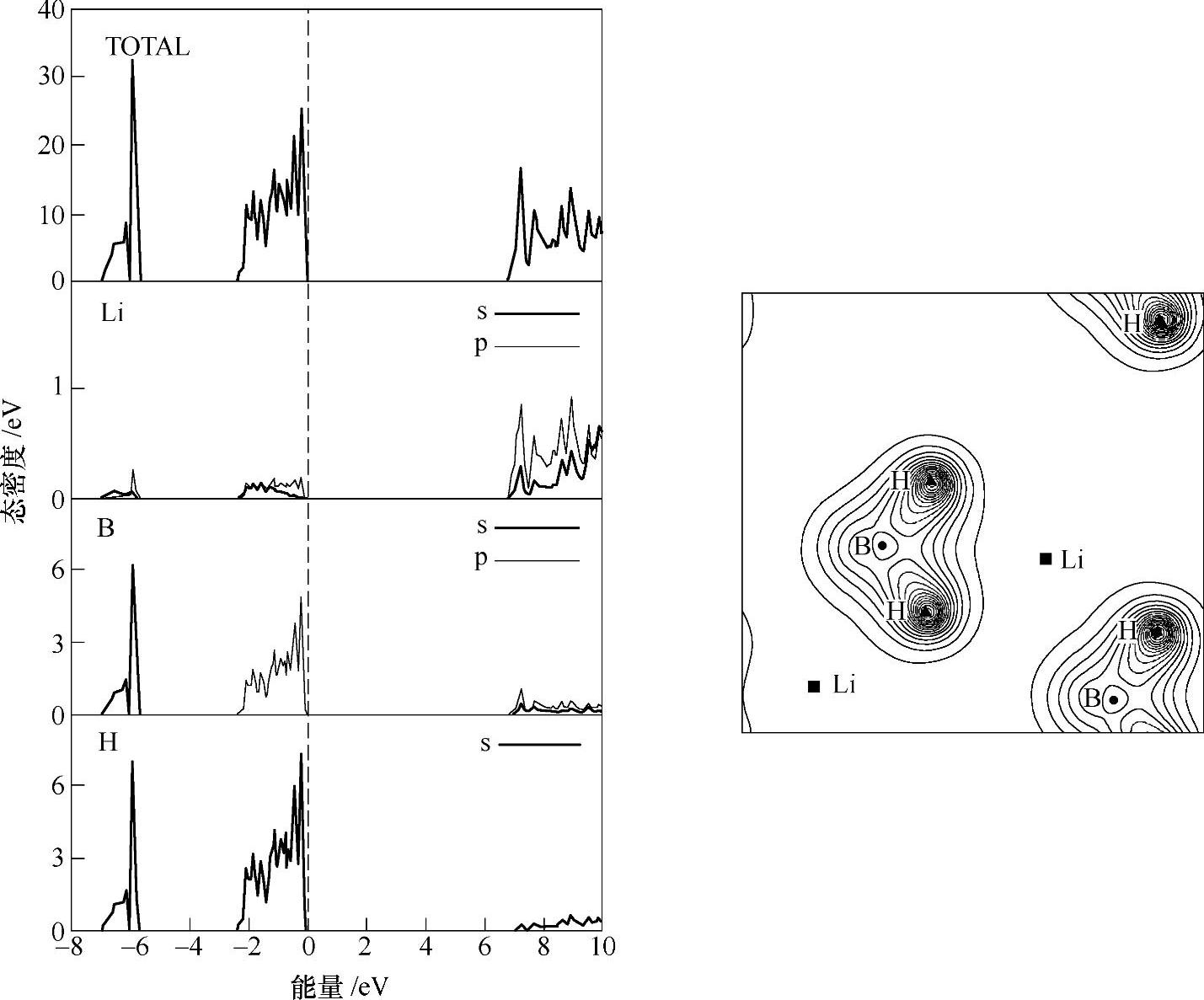
图9-2 LiBH4的电子结构图
LiBH4的全态和部分态电子密度分布(左),斜方晶结构LiBH4的(010)面价电荷密度等高线图(右)[6]。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






