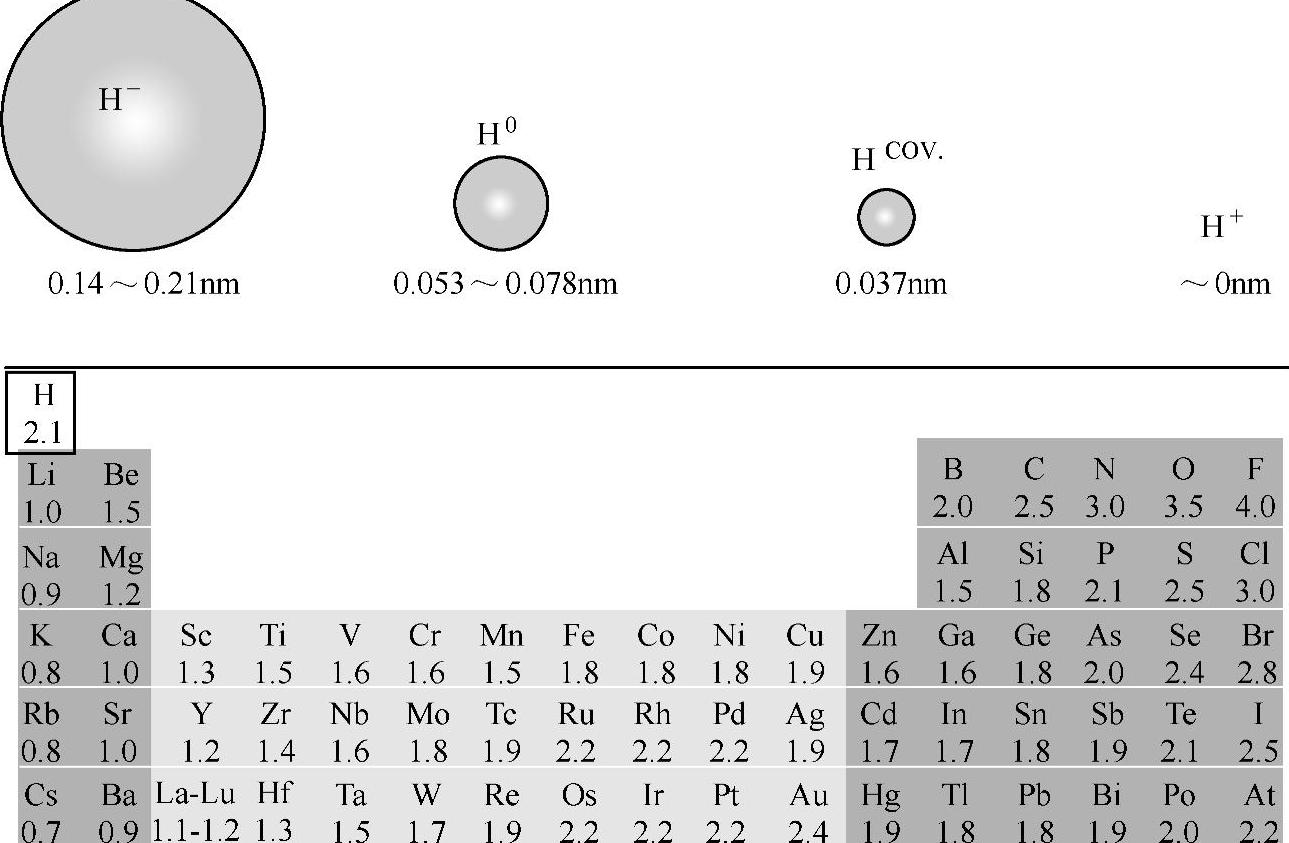
氢的鲍林电负性为2.2,介于大多数的金属和非金属元素的电负性之间,见表9-1,因此既具有还原性又具有氧化性。换句话说,氢与金属和非金属元素都有较高的反应活性,从而生成具有不同键合方式的氢化物。比如说,氢与电负性小的碱金属和碱土金属倾向于形成离子型氢化物;此时氢以H-负离子方式存在,H-负离子直径大致为0.14~0.21nm。相比之下,氢与电负性大的元素,比如卤族元素,相结合形成酸,此时氢提供电子而形成氢阳离子H+。大多数的过渡金属或者合金中,氢主要以原子状态侵入原子空隙中形成金属型氢化物。金属型氢化物主要由密度较大的金属元素组成,所以其单位质量储氢密度通常低于3.0wt%。另外,氢与部分元素(比如Fe、Ni、B、N、Al等)相结合能形成共价键。这一类氢化物通常被称为无机非金属氢化物,如表9-2所示。典型代表如LiBH4、NH3 BH3等氢化物,储氢密度分别达到18.36wt%和19.6wt%。
表9-1 氢原子与氢离子的尺寸以及各种元素的鲍林电负性
无机非金属氢化物被广泛应用于有机化学工业中的还原剂。由于热力学和/或动力学方面的原因,它们的可逆吸放氢反应一般难以实现。1997年,德国马普学会煤炭研究所的 和Schwickardi以钛基化合物作催化剂,成功地使NaAlH4的放氢反应在较温和的条件下实现了可逆。这一重大突破立即引起了广泛的关注,从此,掀起了对无机非金属氢化物的研究热潮。本章将重点介绍配位铝(Al)氢化物、金属氮(N)氢化物、金属硼(B)氢化物和硼氨的合成方法、结构特点及其吸放氢性能。(www.daowen.com)
和Schwickardi以钛基化合物作催化剂,成功地使NaAlH4的放氢反应在较温和的条件下实现了可逆。这一重大突破立即引起了广泛的关注,从此,掀起了对无机非金属氢化物的研究热潮。本章将重点介绍配位铝(Al)氢化物、金属氮(N)氢化物、金属硼(B)氢化物和硼氨的合成方法、结构特点及其吸放氢性能。(www.daowen.com)
表9-2 一些主要无机非金属氢化物的基本性质[1,2]
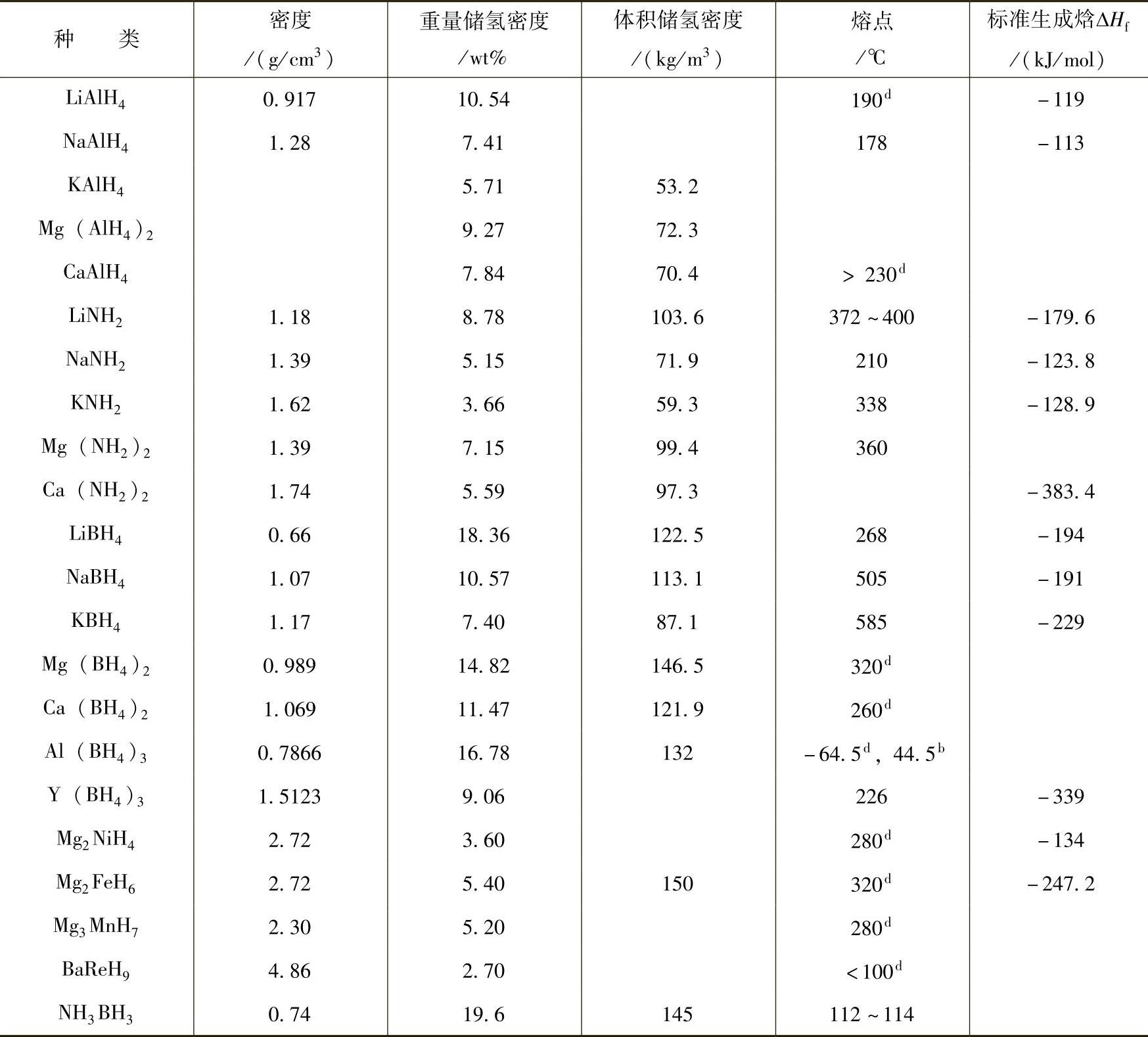
注:d和b分别表示分解和融化。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







