纯的单质镁吸氢量高达7.7wt%,超过了美国能源部对氢动力汽车的吸氢量要求。但是镁单质离真正的实用化还有很长的距离,其主要障碍是镁的吸放氢动力学性能比较差。普通的镁即使在400℃下,50个大气压的氢气中也不能很快地直接吸氢。它必须要在此条件下进行多个循环的活化后才可以在250℃以上吸放氢。其活化困难主要是由于其表面形成的氧化层阻碍了氢的进入。

Mg
结构:六方结构;
空间群:P63/mmc(No.194);
晶胞参数[86]:a=3.2075Å,c=5.2075Å;
α=90°,β=90°,γ=120°;
晶胞体积:0.0464nm3;
计算晶胞密度:1.74g/cm3;
原子坐标:
Mg(c): (1/3,2/3,1/4);
吸放氢反应方程式:
吸氢含量:7.7wt%
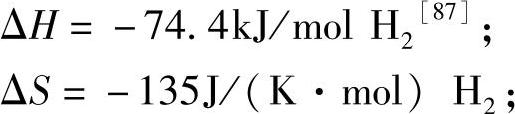
1bar平衡压温度:287℃(图8-24)。

图8-24 MgH2(MgD2)体系的放氢过程PCT曲线[87]
普通温度压力条件下氢化物β-MgH2:
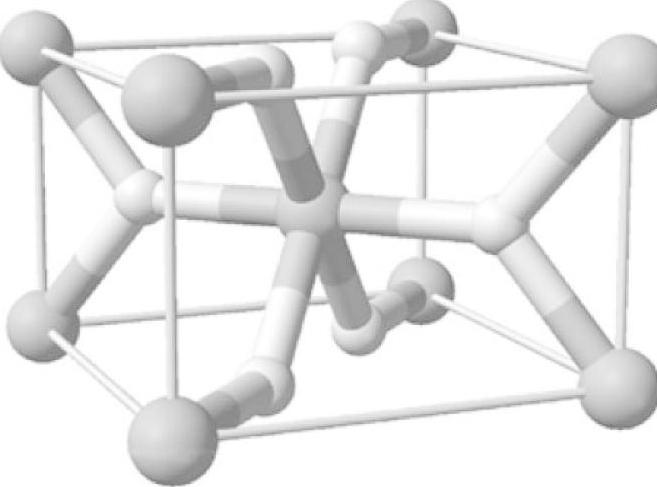
结构:四方金红石结构;
空间群:P42/mnm(No.136);
晶胞参数[86]:a=3.025Å,c=4.5198Å,α=90°,β=90°,γ=90°;
晶胞体积:0.0618nm3;
计算晶胞密度:1.42g/cm3;
原子坐标:
H(f)为(0.30478,0.30478,0)
Mg(a)为(0,0,0)
在单质镁的吸放氢研究方面,各种努力主要是在制备工艺,添加或者复合其他组分来提高其吸放氢性能,研究纯的单质镁的报道相对较少。20世纪70~80年代有一些,那时候主要是一些镁的吸放氢反应早期的数据以及一些机理的讨论。
最近,有研究者通过密度泛函理论研究了Mg(0001)表面的吸氢机理[88],H原子在Mg(0001)表面吸氢为放热过程,H原子倾向于占据fcc空位,H与Mg基体的吸附能在形成单层吸附之前逐渐增加。在形成MgH2之前形成过度H-Mg-H三层结构,随着吸氢量增加,当此3层结构层数超过3时,开始形成金红石结构的MgH2(见图8-25)。
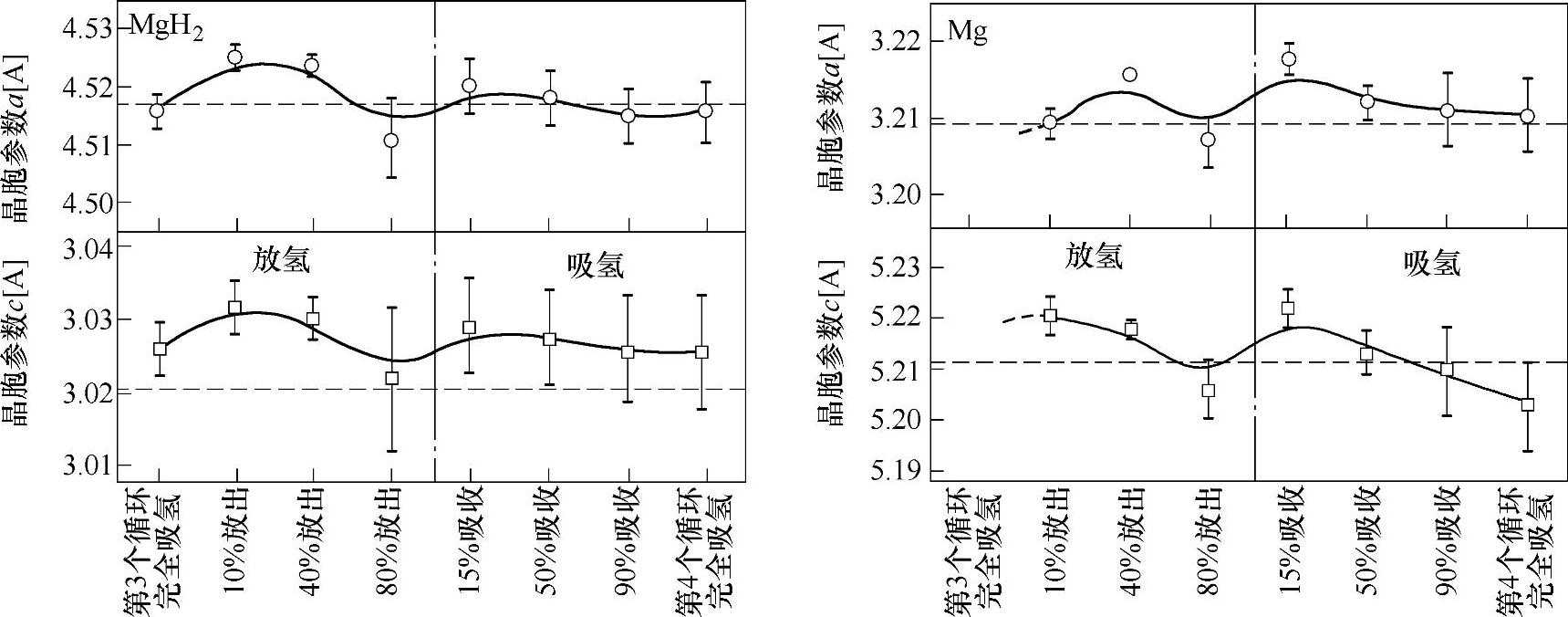
在考察通过球磨法制备得到的MgH2纳米晶样品的吸放氢过程中的微结构演变过程[89]时发现,由于MgH2-Mg体系在吸放氢循环过程中内部应力以及固溶氢含量的变化而导致了MgH2与Mg的晶胞参数在吸放氢循环时呈现波浪形的演变过程(见图8-26)。
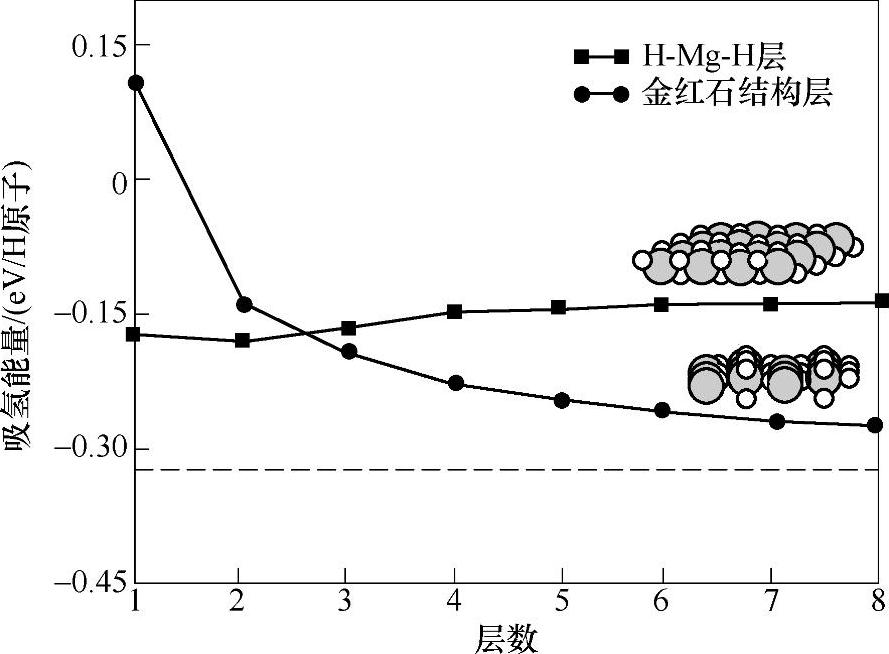
图8-25 密度泛函原理计算在Mg(0001)表面吸氢过程中H-Mg-H三层结构与金红石MgH2(110)结构随着层数的吸氢能量变化
 (https://www.daowen.com)
(https://www.daowen.com)
图8-26 Mg-MgH2体系第三个循环到第四个循环吸放氢过程中Mg、MgH2相晶胞参数的变化过程
1.球磨等制备方法对储氢性能的影响
最近有很多的单质镁的研究报道,这些主要是在材料的尺度以及结构上进行了改进,他们主要使用的是球磨方法。加拿大的Huot小组报道了高能球磨镁的氢化物对其吸放氢性能影响的研究结果[90]。他们系统地研究了球磨对其结构的改变以及吸放氢动力学性能的改善结果。通过对氢化物的球磨,2h后开始生成正交γ相的MgH2。球磨20h后,Rietveld分析表明,样品中含有74wt%的普通β相的纳米晶MgH2和18wt%的γ相的纳米晶MgH2以及8wt%的MgO。通过比较球磨前后的吸放氢速度和吸放氢量,他们发现,球磨后吸放氢速度有了非常大的提高,球磨后的氢化物可以在573K下几分钟内吸氢完全,623K下几分钟内放氢完全,比没有球磨的样品速度提高了5倍。其主要原因是因为球磨过程中产生了无数的缺陷,并且伴随着颗粒尺寸的减小以及比表面积的增加,这些因素增加了样品颗粒与氢反应的接触点并且缩短了扩散行程。另外,放氢温度也降低了64K,这显示了更快的放氢速度以及更低的放氢活化能,其活化能由156kJ/mol降低到了120kJ/mol。另外Zaluska等人[91]报道了他们球磨得到的纳米晶Mg的储氢性能结果。最终他们得到了与Huot等人几乎同样的结论,这便是通过球磨后晶粒尺寸的降低和比表面积的增加对其吸放氢性能的改善起关键作用。这基本上也是目前对各种方法来达到颗粒或晶粒尺寸降低以及比较面积增加所带来的储氢性能改善(特别是在吸放氢速度的提高方面)的普遍结论。
Bogdanovic等人通过均相催化合成方法制备得到了Ti颗粒催化的纳米结构的MgH2[92,93],其合成方法为
最近有研究者详细地研究了通过此方法获得的Ti颗粒催化的纳米结构MgH2样品的吸放氢性能[94],发现其在脱氢后,300℃时的吸氢速度为普通MgH2样品的40倍。
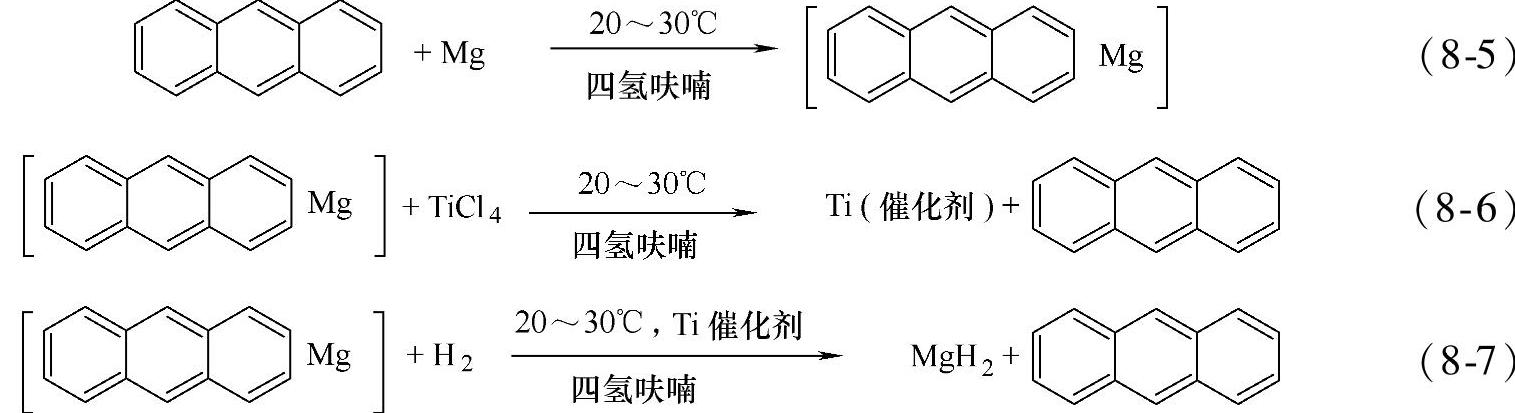
通过金属-氢等离子电弧法可以制备得到平均颗粒度为几百纳米左右的Mg超微颗粒[95],此Mg超微颗粒可以不用活化就可以直接快速吸氢,经过一个673K的吸放氢循环后,Mg超微颗粒样品可以在623K,10min左右达到吸氢完全,吸氢量为7.6wt%,也可以在473K温度下吸氢,不过需要数小时才能达到近饱和吸氢量(见图8-27),通过PCT曲线,使用van't Hoff得到的放氢过程中的反应焓和反应熵分别为79.8kJ/mol H2和140.8J/(K·mol)H2。
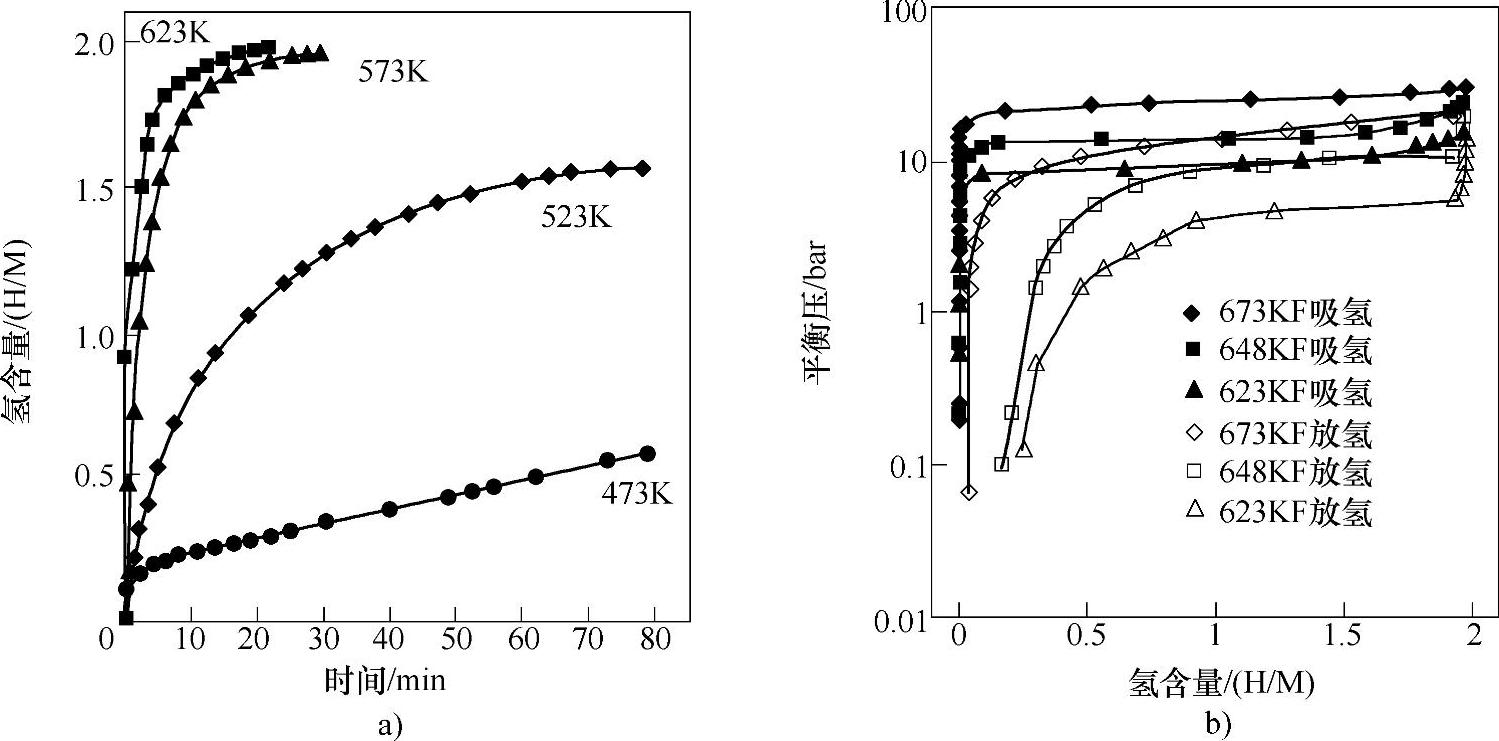
图8-27 通过金属-氢等离子电弧法制备得到的Mg超微粒子的吸氢曲线图(见图a)以及PCT曲线(见图b)
有研究者制备了MgH2薄膜并与Cr、Ti金属形成纳米复合材料,考察了Cr、Ti对其吸放氢过程的催化性能[96]。此纳米复合材料催化体系在吸放氢过程中显示了非常好的动力学性能。他们通过PCT曲线的测量(见图8-28),用van't Hoff方程得到的放氢过程的反应焓为79kJ/mol H2,反应熵为144J/(K·mol)H2。这些值与其他非纳米基Mg-H体系以及纳米基Mg-H体系结果一致[87,95,97-100],表明纳米级材料以及催化剂的使用不改变材料的热力学性能。Wagemans等人[101]通过理论计算认为,当Mg族的颗粒度小于1.3nm时,由于表面能量变化等纳米效应的显现,可能会在吸放氢过程中理论上观察到热力学数值的变化。
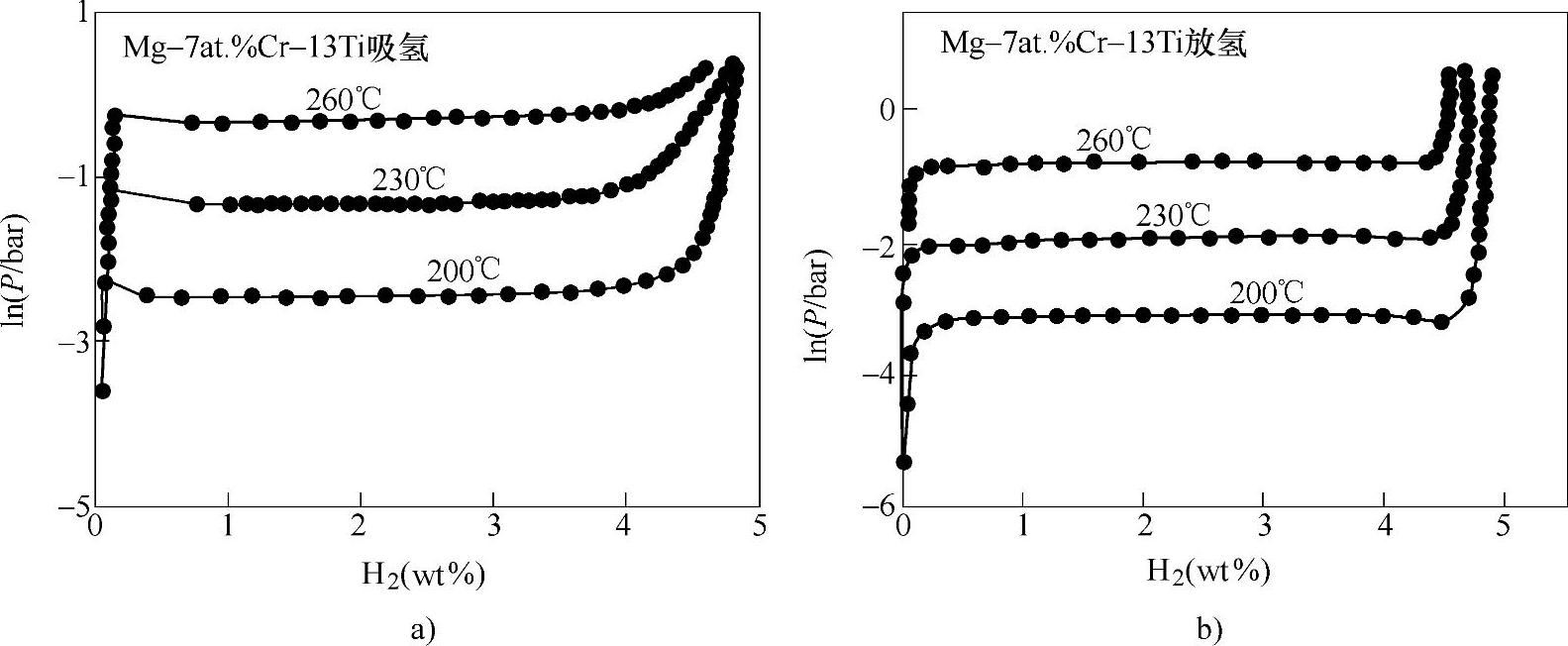
图8-28 Cr、Ti金属催化Mg薄膜纳米复合体系的吸放氢PCT曲线
最近,在提高镁单质储氢性能方面,众多学者主要的研究方向是添加可以降低镁吸放氢温度和提高吸放氢速度的成分。这些成分有金属单质、氧化物、碳质材料以及其他储氢合金等。
2.添加金属单质或化合物对性能的影响
研究Mg0.833Ni0.066Cu0.095Ml0.006多组分镁储氢材料[102]时,其中Ml代表富La的混合稀土组分,结果发现此体系能够显示较好的储氢性能,这主要是由于Ni、Cu、Ml在镁表面沉积对其吸氢性能产生了影响。Friedlmeier等人[103]研究了Mg中掺杂少量Ni对其性能的改变影响,并提出了一个成核生长模型。Liang、G.等人[104]系统地研究了球磨法制备得到氢化镁和过渡金属的纳米复合体系MgH2-Tm(Tm=Ti、V、Mn、Fe、Ni)的性能。发现其中MgH2-V具有低温下最好的放氢性能,而Mg-Ti则显示了最好的吸氢动力学性能。球磨添加其他过渡金属后,氢化物生成焓和生成熵没有什么变化,但是活化能有了很大的降低。Li- ang等人[105]还具体详细地研究了添加少量V对Mg的吸放氢性能和机理的改变影响。
最近,有研究者系统地研究了TiF3和TiCl3对Mg-MgH2体系吸放氢过程的催化性能[106],结果发现TiF3对Mg体系的催化性能要大大好于TiCl3(见图8-29)。其原因主要是F离子活性组分在吸放氢过程中独特的催化机理。
3.添加氧化物对储氢性能的影响
被用来改善Mg基单质吸放氢性能的氧化物主要有ScO3、TiO2、V2O5、Cr2O3、Mn2O3、Fe3O4、CuO、Al2O3、SiO2、CeO2、WO3等。
近几年,很多人[107-117]研究了Nb2O5对Mg基储氢材料吸放氢性能的催化作用。Barkhor-darian等人[107,108]研究了Nb2O5对镁的催化吸放氢效果。他们发现随着氧化物催化剂含量的改变,吸放氢过程的限速反应也在改变。Isobe等人通过原位透射电镜研究了球磨形成的Nb2O5催化的MgH2材料放氢过程的机理。他们发现,当MgH2添加1%摩尔比的Nb2O5时,其放氢温度从150℃便开始,放氢后纳米结构的Mg产生。当MgH2添加10%摩尔比的Nb2 O5时,MgH2的放氢从MgH2与Nb2O5的界面产生,产生的氢原子穿过Mg相层到达Mg与Nb2O5的界面从而形成氢分子释放出来(见图8-30)。对与Nb2O5对Mg-MgH2体系的催化过程中的具体作用成分,目前有多种结论,Hanada等人[115]通过XAFS认为是NbO成分,Porcu等人[114]通过透射电镜观察认为可能是Nb2O5、Nb2O或者MgNb2O3.67相。
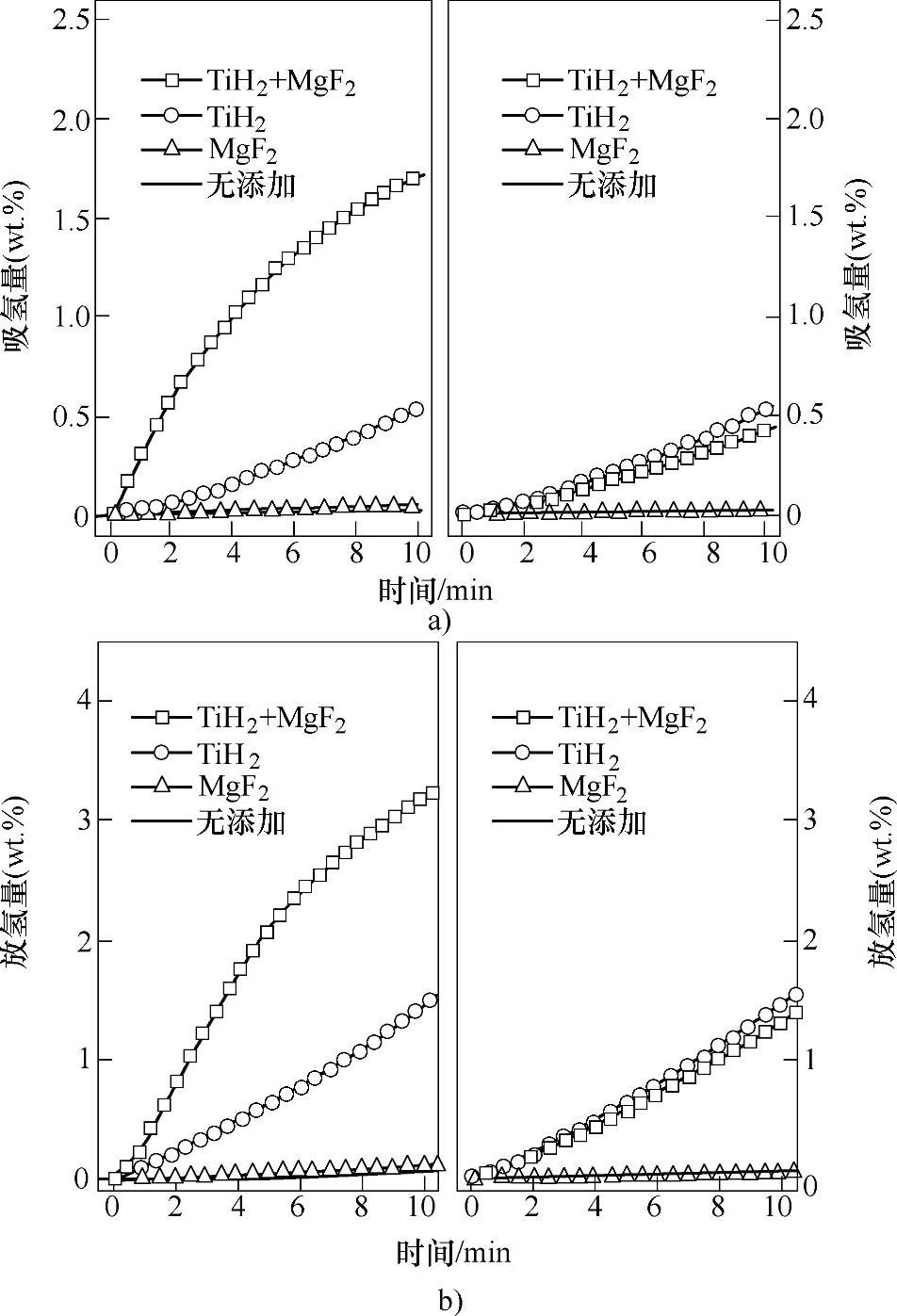
图8-29 催化剂的添加对Mg-MgH2体系吸放氢速度的影响
a)100℃吸氢曲线 b)300℃放氢曲线
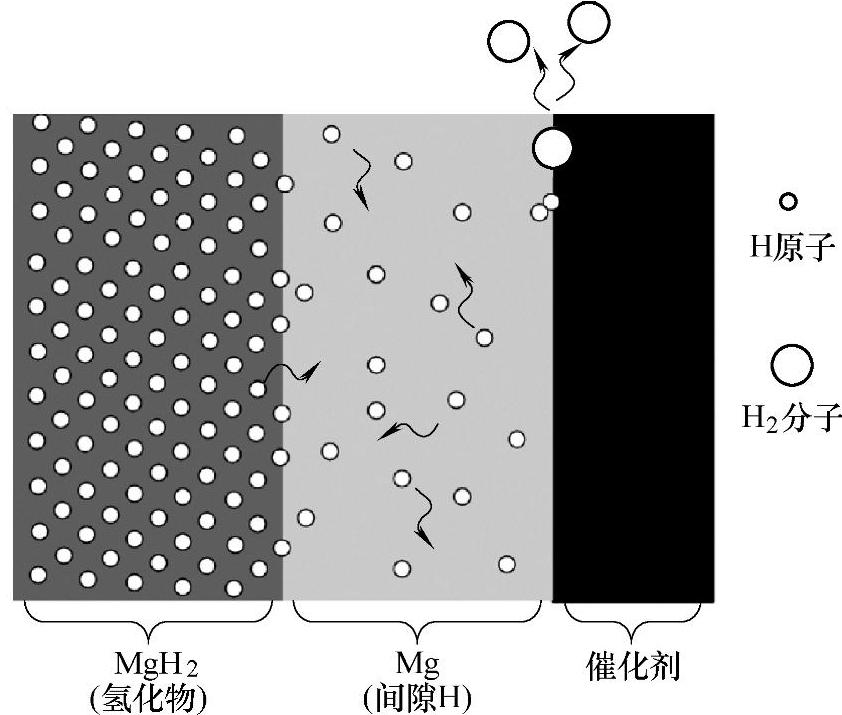
图8-30 催化剂在MgH2放氢过程中的作用机理
4.添加碳质材料对储氢性能的影响
有研究者研究了Mg中添加含有少量Pd的石墨,将样品通过球磨法制备获得的复合体系[118,119],发现得到的样品在300K左右就能够吸氢。他们又研究了用苯作为添加剂而在Mg中掺杂石墨的结果[120,121]。他们发现苯的添加与否对获得的样品体系的结构和性能有着重要的影响。再后来他们又用其他有机物如环己胺、四氢呋喃等作为添加剂在Mg中掺杂石墨[122,123]。研究发现添加少量石墨后可以改善Mg的吸放氢性能,主要是由于石墨与氢之间的相互作用[124],另外,碳的加入可以阻碍Mg的氧化,从而提高了性能。多壁碳纳米管的添加也可以大大改善Mg的吸氢量以及动力学[125]。
5.添加其他储氢合金对储氢性能的影响
Mg和35wt%的FeTi1.2的合金粉末球磨后得到的纳米体系样品吸放氢速度有明显的提高[126]。球磨后得到的纳米结构的复合体系Mg-50wt%LaNi5样品[127]在302K、1.5MPa的氢气中500s就可以吸氢5wt%,其优越的性能来自于样品中的大量的相边界和孔结构。球磨法所制备得到的Mg-x wt%MmNi4.6Fe0.4体系[128]体系在经过一个400℃左右的活化过程后,可以在350℃左右吸收5wt%的氢,并且显示了较好的动力学性能。球磨法制备MmNi5-xMx-Mg纳米复合体系[129]出现了MmNi5-xMx,Mg以及Mm2Mg17相,球磨后样品和MmNi5-xMx相比其性能有较大的改善。在研究Mg和MgH2中添加LaNi5并球磨后的样品[130]时发现前者吸氢后和后者都变成了多相复合体系——MgH2+LaH3+Mg2Ni,并发现其性能有很大的提高,主要是由于La和Ni的协同催化作用,La的加入对吸氢有很大的催化作用,对放氢催化作用不大,在373K温度以上,Mg2Ni的催化作用要强于La。Mg与30%TiMn1.5混合体系的样品中发现TiMn1.5均匀地混合在Mg中[131,132],使得镁可以完全吸氢,显示了TiMn1.5对镁很好的吸氢催化性能。
通过放电等离子烧结的方法可以制备Mg-50%V77.8Zr7.4Ti7.4Ni7.4(见图8-31)、Mg-30%V38 Zr25Ti15Ni22以及Mg-30%ZrMn2复合储氢体系[133]。通过复合第二储氢体系,使得Mg的放氢温度大大降低,Mg在300℃时的放氢量从0提高到了95%理论值。复合材料的吸放氢的动力学有了很大的改善。放氢过程中的限速反应也从纯Mg的表面反应变成了三维扩散反应。
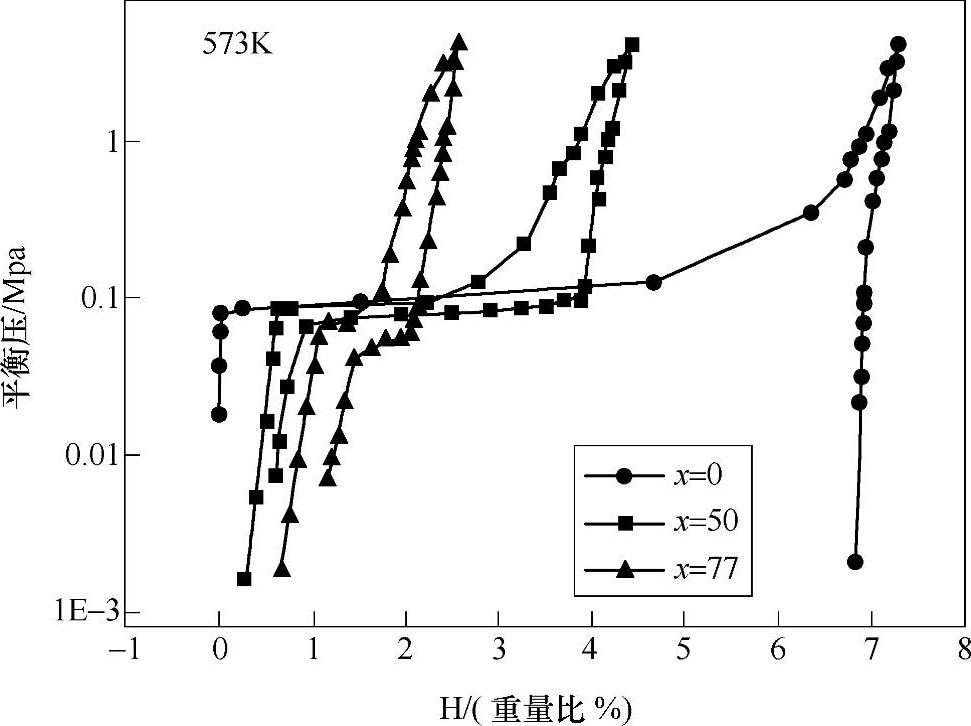
图8-31 放电等离子烧结法制备得到的Mg-x% V77.8Zr7.4Ti7.4Ni7.4(x为0,50,77)在300℃的PCT曲线
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







