2026年Yaghi等人报道了MOF-5的吸氢性质,MOF-5是由[Zn4O]6+四面体与对苯二甲酸(BDC)形成的Zn4O(BDC)3三维简单立方结构,骨架结构中的节点为八面体的Zn4O(CO)6,四面体中心的Zn与顶点的4个O配位,4个四面体通过共用中间的氧原子连接起来,形成八面体节点,称为SBU(Secondary Building Unit)。SBU由刚性配体连接起来得到简单立方的三维骨架结构。MOF-5在77K下饱和吸氢量可达5.1wt%,BET比表面积为2296m2/g,Langmuir比表面积为3840m2/g。1,3,5-三羧基苯连接Zn2+八面体节点得到MOF-177,高压下饱和吸氢量可达7.5wt%,Langmuir比表面积为4500m2/g,77K、1atm下吸氢量为1.25wt%,在约100atm下吸氢量可达11.0wt%[18]。构建基元和拓扑结构类似的MOF[19],称为IRMOF(Isoreticular Metal Organic Framework),如一系列与MOF-5结构类似通式为Zn4O(L)3配体不同的MOF材料(见图7-6)[20-22],分解温度可达400℃,具有较好的稳定性。具有超高空隙率的MOF,孔道内径可达48Å,用含有多个苯环的三元羧酸根与Zn(Ⅱ)离子配合,形成三维非互穿结构。其中MOF-210的BET比表面积和Langmuir比表面积分别为6240m2/g和10400m2/g,77K下测得饱和吸氢量为8.6wt%,总吸氢量达17.6wt%[23]。目前MOF-210是已报道的比表面积和孔体积最大的MOF之一。
Férey等人将它们合成了MIL-n系列MOF材料(Materials of Institut Lavoisier),其中有代表性的是三价过渡金属和对苯二甲酸形成的三维骨架材料,由于三价金属的配位特点,表现出独特的结构性质,比较有代表性的是MIL-53(M(OH)(O2C-C6H4-CO2),M=Cr,Al,V,Fe)。MIL-53(Al)77K下的饱和吸氢量是4.5wt%,BET比表面积为1100m2/g,Langmuir比表面积为1540m2/g。它的吸放氢曲线存在滞回(见图7-7)[24],这与这3种特殊的“呼吸”效应有关。由于骨架结构具有一定的灵活性,在客体分子进入和脱出的过程中,MIL-53的骨架结构会发生扩张和收缩,但空间的拓扑结构维持不变,只是原子间距离和晶胞体积发生变化,这一现象被形象地称为“呼吸”现象(见图7-8)[25]。“呼吸”现象与客体分子和骨架之间的相互作用强弱有关。
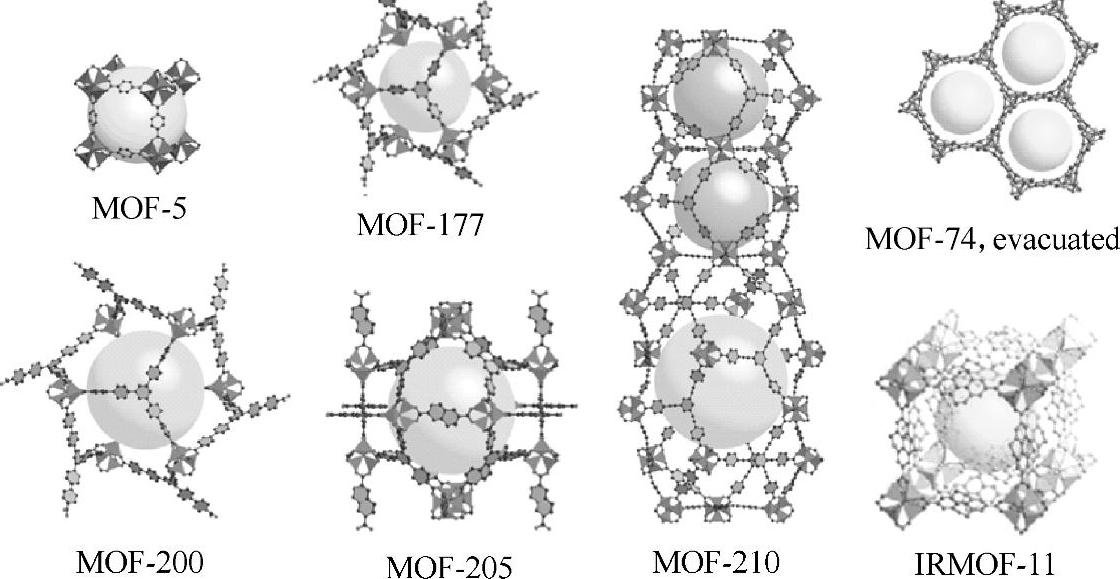
图7-6 一系列典型MOF的结构
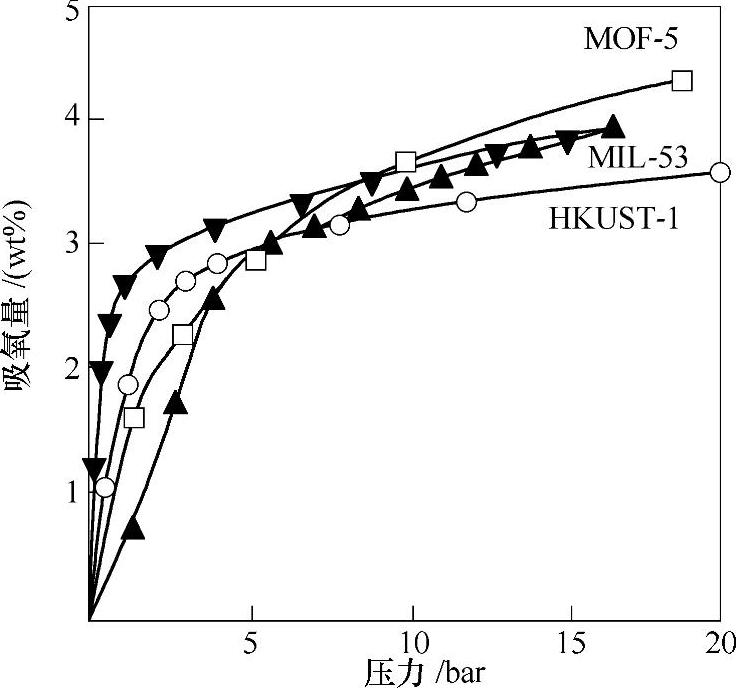
图7-7 MOF-5、MIL-53、HKUST-1在77K下的氢气吸脱附曲线[25]
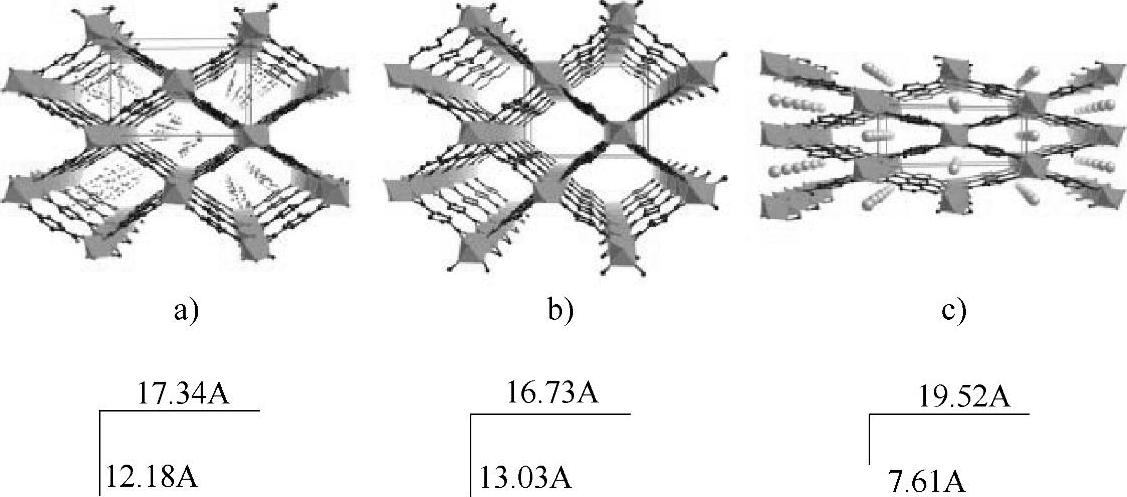
图7-8 MIL-53晶胞参数随客体分子的变化示意图
a)未经处理的(as),孔道中存在无规则的对苯甲酸分子 b)高温脱去客体分子,孔道结构张开(open) c)室温吸附水分子,孔道收缩(hydrated)
绝大多数MOF储氢方面脱去客体分子活化空穴后,对气体的吸附和脱附几乎没有滞回,是一个可逆的物理吸附过程[21]。像MIL-53这样结构表现出特征灵活性的MOF吸放氢曲线表现出滞回的现象,即在一定的压力范围内,放氢比吸氢过程测得的氢含量更高,这样高压吸附的氢气可以在较低的压力下得以保持,对实际储氢应用有利[26]。用柔性配体得到孔径较小,并与氢分子有结构相应的MOF材料,分子式均为Ni2(bipy)3(NO3)4的两种结构M和E在77K下对氢气的吸附曲线存在滞回[27]。活化后具有不饱和配位的金属位点的MOF往往表现出对氢气的强吸附作用[28],其中有代表性的是HKUST-1,77K下饱和吸氢量可达3.6wt%,BET比表面积为1154m2/g,Langmuir比表面积为1958m2/g。4种典型结构MOF的吸附热与吸附量的关系如图7-9所示,MOF结构中的金属位点、配体、骨架结构(互穿等)都可能对氢气吸附作用有影响。(https://www.daowen.com)
尽管大多数MOF材料采用过渡金属和刚性有机配体配位的方式合成,但目前主族金属(Be、Mg、Ca等)MOF的报道也较多[29]。主族金属的配位能力较过渡金属弱,但其较低的原子量有利于提高材料的重量储氢量。在合成中还可引入混合金属位点,如Zn3(BDC)3[Cu(Pyen)]·(DMF)5(H2O)5实验中测得在零表面覆盖时对氢气的吸附热可达12.29±0.53kJ/mol,是目前报道的吸附热最大值,其中不饱和配位的金属位点和超窄孔道(小于5.6Å)结合产生了对氢气的强吸附位点[30]。混合配体的引入进一步增加了MOF材料的结构多样性,常形成层-柱(pillared-layer)结构。层-柱结构一般是指多元羧基和胺类混合配体,由金属离子与羧基配体形成二维的层结构,胺类配体作为柱配位支撑在层与层之间得到三维结构(见图7-10)。如间苯三羧酸和4-联吡啶混合配体体系分别于Ni离子和Co离子形成的MOF,在77K下的吸氢量分别可达3.42wt%和2.05wt%,在室温7MPa下可达1.20wt%和2.05wt%[31]。
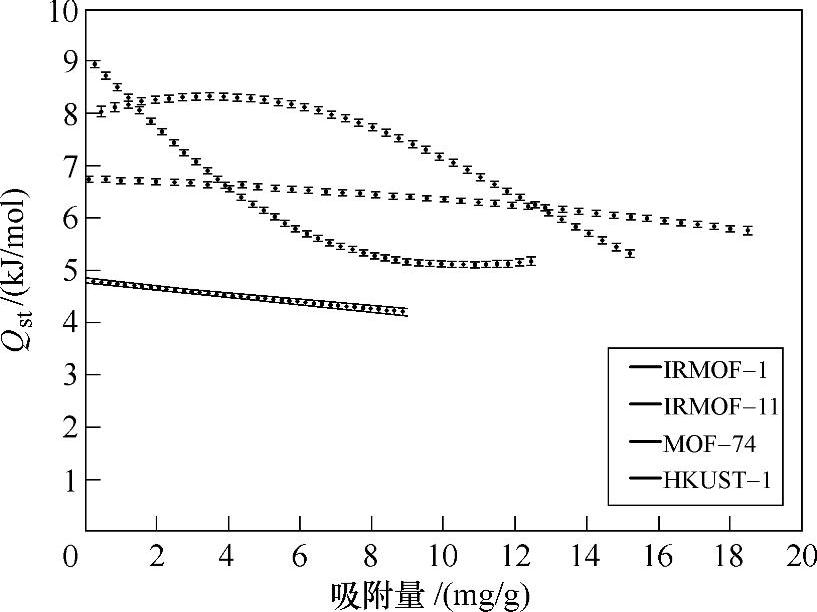
图7-94 种典型MOF材料的吸附热(其中MOF-74和HKUST-1分别具有不饱和吸附的Zn和Cu离子位点,IRMOF-11具有互穿结构)
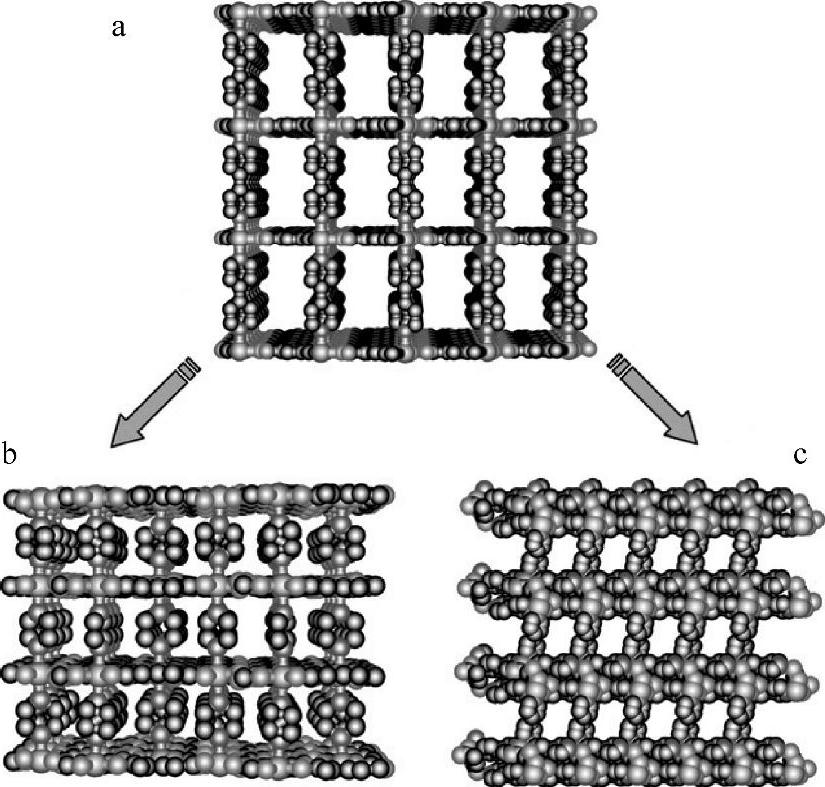
图7-10 层-柱结构MOF示意图[32]
此外,由共价键连接的有机配体组成的一类与MOF结构相似的材料,称为共价有机骨架(Covalent Organic Framework,COF)材料。这种材料结构中不存在金属离子,但与MOF一样具有较大的比表面积,如COF-102和COF-103的比表面积分别为3472m2/g和4210m2/g。COF较MOF更轻,由于不存在金属离子配位,而表现出与氢气不同的作用机理,也是一种具有良好应用前景的储氢材料,典型MOF材料的储氢性质见表7-3[33-34]。
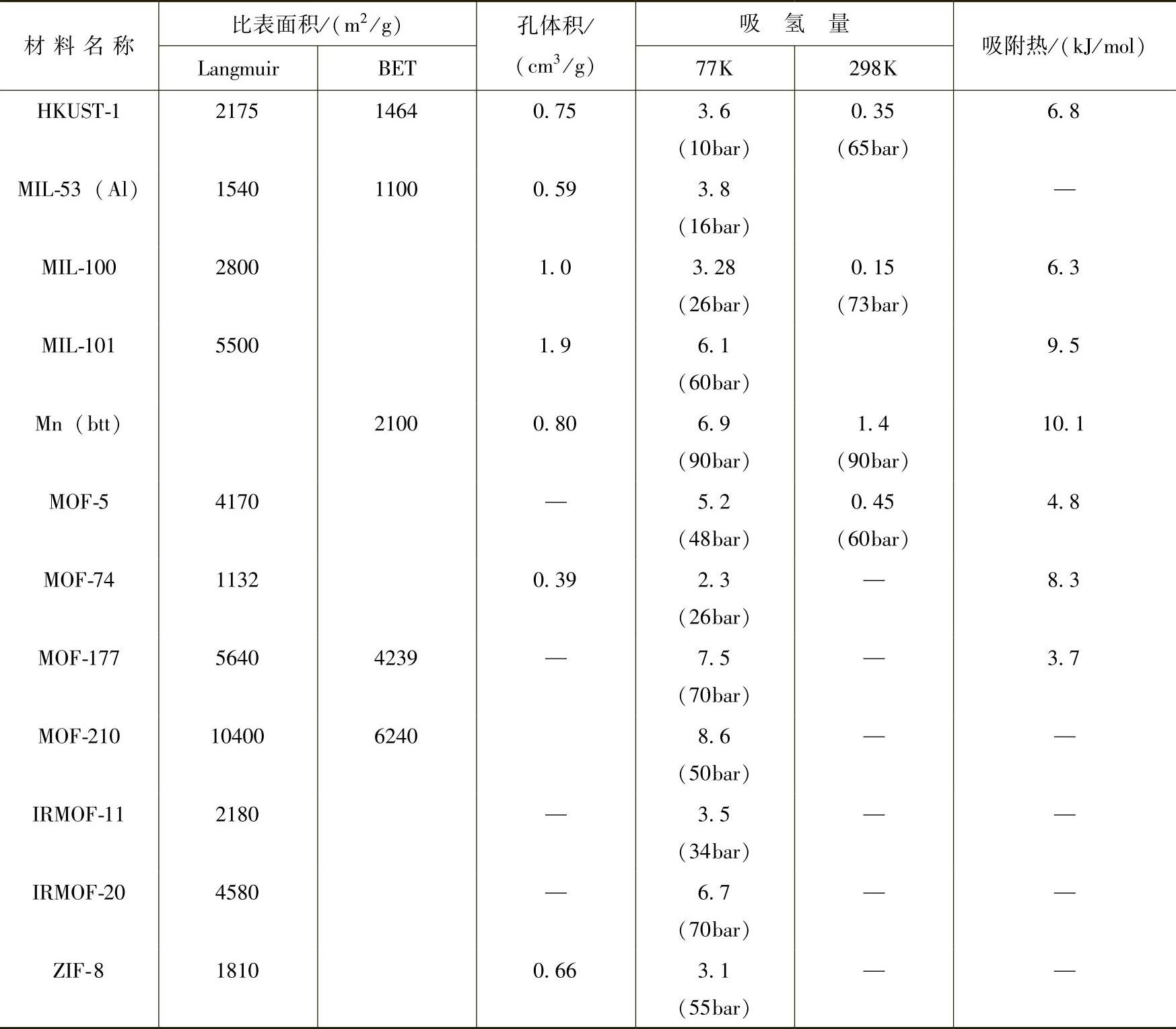
表7-3 典型MOF材料的储氢性质[35]
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






