【摘要】:氢气在高温低压时可看做理想气体,通过理想气体状态方程PV=nRT来计算不同温度和压力时的质量。然而,由于实际气体分子体积和分子相互作用力的原因,随着温度的降低和压力升高,氢气越来越偏离理想气体的性质,范德瓦尔斯方程不再适用。实际气体与理想气体的偏差在热力学上可用压缩因子Z表示,定义为Z=PV/nRT。图5-1列举出几种气体在0℃时压缩因子随压力变化的关系。图5-2 T=273K、393K时氢气压力和密度的关系
氢气在高温低压时可看做理想气体,通过理想气体状态方程PV=nRT来计算不同温度和压力时的质量。然而,由于实际气体分子体积和分子相互作用力的原因,随着温度的降低和压力升高,氢气越来越偏离理想气体的性质,范德瓦尔斯方程不再适用。实际气体与理想气体的偏差在热力学上可用压缩因子Z表示,定义为Z=PV/nRT。图5-1列举出几种气体在0℃时压缩因子随压力变化的关系。从图可以看出氢气的压缩因子随压力的增加而增大。
为正确地描述真实气体的性质,历史上曾提出过许多真实气体的半经验方程,著名的如范德瓦尔斯方程、彭-鲁滨逊状态(P-R方程)、R-K方程、贝蒂一布里奇曼方程、BWR方程、M-H方程等。这些方程的形式一般由理论分析得到,方程中含有两个或多个与计算气体相关的常数,适用于不同的气体。此外,根据对比态原理又发展了各方程的对比态形式,此时方程中的常数不再随气体的不同而不同,而是为一定压力温度范围内的同类气体通用。
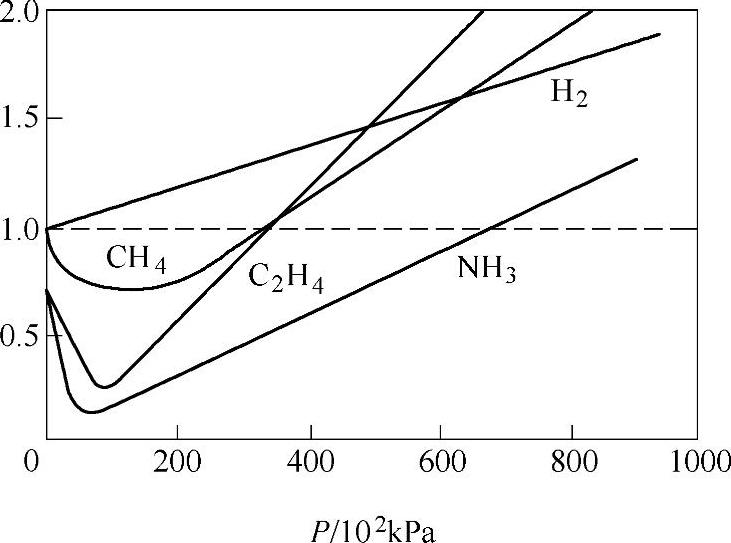
图5-10 ℃时几种气体的Z-P曲线(https://www.daowen.com)
通过美国国家标准技术所(National Institute of Standard sand Technology,NIST)材料性能数据库提供的真实氢气性能数据进行拟合,可得到简化的氢气状态方程:
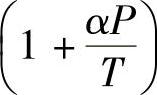 ,其中,α=B1=1.9155×10-6K/Pa[1],在173K<T<393K范围内计算,最大相对误差为3.80%;在253K<T<393K范围内计算,最大相对误差为1.10%。图5-2比较了几个不同状态方程计算的不同温度下氢气压力和密度的关系。
,其中,α=B1=1.9155×10-6K/Pa[1],在173K<T<393K范围内计算,最大相对误差为3.80%;在253K<T<393K范围内计算,最大相对误差为1.10%。图5-2比较了几个不同状态方程计算的不同温度下氢气压力和密度的关系。
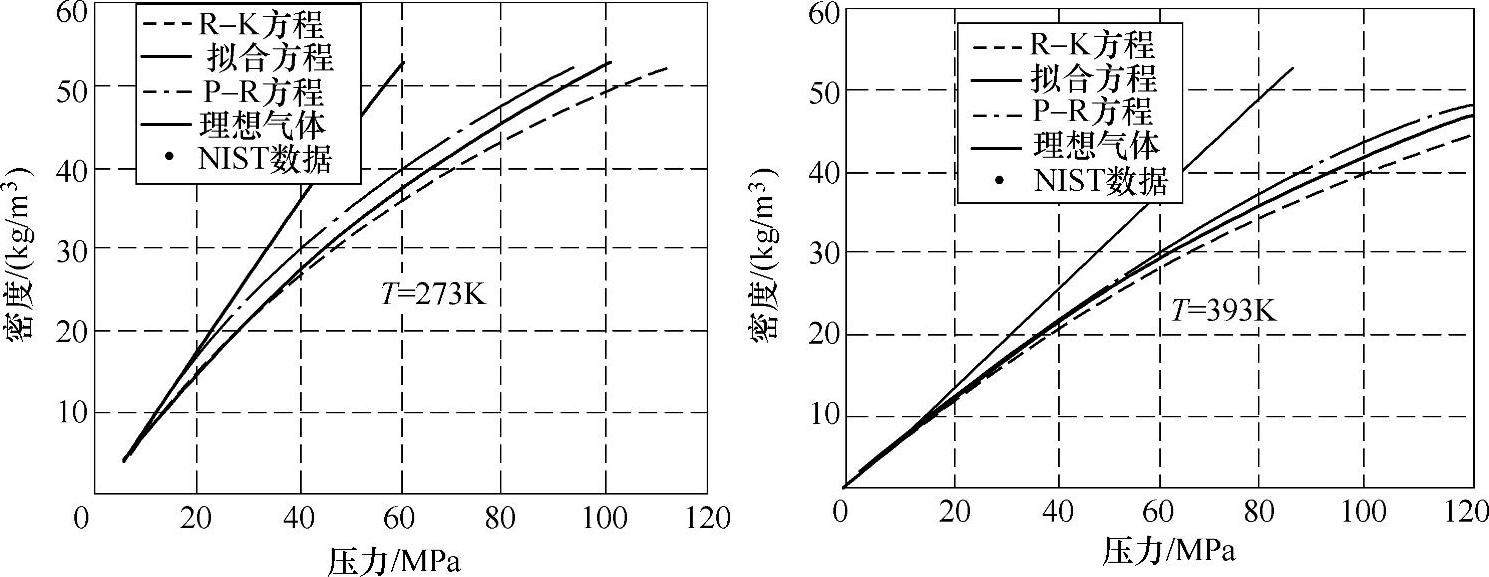
图5-2 T=273K、393K时氢气压力和密度的关系
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
相关文章






