对光催化剂的研究发现,具有d0和d10电子构型的金属离子,如Ti4+、Zr4+、Ta5+、Nb5+、W6+、Ga3+、In3+、Ge4+、Sn4+、Sb5+的氧化物、硫化物和氮化物半导体催化剂可以实现光催化分解水制氢,如图3-9所示。
1.具有d0电子构型光催化剂的制氢性能
(1)钛基光催化剂的制氢研究
1)TiO2。TiO2是首先被报道可以进行光电催化制氢的催化剂,2026年,Fujishima和Honda设计了光电化学电池,阳极是n型TiO2(金红石),阴极是铂黑电极,当电极被波长小于450nm的紫外光照射时(500W氙灯光源),在阳极上会有O2产生,Pt电极有电流流过,在Pt电极表面有氢气析出。此发现开辟了金属氧化物半导体光催化制氢的研究领域。Honda-Fujishima光电分解水制氢原理如图3-10所示。
TiO2化学性质稳定,无毒无害,而且比较廉价。它有3种晶型:板钛矿、锐钛矿、金红石。所有晶型的TiO2都含有TiO6八面体,是通过共边或共点而相互连接的;板钛矿共3条边,锐钛矿共4条边,金红石共2条边;每种晶型的带隙宽度稍有不同,金红石带隙宽度是3.0eV,锐钛矿带隙宽度是3.15eV。TiO2锐钛矿相和金红石相的晶体结构如图3-11所示。
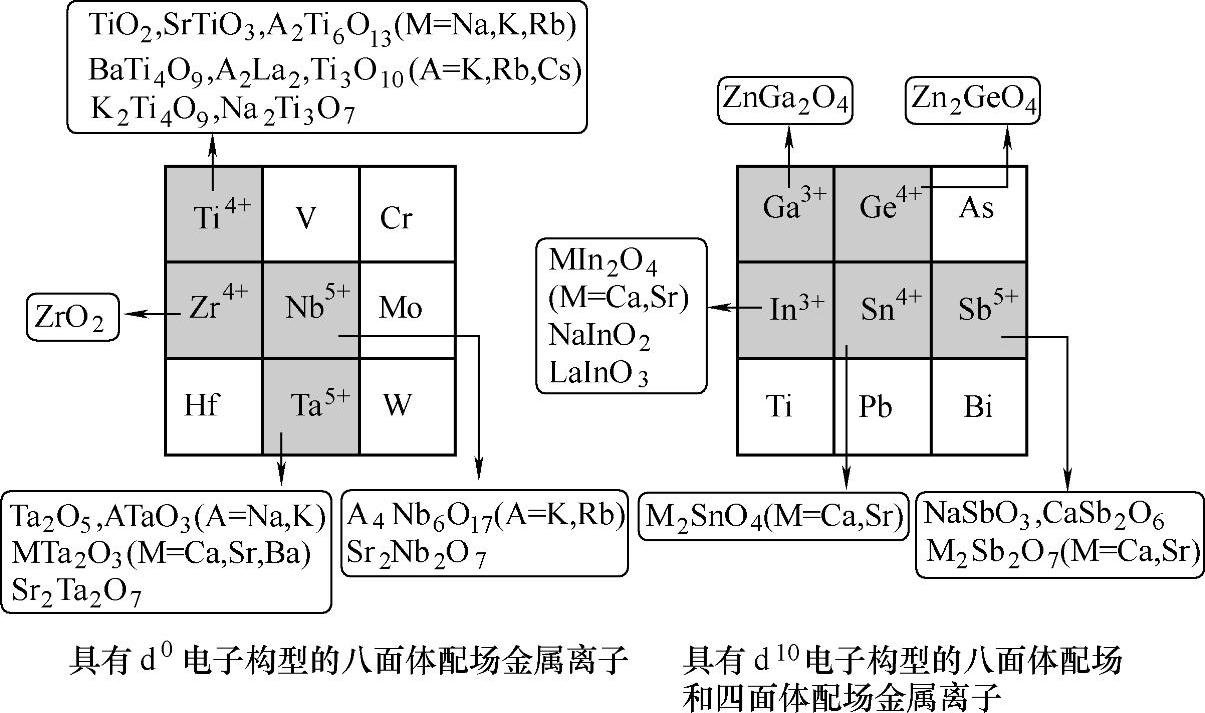
图3-9 具有d0和d10电子构型的光催化剂[50]
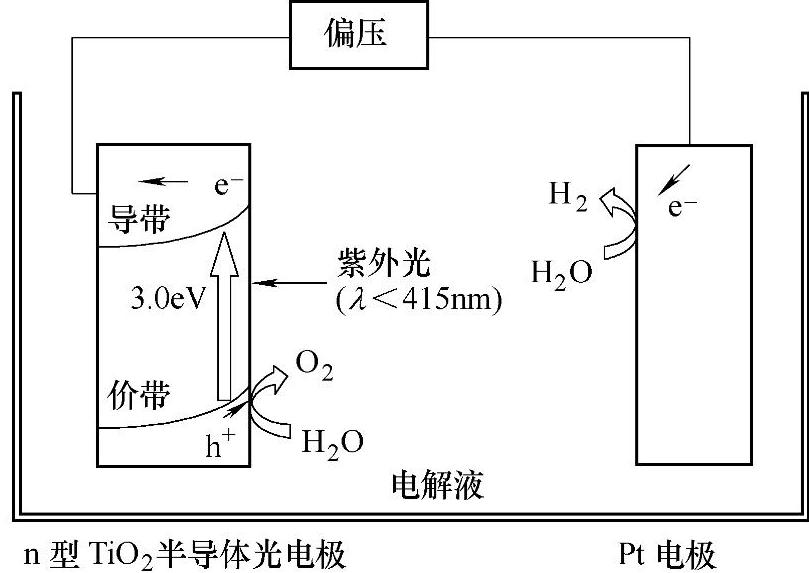
图3-10 Honda-Fujishima光电分解水制氢原理图
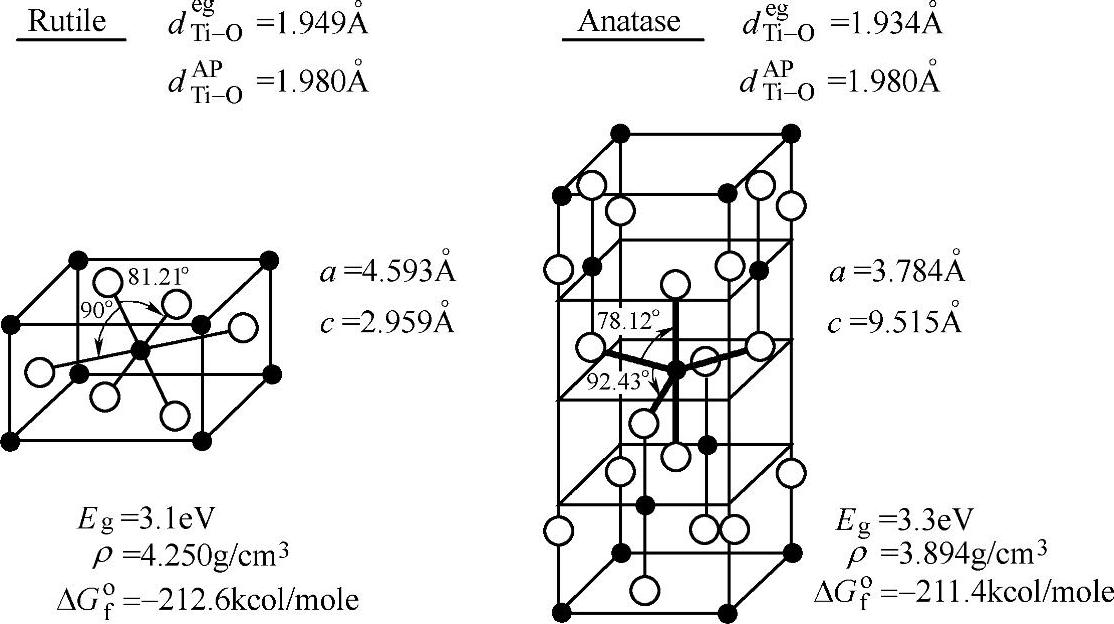
图3-11 TiO2锐钛矿相和金红石相晶体结构图[51]
TiO2光催化剂分解水产生氢气通常在紫外光下进行,且制氢的效率不高,通常要在TiO2催化剂的表面上担载共催化剂,降低H2的析出过电位,从而提高光催化制氢的效率。影响TiO2光催化分解水制氢的因素有催化剂的晶型结构、粒径、形貌、表面状态、结晶程度以及共催化剂的种类、表面状态等。
①共催化剂的作用。一些贵金属如Pt、Pd、Au颗粒作为共催化剂担载在TiO2的表面,可以提高TiO2的光催化制氢的性能[52-55]。利用水热法合成的Pt离子交换TiO2纳米管,Pt颗粒包埋在纳米管的阵列中,其光催化分解纯水的制氢效率为2.3μmol/h,分解含有甲醇牺牲剂的水溶液的制氢速率为14.6μmol/h。惰性金属Pt作为光生载流子的接收器,促进了表面电荷的迁移,这些金属颗粒的电负性很高,由于电荷积聚效应,其Fermi能级移向了负电位处。小的Pt颗粒将Fermi能级移向导带,导致带隙能的降低。半导体Fermi能级移向导带使电荷积聚成为可能,从而提高了光催化制氢的性能。利用火焰喷射分解法合成的Au/TiO2,其光催化制氢的速率为52.4μmol/(h·g),比没有进行Au修饰的TiO2的制氢速率高一个数量级,原因是Au在催化剂的颗粒表面均匀分布,且粒径较小的缘故。
②晶型的影响。TiO2的晶型不同,其光催化制氢性能也不同,随着锐钛矿相TiO2成分的增加,光催化制氢速率增加,当TiO2完全是锐钛矿相时,其光催化制氢的性能最好,这说明晶型是影响光催化剂制氢性能的重要因素之一[56]。
③TiO2形貌的影响。通过对TiO2形貌的控制来增加其比表面积,从而提高其光催化制氢的性能。利用水热法合成像花一样形貌的TiO2,尺寸在250~450nm,比表面积为350.7m2/g,500℃热处理后,得到了锐钛矿相TiO2,其光催化制氢的速率优于商用TiO2(ST-01)。无定形TiO2的光催化制氢速率为72μmol/g,花形TiO2的光催化制氢速率为342μmol/g,而经过500℃热处理之后的TiO2的制氢速率为588μmol/g,说明结晶程度也是影响光催化制氢性能的重要因素。利用溶胶凝胶的方法以碳纳米管为模板剂,合成了纯锐钛矿相、纯金红石相以及铁掺杂的锐钛矿相TiO2纳米管。锐钛矿和金红石相TiO2纳米管的表面上均匀沉积Pt颗粒,平均粒径为2nm。与具有相似比表面积的商品TiO2相比,铁掺杂的锐钛矿相TiO2纳米管的光催化分解水制氢的速率提高了614倍。主要原因是光照的面积提高,吸收区域扩展,减少了电子空穴对的复合速率,同时,均匀分布的Pt颗粒也使催化剂的制氢性能得到进一步提高。
④HF的刻蚀作用。用HF溶液化学刻蚀TiO2后,其光催化制氢的性能比未处理的TiO2的性能得到了明显提高。在可见光下光电转换效率达到9.4%,在紫外光下,光电转换效率达到了66%。经过HF处理之后,TiO2的比表面积明显增加,给体密度明显增加,意味着光生空穴向固液界面的扩散的距离变短[57,58]。
根据TiO2半导体的能带结构的特点,TiO2只能吸收紫外光,激发出光生载流子,还原水产生氢气。为了使TiO2能吸收可见光,人们通过阴离子掺杂或阳离子掺杂来调整TiO2的能带位置,实现了在可见光下的制氢,但是,光催化制氢的速率较低,光量子产率也有待进一步提高。
①阳离子掺杂。由于TiO2半导体的能带结构决定了其只能吸收紫外光,为了调整其能带结构,使其对可见光造成吸收,通常情况下,在半导体的带隙之间形成新的施主能级,将有利于其对可见光的吸收[59-62]。利用水热合成法合成Fe3+掺杂的TiO2,掺杂Fe3+之后,TiO2对光的吸收发生了红移,移向可见光,原因是带隙能降低。掺杂1.0%Fe的TiO2表现出制氢性能明显提高,有甲醇作为牺牲剂的情况下,制氢速率为12.5μmol/h;纯水体系中,制氢速率为1.8μmol/h。
②阴离子掺杂。利用卤素阴离子X-、硫离子S2-、氮离子N3-以及C对TiO2进行掺杂,可以改变半导体的价带位置,使其对光的吸收红移,对可见光产生吸收[63-66]。通过水热法,用TiCl4的HBr的甲醇溶液体系,合成出了Cl-Br共掺杂的TiO2纳米颗粒,通过增加酸度,可以分别得到锐钛矿相、锐钛矿/金红石相、金红石相、金红石相/板钛矿相TiO2。Br-和Cl-共掺杂导致TiO2的吸收带边移向了低能量区。锐钛矿相和金红石相混相的TiO2在紫外光下的制氢性能远优于商用P25的性能。如果对TiO2纳米管进行碳掺杂,形成TiO2-xCx,其表现出较高的光电流密度和高效的可见光催化制氢的性能,在可见光下,其光电流是P25的20倍
2)具有钙钛矿相结构钛酸盐。钙钛矿(perovskite)是以俄罗斯地质学家Perovski命名。通常情况下,具有与天然矿物钙钛石(CaTiO3)晶体结构相似的氧化物,被称为钙钛矿型氧化物,其通式可以用ABO3来表示,理想的钙钛矿型物质具有Pm3m空间群,其晶体结构如图3-12所示。
A位离子主要被稀土和碱土金属离子占据,B位离子主要被过渡金属离子所占据。A离子被最近邻的O离子包围,形成12配位,B离子与O离子形成6配位,共点的BO6八面体形成了骨架结构,中心位置被A离子所占据。由于A位置和B位置很容易发生部分取代,会使多种离子容纳入晶体结构中。
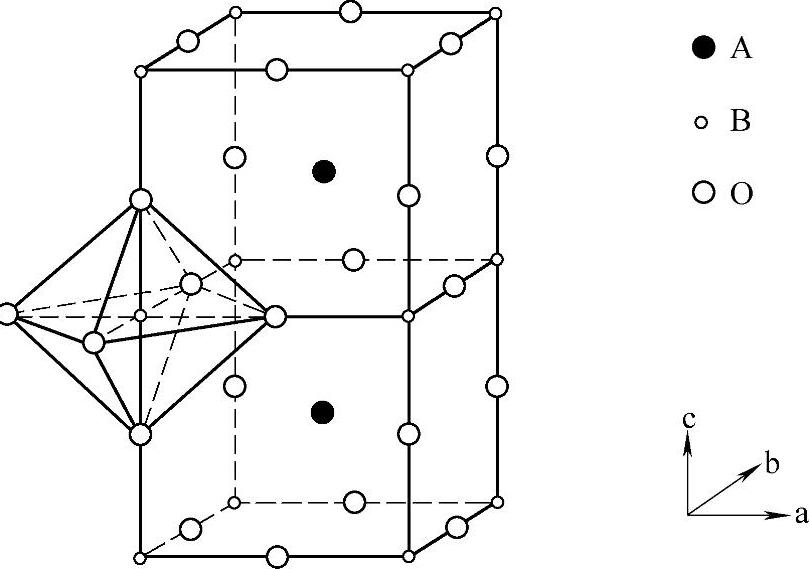
图3-12 钙钛矿相物质ABO3结构[67]
各八面体通过共有的氧离子连接,A离子占据八面体之间的空隙,B离子位于八面体的内部,氧八面体在空间有规则地排列,组成整个晶体。A可以是一价、二价、三价离子,如Li+、K+、Ca2+、Sr2+、Ba2+、Pb2+、La3+;B可以是三价、四价、五价离子,如Ni3+、Ti4+、Ta5+等。
钙钛矿结构具有很大的包容性和可变性,通常A位离子是半径较大的阳离子,B位离子为体积较小的高价阳离子,A位和B位阳离子的价态可以按Ⅲ-Ⅲ,Ⅱ-Ⅳ和Ⅰ-Ⅴ匹配,也可以由几种不同的离子共同占据一种位置。只有当参与晶体结构的各个离子半径满足一定的关系时,如B离子的半径要符合AO12和BO6配位多面体的条件,半径rA>0.90Å,rB>0.15Å,才能形成理想的钙钛矿结构。
具有钙钛矿相结构的钛酸盐,其A位离子为碱金属阳离子时,催化剂表现出较好的光催化制氢性能[68]。具有六角隧道结构的层状钛酸盐M2Ti6O13(M=Na、K、Rb)担载RuO2后,M2Ti6O13光催化剂分解水的性能与光生载流子的产生有关,隧道结构中变形的TiO6八面体对其制氢的性能起到很大的作用[69]。
2026年首先将具有钙钛矿结构的SrTiO3应用在光电催化分解水制氢上,其带隙宽度为3.2eV,比TiO2的略大。研究发现,担载共催化剂之后,SrTiO3表现出较高的光催化制氢的性能[70-72]。如果以SrTiO3为母体,经过离子掺杂或其他氧化物复合,都可以适当提高催化剂的光催化性能。具有(100)取向的层状钙钛矿Sr3Ti2O7,带隙宽度为3.2eV,可以在紫外光下,直接分解水产生氢气。如果掺杂Pb2+离子,则产生了PbTiO3,带隙宽度明显减小,为2.98eV,Pt作为共催化剂时,可以实现可见光催化制氢。
BaTi4O9结构的主要特点是五棱柱形隧道中变形的TiO6八面体,其对分解水制氢的作用是有效的。有研究报道了RuO2担载BaTi4O9光催化剂的制氢性能。变形的TiO6八面体会产生偶极矩,其会有效地进行光生电荷的分离。另外,隧道结构会使共催化剂RuO2均匀地分布。隧道空间会形成巢穴,带有脊的空穴位置,使RuO2恰好容纳在其中。RuO2小颗粒与TiO6八面体之间强烈的相互作用有利于光生电子和光生空穴迁移到吸附的位点。
稀土离子的Ln2Ti2O7是具有层状钙钛矿相的催化剂,其具有光催化制氢的性质,其在紫外光下进行分解水制氢的性能随着Ln离子的量不同而有所差异[73-77]。当在合成样品的过程中加入过量5%的Ln时,样品的制氢性能得到显著提高;原因是过量的Ln可以抑制杂相的生成,增加样品的比表面积。Y2Ti2O7光催化剂的制氢性能的研究表明,5%过量的Y可以抑制金红石相TiO2的形成,因为在高温条件下,会有金红石相TiO2生成于Y2Ti2O7的表面,其会降低光催化制氢的性能。对立方相结构的Y2Ti2O7,GdTi2O7、单斜钙钛矿结构的LaTi2O7的紫外光催化分解水的产氢的研究表明这些材料都是由共点的TiO6八面体构成,八面体网状的结构加快了电子和空穴的迁移,因此提高了其光催化制氢的性能。
(2)钽基光催化剂的制氢研究(https://www.daowen.com)
除了TiO2及钛酸盐等钛基的光催化剂可以实现光催化制氢之外,研究还发现Ta2O5和钽酸盐也能实现光催化制氢。Ta2O5是在紫外光区有吸收的光催化剂,由于其导带能级位置与水的还原电位相匹配,在光催化制氢方面具有巨大潜力。
研究发现Ta2O5的形貌对其制氢的性能产生重要的影响。若利用SiO2的增强作用,使介孔Ta2O5仍然保持有序的二维六角结构。通过将固相结构从无定形转向晶态结构,介孔Ta2O5紫外光催化分解水制氢的性能提高了接近1个数量级。NiOx(3.0wt%)担载晶化的介孔Ta2O5时,其光催化分解水制氢的速率为3360μmol/h,是所有报道的数据中最高的。如此高的活性归因于光生电子和空穴有效地通过晶相的薄壁,从催化剂的内部传输至催化剂的表面上。
钽酸盐的晶体结构对其制氢性能产生较大影响。当La3TaO7为立方相时,其光催化制氢性能很低,当其转向正交斜方晶系时,光催化分解水制氢的速率明显提高,达到79μmol/h[78]。有研究比较了SrTa2O6、Sr2Ta2O7、Sr4Ta2O9和Sr5Ta4O15紫外光催化分解水产氢量,光催化制氢速率高低的顺序如下: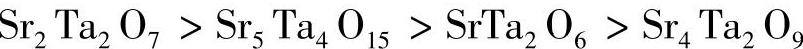 ,分别为2141μmol/h、1194μmol/h、394μmol/h、32μmol/h。造成光催化制氢效率不同的因素在于TaO6八面体拓扑结构的不同。Sr4Ta2O9、Sr5Ta4O15和Sr2Ta2O7化合物中TaO6八面体共点相连,Sr4Ta2O9拥有双重的钙钛矿结构和TaO6结构,与立方面的对角线相邻,使其与导带之间的能量变小,所以不能使光生载流子进行有效的迁移[79]。
,分别为2141μmol/h、1194μmol/h、394μmol/h、32μmol/h。造成光催化制氢效率不同的因素在于TaO6八面体拓扑结构的不同。Sr4Ta2O9、Sr5Ta4O15和Sr2Ta2O7化合物中TaO6八面体共点相连,Sr4Ta2O9拥有双重的钙钛矿结构和TaO6结构,与立方面的对角线相邻,使其与导带之间的能量变小,所以不能使光生载流子进行有效的迁移[79]。
光催化剂的导带位置也是决定催化剂制氢性能的重要因素,有研究比较了具有相似结构的Sr2Ta2O7和Sr2Nb2O7的光催化分解水制氢的性能,其带隙宽度分别为4.6eV和3.9eV。在NiO担载量为0.15%时,在270nm波长下,Sr2Ta2O7的光催化制氢的速率达到了1mmol/h,而Sr2Nb2O7的光催化制氢的速率为0.1mmol/h。虽然两者具有相似的微观结构,但是光催化制氢的速率相差很大,造成这种差异的原因是半导体催化剂导带的位置不同。只有具有更负的电极电位的导带,半导体的制氢速率才能更高[80]。
催化剂的表面状态影响其光催化制氢的性能。NaTaO3的光催化制氢速率为2.18mmol/h,经过NiO(0.2%)担载,并掺杂2%La的NaTaO3体系光催化具有很高的产氢速率(19.8mmol/h),量子效率达到56%。是目前紫外光催化剂分解水制氢性能最好的催化剂。La的加入使NaTaO3的结晶程度提高,同时,在催化剂的表面上形成了阶梯状的结构,增加了比表面积,同时抑制光生电子和光生空穴的复合,在催化剂的表面不同位置析出氢气和氧气,使逆反应发生的几率变小,从而提高了光催化制氢的效率[81-83]。
在半导体原有的能带中,引入新的能带,可以改变光催化剂的制氢性能。2026年邹志刚等人利用传统的高温固相烧结法合成了In1-xNixTaO4(x=0~0.2)光催化剂,InTaO4中每个晶胞中包含一个TaO6八面体和一个InO6八面体,其在可见光照射下,直接分解水产生氢气,产氢速率为16.6μmol/(L·h),光量子产率为0.66%。Ni的掺入直接导致带隙宽度减小,这是Ni3d轨道的重要贡献。尽管产氢效率不高,但却标志着可见光催化分解水制氢取得了突破性进展[84]。
(3)铌基光催化剂的制氢研究
与体相材料相比,具有层状结构的离子交换型光催化剂具有更优越的分解水制氢的性能。利用层状材料作为催化剂的优势在于利用了内层空间作为了反应点。Ni担载的A4Nb6O17(A=K或Rb)催化剂表现出稳定的析氢特性和紫外光下较高的量子产率。K4Nb6O17由NbO6八面体单元构成,通过氧原子形成了二维层状结构。这些层带有负电荷,带有正电荷的K+离子存在于层与层之间,来保持与带负电荷层之间的电荷平衡。K4Nb6O17最突出的特点是两种类型的层状空间交替出现,这两种类型的层间表现出不同的离子交换特性。位于第一种类型层间的K+离子能够取代Li+、Na+和其他多价态的阳离子;位于第二种类型层间的K+离子只能取代一价态的阳离子(如Li+和Na+)。另外,K4Nb6O7很容易发生水合作用,尤其在空气潮湿的环境中和水溶液中,这表明反应物和水分子在光催化反应过程中,很容易插入到层间空隙中。铌酸盐的结构如图3-13所示[85]。
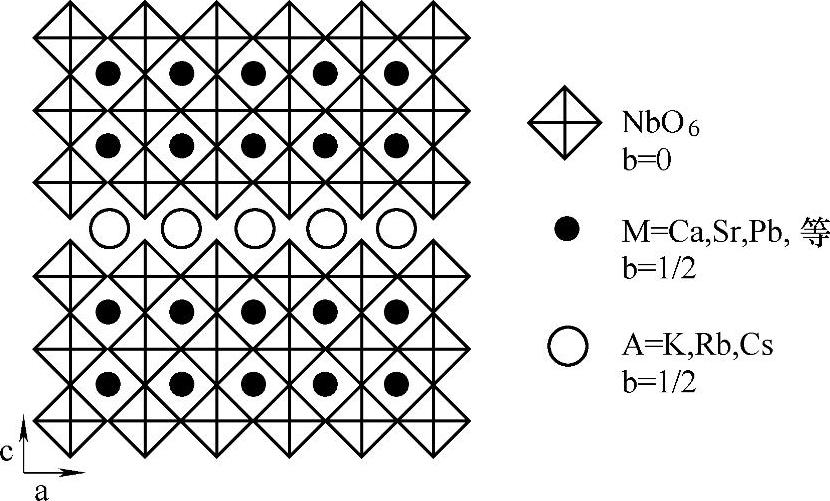
图3-13 A[Mn-1NbnO3n+1](n=3)结构图
铌酸盐具有独特层状结构,有利于光生电子和光生空穴的分离,使氢气和氧气在不同的位点析出,从而提高了其光催化制氢性能。除了其具有独特的片层结构,铌酸盐的形貌也影响着其光催化制氢的性能[86]。利用水热法合成KNbO3纳米线,属于正交晶系,其光催化分解水制氢的速率为5.17mmol/(h·g),是所有KNbO3材料中性能最好的。
铌酸盐与钽酸盐类似,都具有较大的带隙能,虽然不利于对可见光的吸收和利用,但是可以在半导体的带隙之间进行能带的调整,缩短带隙宽度,使其实现可见光催化制氢。AgTaO3和AgNbO3光催化剂具有钙钛矿结构,它们的带隙能分别为3.4eV和2.8eV。尽管AgMO3和NaMO3(M=Ta、Nb)的结构类似,但是AgMO3的带隙能比NaMO3的带隙能小。AgMO3的价带是由Ag4d轨道和O2p轨道的杂化轨道构成,其电极电位比O2p轨道更负。AgNbO3表现出可见光催化制氢的性能,产氢速率为10μmol/h[87]。
2.具有d10电子构型的光催化剂的制氢性能
具有d10电子构型的ⅢA、ⅣA、ⅤA金属离子的氧化物、硫化物和氮化物都可以实现光催化分解水制氢。通常情况下,这些金属的氧化物可以实现紫外光催化制氢,原因是这些金属的s轨道和p轨道构成的半导体的导带与O2p轨道构成的价带之间的能量差较大,价带上的电子只能被紫外光的能量所激发。为了调整能带的结构,通过氮掺杂或硫掺杂,形成氮化物或硫化物,使价带的组成由O2p轨道,变成了N2p轨道或S3p轨道与O2p轨道共同组成半导体的价带,由于N2p轨道的位置和S3p轨道的位置比O2p轨道的位置要高,所以,经过硫掺杂或氮掺杂的氧化物半导体,通常其带隙宽度变窄,从而实现其可见光下的制氢。
影响d10电子构型的金属氧化物和氮化物光催化性能的因素很多,光催化剂导带的区域分布、催化剂表面的共催化剂、催化剂的结晶程度、催化剂的金属掺杂等都会对催化剂的性能产生影响。
1)光催化剂制氢性能的提高取决于催化剂的导带区域分布,在导带的位置高于水还原电位的前提下,半导体导带分布越广,光生电子向表面传输速度越快,导致光催化制氢速率大大提高。
新型的可见光制氢催化剂(Ga1-xZnx)(N1-xOx)是GaN和ZnO的固溶体,是Ⅲ-Ⅴ族和Ⅱ-Ⅵ族半导体,GaN和ZnO的带隙能均大于3eV,两者都不能吸收可见光;但是,(Ga1-xZnx)(N1-xOx)的带隙宽度小于3eV,在可见光区有明显的吸收,其带隙能取决于催化剂的成分(x),固溶体的带隙能降低的原因是由Zn和O组分的电子行为造成的[88-90]。表面分散RuO2颗粒的Zn2GeO4催化剂分解水制氢的速率达到22μmol/h,原因是变形GeO4四面体的偶极矩形成的内场,促进了光生电荷的分离;Ge5p轨道构成的导带分散较广,有利于光生电子的传输,避免光生电子的复合,使光生电子很容易地迁移到较细的RuO2颗粒表面[91]。ZnGa2O4催化剂的价带是由O2p轨道构成,而导带主要是由杂化的Ga4s4p和Zn4s4p轨道构成,导带分布较广使光生电子能够自由移动,使光催化分解水制氢的速率为12μmol/h[92]。In2O3和Y2O3的固溶体YxIn2-xO3(x=0.9~1.5)的光催化制氢性能研究表明,当x=1.3时,其光催化制氢的性能是最佳的,制氢速率约为8μmol/h。经过DFT计算结果显示催化剂的价带(HOMO)是由O2p轨道组成,而导带(LOMO)是由In5s和O2p轨道共同组成[93]。
2)催化剂表面共催化剂的种类影响光催化剂的制氢性能。
NiO、RuO2、Rh2O3、IrO2等作为共催化剂的研究结果表明,当RuO2作为共催化剂时,催化剂的制氢性能比NiO作为共催化剂时的性能高。IrO2和Rh2O3都可以提高催化剂的制氢性能[94-96]。
3)光催化剂的结晶程度影响光催化剂的制氢性能。光催化剂的结晶程度越好,使光生载流子复合的缺陷越少,最终导致光催化制氢活性提高。
新型Ga-Zn-In-O-N化合物结晶程度相当好,其最大吸收波长达到600nm,在可见光的作用下,光催化制氢的速率约为10μmol/h[97]。为了提高(Ga1-xZnx)(N1-xOx)光催化剂和(Zn1+xGe)(N2Ox)催化剂在可见光下的分解水制氢的性能,在适当的温度下对其进行了后处理,以提高结晶性,其光催化制氢的性能明显提高。活性提高的原因是作为光生电子和光生空穴的氧缺陷密度减少[98,99]。结晶程度很好的(Ga1-xZnx)(N1-xOx)催化剂的可见光催化制氢的速率可以达到37μmol/h[100]。
4)金属离子的掺杂可以提高催化剂的光催化制氢的速率。
一些二价金属离子(如Mg2+、Zn2+、Be2+)对负载RuO2的GaN进行了掺杂,发现可以提高GaN在紫外光催化制氢过程中的稳定性和光催化的性能。未掺杂的GaN的主要吸收带位于390nm,掺杂之后吸收带略向长波方向移动。对于Mg2+掺杂的RuO2-GaN,随着Mg掺杂量的增加,光催化制氢的性能增加,但是其荧光强度降低。二价金属离子掺杂使GaN成为p型半导体,从而能够提高空穴的浓度和移动[101]。
除了镓、锗的氮氧化物之外,铟、锡和碲化合物也具有光催化制氢的性能。对其进行金属离子掺杂之后,可以提高这些催化剂的光催化制氢性能。南京大学邹志刚小组研究了Sr取代BaSnO3中的Ba在晶格中的位置之后,BaSnO3的光催化制氢性能得到提高。密度泛函理论计算结果表明Ba1-xSrxSnO3(x=0、0.5、1.0)的导带底逐渐向上推移,Sr5s轨道对导带底有所贡献,随着Sr量的增加,此能级轨道逐渐变成主要的成分。惰性的Sr离子参与到SnO32-框架的电子结构中,不仅会提高光生电子的还原能力,而且会有利于光生载流子的输送,因此金属离子Sr掺杂之后,使BaSnO3的光催化分解水制氢性能得到提高,达到44μmol/h[102]。
利用固相法合成的Cr掺杂的Ba2In2O5/In2O3复合半导体氧化物,可见光催化甲醇产氢速率为7.9μmol/h,紫外光产氢速率为29.3μmol/h。从能带结构上看,Cr-Ba2In2O5表现出较高的制氢性能,而Cr-In2O3表现出较高的析氧性能,主要原因是Cr-Ba2In2O5的带边比Cr-In2O3的带边所处的位置更负,Cr-Ba2In2O5导带上的光激发电子很容易落到Cr-In2O3的导带中,而Cr-In2O3的价带中的空穴很容易跳入Cr-Ba2In2O5的价带中。氧化还原反应分别在Cr-Ba2In2O5和Cr-In2O3上进行,在Cr-In2O3上析出氢气,在Cr-Ba2In2O5上析出氧气。氢气和氧气可以同时在C-BIO体系中析出。造成光催化制氢性能提高的原因是Cr的加入不仅使导带位置偏移,还使价带的位置偏移。一般情况下,肖特基势垒存在于Cr-In2O3和Cr-Ba2In2O5界面处,因为两者都是n型半导体。如果两者界面处的空间电荷区域太小,就不能形成肖特基势垒,因此会产生光生载流子的量子隧道效应。即使对于大颗粒的催化剂之间形成了肖特基势垒,也会因为在催化剂之间形成的合金,使势垒高度有效地降低[103]。
除了对于具有d10电子构型的氧化物和氮化物研究之外,近期研究还发现一些具有d10电子构型硫化物固溶体光催化剂,对可见光有响应,在以硫化物为牺牲剂的条件下,可以将水催化分解生成氢气[104-106]。
ZnS-CuInS2-AgInS2固溶体,其晶体结构取决于其成分,(AgIn)xZn2(1-x)S2固溶体是具有较宽带隙能的ZnS和具有较窄带隙能的AgInS2组成的。由于Cu3d轨道和Ag4d轨道之间相互作用,使固溶体对光的吸收波长发生红移,带隙宽度达到1.77eV。当Ru作为共催化剂时,其产氢速率可为2.3mmol/h。
AgInZnS是AgInS2和ZnS的固溶体,Pt(3wt%)-(AgIn)0.22Zn1.56S2的带隙能为2.3eV,可见光下的量子产率为20%,以在硫化物为牺牲剂的条件下,可见光制氢速率达到3.3L/m2h1。由于Ag4d轨道和In5s5p轨道对价带的贡献导致能带位置的改变,带隙宽度为2.3eV,从而实现可见光催化制氢;而固溶体的光催化制氢的速率取决于硫化物固溶体的成分。
具有d10电子构型的氮化物和硫化物,其价带和导带的位置与水的氧化电位和还原电位匹配,同时具有合适的带隙宽度,能够吸收可见光,实现可见光催化制氢,但是,催化剂的稳定性比较差,在制氢的过程中不得不使用牺牲剂,这点成为其实际应用的瓶颈。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






