Ⅲ主族的元素的三氢化物单体分子很难得到,但由于其中心原子具有缺电子的结构,很容易接受具有孤对电子的配位基团的配位,形成四配位的中心原子结构。一个很重要的配体就是氢负离子H-。铝氢化物和硼氢化物属于配位氢化物,结构中含有AlH4-和BH4-基团,可以看成AlH3和BH3接受一个H-配位后的产物。
金属硼氢化物的稳定性随金属与BH4基团之间键的离子型的增强而提高,因此碱金属的硼氢化物具有较高的稳定性,而诸如Al(BH4)3和Zr(BH4)4等共价型的硼氢化物则很不稳定,表现出类似于乙硼烷的性质,例如在空气中爆炸性的反应,以及迅速的水解等。电负性高于B的元素如Si、P的硼氢化物尚未制得,通常产物为SiH4和PH3。
所有的碱金属和碱土金属都能形成硼氢化物,碱金属的硼氢化物都具有较高的稳定性,分解温度最低的NaBH4也在300℃以上,能溶于醚类、胺类以及液氨中,在质子溶剂如水和醇中也有一定的溶解性,但会水解放出氢气。最常见的硼氢化物为硼氢化钠,其具有NaCl型的面心立方结构,构成单元为Na+阳离子和BH4-阴离子。NaBH4是一种相对较温和的还原剂,在有机合成中用于将醛、酮、酯和酰卤还原成相应的醇,反应可以定量发生,但对于较稳定的羧酸、酰胺、亚胺、腈等基团则不能还原。NaBH4的冰水溶液是金属纳米颗粒制备中常用的还原剂。NaBH4与其他金属卤化物的反应是制备许多金属的硼氢化物的常用方法。NaBH4还可以作为直接硼氢化物燃料电池的燃料。
铝氢化物不如相应的硼氢化物稳定,其分解温度较低,水解反应更为剧烈,还原性也更强。氢化锂铝LiAlH4是最常见的铝氢化物,具有单斜结构,构成单元为Li+阳离子和AlH4-阴离子,其结构如图2-28所示。
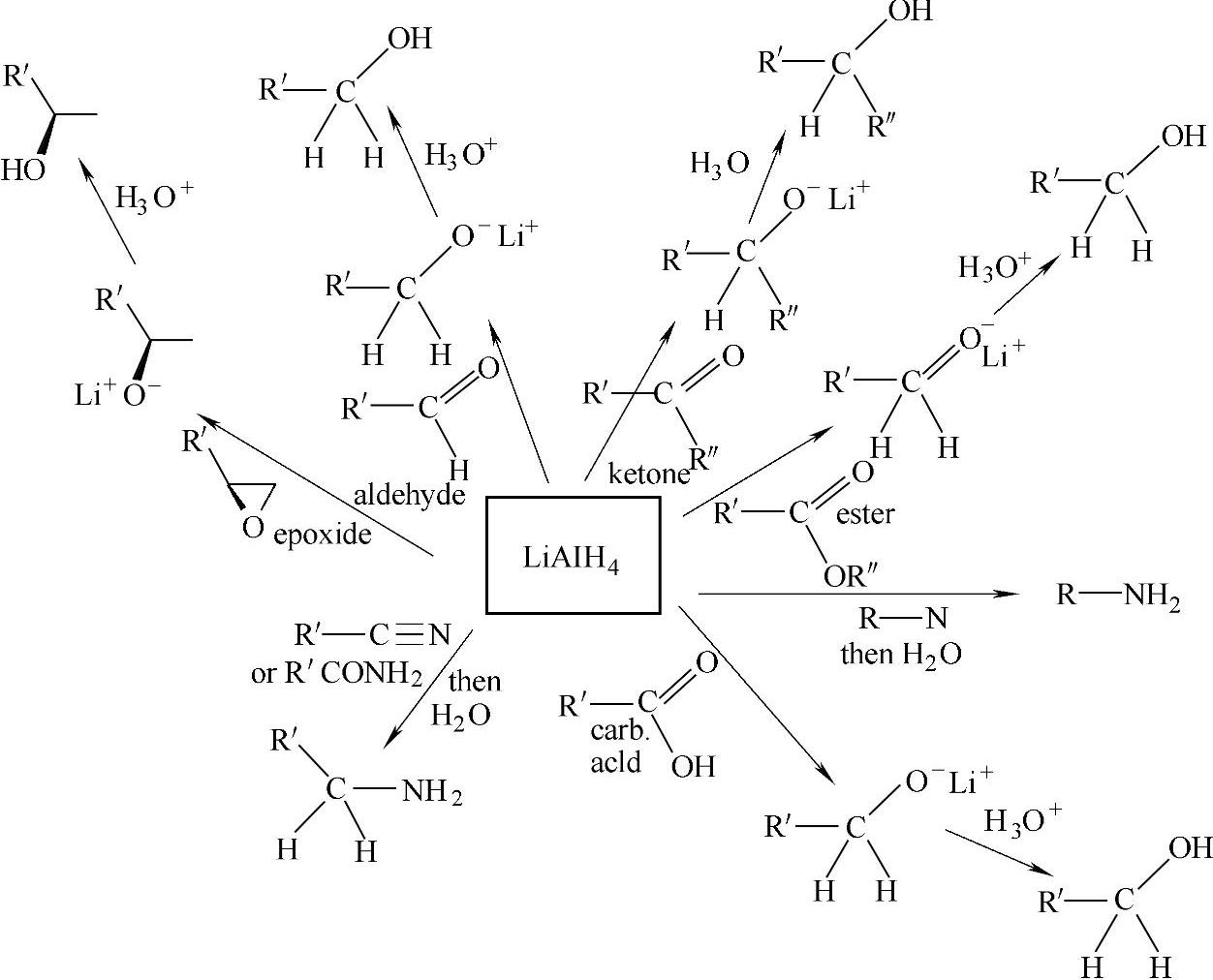
氢化锂铝是很强的还原剂,在许多有机合成反应中有重要应用,能有效地还原不饱和的碳氧和碳氮键,得到相应的醇或胺。LiAlH4在有机合成中的应用总结于图2-29中。在无机化学中LiAlH4由于其高反应活性且能作为商品获得,因此成为制备氢化物、铝氢化物、硼氢化物的重要原料。例如NaH的制备:
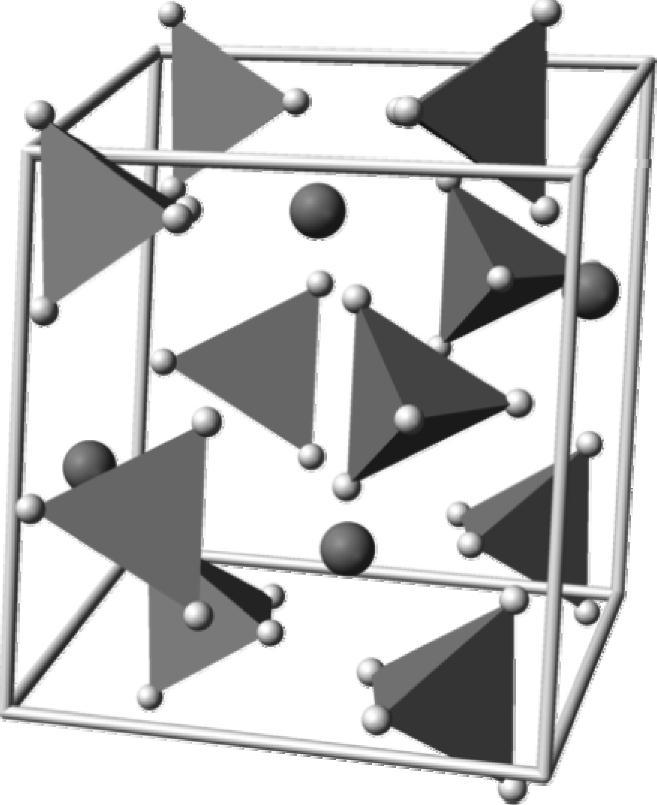
图2-28 LiAlH4的晶体结构(四面体表示AlH4-,大球体为Li+)
 (www.daowen.com)
(www.daowen.com)
图2-29 LiAlH4在有机合成中的应用
铝氢化物的合成方法主要有两类,第一类是通过在醚溶剂如乙醚、四氢呋喃、乙二醇二甲醚中以金属氢化物和无水AlCl3进行离子交换生成[34]:4LiH+AlCl3=LiAlH4+3LiCl。由于LiAlH4在醚类溶剂中具有一定的溶解度,因而可以通过过滤的方法滤去LiCl,得到LiAlH4的醚溶液,而后通过蒸馏除去部分醚溶剂使LiAlH4析出,这一反应一般称为Schlessinger反应,由H.I.Schelessinger等人于1947年报道,也是工业上大量制备LiAlH4的方法。H.I.Schlessinger、H.C.Brown和A.E.Finholt等人在1930~1950年间陆续报道了常见的硼氢化物和铝氢化物的合成。
碱金属铝氢化物也可以通过碱金属单质(或氢化物)、Al以及H2直接在高压下合成,反应通常用四氢呋喃为溶剂: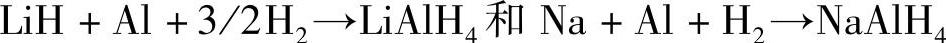 。这一反应的优势是对原料的利用率较高。由于单质Na价格较低,用这种方法合成NaAlH4是较为合适的。
。这一反应的优势是对原料的利用率较高。由于单质Na价格较低,用这种方法合成NaAlH4是较为合适的。
碱金属硼氢化物可以通过硼酸酯与碱金属氢化物反应得到: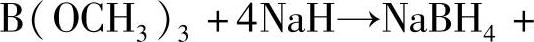 3NaOCH3。其他硼氢化物可以通过碱金属硼氢化物与相应金属的氯化物通过离子交换反应得到。
3NaOCH3。其他硼氢化物可以通过碱金属硼氢化物与相应金属的氯化物通过离子交换反应得到。
轻金属的硼氢化物和铝氢化物由于其极高的氢含量而成为近年来备受关注的储氢材料。铝氢化物由于其稳定性较低,能在较低的温度下分解放出H2,在Ti掺杂的NaAlH4中已经观察到了循环性。氢含量更高的LiAlH4成为近年来的研究热点,其热分解过程被确认为一个三步反应:在150~170℃下分解得到Li3AlH6;Li3AlH6在200℃以上进一步分解得到LiH;LiH的分解需要更高的温度,Al的存在能通过合金化降低其放氢温度,但也在400℃以上。
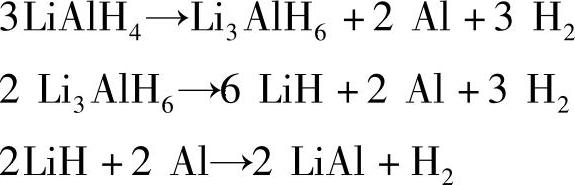
虽然LiAlH4的理论氢质量分数达到10.6%,但由于LiH放氢困难,以LiH+Al为最终产物时实际氢含量为7.96%wt。另一问题是放氢产物通过吸氢转化为LiAlH4较为困难,若以Li3AlH6为原料,仅以第二步反应作为吸放氢循环,实际氢质量分数仅为5.6%。硼氢化物热分解温度要高于相应的铝氢化物,分解过程也是复杂的多步反应。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。








