这里的主族元素氢化物不包括正氢型的含氢化合物(即命名为“某化氢”类型的化合物,包括水、氨)和碳氢化合物。主族元素氢化物种类繁多,此处以每一主族中最为重要的氢化物为代表作简要介绍。
1.第三主族
(1)硼烷[28]
第三主族中的硼元素能与氢形成多种共价型的氢化物,这些氢化物在化学键的性质上类似于碳氢化合物,故命名为硼烷。人们对硼烷的研究始于1912年前后,20世纪50年代以来高能燃料的研究以及现代表征技术的进步使硼烷化学有了新的发展。最简单的硼烷分子是乙硼烷B2H6,目前确认的硼烷中性分子已超过20种,此外还包括种类繁多的硼氢阴离子。
硼烷可以通过多种方法制备,包括
硼化物水解: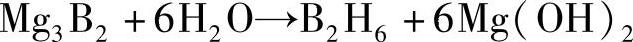
氢气还原卤化硼: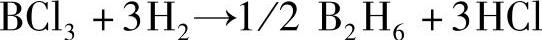
阴离子取代: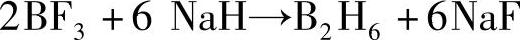
质子迁移: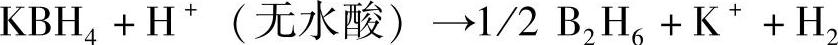
乙硼烷是一种无色气体,生成焓为正值,从热力学角度看乙硼烷是不稳定的,因此化学性质非常活泼;同时有剧毒,能发生自燃,故使用和处理时需非常小心。B-H键活泼性使B2H6成为有机合成中的有用试剂,例如B2H6能对烯烃进行加成,几乎能够定量得到相应的有机硼化物(硼氢化反应):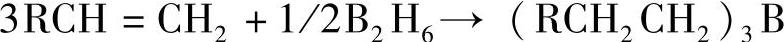 。这个加成反应是具有立体选择性的,得到顺式的加成产物。得到的硼氢化物可以进一步发生反应,例如通过水解可以获得相应的醇。
。这个加成反应是具有立体选择性的,得到顺式的加成产物。得到的硼氢化物可以进一步发生反应,例如通过水解可以获得相应的醇。
乙硼烷具有非常特殊的成键结构,其结构示意图如图2-24所示。这是一个三中心的B-H-B氢桥键构成的分子,其中两个硼原子分别以两个sp2杂化轨道与氢原子的1s轨道重叠,形成4个经典的σ键(即B-H单键),这4个键处于同一平面上;硼原子余下的一个sp2杂化轨道和一个未杂化的p轨道重新组合成两个轨道,分别指向平面上方和下方,并通过一个氢原子的1s轨道对称地与另一个硼原子形成B-H-B三中心两电子键。在这一结构中,虽然B-B键的键长与单质硼中的B-B键长十分接近,但两者之间并未直接成键,而是通过两个B-H-B桥键相连,因此两个硼原子之间不能自由旋转。
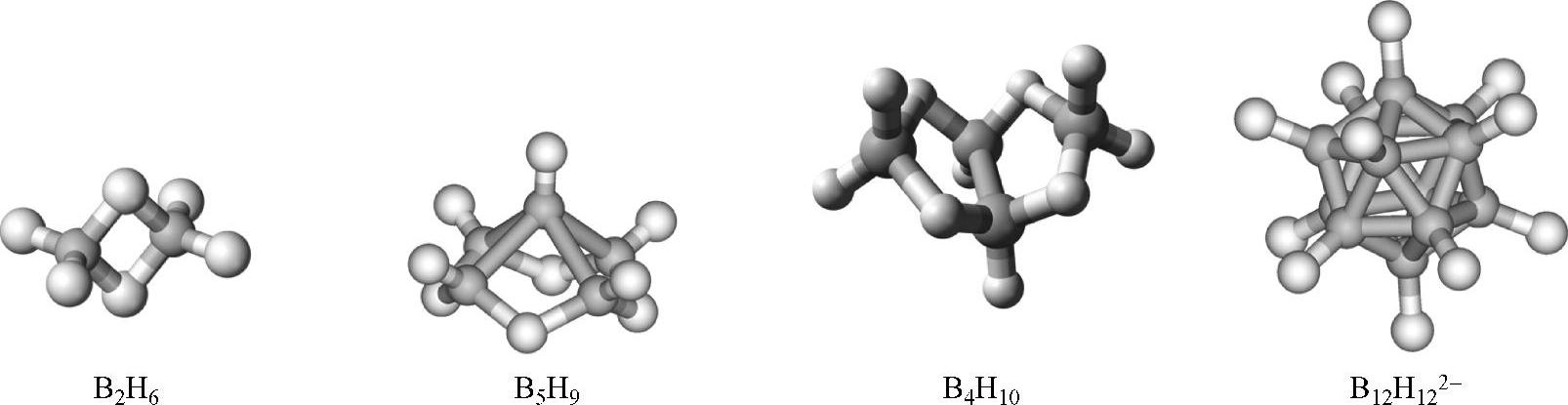
图2-24 几种硼烷和硼烷阴离子的结构示意图(深色原子代表B,浅色原子代表H)
通过乙硼烷加热分解可以得到分子量更高、结构更为复杂的硼烷,如2B2H6→B4H10+H2。常见的含多个硼原子的中性硼烷分子和硼氢阴离子包括丁硼烷B4H10、戊硼烷B5H9和B5H11,以及高度对称的十二面体阴离子B12H122-,它们的结果如图2-24所示。其中B12H122-阴离子具有完整的闭式B12二十面体,类似于α-B中的结构。可以通过BH4-与中性硼烷分子的加和制备得到,如在三乙胺或二甘醚中,180℃下B2H6或B4H10与NaBH4反应可以制备得到B12H122-阴离子:
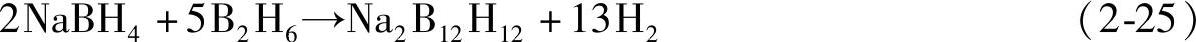
B12H122-的结构是许多硼氢化物热分解过程中的中间产物。
对于多硼烷,其骨架结构可以分为3类。第一类结构中具有闭合的硼多面体结构,硼多面体中每个面均为由3个硼原子构成的三角形,称为闭式,英文名中用词头closo-标明;第二类结构是具有BnHn+4组成的非闭合结构,称为巢式结构,英文名中用词头nido-表示;第三类结构是具有BnHn+6组成的非闭合结构,称为网式结构,英文名中用词头arachno-表示。这些骨架结构(包括中性分子和阴离子)可以通过成键电子对的数目推导。成键电子对的总数减去分配给每个骨架原子的一个B-H键所需的一对电子之后的总数称为骨架成键电子数,对于含有n个硼原子的硼烷,骨架成键电子对数目为n+1、n+2和n+3时分别采取闭式、巢式和网式结构。
在上述这些多硼烷结构中,每个硼原子至少形成一个B-H单键,某些硼原子还会形成BH2基团,此外存在着B-B单键,以及3种三中心两电子共价键:B-H-B氢桥键,闭合型的B-B-B键,开式的B-B-B桥键。在这些多硼烷中用比三中心两电子键离域性更强的多中心键来描述其成键结构更为合适。从分子轨道的角度对这种离域键更加容易理解,其基本思想是参与多中心键的几个原子轨道通过线性组合形成分子轨道,其中包含若干成键、非键和反键轨道,电子按照能级高低依次填入相应的分子轨道中。因此从分子轨道角度讲,电子数小于轨道数不再是一个问题。
(2)铝的氢化物
铝的氢化物为固体,具有多种不同的相结构,其中最稳定的为α-AlH3,具有菱面体型的六方结构,每个Al周围有6个H原子。AlH3对空气和水不稳定,但溶于四氢呋喃等醚类溶剂。分子形态的Al-H化合物不稳定,仅能在气相中形成。利用低温基质可以捕捉这些不稳定的分子,例如利用低温惰性气体基质,可以捕捉到铝与氢形成的AlH3型分子,具有平面三角结构;在固体H2基质中观察到了类似于乙硼烷的Al2H6结构,金属Ga也能形成类似的结构。
AlH3可以以LiAlH4为原料通过离子交换反应制备得到[29]:
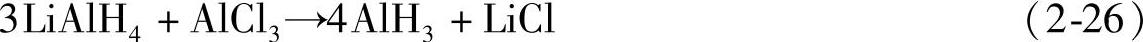
反应在四氢呋喃或乙醚中进行,生成的AlH3能溶于这些醚类溶剂,通过过滤除去生成的LiCl。此外AlH3还可以通过电解法制备,以THF的NaAlH4溶液为电解液,以Al作为阳极,以一根浸入汞的铁丝作为阴极。电解时在阳极生成H2和AlH3的THF络合物,在阴极生成的Na与汞形成钠汞齐,用这种方法得到的AlH3能避免氯化物的污染。
AlH3是比LiAlH4更活泼的还原剂,在有机合成中有广泛应用,例如将醛酮酸酯还原成相应的醇类。此外AlH3燃烧能释放大量的热,能作为火箭推进器的燃料。
(3)镓和铟的氢化物
镓的氢化物与相应的硼和铝的氢化物有类似之处,分子型的GaH3是一种黏胶状液体,高于-15℃时发生分解,加入乙醚可以增强其稳定性。GaCl3与LiAlH4反应可制备得到二聚体Ga2H6,其结构与乙硼烷类似,形成Ga-H-Ga氢桥键,其稳定性高于GaH3。固体氢化镓相对较稳定,其结构与AlH3类似,Ga的配位数为6,较分子态的GaH3稳定,在真空加热至140℃才开始释放H2。铟的氢化物也不稳定,单铟烷InH3仅在气态中通过质谱捕捉到,InH3能溶于乙醚中,形成相对较稳定的乙醚合物,但乙醚合物会慢慢分解,产生(InH)n沉淀。
2.第四主族元素氢化物
(1)分子型氢化物
硅与氢能形成多种共价型氢化物,其中大多数氢化物在形式上与烷烃类似,因此命名为硅烷。一些低价硅的氢化物,如一氢化硅和二氢化硅等是不稳定的,仅作为反应中间体被捕捉到。硅烷中最重要的是甲硅烷SiH4。1902年Moissen用硅化锂与酸反应发现了组成为硅氢化合物的气体,主要是SiH4以及少量的Si2H6。硅烷可以用碱金属或碱土金属的硅化物(最常见的是硅化镁)在酸性水溶液中的水解生成,但用这种方法得到的通常是一系列不同分子量的硅烷的混合物。硅烷还可以在无水乙醚溶液中用LiAlH4还原SiCl4或硅氧醚得到。
甲硅烷SiH4为气体,性质活泼,在空气中会发生自燃,因此使用和处理时必须非常小心。硅烷不如相应的烷烃稳定,在高温下硅烷会发生分解,得到硅单质,工业上用这种方法来制备非晶或多晶硅,这是硅烷十分重要的一个用途。该反应可以在加热条件下进行,例如让硅烷在高温的钨丝(热灯丝)上产生分解;也可以利用等离子体使硅烷分解,在较低的温度下得到薄膜硅。利用硅烷分解制备得到的非晶硅和多晶硅可以形成厚度薄至几纳米的薄膜,相对于传统的单晶硅片,硅薄膜大大减少了硅的用量,成为新一代太阳电池材料,因此对于利用热灯丝或等离子体法分解硅烷制备薄膜硅人们进行了极为详细的研究,希望通过控制反应参数以较高的速率获得高品质的硅薄膜。
与硅类似,锗也能与氢形成锗烷GeH4、Ge2H6、Ge3H8等。锗烷稳定性不如相应的硅烷,在较低温度下(280℃)就分解为单质锗和H2。但是锗烷在空气中不会自燃,同时水解也较硅烷慢。锗烷热分解也是制备半导体锗薄膜的有效方法之一。锡的氢化物包括SnH4和Sn2H6,其稳定性更低,SnH4在100℃以上即迅速分解。SnH4是很好的还原剂,但是有剧毒。Pb的氢化物PbH4非常不稳定,在室温下即分解成单质。
(2)氢化非晶半导体
硅和锗能与H形成非晶半导体材料,成为氢化非晶硅(锗),写作a-Si(Ge):H。以a-Si:H为例,其中Si原子骨架相对其晶体发生了一定程度的扭曲,因而缺乏长程有序结构,骨架扭曲导致一些Si-Si键断裂,但这些断键处的Si原子与H原子形成Si-H键而保持了绝大多数硅原子的四配位结构。a-Si:H是一种重要的半导体材料,可以通过硅烷的热分解或等离子体分解制备得到,可以在许多不同的基底上沉积得到几纳米的薄膜。其制备成本远远低于单晶硅片,同时也为柔性、可折叠的新型电子器件的开发提供了可能,是新一代太阳电池的理想材料。
虽然a-Si:H结构是长程无序的,但作为电子能态缺陷的单电子键绝大多数被H原子饱和,根据制备条件不同,H的摩尔分数可以达到10%以上。在器件级别的非晶硅中,这些单电子键的浓度能控制在1016cm-3这一数量级(约1×10-6)。从结构角度看正是氢原子的引入才使得a-Si:H的实际应用成为可能。
3.磷、砷、锑的氢化物[30]
磷的氢化物PH3也称膦,可以通过金属磷化物水解获得,也可以通过白磷与浓度约为30%的碱溶液反应得到:(www.daowen.com)
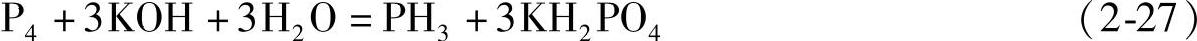
常温下膦为无色有鱼腥味恶臭的气体,有剧毒。PH3不稳定,受热分解成单质磷和氢气。常见的磷的氢化物还包括双膦P2H4,是肼的类似物。此外还存在着聚合度不同的氢化物如P3H5、P4H6、P5H5等,均为磷化钙水解的产物。
砷的氢化物(胂)AsH3可以通过在酸性溶液中以Zn还原亚砷酸,或是通过砷化物水解制备:
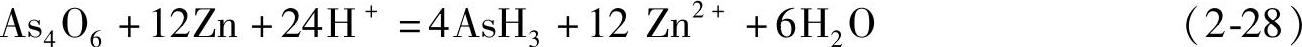
AsH3在热力学上不稳定,但在室温下分解很缓慢。在许多砷的检验方法中(Gutzeit试砷法)生成AsH3是非常关键的。
锑的氢化物SbH3比AsH3稳定性更差,通过氢气还原SbCl5或是金属与Sb的合金水解制备得到。
这些元素的氢化物均不稳定,稳定性按PH3>AsH3>SbH3的顺序下降。由于受热会分解产生纯度很高的单质,这些氢化物常用作利用化学气相沉积法制备相应的Ⅲ-Ⅴ半导体(如GaAs、GaP等)时的原料。
4.过渡金属氢化物
许多过渡金属能与氢形成二元化合物,其生成焓见表2-15,一般来说生成焓需要低于-40kJ/(mol H2)才能在H2分压低于1bar时稳定。ⅢB、ⅣB和ⅤB族元素的氢化物较为稳定,而d电子数较多的过渡金属氢化物均不太稳定,一个例外是Pd,相对于其周围的元素其氢化物稳定性要高得多。过去曾认为这些氢化物是非整比的,是氢原子填隙于金属晶格中的结构,但现在已确定其中的绝大部分均具有确定的物相和化学配比,只有Pd的氢化物仍然没有发现确定的化学计量比,迄今报道的最高氢含量为PdH0.8。与离子型的氢化物相比,过渡金属对于氢的溶解性增强,在相图上形成固溶体相的区域较宽,而具有化学计量比氢化物的相区面积则相应缩小。
表2-15 过渡金属元素氢化物的生成焓[31] [单位:kJ/(mol H2)]
对于过渡金属氢化物的成键理论有3种不同的理论模型:原子态H理论,即H以原子形态存在于晶格的空隙中;质子氢理论,即氢将其价电子提供给氢化物的导带中,以H+的形式存在;氢阴离子模型,即氢从导带获得一个电子,以H-的形式存在。模型1描述的是H在金属中有一定溶解度的行为,比较适合描述金属和氢固溶体相,而具有确定化学计量比的金属氢化物其晶格结构通常会与相应的金属有很大的不同,原子填隙模型并不能解释这一现象。对于氢化物,质子模型和氢阴离子模型均有不同程度的应用。
金属Pd与氢气有特殊的作用,在室温下Pd能吸收氢气使自身体积膨胀,这是由于H2能在Pd的晶格中迅速扩散。在200℃以上氢气对金属Pd有穿透性,可以利用这一特性将氢气与其他杂质气体分离,得到纯度很高的氢气。例如可以使纯度较低的氢气通过一只一端封闭的高温薄壁钯管,透过的气体就是高纯度的H2。由于在氢透过的过程中会发生α-Pd(金属)到β-Pd(氢化物)的相变,因此Pd管在使用一段时间后会变形,通过与Ag形成合金能有效减小形变。
5.过渡金属与氢的配位化合物
过渡金属元素具有空的d轨道,可以形成多种形式的配位化合物。20世纪以来配位化合物的合成以及表征技术获得了很大的发展,一系列超越经典化学键理论的配位化合物相继被合成,也促进了配位理论和化学键理论的发展。其中非常具有代表性的一类就是过渡金属元素和氢的配位化合物(简称配合物),在这些配合物中,氢可以以原子形式与金属形成M-H键,也可以以双原子分子的形式作为配体。
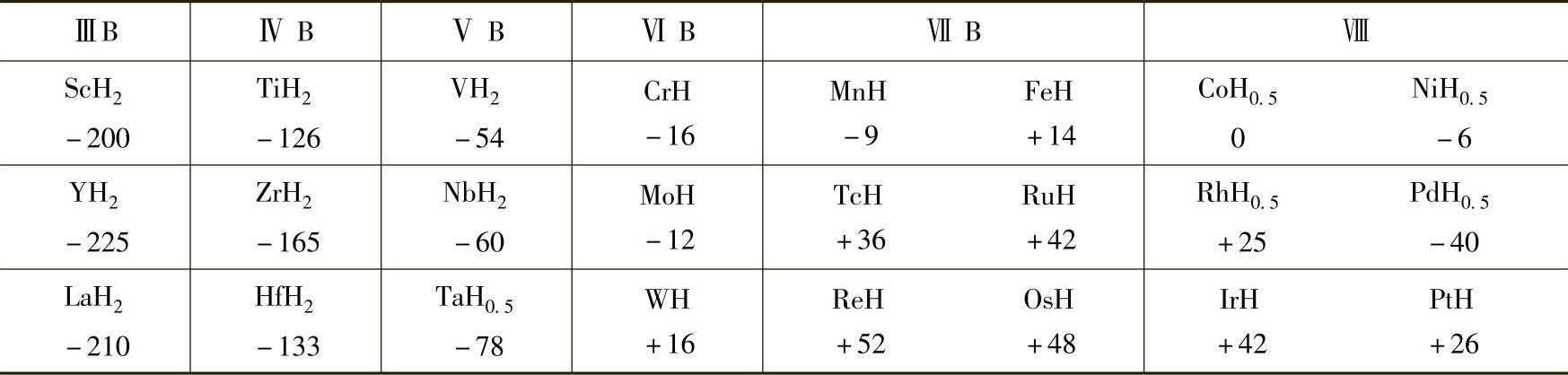
1931年Hieber首先制备得到了铁的氢配合物H2Fe(CO)4,此后数十年中过渡金属氢配合物的研究获得了很大发展,1955年Wilkinson制备得到了Cp2ReH(Cp=Cyclopentadienyl,环戊二烯基),并通过1H NMR和红外光谱确定了M-H键的存在。近年来的研究发现了更多不同类型的H与过渡金属的配合物。一些典型的例子包括:(PPh3)phenCu(η2-BH4),以BH4作为双齿配体与金属中心结合;[(CO)5W-H-W(CO)5]-,其中H作为桥键连接两个W原子;[Co6H(CO)15]-,其中的H原子位于6个Co原子构成的团簇的中心;具有多个氢配体的P(PhiPr2)3WH6,其中的W原子具有极高的配位数。这几类特殊的过渡金属与氢形成的配合物的结构式如图2-25所示。
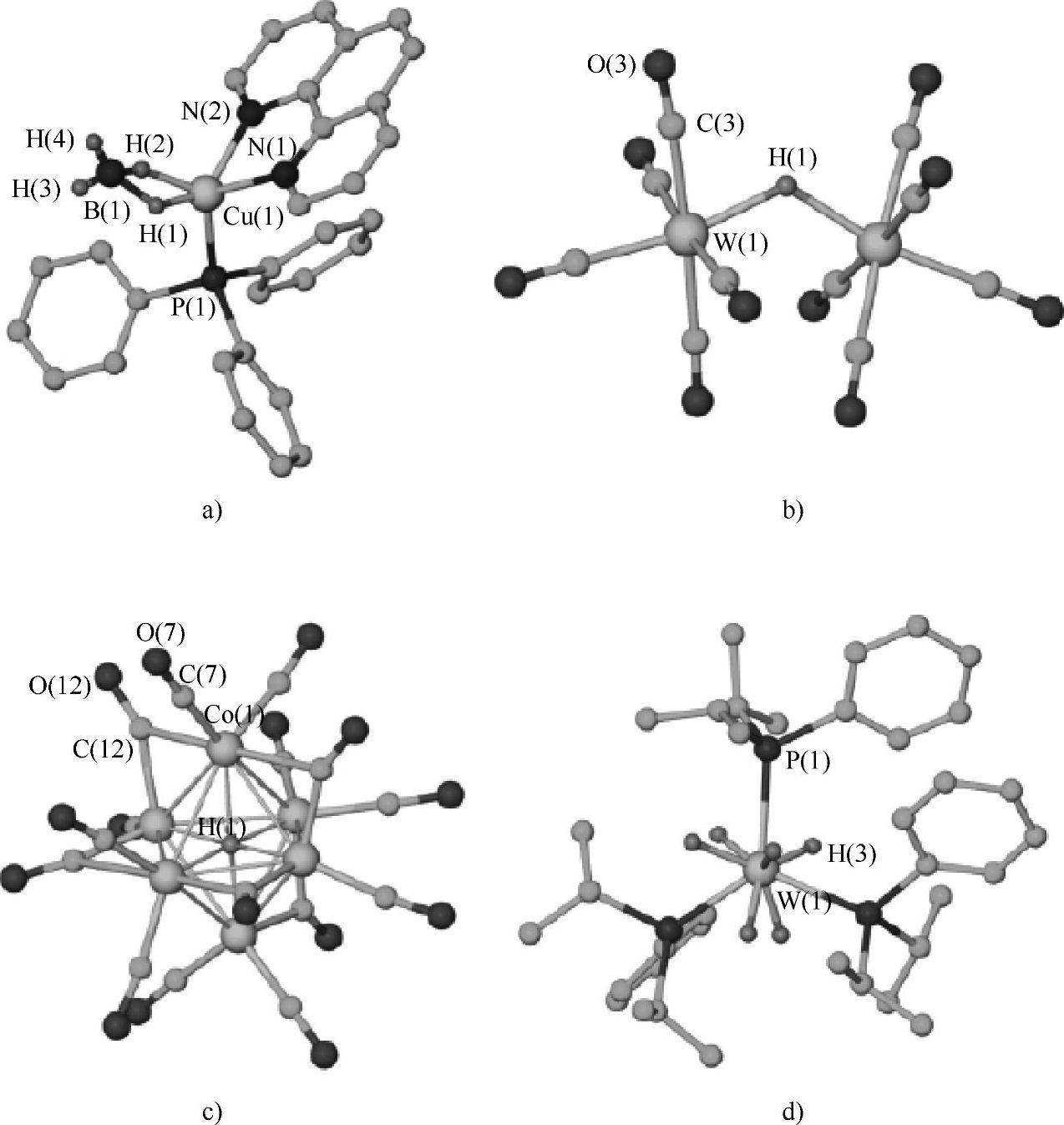
图2-25 几种具有特殊结构的过渡金属与氢的配合物
a)(PPh3)phenCu(η2-BH4),Ph=苯基,Phen=邻二氮菲 b)[(CO)5W-H-W(CO)5]- c)[Co6H(CO)15]-d)P(PhiPr2)3WH6,iPr=异丙基[32]
在氢原子直接作为配体的配合物中的M-H可以看作过渡金属原子与H原子共享电子对形成的。与过渡金属直接成键的H原子通常比较活泼,能够发生氢的插入、转移等一系列重要反应,在合成和催化过程中有着极为重要的作用。虽然不直接涉及这类过渡金属氢配合物,但是很多石油化工过程的关键步骤,都涉及存在M-H键的中间体。图2-26给出了一个Rh的氢配合物在催化烯烃加氢以及醛基化反应中的作用,这两个反应都涉及配位不饱和的中间体(PPh3)2Rh(CO)(η2-CH2CHR),随后通过与H2形成六配位的二氢配合物,最后消去一个配位氢和相邻的碳链,得到加氢产物。在醛基化过程中还涉及与CO的加成反应。利用过渡金属与氢形成的配合物,可以很好地控制过渡金属中心的活性和电荷密度,不仅能使氢转移或插入反应有效进行,还能对产物的立体构型实现很好的控制,对于催化理论的发展有重要意义。
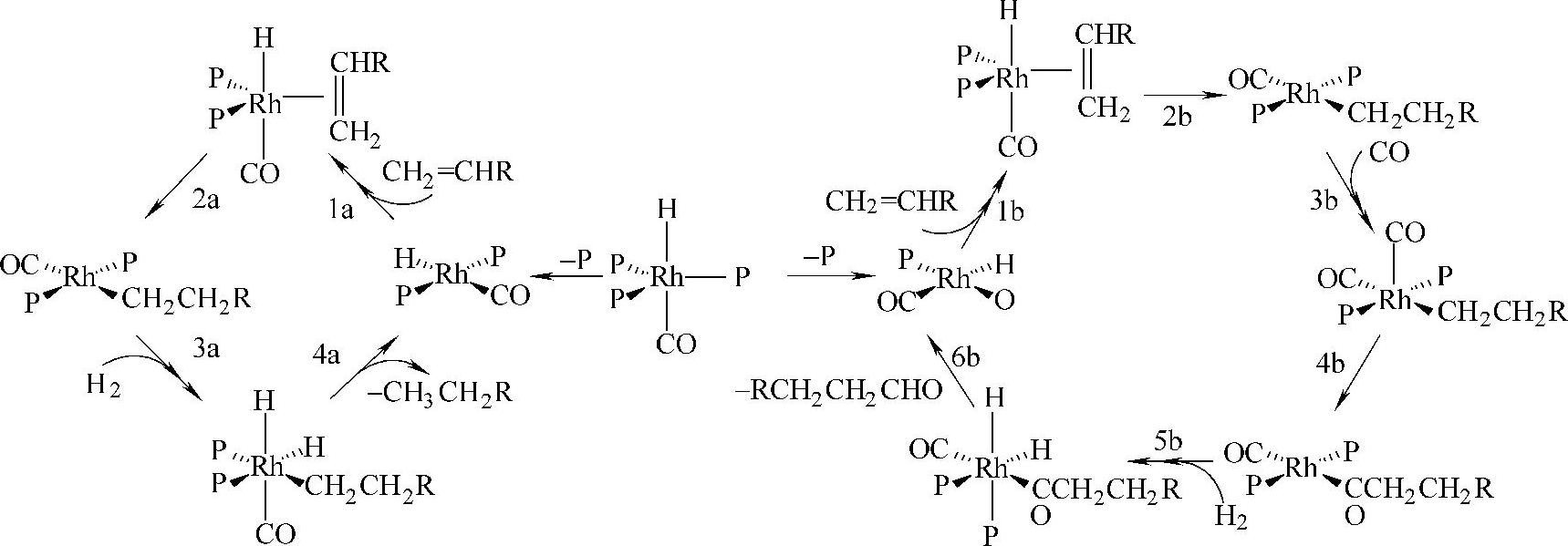
图2-26 Rh-H配合物对烯烃加氢和醛基化的催化机理示意图[32]
1984年Kubas首次报道了存在完整的H2分子的过渡金属与氢的配合物(PiPr3)2(CO)3 W-(η2-H2)(见图2-27)。在H2分子构成配位过程中,存在一个经典的σ型单键,由H2的HOMO(最高占据轨道)向金属中心提供电子;同时金属中心的d轨道与H2分子的反键σ轨道也有一定程度的重叠,形成反馈键。向H2的反键轨道提供电子将削弱H2的共价键,使H2更容易离解成原子,因此许多过渡金属都是涉及H2反应的高效催化剂。通过控制金属中心的电子密度,可以有效地调控这种催化的活性。
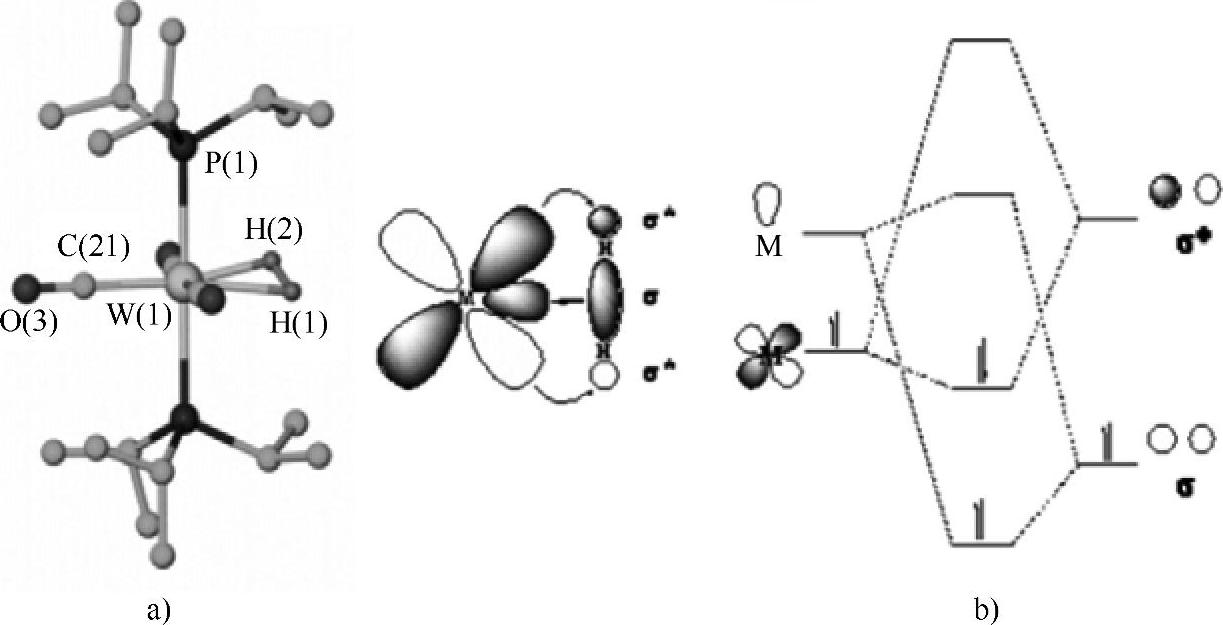
图2-27 (PiPr3)2(CO)3W-(η2-H2)的结构和分子轨道成键示意图[32]
6.稀土元素氢化物
所有镧系元素都能生成LnH2型氢化物,其中EuH2和YbH2具有和碱土金属氢化物类似的正交晶系结构,而其他的镧系稀土二氢化物都具有萤石的面心立方结构。EuH2和YbH2体现出离子性;而其他稀土二氢化物的有效磁矩都接近于相应的三价离子的理论值,且均为导电体,因此属于金属型,可以表示为Ln3+(e)(H-)2。
EuH2和YbH2不能与氢继续化合,其他镧系元素的二氢化物可以继续氢化得到含氢量更高的氢化物,比例接近于LnH3。La-Nd之间元素形成三氢化物时仍然保持萤石结构,而Nd之后的三氢化物则呈六方晶系。并且随着LnH2向LnH3的转变,电阻率明显升高,逐渐变为半导体,可以认为Ln3+(e)(H-)2中的电子与H原子结合了。W.L.Korst等人对面心立方结构的La、Ce、Pu、Nd的二氢化物和三氢化物作了详细的研究,其结构信息表见表2-16,可见这4种元素的氢化物结构非常相似。这几种二氢化物的生成焓以及分解压力和温度的关系也都十分类似(见表2-17)。
表2-16 La-Nd的稀土元素二氢化物和三氢化物结构信息[33]
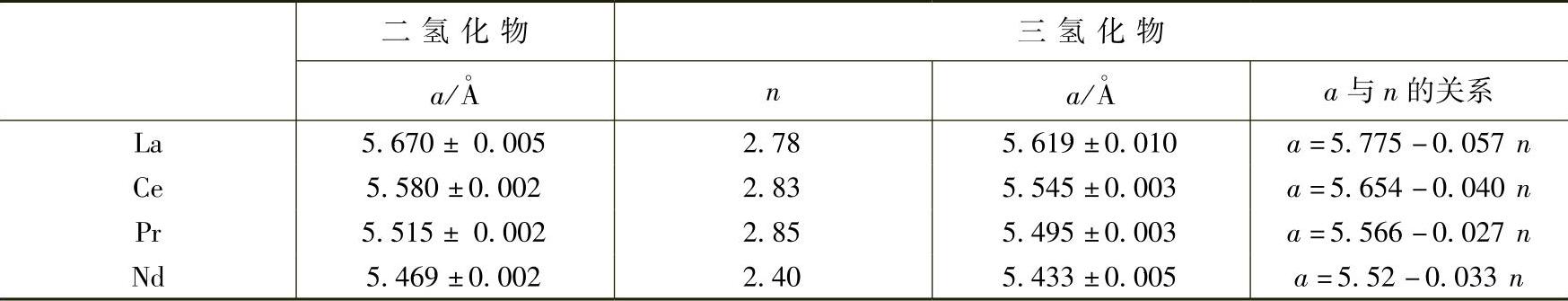
表2-17 La-Nd的稀土元素二氢化物分解平衡压力与温度的关系[33]
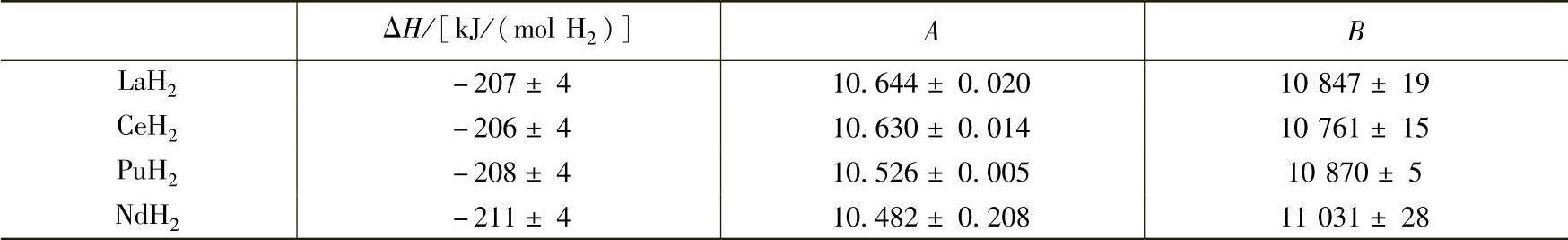
注:logp(mmHg)=A-B/T(K),580~800℃。
在锕系元素的氢化物中最为重要的是氢化铀,可以由金属铀在225~250℃下于1atm H2中加热制备得到。氢化铀的一个重要特征是能可逆地放出氢气。利用这一性质可以获得高纯氢气。在形成氢化铀之后抽真空排除杂质气体,然后在200~300℃下加热氢化铀,使之分解放氢,即可获得纯度很高的H2。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。








