
氢的电子构型是1s1,从电子构型上看,可以失去一个价电子,形成氢正离子H+;也可以得到一个价电子,形成氢负离子H-;也可以通过共享电子对形成共价键。从化合价上看,氢的化合价是+1或-1。元素周期表中,氢与碱金属同属IA族,因此虽然没有碱金属的强金属性,但在成键方面和碱金属有很多类似之处;同时氢原子的电子构型与该周期的饱和电子结构只差一个电子,从这个角度讲,氢与卤素也有类似之处。
氢在形成化合物时的行为主要分为以下几种:
(1)失去价电子
氢原子失去它的1s电子形成H+离子,实际上就是氢原子核或质子。由于质子的半径很小,因此具有很强的正电场,能使同它相邻的原子或分子强烈地变形,因此除了在等离子体状态之外的其他状态下,质子总是以与其他原子或分子结合态存在的,例如在酸性水溶液中的H+的实际存在状态是水合离子H3O+。
(2)结合一个电子
氢原子可以结合一个电子形成负氢离子H-,其电子构型为类似于氦原子的1s2结构,氢与活泼金属形成离子型氢化物时通常以H-的形式存在。与H+离子相反,H-半径较大,容易变形。H-容易与H+结合产生H2。
(3)形成共价键
氢与大多数非金属元素化合时通过共用电子对形成共价型化合物。除了在H2中,其余情况下这种共价键都是极性的。氢的电负性为2.20,高于多数元素,因此除卤素、氧、氮等少数几种元素外,氢与其他元素所成共价键中氢都带负电性。
(4)形成配体
氢负离子H-可以作为配体同过渡金属离子结合形成种类众多的络合物,例如HMn(CO)5和H2Fe(CO)4等。在这种化合物中,M-H键大多是共价型的,但一般计算氧化数时将H记为-1。
(5)形成氢键
氢与电负性强、原子半径小的非金属元素如F、O和N成键时,虽然键的类型为共价型,但电子云被强烈吸引向这些原子上,从而使氢原子上带有较高密度的正电荷。这种氢原子会吸引邻近的高电负性原子上的孤电子对,形成分子间或分子内的额外相互吸引,称之为氢键。氢键的强度处于共价键和分子间作用力之间,在有机和生命化学中有非常重要的作用,例如在遗传物质DNA的双螺旋结构就是通过氢键形成的。
(6)形成桥键
通常情况下氢原子的配位数为1,即只能形成单键。但在形成某些缺电子化合物如硼烷中,氢会形成多中心的桥键。
2.氢与非金属的反应
氢气能与卤素单质、氧气、硫等非金属单质直接化合。因此虽然很多氢与非金属的化合物从热力学上看是非常有利于形成的,但由于氢气分子键能较高,因此在常温下H2体现出一定的化学惰性,仅能与很活泼的非金属单质F2反应。在光照条件下H2能与Cl2剧烈反应,这是由于光照导致自由基的生成从而引发链式反应。
(1)氢的燃烧反应[26]
氢气与氧气的反应涉及氢气化学能的利用以及氢气的使用安全。H2与O2化合生成水的反应在热力学上非常有利,但在常温常压下H2与O2几乎不反应。点燃时H2可以在O2中剧烈燃烧,该反应能放出大量的热量,火焰温度能达到3000℃左右,可以用于焊接和切割。H2和O2的混合气体遇明火会剧烈爆炸。
1)能量密度。氢气与几种常见燃料的能量密度对比见表2-12,能量密度值均用低热值表示,即减去了将燃料汽化所需的能量。氢气是所有燃料中质量能量密度最高的,但在体积能量密度方面则存在明显的劣势。例如1个500L的柴油容器所含的能量若需要用250bar的高压氢气来承载,则需要8000L的体积。
表2-12 氢气与几种常见燃料的能量密度对比
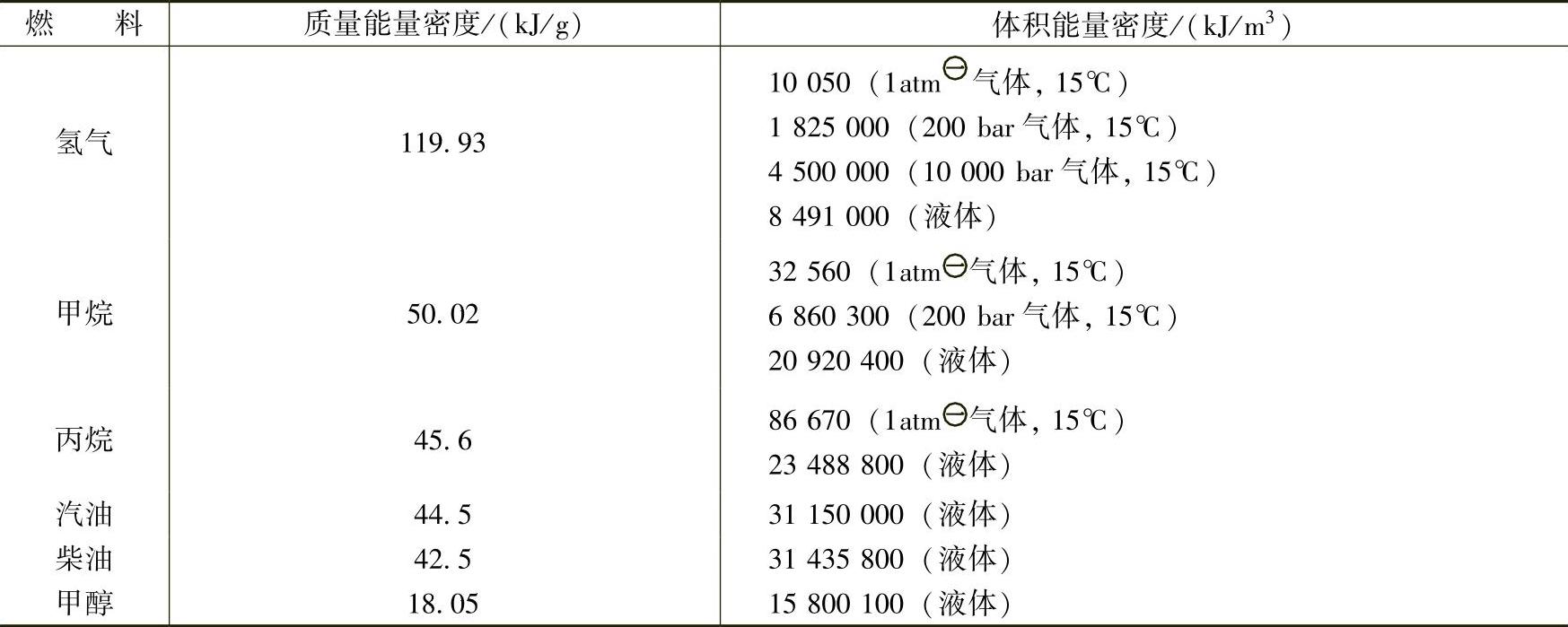
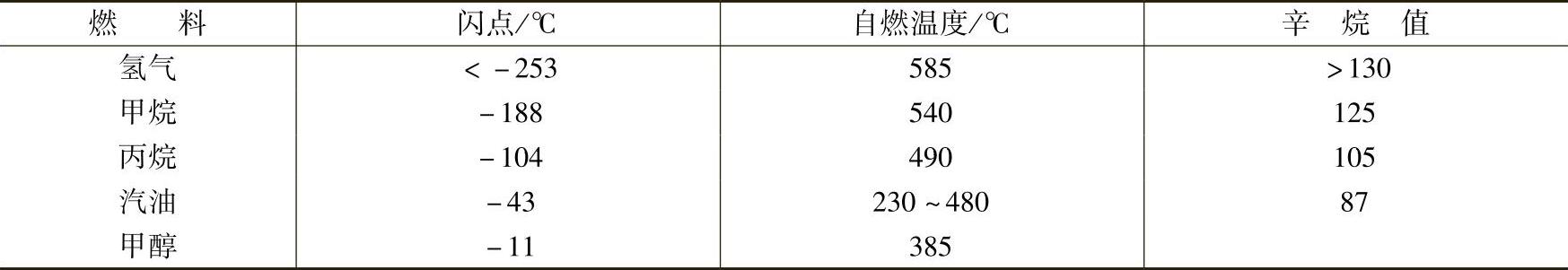
2)闪点。通常燃料需要与空气形成一定程度的混合才能被点燃,如氢气、甲烷等燃料本身就是气体,而对于汽油、甲醇等液体燃料需要在一定的温度下才能挥发形成足以被点燃的蒸气。闪点就反映了一种燃料形成可燃蒸气的能力,其定义为一个大气压下形成能被点燃的燃料——空气混合物的最低温度。该温度总是低于液体的沸点,对于液体燃料来说是其可燃温度的下限。表2-13是一些常见燃料的闪点,可见氢气的闪点非常低,即使是液态氢气也非常容易燃烧。
表2-13 氢气与几种常见燃料的闪点、自燃温度和辛烷值
㊀ 1atm=101.325kPa。——作者注
3)燃烧和爆炸极限。燃料气与空气的混合物被点燃后要发生燃烧或爆炸需要两者之间存在一个合适的比例,燃料气不足或空气不足均不能形成自我维持的一个燃烧过程。能发生燃烧(或爆炸)的燃料气的比例范围的上下限称之为燃烧(爆炸)极限。氢气在不同温度下的燃烧极限由图2-19给出。与其他大多数常见燃料相比,氢气的燃烧范围要宽得多(见图2-20)。
4)自燃温度、辛烷值。自燃温度是指不存在外加点燃源时燃料——空气混合物形成自发燃烧的最低温度。辛烷值描述了一种燃料对撞击的稳定程度。在常见燃料中氢气的自燃温度和辛烷值均较高(见表2-13),主要是由于氢气中共价键较稳定。
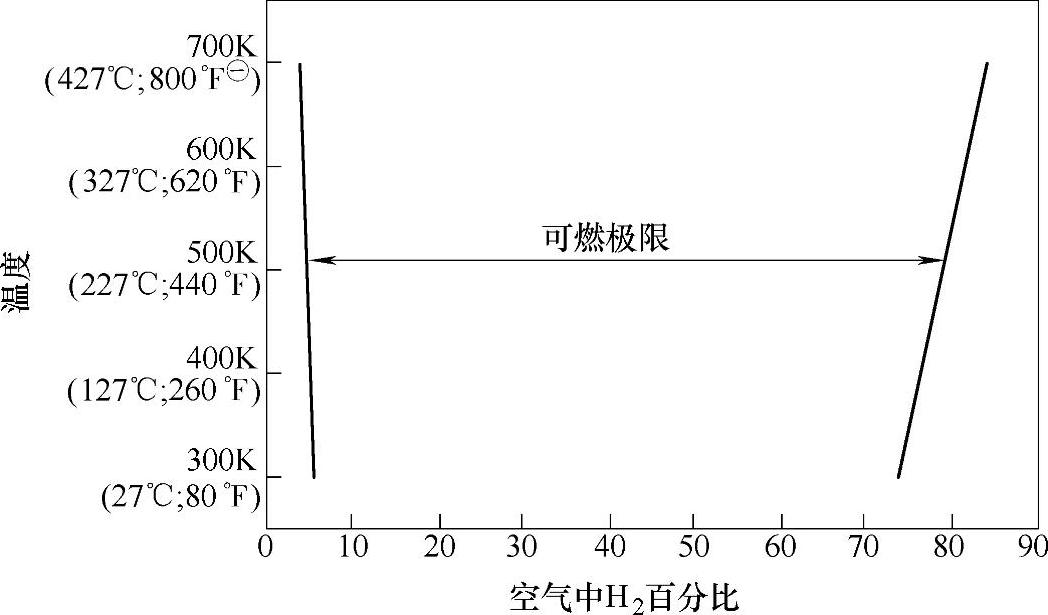
图2-19 氢气在不同温度下的燃烧极限
㊀ 1℉=5/9K。——作者注
5)点燃能量。点燃能量是点燃燃料与空气混合气体所需的外加能量,常见的外加能量源是火焰和火花。点燃能量主要由点燃所需的温度和持续的时间决定。虽然氢气的自燃温度高,但点燃能量仅为0.02mJ,大约比其他常见燃料低一个数量级。氢气和空气的混合物非常容易被点燃,即使是几乎不可见的火花,甚至是干燥天气下人体所释放的静电都有可能使之点燃。此外,H2的电导率很低,容易积累电荷而导致火花,因此所有运送氢气的容器都必须可靠接地。(www.daowen.com)
6)氢气的燃烧特性。氢气燃烧不产生任何烟尘,火焰为很淡的蓝白色,在日光下几乎不可见。氢气燃烧速率约为2.65~3.25m/s,液态氢的燃烧速率为3~6cm/min,均比甲烷和汽油高近一个数量级,因此氢气的火焰燃烧剧烈,存活时间较短。尽管氢气燃烧猛烈,然而氢气作为燃料从很多角度都比传统燃料如汽油等要安全。以汽车为例,若氢气罐破裂导致燃烧,由于氢气密度小、扩散迅速,燃烧产生的火焰形成垂直向上喷射的炬状,且集中于氢气罐的裂口处,车内乘客所受影响相对较小;汽油燃烧时火焰随液体和蒸汽横向扩展面积很大,会使整辆车温度迅速升高,甚至会波及周围,引起二次的燃烧或爆炸。车载高压罐破裂导致的燃烧照片如图2-21所示,可见车的乘坐区并未受太大影响。
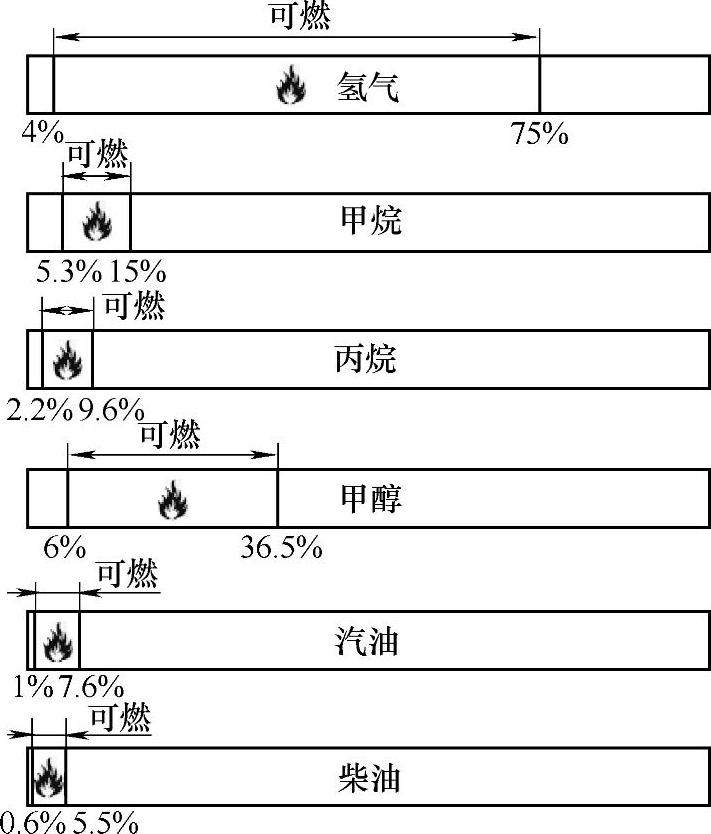
图2-20 氢气与其他常见燃料的燃烧极限对比

图2-21 车载高压氢气罐破裂导致的燃烧照片
(2)合成氨反应
合成氨是当前氢气最重要的用途之一。氨通过Haber-Bosch方法在高压和催化剂作用下使氮气和氢气直接反应合成。1909年德国化学家Fritz Haber解决了合成氨过程中的一系列技术难题,之后BASF公司购买了该专利,并由Carl Bosch成功实现工业化,Haber和Bosch均因此获得诺贝尔化学奖。
合成氨的反应可以表示为N2(g)+3H2(g)=2NH3(g)
该反应为较弱的放热反应,ΔH=-92kJ/mol。该反应是一个平衡反应,且平衡偏向反应物,在300℃时平衡常数仅为4.3×10-3,因此单步的产率较低,仅为15%左右,但通过回收N2和H2,总产率可以达到98%。提高压力有利于反应向生成物方向移动,因此反应通常在较高压力下进行(15~25MPa)。升高温度不利于化学平衡向生成物方向移动,但是为了保证足够的反应速率,反应温度一般在300~550℃。该反应需要催化剂。在最初的Haber-Bosch法中采用的催化剂是Ru和Os,1909年Bosch的助手Alwin Mittasch发现了廉价的铁催化剂,可以由氧化铁在氢气气氛中还原得到,这一催化剂使用至今。
合成氨中的N2来自于空气,而氢气来自于合成气。合成氨的整个过程除中心的反应器外还包括原料气体的净化处理、加压和热交换设施以及未反应产物的回收。Haber-Bosch法合成氨流程示意图如图2-22所示。
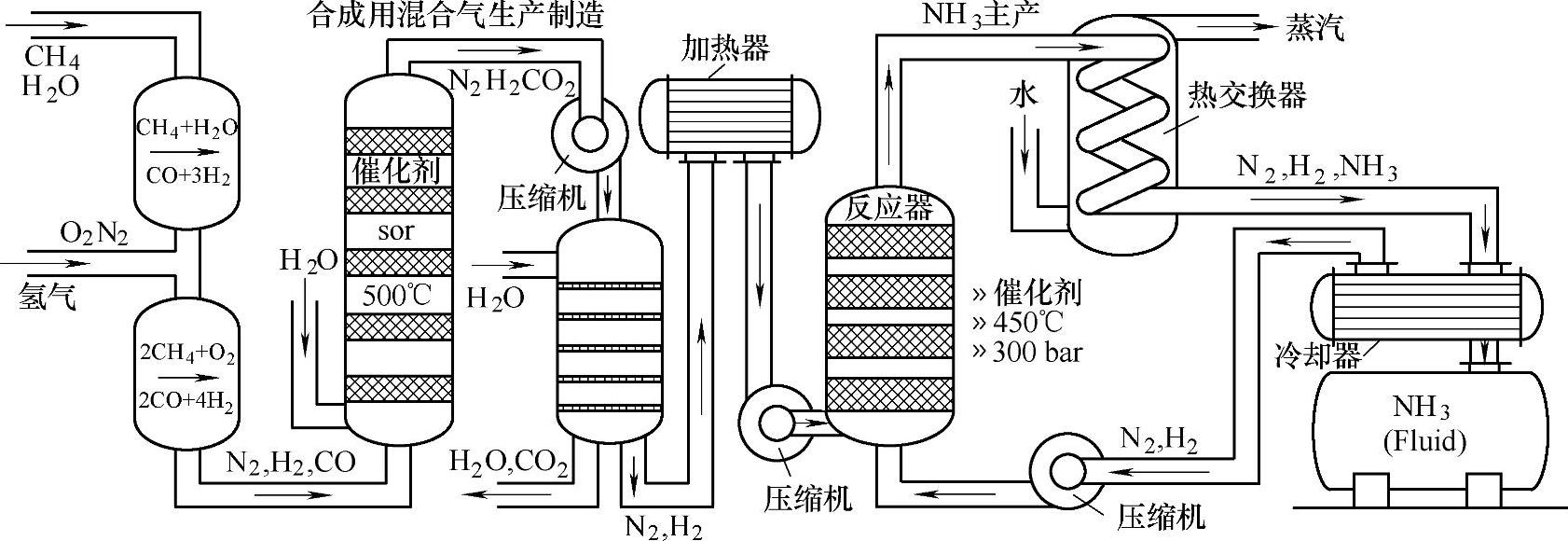
图2-22 Haber-Bosch法合成氨流程示意图
3.氢与金属的反应
许多金属如碱金属、碱土金属、稀土金属以及Pd、Nb、U和Pu等可与氢气作用形成金属氢化物。许多金属氢化物非常容易形成,之所以通常状况下混合时反应速率较慢是由于表面吸附物种的存在,如果采用表面清洁、比表面积大的微细粉末,反应将很容易进行,例如将氢化钒分解得到的金属钒粉末能在常温常压下很快与氢气化合。事实上很多过渡金属不仅有与氢化合的能力,对H2中共价键的离解也有催化作用,在储氢材料中通常用作催化剂添加以提高吸放氢的速率。利用某些金属如Pd、U等与氢可逆的化合、分解过程,可以制得纯度很高的氢气。
4.氢作为还原剂的反应
氢气是工业上常用的还原剂,在高温下能还原许多类型的氧化物和氯化物用以制备金属,如H2+Fe2O3→Fe+H2O这类反应在冶金中有非常重要的应用。
氢气的还原能力与温度以及氢气的流量有关,一般来说H2能够还原MnO以及金属活性在Mn之后的元素形成的氧化物,但对于比Mn活泼的金属形成的氧化物或生成焓高于MnO的氧化物则不能还原。一般来说还原反应发生的温度均会比热力学预测值高得多。在还原某些能形成较为稳定氢化物的金属氧化物或盐类时会得到氢化物,如La2O3+H2→LaH3+H2O。
在1800K以下对金属氧化物的还原能力中,H2介于C和CO之间,具体的顺序为Ca>Mg>Al>CaC2>Si>C>H2>CO。
氢气也能在高温下跟某些金属氯化物反应,生成相应的金属:H2+NiCl2→Ni+HCl、H2+SiCl4→Si+HCl。利用H2与SiCl4的反应可以制取高纯多晶硅。
5.氢对不饱和键的加成反应
在有机化合物中经常存在不饱和的双键和三键,例如C=C、C=O、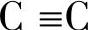 、
、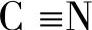 等,对于这些不饱和键,氢气中的两个氢原子可以分别加到不饱和键中的两个原子上,这类反应称为加成反应。
等,对于这些不饱和键,氢气中的两个氢原子可以分别加到不饱和键中的两个原子上,这类反应称为加成反应。
例如:CH2=CH2+H2→CH3-CH3、CH3CH=O+H2→CH3CH2-OH、 CH3CH=NH。
CH3CH=NH。
对于不饱和键数目较多,或是三键的加成,可能生成的产物较多。例如苯加氢可以形成环己二烯、环己烯和环己烷等不同氢化程度的加氢产物。很多加氢反应是重要的工业有机合成反应,如对不饱和油脂的加氢生成氢化油,通过对C=O双键加氢制备醇等。这类反应通常需要使用催化剂,多为具有催化H2共价键断裂的金属如Pd、Ni等,通过催化剂的设计和反应条件的控制实现对加氢产物的控制是化学工业中非常重要的课题。
6.石油化工中氢的反应
氢的另一大应用领域是在石油化工中,主要包括加氢裂化和加氢脱硫、脱氮。
加氢裂化是在氢气作用下使长链烷烃分裂成链长较短的烷烃的过程:
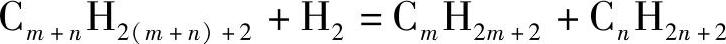
该过程首先于1915年在德国用于褐煤的汽化,1960年后随着沸石催化剂研究的进展和流化床反应器技术的进步,以及柴油和汽油需求量的快速上涨,这一过程被快速推广。这一方法的意义在于将石油炼制过程中分子量较大的石蜡和焦油转化为可用的汽油、柴油和液化气。该反应需要在较高的温度(260~450℃)和压力(35~200bar)下进行,并且需要催化剂。加氢裂化的催化剂是双功能催化剂,即包括加氢和裂化两部分,通常是酸性载体附着金属的形式。酸性载体为沸石型的催化剂,有较大的比表面积,同时提供酸性位点使大分子裂化;金属通常为过渡金属,包括贵金属如Pd、Pt以及Mo、W、Ni等。由于反应气氛中富含氢气,硫、氮等油品中对环境有害的杂质含量会被自动脱除。
加氢脱硫、脱氮是在氢气作用下使石油产品中的S、N杂原子形成H2S和NH3而脱除,如C2H5SH+H2=C2H6+H2S。
由于含硫和氮的油品在燃烧过程中会产生SO2、NOx等会导致酸雨的气体,因此当前各国对油品中硫和氮的含量都做了严格的规定。工业上的加氢脱硫在300~400℃、30~130bar下进行,催化剂主要成分为CoMo。生成的H2S用胺溶液吸收,最后转化为单质硫。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







