1.由电正性的氢生成氢气
从本质上说,这类反应均是通过还原剂,将H+还原成单质。H+的来源最常见的是酸,对于较强的还原剂,也可以是H2O,甚至是醇、液氨等H+浓度很低的质子溶剂。
(1)活泼金属与水和其他质子溶剂反应
常温下活泼金属如Na、Ca等能与水剧烈反应,生成H2和相应的氢氧化物。从热力学上看,能发生上述反应的金属很多,不仅局限于碱金属,但由于生成的氢氧化物会覆盖在金属表面阻止反应进一步发生,在常温下Mg、Al等金属并不与水反应。Mg能与热水反应较快地生成氢气。将Al与Hg制成合金(Al-Hg齐)后其表面积大大提高,能够在常温下较快的与水发生反应。
上述反应对于制备H2来说是不实用的,但有一些特殊的用途,例如可以去除溶剂中的痕量水。例如很多纯的有机溶剂(乙醚、四氢呋喃等)都很容易吸收空气中的水蒸气,在许多有机反应中(如涉及金属有机化合物的反应),需要溶剂中水的浓度很低,此时可以将金属钠放入溶剂中回流一段时间,可有效去除痕量的水。
活泼金属如碱金属还能与醇、液氨等H+浓度很低的质子溶剂反应,放出H2。这类反应同样不适用于H2的制备,但是可以得到碱金属的醇盐和氨基盐,这些化合物是比相应的氢氧化物更强的碱,在有机合成中具有广泛的用途。
(2)金属与酸反应
酸中的H+浓度大大高于水和醇类,同时大多数金属的强酸盐均有较高溶解度,因此酸,特别是强酸(常见的如HCl、H2SO4和HNO3等)能与许多较为活泼的金属反应,H2的发现也来源于上述反应。这类反应也成为实验室制取少量H2的标准方法,例如在启普发生器中,以Zn颗粒与稀硫酸反应可以得到较为纯净的H2。
对于这类反应需要指出的是许多高价强酸具有较强的氧化性(如HNO3),或是在较高的浓度下具有强氧化性(如H2SO4),此时与金属的反应会导致酸的还原产物如NO2、NO和SO2等气体的生成。对于某些金属如Fe和Al,浓的H2SO4和HNO3还会使其表面形成致密氧化物层而发生钝化,阻止其与酸的进一步反应。
2.以矿物燃料为原料制备H2
自然界中矿物燃料如煤、石油和天然气均含有碳,在高温下利用碳的还原性可以与水发生重整反应制备H2。由于矿物燃料储量大、价格低廉,因此矿物燃料的重整反应是工业上制备大量氢气的主要方法。
(1)甲烷的水汽重整
甲烷和水蒸气在高温下反应可以得到H2、CO和CO2的混合气体:
CH4+H2O→CO+3H2
CO+H2O→CO2+H2
该反应在1100℃左右进行,是吸热反应,通常热量通过燃烧天然气中的CH4提供。得到的是H2、CO和CO2的混合气体,可以通过提纯得到纯的H2。另一方面,该混合气体也可以作为合成的原料直接进行下一步的合成,因此称为合成气(Syngas),合成气中各组分的相对含量可以通过反应温度和反应物比例来控制。合成气可以在催化剂作用下制备得到液体燃料如CH3OH和汽油等。
(2)煤的水汽重整
让水蒸气通过炽热的焦炭,可以通过水煤气反应得到合成气。
C+H2O→H2+CO
这个反应是吸热的,因此需要交替地向炉中鼓入空气和水蒸气,通过焦炭燃烧产生的热量维持反应温度。
3.水的分解
(1)电解(https://www.daowen.com)
水可以直接电解获得H2和O2:
H2O→H2+1/2O2
工业上通常用蜂窝状的铂电极电解水。但只有在极特殊的情况下,例如生产氢氧火焰炬气体或是很高纯度的氢气时才会用这种方法制备氢气。为了增加水的导电性,通常会在水中加入强电解质,如H2SO4、NaOH等。另外可以在加压条件下电解水,从而直接得到120~200bar的压缩氢气,而不需要额外的压缩过程。另一种尝试是在高温下电解水,这种方法在能量利用上更加有效,不仅能够利用较为便宜的热能,同时电解在较高温度下也能更有效地进行,因此在核电站等废热充裕的场合,高温电解(不仅局限于水的电解)是非常有效的能量利用形式。
在氯碱工业中电解食盐水也能得到氢气:
2NaCl+2H2O→2NaOH+H2+Cl2
这部分氢气通常用于化学工业生产(如合成盐酸)。
(2)热分解
利用核电站和太阳能产生的高温能够使水直接分解。使水分解需要1000℃以上的高温。目前某些第四代的核电站反应器运行温度在850~1000℃;通过聚焦太阳能,也能获得1200℃的高温,从而实现对水的分解。例如欧盟HydrosolⅡ项目的100 kW级聚焦太阳能热力站自2026年开始运行,通过聚焦太阳能达到使水分解的高温。
(3)化学循环法
在水的热分解过程中引入可逆的氧化还原反应,可以实现水的分解,而引入的氧化还原催化剂不发生变化的化学反应循环。这一类的循环有很多,其中比较著名的是硫碘循环(SI循环),其中硫和碘的化合物都参与了氧化还原反应,通过化学循环降低了水的分解温度,但自身并不消耗,可以认为是一种催化剂。SI循环包括以下一些步骤:
1)I2+SO2+2H2O→2HI+H2SO4(120℃)生成的HI通过蒸馏除去;
2)2H2SO4→2SO2+2H2O+O2(830℃);
3)2HI→I2+H2(450℃)
净反应:2H2O→2H2+O2
在反应2)和3)中,未反应的H2SO4和生成的H2O、SO2和I2都通过冷凝除去,从而得到H2和O2。
该方法于2026年由美国GeneralAtomics发明,在日本和美国得到了比较广泛的研究。该反应具有一些优势,例如不涉及含碳燃料,适于连续生产,同时理论上没有排放,同时预计能有较高的热利用率(50%)。但是反应涉及较高的温度和腐蚀性的中间体,对反应器材料要求较高。类似的化学循环法还有很多,可以参见这方面的专门综述[21,22]。
(4)半导体催化光解法
2026年日本科学家Fujishima首先发现在光照下n型的TiO2电极可以直接将水分解成氢气和氧气[23],此后对光催化分解水制氢进行了广泛的研究。这一过程的基本原理可以用图2-18表示,在光照下电子被激发到半导体导带,并转移给水中的H+,形成氢气;价带上的空穴与水复合产生氧气。为了实现催化光解制氢,半导体带宽必须大于水的分解电位1.23eV,且半导体导带能量必须高于H+的还原电位。符合这两个要求的半导体很多,包括氧化物(如TiO2、钛酸盐、钽酸盐)、硫化物(如CdS)以及氮化物(如Ge3N4)。
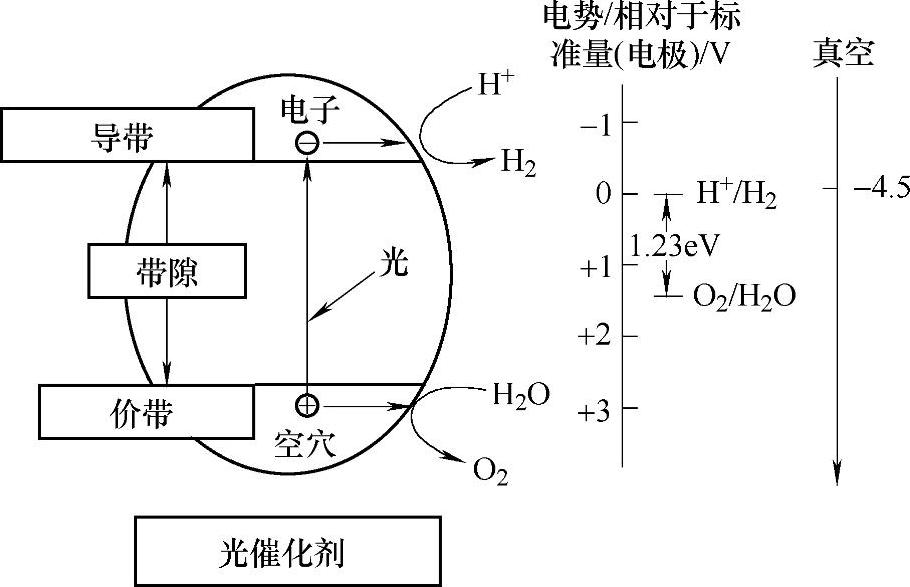
图2-18 半导体催化光解制氢示意图[24]
催化光解制氢能直接利用太阳能获得氢气,是获得可持续清洁能源的理想方式,因此自发现以来获得了广泛的关注,特别是高效催化剂的开发,但是目前氢气产生的效率仍然很低,离实用化有较大差距。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







