一旦人们可以用量子力学来计算原子里电子的轨道,科学家就可以很容易地解释不同的元素为何有不同的物理化学性质。化学家在19世纪就发现了不同的元素具有某些类似的化学性质,门捷列夫(Dmitri Mendeleev)并据此制成了元素周期表(见图3.11)。图中显示,元素的化学性质与原子序有着密切的关系。由于原子序其实就代表着一个原子里电子的数目,周期表所反映的其实是元素的化学性质与一个原子的电子数目的关系。那么,这种关系的物理基础是什么呢?通过量子力学的计算,我们就可以很容易地得到一些合理的解释。
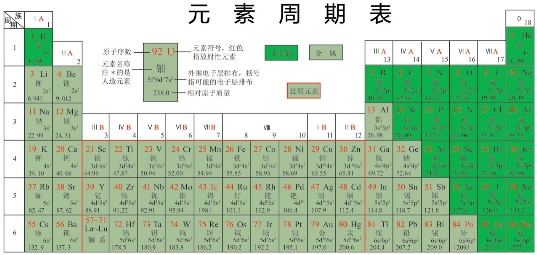
图3.11 元素周期表
周期表原来是根据不同元素的化学性质来订立的。它的物理基础可以用量子力学来解释。一个原子的化学性质主要由它最外层电子的分布情况决定。科学家可以使用量子力学来计算一个原子里面的电子分布。这个计算的结果就很容易地解释了为何不同的元素有不同的化学性质。这项结果与周期表所表达的完全一致。
从上面的讨论,我们已经知道,应用薛定谔方程可以计算出原子里不同电子轨道的波函数。每个波函数由四种量子参数(n,l,m,s)决定。这些量子参数的取值,我们在前面的表3.1已经列了出来。这些量子参数之间,有一定的规律(见表3.2)。从这些规律中,我们可以看出来,这些电子的轨道是分层的。例如,n=1是最内层的轨道,n=2时是次内层的轨道,余类推。因此,科学家可以利用量子力学来探知原子的构造。一旦人们知道了原子里电子的分布,我们就可以利用原子理论来解释原子的化学性质。从而解释了为什么不同的元素会按周期表中所列出的次序来排列。
首先,从泡利不相容原理可知,电子是首先填满内圈的电子轨道,再一层一层地向外圈扩充。原子的化学性质取决于其最外层电子的分布情况。例如,一个原子最外层只有一个电子的时候,这个原子很容易失去这个电子,而变成一个一价的阳离子。相反,如果原子最外层的电子轨道快要填满,只剩下一个空位时,它很容易掳获一个电子而变成一个一价的阴离子。以上这两种元素都会有极高的化学反应能力。
我们也可以想象,假如一个原子的最外层电子轨道是完全填满的,它既没有空位来容纳更多的电子,自己拥有的电子也很难逃脱,那么这种原子就很难与别的原子发生化学反应。事实上,一些惰性气体的元素,包括氦、氖、氩、氪、氙,就是属于这种情形。(https://www.daowen.com)
根据以上的了解,科学家就可以利用原子里电子轨道的排列情形来解释周期表里不同化学元素的位置。从上面的讨论里,我们知道原子里的电子轨道由4个量子数(n,l,m,s)来决定。不同的量子数表示不同的轨道。例如,从表3.2可知,当一个原子的主量子数n=1时,它可以有两个电子轨道,就是ψ(1,0,0,1/2)和,ψ(1,0,0,-1/2)。因此,在原子的最内层,最多只能容纳两个电子。氢原子只有一个电子,所以它的内层电子轨道并没有填满。它很容易失去这个电子而变成了一个一价的阳离子。氦有两个电子,它的内层电子轨道就完全填满了。因而它就成为一种惰性气体。由于原子最内层(n=1)只有两个电子轨道,所以周期表的第一行只有两种元素。到了周期表的第二行,它所对应的原子外层电子轨道n=2。根据表3.3,n=2的电子轨道共有8个,就是l=0的时候有2个,l=1的时候有6个。因此,周期表的第二行就可以容纳8种不同的元素。这8个元素就是锂、铍、硼、碳、氮、氧、氟、氖(见表3.3)。(注:当l在不同值的时候,电子的能级不同,处于不同的亚层。在化学里,l=0,1,2,3的各个能级亚层分别被称为s,p,d,f亚层)。
表3.3 原子里电子轨道的量子参数的不同组合
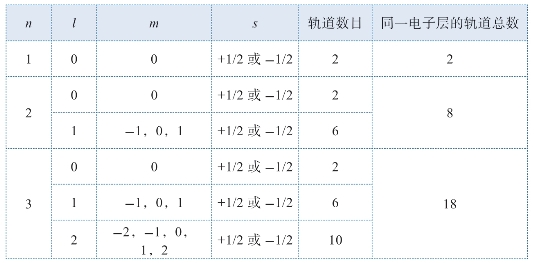
这表列出了主量子数n为1~3的所有量子参数的组合。在每一种n,l,m的组合中,由于电子的自旋s可以为+1/2 或-1/2,因此其能级有两种可能性。
对于原子序更高的原子,它在周期表里的排列也可以用以上的办法类推。不过,情况会变得稍微复杂一点,就是因为不是所有n=3的轨道的能级都比n=4的能级低。事实上,当n=3,l=0或1的轨道填满后,电子就开始填充n=4,l=0的轨道。当这些轨道被填满后,电子才会去填n=3,l=2的轨道。
所以,我们一旦了解了原子里的电子轨道的分布情形,就可以很容易地用这个原子的轨道模型来解释不同元素在周期表里的排列。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。





